人参(Panax ginseng C.A.Mey.)是五加科人参属植物的干燥根,在我国自古以来就是药食同源的植物,食用历史悠久。中医药学理论认为人参性平、味甘、微苦,具有滋补强壮、补脾益肺等功效。现代药理学研究表明,人参具有抗疲劳、提高免疫力、抗肿瘤等多种功效[1]。人参皂苷、人参多糖、氨基酸和挥发性油类(萜类、醇类、脂肪酸类)是人参中的主要化学成分,其中人参皂苷是标志性活性成分[2]。
人参皂苷按其皂苷元结构可分为齐墩果烷型的五环三萜皂苷和达玛烷型的四环三萜皂苷,后者在人参皂苷中占大多数,依据苷元不同又可分为20(S)-人参二醇系皂苷,如人参皂苷Rb1、Rb2、Rc、Rd、Rg3等,以及20(S)-人参三醇系皂苷,如人参皂苷Rg1、Rg2、Re、Rh1等[3]。不同人参皂苷在人参中含量不同,Rb1、Rg1等普通皂苷含量较高,Rg3、C-K、Rh2等稀有人参皂苷则含量甚微[4]。其中,普通人参皂苷很难被胃肠道直接吸收,生物利用率不高,在体内需要经过肠道菌群转化成稀有人参皂苷后才能够很好地发挥药理作用[5-6]。冯亮等[7]报道了大鼠灌胃人参皂苷后,血液中的代谢产物含量远高于原形药物的含量。HASEGAWA等[8-9]的研究发现人参皂苷在胃中基本不发生变化,进入肠道后在肠道菌群作用下才逐步代谢成次级皂苷并发挥作用。
植物乳杆菌(Lactiplantibacillus plantarum)是人类肠道菌群中的重要益生菌,对促进人体健康具有重要作用。同时,植物乳杆菌也广泛存在于各种发酵食品中,尤其在泡菜、发酵果蔬汁、发酵果酒等植物性发酵食品中应用广泛[10-11]。植物乳杆菌基因组中含有大量编码碳水化合物代谢相关的酶系基因,包括多种与寡糖、聚糖水解相关的糖苷水解酶,如β-葡萄糖苷酶等[12-13]。已有研究报道微生物产生的酶作用在人参皂苷的C-3、C-6、C-20位上连接的糖苷,可水解掉部分或全部的糖苷,从而把含量较多的人参皂苷转换成活性更高的稀有人参皂苷[2,14]。因此,本研究从娃哈哈菌种保藏中心筛选具有优良人参皂苷生物转化能力的植物乳杆菌,通过植物乳杆菌发酵转化提升人参提取液中稀有皂苷的含量,提高人参产品的生物活性。经筛选所获得的植物乳杆菌581菌株可在较短的发酵时间内实现多种稀有人参皂苷的高效转化,符合大规模生产的高效性需求,为后续高附加值发酵人参功能饮料的产业化开发奠定了基础。
1 材料与方法
1.1 材料与仪器
MRS培养基,英国Oxoid生物试剂有限公司;低聚半乳糖液体,量子高科生物股份有限公司;人参粉,靖宇县兴和特产品有限责任公司;78株植物乳杆菌,娃哈哈菌种保藏中心;人参皂苷标准品(Rb1、Rb2、Rc、Rd、Re、Rg1、Rf、Rg3、Rk3、Rh2、Rg2、F2、C-K、Rg6),上海源叶生物科技有限公司;人结直肠癌细胞HT-29,中国科学院典型培养物保藏委员会细胞库;RPMI 1640培养基、胎牛血清,美国GIBCO公司;MTT细胞增殖检测试剂盒,南京建成生物工程有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma-Aldrich公司。
Type B2Steril GARD Ⅲ生物安全柜,美国Baker公司;Delta 320 pH计,瑞士Mettler Toledo 公司;5810 R离心机,日本Olympus株式会社;电热恒温培养箱、Multiskan Sky全波长酶标仪,德国Thermo Fisher公司;2695高效液相色谱仪、Aquilty超高效液相色谱仪,美国Waters公司;Galaxy 170S CO2培养箱,德国Eppendorf公司。
1.2 实验方法
1.2.1 菌株培养
于-80 ℃条件下冷冻保存乳杆菌种子液,室温下解冻后,以2%接种比例接种于MRS液体培养基中,于37 ℃下培养16 h,连续活化2代。
1.2.2 人参发酵实验
称取适量人参粉(60目),加入25倍常温水,沸水熬煮3 h,经60目筛网过滤后,所得滤液经5 000 r/min离心10 min得到上清液。在上清液中添加低聚半乳糖液体,调整基料固形物含量(Brix=16),取10 mL试管分装,95 ℃灭菌10 min。获得人参提取液基料,冷却待用。
取植物乳杆菌菌液转移至15 mL无菌离心管,离心去除培养基后,加入相同体积的无菌水。旋涡振荡混匀后于600 nm测定OD值,调整菌液OD600值至0.60±0.05。将菌液以2.5%的接种量接入准备好的人参提取液基料中,37 ℃下静置发酵16 h。发酵结束后,立即95 ℃,10 min灭菌,终止发酵。除不接入菌液外其他操作一致。
1.2.3 人参皂苷转化的分析
菌株筛选实验的人参发酵液中的Rb1、Rg3含量采用高液相色谱仪(waters 2695色谱系统)测定。色谱条件,Diamonsil Plus C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A),水(B),梯度洗脱(0~5.5 min,30%~36%A;5.5~12 min,36%~80%A;12~20 min,80%~100%A;20~21 min,100%~30%A;21~25 min,30%A);流量1 mL/min;柱温40.0 ℃;检测器waters 996 PDA;检测波长203 nm。将人参发酵液中的Rb1、Rg3含量与人参提取液基料中的Rb1、Rg3含量进行比较,计算Rb1转化率与Rg3提高倍数。
植物乳杆菌581菌株人参发酵液中的Rb1、Rb2、Rc、Rd、Re、Rg1、Rf、Rg3、Rk3、Rh2、Rg2、F2、C-K、Rg6含量采用超高液相色谱仪(waters Aquilty UPLC-H-class)测定。色谱条件,Acquilty HSS T3色谱柱(2.1 mm×100 mm,1.7 μm);流动相乙腈(A),水(B),梯度洗脱(0~9.5 min,20%A;9.5~10.5 min,20%~30%A;10.5~14 min,30%~44%A;14~16.5 min,44%~80%A;16.5~19 min,80%~20%A;19~20 min,20%A);流量0.4 mL/min;柱温40.0 ℃;检测器Acquilty eλPDA,检测波长203 nm。
1.2.4 发酵跟踪实验
取植物乳杆菌581菌液,离心去除培养基后,加入相同体积的无菌水,振荡混匀后调整菌液OD600值至0.60±0.05。将菌液以2.5%的接种量接入人参提取液基料中,37 ℃下静置发酵。发酵过程中,每隔2 h取样测定菌液的OD600值和pH,直至18 h。采用稀释涂布平板法测定活菌数并对发酵液风味进行评价。
1.2.5 发酵液抗肿瘤能力测试
人结直肠癌HT-29细胞采用含10%(体积分数)胎牛血清的RPMI 1640培养基在37 ℃、5%(体积分数)CO2条件下以1∶3比例连续传代3代后,取对数生长期细胞用于实验。调整细胞密度为8×104 个/mL接种于96孔板中,每孔接入细胞悬液100 μL。37 ℃培养箱内生长24 h后,加入含药培养基100 μL,空白对照组每孔加培养基100 μL。将96孔板置于37 ℃、5%CO2条件下孵育48 h后,每孔加入5 mg/mL的噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)试剂20 μL。继续培养4 h后,弃上清液,加入DMSO 150 μL,振荡溶解10 min,采用酶标仪于490 nm处测定OD值。用公式(1)计算肿瘤细胞抑制率:
细胞抑制率![]()
(1)
1.2.6 统计分析
试验结果以平均值±标准偏差表示。显著性分析采用SPSS 19.0软件,利用单因素方差分析(ANOVA)中的Duncan法进行比较检验,以P<0.05作为差异具有统计学意义的判断标准。
2 结果与分析
2.1 植物乳杆菌转化人参皂苷能力的筛选
Rb1是人参中含量较高的一种人参皂苷,Rg3则是一种稀有人参皂苷,在野生人参中含量很少,在人工栽培的人参中甚至没有[2-3]。采用高效液相法测定的人参发酵液中的皂苷含量,以Rb1转化率、Rg3提高倍数为筛选指标对78株植物乳杆菌的皂苷转化能力进行评价,结果如表1所示。78株植物乳杆菌均表现出一定的人参皂苷转化能力,但菌株的作用效果各不相同。各菌株的Rb1转化率变化范围在4.36%~75.41%,Rg3提高倍数从4.98倍到13.59倍。其中,综合两项指标,植物乳杆菌581表现出最强的人参皂苷转化能力,Rb1转化率达到75.41%,Rg3提高倍数达到13.59。因此,优选植物乳杆菌581菌株进行后续研究。
表1 78株植物乳杆菌对人参皂苷Rb1、Rg3的转化作用
Table 1 Transforming effects of ginsenoside Rb1 and Rg3 by 78 L.plantarum strains

菌株Rb1转化率/%Rg3提高倍数菌株 Rb1转化率/%Rg3提高倍数55163.668.31416465.3910.9155258.148.84424657.1610.9755359.497.72424964.7911.2655662.088.79425460.5011.4855970.818.65425671.279.7756761.978.99426369.0912.1557668.669.50429654.089.8258175.4113.59434167.047.406778.926.81434260.0311.0168552.7811.15435047.5210.8673963.4310.67435142.4213.2974250.8810.47435849.5910.257574.364.98436252.7012.5677566.209.60436363.667.3478315.877.81436760.6810.66100866.6710.15437165.379.10100946.0510.85437445.0611.82149857.9810.08439462.8011.15150564.3210.87441345.749.95165654.5311.15441438.9511.58166063.6710.60441736.1011.62170567.617.45441841.3710.90171655.3311.15442146.8512.25175468.899.43442542.4510.91178265.929.68442650.0511.42178763.8810.73442761.5812.00193770.707.56442965.1610.67202564.238.97445768.7111.54207372.089.84446645.4413.24345565.3510.00449968.1312.06347563.1212.03450351.3212.64357060.288.86451444.858.90378347.8912.05451549.8911.73394758.879.29451760.3410.71401168.175.64452264.0311.31411362.826.25452656.7310.15413665.9711.35452950.3112.38415350.6412.37453517.6813.13416253.1311.33455064.0211.29
2.2 植物乳杆菌581的发酵特性
对优选的植物乳杆菌581菌株在人参提取液基料中的发酵情况进行跟踪,结果如图1所示。菌悬液OD值的跟踪结果显示植物乳杆菌581在人参提取液中的发酵在14 h达到拐点,pH曲线也呈现类似趋势。在随后的第16 h,菌悬液OD值达到0.82,人参料液的pH由初始的5.17降低至3.64,测定581菌株的活菌数,达到2.1×108 CFU/mL。植物乳杆菌581发酵后对人参基料的色泽无明显影响,未观察到任何不良风味,基料原本具有的微苦的味道无明显变化,同时发酵使得人参料液原有的土腥味明显减弱。
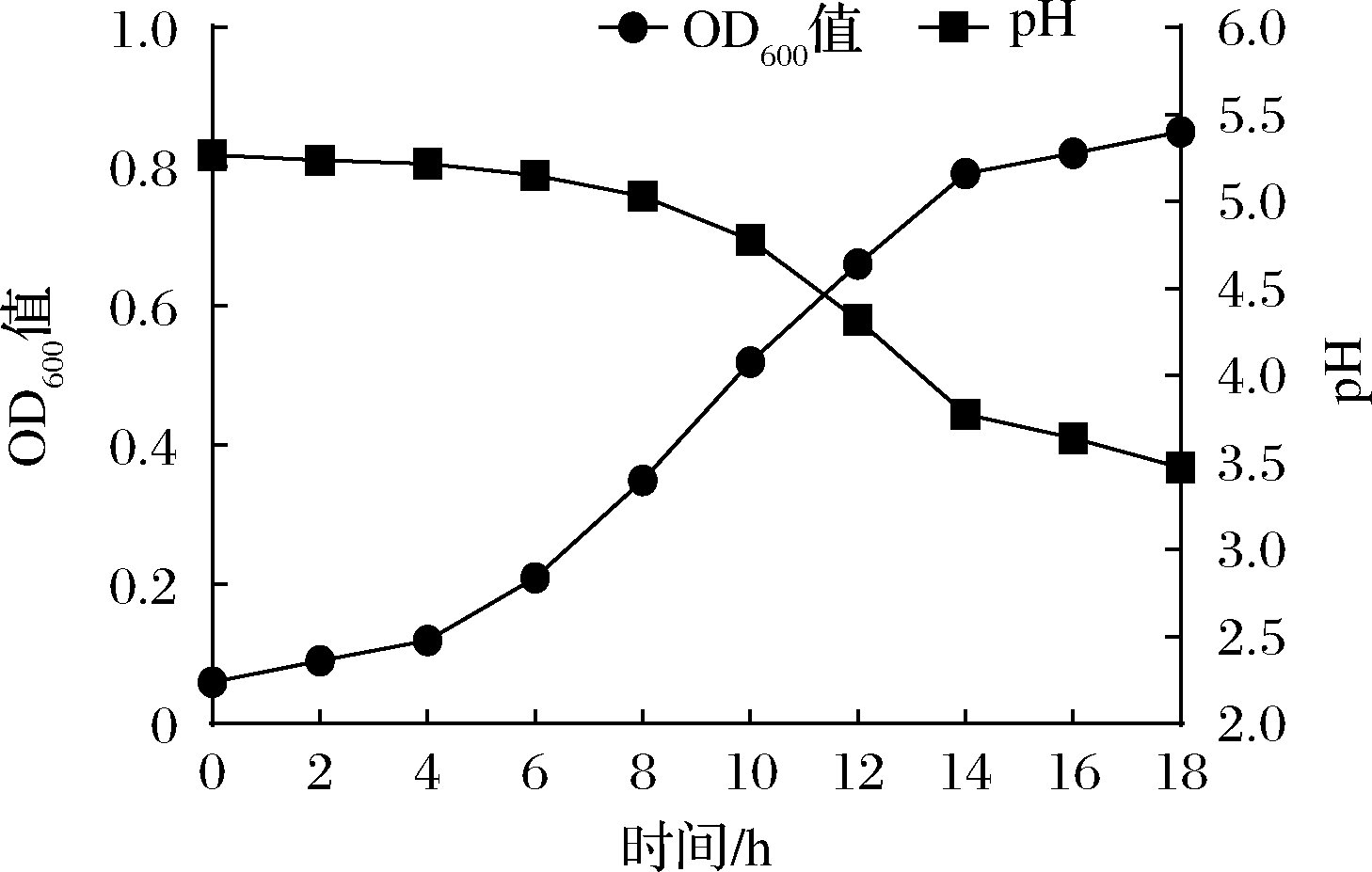
图1 植物乳杆菌581在人参基料中的发酵曲线
Fig.1 The fermentation curve of L.plantarum 581 in ginseng extract
2.3 植物乳杆菌581对人参皂苷的转化
采用超高效液相色谱对植物乳杆菌581菌株发酵16 h后的人参发酵液中各皂苷的含量变化进行进一步的分析,结果如图2所示。图2-a所示为7种普通人参皂苷的含量变化情况,与人参提取液相比,581发酵液中人参皂苷Rb1、Rb2、Rc、Rd、Re、Rg1的含量均发生显著降低(P<0.01)。其中,Rg1下降比例最高,下降66.19%,其次为Rc、Rb1。7种稀有人参皂苷的含量变化情况如图2-b所示,人参提取液中人参皂苷Rg3、Rk3、F2、C-K、Rg6的含量经581菌株发酵显著升高(P<0.01)。其中C-K在原人参基料中未有检出,经581发酵后提升至0.26 mg/L。

a-普通人参皂苷;b-稀有人参皂苷
图2 植物乳杆菌581发酵对人参提取液中14种人参皂苷含量变化的影响
Fig.2 Effect of L.plantarum 581 fermentation on the contents of 14 ginsenosides in ginseng extract
注:**表示P<0.01水平下差异极显著
2.4 植物乳杆菌581人参发酵液的抗肿瘤作用
为进一步评价581菌株人参发酵液的抗肿瘤作用,采用人结直肠肿瘤细胞HT-29模型,通过MTT实验对细胞的增殖情况进行评价,结果如图3所示。人参发酵液对肿瘤细胞存在抑制作用,存活抑制率为(59.16±1.26)%,显著高于未发酵前人参提取液的抑制率[(41.18±11.56)%,P<0.05]。结果表明,经植物乳杆菌581发酵后人参发酵液的抗肿瘤作用显著优于发酵前的人参提取液,可能与人参发酵液中稀有皂苷含量显著提高有关。

图3 植物乳杆菌581的人参发酵液对人结直肠肿瘤细胞HT-29的抑制作用
Fig.3 The inhibitory effect against human colorectal tumor cells HT-29 by L.plantarum 581 fermented ginseng juice
注:*表示P<0.05水平下差异极显著
3 结论与讨论
本研究对78株植物乳杆菌的人参皂苷转化能力进行评价,从中优选出植物乳杆菌581。进一步的研究表明,581菌株具有良好的发酵性能,经581菌株发酵获得的人参发酵液中稀有人参皂苷Rg3、Rk3、F2、C-K、Rg6的含量显著提升。其中,Rg3、F2、C-K都属于20(S)-人参二醇系皂苷。赵林果等[15]报道了一种制备Rg3的方法,可以通过β-葡萄糖苷酶和阿拉伯呋喃糖苷酶降解Rb1、Rb2、Rc来生产Rg3。弓晓杰[16]参照人参皂苷肠道菌代谢机理,报道了酶NS37040作用下的Rb1转化途径:Rb1首先在C20位的糖苷键断裂后失去一分子葡萄糖形成Rd,在C3位的末端失去一分子葡萄糖后会形成F2,随后再进一步脱去C3位的上最后一分子葡萄糖,形成C-K。在本研究中,经581菌株发酵后人参皂苷Rb1、Rb2、Rc、Rd均有下降,推测通过上述途径产生稀有皂苷Rg3、F2和C-K。
PARK等[17]以人参皂苷混合物为底物,研究了6种乳酸菌发酵过程对人参皂苷变化的影响,结果显示Rb1、Rb2、Rc、Re的含量在发酵过程中持续下降。邵淇等[18]报道了发酵乳杆菌和植物乳杆菌经过7 d的发酵可将人参皂苷Rb1转化为F2或C-K。考虑到后续发酵人参饮料开发的可应用性,包括工业化生产的高效性和可连续性,本研究考察了发酵16 h后的人参皂苷的转化情况,也检测到了稀有皂苷F2、C-K含量的显著提升。此外,581菌株发酵还显著提升了Rg3、Rk3在发酵液中的含量。研究显示人参皂苷Rg3在肿瘤的预防和治疗中起重要作用,可作为常规恶性肿瘤治疗的佐剂,具有抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤细胞转移等多方面作用[19-20]。人参皂苷![]() 和C-K[22]也具有类似抑制肿瘤细胞增殖或诱导肿瘤细胞凋亡的作用。因此,经581菌株发酵后的人参发酵液对人结直肠肿瘤细胞也表现出更强的抗肿瘤作用。
和C-K[22]也具有类似抑制肿瘤细胞增殖或诱导肿瘤细胞凋亡的作用。因此,经581菌株发酵后的人参发酵液对人结直肠肿瘤细胞也表现出更强的抗肿瘤作用。
人参作为传统中药2002年被国家卫健委列入保健食品名单,2012年又被列为新资源食品,使得人参的食用形式不再拘泥于传统的人参粉、人参片,人参发酵酒、人参酸奶、人参发酵饮料等都可以成为新形式的人参食品。本研究挑选具有人参皂苷高效转化活性的植物乳杆菌581菌株,通过微生物发酵,在改善人参口感的同时,通过转化生成多种稀有人参皂苷,提高了人参产品的功能活性,也为后续高附加值的人参发酵功能饮料的开发奠定了基础。
[1] 闫清侠, 刘莹莹, 常百金, 等.人参发酵产品研究进展[J].亚太传统医药, 2017, 13(23):54-56.
YAN Q X, LIU Y Y, CHANG B J, et al.Recent progress of fermentation product from Panax ginseng[J].Asia-Pacific Traditional Medicine, 2017, 13(23):54-56.
[2] 浦凤玲, 侯萍萍, 张铁华.人参发酵工艺研究进展[J].食品研究与开发, 2020, 41(8):205-209.
PU F L, HOU P P, ZHANG T H.Research progress on ginseng fermentation process[J].Food Research and Development, 2020, 41(8):205-209.
[3] 蔡小雨, 闫培生, 高秀君, 等.人参皂苷生物转化的研究进展[J].中国农业科技导报, 2018, 20(4):52-60.
CAI X Y, YAN P S, GAO X J, et al.Research progress of ginsenoside biotransformation[J].Journal of Agricultural Science and Technology, 2018,20(4):52-60.
[4] 裴文渊. 人参乳酸菌发酵工艺优化及Rh1对环氧丙醇所致细胞损伤的保护作用研究[D].长春:吉林大学, 2020.
PEI W Y.Optimization of ginseng fermentation process with lactic acid bacteria and the protective effect of Rh1 on cell damage induced by glycidol[D].Changchun:Jilin University, 2020.
[5] 郑志忠, 明艳林.人参皂苷体内代谢及其产物的生物活性[J].海峡药学, 2012, 24(1):9-13.
ZHENG Z Z, MING Y L.Metabolism of ginsenoside in vivo and biological activities of metabolites[J].Strait Pharmaceutical Journal, 2012, 24(1):9-13.
[6] 张怡轩, 陈晓莹, 赵文倩.人参皂苷生物转化的研究进展[J].沈阳药科大学学报, 2008, 25(5):419-422.
ZHANG Y X, CHEN X Y, ZHAO W Q.Advances in studies on biotransformation of ginsenosides[J].Journal of Shenyang Pharmaceutical University, 2008, 25(5):419-422.
[7] 冯亮, 胡昌江, 余凌英.人参皂苷Rg1及其代谢产物的药代动力学研究[J].药学学报, 2010, 45(5):636-640.
FENG L, HU C J, YU L Y.Pharmacokinetics of ginsenosides Rg1 and its metabolites in rats[J].Acta Pharmaceutica Sinica, 2010, 45(5):636-640.
[8] HASEGAWA H, SUNG J H, MATSUMIYA S, et al.Main ginseng saponin metabolites formed by intestinal bacteria[J].Planta Medica, 1996, 62(5):453-457.
[9] HASEGAWA H.Metabolic activation of ginsenoside against cancer:Intestinal bacterial deglycosylation and hepatic fatty-acid esterfication[J].Journal of Traditional Medicines, 2001, 5(18):217-228.
[10] FONSECA H C, DESOUSA MELO D, RAMOS C L, et al.Lactiplantibacillus plantarum CCMA 0743 and Lacticaseibacillus paracasei subsp. paracasei LBC-81 metabolism during the single and mixed fermentation of tropical fruit juices[J].Brazilian Journal of Microbiology, 2021, 52(4):2 307-2 317.
[11] URBINA  , CALDER
, CALDER N F, BENITO S.The combined use of Lachancea thermotolerans and Lactiplantibacillus plantarum (former Lactobacillus plantarum) in wine technology[J].Foods (Basel, Switzerland), 2021, 10(6):1356.
N F, BENITO S.The combined use of Lachancea thermotolerans and Lactiplantibacillus plantarum (former Lactobacillus plantarum) in wine technology[J].Foods (Basel, Switzerland), 2021, 10(6):1356.
[12] 黄涛. 我国传统泡菜中植物乳杆菌 NCU116 的发酵特性及益生功能相关基因解析[D].南昌:南昌大学, 2020.
HUANG T.Genomic analysis of genes related to fermentation and probiotic characteristics of Lactobacillus plantarum NCU116 derived from traditional Chinese sauerkraut[D].Nanchang:Nanchang University, 2020.
[13] CUI Y H, WANG M H, ZHENG Y K, et al.The carbohydrate metabolism of Lactiplantibacillus plantarum[J].International Journal of Molecular Sciences, 2021, 22(24):13452.
[14] 乔梦丹, 刘尚, 张琰, 等.基于UPLC-Q-Orbitrap MS/MS研究人参皂苷在发酵过程中的生物转化[J].高等学校化学学报, 2018, 39(2):219-225.
QIAO M D, LIU S, ZHANG Y, et al.Biotransformation of ginsenosides in fermented ginseng using UPLC-Q-Orbitrap MS/MS[J].Chemical Journal of Chinese Universities, 2018, 39(2):219-225.
[15] 赵林果, 赵东霞, 解静聪, 等.一种酶法制备稀有人参皂苷20(S)-Rg3的方法:中国, CN105695553A[P].2016-06-22.
ZHAO L G, ZHAO D X, XIE J C.An enzymatic method for the preparation of rare ginsenoside 20(S)-Rg3:China, CN105695553A[P].2016-06-22.
[16] 弓晓杰. 人参皂苷酶代谢产物化学修饰及其抗癌活性研究[D].长春:吉林农业大学, 2004.
GONG X J. Study on chemical modification of the enzyme metabolite of ginsenoside and its antitumor activity[D]. Changchun: Jilin Agricultural University, 2004.
[17] PARK S E, NA C S, YOO S A, et al.Biotransformation of major ginsenosides in ginsenoside model culture by lactic acid bacteria[J].Journal of Ginseng Research, 2017, 41(1):36-42.
[18] 卲淇, 陈贺, 尹成日.乳酸菌对人参皂苷Rb1的生物转化研究[J].延边大学学报(自然科学版), 2016, 42(2):177-180.
SHAO Q, CHEN H, YIN C R.Biotransformation of ginsenoside Rb1 by lactic acid bacteria[J].Journal of Yanbian University (Natural Science Edition), 2016, 42(2):177-180.
[19] XIE J T, WANG C Z, ZHANG B, et al.In vitro and in vivo anticancer effects of American ginseng berry:Exploring representative compounds[J].Biological &Pharmaceutical Bulletin, 2009, 32(9):1 552-1 558.
[20] 江昌, 缪雨青, 周文丽, 等.人参皂苷Rg3的抗肿瘤作用及研究进展[J].临床肿瘤学杂志, 2017, 22(7):664-667.
JIANG C, MIAO Y Q, ZHOU W L, et al.Research progress of ginsenoside Rg3 in anticancer activities[J].Chinese Clinical Oncology, 2017, 22(7):664-667.
[21] 范洁, 张磊, 王啸.人参皂苷Rk3对肝癌HepG2细胞凋亡的影响[J].安徽医科大学学报, 2016, 51(11):1 604-1 608.
FAN J, ZHANG L, WANG X.Effect of ginsenoside RK3 on apoptosis of HepG2[J].Acta Universitatis Medicinalis Anhui, 2016, 51(11):1 604-1 608.
[22] CHAE S, KANG K A, CHANG W Y, et al.Effect of compound K, a metabolite of ginseng saponin, combined with gamma-ray radiation in human lung cancer cells in vitro and in vivo[J].Journal of Agricultural and Food Chemistry, 2009, 57(13):5 777-5 782.