湘派卤制品起源于卤菜之都——湖南邵阳,是我国的传统休闲美食。2021年,我国休闲卤制品市场规模已达1 504亿元,其中湘派卤制品因独特的风味和丰富的营养物质而颇受消费者喜爱。湘派卤制品是将原料放入事先熬制的卤汁(猪大骨、香辛料、菜籽油、调味料等)中多次卤制而成,所用卤汁的好坏直接决定卤制品的风味和品质[1]。近年来,伴随着湘派卤制品市场规模持续快速增长,缺乏安全管理的作坊式加工、采用廉价原材料、卤汁粗放保存及反复循环使用等现象已成为卤制品生产的趋势,而原材料不合格和加工工艺不规范易引起卤制品品质劣化,进而导致严重的经济损失。
卤汁中潜在危害因子较多,一方面是原料带入的,另一方面是循环使用发生复杂化学反应产生的,主要分为化学性(美拉德反应产物、亚硝酸盐、重金属、过氧化值等)和生物性(微生物污染及其毒素残留)危害因子[2-3]。近年来,卤汁微生物污染引起国内外学者的广泛关注。但关于卤汁中生物安全性危害因子的识别和监测,研究人员仅关注腐败菌和致病菌含量变化,或粗略地以样品中的菌落总数进行品质评价,忽略了真菌及其毒素污染的监控[4-5]。此外,由于湖南邵阳地域属亚热带季风性湿润气候,温暖潮湿的气候适宜真菌生长繁殖,因此极易引起卤汁霉变和真菌毒素污染,已成为制约休闲卤制品产业发展的瓶颈。
黄曲霉毒素(aflatoxin, AFs)是一类主要由曲霉属真菌产生的有毒次生代谢物,是已知毒性最大的霉菌毒素[6]。AFs包括B1、B2、G1、G2、M1、M2等多种亚型,其中AFB1是迄今发现毒性最强的真菌毒素[7]。AFB1性质十分稳定,在加工过程中难以破坏,暴露剂量为1 μg/kg时即可诱发强致病、致癌、致畸等毒性作用,已被国际癌症研究机构划定为Ⅰ类致癌物[8]。因此,研究湘派卤制品卤汁中AFs产毒菌的筛选鉴定及其产毒能力测定对湘派卤制品质量安全控制具有重要意义。
本研究对湘派卤制品卤汁在贮存过程中产AFs的微生物进行筛选鉴定及其产毒能力测定。采用平板稀释涂布法和紫外荧光法对湘派卤汁进行产毒菌的初筛,并应用HPLC-MS/MS检测各产毒菌培养液中AFs含量,确定各产毒菌的产毒能力。该研究将为揭示湘派卤汁贮存过程中AFs消除机制奠定基础,并为卤制品加工产业的健康发展提供参考依据。
1 材料与方法
1.1 实验材料
1.1.1 样品采集
卤汁由豆制品加工与安全控制湖南省重点实验室提供。
1.1.2 仪器与设备
高压蒸汽灭菌锅,宁波甬安医疗器械制造有限公司;恒温培养箱,上海三腾仪器有限公司;SW-CJ-2FD双人单面净化工作台,江苏通净净化设备有限公司;梯度PCR仪,杭州柏恒科技有限公司。
1.1.3 试剂
PDA培养基,上海博微生物科技有限公司;甲基化β-环糊精,天津市大茂化学试剂厂;AFs对照品(AFB1、AFB2、AFG1、AFG2),深圳市通量检测科技有限公司;甲醇,盐城纳科医药有限公司。
1.2 实验方法
1.2.1 AFs产毒菌筛选
在无菌室内将收集的样品吸取25 mL于装有225 mL无菌生理盐水的三角瓶内,用涡旋振荡器将样品混匀,得到10-1匀浆液,从10-1的匀浆液中吸取1 mL加入到1支装有9 mL无菌生理盐水的试管中,依次进行10倍稀释,得到6个梯度的稀释液,分别吸取100 μL稀释液注入含有PDA的平皿中,用涂布棒涂布均匀,于28 ℃培养箱中倒置培养3 d。每个稀释梯度设置3个平行。
将疑似霉菌的菌落挑取出来在含有甲基化β-环糊精的PDA培养基上进行纯化,采用点种法接种,继续培养3~7 d,将长出菌落的平皿倒置于365 nm的紫外灯下观察,若看到菌落周围有蓝紫色或黄绿色的荧光则初步判定为AFs产毒菌,将产生荧光的菌落再次划线分离、纯培养,最终得到的纯菌株采用甘油管藏法保存并编号。
1.2.2 菌株鉴定
1.2.2.1 形态学鉴定
挑取产生荧光的单菌株于载玻片上,滴1滴乳酸石碳酸棉蓝染液,盖上盖玻片后静置3 min,擦镜纸吸去盖玻片周围多余染色液,用光学显微镜先在低倍镜下观察菌株整体形态,后转高倍镜观察菌株的菌丝、孢子等形态。并结合《真菌鉴定手册》[9]对初筛菌进行初步鉴定。
1.2.2.2 分子生物学鉴定
基因组DNA的提取按照提取试剂盒说明书提取各产毒菌株的DNA,采用通用引物ITS1/ITS4扩增ITS序列。引物序列为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′。PCR反应体系为10×Buffer 2.5 μL;ITS1/ITS4引物各1 μL;基因组DNA 1 μL;Taq聚合酶 0.5 μL;dNTP 1.0 μL;ddH2O 9.5 μL。PCR反应程序为预变性95 ℃,5 min;变性94 ℃,30 s;退火57 ℃,30 s;延伸72 ℃,90 s;终延伸72 ℃,10 min;扩增循环次数为30次。扩增产物用1%琼脂糖凝胶电泳,将PCR产物送上海生工生物工程有限公司测序。得到的测序结果在NCBI网站上进行比对后,下载同源性高的序列用MEGA6.0软件中Neighbour-Joining法上构建系统发育树。
1.2.3 HPLC-MS/MS法测定产毒菌的产AFs的能力
1.2.3.1 色谱条件
色谱柱:Venusil ASB C18(2.1 mm×100 mm,3 μm);进样量3.0 μL;柱温40 ℃;流动相:A甲醇;B一级水。采用梯度洗脱,条件见表1。流速0.5 mL/min。
表1 梯度洗脱条件
Table 1 Gradient elution conditions
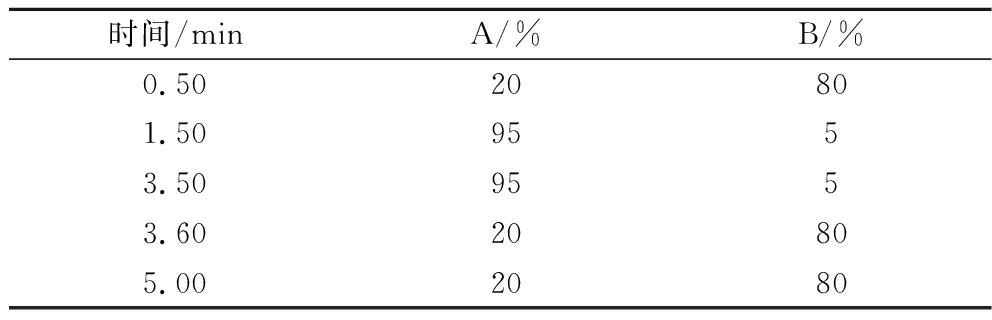
时间/minA/%B/%0.5020801.509553.509553.6020805.002080
1.2.3.2 质谱条件
电喷雾离子源,正离子模式;离子源温度500 ℃;离子喷射电压5 500 V;加热气55.0 psi,雾化气55.0 psi,气帘气体35.0 psi。扫描方式为多重反应监测。
1.2.3.3 标准溶液的制备
准确称取AFB1、AFB2、AFG1、AFG2的标准品,用甲醇溶解、稀释制备成质量浓度分别为5、10、20、50、100、200 ng/mL共6个梯度的标准溶液。
1.2.3.4 产毒培养液的制备
霉菌产毒培养:将筛选得到的产毒菌株接种于PDA固体培养基上,28 ℃培养3 d,用已灭菌的0.5%(体积分数)吐温80洗取平板上菌落的分生孢子,得到5株菌的孢子悬浮液备用。将制备好的孢子悬浮液置于电子显微镜下用血球计数板计数,调整孢子浓度为1.0×106 CFU/mL,然后吸取3 mL孢子悬浮液加入装有100 mL沙氏液体培养基的锥形瓶中。在28 ℃、200 r/min恒温摇床上分别培养3 d和7 d。
AFs的提取:用4层灭菌纱布过滤菌丝球培养液,收集产毒培养液于15 mL离心管中备用。取2 mL产毒培养液再加8 mL纯水定量至10 mL,通过免疫亲和柱,控制流速为2~3 mL/min,用10 mL水分2次洗脱,洗脱后将洗脱液弃去,用洗耳球将水吹尽,再加1 mL纯甲醇洗脱,用注射器将管中上清液吸出,将注射器中的毒素提取液过0.22 μm有机系滤膜,装入进样小瓶用HPLC-MS/MS测定待测AFs含量。
2 结果与分析
2.1 产毒菌的分离与形态学鉴定
采用稀释涂布方法,对疑似霉变的湘派卤汁中的产毒菌进行分离、纯化,根据AFs在紫外作用下可发蓝紫光和黄绿色荧光这一特征,初步筛选得到5株可产生黄绿色孢子的菌株,分别命名为7-1-b、W-18-1b、X-1-3、A-1、A-2。菌落7-1-b在PDA培养-基上生长较快,表面中间有些许的隆起并有类似褐色的桃胶物分泌,从中心呈圆环状向四周生长,质地呈致密丝绒状。菌落正面色泽随其生长由白色变为黄绿色,菌落背面呈褶皱状,颜色为浅褐色。分生孢子头呈疏松放射状或疏松柱状,分生孢子梗粗糙,顶囊呈近球形;分生孢子较为分散,呈球形或近球形(图1-a)。菌落W-18-1b生长较快,菌落表面中间隆起,质地为丝绒状且生长茂密。菌落正面初期为白色,直至第7天产生黄色孢子,菌落背面呈褶皱状,颜色为褐色。分生孢子梗的孢梗茎为浅绿色,壁较厚;顶囊呈椭圆形,光滑。该菌落的分生孢子较分散,呈浅绿色,形状为球形或近球形(图1-b)。菌落X-1-3生长迅速,表面隆起,质地呈丝绒状,边缘有不规则褶皱。菌落初期为白色,培养2~3 d后中间部分分泌黄色孢子,边缘为白色,培养到第7天菌落呈黄绿色。分生孢子头分生孢子梗很粗糙,具有单层分生孢子头的产孢结构,顶囊呈安瓿瓶状;分生孢子较分散,呈球形或椭圆形(图1-c)。菌落A-1生长较快,质地丝绒状,偶有絮状菌丝。菌落正面由最初的白色变为黄绿色,背面为褶皱状,颜色为深褐色。分生孢子头初为球形,后呈辐射形;分生孢子梗粗糙,产孢结构为单层,顶囊为杵形;分生孢子呈球形(图1-d)。菌落A-2生长较快,表面中间隆起,质地为致密丝绒状。菌落正面初期为白色,直至第4天分泌黄绿色孢子,菌落背面呈辐射褶皱状。分生孢子头为球形;分生孢子梗壁厚,无色,粗糙;顶囊近球形;分生孢子多为球形或近球形(图1-e)。各菌株在紫外灯照射下产生荧光现象如图2所示。

1、2-菌株在PDA培养基上培养的菌落;3-菌株的产孢结构(×400)a-菌株7-1-b;b-菌株-W-18-1b;c-菌株X-1-3;d-菌株A-1;e-菌株A-2
图1 五株菌在PDA上菌落形态和微观结构
Fig.1 Morphology and microstructure of five strains on PDA
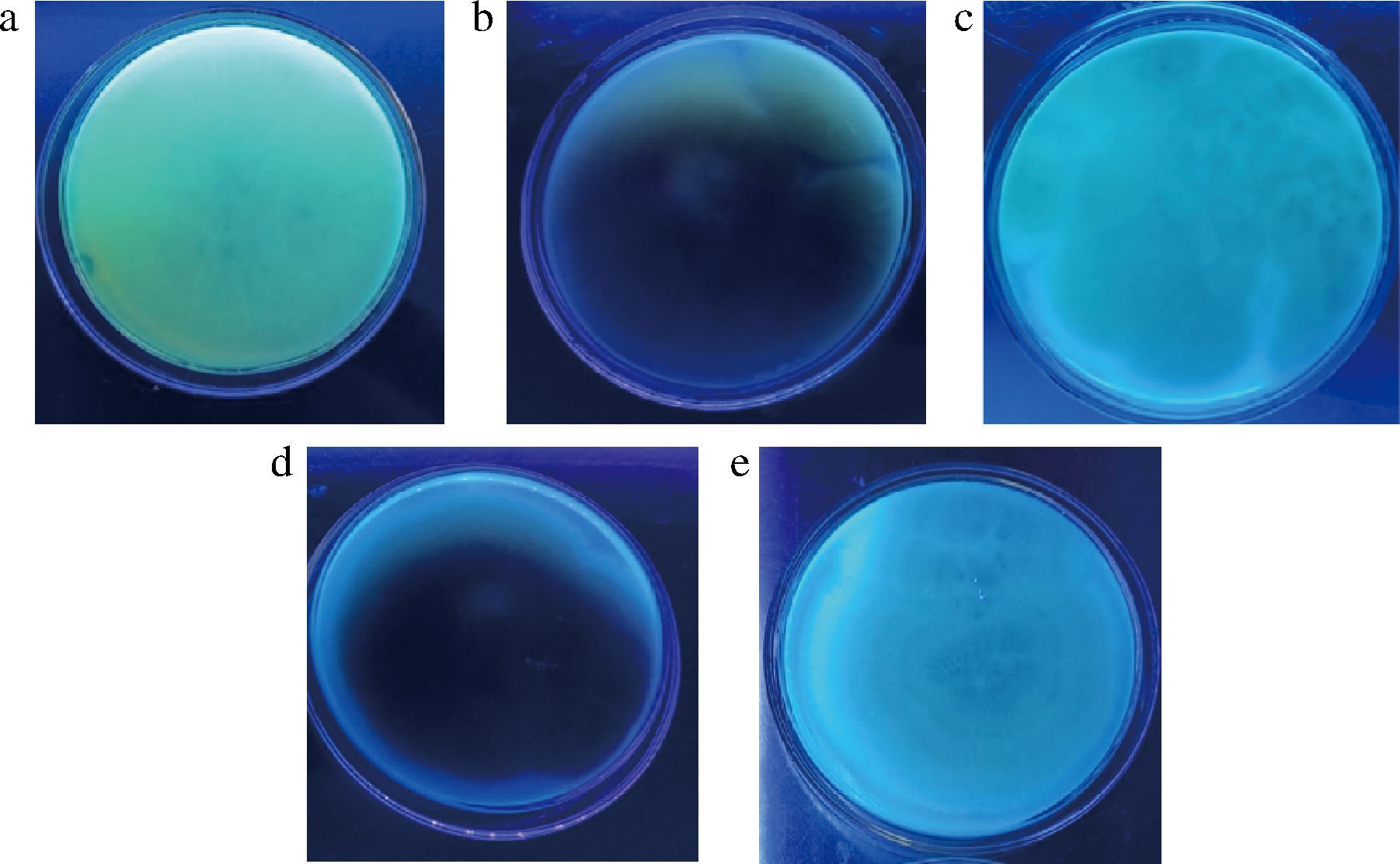
a-7-1-b菌株;b-W-18-1b菌株;c-X-1-3菌株;d-A-1菌株;e-A-2菌株
图2 培养皿中产生荧光现象的菌落
Fig.2 Colony producing fluorescence in petri dish
2.2 分子生物学鉴定
在紫外灯照射下呈现蓝紫色或黄绿色的单菌落,经过基因组DNA的提取,以总DNA为模板,通过利用ITS1/ITS4引物,进行PCR扩增,琼脂糖凝胶电泳检测操作步骤后,发现5株菌在500~600 bp出现特异性条带(图3)。将5株菌测序的结果上传到NCBI网站的的GenBank数据中进行Blast比对,发现7-1-b、W-18-1b、X-1-3、A-2与已知的黄曲霉(Aspergillus flavus)MT645322.1处于同一分枝,同源性达100%,A-1与已知的寄生曲霉(Aspergillus parasiticus)KF624769.1处于同一分枝,同源性达100%。将与5株菌相似度高的序列采用MEGA6.0软件中的邻接法构建系统发育树,7-1-b、W-18-1b、X-1-3、A-2与黄曲霉聚于一支,亲缘关系最近,鉴定为黄曲霉;A-2与寄生曲霉聚于一支,亲缘关系最近,鉴定为寄生曲霉。结果见表2和图4。
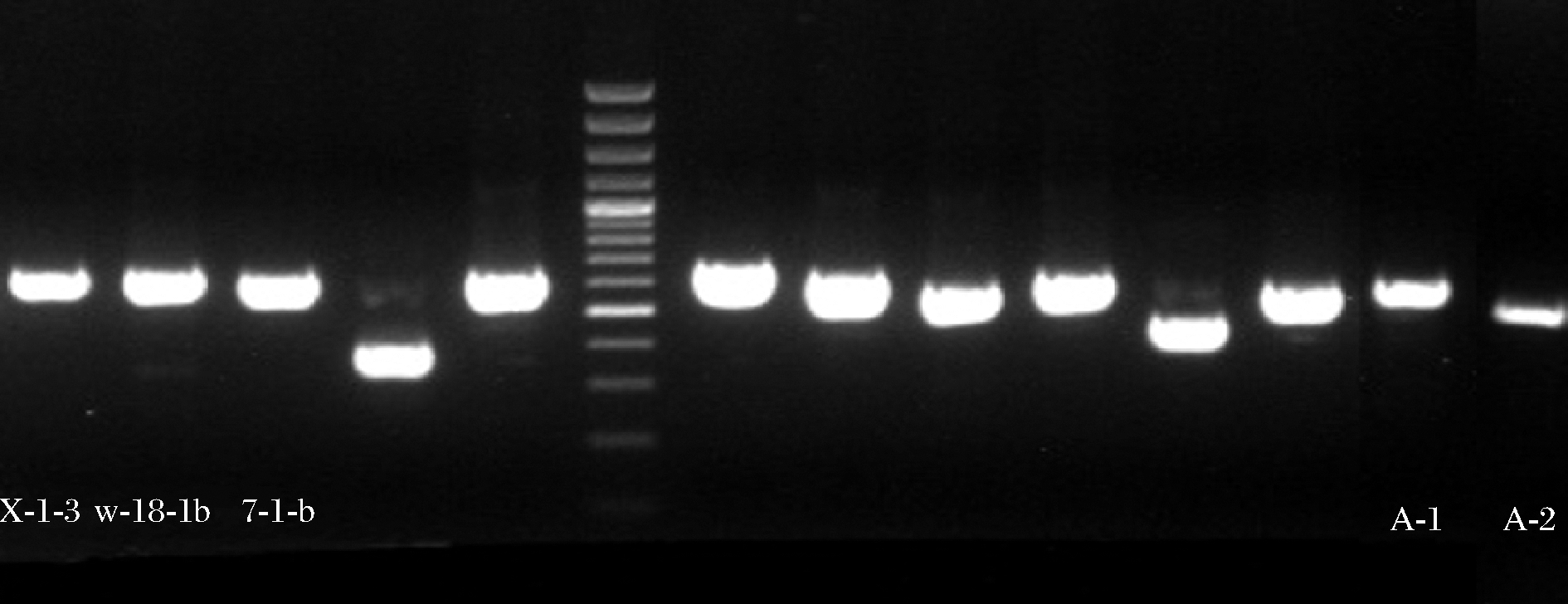
图3 PCR扩增鉴定胶图
Fig.3 Colloidal map of PCR amplification
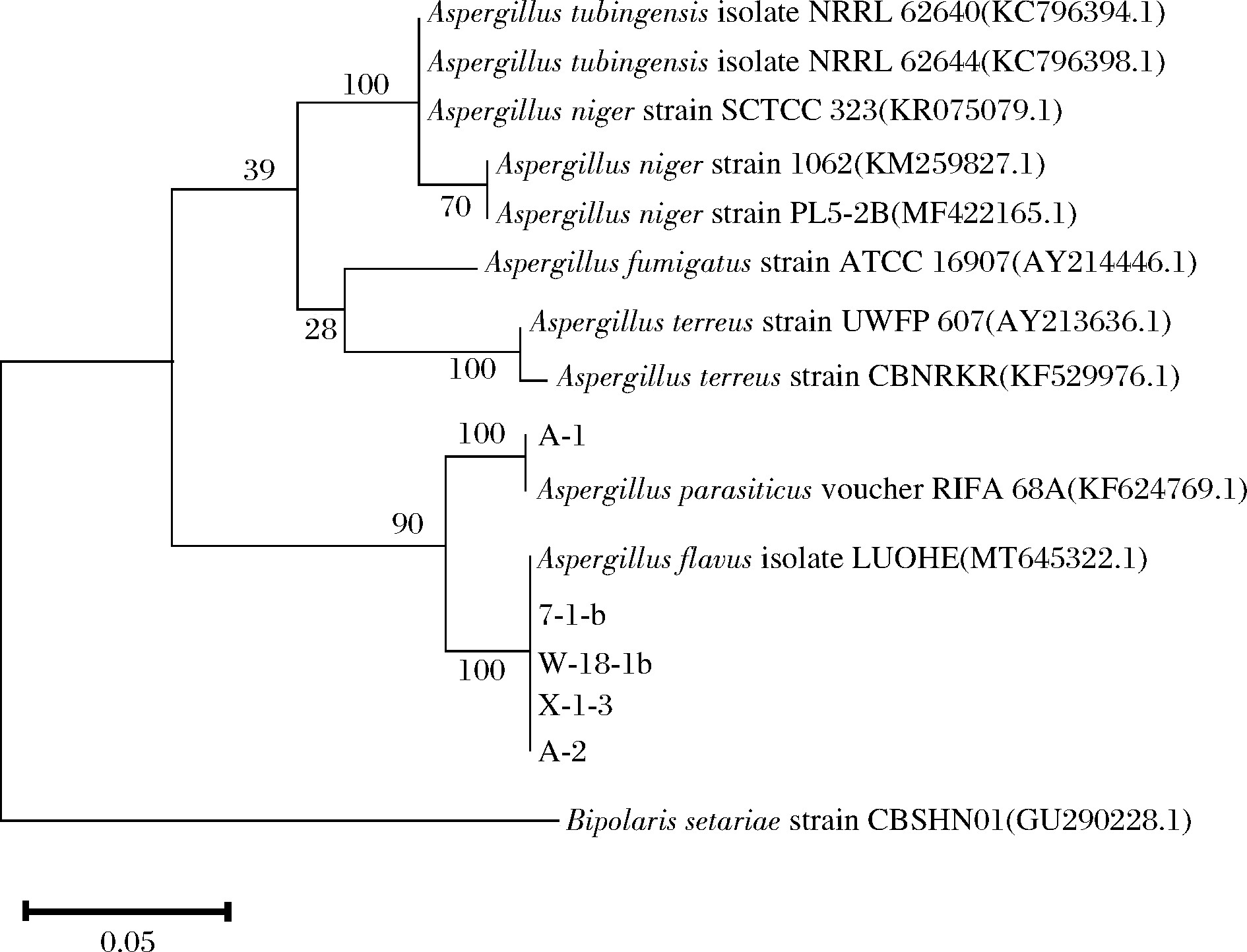
图4 五株菌的系统发育树
Fig.4 Phylogenetic tree of 5 strains
表2 产荧光现象微生物NCBI基因序列比对结果
Table 2 Comparison results of NCBI gene sequences of fluorescent-producing microorganisms
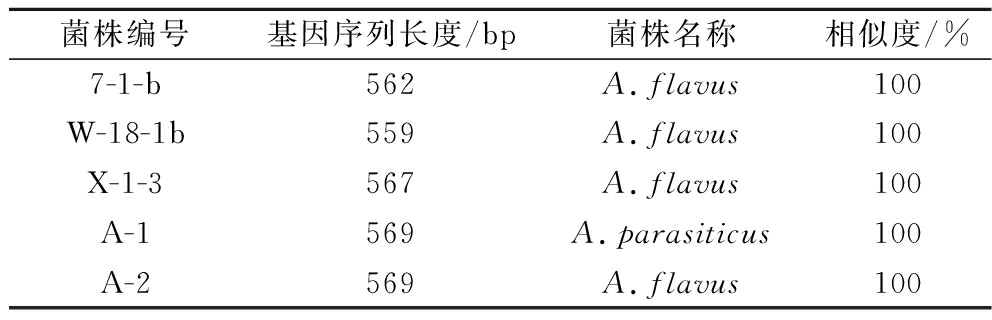
菌株编号基因序列长度/bp菌株名称相似度/%7-1-b562A.flavus100W-18-1b559A.flavus100X-1-3567A.flavus100A-1569A.parasiticus100A-2569A.flavus100
2.3 HPLC-MS/MS法测定产毒菌的产AFs能力
在所选条件下,AFs得到良好的基线分离,4种毒素在4 min内出峰,先后顺序为AFG2、AFG1、AFB2、AFB1,保留时间分别为2.56、2.60、2.64、2.67 min。以峰面积(Y)和毒素浓度(X)为坐标轴,得到4种AFs(AFB1、AFB2、AFG1、AFG2)的标准曲线,相关系数r均大于0.999 0,说明线性关系良好,如表3所示。计算各菌产AFs的能力,结果显示在第3天和第7天的时候4株黄曲霉菌均不产生AFs;1株寄生曲霉菌产生AFB1和AFG1,HPLC-MS/MS定量检测第3天和第7天产AFB1含量分别为6.92、8.08 μg/L,产AFG1含量分别为5.80、7.24 μg/L。结果见表4。
表3 黄曲霉毒素的回归方程、相关系数、线性范围、保留时间、检出限和定量限
Table 3 Regression equation, correlation coefficient, linear range, retention time, detection limit, and quantitative limit of aflatoxins
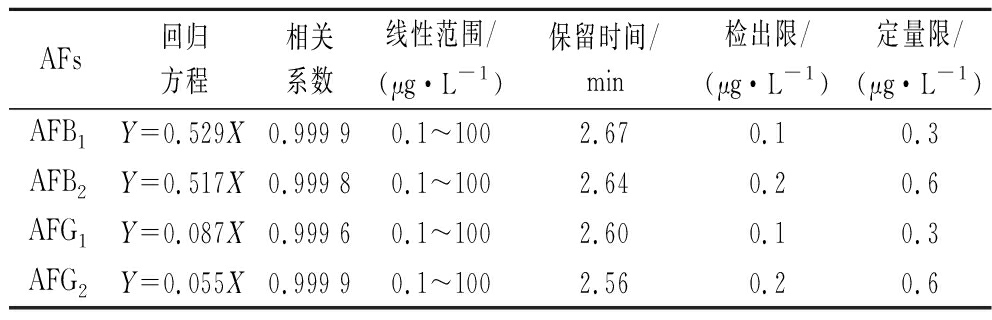
AFs回归方程相关系数线性范围/(μg·L-1)保留时间/min检出限/(μg·L-1)定量限/(μg·L-1)AFB1Y=0.529X0.999 90.1~1002.670.10.3AFB2Y=0.517X0.999 80.1~1002.640.20.6AFG1Y=0.087X0.999 60.1~1002.600.10.3AFG2Y=0.055X0.999 90.1~1002.560.20.6
表4 各菌产AFs能力 单位:μg/L
Table 4 AFs production capacity of each bacterium
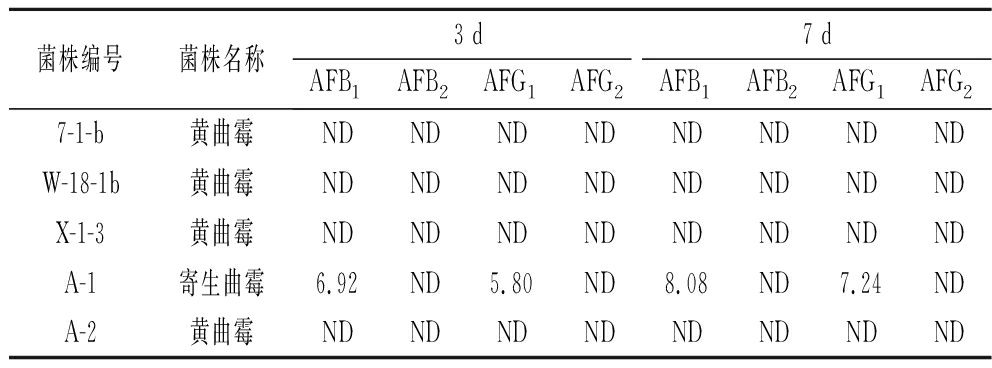
菌株编号菌株名称3 d7 dAFB1AFB2AFG1AFG2AFB1AFB2AFG1AFG27-1-b黄曲霉NDNDNDNDNDNDNDNDW-18-1b黄曲霉NDNDNDNDNDNDNDNDX-1-3黄曲霉NDNDNDNDNDNDNDNDA-1寄生曲霉6.92ND5.80ND8.08ND7.24NDA-2黄曲霉NDNDNDNDNDNDNDND
注:ND为未检出
3 讨论
AFs自然荧光比较难观察到,为了使AFs荧光效果更显著,通常将β-环糊精及其甲基化产物添加到培养基中来进行产毒菌的鉴定[10]。AFB1、AFB2、AFG1、AFG2通过与β-环糊精和它的甲基化衍生物的空穴形成包含复合物从而增强荧光效果,在紫外灯照射下,可观察到菌株周围发出蓝紫色或黄绿色荧光[11]。依据这一原理,本实验将甲基化β-环糊精添加到PDA培养基中,此种方法能够快速检测出湘派卤汁中是否有产AFs的菌株,操作简单且成本低,适用于产毒菌株的初筛。
通过采用紫外荧光检测法,对疑似霉变的湘派卤汁进行产毒菌的筛选,最终获得产蓝紫色和黄绿色荧光的菌落共5株,其中有4株为黄曲霉菌,1株为寄生曲霉菌。经过大量实验证实,自然界中污染食品最多的且分布最广泛的是AFB1[12]。采用液相色谱-串联质谱法检测5株菌的产毒能力的结果显示,4株黄曲霉菌均不产生AFs,寄生曲霉菌产毒且检测到AFB1和AFG1,这一实验结果与寄生曲霉几乎所有的菌株可以产生AFs,黄曲霉则只有部分菌株可以产生AFs相吻合[13]。同时也与在紫外线下B族发出蓝紫色荧光,G族发出黄绿色荧光相一致[14]。
筛选到的4株黄曲霉菌均不产生AFs,原因可能是黄曲霉菌在经过一系列传代培养后,出现营养菌丝增多,囊泡直径和大小减少等现象从而使产AFs能力逐渐降低[15]。同时有研究发现,参与或调控AFs的生物合成包括30个基因[16],当某个基因或基因片段的缺失也可导致菌株不合成AFs或使AFs减少[17]。LIM等[18]研究CRZA基因在黄曲霉中的作用,发现缺乏CRZA会导致菌落生长、分生孢子数量和硬化产生减少,从而导致AFs减少。YUAN等[19]通过研究hexA基因在黄曲霉的分生孢子产生和次生代谢中的作用,结果表明hexA基因的缺失减少了无性孢子的产生,并显著降低了花生和玉米种子的毒力,同时AFB1的产生也显著降低。JIA等[20]研究通过敲除并过表达aflN基因来研究aflN的功能,结果显示aflN缺失导致AFs生物合成的缺陷。YANG等[21]研究不产AFs的黄曲霉菌抑制产毒黄曲霉菌的产毒,通过运用转录组测序分析发酵培养物处理黄曲霉的抑制机制,发现brlA基因和abaA基因显著下调是导致黄曲霉菌不产毒的重要因素。魏丹丹[17]对76株不产毒黄曲霉菌的基因缺失情况进行研究,得到了25种(A~Y)不同的缺失类型,说明了基因的缺失是引起菌株不产毒的关键因素。除此之外,有研究发现紫外线对低浓度AFs具有一定的破坏性[22],而本实验筛选到的黄曲霉菌可能含有的是低浓度的AFs,在紫外线的作用下遭到破坏从而检测不到AFs。
本实验采HPLC-MS/MS法检测初筛产毒菌株的产毒能力,研究结果显示,5株产生荧光的初筛菌株中,4株菌未检测到AFs,表明仅通过紫外荧光法来确定产AFs的菌株可能存在误判的情况,因此还需要使用更准确、更精密的仪器进行检测,如液质联用技术等。根据菌株毒素含量AFs(AFB1、AFB2、AFG1、AFG2 4种类型毒素含量总和),同时参考相关文献,可将其产毒能力划分为4个水平,根据菌株产毒量分别命名为高产毒菌(>1 000 μg/L)、中产毒菌(100~1 000 μg/L)、低产毒菌(<100 μg/L)和不产毒菌(ND)[14,23]。而本实验筛选到的产毒菌的产毒量为12.72 μg/L和15.32 μg/L(均在0~100 μg/L),因此筛选出的寄生曲霉菌为低产毒菌。通过HPLC-MS/MS定量检测发现A-1菌株在培养第3天和第7天均有AFB1和AFG1检出,且第7天的检出量均高于第3天的检出量。
陈浩等[1]通过采用高效液相色谱-柱后衍生法测定湘派卤汁循环使用过程中AFB1含量,结果表明在循环使用的161 d内均未检测出AFB1。出现这种现象的原因可能是湘派卤汁在循环使用的过程中有多种微生物参与,且在不同的时间点存在的优势菌也不一样,已有许多研究发现细菌和真菌均有抑制产AFs菌株生长的作用[24-26]。而本实验在湘派卤汁中不仅筛选出了黄曲霉菌,且筛选出了一株产毒的寄生曲霉菌,说明湘派卤汁存在被霉菌毒素污染的风险,进而引发食品安全问题。由于AFs耐热性很强,而湘派卤制温度通常不超过100 ℃,远远低于其被破坏的温度(280 ℃)[23],因此湘派卤汁一旦被霉菌毒素污染很难将其除去。本研究筛选出的黄曲霉菌虽然没有检测出AFs,但由于霉菌在自然环境中繁殖,不稳定性强、发生突变的概率高,原先不产毒的黄曲霉菌可能存在回复突变的情况,导致其重新产毒[27]。因此从分子生物学的角度去探明其产毒和不产毒机制,并研究湘派卤制品卤汁循环使用过程中是否存在抑制产毒菌生长的微生物是十分必要的,将为湘派卤制品卤制过程中AFs的防控提供科学依据。
4 结论
本研究对湘派卤制品卤汁在贮存过程中产AFs的微生物进行筛选、ITS序列鉴定,并应用HPLC-MS/MS测定其产毒菌培养液中AFs含量。结果显示经平板稀释涂布法、紫外荧光法和分子生物学共筛选鉴定出5株产毒菌株,其中有4株是黄曲霉,1株为寄生曲霉;经HPLC-MS/MS法确定4株黄曲霉均不产生AFs,1株寄生曲霉产AFB1和AFG1,AFB1在第3天和第7天的含量分别为6.92、8.08 μg/L,AFG1在第3天和第7天的含量分别为5.80、7.24 μg/L。该研究将为揭示湘派卤制品卤汁贮存过程中AFs消除机制奠定基础,并为卤制品加工产业的安全、健康发展提供参考依据。
[1] 陈浩, 杨莹, 赵良忠, 等.湘派卤汁循环使用安全监测及预警模型的构建[J].食品与发酵工业, 2020, 46(21):181-187.
CHEN H, YANG Y, ZHAO L Z, et al.The safety monitoring and early-warning model construction for Xiangpai brine recycling[J].Food and Fermentation Industries, 2020, 46(21):181-187.
[2] 杜垒, 谢伟, 徐幸莲, 等.复卤前后盐水鸭老卤基本成分与安全指标变化[J].食品科学, 2009, 30(13):101-104.
DU L, XIE W, XU X L, et al.Changes of main components of old brine used in production of water-boiled salted duck and determination of safety indexes before and after rebrining[J].Food Science, 2009, 30(13):101-104.
[3] 伍涛, 彭希林, 赵良忠, 等.湘派豆干及卤汁在卤制过程中的变化规律[J].食品与发酵工业, 2021, 47(19):146-154.
WU T, PENG X L, ZHAO L Z, et al.Variation law of Xiangpai dried tofu and brine during marinating process[J].Food and Fermentation Industries, 2021, 47(19):146-154.
[4] 杨莹, 唐奕, 尹乐斌, 等.湘派卤豆干卤汁安全品质分析[J].农产品加工, 2018, (24):63-65.
YANG Y, TANG Y, YIN L B, et al.Safety quality analysis of Xiangpai brine bean curd′s brine[J].Farm Products Processing, 2018, (24):63-65.
[5] CHENG Y Q, YU Y J, ZHOU X H, et al.Heterocyclic amines in braised chicken may mainly infiltrate from reused marinade during braising, instead of thermic generation[J].Journal of the Science of Food and Agriculture, 2020, 100(5):1 867-1 874.
[6] SCHAMANN A, SCHMIDT-HEYDT M, GEISEN R, et al.Formation of B- and M-group aflatoxins and precursors by Aspergillus flavus on maize and its implication for food safety[J].Mycotoxin Research, 2022, 38(2):79-92.
[7] PAULETTO M, TOLOSI R, GIANTIN M, et al.Insights into aflatoxin B1 toxicity in cattle:An in vitro whole-transcriptomic approach[J].Toxins, 2020, 12(7):429.
[8] RUSHING B R, SELIM M I.Aflatoxin B1:A review on metabolism, toxicity, occurrence in food, occupational exposure, and detoxification methods[J].Food and Chemical Toxicology, 2019, 124:81-100.
[9] 魏景超. 真菌鉴定手册[M].上海:上海科学技术出版社, 1979.
WEI J C.Fungi Identification Manual[M].Shanghai:Shanghai Science and Technology Press, 1979.
[10] 晏丽. 黄曲霉毒素产毒菌检测方法的研究及其应用[D].无锡:江南大学, 2012.
YAN L. The development and application of detection methods for aflatoxigenic aspergilli[D]. Wuxi: Jiangnan University, 2012.
[11] 阴佳璐. 浑浊红球菌PD630对黄曲霉毒素B1生物降解的研究[D].广州:华南理工大学, 2020.
YIN J L.Study on biodegradation of aflatoxin B1 by Rhodococcus opacus PD630[D].Guangzhou:South China University of Technology, 2020.
[12] CAO W Y, YU P, YANG K P, et al.Aflatoxin B1:Metabolism, toxicology, and its involvement in oxidative stress and cancer development[J].Toxicology Mechanisms and Methods, 2022,32(6):395-419.
[13] 吴丹. 黄曲霉毒素在粮食和食品中的危害及防治[J].粮食加工, 2007, 32(3):91-94.
WU D.Hazard of aflatoxin in oil and grain product and its prevention[J].Grain Processing, 2007, 32(3):91-94.
[14] 张初署. 中国四个生态区花生土壤中黄曲霉菌分布、产毒特征及遗传多样性研究[D].北京:中国农业科学院, 2013.
ZHANG C S.Study on the distribution, aflatoxin production and genetic diversity of Aspergillus flavus in soils of peanut fields in four agroecological zones of China[D].Beijing in soils:Chinese Academy of Agricultural Sciences, 2013.
[15] 罗自生, 秦雨, 徐艳群, 等.黄曲霉毒素的生物合成、代谢和毒性研究进展[J].食品科学, 2015, 36(3):250-257.
LUO Z S, QIN Y, XU Y Q, et al.Recent progress in the biosynthesis, metabolism and toxicity of aflatoxins[J].Food Science, 2015, 36(3):250-257.
[16] 邢福国, 李旭, 张晨曦.黄曲霉毒素的产生机制及污染防控策略[J].食品科学技术学报, 2021, 39(1):13-26;64.
XING F G, LI X, ZHANG C X, et al.Biosynthesis mechanisms and control strategies of aflatoxin[J].Journal of Food Science and Technology, 2021, 39(1):13-26;64.
[17] 魏丹丹. 不产毒黄曲霉菌不产毒的分子机制及其抑制产毒菌产毒的研究[D].北京:中国农业科学院, 2014.
WEI D D.Molecular mechanisms of atoxigenic Aspergillus flavus and the study in inhibiting the aflatoxin production by toxigenic A.flavus[D].Beijing:Chinese Academy of Agricultural Sciences, 2014.
[18] LIM S Y, SON Y E, LEE D H, et al.Function of crzA in fungal development and aflatoxin production in Aspergillus flavus[J].Toxins, 2019, 11(10):567-578.
[19] YUAN J, LI D, QIN L, et al.HexA is required for growth, aflatoxin biosynthesis and virulence in Aspergillus flavus[J].BMC Molecular Biology, 2019, 20(1):4.
[20] JIA K Z, YAN L J, JIA Y P, et al. aflN is involved in the biosynthesis of aflatoxin and conidiation in Aspergillus flavus[J].Toxins, 2021, 13(11):831.
[21] YANG K L, GENG Q R, SONG F Q, et al.Transcriptome sequencing revealed an inhibitory mechanism of Aspergillus flavus asexual development and aflatoxin metabolism by soy-fermenting non-aflatoxigenic Aspergillus[J].International Journal of Molecular Sciences, 2020, 21(19):6994.
[22] DIAO E J, LI X Y, ZHANG Z, et al.Ultraviolet irradiation detoxification of aflatoxins[J].Trends in Food Science and Technology, 2015, 42(1):64-69.
[23] 张杏. 中国典型花生产区黄曲霉菌分布、产毒力与侵染研究[D].北京:中国农业科学院, 2019.
ZHANG X.Study on the distribution, toxigenicity and infection of Aspergillus flavus in typical peanut producing areas in China[D].Beijing:Chinese Academy of Agricultural Sciences, 2019.
[24] 姚彦坡, 丁丹, 张友青, 等.玉米黄曲霉毒素污染生防菌筛选及菌株B42-3抗菌活性研究[J].中国粮油学报, 2018, 33(3):84-88.
YAO Y P, DING D, ZHANG Y Q, et al.Screening of maize endophytic antagonists against Aspergillus flavus and activities research of antagonistic strain B42-3[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(3):84-88.
[25] GALV N A I, HERN
N A I, HERN NDEZ A, DE GU
NDEZ A, DE GU A C
A C RDOBA M, et al.Control of toxigenic Aspergillus spp.in dried figs by volatile organic compounds (VOCs) from antagonistic yeasts[J].International Journal of Food Microbiology, 2022,376:109772.
RDOBA M, et al.Control of toxigenic Aspergillus spp.in dried figs by volatile organic compounds (VOCs) from antagonistic yeasts[J].International Journal of Food Microbiology, 2022,376:109772.
[26] SWEANY REBECCA R, MACK BRIAN M, MOORE GEROMY G, et al.Genetic responses and aflatoxin inhibition during co-culture of aflatoxigenic and non-aflatoxigenic Aspergillus flavus[J].Toxins, 2021, 13(11):794.
[27] 刘俊, 张国朋, 张智猛, 等.不产毒黄曲霉菌株的筛选鉴定及分子机理研究[J].花生学报, 2018, 47(3):8-13.
LIU J, ZHANG G P, ZHANG Z M, et al.Screening and mechanism study on an Aspergillus flavu strain which cannot produce aflatoxin[J].Journal of Peanut Science, 2018, 47(3):8-13.