樟芝是我国台湾地区特有的一种药食两用真菌,又名牛樟芝、牛樟菇等,被称为“森林中的红宝石”。樟芝在台湾民间已有用于治疗食物中毒、增强肝脏功能和免疫力的悠久历史。科学研究结果表明樟芝具备抗炎、护肝、增强免疫力和抗癌等多方面药理活性[1],这些药理活性与其主要含有的三萜、多糖、马来酸与琥珀酸衍生物以及泛醌类衍生物等生物活性成分息息相关。多糖作为其中含量较高的活性成分之一,在抗炎、增强免疫、抗疲劳、抗血管生成、抗癌[2-5]等方面有良好功效。各项深入研究表明樟芝菌菌丝体半乳葡聚糖、β-D-葡聚糖、硫酸化多糖等成分对炎症反应均能够起到显著抑制作用。因此,作为具有较高的生物安全性与药理活性的一类化学成分,樟芝菌多糖在相关保健品、胶囊产品开发等方面有着巨大的潜力。
硒多糖是多糖与硒元素相结合形成的有机硒化合物,是一种良好的补硒原料[6]。大量研究证明,硒多糖在具备补硒功效的同时,具有较高的生物活性。例如,沙蒿硒多糖对人肺腺癌细胞(H1975、A549)、人肝癌细胞的抗增殖活性高于普通沙蒿多糖[7]。真姬菇硒多糖对脂多糖(lipopolysaccharide,LPS)诱导的肺损伤能够起到显著保护作用[8]。螺旋藻硒多糖对镉诱导的毒性保护作用高于螺旋藻多糖与无机硒[9]。以石莼多糖富硒后制备的纳米颗粒为原料的漱口水对乳酸菌、白色念球菌的抗菌活性与抗生素相当,对变形链球菌、金黄色葡萄球菌的抗菌效果更佳[10]。还有其他研究表明硒多糖能起到较好地诱导癌细胞凋亡,比无机硒更易吸收等效果[11-12]。近年来,已有大量学者通过食用菌富硒的方式对硒多糖的制备与结构开展研究,包括灵芝富硒多糖、真姬菇硒多糖、蛹虫草硒多糖和猴头菇硒多糖等。樟芝作为一种良好的药食两用真菌,具有较高的开发利用价值,但关于其菌丝体的富硒研究却很少。
樟芝菌的液态发酵培养相比于椴木培养、固态培养等培养方式具有培养周期短、操作简单、可实现规模化生产等优势,是研究樟芝菌代谢产物常用的培养方式[13-14]。
因此,本文分别从培养基成分、发酵条件方面进行了单因素试验以及正交条件优化,以生物量、多糖含量、硒含量与富硒率为评价指标,综合选出樟芝菌液态发酵硒多糖的最佳条件。通过体外抗炎活性实验,比较菌丝体硒多糖与无硒多糖对相关炎症指标的影响,探究了二者抗炎活性的差异。本研究可为樟芝菌硒多糖的扩大培养提供理论依据,为挖掘樟芝菌活性成分更多方面的开发利用方式提供思路。
1 材料与方法
1.1 材料与试剂
樟芝菌(Antrodia cinnamomea),上海福茂食用菌有限公司;巨噬细胞(RAW264.7),昆明细胞库。
1.2 仪器与设备
生化培养箱,上海一恒科学仪器有限公司;QYC-2102全温培养摇床,宁波江南仪器公司;MARS6型高通量密闭微波消解仪,美国培安有限公司;原子荧光光谱仪,北京普析通用仪器有限责任公司;SpectraMax M5酶标仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 樟芝菌培养条件
种子培养基:葡萄糖50 g/L,玉米浆干粉16 g/L,大豆水解液20 mL/L,MgSO4·7H2O 0.5 g/L,K2HPO4 0.5 g/L,柠檬酸0.5 g/L,pH自然,装液量100 mL/250 mL。
液态发酵初始培养基:葡萄糖40 g/L,玉米浆干粉8 g/L,大豆水解液50 mL/L,MgSO4·7H2O 0.5 g/L,K2HPO4 0.5 g/L,pH自然,装液量100 mL/250 mL。
孢子悬浮液制备:选取生长情况良好的樟芝菌,将其表层孢子洗下,调整浓度为1×106~1×107 CFU/mL。
发酵时间测定:以初始发酵培养基为发酵条件,共接种16组,每组3个平行。每天随机抽取3个培养瓶,测定生物量和多糖含量,选择最佳发酵时间。
种子液培养:取孢子悬浮液以10% (体积分数)接种于制备好的种子培养基中,28 ℃,130 r/min培养3 d。
摇瓶培养:取培养好的种子液以15% (体积分数)接种量转接于初始发酵培养基中,28 ℃,130 r/min培养9 d。
1.3.2 发酵优化指标测定
生物量的测定:滤纸烘干至恒重,精确称取滤纸干重。将培养好的菌丝体进行抽滤,用蒸馏水洗涤数遍,50 ℃烘干至恒重,准确称量滤纸与菌丝体总重,生物量计算如公式(1)所示:
生物量![]()
(1)
式中:m1为烘干后滤纸质量,g;m2为烘干后滤纸与菌丝体总质量,g;V为每瓶培养基装液量,mL。
多糖的测定:称取0.200 g樟芝菌菌丝体粉末,加入30 mL蒸馏水混匀,80 ℃水浴1 h,取上清液,重复1次,超声提取30 min,重复1次,合并上清液,加入4倍体积的无水乙醇静置过夜,5 000 r/min离心15 min,收集沉淀。利用苯酚-硫酸法测定多糖含量。硒含量的测定:采用GB 5009.93—2017《食品安全国家标准 食品中硒的测定》。富硒率的计算如公式(2)所示:
富硒率![]()
(2)
式中:硒含量为原子荧光光谱法所得,mg/g;生物量为该样品生物量测定结果,g;Na2SeO3质量浓度为该菌丝体所在培养基的Na2SeO3质量浓度,mg/L。
1.3.3 发酵优化实验步骤
1.3.3.1 培养基成分的优化
在初始培养基的基础上分别添加0、0.2、0.4、0.6、0.8、1、1.5、2、2.5、3、3.5 mg/L的Na2SeO3,选取最佳Na2SeO3添加量;在上述实验基础上,将碳源分别替换为葡萄糖、麦芽糖、果糖、乳糖、可溶性淀粉、蔗糖、玉米粉、米粉,总添加量均为40 g/L,选取最佳碳源种类,并对最佳碳源复合比例进一步优化;在上述实验基础上,将氮源分别替换为大豆水解液、蛋白胨、玉米浆粉、氯化铵、硫酸铵、硝酸钠,总添加量均为15 g/L,选取最佳氮源种类,并对最佳氮源复合比例进一步优化。
1.3.3.2 发酵条件的优化
在上述实验基础上,将发酵液初始pH值分别设定为3、4、5、6、7、8,选取最佳发酵液初始pH值;在上述实验基础上,将250 mL摇瓶中发酵液装液量分别设定为50、75、100、125、150 mL,选取最佳装液量;在上述实验基础上,将摇床转速分别设定为70、100、130、160、190 r/min,选取最佳摇床转速;在上述实验基础上,将发酵温度分别设定为20、24、28、32、36 ℃,选取最佳发酵温度。
1.3.3.3 正交试验
通过单因素试验综合选择正交试验的因素与水平。选择玉米浆干粉添加量、硫酸铵添加量、初始pH值、摇床转速,进行4因素3水平的正交试验(表1)。
表1 L9 (34) 正交试验设计
Table 1 Code and level of independent variables used for L9(34) orthogonal array
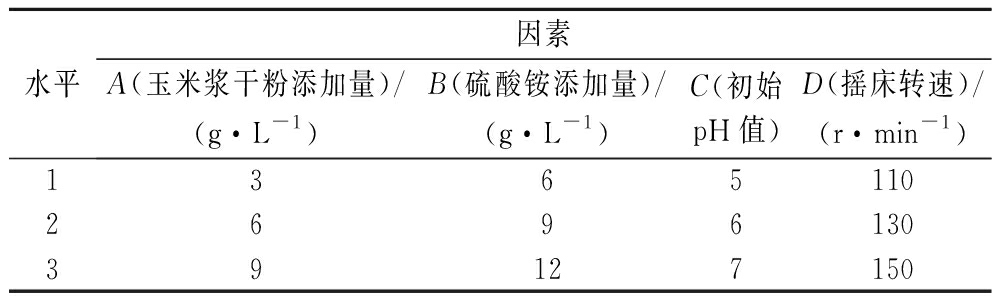
水平因素A(玉米浆干粉添加量)/(g·L-1)B(硫酸铵添加量)/(g·L-1)C(初始pH值)D(摇床转速)/(r·min-1)1365110269613039127150
1.3.4 樟芝菌硒多糖与无硒多糖对RAW264.7细胞的抗炎活性
1.3.4.1 RAW264.7细胞培养方法
小鼠单核巨噬细胞RAW264.7加入DMEM高糖完全培养基(含1%青-链霉素双抗)中,置于37 ℃、5%(体积分数)CO2培养箱中培养,当细胞铺满培养瓶底部80%时进行传代,并进行后续实验。
1.3.4.2 细胞存活率实验
调整RAW264.7细胞悬液以1×105个/mL的密度接种于96孔板,每孔200 μL,待细胞贴壁后按实验分组进行处理,分别为空白组(完全培养基)、硒多糖实验组(硒多糖质量浓度分别为50、100、150、200、250 μg/mL的培养基)、无硒多糖实验组(无硒多糖质量浓度分别为50、100、150、200、250 μg/mL的培养基),实验设置6复孔。培养20 h后,去掉原有培养基,加入200 μL四甲基偶氮唑蓝( methyl thiazolyl terazolium,MTT)溶液(0.5 mg/mL),培养4 h后加入200 μL 二甲基亚砜(dimethyl sulfoxide,DMSO),振板10 min后,用酶标仪测定各孔在540 nm波长的吸光值。计算各组细胞存活率。
1.3.4.3 NO、总超氧化物歧化酶(superoxide dismutase,SOD)活性及炎症因子的测定
调整RAW264.7细胞悬液以1×105个/mL的密度接种于12孔板,待细胞贴壁后按实验分组进行处理,实验分组同上。实验设置3复孔,放置于培养箱内培养12 h后,除空白组外其他组均加入含1 μg/mL LPS培养基作用24 h,而后收集细胞上清液和细胞,按试剂盒说明测定NO、TNF-α、IL-1β、IL-6和总SOD的水平。
1.4 数据处理
每个实验重复3次,数据均以平均值±标准误差表示。采用IBM SPSS Statistics 25.0软件进行方差分析与显著性分析,运用Origin 8.5和Photoshop 19软件进行作图。
2 结果与分析
2.1 发酵时间测定结果
由图1可知,生物量于第9天达到最高值15.06 g/L。菌丝体多糖含量在第7天达到最高值后逐渐下降,从第12天起含量又逐渐上升,这与已有的研究结果一致[15-16]。在发酵初期,多糖含量随着生物量的快速增长不断增加。进一步发酵后由于菌种量较大,菌种在形成其他代谢产物的过程中多糖的消耗量大于生成量,导致含量降低。在后期阶段,菌种量逐渐降低,菌种代谢逐渐减弱,产生的多糖则会逐渐积累[17]。在第9天,生物量生长达到最高水平,且此时多糖含量与后期最高值相差不大。综合考虑,选取第9天为最佳发酵时间。

图1 发酵时间对樟芝菌生物量和多糖含量的影响
Fig.1 Effect of fermentation time on biomass and polysaccharide content of Antrodia cinnamomea
2.2 樟芝菌液态发酵多糖富硒条件优化
2.2.1 培养基对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
2.2.1.1 Na2SeO3添加量对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图2-a可知,当Na2SeO3添加量为3.5 mg/L时,生物量达到最高值13.98 g/L;在1.5 mg/L添加量时多糖含量最高为5.86 mg/g;在2、2.5 mg/L Na2SeO3添加量时富硒率可达到70%以上。在0~2.5 mg/L,培养基Na2SeO3添加量的增加可以促进菌丝体的生长,超过2.5 mg/L的添加量时,菌丝体硒含量则逐渐下降,这与唐亚丽[18]的实验结果一致。综合来看,最终选取2 mg/L作为最佳Na2SeO3添加量。

a-Na2SeO3添加量;b-碳源种类;c-碳源(麦芽糖、可溶性淀粉)复合比例;d-氮源种类;e-氮源(玉米浆干粉、硫酸铵)复合比例
图2 培养基对樟芝菌生物量、多糖含量、硒含量和富硒率的影响
Fig.2 Effect of culture medium on the biomass, polysaccharide content, selenium content, and selenium enrichment rate of Antrodia cinnamomea
2.2.1.2 碳源种类及其复合比例对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图2-b可知,玉米粉作为碳源时生物量可达到20.04 g/L,可溶性淀粉作为碳源时,多糖含量达到5.77 mg/g,当乳糖和麦芽糖为碳源时,硒含量与富硒率均为较高值。结果表明,复合碳源如可溶性淀粉、玉米粉等更适宜樟芝菌的生长和多糖的产生,而单一碳源如麦芽糖和乳糖则可以促进菌丝体对硒的吸收。综合4个指标,最终选取麦芽糖和可溶性淀粉作为最佳复合碳源。
由图2-c可知,当麦芽糖与可溶性淀粉质量比为3∶2时,多糖含量达到最高值10.84 mg/g,生物量与硒含量分别为12.03 g/L和79 μg/g(与最高值之间差值较小)。综合来看,最终选取麦芽糖∶可溶性淀粉质量比为3∶2作为最佳碳源复合比例。
2.2.1.3 氮源种类及其复合比例对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图2-d可知,玉米浆干粉可以促进生物量的增长,硝酸铵对于多糖的合成有优势,硫酸铵可以促进菌丝体硒的吸收。有研究表明,有机氮有利于菌丝体的生长和多糖的产生,铵态氮比硝态氮更有利于促进多糖的合成[19]。这可能是因为有机氮中能够更好的为菌丝生长提供营养;而无机氮利于吸收利用,从而加速多糖产生,能够为硒的吸收提供更多能量。综合选择,最终选取玉米浆干粉和硫酸铵作为最佳复合氮源。
由图2-e可知,第一组生物量为最后一组的1.3倍,说明玉米浆干粉可以为菌丝体生长提供更丰富的营养;硫酸铵添加比例为玉米浆干粉4倍时,硒含量与富硒率为最高值215 μg/g和81%。这些与上述实验结果保持一致。结合来看,最终选取玉米浆干粉与硫酸铵质量比为2∶3作为最佳氮源复合比例。
2.2.2 发酵条件对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
2.2.2.1 初始pH值对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图3-a可知,生物量在pH 6时达到最高值14.18 g/L,发酵液初始pH值为7时硒含量和富硒率分别为129 μg/g和65%,与最高值之间差值较小。生物量结果表明在偏酸环境生长的樟芝生物量要高于碱性环境,这与已有的研究结果相一致[20]。综合来看,最终选取初始pH 7作为最佳pH值。

a-初始pH值;b-装液量;c-摇床转速;d-温度
图3 发酵条件对樟芝菌生物量、多糖含量、硒含量和富硒率的影响
Fig.3 Effect of fermentation conditions on the biomass, polysaccharide content, selenium content, and selenium enrichment rate of Antrodia cinnamomea
2.2.2.2 装液量对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图3-b可知,随着装液量的增加生物量逐渐减少,这与樟芝菌是好氧真菌有关[21]。在装液量为150 mL/250 mL时,生物量仅为最高值(8.349 g/L)的45%,硒含量(481.2 μg/g)与富硒率(89%)均为最高值。由此推测硒的富集与菌丝体自身生长状况相关性较小,这一现象值得进一步探索。综合来看,最终选取装液量75 mL/250 mL作为最佳装液量。
2.2.2.3 摇床转速对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图3-c可知,在一定范围内增加转速可以增加锥形瓶内的通气量,提高溶氧量,提高菌体生物量。而转速过高则会导致剪切力过大,阻碍菌体生长。在摇床转速为130 r/min时,生物量和多糖含量可分别达到最高值9.54 g/L和24.97 mg/g,富硒率为96%。综合来看,选择130 r/min为最佳转速。
2.2.2.4 发酵温度对樟芝菌生物量、多糖含量、菌丝体硒含量及富硒率的影响
由图3-d可知,在24 ℃条件下,生物量与富硒率均为最高值,而多糖含量与硒含量在36 ℃条件下达到最高值。由于生物量是发酵优化中重要参考指标,且36 ℃条件下的生物量过低,因此排除36 ℃。综合考虑,选取24 ℃为发酵最佳温度。
2.2.3 正交试验结果
由上述单因素试验结果,综合选择了玉米浆干粉添加量、硫酸铵添加量、初始pH值、摇床转速来进行正交试验,实验结果如表2所示,4个因素对樟芝菌生物量影响顺序为A>D>B>C;对樟芝菌多糖含量影响顺序为A>D>B>C;对樟芝菌菌硒含量影响顺序为A>C>D>B;对樟芝菌菌富硒率影响顺序为A>C>B>D。综合选择A3B2C3D3,即玉米浆干粉添加量为9 g/L,硫酸铵添加量为9 g/L,初始pH值为7,摇床转速为150 r/min。经验证实验,在此最佳发酵条件下樟芝菌生物量可达到13.24 g/L,与含有2 mg/L Na2SeO3的初始培养条件相比,多糖含量提高15%、硒含量提高15%、富硒率提高19%。
表2 L9(34)正交试验设计及结果
Table 2 L9(34) Orthogonal array design and corresponding experimental results

试验号ABCD生物量/(g·L-1)多糖含量/(mg·L-1)硒含量/(μg·g-1)富硒率/%111118.19417.498185.43675.97212229.61517.258221.530100.00313338.49322.300234.75099.69421239.12525.047206.60494.26522319.12325.917223.043100.00623129.45825.379138.69665.597313211.26324.011107.92960.788321310.34028.140112.54158.189332110.12126.652124.55063.03K126.30228.58127.99227.438 生物量/(g·L-1)K227.70629.07828.86030.335K331.72428.07228.87927.958R1.8070.3350.2960.966K157.05666.55771.01770.067多糖含量/(mg·g-1)K276.34371.31468.95666.648K378.80374.33172.22875.487R7.2492.5921.0912.946K1641.716499.968436.673533.029硒含量/(μg·g-1)K2568.343557.115552.684468.155K3345.020497.996565.721553.894R98.89819.70643.01628.580K1275.661231.009199.743238.999富硒率/%K2259.847258.184257.287226.366K3181.990228.306260.468252.134R31.2249.95920.2428.589
2.3 樟芝菌硒多糖与无硒多糖对RAW264.7细胞抗炎活性的影响
2.3.1 樟芝菌硒多糖与无硒多糖对RAW264.7细胞存活率的影响
如图4所示,在0~250 μg/mL,樟芝菌硒多糖与无硒多糖对小鼠巨噬细胞均无毒性作用。
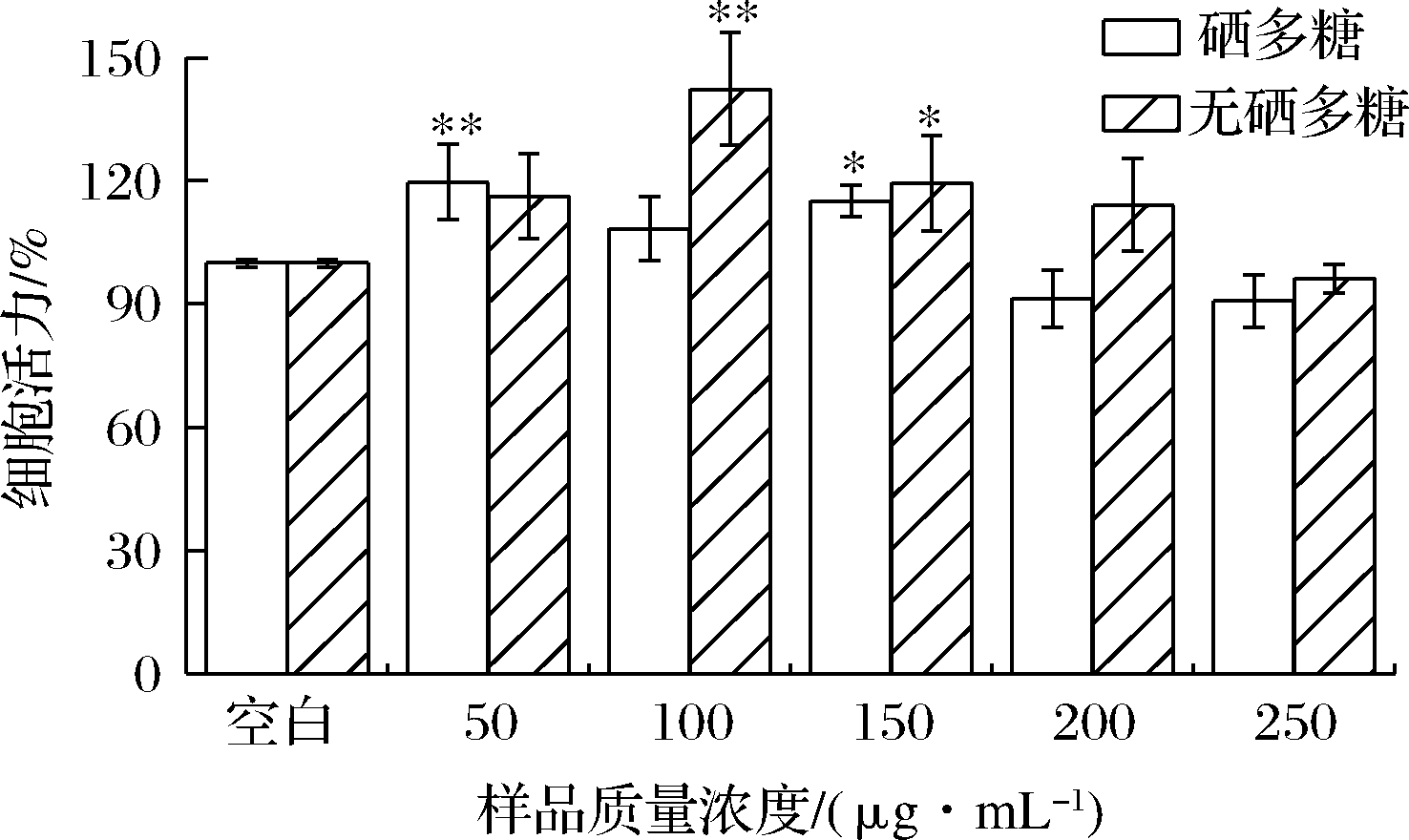
图4 无硒多糖、硒多糖对RAW264.7细胞存活率的影响
Fig.4 Effect of selenium-free polysaccharides and selenium polysaccharides on the viability of RAW264.7 cells
注:“##” 表示模型组与空白组P<0.01差异极显著;“*”表示实验组与模型组差异显著(P<0.05),“**”表示试验组与模型组组差异极显著(P<0.01)(下同)
2.3.2 樟芝菌硒多糖与无硒多糖对RAW264.7细胞NO释放量和SOD活力的影响
在正常情况下,机体内的细胞会释放少量NO,对机体有一定的保护作用,而过高浓度的NO释放则会引起炎症反应[22]。如图5所示,与空白组相比,模型组的NO释放量显著增高、SOD活力显著降低。与模型组相比,无硒多糖与硒多糖处理组细胞的NO释放量都显著降低,并且与样品浓度的增加呈现一定的正相关性。由图5-b可知,硒多糖处理组在实验范围内均能显著提高SOD活性,而无硒多糖在50~150 μg/mL显著提高SOD活性,二者均于100 μg/mL质量浓度时可分别达到8.186、6.740 U/mg prot的SOD活性。以上数据表明,两组样品对LPS诱导的RAW264.7细胞炎症模型具有抗氧化保护作用,综合来说,硒多糖既能够显著降低NO释放量,同时对于提高SOD的活力的效果更强。

a-NO含量;b-SOD活力
图5 无硒多糖、硒多糖对RAW264.7细胞NO含量和SOD活力的影响
Fig.5 Effect of selenium-free polysaccharides and selenium polysaccharides on NO productione and SOD activity in RAW264.7 cells
2.3.3 樟芝菌硒多糖对RAW264.7细胞产生炎症因子的影响
由图6可知,模型组细胞的TNF-α、IL-6、IL-1β释放量均显著上升。与模型组相比,硒多糖样品处理组在250 μg/mL条件下TNF-α释放量可下降17%,在200 μg/mL条件下IL-6释放量可下降23%;无硒多糖样品处理组在100 μg/mL条件下细胞中TNF-α、IL-6释放量分别下降了27%和35%。无硒多糖处理组IL-1β释放量随样品浓度的增加而逐渐上升,其IL-1β释放量在50 μg/mL时产生最低值(151.483±5.557) pg/mL。硒多糖对IL-1β释放量的影响则呈现先下降后上升的趋势,在150 μg/mL达到最好的效果(168.612±1.798) pg/mL。硒多糖与无硒多糖在100~250 μg/mL均能显著降低TNF-α、IL-6的释放量。实验结果表明,无硒多糖与硒多糖均可以减弱LPS诱导的RAW264.7细胞炎症。这与之前的研究结果相一致,在之前的研究中樟芝菌乙醇提取物可以显着抑制LPS、ATP 诱导的巨噬细胞分泌IL-1β、IL-18和 TNF-α[23],樟芝菌的水提取物可抑制小鼠RAW264.7巨噬细胞中TNF-α、IL-1β、诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和环氧合酶-2(cyclooxygenase-2,COX-2)的产生[24]。

a-TNF-α;b-IL-6;c-IL-1β
图6 无硒多糖、硒多糖对RAW264.7细胞中炎症因子产生的影响
Fig.6 Effect of selenium-free polysaccharide and selenium polysaccharides on inflammatory cytokines
此外,LU等[25]通过实验发现,硫酸铵处理会改变樟芝多糖的理化性质,包括分子质量分布和化学成分。在抗炎活性实验结果中表明,经过硫酸铵处理后的樟芝菌多糖仅在低浓度条件下对IL-6的释放起到显著抑制作用,且在此条件下的硫酸铵多糖中岩藻糖、半乳糖、葡萄糖、甘露糖和硫酸盐含量达到最大值。在不同温度(90、25 ℃)条件下处理得到的两种不同低聚糖特性的樟芝菌多糖产物,对于LPS诱导的巨噬细胞促炎因子的抑制效果不同[26]。在本实验中,无硒多糖在降低NO、IL-6的释放量上具有更大优势,硒多糖能够更好地提高SOD活力,且在150 μg/mL条件下对各指标的影响最显著。由此可以推测经过微生物富集得到的硒多糖,其理化性质产生了一定的变化,这些变化导致樟芝多糖能够从多方面更好的减弱细胞炎症。
3 结论
本文首先进行了单因素优化,发现复合碳氮源如可溶性淀粉、玉米浆干粉,有利于樟芝菌菌丝体的生长和多糖的产生;麦芽糖、硫酸铵对菌丝体富硒能起到一定的促进作用。以单因素试验结果为依据进行了正交试验,得出最佳条件为Na2SeO3添加量2 mg/L、麦芽糖24 g/L、可溶性淀粉16 g/L、玉米浆干粉9 g/L,硫酸铵9 g/L,装液量75 mL/250 mL、初始pH值7,24 ℃、150 r/min培养9 d。实验结果表明,无硒多糖、硒多糖预处理后,均能够显著降低炎症反应下RAW264.7细胞NO释放量、提高细胞内SOD活力、降低TNF-α、IL-1β和IL-6释放量,对炎症反应能够起到有效抑制作用。进一步分析发现硒多糖实验组对SOD活力提高效果更好,能够显著性降低IL-1β释放量的样品浓度范围更广泛,说明樟芝菌硒多糖在富硒的同时,对于提高SOD活力和降低IL-1β方面的抗炎活性高于无硒多糖。
综上,本实验为樟芝菌硒多糖的规模化生产提供了一定的理论基础,在抗炎活性方面的初步探索为樟芝菌硒多糖的开发利用提供新的思路,同时为其深入研究提供一定的理论基础。
[1] JEITLER M, MICHALSEN A, FRINGS D, et al.Significance of medicinal mushrooms in integrative oncology:A narrative review[J].Frontiers in Pharmacology, 2020, 11:580656.
[2] ZHANG Y T, WANG Z, LI D Y, et al.A polysaccharide from Antrodia cinnamomea mycelia exerts antitumor activity through blocking of TOP1/TDP1-mediated DNA repair pathway[J].International Journal of Biological Macromolecules, 2018, 120:1 551-1 560.
[3] LU M K, LIN T Y, HU C H, et al.Characterization of a sulfated galactoglucan from Antrodia cinnamomea and its anticancer mechanism via TGFβ/FAK/Slug axis suppression[J].Carbohydrate Polymers, 2017, 167:229-239.
[4] LIU Y G, LI L Z, AN S S, et al.Antifatigue effects of Antrodia cinnamomea cultured mycelium via modulation of oxidative stress signaling in a mouse model[J].BioMed Research International, 2017, 2017:9374026.
[5] LIU Y Q, DING Y Q, YE M, et al.A novel heterogalactan from Antrodia camphorata and anti-angiogenic activity of its sulfated derivative[J].Polymers, 2017, 9(6):228.
[6] 殷娴, 邵蕾娜, 廖永红, 等.微生物富集有机硒研究进展[J].食品与发酵工业, 2021, 47(5):259-266.
YIN X, SHAO L N, LIAO Y H, et al.Research progress on organic selenium accumulation by microorganisms[J].Food and Fermentation Industries, 2021, 47(5):259-266.
[7] ZHU S Y, HU J H, LIU S, et al.Synthesis of Se-polysaccharide mediated by selenium oxychloride:Structure features and antiproliferative activity[J].Carbohydrate Polymers, 2020, 246:116545.
[8] LIU M, YAO W J S, ZHU Y F, et al.Characterization, antioxidant and antiinflammation of mycelia selenium polysaccharides from Hypsizygus marmoreus SK-03[J].Carbohydrate Polymers, 2018, 201:566-574.
[9] ZHOU N, LONG H R, WANG C H, et al.Characterization of selenium-containing polysaccharide from Spirulina platensis and its protective role against Cd-induced toxicity[J].International Journal of Biological Macromolecules, 2020, 164:2 465-2 476.
[10] VIKNESHAN M, SARAVANAKUMAR R, MANGAIYARKARASI R, et al.Algal biomass as a source for novel oral nano-antimicrobial agent[J].Saudi Journal of Biological Sciences, 2020, 27(12):3 753-3 758.
[11] XIANG Q F, ZHANG W J, LI Q, et al.Investigation of the uptake and transport of polysaccharide from Se-enriched Grifola frondosa in Caco-2 cells model[J].International Journal of Biological Macromolecules, 2020, 158:1 330-1 341.
[12] 刘韫滔, 李林键, 李诚, 等.两种富硒黄牛肝菌伞多糖的制备、表征及其抗氧化活性[J] 食品科学, 2022,43(7):31-37.
LIU Y T, LI L J, LI C, et al.Preparation, characterization and antioxidant activity of two selenium-enriched polysaccharides from Suillellus luridus[J] Food Science, 2022,43(7):31-37.
[13] ZHANG B B, GUAN Y Y, HU P F, et al.Production of bioactive metabolites by submerged fermentation of the medicinal mushroom Antrodia cinnamomea:Recent advances and future development[J].Critical Reviews in Biotechnology, 2019, 39(4):541-554.
[14] WANG Z Q, ZHU C X, DAI A R, et al.Chemical characterization and antioxidant properties of cell wall polysaccharides from Antrodia cinnamomea mycelia[J].Food Bioscience, 2021, 41:100932.
[15] 肖咪, 刘利敏, 李鹏程, 等.冠突散囊菌发酵湖北海棠茶过程中主要成分及活性研究[J].食品科技, 2022, 47(1):79-86.
XIAO M, LIU L M, LI P C, et al.Dynamic analysis of the main active components and activity in fermentation process of Malus hupehensis by Eurotium cristatum[J].Food Science and Technology, 2022, 47(1):79-86.
[16] 韩瑨. 产糖乳酸菌的筛选、鉴定及其产糖条件的优化[J].微生物学杂志, 2021, 41(5):43-51.
HAN J.Screening, identification and polysaccharide biosynthesis condition optimization of EPS-Producing Lactic Acid Bacteria[J] Journal of Microbiology, 2021, 41(5):43-51.
[17] 刘玉洁, 董丽婷, 罗灿, 等.枯草芽孢杆菌LY-05发酵玉竹产水溶性多糖工艺优化及其抗氧化活性研究[J].食品工业科技, 2022, 43(3):212-221.
LIU Y J, DONG L T, LUO C, et al.Optimization of fermentation process for water-soluble polysaccharides and antioxidant activity of Polygonatum odoratum fermentated by Bacillus subtilis LY-05[J].Science and Technology of Food Industry, 2022, 43(3):212-221.
[18] 唐亚丽. 富硒古尼虫草菌发酵条件优化及活性成分研究[D].天津:天津科技大学,2016.
TANG Y L.Study on optimization of fermentation conditions and active ingredients of Cordyceps gunnii mycelium selenium-riched[D] Tianjin:Tianjin University of Science and Technology, 2016.
[19] 王正齐, 张薄博, 陈磊, 等.响应面法优化樟芝胞外多糖的发酵条件[J].食品工业科技, 2018, 39(11):99-107.
WANG Z Q, ZHANG B B, CHEN L, et al.Optimization of exopolysaccharide yield produced by submerged fermentation of Antrodia cinnamomea by response surface methodology[J].Science and Technology of Food Industry, 2018, 39(11):99-107.
[20] SHU C H, LUNG M Y.Effect of pH on the production and molecular weight distribution of exopolysaccharide by Antrodia camphorata in batch cultures[J].Process Biochemistry, 2004, 39(8):931-937.
[21] CHIANG C C, CHIANG B H.Processing characteristics of submerged fermentation of Antrodia cinnamomea in airlift bioreactor[J].Biochemical Engineering Journal, 2013, 73:65-71.
[22] 苗月, 任桂红, 甄东, 等.蛹虫草多糖调节小鼠巨噬细胞RAW264.7免疫活性的分子机制[J].食品科学, 2019, 40(9):188-194.
MIAO Y, REN G H, ZHEN D, et al.Molecular mechanism of Cordyceps militaris polysaccharides in regulating the immune function of macrophage RAW264.7 cells[J]. Food Science, 2019, 40(9):188-194.
[23] HUANG T T, WU S P, CHONG K Y, et al.The medicinal fungus Antrodia cinnamomea suppresses inflammation by inhibiting the NLRP3 inflammasome[J].Journal of Ethnopharmacology, 2014, 155(1):154-164.
[24] HSEU Y C, WU F Y, WU J J, et al.Anti-inflammatory potential of Antrodia camphorata through inhibition of iNOS, COX-2 and cytokines via the NF-κB pathway[J].International Immunopharmacology, 2005, 5(13-14):1 914-1 925.
[25] LU M K, LEE M H, CHAO C H, et al.Physiochemical changes and mechanisms of anti-inflammation effect of sulfated polysaccharides from ammonium sulfate feeding of Antrodia cinnamomea[J].International Journal of Biological Macromolecules(Basel, Switerland), 2020, 148:715-721.
[26] ZHENG J P, JIAO S M, LI Q Y, et al.Antrodia cinnamomea oligosaccharides suppress lipopolysaccharide-induced inflammation through promoting O-GlcNAcylation and repressing p38/Akt phosphorylation[J].Molecules(Basel, Switzerland), 2017, 23(1):51.