花椒芽是花椒树发芽期幼嫩的芽叶,颜色油亮鲜绿,具有独特的麻香味。花椒芽还含有丰富的营养成分,其粗蛋白、粗脂肪、Ca、Fe和P的含量高于香椿芽,含有16种氨基酸,必需氨基酸占总氨基酸含量达到46.57%;经测定花椒芽含有2.07%的粗脂肪,符合低脂肪的健康饮食要求[1]。花椒在种植过程中只施少量的水溶性化肥,因此花椒芽内几乎不含有害农药、化肥,是纯绿色食品,历来被视为高档的木本蔬菜,是芽苗菜中的珍品;旧时曾被列为宫廷贡品,供宫廷贵族享用,具有“一品椒蕊”的美称[2]。
我国花椒资源丰富,但花椒芽的生长季节性较强。花椒芽采收期短,量大集中,采后组织呼吸作用旺盛,不久便会失水老化变质。新鲜的花椒芽在贮藏加工过程中由于内源酶的作用,也极易发生褐变,使其商品价值降低[3]。采摘后的花椒芽需及时处理,如干制、腌制、罐装等,制成芽菜干、花椒芽泡菜、花椒芽酱、花椒芽罐头等产品,而这些加工方式都需热烫前处理。目前对热烫的研究集中在热烫对原料物理和化学特性的影响,如色泽、营养物质、酶的活性、风味成分[4]。热烫处理后的白菜,钝化了内源酶,防止异味的产生;还可以排除细胞组织内氧气、减少表面微生物,从而保持了较好的品质[5]。但热烫处理也会对果蔬造成一些不利的影响,果蔬的色泽、营养物质等会因热处理产生损失;热烫对萝卜青菜品质影响的研究中发现,热烫会破坏果蔬的细胞壁结构,导致叶绿素和维生素等成分的大量流失[4]。此外热烫过程中存在的热降解、热扩散以及热浸出等作用均会造成果蔬营养物质的损失[6],目前未见有热烫处理对花椒芽的研究。
花椒芽是一种新兴的蔬菜品种,因其贮藏期较短,导致其在市场流通较少。因此本实验探究热水热烫处理对花椒芽色泽、营养物质、多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase, POD)活性、麻味物质以及挥发性成分的影响,寻找可以延长花椒芽贮藏期、最大限度保存其品质的简单处理方式。
1 材料与方法
1.1 材料与试剂
实验所用花椒芽为九叶青花椒嫩叶,于2021年4月采自重庆市江津区李市镇,采摘后装入编织袋中当天运至实验室。
丙酮、乙醇、偏磷酸、草酸、2,6-二氯靛酚、硫酸铜、硫酸钾、浓硫酸、盐酸、硼酸,成都市科隆化学品有限公司;甲基红指示剂、溴甲酚绿指示剂、亚甲基蓝指示剂、氢氧化钠、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVPP)、磷酸氢二钠·H2O、磷酸二氢钠·12H2O、邻苯二酚、H2O2、愈创木酚,重庆川东化工(集团)有限公司;甲醇(色谱纯),上海阿拉丁生化科技股份有限公司;羟基-α-山椒素、羟基-β-山椒素、羟基-ε-山椒素标准品,成都麦德生科技有限公司。
1.2 仪器与设备
SF-756P紫外可见分光光度计,上海光谱仪器有限公司;FA1004A电子分析天平,上海精天电子仪器有限公司;UltraScan Pro测色仪,美国 Hunter Lab;5810高速离心机,德国Eppendorf公司;UV-2450型可见光分光光度计、LC-10AT型分析型高效液相色谱仪(配有紫外可见光检测器),日本岛津公司;HC-C18型色谱柱、Agilent 7890B/5977b气相色谱-质谱仪,美国安捷伦公司;H-ZK8型数显恒温水浴锅,巩义市予华仪器有限责任公司。
1.3 实验方法
1.3.1 样品制备
新鲜花椒芽去梗、清洗,取60 g于80、85、90、95、100 ℃的热水中分别热烫30、60、120、180、240、300 s后(达到预定温度后计时),冷却沥水,测定色泽后装入聚乙烯包装袋中密封,置于(-18±0.5) ℃条件下保存备用,取样测定其各项指标。
1.3.2 PPO、POD活性测定
称取2.00 g花椒芽样品,加入8 mL磷酸缓冲液(PBS,pH 6.8,0.2 mol/L)和2 mL 4%(质量分数)的PVPP溶液,充分研磨后,于10 000 r/min下离心20 min,取上清液待测。分别取上清液100 μL于2个比色皿中(PBS作为空白对照),一份加入200 μL邻苯二酚(0.2 mol/L),另一份同时加入100 μL双氧水(体积分数为2%)和100 μL愈创木酚(0.25 mol/L),充分振荡,混匀后迅速放入分光光度计中,设定波长420 nm测定PPO活性,470 nm测定POD活性,测定反应体系3 min内的吸光度(OD)变化[7]。1个酶活性单位定义为1 min吸光值增加0.001所需要的酶量,表示为U/(g·min)。
1.3.3 色泽测定
将热烫处理后的花椒芽叶平放后,在叶片表面随机选取5个点测量,使用色差计测定不同热烫条件处理下花椒芽的亮度值(L*)、红度值(a*)和黄度值(b*),并且计算出总色差(ΔE)。
1.3.4 叶绿素含量测定
参考NY/T 3082—2017《水果、蔬菜及其制品中叶绿素含量的测定 分光光度法》方法并有所改动。将花椒芽用料理机打成菜泥,称取200 mg,加入50 mL 80%(体积分数)丙酮与95%(体积分数)乙醇的混合液(2∶1,体积比),避光放置24 h。抽滤得上清液,用1 cm比色皿,分别于663、645 nm下测定吸光度[8]。
1.3.5 维生素C含量测定
参考GB 5009.86—2016《食品安全国家标准 食品中维生素C的测定》中的2,6-二氯靛酚法并稍作修改,称取5.00 g花椒芽,放入研钵中加入2%(质量分数)草酸溶液10 mL,研磨匀浆后,转入100 mL容量瓶中,用2%草酸冲洗研钵并将洗液一并转入,用2%草酸定容。取滤液10 mL于三角瓶中,用已标定过的2,6-二氯靛酚溶液滴定至粉红色,并在30 s内不褪色为止。记录2,6-二氯靛酚的消耗体积。
1.3.6 蛋白质含量测定
参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法进行测定,称取3.00 g花椒芽于消化管中,依次加入3~4粒玻璃珠、0.2 g硫酸铜、3.0 g硫酸钾和20 mL浓硫酸,先用小火进行炭化,随后加强火力加热,直至管内液体呈现蓝绿色。使用自动凯氏定氮仪检测蒸馏吸收后,使用标准盐酸溶液进行滴定,终点为液体由蓝色变为无色。记录盐酸溶液的消耗体积。
1.3.7 麻味物质的测定
取10.00 g花椒芽打碎后置于100 mL锥形瓶中,加入50 mL甲醇,室温振荡4 h,将浸提液移入离心管中,在2 500 r/min的速度下离心10 min,将上清液置于100 mL容量瓶,甲醇定容,用0.22 μm有机系微孔滤膜过滤,即得供试品溶液,-20 ℃冰箱保存备用[9]。分别精密称取1 mg羟基-α-山椒素、羟基-β-山椒素和羟基-ε-山椒素标准品,用甲醇(色谱纯)溶解并定容至10 mL,配成质量浓度为100 μg/mL的标准品储备液。取一定量的标准品储备液加入甲醇溶液配制成一系列质量浓度的花椒麻味物质标准溶液,绘制标准曲线。高效液相色谱检测条件:安捷伦XDB-C18柱(250 mm×4.6 mm,5 μm);流动相:水-甲醇(体积比);进样量:10 μL;流速:1.0 mL/min;检测波长:270 nm;柱温:40 ℃。采用甲醇-水梯度洗脱,洗脱条件分为3个过程,0~25 min,60%甲醇、40%纯水;25~36 min,80%甲醇、20%纯水;36~40 min,60%甲醇、40%纯水[10]。
样品中花椒麻味物质的含量按公式(1)计算:
(1)
式中:X,待测样中麻味物质的含量,mg/g;C,根据标准曲线计算求出的花椒麻味物质的含量,μg/mL;m,样品的质量,g;V,待测液的定容体积,mL;k,样品提取液稀释倍数;1 000,单位换算系数。
1.3.8 香气成分的测定
称取2.00 g花椒芽于顶空瓶,立即密封顶空瓶。将样品瓶置于加热的磁力搅拌器中,在50 ℃的恒温水浴锅中平衡40 min,将老化的萃取头插入顶空瓶中萃取40 min后取出插入气相色谱进样口,解吸附3.5 min,同时启动仪器收集数据[11]。气相色谱检测条件:色谱柱122-5532为DB-5MS(30 m×0.25 mm×0.25 μm),进样口温度250 ℃;升温梯度:以5 ℃/min升至150 ℃,再以4 ℃/min升至250 ℃。载气He。检测器温度280 ℃。质谱检测条件:EI离子源,离子源温度230 ℃,电离电压70 eV,前进样口温度250 ℃,四极杆温度150 ℃,扫描范围35~450 m/z,电离方式:EI,检索谱库:NIST[5][12]。
1.4 数据分析与处理
数据均用Origin 2019、SPSS Statistics 25进行处理与分析,每次试验均3次平行,试验结果以“平均值±标准差”的形式标注,显著性分析以Duncan′ tests进行方差分析(ANOVA),P<0.05为显著差异。
2 结果与分析
2.1 热烫处理对花椒芽中PPO、POD活性的影响
PPO和POD是果蔬加工过程中引起褐变的主要酶类,且POD是最耐热的酶,需要长时间热烫才能完全失活(即过度热烫),这不仅会导致营养物质的大量流失,还增加能量成本。研究表明,最佳热烫以POD活性保留率在3%~10%为宜,保留的活性也不会造成水果和蔬菜的任何变质[13]。因此本文首先研究不同热烫条件花椒芽PPO和POD的活性,结合色泽、营养物质等的变化,确定花椒芽最佳的热烫条件。热烫对花椒芽PPO活性的影响如图1-a所示,PPO对热敏感,PPO活性随着热烫温度升高及时间延长逐渐降低,在80~100 ℃,PPO随时间的延长呈不同幅度的下降。90 ℃处理条件下,对PPO钝化效果较明显,在此温度下处理30~240 s后,PPO活性保留率分别为41.57%、23.54%、16.30%、5.41%、1.80%;处理300 s时,PPO活性降为0。热烫时间达到180 s,80~95 ℃内均能将PPO有效钝化,分别为12.58%、7.27%、5.41%、1.79%;100 ℃时PPO活性为0。
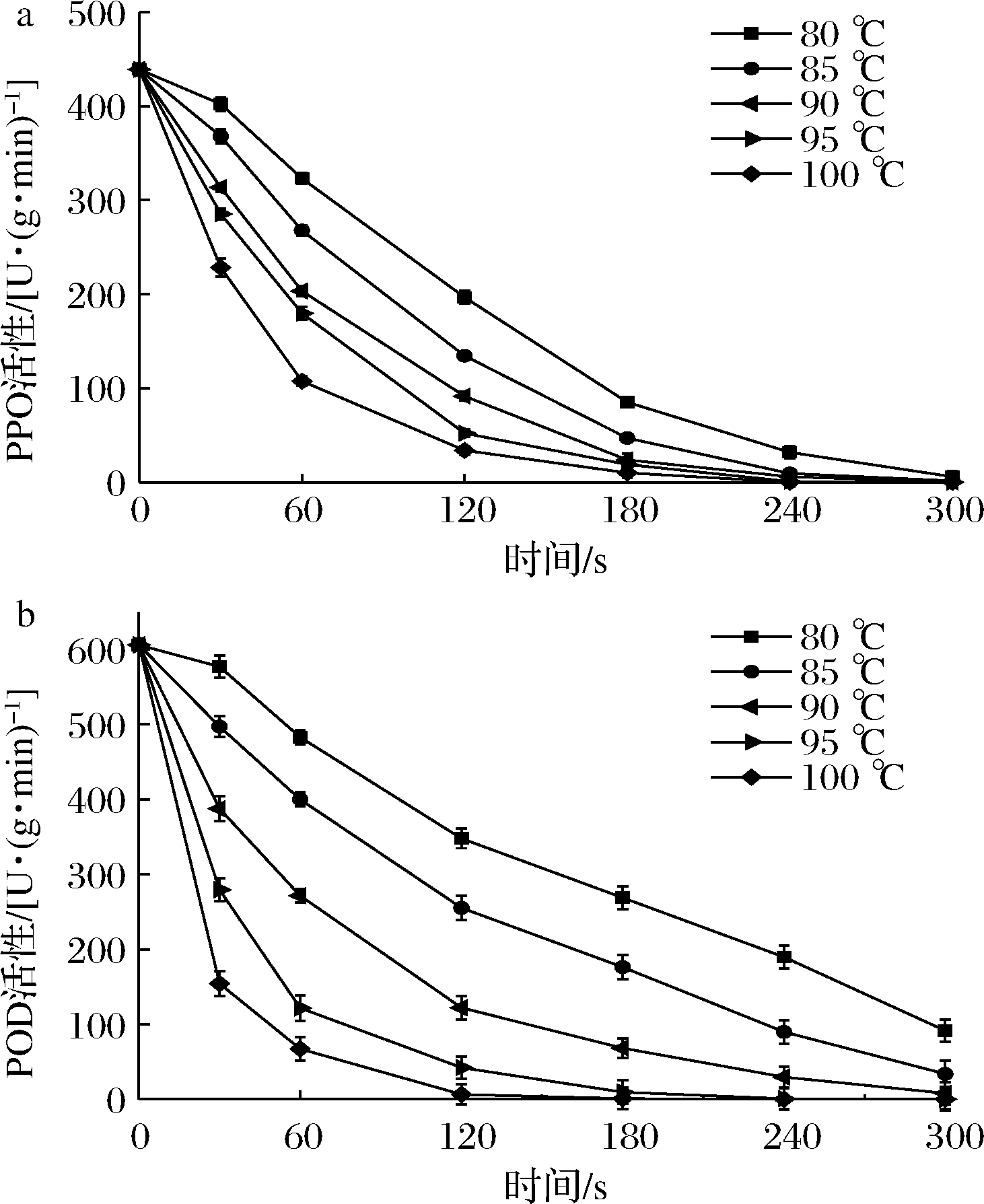
a-PPO活性;b-POD活性
图1 热烫处理对花椒芽酶活性的影响
Fig.1 Effects of blanching treatment on enzyme activity of Zanthoxylum bungeanum sprout
热烫对花椒芽POD活性的影响如图1-b所示,随着热烫温度的升高和时间的延长,POD活性显著降低;温度越高,时间越长,POD活性保留率越低;热烫温度为80~90 ℃时,POD活性随时间的延长近乎呈线性下降;90~100 ℃时,POD活性随时间的延长呈不同的下降幅度。热烫温度为90 ℃时,POD的钝化效果较显著,此温度下处理30~300 s 后POD活性保留率分别为63.97%、44.78%、20.14%、9.86%、4.87%、1.31%。热烫时间达到180 s,在80~100 ℃,POD活性保留率均降至较低水平,分别为44.36%、29.06%、9.86%、1.56%、0.15%。热烫条件在90 ℃处理180 s就能将PPO和POD活性降至较低水平。在相同的处理时间内,与其他热烫方式相比较,热水热烫可使PPO及POD活性在短时间内降至最低[14]。但热烫温度过高或时间过长,会破坏花椒芽内部组织结构,导致花椒芽变软以及营养成分和色素损失较多,品质劣变。热烫处理可使酶分子内部的氢键发生断裂,构象被破坏,从而影响酶活性、抑制酶促反应[15]。因此要选择合适的热烫温度和时间,即酶活性已降至原有酶活性10%以下的90 ℃与180 s,重点分析此温度和时间条件下花椒芽色泽、营养物质和风味物质的变化趋势。
2.2 热烫处理对花椒芽色泽的影响
色泽的变化是反映加工处理对蔬菜感官品质影响的重要指标。由图2-a可知,L*值随着热烫温度的升高与时间延长而逐渐降低,表明热烫温度越高,时间越长,花椒芽的色泽越暗。在90 ℃条件下处理30~300 s后,L*值分别降低了10.54%、12.31%、13.10%、13.98%、14.86%、15.64%。保持时间为180 s,温度为80~100 ℃,L*值分别降低了12.40%、13.16%、13.98%、14.57%、15.01%;由图2-b可知,a*值随温度的升高与热烫时间的延长逐渐升高,表明热烫温度越高,时间越长,花椒芽的绿值越低,色泽劣变更严重。保持热烫温度为90 ℃,处理30~300 s后,a*值分别增加了7.97%、14.09%、20.79%、21.64%、22.24%、22.84%。保持时间为180 s,温度为80~100 ℃,a*值分别增加了19.99%、20.70%、21.64%、22.52%、23.46%。热烫处理对b*值的影响如图2-c所示,随着热烫温度升高及时间的延长,b*值逐渐增加,花椒芽的颜色越黄。保持温度为90 ℃,30~300 s内,b*值分别增加了12.56%、11.10%、10.17%、12.41%、14.80%、17.37%。保持时间为180 s,温度在80~100 ℃内,b*值分别增加了1.29%、4.46%、12.41%、16.88%、19.69%。ΔE代表样品颜色的可接受度,数值越低,可接受度越高。由图2-d可知,随着热烫温度的增加和时间的延长,总色差ΔE值逐渐增加,花椒芽色泽的可接受度越低。保持温度为90 ℃,处理60~300 s 与30 s相比,ΔE值分别增加了2.45%、6.47%、16.01%、25.83%、36.07%。保持时间为180 s,温度为80~85 ℃时,ΔE值减少了4.56%、3.78%;温度为90~100 ℃时,ΔE值分别增加了16.01%、23.04%、25.80%。在研究不同的热处理方式对卷心菜营养价值、生物活性特征的一文中发现热水热烫亦使卷心菜的L*值下降,a*值和b*值有不同程度的增加[13];同样对大白菜热水热烫后,发现大白菜的亮度在热烫后逐渐减少,且热烫温度越高与未处理对照差异越显著[5]。综上,热烫处理使花椒芽的色泽变为暗绿色并且发黄,可接受程度下降。完好的叶绿体受热遭到破坏,色泽劣变。适宜的热烫条件可以促使叶绿素a和叶绿素b被释放出来,使花椒芽的b*值降低;但随着热烫温度的升高和时间的延长,细胞的完整性遭到破坏,大量酸性物质被释放出来,氧离子取代了叶绿素中的镁离子,形成了脱镁叶绿素,随着细胞生物膜结构的破坏也导致色素物质的大量溶出[16]。
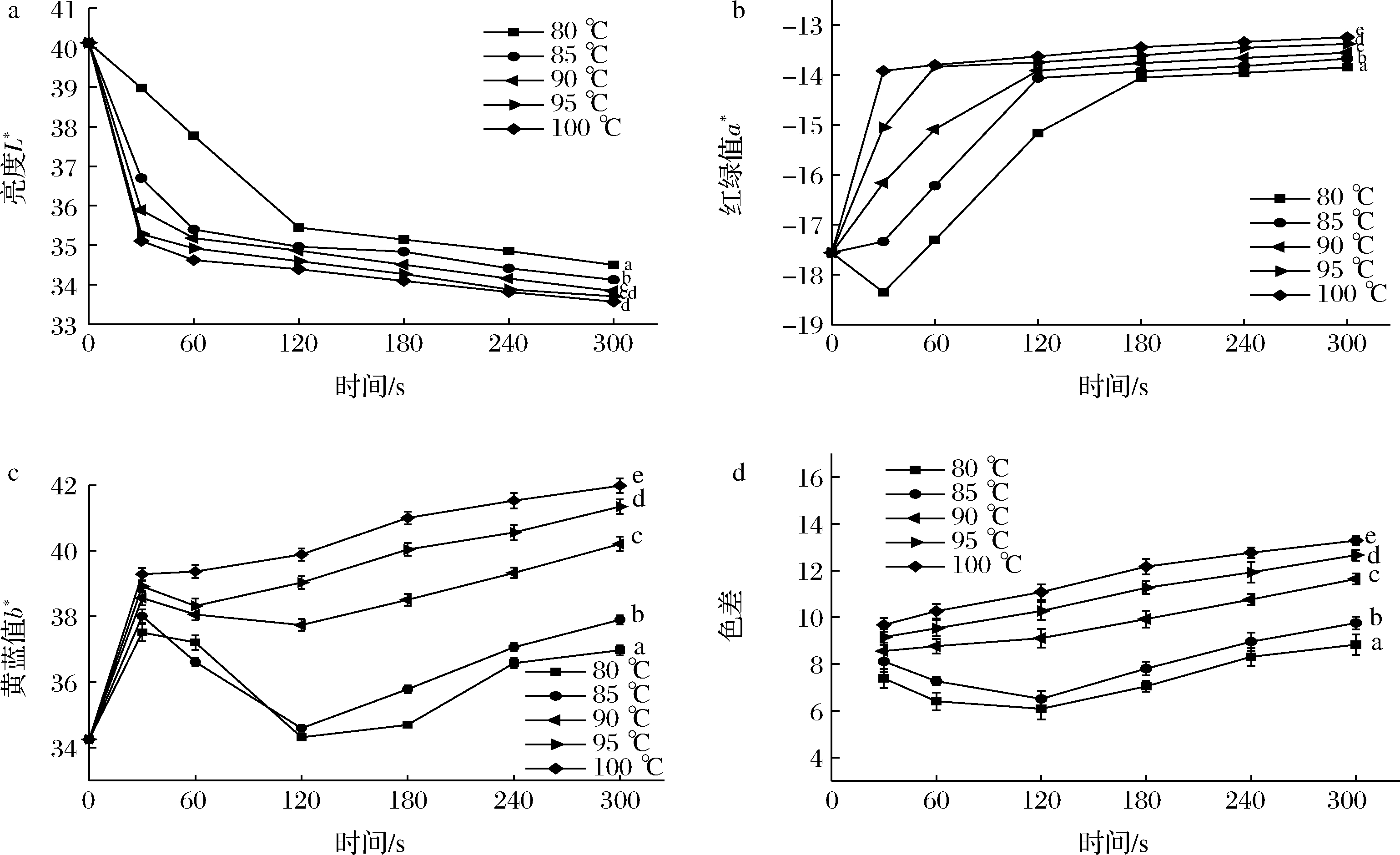
a-亮度L*;b-红绿值a*;c-黄蓝值b*;d-色差
图2 热烫处理对花椒芽色泽的影响
Fig.2 Effects of blanching treatment on color of Zanthoxylum bungeanum sprout
注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.3 热烫处理对花椒芽中叶绿素的影响
叶绿素含量是影响蔬菜色泽的重要因素,花椒芽的鲜绿色主要来自于叶绿素。由图3可见,叶绿素含量与热烫温度和时间呈负相关,温度越高、时间越长,叶绿素的含量越低。热烫温度为80~90 ℃,叶绿素含量的下降趋势较缓慢;90~100 ℃,叶绿素含量下降趋势较快速。在90 ℃条件下处理30~300 s后,叶绿素含量的损失率为22.91%、29.08%、32.67%、37.22%、39.30%、42.64%。叶绿素含量随着时间的延长逐渐减少,时间范围不同,下降幅度不同,热烫180 s后叶绿素含量的下降幅度较低。热烫时间为180 s,80~100 ℃条件下,叶绿素含量分别降低24.88%、33.26%、37.22%、44.64%、47.76%。花椒芽的色泽也因叶绿素溶出变化明显,绿值降低。热烫预处理对卷心菜品质的研究中发现,叶绿素对热很敏感,其保留率受温度和热处理持续时间的影响。通过热烫对卷心菜进行预处理,造成了叶绿素含量的损失,但同时提高了干蔬菜的质量和安全性,研究还表明干燥前热烫预处理还可以改善干卷心菜的营养保留[17]。在热烫对脱水西兰花副产物的影响一文中发现,西兰花的组织细胞因受热被严重破坏,叶绿素从蛋白质等质体中分离出来,部分叶绿素受热水解为叶绿酸、叶绿醇等物质。这些分解产物很快地扩散到水中,降低了蔬菜中绿色物质的浓度[18]。热烫对花椒芽色泽的研究中发现,不能选择过高的温度和时间,否则会严重影响花椒芽的色泽,降低其商品价值;若温度过低时间较短,由于酶未能完全失活,在后续加工过程中复活,亦会降低花椒芽的品质。因此90 ℃与180 s可作为花椒芽适宜的热烫条件。

图3 热烫处理对花椒芽叶绿素的影响
Fig.3 Effects of blanching treatment on chlorophyll of Zanthoxylum bungeanum sprout
2.4 热烫处理对花椒芽中维生素C的影响
花椒芽中富含维生素C,其含量是一般蔬菜的几倍甚至十几倍,该物质含量的多少用作评价热烫后花椒芽总体营养的指标[2]。热烫温度和时间对花椒芽的维生素C的影响如图4所示,维生素C的含量随着热烫温度的升高和时间的延长逐渐降低;温度为80~90 ℃时,维生素C含量的下降趋势较为平缓;在90~100 ℃时,维生素C含量下降幅度较快速。保持温度为90 ℃,30~300 s条件下,维生素C的含量减少25.74%、36.99%、44.38%、53.14%、61.68%、63.95%。随着热烫时间的延长,维生素C的含量也在逐渐降低,180 s后维生素C的下降幅度趋于平缓。热烫时间为180 s,80~100 ℃时维生素C含量的损失率为40.40%、42.01%、53.14%、60.54%、73.63%。花椰菜热水热烫处理后营养物质尤其是维生素C的含量损失率与微波热烫处理存在极显著的差异(P<0.01),热水热烫后维生素C的保留率最高仅为45.36%[19]。由于维生素C极不稳定,易被氧化或渗漏到水溶液中流失,其含量随着热烫时间的延长急剧减少,表明了热烫处理不利于蔬菜加工过程中维生素C的保留[20],因此在花椒芽热烫处理过程中为了减少维生素C的损失,不宜采用较高的温度和较长的时间。
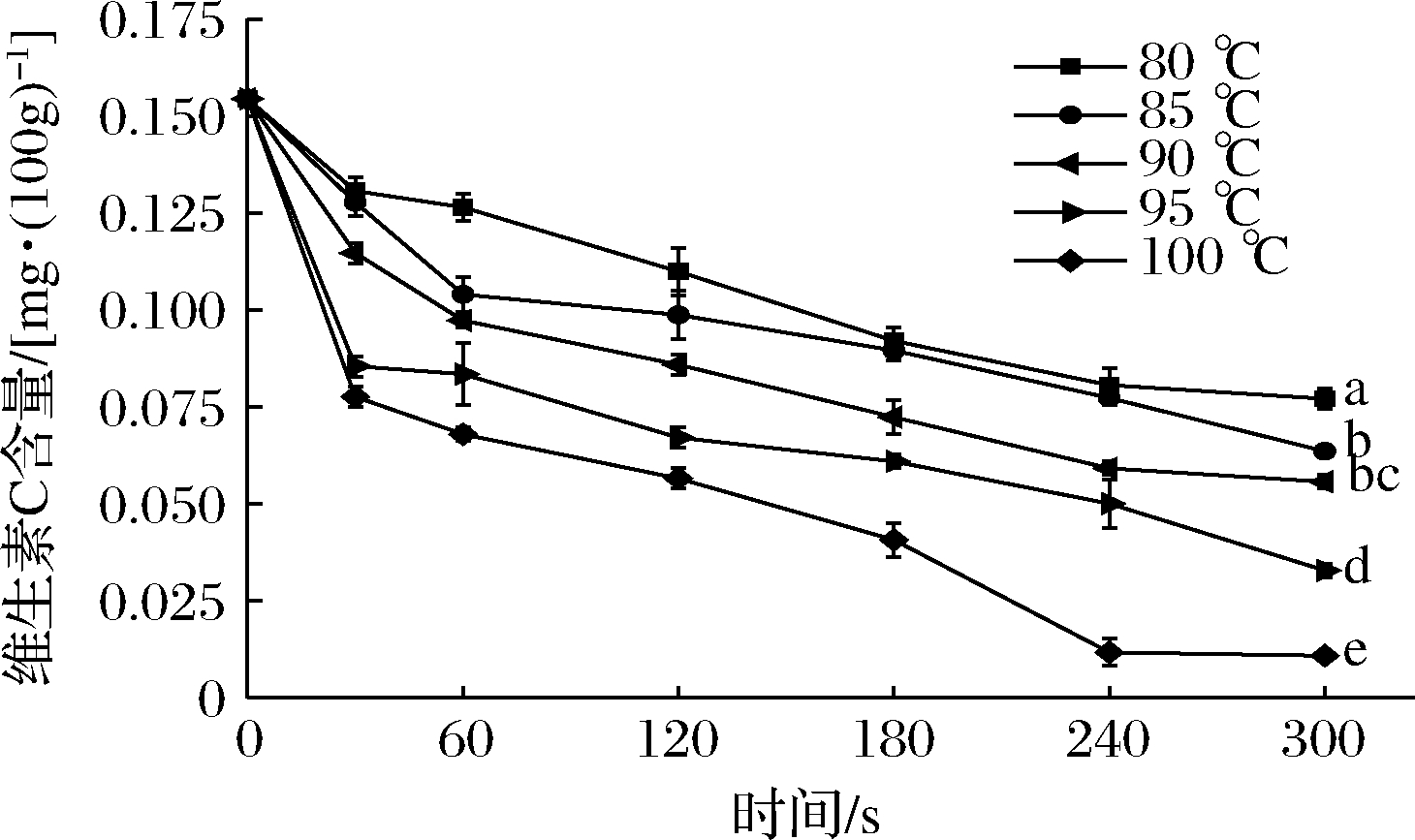
图4 热烫处理对花椒芽维生素C的影响
Fig.4 Effects of blanching treatment on vitamin C of Zanthoxylum bungeanum sprout
2.5 热烫处理对花椒芽中蛋白质含量的影响
花椒芽是一种富含蛋白质的蔬菜,蛋白质含量的高低是衡量花椒芽品质的另一重要指标。由图5可知,花椒芽可溶性蛋白质的含量随热烫温度的升高和时间的延长逐渐减少。热烫温度为80~90 ℃时,蛋白质含量的下降趋势比较平缓。在90~100 ℃时,蛋白质含量的下降幅度较高。保持温度为90 ℃,可溶性蛋白质含量的下降幅度较低,在30~300 s条件下,蛋白质含量的损失率分别为11.90%、14.89%、19.98%、24.12%、26.99%、29.22%。可溶性蛋白质的含量在不同热烫时间范围内下降的幅度不同,保持时间为180 s,在80~100 ℃条件下,蛋白质的损失率分别为16.05%、23.17%、24.12%、27.48%、29.54%。热水漂烫处理的洋蓟头损失了大量的蛋白质,可能是由于在热烫过程中浸出可溶性蛋白质和水溶性分解产物(如游离氨基酸和核苷酸),但与欧姆热处理损失的蛋白质相比,两者不存在显著性的差异(P>0.05)[21]。杏皮热烫处理后,蛋白质受热变性和渗出,从而导致杏皮中蛋白质含量降低,在热烫水溶液中检测到蛋白质和蛋白质的分解物[22]。热烫处理加快花椒芽蛋白质变性及溶出,同时由于热烫过程中的热分解、热浸出等作用也会造成蛋白质的损失。
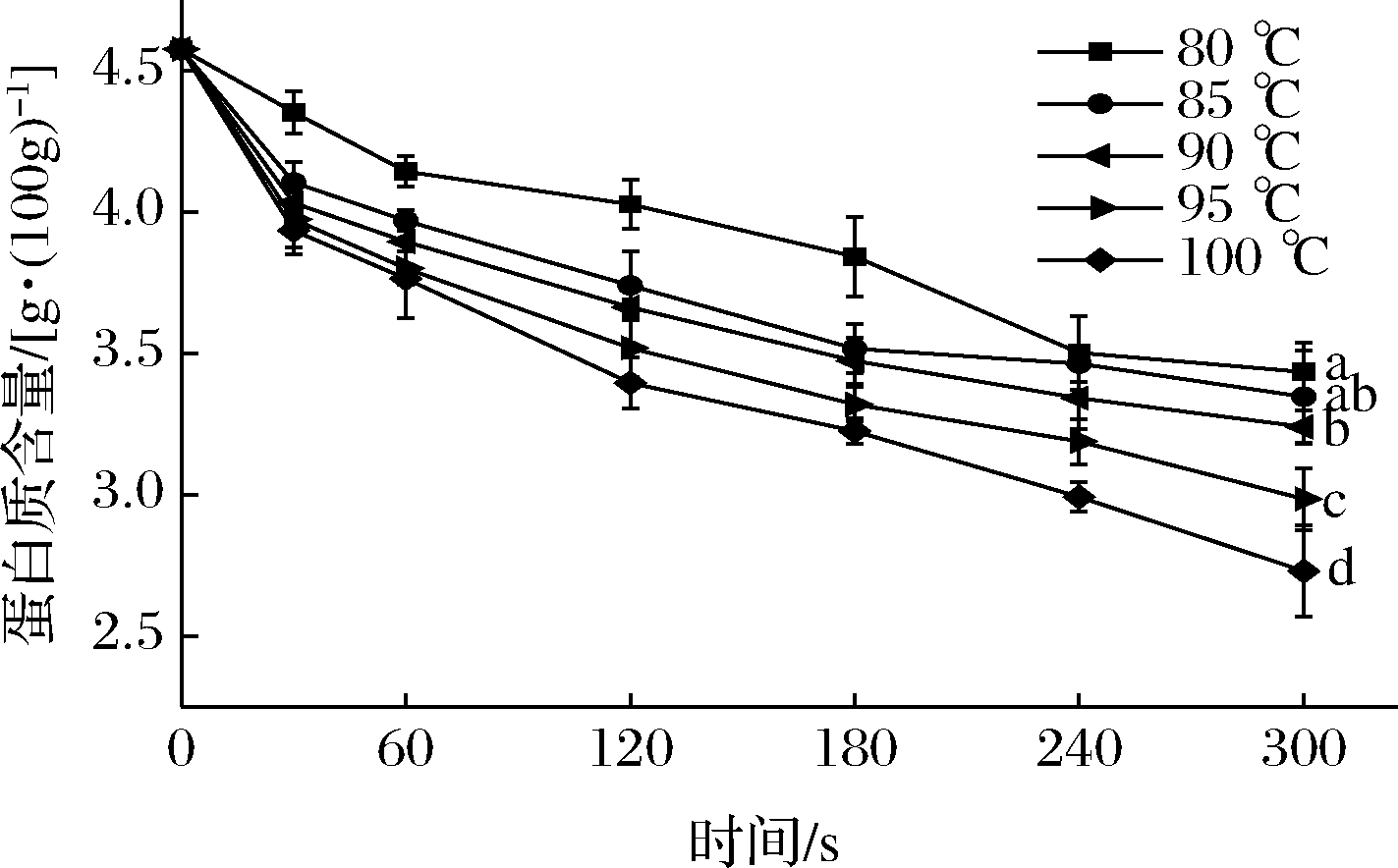
图5 热烫处理对花椒芽中蛋白质含量的影响
Fig.5 Effects of blanching treatment on protein of Zanthoxylum bungeanum sprout
2.6 热烫处理对花椒芽中麻味物质含量的影响
麻味是花椒特有的感官特征,在花椒的花、叶、茎和果皮中都能分离出麻味物质,因此麻味物质含量是判断热烫对花椒芽品质影响的主要指标。目前,从花椒中分离得到的25种麻味物质,为一类链状不饱和脂肪酰胺物质,其中山椒素是代表性的麻味物质[23]。在众多的花椒酰胺类物质中,羟基-ε-山椒素、羟基-α-山椒素和羟基-β-山椒素是花椒中最主要的麻味物质,也是花椒果皮和叶中含量最高的3种,因此这3种物质作为本实验研究花椒芽麻味物质在热烫过程中变化的对象[10]。
由图6-a可知,热烫过程中花椒芽的羟基-α-山椒素含量随热烫温度的升高和时间的延长呈现下降的趋势,热烫温度越高,时间越长,羟基-α-山椒素的含量越低。80~90 ℃羟基-α-山椒素含量的下降幅度较平缓,90~100 ℃下降幅度较高。保持温度为90 ℃,在30~300 s,羟基-α-山椒素含量的损失率分别为6.08%、12.80%、16.94%、20.83%、25.44%、26.56%。热烫时间为180 s,温度为80~100 ℃,羟基-α-山椒素的损失率分别为14.55%、16.10%、20.83%、29.84%、30.79%。由图6-b可知,在热烫温度为80~90 ℃时,羟基-ε-山椒素的含量随温度的升高逐渐增加,在90 ℃达到最高值。在90~100 ℃时,则随着温度的升高逐渐降低。90 ℃处理30~300 s,羟基-ε-山椒素的含量增加了11.89%、36.61%、45.72%、37.56%、28.92%、3.41%。羟基-ε-山椒素的含量随着热烫时间的延长呈现先增加后减少的趋势。保持时间为180 s、温度为80~90 ℃,羟基-ε-山椒素的含量分别增加了17.99%、32.49%、37.56%;温度为90~100 ℃时,羟基-ε-山椒素的含量减少了48.49%、69.73%。
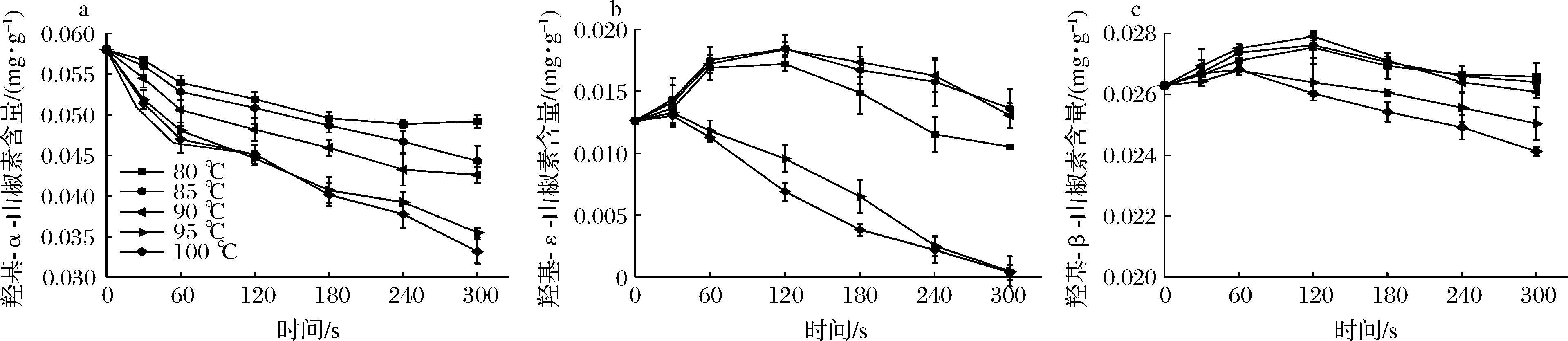
a-羟基-α-山椒素;b-羟基-ε-山椒素;c-羟基-β-山椒素
图6 热烫处理对花椒芽麻味物质的影响
Fig.6 Effects of blanching treatment on numb-taste substances of Zanthoxylum bungeanum sprout
由图6-c可知,热烫处理时羟基-β-山椒素含量的变化趋势与羟基-ε-山椒素相似,在90 ℃达到最高值。90 ℃处理30~240 s时,羟基-β-山椒素分别增加了2.47%、4.64%、6.12%、3.12%、0.42%;时间为300 s羟基-β-山椒素的含量减少了0.80%。热烫时间为180 s,温度为80~90 ℃,羟基-β-山椒素的含量分别增加了2.47%、2.93%、3.11%;温度为90~100 ℃,羟基-β-山椒素的含量减少了0.90%和3.31%。花椒麻素的含量随着成熟度的增加呈现先增加后减少的趋势,成熟度为中期时含量达到最高[24]。以不饱和脂肪酸酰胺类物质为主的麻味物质极不稳定,易被氧化、分解,热烫处理可以抑制酶的活性,减少麻味物质被氧化分解,适当的温度会促进麻味成分的溶出,而温度过高则会加剧麻味物质的分解[25]。在研究不同时期花椒中麻味素含量变化时发现干花椒果皮中羟基-α-山椒素的含量要低于新鲜绿色花椒中羟基-α-山椒素的含量,而所有反式同分异构体,尤其是羟基-β-山椒素的含量却是增加的。由此得出在加热的过程中化合物的双键从顺式转化为反式构型的结论,羟基-β-山椒素有可能是由羟基-α-山椒素转化而来[26]。
2.7 热烫处理对花椒芽挥发性物质的影响
花椒芽中的挥发性物质可以分为酯类、烯烃类、酮类、醇类、醛类5种,酯类物质有令人愉快的花香和果香,烯烃类物质普遍较易挥发,具有强烈的木青气息和药草香气,在酮类物质中2-十一烷酮具有酮香、脂肪香,醇类化合物多呈现出清新的花草香气,醛类化合物一般会产生清香的风味,主要有油脂味、坚果味和青草味[27]。由表1可知,烯烃类和酮类是花椒芽中占比最高的两类挥发性物质,占总挥发物质相对含量的91.06%~97.87%。酯类物质的含量随着热烫温度的升高和时间的延长先增加后逐渐减少,有效钝化酶的热烫条件下即90 ℃处理180 s,酯类物质的相对含量为2.16%,此时花椒芽的花果香较为突出。烯烃类物质的相对含量随着温度的升高呈现先减少后增加的趋势,随时间的变化呈现无规则的变化;热烫条件为90 ℃处理180 s时,烯烃物质的相对含量为47.17%,与未热烫对照组的相对含量较接近,此条件下花椒芽的辛辣香与对照组也较相似。
表1 热烫处理对花椒芽挥发性物质的影响
Table 1 Effects of blanching treatment on volatile substance of Zanthoxylum bungeanum sprout

处理条件挥发性物质相对含量/%温度/℃时间/s酯类烯烃类酮类醇类醛类对照0.16±0.0449.54±7.7248.33±0.861.68±0.210.29±0.05300.21±0.0949.31±2.0547.5±1.511.51±0.530.15±2.62601.06±0.1548.89±4.1746.45±3.041.47±0.240.64±0.18801202.58±0.1748.45±6.345.84±1.571.26±0.280.8±0.361801.3±0.3547.94±5.1543.12±2.161.17±0.051.19±0.142400.72±0.1347.41±6.0448.42±8.811.21±0.041.28±0.673000.31±0.0847.26±5.0848.75±4.071.29±0.151.51±0.1300.32±0.0339.69±2.5457.94±1.131.69±0.050.21±0.14601.14±0.2439.67±2.0457.24±2.421.58±0.040.32±0.08851202.96±0.1236.92±1.0956.25±3.071.48±0.080.45±0.231801.69±0.634.26±0.6260.74±0.711.44±0.850.66±0.092400.96±0.3932.9±1.3462.96±1.561.35±0.410.98±0.043000.51±0.1231.38±0.9464.1±2.631.25±0.171.14±0.59300.48±0.1144.32±1.1352.17±2.261.81±0.280.27±0.12601.47±0.0844.89±2.0950.27±4.521.75±0.120.41±0.04901203.05±0.149.28±0.6444.73±3.751.67±0.420.65±0.051802.16±0.0747.17±3.0447.58±7.311.47±0.091.19±0.052401.04±0.2745.78±0.1150.23±3.541.38±0.331.51±0.083000.59±0.0646.43±0.0550.66±3.421.29±0.281.08±0.15300.31±0.1144.55±8.7150.4±1.542.43±0.230.74±0.06600.98±0.1747.06±6.147.24±3.222.01±0.181.05±0.79951202.34±0.2944.59±5.3647.85±3.191.88±0.140.44±0.191802.05±0.0543.34±3.1852.48±1.031.65±0.060.19±0.082400.66±0.1548.23±5.0849.19±2.641.49±0.110.17±0.043000.34±0.1243.57±2.0954.3±3.231.31±0.060.17±0.13300.14±0.0641.44±1.5653.36±3.641.44±0.141.54±0.15600.43±0.1443.28±0.9649.89±2.471.23±0.782.45±0.741001200.99±0.1844.72±4.4547.18±2.182.18±0.043.26±0.041800.81±0.0745.51±4.2148.41±7.141.96±0.22.98±0.012400.1±0.1837.48±0.5957.61±3.930.88±0.322.67±0.043000.1±0.0734.79±6.4860.3±4.090.84±0.652.14±1.18
酮类物质的相对含量随着温度的升高先增加后逐渐减少,随时间的变化无规律可循。酮类物质含量增加,花椒芽会呈现更浓烈的油脂味,感官品质降低。热烫条件为90 ℃、180 s时,酮类物质的相对含量为47.58%,处于较低的水平。醇类物质的相对含量随着温度的升高先逐渐增加后减少,随着热烫时间的延长呈现逐渐减少的趋势。热烫处理为90 ℃、180 s条件下,醇类物质的相对含量为1.47%,此时花椒芽的花草香气与未处理组较接近。醛类物质的含量随着热烫温度的升高逐渐增加,随着热烫时间的延长则呈现无规律的变化。在90 ℃处理180 s醛类物质的相对含量为1.19%,此时花椒芽的青草香气较突出。此外检测到少量胺类物质,是由于在热烫过程中蛋白质变性产生一些胺类、醛类等有不良气味的风味物质[28]。实验结果表明,不同条件的热烫处理对花椒芽香味成分的保留有较大的影响,挥发性物质的相对含量在热烫过程中会发生变化,这些变化很大程度上影响花椒芽的香气特征,温度过高以及时间太长都会使酮类和醛类物质相对含量过高导致花椒芽产生油脂异味[11]。在对花椒不同贮藏条件下香气成分的研究中发现,经过热处理后的花椒的香味物质成分和相对含量最少,但在贮藏过程中香味物质保存最好。射频辅助热风干燥后的花椒中不同品种挥发性化合物的变化是不同的,相对含量的变化没有明显的规律[7]。
3 结论
本文研究了热烫温度和时间对花椒芽色泽、营养物质和特征品质的影响。研究结果表明,热烫处理后的花椒芽颜色偏暗、偏红和偏黄,营养物质含量降低。热烫条件既要能抑制花椒芽中PPO和POD的活性,同时对花椒芽的营养物质如维生素C和蛋白质含量的影响较小。综上所述,90 ℃处理180 s的热烫条件是内源酶不发生酶促反应、保持花椒芽品质有效的方法。此热烫条件下,羟基-ε-山椒素和羟基-β-山椒素的含量增加,挥发性物质主成分的相对含量与未处理组接近。此研究可以为今后制作花椒芽辣酱、花椒芽调味品、花椒芽干制品等深加工提供热烫参考条件。
[1] 王秀玲, 张解放, 郭建信.韩城市花椒芽菜产业发展现状及趋势[J].陕西林业科技, 2015(3):72-74.
WANG X L, ZHANG J F, GUO J X.Current situation and development of sprout of Zanthoxylum bungeanum as sort of vegetable in Hancheng[J].Shaanxi Forest Science and Technology, 2015(3):72-74.
[2] 王卫平, 郭少锋, 卫晓东, 等.韩城市芽菜花椒提质增效技术[J].陕西林业科技, 2021,49(1):120-122.
WANG W P, GUO S F, WEI X D, et al.Technologies for quality and profit improvement of pepper sprouts[J].Shaanxi Forest Science and Technology, 2021,49(1):120-122.
[3] FAN L H, ZHANG C L, ZHAO R, et al.Rapid and nondestructive determination of origin, volatile oil, sanshoamides and crack rate in the ‘Sichuan Pepper’ based on a novel portable near infrared spectrometer[J].Journal of Food Composition and Analysis, 2021,101:103942.
[4] 安可婧,魏来,唐道邦,等.果蔬干燥前处理技术的应用及研究进展[J].现代食品科技,2019,35(6):314-321.
AN K J, WEI L, TANG D B, et al.Application and research progress of pretreatment technology for drying of fruits and vegetables[J].Modern Food Science and Technology, 2019,35(6):314-321.
[5] MANAGA M G, REMIZE F, GARCIA C, et al.Effect of moist cooking blanching on colour, phenolic metabolites and glucosinolate content in Chinese cabbage (Brassica rapa L.subsp.chinensis)[J].Foods(Basel,Switzerland), 2019,8(9):399.
[6] XIAO H W, PAN Z L, DENG L Z, et al.Recent developments and trends in thermal blanching—A comprehensive review[J].Information Processing in Agriculture, 2017,4(2):101-127.
[7] ZHANG Z N, YAO Y S, SHI Q L, et al.Effects of radio-frequency-assisted blanching on the polyphenol oxidase, microstructure, physical characteristics, and starch content of potato[J].LWT, 2020,125:109357.
[8] PHAN A D T, ADIAMO O, AKTER S, et al.Effects of drying methods and maltodextrin on vitamin C and quality of Terminalia ferdinandiana fruit powder, an emerging Australian functional food ingredient[J].Journal of the Science of Food and Agriculture, 2021,101(12):5 132-5 141.
[9] KE J, QU Y, LI S, et al. Application of HPLC fingerprint based on acid amide components in Chinese prickly ash (Zanthoxylum)[J]. Industrial Crops and Products, 2018,119:267-276.
[10] ZHUO Z, XU D, LI Y, et al. Fingerprint analysis of Zanthoxylum armatum DC. by HPLC[J]. Journal of Food Composition and Analysis, 2021,96:103736.
[11] HWANG Y S, YANG J S, LEE H W, et al.Optimization and comparison of headspace hot injection and trapping, headspace solid-phase microextraction, and static headspace sampling techniques with gas chromatography-mass spectrometry for the analysis of volatile compounds in kimchi[J].LWT, 2020,134:110155.
[12] LIU Y J, QIAN Y Y, SHU B, et al.Effects of four drying methods on Ganoderma lucidum volatile organic compounds analyzed via headspace solid-phase microextraction and comprehensive two-dimensional chromatography-time-of-flight mass spectrometry[J].Microchemical Journal, 2021,166:106258.
[13] TAO Y, HAN M F, GAO X G, et al.Applications of water blanching, surface contacting ultrasound-assisted air drying, and their combination for dehydration of white cabbage:Drying mechanism, bioactive profile, color and rehydration property[J].Ultrasonics Sonochemistry, 2019,53:192-201.
[14] WANG C, ZHANG B B, SONG L P, et al.Assessment of different blanching strategies on quality characteristics and bioactive constituents of Toona sinensis[J].LWT, 2020,130:109549.
[15] JIANG H Y, LING B, ZHOU X, et al.Effects of combined radio frequency with hot water blanching on enzyme inactivation, color and texture of sweet potato[J].Innovative Food Science &Emerging Technologies, 2020,66:102513.
[16] FERREIRA S S, MONTEIRO F, PASSOS C P, et al.Blanching impact on pigments, glucosinolates, and phenolics of dehydrated broccoli by-products[J].Food Research International, 2020,132:109055.
[17] SINGH S, KHEMARIYA P, ALAM T, et al.Combined effect of pretreatments and packaging materials on quality retention in dried cabbage (Brassica oleraceae var.capitata L.)[J].Journal of Packaging Technology and Research, 2019,3(3):205-214.
[18] FERREIRA S S, MONTEIRO F, PASSOS C P, et al.Blanching impact on pigments, glucosinolates, and phenolics of dehydrated broccoli by-products[J].Food Research International, 2020,132:109055.
[19] PATRICIA C M, BIBIANA D Y, JOSÉ P M.Evaluation of microwave technology in blanching of broccoli (Brassica oleracea L.var Botrytis) as a substitute for conventional blanching[J].Procedia Food Science, 2011,1:426-432.
[20] SONG X Q, YU X J, ZHOU C S, et al.Conveyor belt catalytic infrared as a novel apparatus for blanching processing applied to sweet potatoes in the industrial scale[J].LWT, 2021,149:111827.
[21] GUIDA V, FERRARI G, PATARO G, et al.The effects of ohmic and conventional blanching on the nutritional, bioactive compounds and quality parameters of artichoke heads[J].LWT - Food Science and Technology, 2013,53(2):569-579.
[22] ZHANG H S, GUO P H, ZHANG Q G, et al.Effects of saturated hot air pretreatment compared to traditional blanching on the physicochemical properties of Apricot (Prunus armeniaca L.) kernels and its skin during removing skin[J].LWT, 2021,150:111947.
[23] 杨兵, 梅小飞, 阚建全.热泵干制对青花椒色差和品质的影响及工艺优化[J].食品与发酵工业, 2019,45(12):140-145;151.
YANG B, MEI X F, KAN J Q, et al.Effects of heat pump drying on chromatism and quality of Zanthoxylum L.and process optimization[J].Food and Fermentation Industries, 2019,45(12):140-145;151.
[24] 李佩洪, 陈政, 曾攀, 等.不同成熟度青花椒的品质[J].贵州农业科学,2021,49(5):82-87.
LI P H, CHEN Z, ZENG P, et al.Quality of Zanthoxylum armatum with different maturity[J].Guizhou Agricultural Sciences, 2021,49(5):82-87.
[25] CHEN K X, XUE L L, LI Q Y, et al.Quantitative structure-pungency landscape of sanshool dietary components from Zanthoxylum species[J].Food Chemistry, 2021,363:130286.
[26] WU Z C, WANG W, SUN L W, et al.Accumulation and biosynthesis of hydroxyl-α-sanshool in varieties of Zanthoxylum bungeanum Maxim.by HPLC-fingerprint and transcriptome analyses[J].Industrial Crops and Products, 2020,145:111998.
[27] LIU Y F, ZHANG Y L, WEI X Y, et al.Effect of radio frequency-assisted hot-air drying on drying kinetics and quality of Sichuan pepper (Zanthoxylum bungeanum maxim.)[J].LWT, 2021,147:111572.
[28] SHI Y, CHEN G J, CHEN K W, et al.Assessment of fresh star anise (Illicium verum Hook.f.) drying methods for influencing drying characteristics, color, flavor, volatile oil and shikimic acid[J].Food Chemistry, 2021,342:128359.