肉类在生产、加工和贮藏过程中,由于受到许多结构破坏和氧化促进剂的影响,蛋白质不可避免地暴露在含有氧化应激的环境中,导致肉蛋白质的结构发生改变从而影响肉品的加工性能、风味品质以及营养价值,最终影响制品品质[1]。其中肉蛋白的过度氧化是造成其品质下降的重要原因,不仅影响肉制品感官品质,而且会破坏乳化和凝胶等加工性能。已有研究发现,蛋白适度氧化会导致肌肉蛋白发生去折叠并进一步提高其凝胶性能,而过度氧化会导致共价交联介导的不可逆和不恰当聚集,从而降低蛋白质的凝胶性能[2]。
近年来,蛋白氧化的研究越来越受到学者的关注,以植物多酚作为天然抗氧化剂代表,研究其诱导调控肌肉蛋白氧化及对功能特性的影响已成为肉品科学技术领域的研究热点。植物多酚具有优良的抗菌、抗炎和抗氧化等生理功效,广泛存在于中草药、香辛料、水果蔬菜、果皮果渣等农产品加工副产物中[3],因而备受关注。现有研究表明,在肉制品加工与贮藏过程中,植物多酚具有抑制脂肪氧化、调控肉蛋白氧化程度进而影响蛋白功能特性的作用[4]。
阿魏酸(ferulic acid,FA)是植物多酚中酚酸的一种,是阿魏、当归、川芎、升麻等中药材的有效成分,在医药、化妆品、保健品、食品中有着广泛的应用[5]。FA具有较强的抗氧化能力,对羟自由基(·OH)和超氧阴离子自由基![]() 等都有一定的清除能力[6],因副作用小、价格低且容易获得,阿魏酸在食品营养及医药方面的重要性逐渐凸显出来,其生物学作用成为近年来的研究热点之一,其中最受关注的是抗氧化作用。目前未见有阿魏酸诱导调控肉蛋白氧化及其对乳化特性的影响和相关作用机制研究报道,本文研究了不同浓度阿魏酸对猪肉肌原纤维蛋白贮藏过程中蛋白氧化及乳化特性的影响,研究可为有效调控蛋白氧化程度以及富含酚类的天然植提物在肉制品绿色加工中的科学应用提供理论依据和实际参考。
等都有一定的清除能力[6],因副作用小、价格低且容易获得,阿魏酸在食品营养及医药方面的重要性逐渐凸显出来,其生物学作用成为近年来的研究热点之一,其中最受关注的是抗氧化作用。目前未见有阿魏酸诱导调控肉蛋白氧化及其对乳化特性的影响和相关作用机制研究报道,本文研究了不同浓度阿魏酸对猪肉肌原纤维蛋白贮藏过程中蛋白氧化及乳化特性的影响,研究可为有效调控蛋白氧化程度以及富含酚类的天然植提物在肉制品绿色加工中的科学应用提供理论依据和实际参考。
1 材料与方法
1.1 材料与试剂
实验所用猪肉为里脊肉,购于重庆市南岸区五公里人人乐超市。
FA(99%),上海麦克林生化科技有限责任公司;结晶牛血清蛋白(bovine serum albumin,BSA)为生化试剂,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
Ultra-Turrax T25 BASIC高速匀浆器,德国Ika-Werke公司;MM12B自动绞肉机,广东省韶关市大金食品机械厂;F-7000荧光分光光度计,日本日立仪器有限公司;IRPrestige-21傅里叶红外光谱,日本岛津公司;TGL-16M高速冷冻离心机、TD24-WS低速台式离心机,湘仪离心机(长沙)仪器有限公司;UV-1900紫外可见分光光度计,翱艺仪器(上海)有限公司;HH-S11-1-S电热恒温水浴锅,江星仪器(上海)有限公司;Shimadzu AUY120电子天平,日本岛津公司;BCD-215KHN冰箱,青岛海尔股份有限公司。
1.3 实验方法
1.3.1 肌原纤维蛋白的提取
肉肌原纤维蛋白(myofibrillary proteins, MPs)的提取参考PARK等[7]的方法,用双缩脲法测定MPs蛋白浓度,所提取的MPs于48 h内使用完。
1.3.2 样品制备
将提取的MPs随机分为5组,每组用15 mmol/L PIPES缓冲液(含0.6 mol/L NaCl,pH 6.25)将MPs蛋白膏稀释为40 mg/mL。第1组为空白对照组(不添加任何抗氧化剂),第2组添加0.04 g/kg阿魏酸,第3组添加0.20 g/kg阿魏酸,第4组添加1.00 g/kg阿魏酸,第5组添加1.00 g/kg丁基羟基茴香醚(butyl hydroxy anisd,BHA)作为阳性对照。混匀后,置于4 ℃冰箱冷藏,分别在第2、4、6、8、10天测定每组相应指标。
1.3.3 氨基酸侧链修饰
1.3.3.1 羰基含量测定
采用二硝基苯肼法进行测定,参照ORTU O等[8]的研究方法,并作部分修改,测定方法如下:取4 mL MPs溶液(质量浓度5 mg/mL)于离心管中,加入5 mL 10 mmol/L 二硝基苯肼。设立空白对照组(加入HCl溶液),振荡混匀,37 ℃避光反应1 h,然后添加2 mL 20%(体积分数)三氯乙酸溶液充分振荡以沉淀蛋白并终止反应,于4 ℃、4 500 r/min条件下离心10 min,离心后的黄色沉淀用乙醇和乙酸乙脂混合物(1∶1,体积比)洗涤2次。最后一次洗涤后挥干有机溶剂,加入5 mL 盐酸胍溶液(6 mol/L),在37 ℃的水浴锅中温育10 min。之后于25 ℃、4 500 r/min离心15 min,在波长370 nm测定上清液吸光度,按照公式(1)计算羰基含量:
O等[8]的研究方法,并作部分修改,测定方法如下:取4 mL MPs溶液(质量浓度5 mg/mL)于离心管中,加入5 mL 10 mmol/L 二硝基苯肼。设立空白对照组(加入HCl溶液),振荡混匀,37 ℃避光反应1 h,然后添加2 mL 20%(体积分数)三氯乙酸溶液充分振荡以沉淀蛋白并终止反应,于4 ℃、4 500 r/min条件下离心10 min,离心后的黄色沉淀用乙醇和乙酸乙脂混合物(1∶1,体积比)洗涤2次。最后一次洗涤后挥干有机溶剂,加入5 mL 盐酸胍溶液(6 mol/L),在37 ℃的水浴锅中温育10 min。之后于25 ℃、4 500 r/min离心15 min,在波长370 nm测定上清液吸光度,按照公式(1)计算羰基含量:
羰基含量/(nmol·mg-1蛋白质![]()
(1)
式中:A370,370 nm处样品的吸光度;A0,370 nm处对照组的吸光度;d,比色光径=1 cm;C,样品的蛋白质量浓度,mg/mL;V反总,反应体系的总体积;V样,样品加入的体积。
1.3.3.2 总巯基含量测定
参照熊杰等[9]的测定方法,并作相应的调整,使用5,5′-二硫双(2-硝基苯甲酸)试剂进行测定。取各样品溶液4 mL(MPs浓度5 mg/mL)置于离心管中,加入8 mL Tris-甘氨酸溶液,匀浆后冷冻离心20 min(4 ℃,4 000 r/min),取上清液4.5 mL加入0.5 mL的Ellman′s试剂混匀,室温25 ℃避光静置20 min,然后于412 nm波长处测定吸光度。稀释倍数n=10。按照公式(2)计算总巯基含量:
巯基含量![]()
(2)
式中:A412,样品组在波长为412 nm处的吸光值;c,分子吸光系数,其值为13 600 mol/(L·cm);M,MPs质量浓度,mg/mL,此处为1 mg/mL;n,稀释倍数,此处为1.1。
1.3.3.3 自由氨基含量测定
参照褚千千等[10]的方法,自由氨基的含量利用TNBS试剂测定。MPs液用PIPES缓冲液(15 mmol/L)稀释至4 mg/mL,加入2 mL 1%(质量分数)十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液与200 μL的蛋白样液混合均匀,再加入1 mL 0.01%三硝基苯磺酸,之后在55 ℃水浴中避光反应25 min,加入2 mL 0.1 mol/L Na2SO3使反应停止,室温下冷却15 min后测定样品在420 nm处的吸光值。以L-亮氨酸浓度为横坐标,吸光值为纵坐标,绘制L-亮氨酸在相同条件下的标准曲线,带入样品吸光值即可确定自由氨基含量。
1.3.4 肌原纤维蛋白结构分析
1.3.4.1 二级结构测定
参考ZHANG等[11]的方法,利用傅里叶变换红外光谱(Fourier transform infrared spectrometer, FTIR)扫描分析蛋白的二级结构。MPs经氧化处理和冷冻干燥后,与KBr压制成薄片,红外光谱仪扫描范围为400~4 000 cm-1,分辨率4 cm-1,扫描次数32,使用PeakFit 4.12软件提取蛋白质酰胺Ι带1 700~1 600 cm-1波段图谱,对检测得到的数据进行傅里叶去卷积处理,分析蛋白质α-螺旋、β-折叠、β-转角和无规卷曲等二级结构的变化。
1.3.4.2 内源性色氨酸荧光分析
参考CAO等[12]的测定方法,利用荧光光度仪测定内源性色氨酸荧光强度。MPs样品用PIPES液稀释,使蛋白含量为0.1 mg/mL,取0.2 mL于石英比色皿中在波长283 nm处激发,取波长为300~400 nm的光谱,电压为700 V,扫描速度为240 nm/min。
1.3.4.3 表面疏水性测定
参考CHELH等[13]方法并略作修改,利用溴酚蓝法测定。取3 mg MPs(5 mg/mL)溶解于20 mmol/L磷酸缓冲溶液(pH=6.0)中。吸取1 mL MPs溶液加入200 μL溴酚蓝(1 mg/mL),25 ℃条件下搅拌混匀10 min,于4 000 r/ min离心20 min,用蒸馏水将上清液稀释10倍,于595 nm处测定吸光度;设立空白对照组。表面疏水性可按照公式(3)计算:
溴酚蓝结合量![]()
(3)
式中:A对照和A样品分别表示不含蛋白的对照组和样品的吸光度。
1.3.5 肌原纤维蛋白乳化活性(emulsifying activity index, EAI)和乳化稳定性(emulsification stability index, ESI)的测定
参考邵俊花等[14]的方法并稍作调整,采用浊度法进行测定。用磷酸盐缓冲液将含有不同阿魏酸浓度的MPs稀释至1 mg/mL。取5 mL的大豆油,再加入配制好的蛋白溶液20 mL,室温高速均质1 min,立即从乳液底部5 mm处取100 μL新制备的乳状液放入离心管中,另加入5 mL 0.1% SDS溶液,并充分摇匀。于室温下静置 0 min和10 min后,于波长500 nm处测定吸光值,并记录为A0和A10。用0.1% SDS溶液作为空白对照。EAI和ESI分别按照公式(4)、公式(5)计算:
(4)
式中:C为乳化前的蛋白浓度;φ为乳化液中油的体积分数;A500代表500 nm处的吸光度值。
(5)
式中:A10和A0分别表示静置10 min和0 min后,在500 nm处的吸光度值。
1.4 数据分析处理
所用每组样品设置3个平行组,试验测试重复3次,用平均值±标准偏差(X±SD)来表示结果;差异显著(P<0.05)和极显著(P<0.01)分析采用SPSS 19.0进行ANOVA分析所得。采用OMNIC和Peakfit分析红外光谱。
2 结果与分析
2.1 氨基酸侧链修饰
2.1.1 不同浓度阿魏酸对冷藏肌原纤维蛋白羰基含量的影响
羰基是反映蛋白质变性的重要标志性物质,其形成是由于氧化过程中蛋白肽键发生断裂,以及一些带有NH2或NH的氨基酸侧链受活性氧的攻击,羰基值的高低可以间接地反映蛋白被氧化的程度[15]。在MPs贮藏期内,羰基的含量总体呈上升趋势,说明蛋白质的氧化程度也有所增加。贮藏第2天时,0.04、1.00 g/kg阿魏酸组羰基含量极显著低于空白组(P<0.01);贮藏第10天时,随着阿魏酸浓度的增加,羰基含量逐渐减少,且阿魏酸组的羰基值均极显著低于空白对照组(P<0.01)。这说明随着贮藏时间的延长,添加一定浓度的阿魏酸能有效地抑制MPs的氧化,尤其是添加1.00 g/kg阿魏酸与添加1.00 g/kg BHA具有同等的抗氧化效果,这可能与阿魏酸具有较强的清除自由基和鳌合金属能力有关。
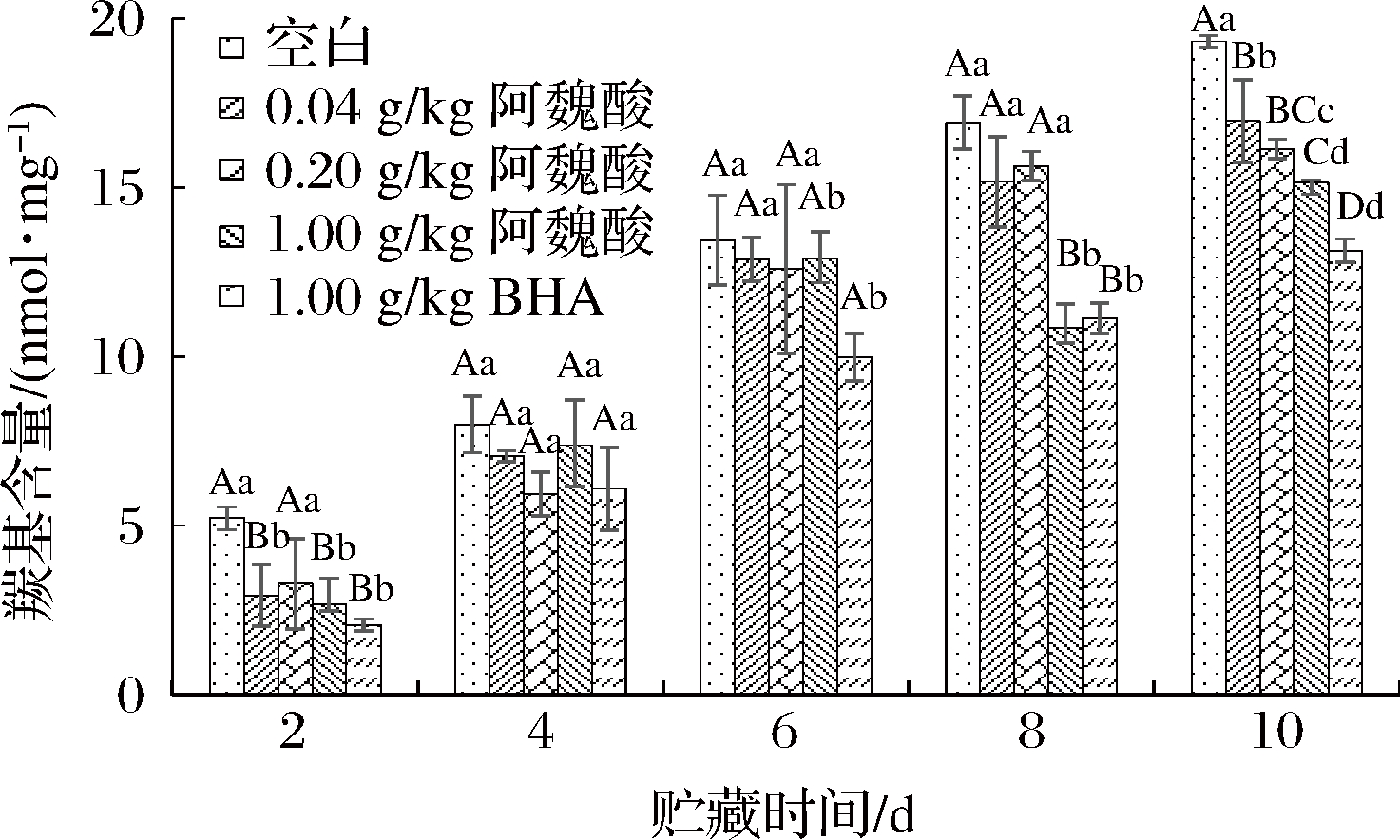
图1 不同浓度阿魏酸对冷藏肌原纤维蛋白羰基含量的影响
Fig.1 Effects of ferulic acid at different concentrations on the carbonyl content of myofibrillar protein during cold storage
注:不同小写字母表示同一贮藏时间各处理组差异显著(P<0.05),不同大写字母表示同一贮藏时间各处理组差异极显著(P<0.01)(下同)
2.1.2 不同浓度阿魏酸对冷藏肌原纤维蛋白总巯基含量的影响
由于蛋白半胱氨酸中的巯基属于活性巯基,容易发生氧化形成二硫键,MPs贮藏期巯基含量降低,因此也可用巯基的损失来判断蛋白质的氧化程度。由图2可知,巯基量总体呈现减少的变化趋势,说明蛋白质受活性氧影响促使巯基逐渐转变为二硫键,导致蛋白氧化程度越来越大。贮藏第4天时,0.04、0.20、1.00 g/kg阿魏酸组巯基含量均显著高于空白对照组(P<0.05);贮藏第6和8天时,0.04、0.20、1.00 g/kg阿魏酸组巯基含量均极显著高于空白对照组(P<0.01)。这说明阿魏酸和BHA在贮藏的中后期能够在一定程度上抑制蛋白质氧化,从而降低巯基的损失。并且贮藏期间添加1.00 g/kg阿魏酸抑制MPs巯基损失效果与添加同浓度的BHA接近,说明阿魏酸的抗氧化能力与BHA接近。这与李玲等[16]研究报道的添加0~1 mg/mL茶多酚可有效抑制蛋白巯基损失的结论一致,说明阿魏酸和茶多酚一样可保护MPs侧链基团。
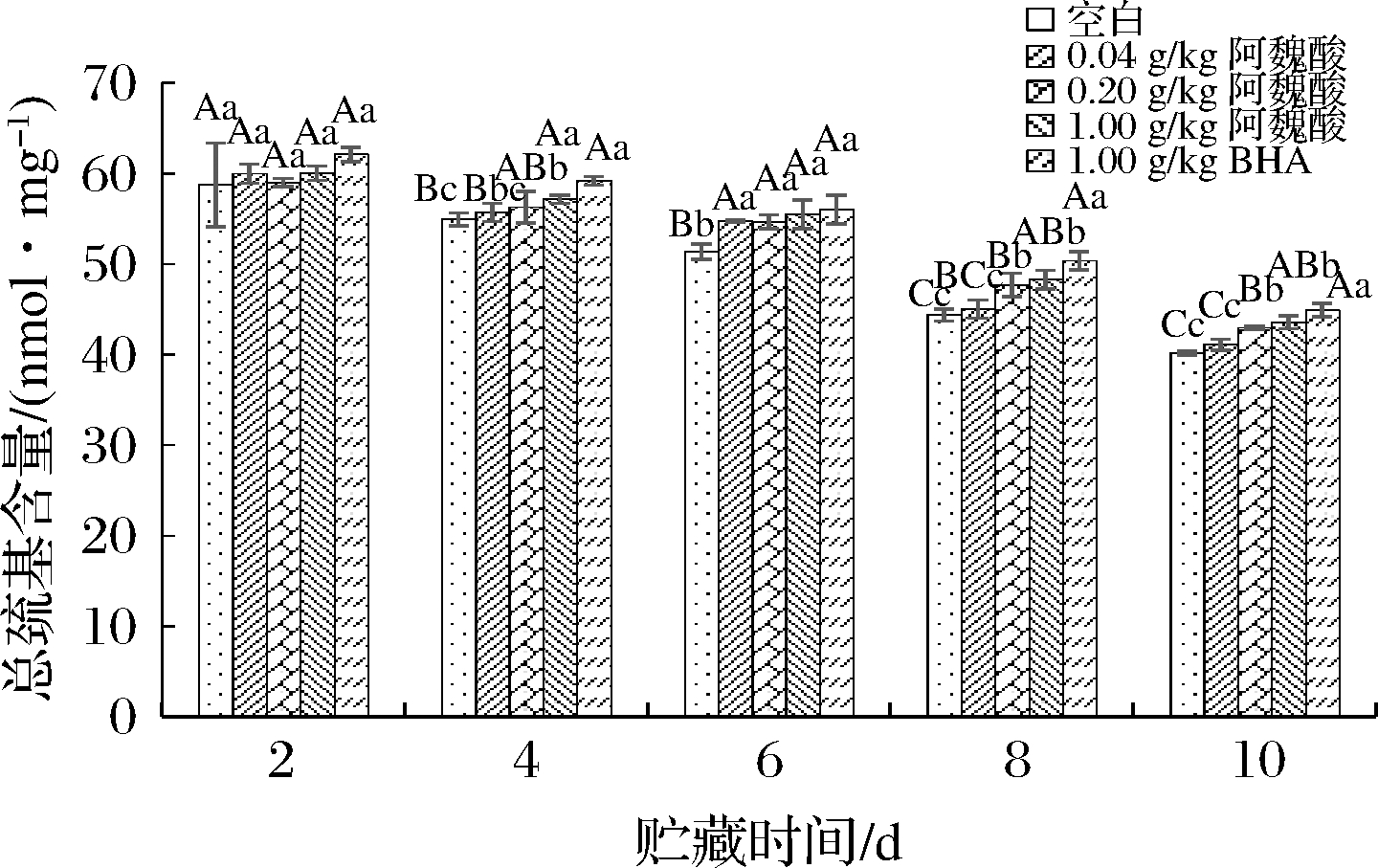
图2 不同浓度阿魏酸对冷藏肌原纤维蛋白总巯基含量的影响
Fig.2 Effects of ferulic acid at different concentrations on the total sulfhydryl groups content of myofibrillar protein during cold storage
2.1.3 不同浓度阿魏酸对冷藏肌原纤维蛋白自由氨基含量的影响
多酚物质在清除自由基后,会转化为醌或半醌物质,这类物质能够进一步与蛋白质的氨基发生加合反应得到“氨基-醌”加合物,从而降低蛋白质中自由氨基含量[1]。图3表明,在MPs贮藏期内,自由氨基含量总体呈增加趋势,这可能是由于蛋白质氧化发生脱氨基作用,使得蛋白质中的自由氨基含量增加。贮藏第2天时,添加阿魏酸和BHA组的自由氨基含量均显著低于空白对照组(P<0.05);贮藏第4天时,0.20、1.00 g/kg阿魏酸组自由氨基含量极显著低于空白对照组(P<0.01);贮藏第6、8、10天时,均随着阿魏酸浓度增大,自由氨基含量逐渐减少,且0.04、0.20、1.00 g/kg阿魏酸组自由氨基含量均显著低于空白对照组(P<0.05)。在贮藏过程中,添加BHA后MPs中的自由氨基的量都降到最低。由此说明添加阿魏酸和BHA后导致自由氨基含量降低,可能与酚类物质与自由氨基发生加成反应产生“氨基-醌”加合物有关。与此类似,曹云刚[17]研究表明,肉蛋白中加入绿原酸可被氧化生成醌或半醌类物质,再与氨基共价结合,形成“氨基-醌”共价化合物,最终导致自由氨基含量的降低。因此,添加阿魏酸能在一定程度上与蛋白质氨基发生共价结合,降低蛋白质中自由氨基的含量。
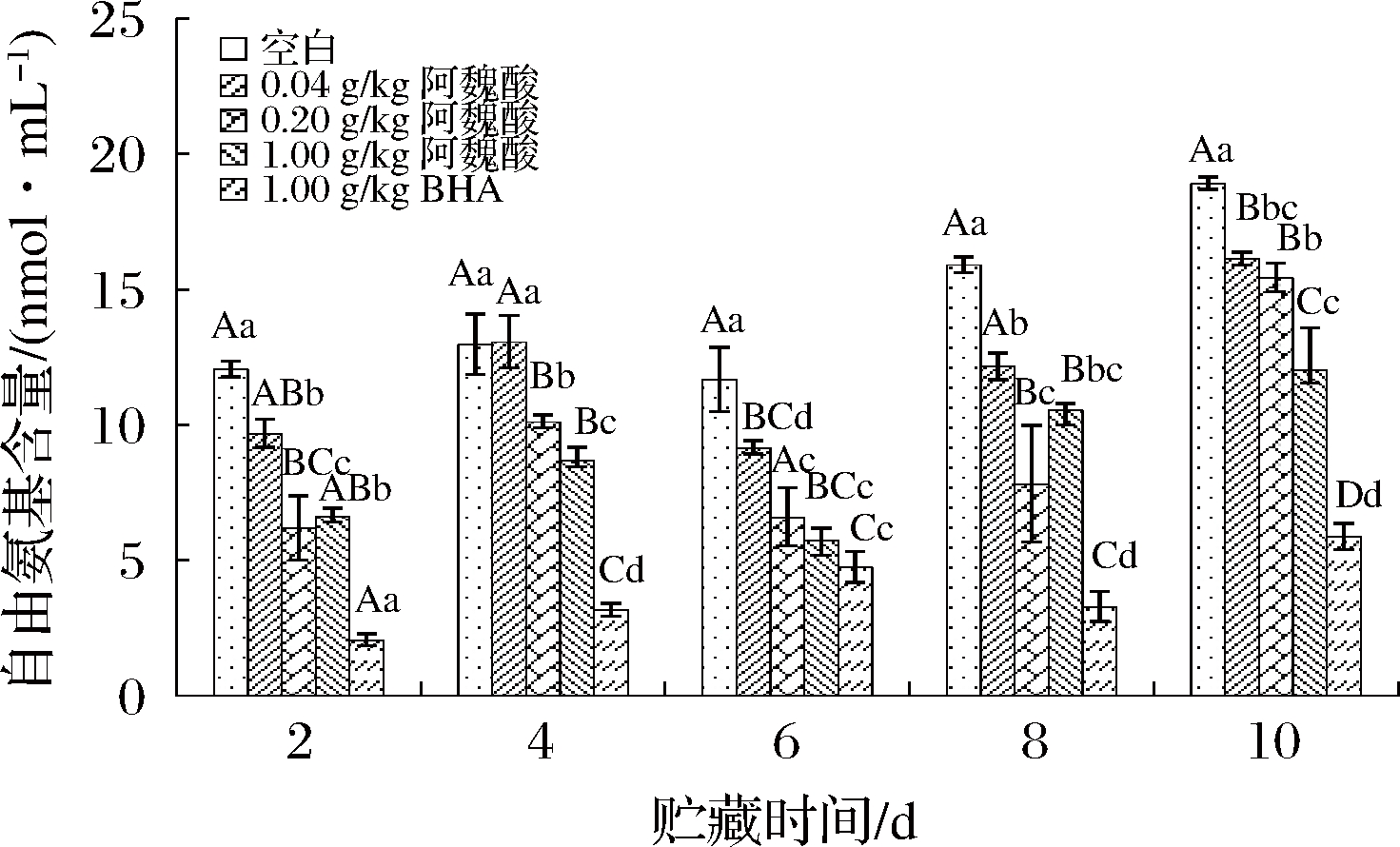
图3 不同浓度阿魏酸对冷藏肌原纤维蛋白自由氨基含量的影响
Fig.3 Effects of ferulic acid at different concentrations on the free amino content of myofibrillar protein during cold storage
2.2 肌原纤维蛋白结构分析
2.2.1 不同浓度阿魏酸对冷藏肌原纤维蛋白二级结构的影响
蛋白质红外图主要反映的是蛋白质酰胺Ⅰ带和Ⅱ带上特征官能团的振动,对样品定性起到尤为重要的作用[18]。蛋白质二级结构的4个主要指标(β-折叠、无规则卷曲、α-螺旋和β-转角)与蛋白质吸收峰的分布具有一定的关系,通过酰胺I带最大峰波数就能分析出蛋白质中二级结构的分布情况[19]。由图5可知,β-折叠是MPs二级结构的主要结构,其次是α-螺旋。随着阿魏酸浓度的增加,MPs中β-折叠和β-转角两者呈现降低的趋势,α-螺旋和无规则卷曲两者呈现升高趋势。因此阿魏酸可促进蛋白二级结构中的β-折叠和β-转角向α-螺旋和无规则卷曲转变。这可能是因为阿魏酸含有的多个羟基破坏了维持β-型结构稳定的氢键,使得多肽羰基中氢键网络结构发生重排和α-螺旋结构还原[19]。已有研究表明蛋白氧化会促使α-螺旋结构向β-结构或无规则卷曲结构转变,导致α-螺旋结构损失[15]。因此,阿魏酸可有效阻止蛋白氧化,进而保护α-螺旋结构。
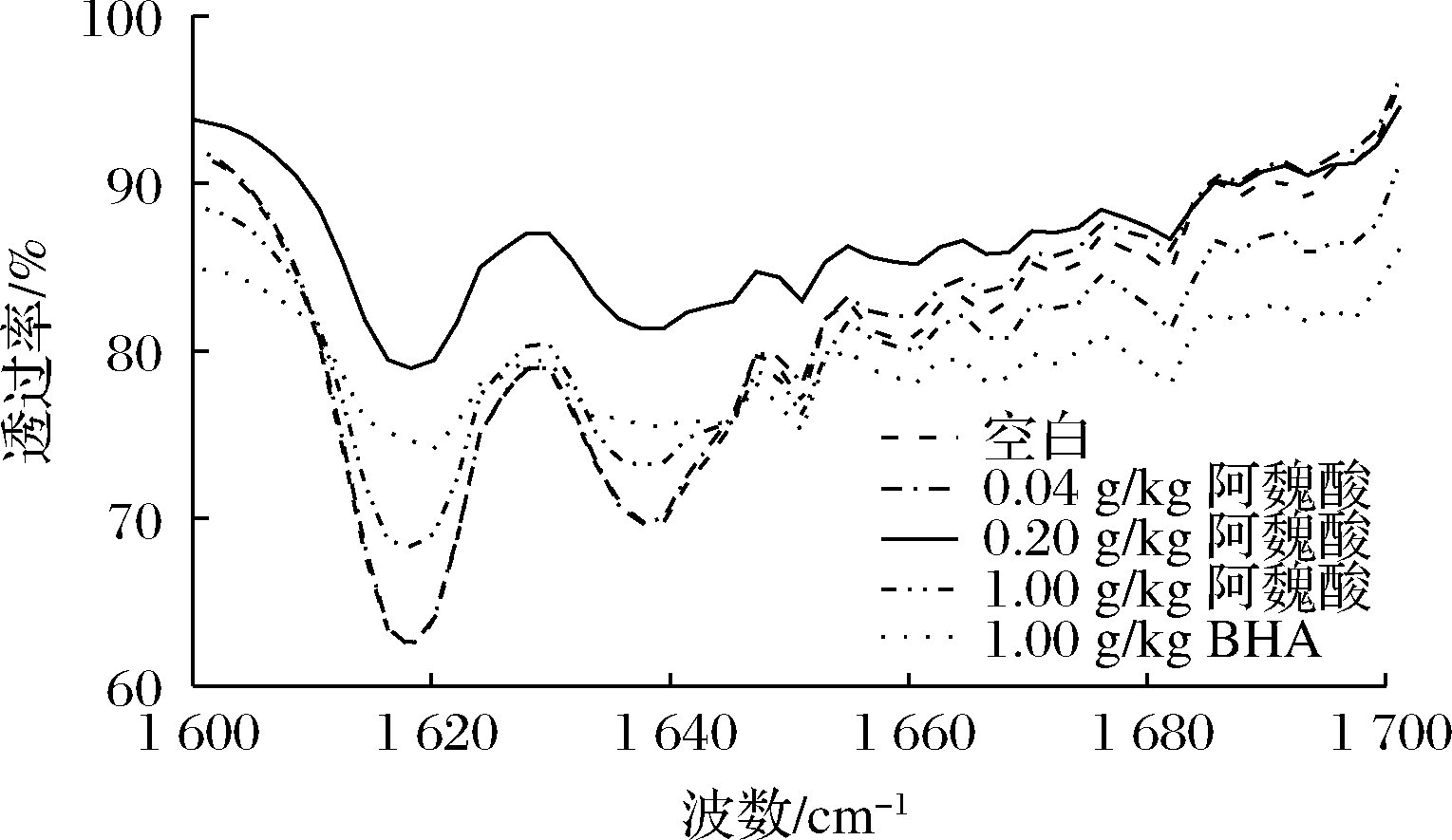
图4 不同浓度阿魏酸处理肌原纤维蛋白FTIR图谱
Fig.4 FTIR spectra of myofibrillar proteins treated with different concentrations of ferulic acid
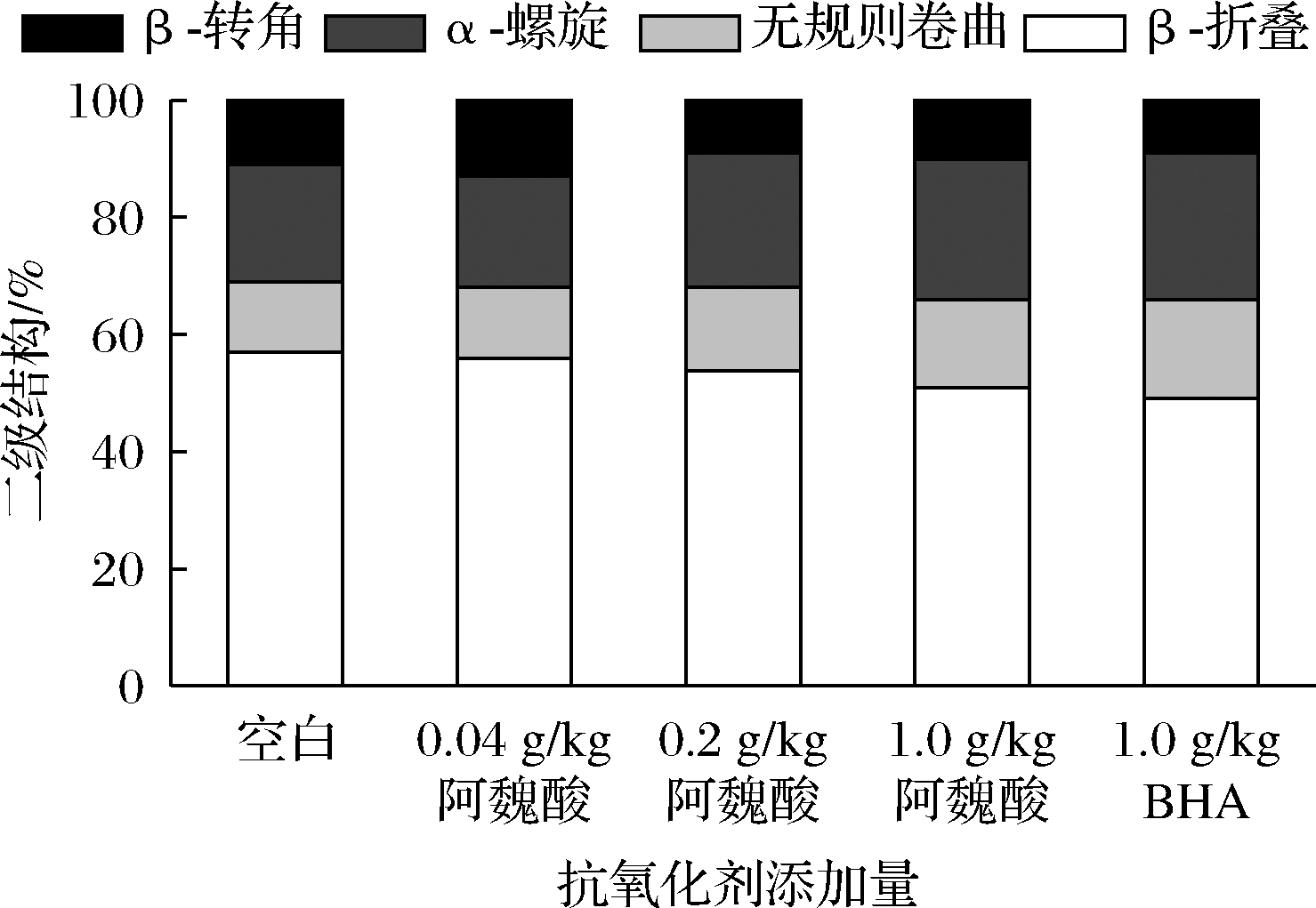
图5 不同浓度阿魏酸对冷藏肌原纤维蛋白二级结构的影响
Fig.5 Effects of ferulic acid at different concentrations on the secondary structure of myofibrillar protein during cold storage
2.2.2 不同浓度阿魏酸对冷藏肌原纤维蛋白内源性色氨酸荧光的影响
色氨酸荧光法是一种常用的研究蛋白质三级构象的方法。诸如蛋白质中的色氨酸和酪氨酸等部分氨基酸具有荧光性,可以通过测定其荧光光谱有效地反映蛋白质三级结构变化[20]。随阿魏酸浓度的增加,相对于空白对照组MPs内源色氨酸荧光强度逐渐降低,添加量达到1.00 g/kg时荧光强度最低,此时荧光强度略高于1.00 g/kg BHA组。可能是因为阿魏酸通过共价和非共价相互作用与MPs中的活性官能团结合,促进蛋白结构展开,将色氨酸、苯丙氨酸和酪氨酸残基暴露于蛋白质表面并处于极性环境中,导致较低的荧光强度[21]。与此类似,CAO等[22]研究发现随着没食子儿茶素的添加量(0、6、30、150 mol/g蛋白)逐渐增加,猪肉MPs的荧光发生逐渐猝灭现象;邵晓等[23]研究表明芦丁和槲皮素在一定添加范围内也能使MPs内源色氨酸荧光强度降低。由以上研究可知,阿魏酸与MPs的相互作用具有浓度的依赖性,阿魏酸浓度越高,MPs三级结构变化越大。
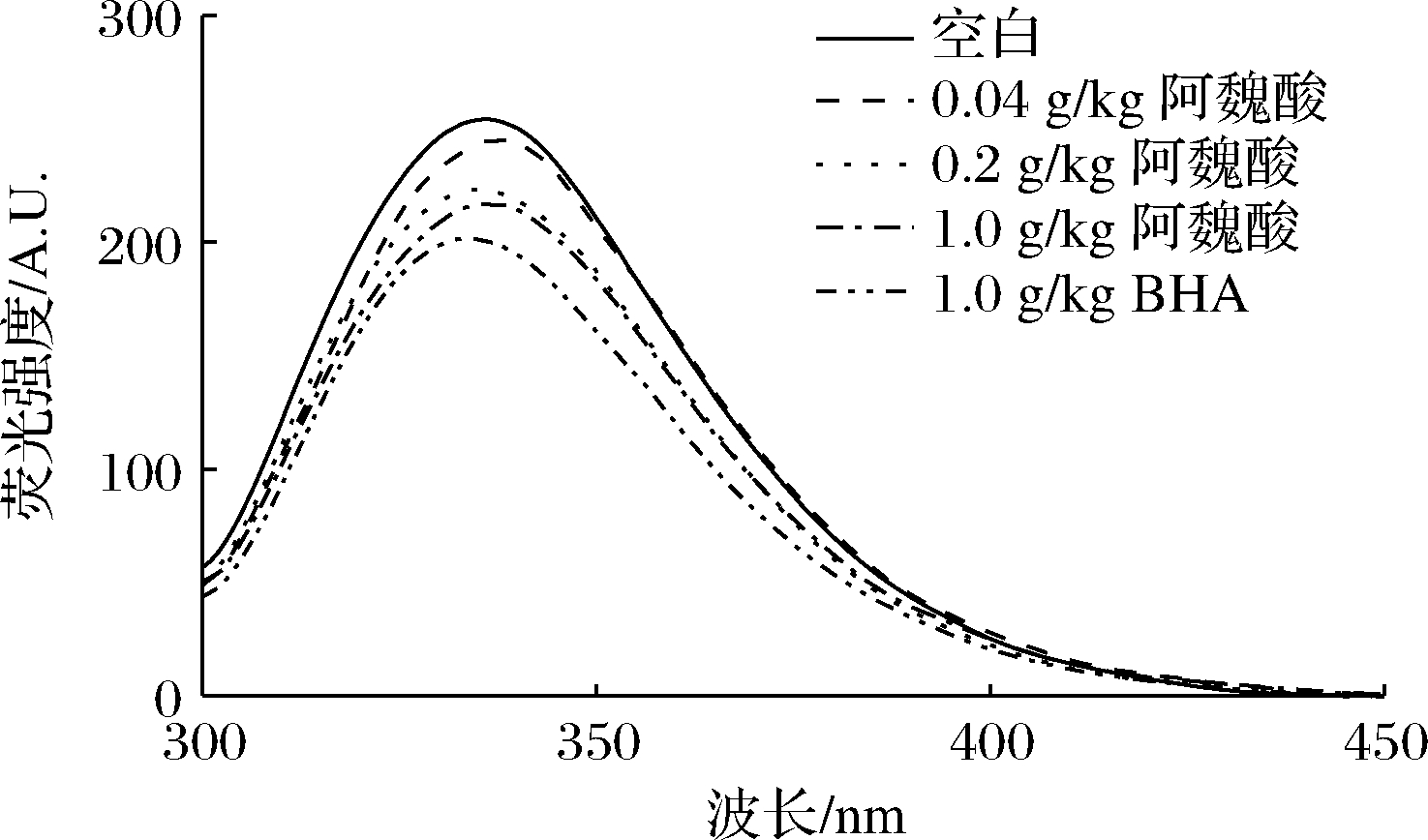
图6 不同浓度阿魏酸对冷藏肌原纤维蛋白内源性色氨酸荧光的影响
Fig.6 Effects of ferulic acid at different concentrations on endogenous tryptophan fluorescence of myofibrillar protein during cold storage
2.2.3 不同浓度阿魏酸对冷藏肌原纤维蛋白表面疏水性的影响
蛋白表面疏水性也是判断其三级结构变化的主要指标,可根据氨基酸残基与溴酚蓝的结合量来研究蛋白质变性程度,表面疏水性反映的是蛋白质表面的疏水性氨基酸残基的数量,蛋白质去折叠暴露在表面的疏水性氨基酸越多,表明疏水性越大[9]。由图7可知,在贮藏全过程中,表面疏水性总体呈上升趋势,这与伯朝英等[24]和贾娜等[25]的研究一致,说明随MPs氧化程度加剧,其蛋白的结构可逐渐展开,暴露在蛋白质表面的疏水残基越来越多。贮藏时间在第2天之后,0.04、0.20、1.00 g/kg阿魏酸组的溴酚蓝结合量都显著低于空白对照组(P<0.05),且阿魏酸浓度越高,溴酚蓝结合量越低;但在贮藏全过程中,高浓度阿魏酸组的溴酚蓝结合量极显著高于BHA组(P<0.01)。第8天时,各处理组的溴酚蓝结合量都低于空白组,差异性极显著(P<0.01)。随着阿魏酸浓度增加,MPs的表面疏水性逐渐降低,尤其是贮藏后期,可能是因为阿魏酸一定程度上维持了蛋白结构稳定性,减少了疏水性残基的暴露。由此说明,随着贮藏时间的延长,添加不同浓度的阿魏酸可以有效阻碍蛋白分子内部的疏水基团发生暴露的程度,达到抑制蛋白质氧化的目的。
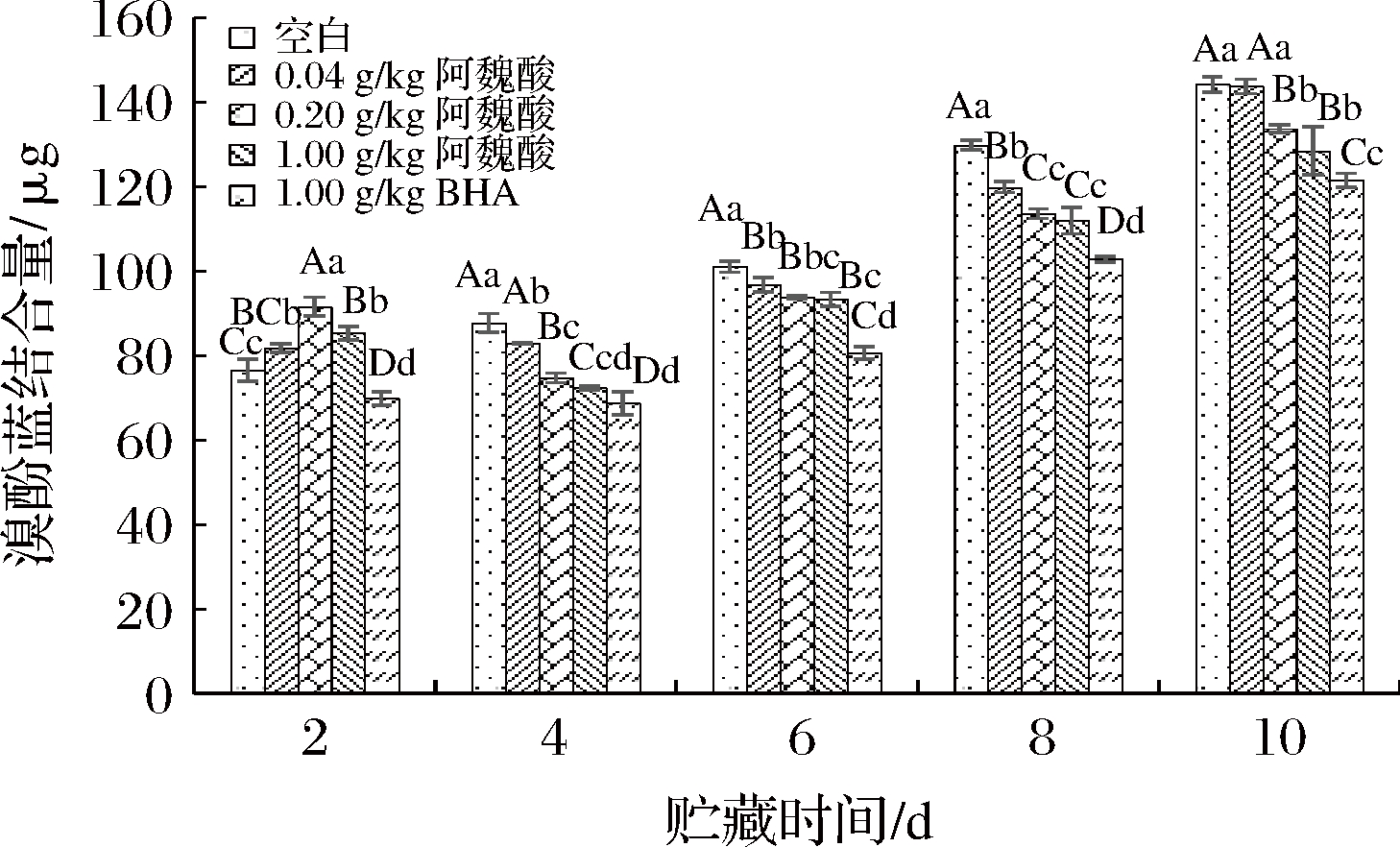
图7 不同浓度阿魏酸对冷藏肌原纤维蛋白表面疏水性的影响
Fig.7 Effects of ferulic acid at different concentrations on the surface hydrophobicity of myofibrillar protein during cold storage
2.3 肌原纤维蛋白乳化活性和乳化稳定性
2.3.1 不同浓度阿魏酸对冷藏肌原纤维蛋白乳化活性的影响
乳化活性是评价蛋白质乳化性能的重要指标,指水和油相互融合时,单位质量蛋白质稳定油水界面的能力。由图8可知,各处理组的MPs乳化活性均随着贮藏时间的延长不断升高,可能是由于蛋白经过氧化后,蛋白结构展开,暴露出较多的亲油性和亲水性基团,使得油相和水相发生较好地交联,导致乳化活性增加[26]。贮藏2~8 d时,添加阿魏酸和BHA各组的乳化活性均极显著高于空白对照组(P<0.01),并且随着阿魏酸浓度的增加,乳化活性也随之增大,此外添加1.00 g/kg阿魏酸组的乳化活性与同浓度BHA组相当。贮藏至第10天时,添加阿魏酸各组的乳化活性显著高于空白对照组(P<0.05),且添加1.00 g/kg BHA组乳化活性极显著高于高浓度阿魏酸组(P<0.01)。说明在贮藏前期,高浓度阿魏酸对MPs乳化活性的增强效果与同浓度BHA相当,贮藏后期BHA组呈现最佳的乳化活性。因此,添加适量阿魏酸可有效改善MPs的乳化活性。这与李立敏等[27]的研究结果一致,添加适量茶多酚可以改善羊肉MP-多糖体系的乳化活性。

图8 不同浓度阿魏酸对冷藏肌原纤维蛋白乳化活性的影响
Fig.8 Effects of ferulic acid at different concentrations on emulsification activity of myofibrillar protein during cold storage
2.3.2 不同浓度阿魏酸对冷藏肌原纤维蛋白乳化稳定性的影响
蛋白乳化稳定性也是评价蛋白质乳化性能的重要指标,是指蛋白质在贮藏过程中维持乳液体系稳定不分层的能力。由图9可知,贮藏期内各处理组MPs的乳化稳定性呈降低趋势,其中空白对照组乳化稳定性由第2天的77.143%下降至第10天的38.046%。与叶凤凌等[26]研究结果相似,这可能是因为随着贮藏时间延长,MPs氧化变性和交联,蛋白质结构改变,导致乳液中连续相没有足够的蛋白质来包裹脂肪,加快乳液的分层,最终乳化稳定性降低。在贮藏过程中,随着阿魏酸浓度升高,MPs乳化稳定性逐渐上升。贮藏第2、4、6天时,0.04、0.20、1.00 g/kg阿魏酸组的乳化稳定性均极显著高于空白组(P<0.01);第8天时,0.04、0.20、1.00 g/kg阿魏酸组的乳化稳定性分别为39.606%、42.778%、44.883%,差异极显著(P<0.01)。因此实验结果表明阿魏酸和BHA的添加有利于MPs的乳化稳定性,这是因为阿魏酸能够调控MPs氧化,延缓蛋白变性,与前面的实验结果相呼应。
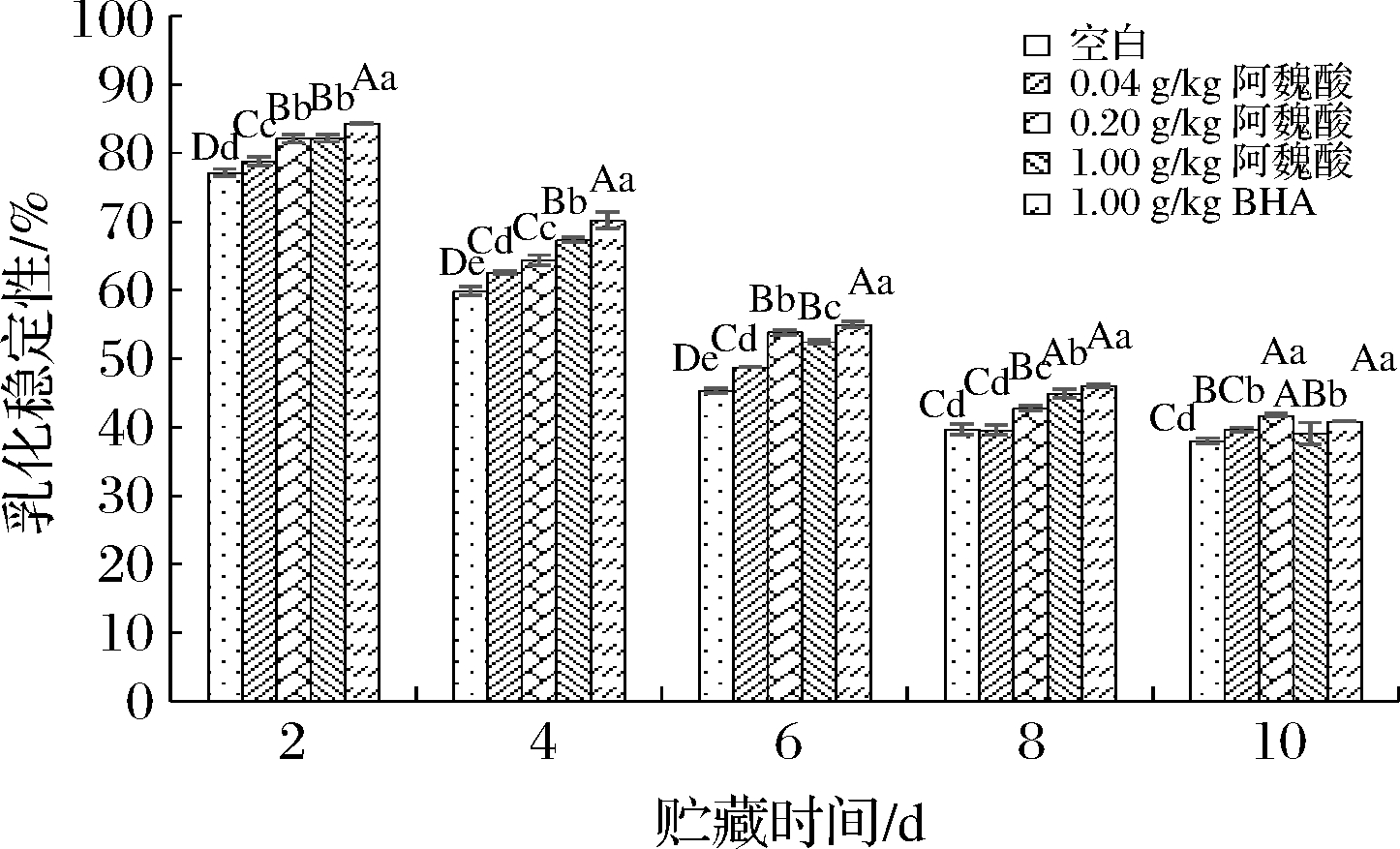
图9 不同浓度阿魏酸对冷藏肌原纤维蛋白乳化稳定性的影响
Fig.9 Effects of ferulic acid at different concentrations on emulsification stability of myofibrillar protein during cold storage
3 结论
通过研究阿魏酸不同添加量对MPs在贮藏过程中氧化稳定性、结构及乳化特性的影响,发现阿魏酸可有效调控MPs氧化,改变蛋白构象并有利于蛋白乳化性能。与空白对照相比,添加0.04~1.00 g/kg阿魏酸均可有效阻止羰基生成、降低巯基损失,可与自由氨基共价结合促进自由氨基含量降低。蛋白结构分析表明,阿魏酸的存在促进了MPs部分结构展开、色氨酸残基暴露,导致β结构的减少、色氨酸荧光猝灭和表面疏水性降低。乳化性能分析表明,阿魏酸的存在可增强MPs乳化活性和乳化稳定性。可见,阿魏酸具有抑制MPs氧化的潜能,改变蛋白二级和三级结构,提高蛋白乳化性能。
[1] ZHAO X, XU X L, ZHOU G H.Covalent chemical modification of myofibrillar proteins to improve their gelation properties:A systematic review[J].Comprehensive Reviews in Food Science and Food Safety, 2021,20(1):924-959.
[2] CAO Y G, MA W H, HUANG J R, et al.Effects of sodium pyrophosphate coupled with catechin on the oxidative stability and gelling properties of myofibrillar protein[J].Food Hydrocolloids, 2020, 104:105722.
[3] SHAHIDI F, AMBIGAIPALAN P.Phenolics and polyphenolics in foods, beverages and spices:Antioxidant activity and health effects-A review[J].Journal of Functional Foods, 2015, 18:820-897.
[4] GUO A Q, JIANG J, TRUE A D, et al.Myofibrillar protein cross-linking and gelling behavior modified by structurally relevant phenolic compounds[J].Journal of Agricultural and Food Chemistry, 2021, 69(4):1 308-1 317.
[5] ZHANG D X, ZHU J F, YE, F Y, et al.Non-covalent interaction between ferulic acid and arabinan-rich pectic polysaccharide from rapeseed meal[J].International Journal of Biological Macromolecules, 2017, 103:307-315.
[6] KHANDUJA K L, AVTI P K, KUMAR S,et al.Anti-apoptotic activity of caffeic acid, ellagic acid and ferulic acid in normal human peripheral.blood mononuclear cells:A Bcl-2 independent mechanism[J].Biochimica et Biophysica Acta(BBA)-General Subjects, 2006, 1 760(2):283-289.
[7] PARK D, XIONG Y L, ALDERTON A L, et al.Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J].Journal of Agricultural and Food Chemistry, 2006, 54(12):4 445-4 451.
[8] ORTU O J, SERRANO R, JORD
O J, SERRANO R, JORD N M J, et al.Shelf life of meat from lambs given essential oil-free rosemary extract containing carnosic acid plus carnosol at 200 or 400 mg/kg[J].Meat Science, 2014, 96(4):1 452-1 459.
N M J, et al.Shelf life of meat from lambs given essential oil-free rosemary extract containing carnosic acid plus carnosol at 200 or 400 mg/kg[J].Meat Science, 2014, 96(4):1 452-1 459.
[9] 熊杰, 伯朝英, 常海军.甘草提取物对冷藏鸡肉糜脂肪和蛋白质氧化及品质特性的影响[J].食品工业科技, 2021, 42(1):75-81;88.
XIONG J, BO Z Y, CHANG H J.Effects of licorice extract on oxidation and quality characteristics of fat and protein in refrigerated chicken meat batter[J].Science and Technology of Food Industry, 2021, 42(1):75-81;88.
[10] 褚千千, 韩秋煜, 陈必文, 等.一种蛋白质游离氨基含量测定方法:三硝基苯磺酸法的探究[J].食品与发酵工业, 2020, 46(6):275-279.
CHU Q Q, HAN Q Y, CHEN B W, et al.Determination of free amino group content of protein using trinitrobenzenesulfonic acid (TNBS) method[J].Food and Fermentation Industries, 2020, 46(6):275-279.
[11] ZHANG R H, PANG X Y, LU J, et al.Effect of high intensity ultrasound pretreatment on functional and structural properties of micellar casein concentrates[J].Ultrasonics Sonochemistry, 2018, 47:10-16.
[12] CAO Y G, AI N S, TRUE A D, et al.Effects of (-)-epigallocatechin-3-gallate incorporation on the physicochemical and oxidative stability of myofibrillar protein-soybean oil emulsions[J].Food Chemistry, 2018, 245:439-445.
[13] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[14] 邵俊花, 吴菊清, 周光宏, 等.巯基和疏水性对蛋白质乳化及凝胶特性的影响[J].食品科学, 2013, 34(23):155-159.
SHAO J H, WU J Q, ZHOU G H, et al.Effects of sulfhydryl content and hydrophobicity on gel and emulsifying properties of pork proteins[J].Food Science, 2013, 34(23):155-159.
[15] ZHANG Z L, XIONG Z Y, LU S F, et al.Effects of oxidative modification on the functional, conformational and gelling properties of myofibrillar proteins from Culter alburnus[J].International Journal of Biological Macromolecules, 2020, 162:1 442-1 452.
[16] 李玲, 季慧, 康大成, 等.氧化条件下茶多酚对猪肉肌原纤维蛋白理化和凝胶特性的影响[J].食品科学, 2019, 40(2):12-17.
LI L, JI H, KANG D C, et al.Effect of tea polyphenols on physicochemical and gel properties of pork myofibrillar protein under oxidative conditions[J].Food Science, 2019, 40(2):12-17.
[17] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D].无锡:江南大学, 2016.
CAO Y G.Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins: Mechanism and application[D].Wuxi:Jiangnan University, 2016.
[18] KAUR J, KATOPO L, HUNG A, et al.Combined spectroscopic,molecular docking and quantum mechanics study of β-casein and p-coumaric acid interactions following thermal treatment[J].Food Chemistry, 2018, 252:163-170.
[19] 李春翼, 王启明, 唐瑜婉, 等.热诱导对麦醇溶蛋白/芦丁相互作用及其乳液流变学特性的影响[J].食品科学, 2020, 41(18):27-34.
LI C Y, WANG Q M, TANG Y W, et al.Effects of heat treatment on interaction between gliadin and rutin and rheological properties of emulsion stabilized with their complex[J].Food Science, 2020, 41(18):27-34.
[20] 尚坤. 不同磷酸盐对虾蛄肌原纤维蛋白功能特性的影响及应用[D].天津:天津商业大学, 2019.
SHANG K.Effects of different phosphates on functional properties of myofibrillar protein from Mantis shrimp and application[D].Tianjin:Tianjin University of Commerce, 2019.
[21] ZHANG L, SUN J, QI Y, et al.Forming nanoconjugates or inducing macroaggregates, curcumin dose effect on myosin assembling revealed by molecular dynamics simulation[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020,607:125415.
[22] CAO Y G, TRUE A D, CHEN J, et al.Dual role (anti-and pro-oxidant) of gallic acid in mediating myofibrillar protein gelation and gel in vitro digestion[J].Journal of Agricultural and Food Chemistry, 2016, 64(15):3 054-3 061.
[23] 邵晓, 张宁, 孙乐彤, 等.槲皮素和芦丁对猪肉肌原纤维蛋白结构的影响[J].食品研究与开发, 2019, 40(2):26-30.
SHAO X, ZHANG N, SUN L T, et al.Effect of quercetin and rutinum on the constructure of pork myofibrillar protein[J].Food Research and Development, 2019, 40(2):26-30.
[24] 伯朝英, 熊杰, 常海军, 等.马齿苋提取物抑制冷藏猪肉糜脂肪和蛋白氧化及对品质特性的影响[J].食品与发酵工业, 2022, 48(22):172-179.
BO Z Y, XIONG J, CHANG H J, et al.Effects of Purslane extract on oxidation and quality of fat and protein in refrigerated minced pork[J].Food and Fermentation Industries, 2022, 48(22):172-179.
[25] 贾娜, 刘丹, 王乐田, 等.儿茶素对冷藏猪肉糜脂肪和蛋白氧化及品质特性的影响[J].中国食品学报,2018,18(12):210-218.
JIA N, LIU D,WANG L T, et al.Effect of catechin on lipid/protein oxidation and quality of minced pork during chilled storage[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12):210-218.
[26] 叶凤凌, 池玉闽, 周敏之, 等.氧化对兔肉肌原纤维蛋白结构、乳化性和凝胶性的影响研究[J].食品工业科技, 2020, 41(24):22-30.
YE F L, CHI Y M, ZHOU M Z, et al.Effect of oxidation on the structure, emulsification and gelability of rabbit meat myofibrillar protein[J].Science and Technology of Food Industry, 2020, 41(24):22-30.
[27] 李立敏, 杨豫菘, 成立新, 等.茶多酚对羊肉肌原纤维蛋白-多糖复合体系乳化及质构特性的影响[J].中国食品学报, 2021, 21(8):67-77.
LI L M, YANG Y S, CHENG L X, et al.Effect of tea polyphenols on emulsifying and textural properties of mutton myofibrillar protein-polysaccharide composite[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(8):67-77.