益生菌是指一类活的微生物,当有足够量的菌体到达宿主肠道、定植从而改变宿主肠道菌群平衡,能够对宿主产生健康效应[1-2]。益生菌主要包括乳酸菌、酵母菌、芽孢杆菌等,其中乳酸菌是应用最多的一类益生菌。嗜酸乳杆菌(Lactobacillus acidophilus)具有降低机体胆固醇、代谢乳品中乳糖,缓解乳糖不耐症[3-4],有效降解食物中的杂环胺[5]等功能,被广泛应用于食品发酵、奶酒和干酪制品的生产、调节血糖血脂等领域[6-7]。
益生菌的安全性一直是人们关注的热点,对益生菌安全性的理解也在不断的发生变化。国内外研究显示,绝大多数乳酸菌经过长期的应用筛选,通常被认为是安全的,但部分乳酸菌中携带抗性基因的质粒,可以通过质粒水平转移等途径将抗性基因转移至其他肠道菌群内[8-11],带来健康隐患。此外,少数乳酸菌可能产生诸如溶血素、生物胺[12-13]等有害物质进而对宿主产生健康威胁。
本实验室从发酵食品中分离获得一株优势乳酸菌Lactobacillus acidophilus NC55,但其生物安全性尚不清楚。为评估该菌株的生物安全性,本研究参考国家标准GB 15193.1—2014《食品安全国家标准 食品安全性毒理学评价程序》等资料,通过抗生素敏感实验、质粒提取实验、有害产物代谢实验和动物实验等,从体内、体外两方面对NC55菌株的安全性进行评价,为后续将其开发应用于特色膳食或者药品奠定研究基础。
1 材料与方法
1.1 材料与试剂
嗜酸乳杆菌NC55,本实验室分离保存;嗜酸乳杆菌NC55(pTRK669)、金黄色葡萄球菌(Staphylococcus aureus)JH01,本实验室保存;健康SPF级ICR小鼠,北京斯贝福生物技术有限公司;MRS培养基,青岛高科园海博生物技术有限公司;哥伦比亚血琼脂培养基,北京陆桥技术股份有限公司;质粒小提试剂盒,美国Omega Biotek Inc;氨苄西林、头孢噻吩等抗生素,上海麦克林生化科技有限公司;溶菌酶,北京索莱宝科技有限公司。
1.2 仪器与设备
JY-SPCT型核酸电泳仪、JY04S-3E型凝胶成像系统,北京君意东方电泳设备有限公司;DHP-360型恒温培养箱,上海科恒实业发展有限公司;FSIVC-3318型生物安全型独立送风隔离笼具,苏州市冯氏实验动物设备有限公司;P-800型多波段酶标仪,杭州遂真生物技术有限公司;QYC-200型恒温摇床,上海新苗医疗器械制造有限公司。
1.3 实验方法
1.3.1 抗生素敏感性检测
采用肉汤稀释法分析NC55菌株对临床常用抗生素的最小抑菌浓度(minimal inhibitory concentration, MIC)[14-15]。以无菌生理盐水稀释菌液,将菌液加入含不同浓度抗生素的液体培养基中[V(菌液)∶V(培养基)=1∶100],37 ℃ 200 r/min恒温摇床中培养,采用酶标仪测定NC55菌株的生长情况。
1.3.2 质粒提取与检测
取对数生长期的NC55菌株和阳性对照菌株NC55(pTRK669),13 000 r/min离心2 min后收集菌体,在离心管中加入200 μL Solution Ⅰ (已预先加入RNase A),涡旋振荡后加入50 μL溶菌酶(100 mg/mL),37 ℃孵育15 min;加入250 μL Solution Ⅱ 混匀后静置2 min;加入350 μL Solution Ⅲ 离心10 min后收集上清液,依次加入HBC buffer及Washing buffer洗涤后用超纯水洗脱质粒。以琼脂糖凝胶电泳方式进行检测,使用凝胶成像系统分析质粒条带。
1.3.3 质粒提取与检测
菌株溶血性检测参考已报道的方法进行[16]。将活化后的NC55菌株接种于MRS液体培养基中37 ℃培养过夜,离心收集菌体,以无菌生理盐水洗涤后重悬,点样于哥伦比亚血琼脂培养基,37 ℃培养24 h后观察有无溶血环出现。以金黄葡萄球菌JH01作为对照。
1.3.4 氨基酸脱羧酶检测
氨基酸脱羧酶检测参考已报道的方法进行[17]。将活化的NC55菌株以1%(体积分数)接种量接入含有5 g/L氨基酸(组氨酸、酪氨酸、赖氨酸或鸟氨酸)的MRS液体培养基中培养过夜,多次传代后,离心收集菌体。以无菌生理盐水洗涤后重悬,点样于添加组氨酸、酪氨酸、赖氨酸或鸟氨酸的氨基脱羧酶固体培养基,37 ℃培养24 h后,观察培养基有无变色,检测是否生成组胺、酪胺、腐胺或尸胺等生物胺。
1.3.5 28 d经口毒性试验
28 d经口毒性试验可以对受试动物的全身毒性进行评价[18]。本试验参考GB 15193.22—2014《食品安全国家标准 28天经口毒性试验》进行实验。选取6周龄SPF级ICR小鼠48只,雌雄各半,分为对照组、低剂量组、高剂量组,每组16只小鼠。其中对照组小鼠灌胃生理盐水,实验组小鼠灌胃NC55生理盐水稀释液(低剂量:1×106 CFU/mL,高剂量1×108 CFU/mL)。每日定时灌胃1次,剂量为0.2 mL/只,连续灌胃28 d。每日灌胃后观察小鼠形态、行为变化。灌胃28 d后,小鼠禁食禁水过夜。称取小鼠体重,每组选择6只小鼠处死取全血、血清,送武汉赛维尔生物科技有限公司对小鼠血常规、血生化数据测定。随后解剖小鼠,取小鼠心、肝、脾、肺、肾称重后计算小鼠脏器系数。参考朱广素等[19]的方法,观察脏器确定表面无异常组织或增生后,于超净工作台剖开脏器,以一次性无菌棉签擦拭切面后涂布于MRS固体培养基上,37 ℃倒置培养72 h,观察有无特征菌落生长,分析有无细菌移位现象产生。
1.3.6 急性毒性试验
急性毒性试验可以探明受试物可能对实验动物产生的急性毒性强度和性质,确定毒性作用的靶器官[20]。本试验参考GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》进行实验。选取6周龄SPF级ICR小鼠24只,雌雄各半,分为对照组与实验组。对照组小鼠灌胃生理盐水,实验组小鼠灌胃NC55菌液(2×108 CFU/mL)。每日定时灌胃1次,剂量为1 mL/只,连续灌胃7 d。每日灌胃后观察小鼠形态、行为变化。灌胃7 d后,小鼠禁食禁水过夜。称取小鼠体重,处死小鼠,一半小鼠取全血,另一半取血清。后续处理同1.3.5。
1.3.7 致畸试验
参考GB 15193.14—2015《食品安全国家标准 致畸试验》进行。选取性成熟SPF级ICR小鼠24只,雌雄各半,饲料为大小鼠营养繁殖饲料,自由饮食饮水。雌雄小鼠随机1∶1合笼饲养,以母鼠阴道口发现阴道栓时间视为小鼠怀孕,为孕0.5 d[21]。将出栓小鼠分为对照组、低剂量组、高剂量组3组,每组4只,实验设计与28 d喂养实验一致。小鼠孕7~16 d,每日定时灌胃1次,剂量为0.2 mL/只。小鼠在孕18 d时处死,取子宫及胎盘,检查胚胎外观有无异常。将一半小鼠胚胎放入茜素红染液染色后检查小鼠骨骼发育状态,另一半小鼠胚胎放入Davidson’s固定液中固定,检查内脏发育情况[22]。
1.4 数据处理
使用SPSS 21.0软件中的t检验、非参数检验,对数据进行统计及显著性差异分析。数据的表示方法为平均值±标准差。
2 结果与分析
2.1 体外安全性实验
2.1.1 NC55菌株的抗生素MICs
实验结果如表1所示,NC55菌株对9类抗生素中的8类敏感,对四环素存在抗性。研究表明乳酸菌普遍对四环素具有抗性,部分菌株MIC>256 μg/mL[23-25]。大多数四环素耐药基因与质粒、转座子或接合型转移元件相关联,表明嗜酸乳杆菌的四环素抗性为获得性耐药[26-30]。本研究中NC55菌株对四环素耐药,与文献报道乳酸菌普遍对四环素具有抗性相一致。
表1 嗜酸乳杆菌NC55菌株的抗生素MICs检测结果
Table 1 Antibiotic MICs test of strain Lactobacillus acidophilus NC55
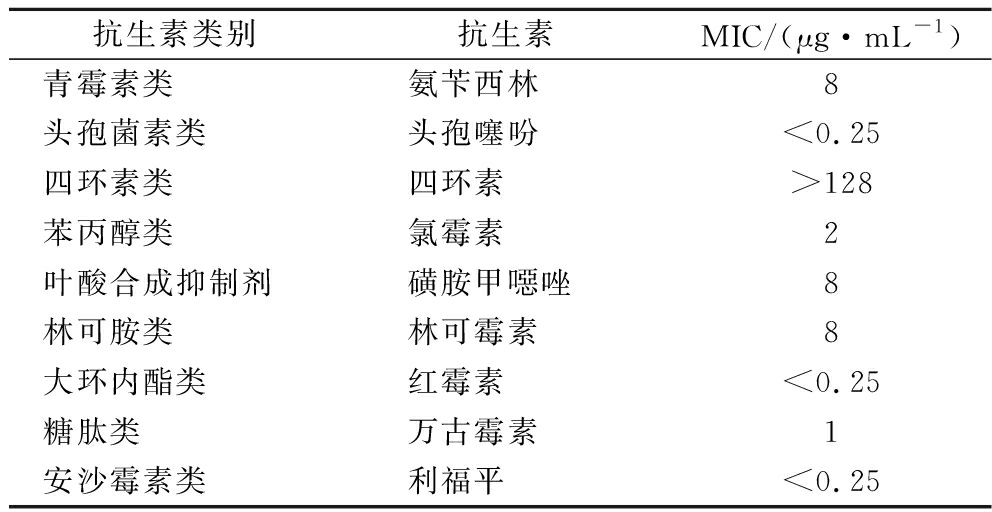
抗生素类别抗生素MIC/(μg·mL-1)青霉素类氨苄西林8头孢菌素类头孢噻吩<0.25四环素类四环素>128苯丙醇类氯霉素2叶酸合成抑制剂磺胺甲噁唑8林可胺类林可霉素8大环内酯类红霉素<0.25糖肽类万古霉素1安沙霉素类利福平<0.25
2.1.2 NC55菌株中质粒提取结果
琼脂糖凝胶电泳实验结果如图1所示。结果显示嗜酸乳杆菌NC55泳道内无质粒条带;而对照阳性菌株NC55(pTRK669)泳道内存在质粒条带,证明对革兰阳性菌质粒提取成功且嗜酸乳杆菌NC55内不存在质粒,表明NC55菌株不存在通过质粒水平转移扩散抗性基因至肠道菌群的能力,但尚不能排除嗜酸乳杆菌NC55通过转座子或者其他接合型转移元件扩散抗生素抗性基因的风险。
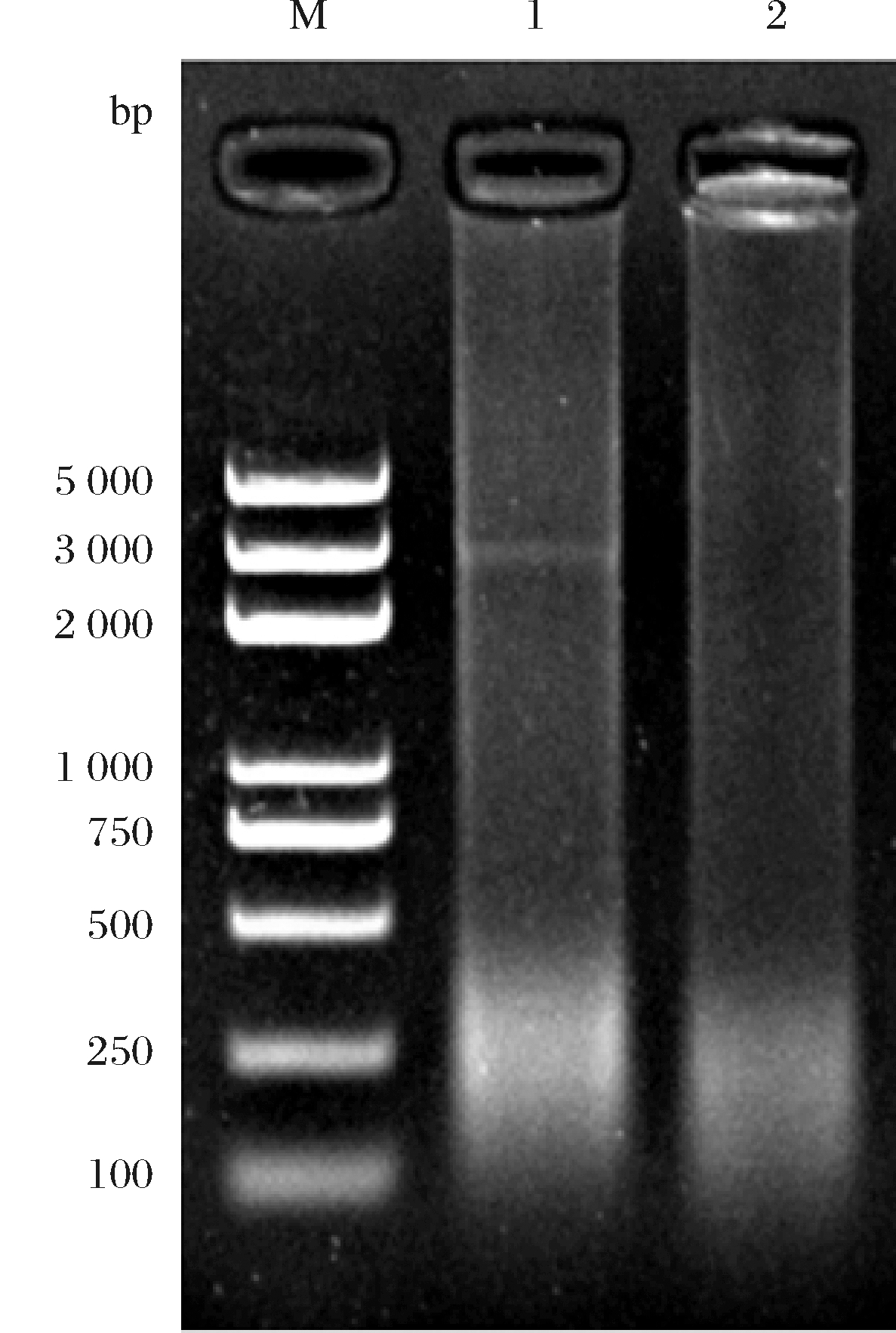
M-DL5000 DNA Marker;1-NC55(pTRK669)菌株;2-NC55菌株
图1 嗜酸乳杆菌NC55菌株中质粒检测
Fig.1 Plasmid detection in Lactobacillus acidophilus NC55 strain
2.1.3 NC55菌株中质粒提取结果
菌株溶血性检测结果如图2所示。在血琼脂培养基中阳性对照菌株金黄色葡萄球菌JH01菌落附近出现透明的溶血圈,表现为完全溶血(β溶血),NC55菌落附近无明显变化,属于无毒性的不溶血菌株。结果表明NC55菌株不会以溶血方式危害宿主安全。

图2 嗜酸乳杆菌NC55菌株溶血性检测
Fig.2 Hemolysis test of Lactobacillus acidophilus NC55 strain
2.1.4 NC55氨基酸脱羧酶检测结果
本研究结果显示NC55菌株在氨基脱羧酶固体培养基中可正常生长,培养基颜色不发生变化,说明NC55菌株生长、增殖过程中不能利用组氨酸、酪氨酸、赖氨酸或鸟氨酸产生生物胺。
2.2 体内安全性实验
2.2.1 NC55小鼠28 d经口毒性试验结果
本试验将小鼠分为对照组、低剂量组、高剂量组连续28 d固定时间对小鼠灌胃。小鼠灌胃后无异常,偶有呃逆发生,可自行恢复。28 d后,小鼠无死亡,生命活动一切正常,精神状态良好,饮食、饮水正常,无腹泻血便,对外界刺激反应正常,鼠毛光洁白亮,皮肤无破损溃烂。结果显示,在小鼠28 d经口毒性试验中对照组小鼠与低剂量组、高剂量组小鼠在体重、脏器系数、血液生化指标方面均无显著性差异(表2~表4),解剖观察未发现内脏异常,细菌培养也未发现细菌移位现象。综上,可认为在28 d经口毒性试验中,嗜酸乳杆菌NC55未造成小鼠机体各项数据的改变,未对小鼠机体造成不良影响。
表2 小鼠28 d经口毒性试验动物体重 单位:g
Table 2 Body weight of the mice in 28-day oral toxicity test

组别7 d14 d21 d28 d对照组体重 29.24±3.9430.38±3.6731.69±4.2532.52±4.38低剂量组体重28.81±4.9631.01±4.2731.75±4.3532.74±4.47高剂量组体重28.28±4.0629.50±4.2730.68±4.3331.62±4.65
注:数据为平均值±标准差(n=16)
表3 小鼠28 d经口毒性试验脏器系数
Table 3 Organ coefficient of the mice in 28-day oral toxicity test
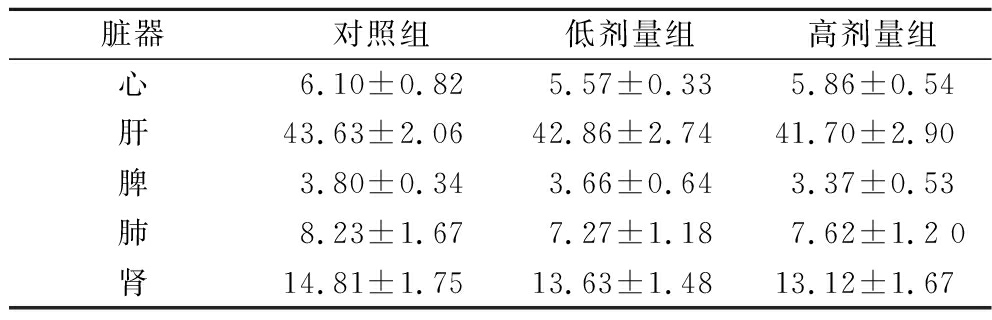
脏器对照组低剂量组高剂量组心6.10±0.825.57±0.335.86±0.54肝43.63±2.0642.86±2.7441.70±2.90脾3.80±0.343.66±0.643.37±0.53肺8.23±1.677.27±1.187.62±1.2 0肾14.81±1.7513.63±1.4813.12±1.67
注:数据为平均值±标准差(n=6)(表4、表7同)
表4 小鼠28 d经口毒性试验血常规、血生化数据
Table 4 Blood routine and blood biochemical data of mice in 28-day oral toxicity test
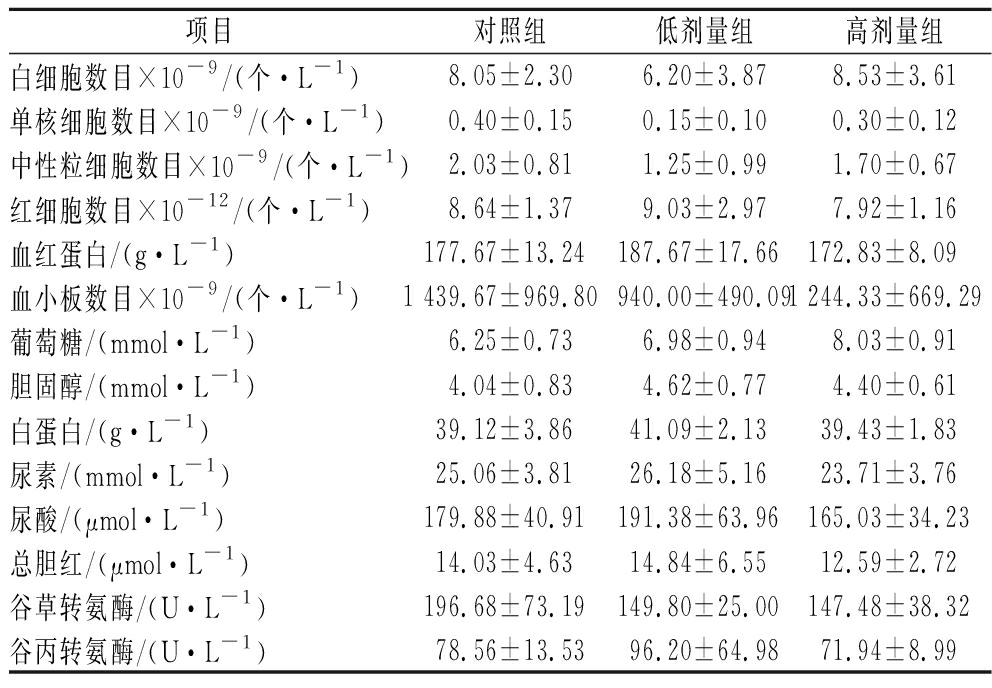
项目对照组低剂量组高剂量组白细胞数目×10-9/(个·L-1) 8.05±2.306.20±3.878.53±3.61单核细胞数目×10-9/(个·L-1)0.40±0.150.15±0.100.30±0.12中性粒细胞数目×10-9/(个·L-1)2.03±0.811.25±0.991.70±0.67红细胞数目×10-12/(个·L-1)8.64±1.379.03±2.977.92±1.16血红蛋白/(g·L-1)177.67±13.24187.67±17.66172.83±8.09血小板数目×10-9/(个·L-1)1 439.67±969.80940.00±490.091 244.33±669.29葡萄糖/(mmol·L-1) 6.25±0.736.98±0.948.03±0.91胆固醇/(mmol·L-1)4.04±0.834.62±0.774.40±0.61白蛋白/(g·L-1)39.12±3.8641.09±2.1339.43±1.83尿素/(mmol·L-1)25.06±3.8126.18±5.1623.71±3.76尿酸/(μmol·L-1) 179.88±40.91191.38±63.96165.03±34.23总胆红/(μmol·L-1)14.03±4.6314.84±6.5512.59±2.72谷草转氨酶/(U·L-1) 196.68±73.19149.80±25.00147.48±38.32 谷丙转氨酶/(U·L-1)78.56±13.5396.20±64.9871.94±8.99
2.2.2 NC55小鼠急性毒性试验结果
在本研究中以浓度为2×108 CFU/mL的NC55菌液对小鼠灌胃,对照组小鼠灌胃等体积的生理盐水。小鼠体重变化趋势及脏器系数如表5和表6所示,实验组与对照组小鼠间体重、脏器系数均无显著性差异。实验组与对照组小鼠体重均有一定程度减轻,可能与灌胃前禁食时间过长、灌胃剂量过大影响小鼠进食有关。小鼠血液检测数据如表7所示,与对照组相比,实验组血常规、血生化数据不存在显著性差异,说明NC55菌株未对小鼠血常规、血生化数值造成影响。此外,小鼠内脏表面无肉眼可见增生或病变,脏器剖面于无菌条件下涂布无NC55菌株生长,提示未发生细菌移位现象,证明NC55菌株不存在造成多器官功能障碍或肠源性感染的危险。
表5 小鼠急性毒性试验动物体重 单位:g
Table 5 Body weight of mice in acute toxicity test

组别1 d8 d对照组体重32.93±4.3830.09±4.03实验组体重36.34±5.6331.51±4.21
注:数据为平均值±标准差(n=12)(表6同)
表6 小鼠急性毒性试验脏器系数
Table 6 Organ coefficient of mice in acute toxicity test

脏器对照组实验组心5.36±0.556.14±1.52肝43.72±4.3045.09±6.74脾3.72±1.604.38±2.55肺8.58±1.218.87±1.60肾14.32±1.6315.26±2.10
表7 小鼠急性毒性试验的血常规、血生化数据
Table 7 Blood routine and blood biochemical data of mice in acute toxicity test

项目对照组实验组白细胞数目×10-9/(个·L-1)12.20±3.629.00±3.85单核细胞数目×10-9/(个·L-1)0.53±0.170.47±0.28中性粒细胞数目×10-9/(个·L-1)3.40±1.014.67±2.90红细胞数目×10-12/(个·L-1)9.83±1.8311.18±1.04血红蛋白/(g·L-1)165.33±33.19183.50±16.37血小板数目×10-9/(个·L-1)1 160.67±442.941 221.67±501.24葡萄糖/(mmol·L-1)6.28±1.006.32±1.18胆固醇/(mmol·L-1)4.63±1.304.37±1.08白蛋白/(g·L-1)42.93±2.3140.25±4.36尿素/(mmol·L-1)29.04±6.1828.00±6.81尿酸/(μmol·L-1)171.47±33.57138.94±48.20总胆红/(μmol·L-1)13.69±2.1512.25±2.77谷草转氨酶/(U·L-1)250.64±20.60211.80±42.30谷丙转氨酶/(U·L-1)90.44±6.3484.32±18.09
2.2.3 致畸试验结果
实验过程中孕鼠精神状态良好,饮食、饮水正常。无腹泻、血便,对外界刺激反应正常,毛发光洁白亮,皮肤无破损。胎鼠外观均无异常,未发现四肢缺失或多肢、五官缺失、肛门发育不全等情况。茜素红染液染色观察显示,高剂量组和低剂量组的胎鼠均未发现骨骼畸形变异情况。使用Davidson′s固定液固定后解剖观察,胎鼠内脏发育正常,五官清晰,未见变异或缺失,大脑发育完好。综上所述,在孕期大剂量摄入NC55菌株不会对小鼠胚胎形成和发育造成影响,可视为通过致畸试验。
3 结论
嗜酸乳杆菌作为国内外研究者重视的乳酸菌,被应用于乳品及其他饮品的复配发酵中,具有改善风味,提高肠道乳酸菌定存率的作用,同时也被视为膳食补充剂来预防乃至治疗诸如腹泻、炎症损伤等疾病[31-32]。本研究对一株分离于发酵食品的嗜酸乳杆菌NC55菌株进行了安全性实验,确定菌株的安全性。常用抗生素的MICs检测显示NC55菌株仅对四环素耐药,质粒提取实验证明菌株不存在质粒,不具备通过质粒传播耐药基因的能力;溶血实验表现为不溶血的γ溶血;氨基脱羧实验中未表现氨基脱羧酶活性。动物实验显示,在急性毒性试验和28 d经口毒性试验中NC55菌株实验组各项数据均未与对照组数据之间存在显著差异,致畸试验中胎鼠外观及脏器发育正常,无畸变。
综上所述,嗜酸乳杆菌NC55在各项实验中均表现出良好的安全性,为后续将其开发为益生菌或应用于食品发酵奠定了基础。
[1] 陈潇,吕涵阳,张婧,等.益生菌在食品中应用及健康声称管理现状和分析[J].中国食品卫生杂志,2020,32(4):401-408.
CHEN X, LYU H Y, ZHANG J, et al. Regulation status and analysis of probiotics in food application and their health claims[J]. Chinese Journal of Food Hygiene,2020,32(4):401-408.
[2] 吴蜀豫, 冉陆.FAO/WHO《食品益生菌评价指南》[J].中国食品卫生杂志, 2003, 15(4):377-379.
WU S Y, RAN L.FAO/WHO guidelines for the evaluation of food probiotics[J].Chinese Journal of Food Hygiene, 2003, 15(4):377-379.
[3] LEE N Y, SHIN M J, YOUN G S, et al.Lactobacillus attenuates progression of non alcoholic fatty liver disease by lowering cholesterol and steatosis[J].Clinical and Molecular Hepatology, 2020, 27(1):110-124.
[4] MASOUMI S J, MEHRABANI D, SABERIFIROOZI M, et al.The effect of yogurt fortified with Lactobacillus acidophilus and Bifidobacterium sp. probiotic in patients with lactose intolerance[J].Food Science &Nutrition, 2021, 9(3):1 704-1 711.
[5] SHAO X F, XU B C, CHEN C G, et al.The function and mechanism of lactic acid bacteria in the reduction of toxic substances in food:A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(21):5 950-5 963.
[6] YAN F F, LI N, SHI J L, et al.Lactobacillus acidophilus alleviates type 2 diabetes by regulating hepatic glucose, lipid metabolism and gut microbiota in mice[J].Food &Function, 2019, 10(9):5 804-5 815.
[7] MCFARLAND L V, SHIP N, AUCLAIR J, et al.Primary prevention of Clostridium difficile infections with a specific probiotic combining Lactobacillus acidophilus, L.casei, and L.rhamnosus strains:Assessing the evidence[J].Journal of Hospital Infection, 2018, 99(4):443-452.
[8] 高婧, 姚景慧, 赵秋华, 等.奶酪中抗生素抗性基因检测及奶酪分离乳酸菌耐药性分析[J].南昌大学学报(理科版), 2020, 44(1):63-69;75.
GAO J, YAO J H, ZHAO Q H, et al.Detection of antibiotic resistance gene in cheese and analysis of resistance of lactobacillus isolated from cheese[J].Journal of Nanchang University (Natural Science), 2020, 44(1):63-69;75.
[9] FU J F, ZHONG C Q, ZHANG P P, et al.Novel mobilizable genomic island GEI-D18A mediates conjugational transfer of antibiotic resistance genes in the multidrug-resistant strain Rheinheimera sp.D18[J].Frontiers in Microbiology, 2020, 11:627.
[10] LI Y M, LI L L, KROMANN S, et al.Antibiotic resistance of Lactobacillus spp.and Streptococcus thermophilus isolated from Chinese fermented milk products[J].Foodborne Pathogens and Disease, 2019, 16(3):221-228.
[11] T TH A G, CSABAI I,MAR
TH A G, CSABAI I,MAR TI G, et al.A glimpse of antimicrobial resistance gene diversity in kefir and yoghurt[J].Scientific Reports, 2020, 10(1):22458.
TI G, et al.A glimpse of antimicrobial resistance gene diversity in kefir and yoghurt[J].Scientific Reports, 2020, 10(1):22458.
[12] MOROVIC W, ROPER J M, SMITH A B, et al.Safety evaluation of HOWARU® Restore (Lactobacillus acidophilus NCFM, Lactobacillus paracasei Lpc-37, Bifidobacterium animalis subsp.lactis Bl-04 and B.lactis Bi-07) for antibiotic resistance, genomic risk factors, and acute toxicity[J].Food and Chemical Toxicology, 2017, 110:316-324.
[13] SUEZ J, ZMORA N, SEGAL E, et al.The pros, cons, and many unknowns of probiotics[J].Nature Medicine, 2019, 25(5):716-729.
[14] GALANI I, ADAMOU P, KARAISKOS I, et al.Evaluation of ComASPTM Colistin (formerly SensiTestTM Colistin), a commercial broth microdilution-based method to evaluate the colistin minimum inhibitory concentration for carbapenem-resistant Klebsiella pneumoniae isolates[J].Journal of Global Antimicrobial Resistance, 2018, 15:123-126.
[15] ![]() K, et al.Antimicrobial susceptibility of lactic acid bacteria strains of potential use as feed additives-the basic safety and usefulness criterion[J].Frontiers in Veterinary Science, 2021, 8:687071.
K, et al.Antimicrobial susceptibility of lactic acid bacteria strains of potential use as feed additives-the basic safety and usefulness criterion[J].Frontiers in Veterinary Science, 2021, 8:687071.
[16] ARELLANO K, VAZQUEZ J, PARK H, et al.Safety evaluation and whole-genome annotation of Lactobacillus plantarum strains from different sources with special focus on isolates from green tea[J].Probiotics and Antimicrobial Proteins, 2020, 12(3):1 057-1 070.
[17] ALVAREZ-CISNEROS Y M, FERN NDEZ F J, SAINZ-ESPU
NDEZ F J, SAINZ-ESPU EZ, et al.Assessment of virulence factors, antibiotic resistance and amino-decarboxylase activity in Enterococcus faecium MXVK29 isolated from Mexican chorizo[J].Letters in Applied Microbiology, 2017, 64(2):171-176.
EZ, et al.Assessment of virulence factors, antibiotic resistance and amino-decarboxylase activity in Enterococcus faecium MXVK29 isolated from Mexican chorizo[J].Letters in Applied Microbiology, 2017, 64(2):171-176.
[18] MARXFELD H A, KÜTTLER K, DAMMANN M, et al.Variance of body and organ weights in 28-day studies in mice[J].Regulatory Toxicology and Pharmacology, 2019, 108:104472.
[19] 朱广素, 王刚, 王园园, 等.两株具有缓解代谢综合征功能的人源益生菌的安全性评价[J].食品与发酵工业, 2018, 44(8):57-64.
ZHU G S, WANG G, WANG Y Y, et al.Safety assessment of two probiotic strains with the function of metabolic syndrome alleviation isolated from human gut[J].Food and Fermentation Industries, 2018, 44(8):57-64.
[20] 王楠, 田晗, 张文晓, 等.两株具有潜在益生作用的人源链球菌的安全性评价[J].食品与发酵工业, 2021, 47(5):12-16.
WANG N, TIAN H, ZHANG W X, et al.Safety evaluation of two strains of human Streptococcus with potential probiotics[J].Food and Fermentation Industries, 2021, 47(5):12-16.
[21] 郑鹏, 田亚光, 黄贺.小鼠繁殖行为的观察与分析[J].黑龙江动物繁殖, 2013, 21(3):20-23.
ZHENG P, TIAN Y G, HUANG H.Observation and analysis of reproductive behavior of mice[J].Heilongjiang Journal of Animal Reproduction, 2013, 21(3):20-23.
[22] CRIST BAL-LUNA J M, CORREA-BASURTO J, MENDOZA-FIGUEROA H L, et al.Anti-epileptic activity, toxicity and teratogenicity in CD1 mice of a novel valproic acid arylamide derivative, N-(2-hydroxyphenyl)-2-propylpentanamide[J].Toxicology and Applied Pharmacology, 2020, 399:115033.
BAL-LUNA J M, CORREA-BASURTO J, MENDOZA-FIGUEROA H L, et al.Anti-epileptic activity, toxicity and teratogenicity in CD1 mice of a novel valproic acid arylamide derivative, N-(2-hydroxyphenyl)-2-propylpentanamide[J].Toxicology and Applied Pharmacology, 2020, 399:115033.
[23] DELGADO S, FL REZ A B, MAYO B.Antibiotic susceptibility of Lactobacillus and Bifidobacterium species from the human gastrointestinal tract[J].Current Microbiology, 2005, 50(4):202-207.
REZ A B, MAYO B.Antibiotic susceptibility of Lactobacillus and Bifidobacterium species from the human gastrointestinal tract[J].Current Microbiology, 2005, 50(4):202-207.
[24] 韩慧玲, 李华, 包振江, 等.内蒙古传统发酵乳制品中乳酸菌的分离及其耐药性研究[J].中国酿造, 2022, 41(2):40-47.
HAN H L, LI H, BAO Z J, et al.Isolation and drug resistance of lactic acid bacteria from traditional fermented dairy products in Inner Mongolia[J].China Brewing, 2022, 41(2):40-47.
[25] VIEIR A DE, SOUZA F, ROQUE R, SILVA MOREIRA J L, et al.Transfer of antibiotic resistance determinants between lactobacilli isolates from the gastrointestinal tract of chicken[J].Beneficial Microbes, 2012, 3(2):137-144.
[26] SIRICHOAT A, FL REZ A B, V
REZ A B, V ZQUEZ, L, et al.Antibiotic susceptibility profiles of lactic acid bacteria from the human vagina and genetic basis of acquired resistances[J].International Journal of Molecular Sciences, 2020, 21(7):2594.
ZQUEZ, L, et al.Antibiotic susceptibility profiles of lactic acid bacteria from the human vagina and genetic basis of acquired resistances[J].International Journal of Molecular Sciences, 2020, 21(7):2594.
[27] MA Q Q, PEI Z M, FANG Z F, et al.Evaluation of tetracycline resistance and determination of the tentative microbiological cutoff values in lactic acid bacterial species[J].Microorganisms, 2021, 9(10):2128.
[28] 许女, 李雅茹, 王超宇, 等.传统发酵食品中乳酸菌的抗生素耐药性评估及耐药基因分析[J].中国食品学报, 2020, 20(7):160-171.
XU N, LI Y R, WANG Y C, et al.Antimicrobial resistance evaluation and resistant gene profiles of lactic acid bacteria isolated from traditional fermented foods[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):160-171.
[29] MAYRHOFER S, VAN HOEK A H A M, MAIR C, et al.Antibiotic susceptibility of members of the Lactobacillus acidophilus group using broth microdilution and molecular identification of their resistance determinants[J].International Journal of Food Microbiology, 2010, 144(1):81-87.
[30] CAUWERTS K, PASMANS F, DEVRIESE L A, et al.Cloacal Lactobacillus isolates from broilers often display resistance toward tetracycline antibiotics[J].Microbial Drug Resistance(Larchmont N.Y.), 2006, 12(4):284-288.
[31] LI S C, HSU W F, CHANG J S, et al.Combination of Lactobacillus acidophilus and Bifidobacterium animalis subsp.lactis shows a stronger anti-inflammatory effect than individual strains in HT-29 Cells[J].Nutrients, 2019, 11(5):969.
[32] 薛玉玲, 袁庆彬, 冯丽莉, 等.益生菌饮料改善甲型副伤寒沙门氏菌诱导小鼠腹泻作用研究[J].食品与发酵工业, 2022,48(15):98-101.
XUE Y L, YUAN Q B, FENG L L, et al.Effect of probiotics beverage on relieving diarrhea induced by Salmonella parptyphi A in mice[J].Food and Fermentation Industries, 2022,48(15):98-101.