魔芋葡甘聚糖(konjac glucomannan, KGM)是一种水溶性膳食纤维多糖,具有许多独特的理化性质,如保水性、增稠性等,同时其具有一定的生物活性,对健康有促进作用[1]。花生蛋白(peanut protein, PP)含有多种人体必需氨基酸,是一种优质的蛋白质补充剂;但PP的溶解度较低,持水性、乳化性和凝胶性难以满足实际生产需求,限制了PP在蛋白食品加工领域的应用[2]。魔芋葡甘聚糖与花生蛋白复合或物理改性可以有效弥补花生蛋白的缺点,改善其流变性、乳化特性、热稳定性以及许多其他功能特性[3]。目前关于多糖-蛋白质复合体系的物理改性方法有热处理、高压以及辐照等[4],虽然这些方法能够改善多糖-蛋白质复合体系的理化特性,但存在着时间周期长、营养流失多、高温加工下感官质量下降、成本过高等缺点[5]。而超声波物理改性,既高效又环保,且不需要额外的化学添加剂,在食品成分提取、改性的领域得到了广泛的应用[6]。目前已有一些关于超声处理对多糖蛋白复合物的研究[7-8],在KGM-PP的研究上也大多集中在探究超声处理对KGM-PP的接枝程度以及部分结构的影响[9-10],未有系统地探讨不同超声功率和时间对于KGM-PP流变学特性以及微观结构等方面的研究。
为此,本实验探讨了不同输出功率和处理时间的超声处理对KGM-PP复合体系流变学、乳化性能、热力学、粒径和结构等方面的影响,系统地研究超声对KGM-PP复合体系理化和结构特性;研究结果将拓宽超声技术在多糖-蛋白质复合体系功能性质改善方面的应用,也有望为后期多糖-蛋白质复合体系的研究提供理论参考。
1 材料与方法
1.1 材料与试剂
纯化食品级KGM(纯度>95%),重庆鑫来农产品开发有限公司;PP(凯氏定氮法测定蛋白质含量为75%),河南地新食品有限公司;其他使用的化学试剂均为分析纯,市售。
1.2 仪器与设备
JY99-IIDN超声细胞粉碎机,宁波新芝生物科技股份有限公司;BRUKER全自动射线衍射仪,德国布鲁克有限公司;S-4800 N扫描电子显微镜,日立精密仪器有限公司;Nano-ZS &MPT2激光粒度分析仪,英国马尔文有限公司;DHR-1型流变仪、差示扫描量热仪,美国TA仪器;Niclet-1热重分析仪,美国赛默飞世尔科技公司;HH-2型数显恒温水浴锅,常州奥华仪器有限公司。
1.3 实验方法
1.3.1 KGM/PP复合体系的制备及超声处理
将KGM(10 g/L)和PP(10 g/L)的新鲜样品分散在50 mL超纯水中,在40 ℃条件下以400 r/min搅拌30 min,搅拌完成后冷却至室温,放置于真空冷冻干燥机中冻干处理36 h,将冻干后的样品磨成细小的粉末。
在冰浴中使用超声细胞粉碎机进行处理。设置占空比为50%,即工作时间和间隔时间均为5 s[11]。超声频率为20 kHz,钛合金探头浸入液面以下2 cm处。基于前期实验的研究结果,将一组KGM-PP样品在输出功率为500、600、700、800 W时处理5 min,另一组KGM-PP样品在输出功率为700 W时分别处理5、10、15、20 min。设置非超声组为对照组。
1.3.2 流变特性
流变特性测定方法按照LIU的方法稍加修改[1],流变仪采用直径为40 mm的平行板。将新鲜配制的2 mL的KGM-PP复合体系置于平台上,间隙设为1 000 μm。测量剪切速率从1.0 s-1增加到300.0 s-1时KGM-PP复合体系的表观黏度。当剪切速率稳定在300 s-1时,分析各组的表观黏度。所有的测量过程都在25 ℃下进行,测量前让样品在25 ℃保持2 min。样品边缘用硅油覆盖,以减少测量过程中水分的蒸发。
1.3.3 乳化活性
乳化活性的测定方法根据WANG的方法稍做修改[12],采用浊度法对KGM-PP复合体系的乳化活性指数(emulsifying activity index, EAI)和乳化稳定性指数(emulsification stability index, ESI)进行分析。将1.3.1法制备的新鲜KGM-PP复合体系与大豆油以体积比3∶1混合,25 ℃、10 000 r/min离心2 min。分别从离心管底部取250 μL样品,在静置0、10 min时,用1 g/L的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液将样品稀释100 倍,在500 nm处用分光光度计进行吸光度测定。以水为空白对照,EAI和ESI的计算如公式(1)、公式(2) 所示:
(1)
(2)
式中:DF,稀释系数;C,蛋白质质量浓度,g/mL;θ,豆油体积分数;A0 和A10分别为在0、10 min时测量的复合体系的吸光值。
1.3.4 热重分析(thermogravimetric analysis, TGA)
热重分析按照HUANG等[13]的方法略有改动。称取5 mg的干粉样品放入陶瓷坩埚中,在热分析仪中以20 ℃/min的速率从40 ℃加热到600 ℃,氮气流速为40 mL/min。系统自动记录试样在加热过程中的质量损失,并计算失重率和分解率。
1.3.5 差示扫描量热法(differential scanning calorimetry, DSC)
称取5 mg的干粉样品密封在铝制平底锅中。样品盘在40 mL/min的流动氮气中以10 ℃/min的速率加热,从30 ℃加热到200 ℃[1]。计算起始温度(T0)、峰值温度(Tp)、结束温度(Tc)和吸热焓变(ΔH),以不带样品的铝锅为对照,每个样品重复测量3次。
1.3.6 粒径分析
取1.3.1法制备的新鲜KGM-PP复合体系溶液100 μL,用去离子水稀释500 倍,在25 ℃下测量粒径,光源为He-Ne激光,探测角度为90°,平衡时间为1 800 s[14]。
1.3.7 傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)
将KBr置于105 ℃的烘干箱中烘干24 h,将水分完全去除。将脱水后的KBr与KGM-PP复合体系样品按质量比100∶1混合,轻轻研磨后压成半透明的薄片。测量范围为400~4 000 cm-1,共进行128次扫描,分辨率为4 cm-1,以空气为参考扫描背景[8]。
1.3.8 X射线衍射测量(X-ray diffraction, XRD)
将制备好的冻干样品磨碎,过80目筛。样品的X射线衍射采用X射线衍射仪,在40 kV和30 mA下对10~55 °(2θ)样品的衍射强度进行扫描。扫描速率为4 °/min。扫描步长0.02 °。实验管压力为40 kV,电流为30 mA。选用铜靶和石墨单色仪进行试验[1]。
1.3.9 扫描电子显微镜(scanning electron microscope, SEM)
将KGM-PP复合体系粉末固定在铜样品台上,在真空压力为10-3~ 10-2mmHg,溅射电压为1.1~1.2 kV条件下,镀金约2 min[15]。将涂布后的样品在电压为20 kV的扫描电子显微镜下进行分析,扫描电镜的放大倍数为300倍。
1.4 数据处理
所有测试数据都是从3次重复测量中收集并使用SPSS 18.0进行分析;数据以平均值和标准差表示,P<0.05的水平表示显著性差异;使用Origin 2018绘制图像。
2 结果与分析
2.1 KGM-PP复合体系的黏度分析
KGM-PP复合体系经不同功率和时间的超声处理后,其表观黏度均呈现先增后减的趋势(图1)。随着各处理组功率的增加, 500~700 W处理组的黏度逐渐增加,而800 W处理组黏度下降。600 W和700 W处理组的表观黏度差异不显著,但显著高于其他处理组。当超声功率为600~700 W时,适宜的超声强度使复合体系中蛋白质的结构展开,暴露其内部基团,KGM溶胀后与PP相互作用形成紧密的网络结构,复合体系流动性降低,黏度增加[16];但过高的能量(800 W)可能会阻止KGM和PP的互作交联,KGM-PP复合体系结构被破坏,二者分离导致黏度下降。
在相同的超声功率(700 W)下,随着各组处理时间的延长,复合体系的黏度同样呈现先增后减的趋势。在超声处理时间为5 min时复合体系的黏度最大,说明适当的超声处理时间有利于KGM-PP复合体系交联结构的形成与维持,从而提高其黏度。当超声处理时间延长至10~20 min时,KGM-PP复合体系的黏度大幅度下降,可能是长时间的超声作用产生的空化效应提供大量能量和压力引起多糖或蛋白分子主链中结合较弱的非共价键断裂[17],KGM与PP之间的交联结构破坏,从而导致KGM-PP复合体系的黏度下降。

a-超声功率;b-超声时间
图1 超声对KGM-PP复合体系黏度的影响
Fig.1 Influence of ultrasonic on viscosity of KGM-PP composite system
注:图中不同小写字母表示差异显著(P<0.05)(下同)
2.2 KGM-PP复合体系的乳化性能分析
随着各组超声功率的增加,KGM-PP复合体系的EAI和ESI在0~600 W呈上升趋势,在700~800 W呈下降趋势(图2-a);600 W时KGM-PP复合体系乳化性能达到最佳,EAI和ESI分别提高了75.1%和33.2%。KGM-PP复合体系的乳化性能增强可能与PP溶解性的改变有关[18]。超声处理后,PP内部结构逐渐暴露, PP与KGM的互作增强;同时因PP内部结构变化,亲水性基团增加,更多的PP吸附在油水界面上,提高了复合体系溶解度,导致乳化活性增加[19]。当多糖分子与肽链连接时,空间位阻增加,阻碍了蛋白质在界面上的聚集,导致表面张力降低[7],从而提高了KGM-PP复合体系的乳化稳定性。但是较高功率(>700 W)超声处理可能会导致蛋白质变性,影响分子间的交联反应,从而又导致乳化性能下降[20]。

a-超声功率;b-超声时间
图2 超声对KGM-PP复合体系乳化活性和乳化稳定性的影响
Fig.2 Influence of ultrasonic on emulsifying activity and emulsion stability of KGM-PP composite system
在相同的超声功率(700 W)下,随着各组处理时间的延长,EAI和ESI同样呈先增后减的趋势(图2-b)。KGM-PP复合体系在0~10 min,EAI和ESI增加,超过15 min后,EAI和ESI减少,并在5~10 min时KGM-PP复合体系的乳化性能达到最佳。5~10 min的超声处理使KGM-PP复合体系分散成微小的颗粒,溶解性提高,与水分接触的面积增大,更容易在油水界面被吸收[21]。当超声时间延长至15 min后,KGM-PP复合体系中非共价键被破坏,疏水基团暴露[22],分子之间相互聚集,溶解性下降,KGM部分降解[17],导致乳化性能降低。因此,对KGM-PP复合体系进行5~10 min的超声处理,能够提高其乳化稳定性。
2.3 KGM-PP复合体系的热性能分析
TGA整个过程分为3个阶段(图3)。在40~250 ℃,随着温度的升高,试样中游离水逸出,失重速率较慢,此时超声处理对失重速率影响不大。DTG曲线在100 ℃附近出现了一个小峰。在250~400 ℃,样品重量急剧下降,说明KGM-PP复合体系开始分解,分解速率在300 ℃左右达到最大值,这与HUANG等[13]的研究一致。在400~600 ℃,随着温度的升高,试样失重的下降趋势减缓,这可能是由于材料分解完全,随后的碳化消耗了较大的能量[16]。

a-超声功率;b-超声时间
图3 超声对KGM-PP复合体系的热重和微商热重的影响
Fig.3 The influence of ultrasonic on thermogravimetry and derivative thermogravimetry of KGM-PP composite system
在功率的影响上,各超声功率处理的KGM-PP复合体系的分解速率呈先降低后增加趋势,500~700 W超声功率处理的KGM-PP复合体系分解速率低于对照组,并且分解速率随着功率的增大而减小,表明此时KGM-PP复合体系内部的交联作用不断增强,热稳定性提高,600~700 W时分解速率最小,说明此超声功率范围内KGM-PP复合体系的热稳定性最佳。高超声功率产生的空化效应释放巨大能量高速剪切KGM-PP复合体系,导致其结构被破坏,热稳定性降低[11]。
在超声时间的影响上,各超声时间处理的 KGM-PP复合体系的分解速率均逐渐增大,仍低于对照组;其中处理时间为5 min时分解速率最小,说明此组处理能够更好地改善KGM-PP复合体系的结构,形成更致密的体系,提高KGM-PP复合体系的热稳定性[7]。而当超声时间超过10 min后,长时间的超声处理使KGM和PP分子互作破坏重聚,复合体系内部交联程度减弱,热稳定性下降,分解速率增大[8]。
KGM-PP复合体系的变性温度(Td)在125 ℃左右,高于花生球蛋白的变性温度(约101.5 ℃)[23]。变性温度Td越高,热稳定性越好。因此,KGM-PP复合体系比单独的PP更耐热。在500~700 W,各组的熔融温度(T0)、变性温度(Td)、吸热焓(ΔH)随超声处理功率的增大而升高(表1)。ΔH的值与复合体系内部结构有序度有关。500~700 W处理的KGM-PP复合体系的ΔH值明显高于对照组和800 W处理后的复合体系,表明500~700 W超声功率能够使复合体系的内部结构保持稳定;过高的功率会破坏复合体系内部稳定结构,使其焓值降低。700 W超声处理KGM-PP复合体系的Td在129 ℃左右,显著高于其他超声处理组(500、600、800 W)及对照组。KGM-PP复合体系的热稳定性增强与超声作用下多糖-蛋白质交联结构的形成有关[3]。
表1 KGM-PP复合体系超声前后的DSC参数
Table 1 DSC parameters of KGM-PP composite system before and after ultrasonic
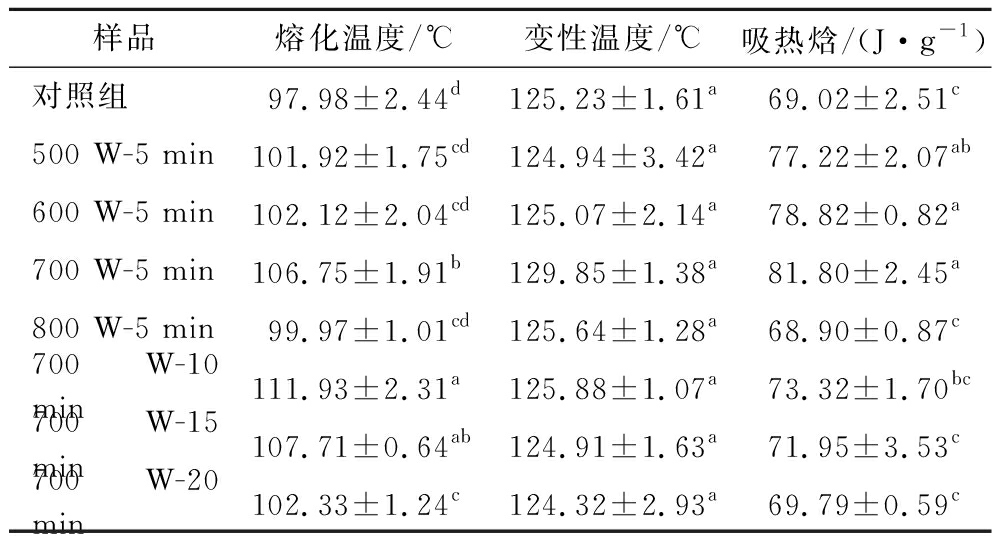
样品熔化温度/℃变性温度/℃吸热焓/(J·g-1)对照组97.98±2.44d125.23±1.61a69.02±2.51c500 W-5 min101.92±1.75cd124.94±3.42a77.22±2.07ab600 W-5 min102.12±2.04cd125.07±2.14a78.82±0.82a700 W-5 min106.75±1.91b129.85±1.38a81.80±2.45a800 W-5 min99.97±1.01cd125.64±1.28a68.90±0.87c700 W-10 min111.93±2.31a125.88±1.07a73.32±1.70bc700 W-15 min107.71±0.64ab124.91±1.63a71.95±3.53c700 W-20 min102.33±1.24c124.32±2.93a69.79±0.59c
注:熔化温度,T0;变性温度,Td;吸热焓,ΔH;同一列中相同小写字母表示差异不显著(P>0.05)(下同)
超声时间在5~20 min内复合体系的Td逐渐降低,热稳定性降低。超声处理5 min时的T0、Td、ΔH达到最大值,此时的KGM与PP分子交联程度较强,内部结构稳定性好,KGM-PP复合体系的热稳定性高。超声处理5 min的ΔH比对照组高了18.5%,说明短时的超声处理能够提高KGM-PP复合体系的热稳定性,但与10~20 min的长时超声处理相比,ΔH分别降低了10.4%、12.0%以及14.7%,差异显著,说明长时超声处理导致KGM-PP复合体系的ΔH逐渐降低,KGM与PP的交联作用减弱,内部结构遭到破坏。
2.4 KGM-PP复合体系的粒径分析
KGM-PP复合体系的粒径主要分布在100~500 nm 和4 000~6 000 nm(图4)。不同超声功率作用下KGM-PP复合体系平均粒径显著减小(表2),说明超声作用能让KGM和PP颗粒分散更均匀,促进KGM和PP分子之间的作用,使其结合更加稳定。随着超声功率的增加,600、700 W处理的KGM-PP复合体系颗粒在100~500 nm的分布比例增加,在4 000~6 000 nm的分布比例减小,可能是600~700 W超声功率产生的空化效应提供能量使KGM-PP复合体系溶液更加均匀,体系向更小的颗粒转移。500、800 W功率超声处理后,体系的平均粒径出现上升趋势,可能是由于低功率的超声能量不足以使复合体系颗粒的界面张力降低,空间结构改变较小,颗粒分散程度不够[15];而高功率的超声能够引起空化效应导致能量大量释放,复合体系的内部结构暴露,颗粒部分聚集,平均粒径增大[18]。此外,过高的超声功率会产生更多的自由基,促进分子间二硫键的形成[12],导致复合物的相对分子质量增加。

a-超声功率;b-超声时间
图4 超声对KGM-PP复合体系粒径分布的影响
Fig.4 The influence of ultrasonic on particle size distribution of KGM-PP composite system
表2 超声前后KGM-PP复合体系的平均粒径
Table 2 Mean size of KGM-PP composite system before and after ultrasonic
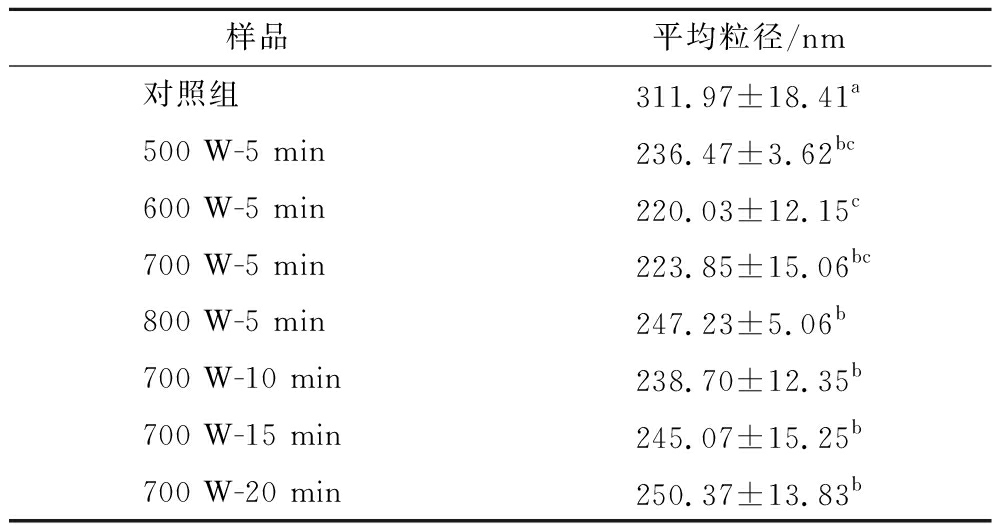
样品平均粒径/nm对照组311.97±18.41a500 W-5 min236.47±3.62bc600 W-5 min220.03±12.15c700 W-5 min223.85±15.06bc800 W-5 min247.23±5.06b700 W-10 min238.70±12.35b700 W-15 min245.07±15.25b700 W-20 min250.37±13.83b
不同时间超声处理KGM-PP复合体系时,其平均粒径均明显低于对照组,意味着超声处理能促进复合体系的颗粒分散更加均匀,使复合体系的结构更加稳定。700 W超声作用5 min后,KGM-PP复合体系在100~500 nm颗粒分布比例显著增加,在4 000~6 000 nm颗粒分布比例显著降低(图4-b)。随着超声时间的延长,KGM-PP复合体系中大颗粒(4 000~6 000 nm)的比例增加,这与SUI等[20]的研究结果一致。长时间的超声作用改变了蛋白质的二级结构,导致蛋白质表面的内部疏水性基团暴露,通过疏水作用导致蛋白质表面疏水性增加,蛋白质分子与魔芋葡甘聚糖分子聚集形成较大的分子簇,颗粒尺寸变大[6]。
2.5 KGM-PP复合体系的FTIR比较分析
KGM-PP复合体系在3 354 cm-1附近有一个宽而强的吸收峰(图5),这主要归因于N—H或O—H键的伸缩振动,该结果有助于分析KGM与PP之间的相互作用[24]。2 926 cm-1附近的吸收峰与甲基、甲基烯中C—H的伸缩振动有关;1 645 cm-1处的吸收峰与C![]() O键或C
O键或C![]() N键有关;N—H平面的弯曲振动和C—N键的伸缩振动导致了1 542 cm-1处吸收峰的产生;1 064 cm-1的吸收峰与C—H键(芳香结构面外)的弯曲振动有关。在896 cm-1左右的吸收峰可能代表一种葡甘聚糖链[17],该吸收峰在超声处理前后的变化不大,说明超声处理并没有改变葡甘聚糖的基本结构。在测定波长范围内没有产生新的吸收峰,表明KGM-PP复合体系[18]的官能团结构没有被破坏,也没有形成新的官能团;但吸收峰的强度发生了显著变化,部分峰的吸收强度发生了偏移(表3)。
N键有关;N—H平面的弯曲振动和C—N键的伸缩振动导致了1 542 cm-1处吸收峰的产生;1 064 cm-1的吸收峰与C—H键(芳香结构面外)的弯曲振动有关。在896 cm-1左右的吸收峰可能代表一种葡甘聚糖链[17],该吸收峰在超声处理前后的变化不大,说明超声处理并没有改变葡甘聚糖的基本结构。在测定波长范围内没有产生新的吸收峰,表明KGM-PP复合体系[18]的官能团结构没有被破坏,也没有形成新的官能团;但吸收峰的强度发生了显著变化,部分峰的吸收强度发生了偏移(表3)。

a-超声功率不同;b-超声时间不同
图5 KGM-PP复合体系的傅里叶红外光谱图
Fig.5 Fourier infrared spectroscopy of KGM-PP composite system
KGM-PP复合体系的透射率随着超声功率增加呈先减后增趋势(表3)。500~700 W处理组在不同波峰的透射率均比对照组小,表明该功率处理的复合体系吸收强度几乎全部增加,而800 W处理组的透射率有所增加,表明该功率处理的复合体系吸收强度减小。500~600 W处理的KGM-PP复合体系在3 354 cm-1左右的吸收峰增强,这可能是因为PP与KGM分子通过氢键不断交联,加剧了N—H或O—H键的伸缩振动。该范围的超声功率能促进PP的二级结构从β-折叠转变到α-螺旋,α-螺旋的相对含量增加表明PP内部有更多的疏水基团暴露,KGM-PP复合体系的稳定性增强,这与李可等[25] 的研究结论一致。当超声功率超过600 W后,蛋白质二级结构部分变性,PP分子中C—H等键断裂,导致2 926、1 542 cm-1波峰的透射率升高;但此时KGM-PP复合体系交联更加紧密,内部形成的氢键占据主导地位[21],最终体现为KGM-PP复合体系的吸收强度仍增加。800 W的功率下KGM与PP分子之间化学键断裂,静电斥力增加,KGM-PP复合体系交联结构被破坏,导致吸收强度降低。
表3 KGM-PP复合体系的红外透射率
Table 3 Infrared transmittance of KGM-PP composite system
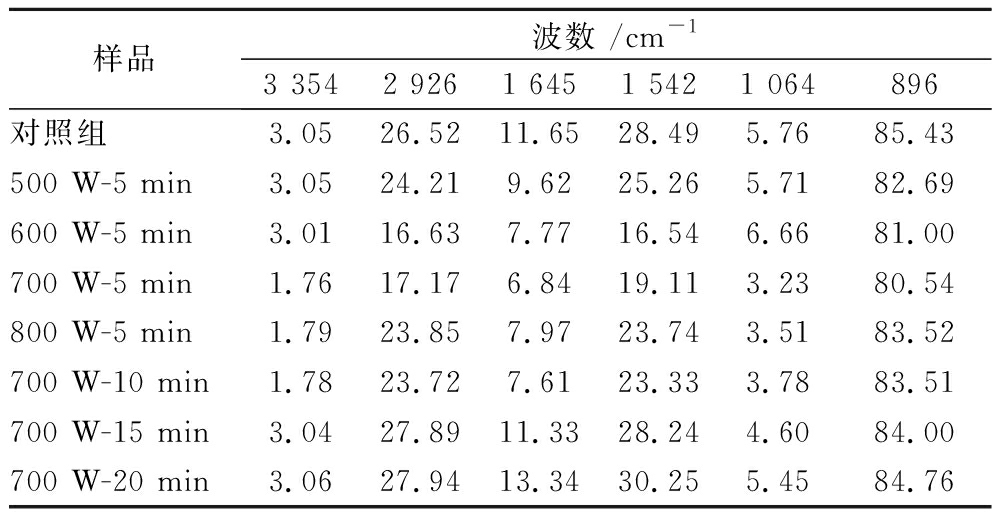
样品波数 /cm-13 3542 9261 6451 5421 064896对照组3.0526.5211.6528.495.7685.43500 W-5 min3.0524.219.6225.265.7182.69600 W-5 min3.0116.637.7716.546.6681.00700 W-5 min1.7617.176.8419.113.2380.54800 W-5 min1.7923.857.9723.743.5183.52700 W-10 min1.7823.727.6123.333.7883.51700 W-15 min3.0427.8911.3328.244.6084.00700 W-20 min3.0627.9413.3430.255.4584.76
KGM-PP复合体系的透射率随着超声处理时间延长呈先减后增趋势。超声处理5 min的KGM-PP复合体系在1 645 cm-1处的吸收强度较高,说明蛋白质的二级结构更多的向α-螺旋或随机螺旋方向转变[15],但随着超声时间从10 min延长到20 min,1 645 cm-1处的吸收强度降低,蛋白质二级结构向α-螺旋或随机螺旋方向转变减少。蛋白质的二级结构在很大程度上取决于氨基酸序列以及氨基酸与其他分子之间的相互作用。因此,很可能是超声引起了PP中二级结构的变化,并影响了KGM与PP之间的相互作用,导致KGM与PP的互作交联被破坏,稳定性降低。
2.6 KGM-PP复合体系的XRD比较分析
如图6所示,KMG-PP复合体系在20.4°左右出现衍射峰,表明KGM-PP复合体系为非晶相结构[25];总体上超声处理组的衍射峰强度均低于对照组。随着超声功率的增加,衍射峰强度呈先减后增的趋势。衍射峰的强度在700 W时达到最小,此时KGM与PP分子的相互缠联最紧密,PP分子可以得到更好的延伸,其内部基团暴露,并与KGM的反应位点产生更多的相互作用和交联,导致蛋白质晶体结构改变,某些结构的特征衍射峰强度降低。600、700 W处理的KGM-PP复合体系的衍射峰强度低于其他组(500、800 W)。推测800 W的高功率对蛋白质分子的内部结构作用力影响较大, KGM与PP之间的非共价键破裂,导致蛋白质分子与KGM的结合不再紧密,衍射峰强度重新增加[26]。

a-超声功率不同;b-超声时间不同
图6 KGM-PP复合体系的XRD衍射图
Fig.6 XRD curve of KGM-PP composite system
随着超声处理时间的延长,5 min处理组的 KGM-PP复合体系衍射峰的强度最低,这可能是由于适宜的短时超声处理能够有效促进KGM-PP复合体系内部交联结构的形成。当超声处理时间超过5 min后, KGM-PP复合体系交联结构被逐渐破坏,相互作用发生改变,内部结构无法继续维持[27];超声所产生的大量能量将KGM-PP复合体系中部分的花生蛋白或者魔芋葡甘聚糖分子相互聚集形成单一的集团导致其衍射峰强度增大[28]。
2.7 KGM-PP复合体系的微观结构分析
KGM-PP复合体系的三维网络微观结构与其质构、感官、乳化等功能性能有关,SEM为KGM-PP复合体系微观结构的变化提供了直接的物理证据(图7)。未经处理的KGM-PP复合体系形成了具有大孔洞和丝状结构的三维多孔网络(图7-a)。在500~700 W的超声功率作用下,KGM-PP复合体系的微观交联结构比对照组更致密,孔洞也更小,表明其结构更完整,分子间相互作用更强(图7-b~图7-d)。当超声功率达到800 W时,KGM-PP复合体系的均匀连接结构被分离,大孔隙再次出现。已有研究表明,适当的超声功率可显著改变了某些多糖蛋白复合体系的二级结构,促进了蛋白分子中α-螺旋、β-折叠、随机卷曲等结构的转化,使KGM-PP复合体系的结构交联更加紧密[6]。而高强度超声作用减弱了蛋白质的内键合效应或使蛋白质因疏水相互作用而聚集,从而破坏了复合体系均匀的三维结构[29]。SEM图像表明,相对较低强度的超声处理可以增强魔芋葡甘聚糖和花生蛋白之间的相互作用,形成更稳定的交联结构,这与FTIR和XRD结果一致。

a~g分别是空白对照以及500 W-5 min、600 W-5 min、700 W-5 min、800 W-5 min、700 W-10 min、700 W-15 min、700 W-20 min超声处理后的扫描电镜照片
图7 KGM-PP复合体系扫描电镜图
Fig.7 SEM of KGM-PP composite system
超声处理5 min后,三维孔状结构更加密集,孔的直径减小,孔数增加(图7-a,图7-d)。这表明KGM-PP分子间的交联更加紧密,结构更加稳定[12]。超声处理10 min时,孔的直径增大,数量增多,结构变得无序(图7-f),表明此时KGM-PP复合体系分子之间的缠结程度降低,交联结构被破坏。且随着超声时间的延长,超声处理15~20 min时,KGM-PP复合体系的三维结构与大孔部分分离(图7-g,图7-h),结构破坏更多,孔洞的直径变更大,部分坍塌成薄壁,可能是长时间的超声作用使交联结构被破坏后游离单一的KGM或者PP聚集而成的[28]。过长超声处理对KGM与PP分子间缔合有不利影响,这与XRD的结果一致。
3 结论
超声处理是目前较为热门的一种多糖-蛋白复合体系的改性技术。在一定的超声功率和超声时间范围内,超声处理能够促进KGM与PP的分子间相互作用,增强KGM与PP的交联性,使得KGM-PP复合体系的流变性、乳化性能、热稳定性得到改善。适当的超声处理能够提高KGM-PP复合体系的表观黏度,降低其平均粒径,使其基体分布更加均匀,分子之间的结合更加紧密,利于维持KGM-PP复合体系的稳定性。超声作用可改变PP的二级结构,使其更多的向α-螺旋方向转变,增强KGM与PP之间的交联。高功率和长时间的超声处理导致复合体系的内部结构被破坏,蛋白质因疏水作用变性聚集,KGM分子间的糖苷键部分断裂,KGM和PP分子间的缔合作用减弱,导致KGM-PP复合体系结构被破坏,稳定性降低。超声处理对KGM-PP复合体系乳化性能、热稳定等性能的改善,可用于拓宽多糖-蛋白复合体系制作蛋白质复合饮料的应用并解决乳饮料的分层问题,以及确定蛋白食品热加工的最佳工艺条件等。后期可进一步研究超声处理后KGM-PP复合体系的生物活性和营养特性,以期为我国多糖-蛋白基食品的创新提供更多的理论参考。
[1] LIU Y Q, CHEN Q L, FANG F, et al.The influence of konjac glucomannan on the physicochemical and rheological properties and microstructure of canna starch[J].Foods(Basel,Switzerland), 2021, 10(2):422.
[2] LI J G, WU M M, WANG Y T, et al.Effect of pH-shifting treatment on structural and heat induced gel properties of peanut protein isolate[J].Food Chemistry, 2020, 325:126921.
[3] 汪少芸, 冯雅梅, 伍久林, 等.蛋白质-多糖多尺度复合物结构的形成机制及其应用前景[J].食品科学, 2021, 42(17):1-9.
WANG S Y, FENG Y M, WU J L, et al.Formation mechanism of protein-polysaccharide multi-scale complexes and their future applications[J].Food Science, 2021, 42(17):1-9.
[4] NIKBAKHT NASRABADI M, SEDAGHAT DOOST A, MEZZENGA R.Modification approaches of plant-based proteins to improve their techno-functionality and use in food products[J].Food Hydrocolloids, 2021, 118:106789.
[5] JAYATHUNGE K G L R, STRATAKOS A C, DELGADO-PANDO G, et al.Thermal and non-thermal processing technologies on intrinsic and extrinsic quality factors of tomato products:A review[J].Journal of Food Processing and Preservation, 2019, 43(3):13901.
[6] 李侠. 超声波协同酶交联改善花生蛋白凝胶性的研究[D].郑州:河南工业大学, 2020.
LI X.Study on improving gelation of peanut protein by ultrasonic and enzyme cross-linking[D].Zhengzhou:Henan University of Technology,2020.
[7] CUI Q, ZHANG A Q, LI R, et al.Ultrasonic treatment affects emulsifying properties and molecular flexibility of soybean protein isolate-glucose conjugates[J].Food Bioscience, 2020, 38:100747.
[8] ZHAO C B, YIN H H, YAN J N, et al.Structure and acid-induced gelation properties of soy protein isolate-maltodextrin glycation conjugates with ultrasonic pretreatment[J].Food Hydrocolloids, 2021, 112:106278.
[9] LI C, XUE H R, CHEN Z Y, et al.Comparative studies on the physicochemical properties of peanut protein isolate-polysaccharide conjugates prepared by ultrasonic treatment or classical heating[J].Food Research International, 2014, 57:1-7.
[10] LI C, HUANG X J, PENG Q, et al.Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J].Ultrasonics Sonochemistry, 2014, 21(5):1 722-1 727.
[11] ZHANG B, XIAO Y W, WU X N, et al.Changes in structural, digestive, and rheological properties of corn, potato, and pea starches as influenced by different ultrasonic treatments[J].International Journal of Biological Macromolecules, 2021, 185:206-218.
[12] WANG Y T, WANG Y J, LI K, et al.Effect of high intensity ultrasound on physicochemical, interfacial and gel properties of chickpea protein isolate[J].LWT, 2020, 129:109563.
[13] HUANG Y L, GUO J, ZHANG J.Physicochemical and antioxidant properties of Potentilla anserina L.polysaccharides affected by ultrasonication[J].Applied Sciences, 2020, 10(13):4 510.
[14] 叶钰, 高金燕, 陈红兵, 等.超声波加工对蛋清蛋白质结构和凝胶特性的影响[J].食品科学, 2018, 39(21):45-52.
YE Y,GAO J Y,CHEN H B, et al.Effect of ultrasonic processing on protein structure and gel properties of egg white[J].Food Science, 2018, 39(21):45-52.
[15] ZHOU G W, LIU J N, WANG G R, et al.Effect of ultrasonic treatment on freeze-thaw stability of soy protein isolate gel[J].Journal of Oleo Science, 2019, 68(11):1 113-1 123.
[16] ZHANG L, ZENG L R, WANG X, et al.The influence of Konjac glucomannan on the functional and structural properties of wheat starch[J].Food Science &Nutrition, 2020, 8(6):2 959-2 967.
[17] LI J, LI B, GENG P, et al.Ultrasonic degradation kinetics and rheological profiles of a food polysaccharide (konjac glucomannan) in water[J].Food Hydrocolloids, 2017, 70:14-19.
[18] XIONG Y, LI Q R, MIAO S, et al.Effect of ultrasound on physicochemical properties of emulsion stabilized by fish myofibrillar protein and xanthan gum[J].Innovative Food Science &Emerging Technologies, 2019, 54:225-234.
[19] ZHANG Q T, TU Z C, XIAO H, et al.Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J].Food and Bioproducts Processing, 2014, 92(1):30-37.
[20] SUI X N, BI S, QI B K, et al.Impact of ultrasonic treatment on an emulsion system stabilized with soybean protein isolate and lecithin:Its emulsifying property and emulsion stability[J].Food Hydrocolloids, 2017, 63:727-734.
[21] NAZARI B, MOHAMMADIFAR M A, SHOJAEE-ALIABADI S, et al.Effect of ultrasound treatments on functional properties and structure of millet protein concentrate[J].Ultrasonics Sonochemistry, 2018, 41:382-388.
[22] PAN J F, LIAN H L, JIA H, et al.Ultrasound treatment modified the functional mode of gallic acid on properties of fish myofibrillar protein[J].Food Chemistry, 2020, 320:126637.
[23] HU X, ZHAO M M, SUN W Z, et al.Effects of microfluidization treatment and transglutaminase cross-linking on physicochemical, functional, and conformational properties of peanut protein isolate[J].Journal of Agricultural and Food Chemistry, 2011, 59(16):8 886-8 894.
[24] LI Q R, WANG P S, MIAO S, et al.Curdlan enhances the structure of myosin gel model[J].Food Science &Nutrition, 2019, 7(6):2 123-2 130.
[25] 李可, 李三影, 杜曼婷,等.超声处理对类PSE鸡肉分离蛋白结构和乳化特性的影响[J].食品科学, 2021, 42(23):114-122.
LI K,LI S Y,DU M T, et al.Effect of ultrasonic treatment on the structure and emulsifying properties of PSE (pale, soft and exudative)-like chicken meat protein isolate[J].Food Science, 2021, 42(23):114-122.
[26] SU J F, HUANG Z, YUAN X Y, et al.Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible films crosslinked by Maillard reactions[J].Carbohydrate Polymers, 2010, 79(1):145-153.
[27] QIAO D L, WANG Z, CAI C, et al.Tailoring multi-level structural and practical features of gelatin films by varying konjac glucomannan content and drying temperature[J].Polymers, 2020, 12(2):385.
[28] YUAN D, MENG H C, HUANG Q, et al.Preparation and characterization of chitosan-based edible active films incorporated with Sargassum pallidum polysaccharides by ultrasound treatment[J].International Journal of Biological Macromolecules, 2021, 183:473-480.
[29] 薛艾莲, 李春翼, 王启明, 等.超声处理对麦醇溶蛋白/芦丁相互作用及结构特性的影响[J].食品科学, 2022,43(7):45-51.
XUE A L,LI C Y,WANG Q M, et al.Effect of ultrasonic treatment on the interaction structural properties of gliadin-rutin complex[J].Food Science, 2022,43(7):45-51.