淀粉作为众多食品的主要成分,是人类饮食中的主要能量来源。小麦淀粉(wheat starch, WS)是食品加工过程中常用的一种原料,因其成本低廉,而被广泛应用于面条、饼干、面包、蛋糕等食品中[1]。然而,由于天然小麦淀粉具有水合性能差、热稳定性低、抗剪切性低和易回生等缺陷,因此需要通过对其进行改性以满足某些食品的加工要求。目前,淀粉改性可以通过3种方法实现,即物理改性、化学改性和酶改性[2]。其中,物理改性是相对安全且产生较少污染的方法,已受到大家广泛的关注[3]。
韧化(annealing, ANN)是一种常用的淀粉物理改性方法,通常在过量水分含量(>40%)和相对较低的温度(高于玻璃化转变温度但低于糊化温度)下进行[4]。ANN条件相对温和,仅涉及水和热,因此受到广泛关注[5]。韧化后淀粉的结构和功能特性发生了变化,使其更易于加工和使用。
等离子体活化水(plasma-activated water, PAW)是蒸馏水经等离子放电处理得到的一种活性水,具有较好的流动性和均一性。等离子放电可以产生大量的活性氧和活性氮,使PAW呈酸性,氧化还原电位增加,导电性增强。PAW独特的理化性质使其在食品和农业领域应用广泛[6]。然而,目前PAW在淀粉改性领域研究较少[7],尚需进一步深入研究。
本研究首次将PAW与ANN联合用于WS改性,研究了改性后WS的结构及性质的变化规律。PAW-ANN避免了改性中化学物质或生物酶的使用,仅采用了等离子体、水和热,具有绿色、安全、无二次污染等优点。该研究既提出了一种淀粉韧化处理的新方式,也进一步扩展了PAW在淀粉改性中的应用,为PAW韧化的应用奠定了理论基础。
1 材料与方法
1.1 材料与试剂
小麦淀粉,郑州特正商贸公司;无水乙醇(分析纯),天津富宇精细化工有限公司。
1.2 仪器与设备
TS-PL200空气常压等离子体射流装置,深圳市东信高科自动化设备有限公司;JSM-6490LV型扫描电子显微镜,日本电子株式会社;BX53M偏光显微镜,日本奥林巴斯公司;Bruker D8型X-射线衍射仪、Vertex70型傅里叶变换红外光谱仪,德国布鲁克公司;Invia Qontor型激光共聚焦显微拉曼光谱仪,英国Renishaw公司;Q20差示扫描量热仪,美国TA公司;RVA4500快速黏度分析仪,瑞典波通公司;Discovery HR-1旋转流动仪,美国TA公司。
1.3 实验方法
1.3.1 等离子体活化水的制备
将100 mL蒸馏水(distilled water,DW)置于圆柱形瓶中,等离子体探头与水面的距离为2 cm。电源高频25 kHz,输入功率750 W,经等离子体射流处理2 min得到PAW。
1.3.2 小麦淀粉DW-ANN或PAW-ANN改性
将小麦淀粉(30 g,干基)在45 ℃的烘箱中干燥24 h,使其水分含量降至约5%。分别用DW或PAW将淀粉水分含量调节至60%;充分搅拌后放入反应釜中,在50 ℃烘箱中加热12 h后取出,洗涤,研磨,过筛。DW-ANN和PAW-ANN改性小麦淀粉样品分别用DW-WS和PAW-WS表示。
1.3.3 扫描电子显微镜(scanning electron microscopy,SEM)
测试前用导电胶粘取适量淀粉样品,进行喷金处理。测试所用电压为20 kV,然后将载物台放入扫描电子显微镜下观察,并以1 500的放大倍数拍摄图片。
1.3.4 偏光显微镜(polarization light microscopy,PLM)
将淀粉放入混合液V(丙三醇)∶V(水)=1∶1中配成1%的乳液。测试时,加一滴于载玻片上,在偏光显微镜下观察并以200的放大倍数拍摄偏光十字图片。
1.3.5 X-射线衍射(X-ray diffraction,XRD)
测试前,所有淀粉样品需在室温下用饱和NaCl溶液平衡水分1周[8]。用Burker D8型X-射线衍射仪测定,测试条件:管压为40 kV,管流为30 mA,扫描速度为2°/min,扫描区域为5°~35°,扫描步长为0.02°,扫描方式为连续。用Jade 6.0计算样品的相对结晶度(relative crystallinity,RC)。
1.3.6 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)
将溴化钾置于105 ℃烘箱烘干后,取一定量的样品和溴化钾(质量比为1∶100),混合并充分研磨均匀,压片。测试条件:扫描波数为4 000~400 cm-1,分辨率为4 cm-1,扫描时间为64 s。使用OMNIC 8.2软件分析所得数据。
1.3.7 拉曼光谱
采用激光共聚焦显微拉曼光谱仪测定,激光光源为波长785 nm的绿色二极管。测试条件:输出功率为150 W,扫描次数为1次,曝光时间为10 000 ms,光谱扫描范围为3 000~300 cm-1。使用Wire 5.4软件计算479 cm-1处特征峰的半高峰宽(full width at half maxima, FWHM),以表征淀粉的短程有序结构。
1.3.8 差示扫描量热仪(differential scanning calorimetry,DSC)
称取3 mg(干基)样品于铝盘中,加入蒸馏水至样品总重12 mg,密封后于室温下平衡24 h。测试时用空的铝盘作为参照,在30~120 ℃内以10 ℃/min的速度进行扫描。用TA2000分析软件获得淀粉的热力学参数。
1.3.9 快速黏度分析仪(rapid viscosity analysis,RVA)
称取3 g(干基)淀粉样品于铝罐中,加蒸馏水至总质量为28 g。使用RVA标准程序1进行测试:将天然和改性淀粉浆液在50 ℃下平衡1 min,在222 s内加热至95 ℃,然后在95 ℃下保持150 s,在228 s内冷却至50 ℃,然后在50 ℃下平衡2 min。在此过程中,桨叶的速度在前10 s保持在960 r/min,随后保持在160 r/min。黏度曲线和各种糊化特性参数通过RVA系统软件获得。
1.3.10 旋转流变仪
通过旋转流动仪获得淀粉样品的动态流变学性质。将通过1.3.9中所得淀粉糊转移到流变仪板(直径40 mm,间隙1 000 μm)上,在25 ℃下平衡5 min后进行流变测试。在1%应变下进行0.1~20 Hz的频率范围扫描,并记录得到的储能模量(G′)、损耗模量(G″)和损耗因子(tanδ:G″/G′)。
1.4 数据处理
所有试验数据重复3次,使用IBM SPSS Statistics 26.0软件程序Duncan检验法进行显著性分析(P<0.05),所得结果用平均值±标准差表示。本研究均采用Origin 9.0软件作图。
2 结果与分析
2.1 PAW-ANN对小麦淀粉颗粒形貌的影响
2.1.1 SEM分析
天然和ANN改性小麦淀粉的SEM图像如图1所示。天然小麦淀粉大部分呈球形,大小不一,表面光滑。经过ANN改性后,DW-WS和PAW-WS大部分淀粉颗粒形状未发生明显变化,仅PAW-WS中有少许小麦淀粉颗粒发生变形。

a-WS;b-DW-WS;c-PAW-WS
图1 天然和ANN改性小麦淀粉的SEM图(×1 500)
Fig.1 SEM images (×1 500) of native and ANN-modified WS
2.1.2 PLM分析
天然和ANN改性小麦淀粉的PLM图像如图2所示。淀粉颗粒显示特征性的双折射模式(“马耳他十字”),双折射的强度与晶粒的整体尺寸、相对结晶度和微晶取向有关[9]。由图2可知,天然小麦淀粉的极化交叉完整且明显,经过ANN处理后小麦淀粉的双折射强度有所增强,而DW-WS和PAW-WS间未见明显差异。

a-WS;b-DW-WS;c-PAW-WS
图2 天然和ANN改性小麦淀粉的偏光显微镜图(×200)
Fig.2 PLM images (×200) of native and ANN-modified WS
2.2 PAW-ANN对小麦淀粉结晶结构的影响
天然和ANN改性小麦淀粉的XRD图谱如图3所示。由图3可知,WS、DW-WS和PAW-WS在2θ=15.1°、17.1°、18.0°、23.2°处均出现相同的特征衍射峰,同属于A型淀粉结构[10],这表明经过ANN处理后,小麦淀粉的结晶结构类型没有发生变化。由表1看出,ANN改性小麦淀粉的RC都高于天然小麦淀粉,这可能是因为韧化使最初弱或不完美的微晶逐渐消失,而剩余的微晶由于熔化和再结晶而变得更加完美[11]。此外,PAW-WS的RC高于DW-WS,表明在韧化过程中,PAW可以提高小麦淀粉的RC。这可能是PAW中的酸性成分先水解无定形区域,使得水解淀粉微晶获得更好的取向[12]。这一结果与以前研究也是相一致的,即短时间的弱酸水解主要影响淀粉的无定形区域,导致残留淀粉的结晶度更高[13]。
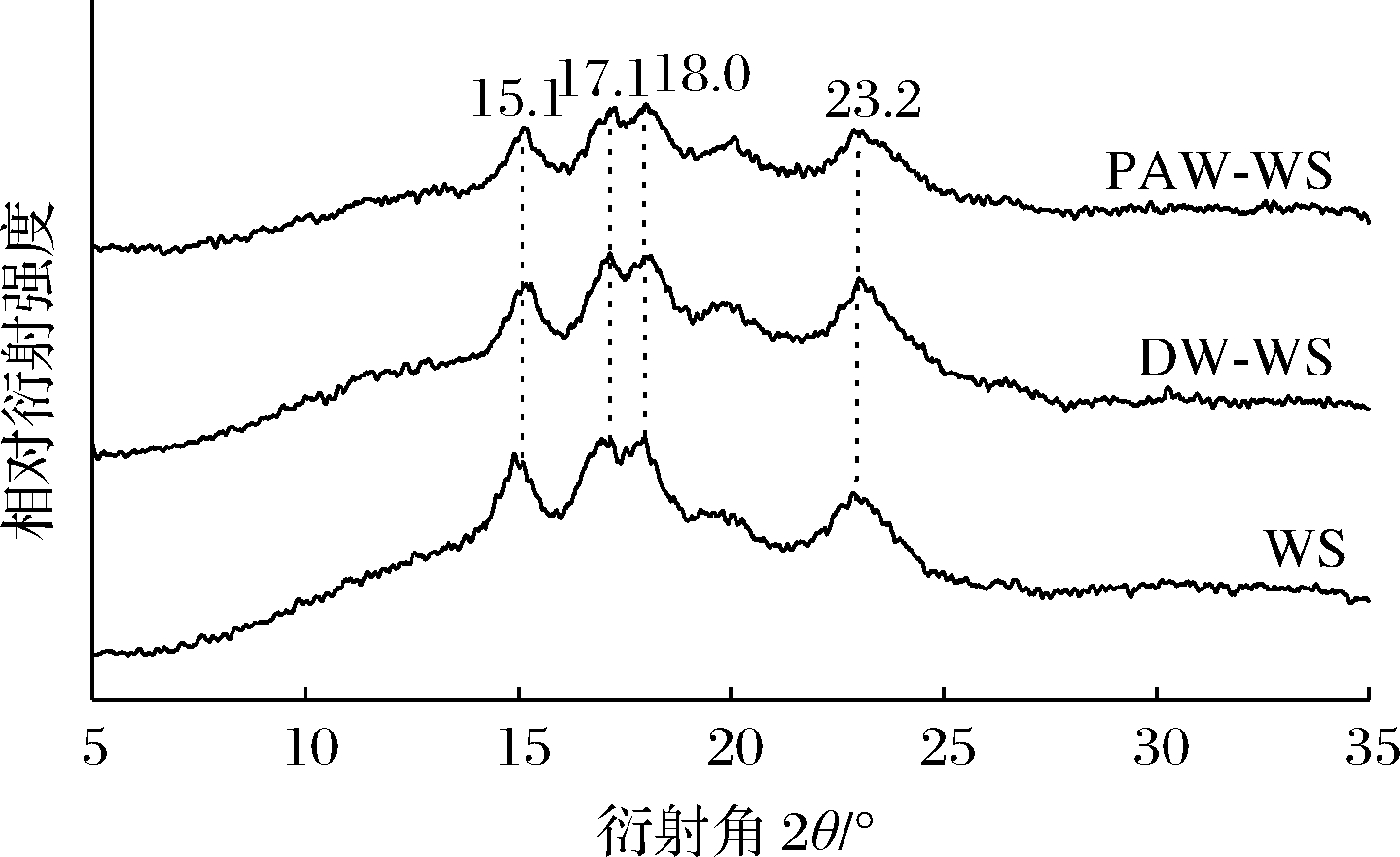
图3 天然和ANN改性小麦淀粉的X射线衍射图谱
Fig.3 XRD patterns of native and ANN-modified WS
表1 天然和ANN改性小麦淀粉的RC、R1 047/1 022和FWHM
Table 1 RC,R1 047/1 022, and FWHM of native and ANN-modified WS
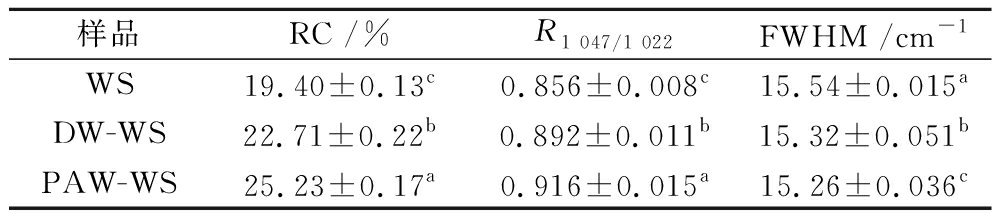
样品RC /%R1 047/1 022FWHM /cm-1WS19.40±0.13c0.856±0.008c15.54±0.015aDW-WS22.71±0.22b0.892±0.011b15.32±0.051bPAW-WS25.23±0.17a0.916±0.015a15.26±0.036c
注:数值为平均值±标准差,列中不同字母表示显著性差异(P<0.05)(下同)
2.3 PAW-ANN对小麦淀粉分子结构及短程有序性的影响
2.3.1 FTIR分析
天然和ANN改性小麦淀粉的FTIR谱图如图4所示。WS、DW-WS和PAW-WS样品的红外光谱均显示出相同的特征峰,这表明韧化过程中没有形成新的官能团。3 413 cm-1处宽的吸收峰是羟基伸缩振动的特征峰[14],2 934 cm-1处的特征峰归因于C—H伸缩振动[15],1 646 cm-1特征峰归因于淀粉无定形区域中水分子的—OH的剪切振动[16],1 156、1 081、1 018 cm-1处的特征峰分别对应于不对称的C—O—C、C—O和C—C骨架伸缩振动[17]。
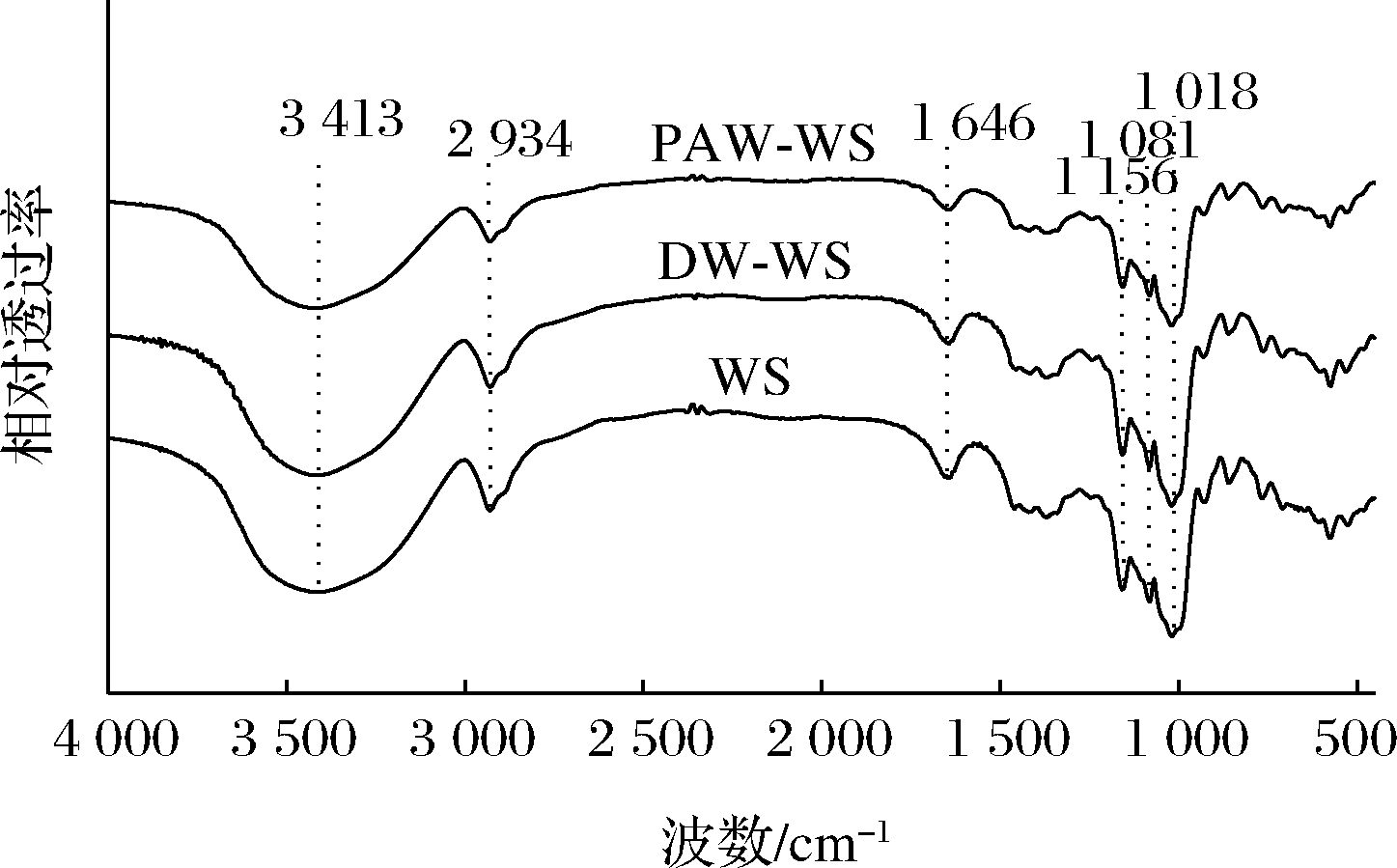
图4 天然和ANN改性小麦淀粉的红外光谱图
Fig.4 FTIR spectrogram of native and ANN-modified WS
1 047 cm-1和1 022 cm-1处的红外特征峰分别与淀粉的有序结构和无序结构密切相关,两者吸光度比值(R1 047/1 022)可以反应淀粉分子的短程有序性[18]。从表1得出,PAW-WS的R1 047/1 022高于WS和DW-WS,这可能是由于韧化过程中存在的高水分含量和适中的热能可以导致更有效的双螺旋堆积[19]。此外,PAW的酸性成分和活性物质会影响淀粉的无定形区域,导致无定形区减少,并产生更多的短直链淀粉以形成新的双螺旋结构,从而提高R1 047/1 022[20]。R1 047/1 022比值结果与XRD的RC结果一致。
2.3.2 Raman光谱分析
天然和ANN改性小麦淀粉的Raman光谱如图5所示。WS、DW-WS和PAW-WS的光谱显示出相似的趋势,表明没有形成新的官能团。2 918 cm-1特征峰归因于C—H伸缩振动[21],1 500~800 cm-1谱带属于淀粉的指纹区,1 345 cm-1、1 267 cm-1、1 123 cm-1、944 cm-1和868 cm-1分别为C—OH弯曲振动、CH2变形振动、C—O伸缩振动、C1—O—C4'对称伸缩振动和C—H变形振动[22],479 cm-1处的强谱带为淀粉的吡喃环骨架振动区域[23]。

图5 天然和ANN改性小麦淀粉的拉曼光谱图
Fig.5 Raman spectrogram of native and ANN-modified WS
在479 cm-1处吸收峰的FWHM可用来表征淀粉的短程有序性,FWHM越低,淀粉的短程有序性越高[24]。由表1可知,ANN改性小麦淀粉的FWHM均低于天然淀粉,其中PAW-WS的FWHM最低,这说明PAW-ANN增强了小麦淀粉的短程有序性,与FTIR的R1 047/1 022和XRD的RC结果基本一致。
2.4 PAW-ANN对小麦淀粉热力学性质的影响
天然和ANN改性小麦淀粉的DSC曲线如图6所示。所有淀粉样品都呈现出一个相似的吸热峰,这是典型的淀粉糊化峰,具体热力学参数见表2。由表2可知,ANN改性后小麦淀粉的糊化温度To、Tp和Tc均明显升高,这可能是由于韧化增强了直链淀粉与直链淀粉或支链淀粉之间的相互作用,抑制了颗粒膨胀并延迟了糊化[25]。而DW-WS与PAW-WS间糊化温度未见显著差异。淀粉糊化焓ΔH的变化通常反映了淀粉内部双螺旋含量的变化[26]。DW-ANN改性后,小麦淀粉的糊化焓值ΔH从6.63 J/g增加到7.47 J/g,PAW-ANN改性后ΔH进一步增加至7.77 J/g。ΔH的增加是由于淀粉分子中双螺旋结构含量增加所导致的,这与XRD、FTIR和Raman结果完全一致。
表2 天然和ANN改性小麦的热力学性质
Table 2 Thermal properties of native and ANN-modified WS
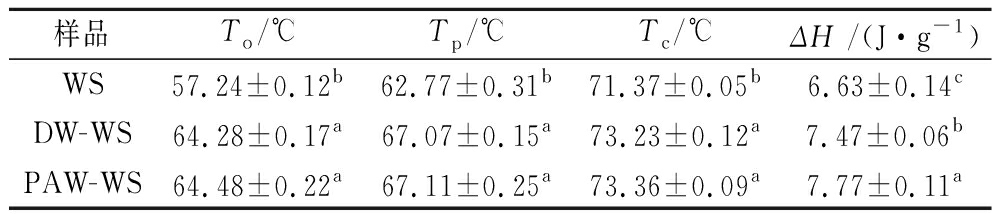
样品To/℃Tp/℃Tc/℃ΔH /(J·g-1)WS57.24±0.12b62.77±0.31b71.37±0.05b6.63±0.14cDW-WS64.28±0.17a67.07±0.15a73.23±0.12a7.47±0.06bPAW-WS64.48±0.22a67.11±0.25a73.36±0.09a7.77±0.11a
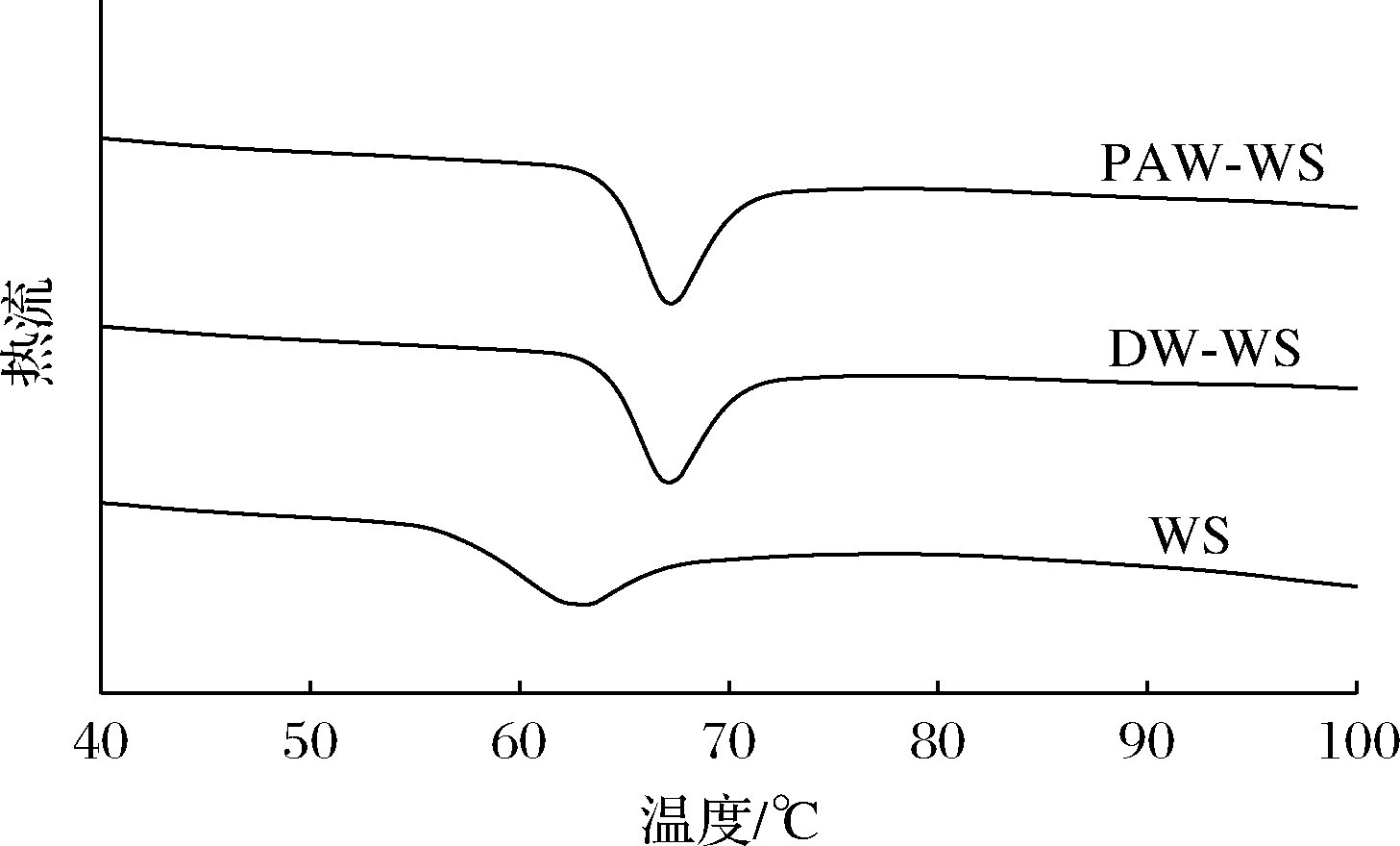
图6 天然和ANN改性小麦淀粉的DSC曲线
Fig.6 DSC curves of native and ANN-modified WS
2.5 PAW-ANN对小麦淀粉糊化特性的影响
天然和ANN改性小麦淀粉的黏度曲线如图7所示。淀粉颗粒在加热和剪切作用下的黏度变化归因于紧密变形的颗粒排列、膨胀颗粒之间的摩擦以及浸出的直链和支链淀粉的含量。ANN改性后小麦淀粉的峰值黏度降低,这可能与直链淀粉与直链淀粉或支链淀粉之间的相互作用显著增加抑制颗粒膨胀有关,这从淀粉糊化温度的升高也可以看出[27]。其中PAW-WS的峰值黏度最低,这可能是因为淀粉链在很大程度上受到酸水解的影响,酸水解导致淀粉链断裂形成短链淀粉分子[28]。
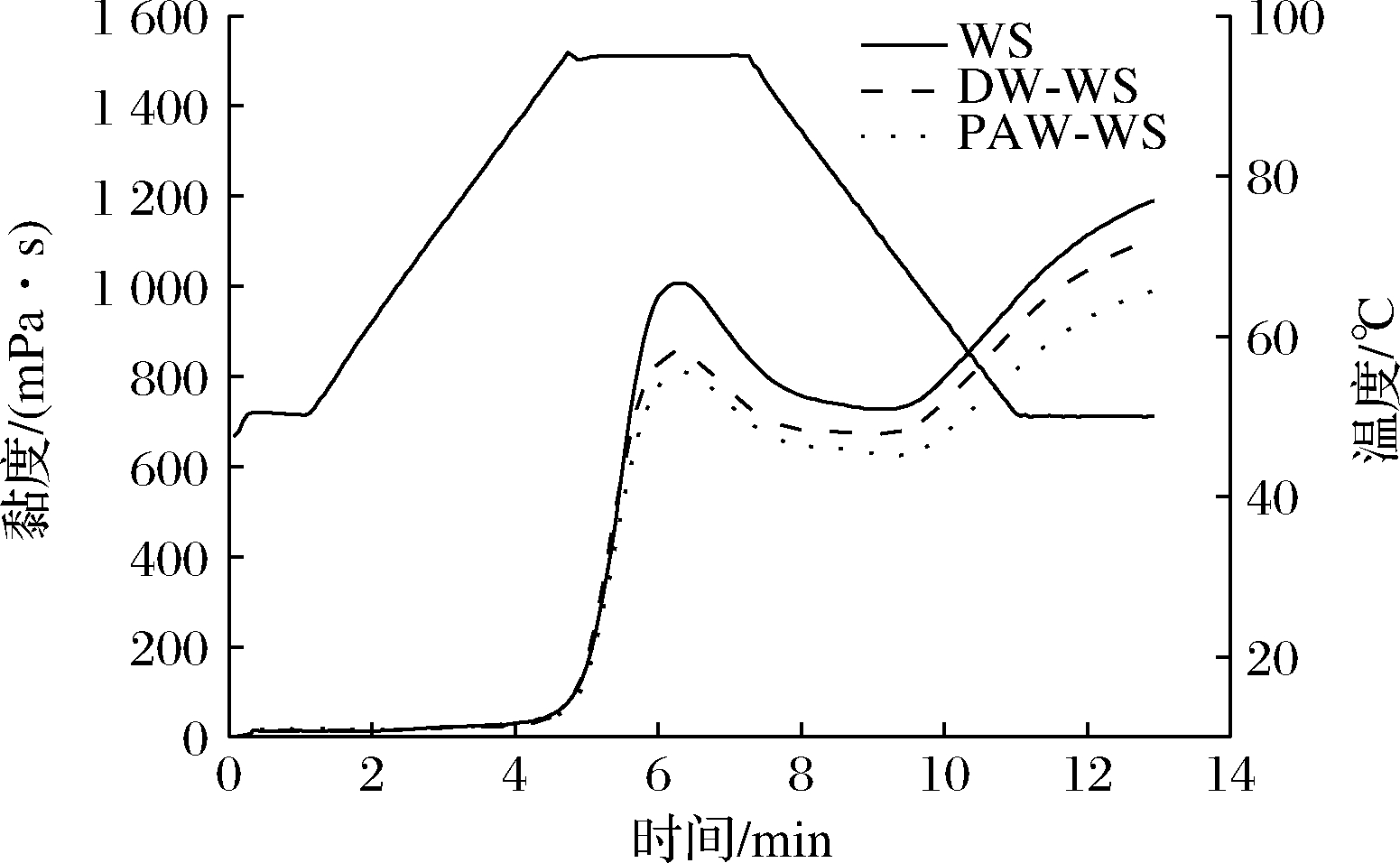
图7 天然和ANN改性小麦淀粉的黏度曲线
Fig.7 Viscosity curves of native and ANN-modified WS
2.6 PAW-ANN对小麦淀粉动态流变特性的影响
天然和ANN改性小麦淀粉的动态流变特性如图8所示。储能模量G′和损耗模量G″分别代表淀粉糊的弹性和黏性[29],损耗因子tanδ表示黏性和弹性组分对淀粉糊的黏弹性特性的相对贡献[30]。由图8可知,WS、DW-WS和PAW-WS的G′和G″都随频率的增加而增加,这表明其具有典型的弱凝胶结构[31]。所有淀粉糊的G′均大于G″,表明淀粉凝胶在性质上更具弹性。与天然淀粉相比,ANN改性淀粉显示出更高的G′、G″和更低的tanδ值,表明经过ANN改性后淀粉的固体特性和凝胶强度增强。这可能是因为在韧化过程中,通过淀粉颗粒表面上形成的孔和裂缝流出的直链淀粉单元的重新排列增加了淀粉凝胶的硬度[32]。特别地,PAW-WS表现出最低的tanδ,表明其具有最高的凝胶强度,说明PAW-ANN能有效提升淀粉的凝胶强度,可作为潜在的胶凝剂。
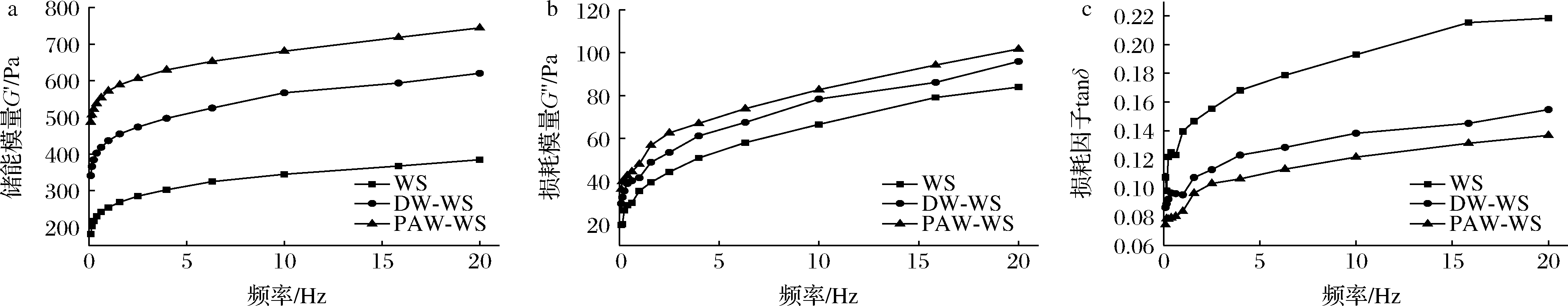
a-储能模量G′;b-损耗模量G″;c-损耗因子 tanδ
图8 天然和ANN改性小麦淀粉的动态流变曲线
Fig.8 Dynamic rheological curves of ANN-modified WS
3 结论
综上所述,PAW-ANN作为一种绿色安全的淀粉改性方法,可以显著影响小麦淀粉的结构和性质。与DW-ANN相比,PAW-ANN保持了小麦淀粉颗粒的完整性,增加了小麦淀粉的长程和短程有序性,提升了双螺旋结构的含量。与WS和DW-WS相比,PAW-WS具有最低的峰值黏度和最高的凝胶强度,有望用作软糖、冰淇淋和肉类食品生产的胶凝剂。
[1] 冀晓龙, 尹明松, 赵阳, 等.菊粉-小麦淀粉复配体系理化特性及相互作用[J].食品与发酵工业, 2022, 48(3):135-140.
JI X L, YIN M S, ZHAO Y, et al.Study on physicochemical properties of inulin-wheat starch blended systems and the interactions between the components[J].Food and Fermentation Industries, 2022, 48(3):135-140.
[2] YADAV B S, GULERIA P, YADAV R B.Hydrothermal modification of Indian water chestnut starch:Influence of heat-moisture treatment and annealing on the physicochemical, gelatinization and pasting characteristics[J].LWT-Food Science and Technology, 2013, 53(1):211-217.
[3] ZHANG F, ZHANG Y Y, THAKUR K, et al.Structural and physicochemical characteristics of lycoris starch treated with different physical methods[J].Food Chemistry, 2019, 275:8-14.
[4] GUO B Z, WANG Y T, PANG M, et al.Annealing treatment of amylose and amylopectin extracted from rice starch[J].International Journal of Biological Macromolecules, 2020, 164:3 496-3 500.
[5] IUGA M, MIRONEASA S.A review of the hydrothermal treatments impact on starch based systems properties[J].Critical Reviews in Food Science and Nutrition, 2020, 60(22):3 890-3 915.
[6] THIRUMDAS R, KOTHAKOTA A, ANNAPURE U, et al.Plasma activated water (PAW):Chemistry, physico-chemical properties, applications in food and agriculture[J].Trends in Food Science &Technology, 2018, 77:21-31.
[7] YAN Y Z, FENG L L, SHI M M, et al.Effect of plasma-activated water on the structure and in vitro digestibility of waxy and normal maize starches during heat-moisture treatment[J].Food Chemistry, 2020, 306:125589.
[8] WANG S J, WANG J R, WANG S K, et al.Annealing improves paste viscosity and stability of starch[J].Food Hydrocolloids, 2017, 62:203-211.
[9] ZHANG B J, LI X X, LIU J, et al.Supramolecular structure of A- and B-type granules of wheat starch[J].Food Hydrocolloids, 2013, 31(1):68-73.
[10] SHI M M, LU W Q, YU S J, et al.Effect of acid-ethanol treatment on physicochemical properties and in vitro digestibility of maize starches varying in AM content[J].Starch-Stärke, 2014, 66(5-6):429-435.
[11] DEVI R, SIT N.Effect of single and dual steps annealing in combination with hydroxypropylation on physicochemical, functional and rheological properties of barley starch[J].International Journal of Biological Macromolecules, 2019, 129:1 006-1 014.
[12] ZHANG H, HOU H X, LIU P F, et al.Effects of acid hydrolysis on the physicochemical properties of pea starch and its film forming capacity[J].Food Hydrocolloids, 2019, 87:173-179.
[13] UTRILLA-COELLO R G, HERN NDEZ-JAIMES C, CARRILLO-NAVAS H, et al.Acid hydrolysis of native corn starch:Morphology, crystallinity, rheological and thermal properties[J].Carbohydrate Polymers, 2014, 103:596-602.
NDEZ-JAIMES C, CARRILLO-NAVAS H, et al.Acid hydrolysis of native corn starch:Morphology, crystallinity, rheological and thermal properties[J].Carbohydrate Polymers, 2014, 103:596-602.
[14] JI N, LI X J, QIU C, et al.Effects of heat moisture treatment on the physicochemical properties of starch nanoparticles[J].Carbohydrate Polymers, 2015, 117:605-609.
[15] LIU Q, LI F, LU H, et al.Enhanced dispersion stability and heavy metal ion adsorption capability of oxidized starch nanoparticles[J].Food Chemistry, 2018, 242:256-263.
[16] PASCOAL A M, DI-MEDEIROS M C B, BATISTA K A, et al.Extraction and chemical characterization of starch from S.lycocarpum fruits[J].Carbohydrate Polymers, 2013, 98(2):1 304-1 310.
[17] KIZIL R, IRUDAYARAJ J, SEETHARAMAN K.Characterization of irradiated starches by using FT-Raman and FTIR spectroscopy[J].Journal of Agricultural and Food Chemistry, 2002, 50(14):3 912-3 918.
[18] CAPRON I, ROBERT P, COLONNA P, et al.Starch in rubbery and glassy states by FTIR spectroscopy[J].Carbohydrate Polymers, 2007, 68(2):249-259.
[19] CHUNG H J, LIU Q, HOOVER R.Impact of annealing and heat-moisture treatment on rapidly digestible, slowly digestible and resistant starch levels in native and gelatinized corn, pea and lentil starches[J].Carbohydrate Polymers, 2009, 75(3):436-447.
[20] YAN S L, CHEN G Y, HOU Y J, et al.Improved solubility of banana starch by dielectric barrier discharge plasma treatment[J].International Journal of Food Science and Technology, 2020, 55(2):641-648.
[21] KIZIL R, IRUDAYARAJ J.Discrimination of irradiated starch gels using FT-Raman spectroscopy and chemometrics[J].Journal of Agricultural and Food Chemistry, 2006, 54(1):13-18.
[22] 杨雪凡, 张维, 顾欣哲, 等.拉曼光谱在食品加工及品质控制中的应用[J].食品工业科技, 2020, 41(19):361-368.
YANG X F, ZHANG W, GU X Z, et al.The application of Raman spectroscopy in quality control and food processing[J].Science and Technology of Food Industry, 2020, 41(19):361-368.
[23] SUN Z H, CHEN Z W, XU B, et al.Distribution of octenylsuccinate substituents within a single granule of modified waxy maize starch determined by Raman microspectroscopy[J].Carbohydrate Polymers, 2019, 216:282-286.
[24] WANG S J, WANG J R, ZHANG W, et al.Molecular order and functional properties of starches from three waxy wheat varieties grown in China[J].Food Chemistry, 2015, 181:43-50.
[25] ZHANG B, WU C S, LI H Y, et al.Long-term annealing of C-type kudzu starch:Effect on crystalline type and other physicochemical properties[J].Starch-Stärke, 2015, 67(7-8):577-584.
[26] SONG H Y, LEE S Y, CHOI S J, et al.Digestibility and physicochemical properties of granular sweet potato starch as affected by annealing[J].Food Science and Biotechnology, 2014, 23(1):23-31.
[27] LAN H, HOOVER R, JAYAKODY L, et al.Impact of annealing on the molecular structure and physicochemical properties of normal, waxy and high amylose bread wheat starches[J].Food Chemistry, 2008, 111(3):663-675.
[28] ZAMBELLI R A, GALV O A M M T, DE MENDONÇA L G, et al.Effect of different levels of acetic, citric and lactic acid in the cassava starch modification on physical, rheological, thermal and microstructural properties[J].Food Science and Technology Research, 2018, 24(4):747-754.
O A M M T, DE MENDONÇA L G, et al.Effect of different levels of acetic, citric and lactic acid in the cassava starch modification on physical, rheological, thermal and microstructural properties[J].Food Science and Technology Research, 2018, 24(4):747-754.
[29] SUDHEESH C, SUNOOJ K V, SINHA S K, et al.Impact of energetic neutral nitrogen atoms created by glow discharge air plasma on the physico-chemical and rheological properties of kithul starch[J].Food Chemistry, 2019, 294:194-202.
[30] CHEN L, TIAN Y Q, BAI Y X, et al.Effect of frying on the pasting and rheological properties of normal maize starch[J].Food Hydrocolloids, 2018, 77:85-95.
[31] YANG C H, ZHONG F, DOUGLAS GOFF H, et al.Study on starch-protein interactions and their effects on physicochemical and digestible properties of the blends[J].Food Chemistry, 2019, 280:51-58.
[32] SUDHEESH C, SUNOOJ K V, NAVAF M, et al.Hydrothermal modifications of nonconventional kithul (Caryota urens) starch:Physico-chemical, rheological properties and in vitro digestibility[J].Journal of Food Science and Technology, 2020, 57(8):2 916-2 925.