植物基素食是指用植物性原料加工制成的一类具有类似肉类口感的产品,近年来随着生活水平的不断提高及环保主义的提倡,人们对食品健康和营养的需求越来越大,植物基素食产品具有良好的市场前景[1]。植物基素食产品在生产销售时面临着色泽单一、着色难、保色难等问题,而色泽是影响消费者感官的重要因素,解决植物基素食的着色问题是当前研究的一大重点和难点。天然色素根据色素的溶解性分为水溶性色素和油溶性色素,植物基素食体系多属于水溶性体系,水溶性色素加入其中易流失,着色和保色效果较差[2],而油溶性色素可以较好地克服这一缺点。目前在素食产品赋色上应用较多的是包埋法和微胶囊化[3],虽有些效果,但存在着色不足、易泄漏及凝胶体系不均一等问题,在一定程度上阻碍了植物基素食产业的发展,因此拓展油溶性色素在素食产品中的应用以及研究色素对于产品性能的影响具有重要的意义。
蛋白质-多糖的共混体系是目前研究较多的植物基素食类产品之一[4]。魔芋葡甘聚糖(konjac glucomannan,KGM)是一种天然植物性多糖,具有减肥、降血压、降血脂、抗肿瘤等功效,在食品、医学、生物学等方面具有广泛的应用[5];大豆分离蛋白(soybean protein isolate,SPI)是一种优质的植物性蛋白质资源,具有丰富的营养成分[6],可以赋予素食产品特殊的口感和质地[7]。有研究表明,KGM和SPI可以通过氢键和静电作用结合,复合体系的性质比单独使用时更加优越,是植物基素食产品较为理想的原料[8]。辣椒红色素(capsanthin,CAP)是在素食仿生食品中应用最广泛的天然油溶性色素之一[9],具有制备简单、着色力强、色泽鲜艳、稳定性高等优点,还具有极高的保健价值,能够起到抗氧化、降血脂、抗癌等作用,被广泛地应用于食品、药品、化妆品等行业[10]。
在实际生产中,色素的添加量十分重要,色素添加量过少会导致达不到理想的赋色效果[11],而超量添加则可能会对产品的性能造成影响[12],因此控制好色素的添加量十分重要。有研究表明辣椒红色素对KGM-SPI复合凝胶的赋色效果较好[13],而辣椒红色素对KGM凝胶的持水性、凝胶强度、凝胶温度等性质有影响[2]。但目前未见有关该色素对KGM-SPI复合凝胶性质影响的报道,因此本研究的重点是探讨辣椒红色素添加量对KGM-SPI复合凝胶体系性质的影响。
基于此,以KGM-SPI复合凝胶体系作为载体,向其中添加不同量的辣椒红色素,从复合凝胶体系的色泽、持水力(water holding capacity,WHC)、质构特性等理化性质以及差示扫描量热(differential scanning calorimetry,DSC)、傅里叶红外光谱(Fourier transform infrared spectrometer,FT-IR)和扫描电子显微镜(scanning electron microscope,SEM)的微观表征结果探讨辣椒红色素的添加量对KGM-SPI复合凝胶性质的影响,并探讨其影响机理,在此基础上对食品的加工生产过程给出推荐用量,拓展了辣椒红色素在植物基素食产品中的应用,以期对素食产品色泽的研究提供一定的理论和技术指导,为食品工业的发展做出一定贡献。
1 材料与方法
1.1 材料与试剂
魔芋精粉(食品级)(魔芋葡甘聚糖含量≥75%),湖北一致魔芋生物科技股份有限公司;大豆分离蛋白(食品级),蛋白含量≥90%,上海源叶生物科技有限公司;E150色阶辣椒红色素(食品级),山东齐鲁生物科技有限公司;食用碱(食品级),河南中源化学股份有限公司。
1.2 仪器与设备
FA1004A电子分析天平,上海精天电子仪器有限公司;JJ-1型精密增力电动搅拌器,金坛市城东新瑞仪器厂;DF-101S型集热式恒温加热磁力搅拌器、HZ-ZK8型数显恒温水浴锅,巩义市予华仪器有限责任公司;TA.XT Plus质构仪,英国Stable Micro System公司;5810台式高速离心机,德国Eppendorf公司;CM-5色差仪,柯尼卡美能达公司;SCIENTZ-10 ND型真空冷冻干燥机,宁波新芝生物科技股份有限公司;Phenom Pro型扫描电镜,荷兰Phenom World公司;DSC25差示扫描量热仪,美国TA公司;Spectrum 100傅里叶红外光谱仪,美国Perkin Elmer公司。
1.3 实验方法
1.3.1 复配凝胶制备
通过预实验确定具备良好凝胶性能的KGM-SPI复配体系中KGM、SPI、食用碱的添加比例以及凝胶制备条件。制备过程如下:将0.5%(质量分数)的食用碱加入到磁力搅拌器搅拌下的30 ℃去离子水中,搅拌均匀后加入3.5%(质量分数)的SPI,使SPI分散均匀,接着分别加入不同质量分数的CAP(0%、0.05%、0.10%、0.15%、0.20%、0.25%、0.30%,其中色素添加量为0%的样品为对照组),充分搅拌使色素均匀的分散到体系中,最后缓慢加入10.5%(质量分数)的KGM粉末,体系充分搅拌均匀后平整表面,于95 ℃恒温水浴30 min,取出冷却至室温后放入4 ℃冰箱冷藏5 h,得待测样品。
1.3.2 色泽的测定
色差仪经校正后对添加了不同量辣椒红色素的KGM-SPI复合凝胶样品色泽进行测定,测定方法参照汪师帅等[2]并稍作改动。
1.3.3 WHC的测定
将添加了不同量辣椒红色素的KGM-SPI复合凝胶样品切成3 mm×3 mm×3 mm大小的均匀颗粒状,取5 g左右样品放入离心管中,样品质量记录为m1,于12 000×g转速离心15 min,取出用滤纸吸干样品表面水分后称量,质量记录为m2,持水力的计算如公式(1)所示[14]:
(1)
式中:m1为样品质量,g;m2为离心并吸干表面水分后的样品质量,g。
1.3.4 TPA质构特征的测定
将添加了不同量辣椒红色素的KGM-SPI复合凝胶样品切成5 mm厚的薄片,质构分析为TPA模式,探头采用P/0.5,测前速率为2 mm/s,测试速率为1 mm/s,测后速率为l mm/s,形变量为80%,触发力为5 g,触发时间为5 s[13]。
1.3.5 DSC测定
将添加了不同量辣椒红色素的KGM-SPI复合凝胶样品于-40 ℃预冻24 h后进行真空冷冻干燥,干燥后研磨成细粉状待测。称取2 mg样品放于盖子中心带孔的铝坩埚中并密封,在流速为60 mL/min的干燥氮气保护下测定,以密封的空坩埚作为对照,从20 ℃加热到250 ℃,升温速率为10 ℃/min[15],记录样品的DSC图谱。
1.3.6 FT-IR测定
将添加了不同量辣椒红色素的KGM-SPI复合凝胶样品先按照1.3.5的方法进行真空冷冻干燥,干燥后将样品磨成粉末放入干燥皿备用。测量时样品粉末放入圆盘压片,扫描光谱范围为4 000~600 cm-1,分辨率为0.4 cm-1,扫描次数64[16],记录样品的红外光谱。
1.3.7 SEM测定
将添加了不同量辣椒红色素的KGM-SPI复合凝胶样品先按照1.3.5的方法进行真空冷冻干燥,干燥好的样品切成均匀的薄片备用。观察前将样品固定在样品铜台上,选择真空度1.0×10-3 Pa,溅射电压1.2 kV,镀膜时间3 min进行镀金,放置10 min后送入电镜观察[17],放大300倍选择有代表性的区域进行拍摄。
1.4 数据分析
所有实验进行3次平行,结果表示为“平均值±标准差”的形式。采用Excel 2010进行基础数据收集与处理;采用SPSS 22.0进行数据分析;显著性分析以Duncan′s test进行方差分析(ANOVA),P<0.05被认为存在显著差异;采用Origin 2019进行图形绘制。
2 结果与分析
2.1 辣椒红色素添加量对KGM-SPI复合凝胶色泽的影响
辣椒红色素添加量对KGM-SPI复合凝胶色泽的影响如图1所示,采用Lab法表示结果,其中L*值代表亮度,L*值越大表示亮度越大,a*值代表红绿,a*值越大表示越红,b*值代表黄蓝,b*值越大代表越黄。由图1可知,当色素添加量为0%~0.20%时,随着色素添加量的增加,体系的L*值显著下降,a*值和b*值显著上升(P<0.05),其中当添加量为0%~0.05%时,L*值、a*值、b*值的变化率分别达16.38%、85.22%、64.02%,当添加量为0.05%~0.10%时变化率分别下降至2.00%、7.43%、5.41%,当添加量为0.10%~0.20%时,变化率持续下降;而当添加量为0.20%~0.30%时,体系的L*值、a*值、b*值均未显示出显著性差异,汪师帅等[2]在研究中发现了类似的结果。不添加色素的KGM-SPI凝胶为类似市面上常见的魔芋豆腐的土棕色,辣椒红色素是橙红色系色素,加入色素后与对照组相比样品的亮度降低,颜色向黄色、红色转变,即L*值下降,a*值和b*值上升,且3个值的变化率都随色素添加量的增加而降低,最终在添加量为0.20%时,体系的色泽趋于稳定,此时体系的L*值为添加色素前的78%,a*值和b*值分别为添加色素前的8倍和3倍。辣椒红色素的加入改善了体系的色泽,可以在一定程度上增加消费者的食欲和购买欲望,且该色素的赋色效果较好,少量的辣椒红色素即可使色泽趋于稳定。
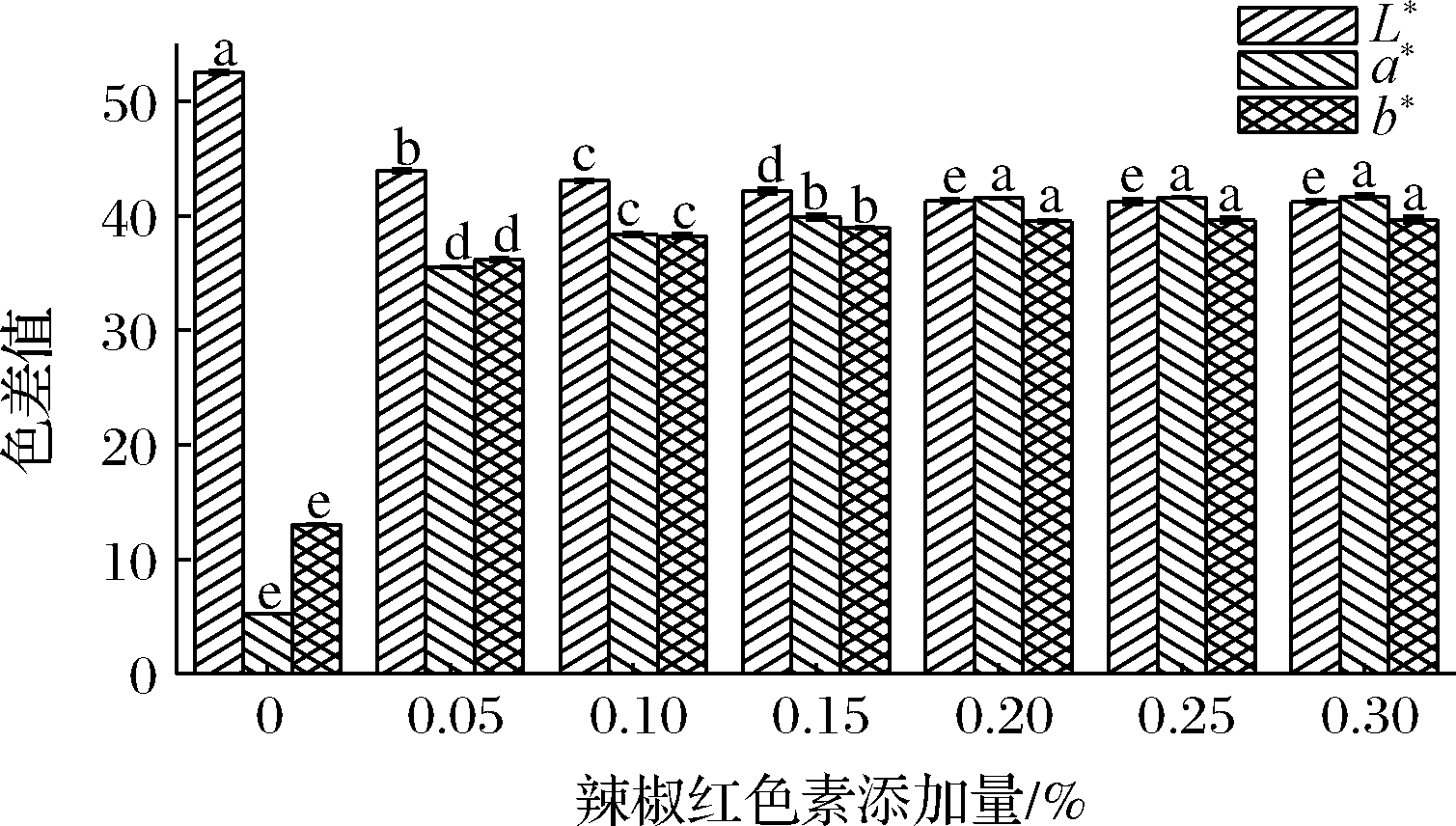
图1 辣椒红色素添加量对KGM-SPI复合凝胶色泽的影响
Fig.1 Effect of capsanthin addition on the color of KGM-SPI composite gel
注:柱形条上标注的不同小写字母表示具有显著性差异(P<0.05)(下同)
2.2 辣椒红色素添加量对KGM-SPI复合凝胶WHC的影响
辣椒红色素添加量对KGM-SPI复合凝胶WHC的影响如图2所示。由图2可知,实验样品都具有较好的持水性,所有样品的持水率都达到95%以上,这是因为KGM本身具有较强的吸水性,可以通过氢键、偶极键的作用力与大量的水分子结合,KGM与SPI结合所形成的凝胶网络对水分子也有较好的束缚作用[18],故KGM-SPI复合凝胶有较高的持水性。当色素添加量为0%~0.20%时,随着色素添加量的增加复合凝胶体系的持水力显著降低(P<0.05),其中当添加量为0%~0.05%时,持水力变化率为0.52%,当添加量为0.05%~0.10%时变化率下降为0.47%,当添加量为0.10%~0.20%时变化率持续下降,并在添加量为0.20%~0.30%时持水性达到稳定,无显著性差异,最终与对照组相比持水力下降了1.75%,这与郭培等[19]关于脂溶性体系对凝胶持水性的影响研究结果一致(当紫苏籽油浓度升高,凝胶的持水性逐渐下降并在一定浓度的时候达到稳定,最终与对照组相比下降了1.64%)。
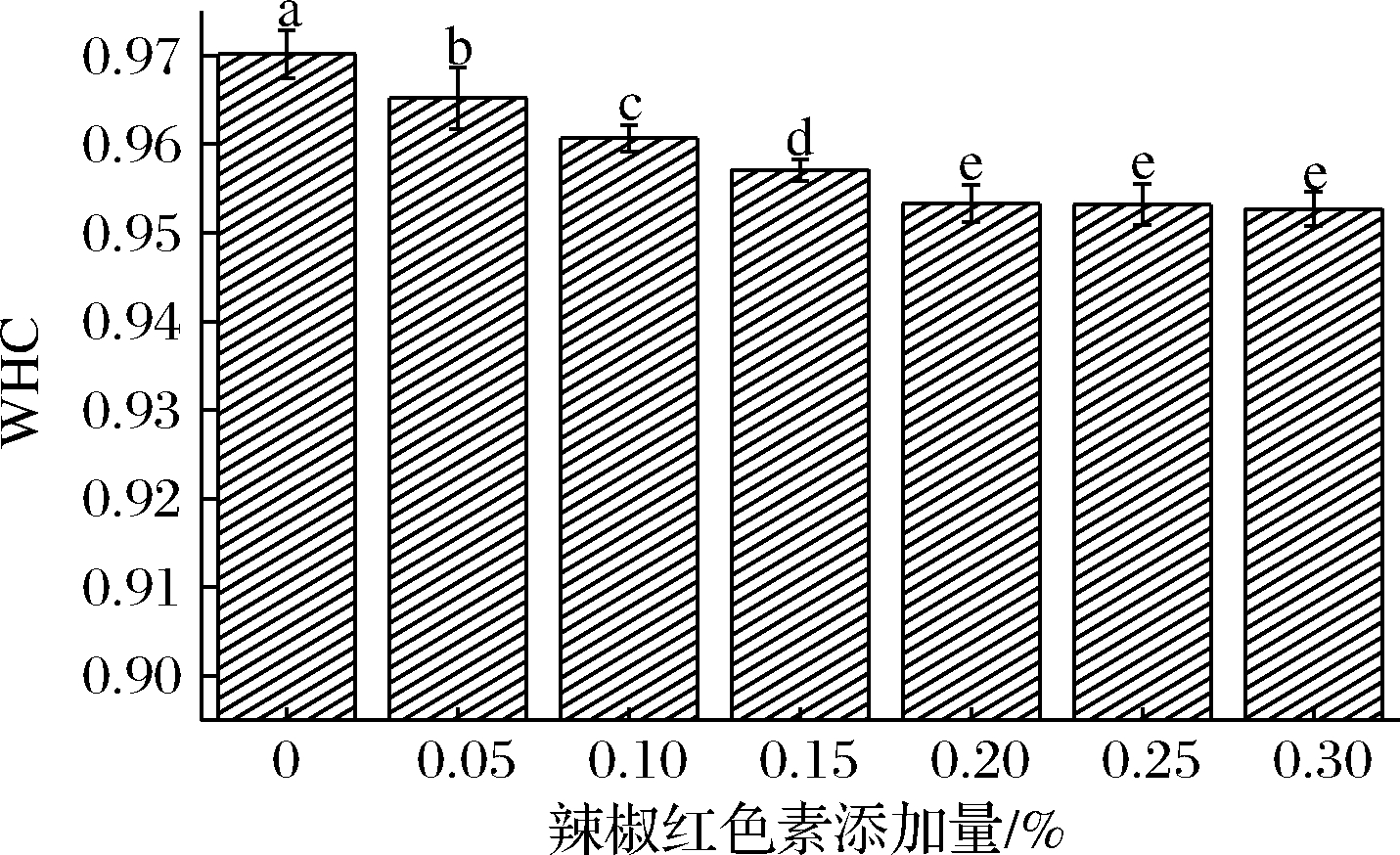
图2 辣椒红色素添加量对KGM-SPI复合凝胶WHC的影响
Fig.2 Effect of capsanthin addition on water-holding capacity of KGM-SPI composite gel
凝胶的持水性主要与凝胶的三维网络强度有关,网络结构强度越弱,水分流失越严重,从而导致体系WHC的下降[14],产生以上结果的原因可能是辣椒红色素属于油溶性色素,加入后会干扰KGM与SPI以及KGM与水分子之间的相互作用,破坏凝胶三维网络的致密性,同时辣椒红色素可能会排挤水分子,从而导致凝胶体系持水力的降低[19]。
2.3 辣椒红色素添加量对KGM-SPI复合凝胶TPA质构的影响
辣椒红色素添加量对KGM-SPI复合凝胶质构的影响如表1所示。当辣椒红色素添加量为0%~0.20%时,凝胶体系的内聚力、回复性和弹性没有显著性差异;硬度、胶黏性、咀嚼性随着色素添加量的增加显著下降(P<0.05),且硬度变化率高于胶黏性、咀嚼性的变化率,当添加量为0.20%~0.30%时,凝胶体系的质构特征均未表现出显著性差异。当辣椒红色素添加量为0.20%时,与对照组相比,KGM-SPI复合凝胶的硬度、胶黏性、咀嚼性分别下降了20.30%、15.79%、16.50%,复合凝胶质构的变化趋势与持水性的变化趋势大致相同,JIAO等[20]研究了油脂的加入对凝胶质构的影响,变化规律与本研究相似。
表1 辣椒红色素添加量对KGM-SPI复合凝胶质构的影响
Table 1 Effect of capsanthin addition on texture of KGM-SPI composite gel
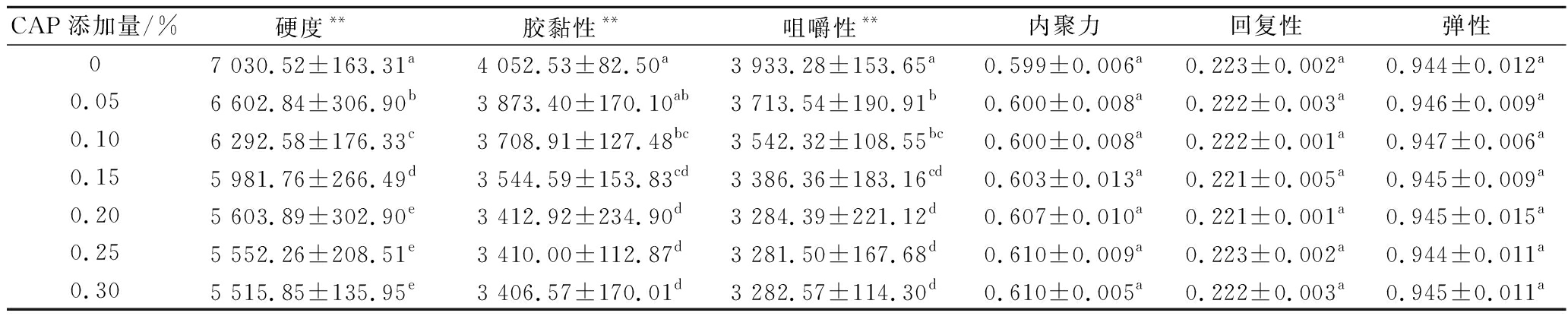
CAP添加量/%硬度**胶黏性**咀嚼性**内聚力回复性弹性07 030.52±163.31a4 052.53±82.50a3 933.28±153.65a0.599±0.006a0.223±0.002a0.944±0.012a0.056 602.84±306.90b3 873.40±170.10ab3 713.54±190.91b0.600±0.008a0.222±0.003a0.946±0.009a0.106 292.58±176.33c3 708.91±127.48bc3 542.32±108.55bc0.600±0.008a0.222±0.001a0.947±0.006a0.155 981.76±266.49d3 544.59±153.83cd3 386.36±183.16cd0.603±0.013a0.221±0.005a0.945±0.009a0.205 603.89±302.90e3 412.92±234.90d3 284.39±221.12d0.607±0.010a0.221±0.001a0.945±0.015a0.255 552.26±208.51e3 410.00±112.87d3 281.50±167.68d0.610±0.009a0.223±0.002a0.944±0.011a0.305 515.85±135.95e3 406.57±170.01d3 282.57±114.30d0.610±0.005a0.222±0.003a0.945±0.011a
注:*代表在0.05水平上有显著性;**代表在0.01水平上极显著;数字上标注的字母指在5%水平下的Duncan多重比较检验,不同字母代表不同的显著性
产生此现象的原因可能是色素的存在影响了KGM的脱乙酰作用[2,21]和增大了SPI分子之间的距离,这两种影响的最终结果都是破坏KGM-SPI凝胶的三维网络结构,降低凝胶网络的致密性和均匀性[22],而凝胶的体系的硬度等质构特性与凝胶三维网络孔径的大小与数量具有重要的联系,所以直观的表现为凝胶硬度、胶黏性、咀嚼性下降。
2.4 辣椒红色素添加量对KGM-SPI复合凝胶样品外观的影响
不同辣椒红色素添加量的KGM-SPI复合凝胶样品外观如图3所示,可以看出未添加辣椒红色素的样品(图3-A)表面粗糙,光泽感差,而添加了辣椒红色素的样品(图3-B~图3-G)有更加鲜艳明亮的色泽,且微量的色素即可赋予凝胶较好的色泽,添加量为0.05%的样品(图3-B)色泽就与对照组有非常明显的变化;当色素添加量为0%~0.20%时,随着添加量的增加,复合凝胶的颜色逐渐加深,当添加量为0.20%~0.30%时,颜色达到饱和,未有显著差异,与上述色差的测定结果相一致,此时产品的颜色与市售肉制品的颜色接近,赋予人极强的食欲。且与对照组相比,添加了辣椒红色素的样品表面出现了更多微小的孔洞,当色素添加量为0%~0.20%时,随着色素添加量的增加这种现象更加明显,当添加量为0.20%~0.30%时,破坏程度不再增强,表明添加辣椒红色素之后,KGM-SPI复合凝胶的组织状态受到一定程度的破坏。

A-0%;B-0.05%;C-0.10%;D-0.15%;E-0.20%;F-0.25%;G-0.30%
图3 不同辣椒红色素添加量水平下KGM-SPI复合凝胶样品图
Fig.3 Samples of KGM-SPI composite gel under different levels of capsanthin
2.5 DSC结果分析
不同辣椒红色素添加量的KGM-SPI复合凝胶DSC谱图如图4所示,7个样品均在100~150 ℃出现一个明显的吸热宽峰,当色素添加量小于0.20%时,KGM-SPI复合凝胶的DSC曲线波峰向左偏移,即峰值温度较对照组有所降低,且随着色素添加量的增加峰值温度逐渐趋于对照组,当添加量为0.20%~0.30%时峰值温度与对照组无显著差异。表明辣椒红色素的加入会降低KGM-SPI复合凝胶的热稳定性,但随着色素添加量的增加体系热稳定性降低的程度减小,这与周绪霞等[23]关于油茶籽油添加量对凝胶热稳定性的影响结果类似。产生这种现象的原因可能为以下两方面:一方面辣椒红色素的加入会在一定程度上破坏KGM-SPI凝胶的三维网络结构,进而降低其热稳定性;另一方面DSC加热时KGM-SPI凝胶会受到破坏,凝胶破坏暴露出的疏水区域与辣椒红色素结合,暴露的亲水基团与水分子紧密结合[17],凝胶网络结构进一步伸展,致使峰值温度升高,而当辣椒红色素的添加量达到一定量时,凝胶网络达到极限伸展,峰值温度不再上升,与对照组无明显差异。
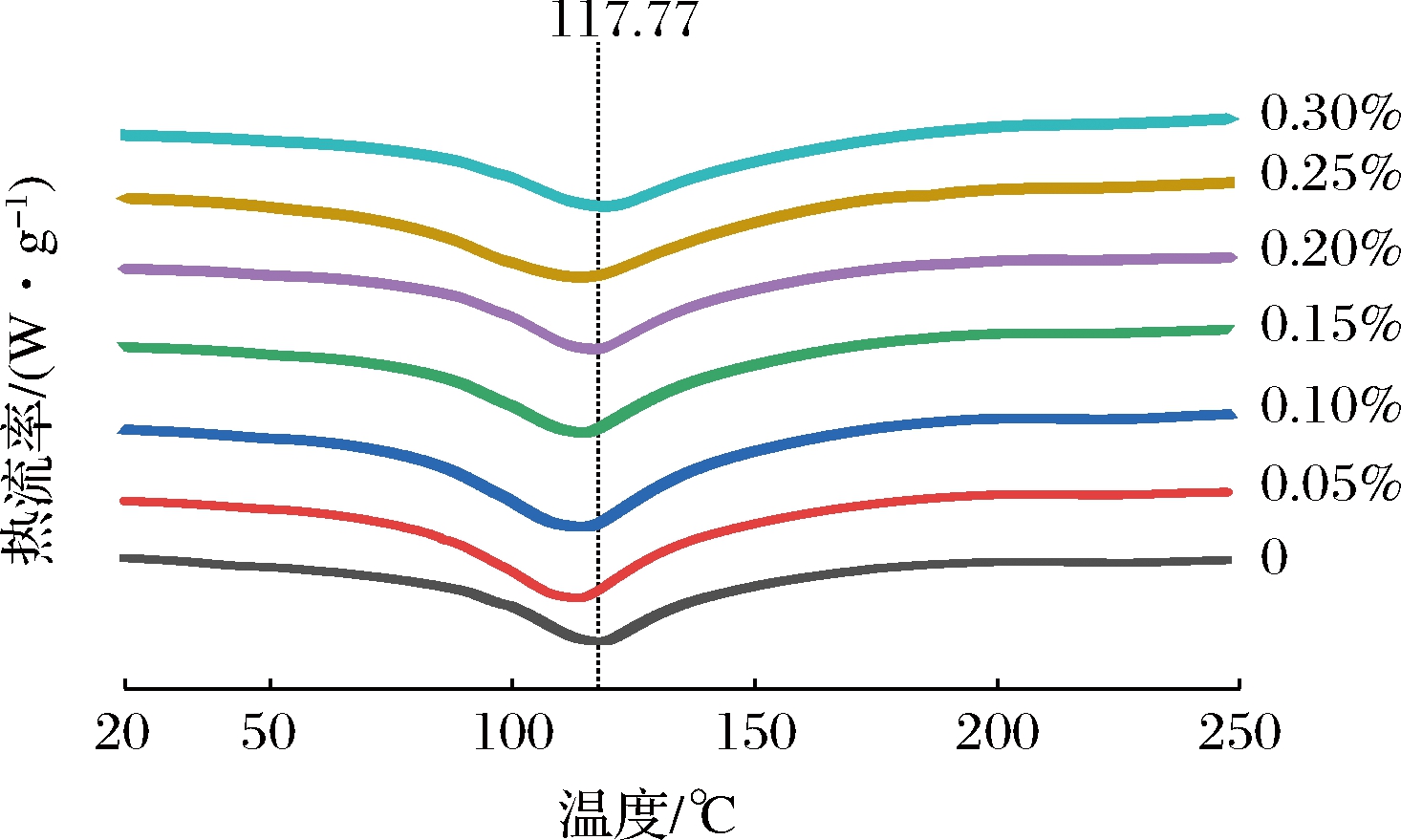
图4 不同辣椒红色素添加量水平下KGM-SPI复合凝胶的DSC谱图
Fig.4 DSC curves of KGM-SPI composite gel under different levels of capsanthin
同时随着辣椒红色素添加量的增加,KGM-SPI复合凝胶的起始分解温度逐渐降低,热分解温度与其内部结构有重要的关系,该复合体系主要存在KGM与水分子之间通过氢键构成的网络结构和KGM与SPI分子之间通过氢键构成的网络结构,热分解中的质量损失过程即对应凝胶网络结构的破坏,凝胶网络的致密性增加会滞后凝胶的起始分解温度,使起始分解温度升高[23]。辣椒红色素的加入会使KGM-SPI复合凝胶的三维网络在一定程度上受到破坏[15],所以添加该红色素后凝胶的起始分解温度会降低。当辣椒红色素添加量为0.20%~0.30%时,凝胶不仅起始分解温度低,且终止分解温度也低,说明此时凝胶的网络结构已经产生质的变化,分子间相互作用力极大降低。
2.6 FT-IR结果分析
通过红外光谱特征吸收峰的形状、位置和数目可以分析不同样品的分子结构变化[16]。不同辣椒红色素添加量的KGM-SPI复合凝胶红外光谱如图5所示,所有样品的吸收峰形状和位置大致相似。与对照组相比,添加了辣椒红色素的样品在1 744 cm-1处增加了羰基(—C![]() O)振动吸收峰,此峰为辣椒红色素的特征吸收峰;3 281 cm-1附近的宽吸收峰是O—H的伸缩振动峰,2 925 cm-1附近为亚甲基的C—H伸缩振动峰,2 000~2 500 cm-1主要为C≡≡C和C≡≡N等三键和累积双键的伸缩振动[13];1 641、1 544、1 400 cm-1附近的吸收峰分别为SPI酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带的特征吸收峰[24]。
O)振动吸收峰,此峰为辣椒红色素的特征吸收峰;3 281 cm-1附近的宽吸收峰是O—H的伸缩振动峰,2 925 cm-1附近为亚甲基的C—H伸缩振动峰,2 000~2 500 cm-1主要为C≡≡C和C≡≡N等三键和累积双键的伸缩振动[13];1 641、1 544、1 400 cm-1附近的吸收峰分别为SPI酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带的特征吸收峰[24]。
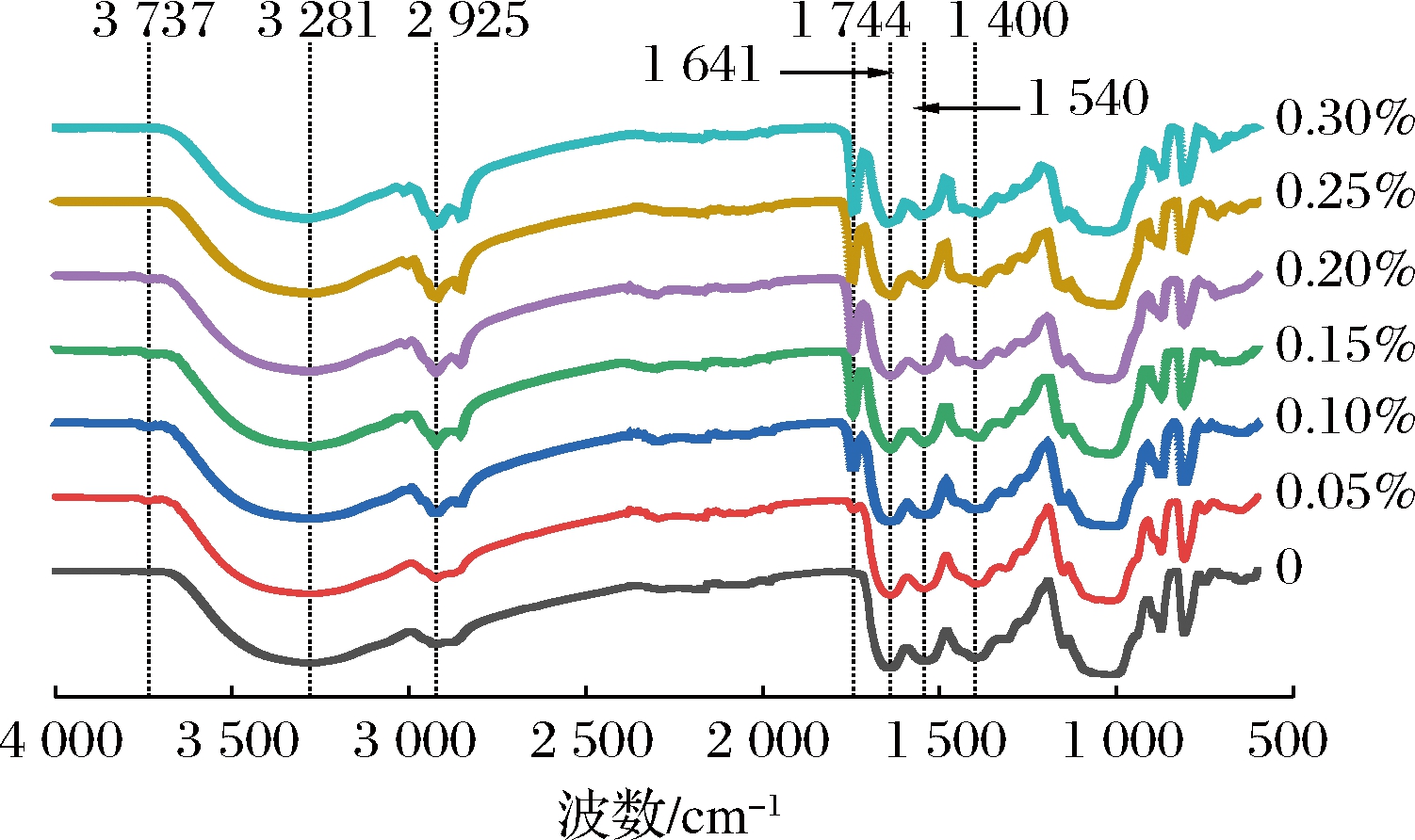
图5 不同辣椒红色素添加量水平下KGM-SPI复合凝胶的红外光谱图
Fig.5 FT-IR of KGM-SPI composite gel under different levels of capsanthin
随着色素从0%添加至0.30%,辣椒红色素特征吸收峰强度逐渐增强;O—H伸缩振动峰的透射率从7.75%增加到14.02%;亚甲基的C—H伸缩振动峰透射率从29.38%降低至7.05%,表明KGM-SPI体系的氢键减少,碳链数量增加;当辣椒红色素的添加量为0%~0.20%时在3 737 cm-1处增加了N—H特征吸收峰,在该范围内随着色素添加量的增加吸收峰的强度逐渐减弱;当色素添加量为0.20%~0.30%时,C≡≡N伸缩振动峰和酰胺Ⅰ带、酰胺Ⅱ带、酰胺Ⅲ带的特征吸收透射率显著增强,其它波段未发生较明显变化,这与张芳[25]关于大豆油对凝胶特性与微观结构的影响相似。
产生上述变化主要是因为辣椒红色素的加入降低了氢键作用力,阻碍了KGM与水分子以及KGM与SPI分子通过氢键等非共价键作用的结合,从而阻碍了凝胶网络的形成[16],导致氢键减少,碳链增多,这与上述2.2、2.3得出的结论一致。已证实油的存在会使大豆分离蛋白的稳定结构发生改变,蛋白凝胶的α-螺旋和β-折叠显著降低[25],由此推测油溶性的辣椒红色素加入后,SPI的结构会受到一定程度的破坏,舒展开的疏水性氨基酸残基与辣椒红色素相结合,因此添加量为0%~0.20%时增加了N—H的特征峰;但由于SPI的量是固定的,即能与色素结合的基团是有限的,当添加量达到0.20%后,这种作用达到临界值,所以添加量为0.20%~0.30%时出现了C≡≡N伸缩振动峰和3个振动带的变化现象,但由于此现象比较微弱,未在凝胶宏观理化特性上有直观体现。
2.7 SEM结果分析
不同辣椒红色素添加量的KGM-SPI复合凝胶扫描电镜观测图如图6所示,可以看出与对照组(图6-A)相比,当辣椒红色素添加量为0.05%(图6-B)时,表面的孔洞减少,空穴半径增大;当色素添加到0.10%时(图6-C),表面开始出现褶皱现象;当色素添加量为0.15%(图6-D)和0.20%(图6-E)时,孔洞的连接处出现很多缠结的结构;当色素添加量为0.25%(图6-F)和0.30%(图6-G)时,凝胶网络的结构不再产生明显的变化,这与2.3的结果一致。

A-0%;B-0.05%;C-0.10%;D-0.15%;E-0.20%;F-0.25%;G-0.30%
图6 不同辣椒红色素添加量水平下KGM-SPI复合凝胶的扫描电镜图
Fig.6 SEM of KGM-SPI composite gel under different levels of capsanthin
产生这种现象的原因可能是辣椒红色素的加入阻碍了KGM分子内以及KGM与SPI分子间的结合,降低了凝胶体系中的氢键,在一定程度上破坏了凝胶三维网络的结构,导致孔洞减少且孔径增大[22];同时辣椒红色素加入后可能会影响SPI的结构,与SPI舒展开的氨基酸残基相结合,导致表面缠结结构的出现;随着色素添加量的增加,凝胶网络的破坏程度和与SPI结合的程度均增大,当添加量达到0.20%时,这种破坏与结合作用达到临界值,所以不再产生明显变化。
3 结论
植物基素食的赋色问题具有重要的研究意义,辣椒红色素作为一种赋色效果好,稳定性高,应用前景广泛的天然油溶性色素,在KGM-SPI复合凝胶上可以较好地实现赋色、保色效果。通过对不同添加量的辣椒红色素对KGM-SPI复合凝胶性质的影响研究,发现辣椒红色素可以作为优质的着色剂应用于以KGM-SPI为主要生产原料的植物基素食产品,但该色素的加入会对复合凝胶的性质产生一定影响,导致凝胶的持水性、硬度、咀嚼性等理化特性在一定程度上下降,凝胶体系的氢键、热稳定性也会受到一定的影响。在实际工业生产中应根据产品具体的需求选择合适的添加量,对于素肉、素毛肚等对凝胶性能需求较大的产品应在达到理想色泽的前提下尽量降低辣椒红色素的用量,而对于果冻、布丁等凝胶性能需求较小的产品则可以在安全使用范围内提高辣椒红色素的添加量,未来的研究可着重于探讨辣椒红色素在特定食品中的最适添加量。
[1] ESTELL M, HUGHES J, GRAFENAUER S.Plant protein and plant-based meat alternatives:Consumer and nutrition professional attitudes and perceptions[J].Sustainability, 2021, 13(3):1478.
[2] 汪师帅, 杨金初.辣椒红色素对魔芋葡甘聚糖凝胶性质的影响[J].食品研究与开发, 2018, 39(17):21-25.
WANG S S,YANG J C.Effect of capsanthin on properties of konjac glucomannan gels[J].Food Research and Development, 2018, 39(17):21-25.
[3] FAN L H, LU Y Q, OUYANG X K, et al.Development and characterization of soybean protein isolate and fucoidan nanoparticles for curcumin encapsulation[J].International Journal of Biological Macromolecules, 2021, 169:194-205.
[4] WARKENTIN R, KWAN D H.Resources and methods for engineering designer glycan-binding proteins[J].Molecules(Basel,Switzerland), 2021, 26(2):380.
[5] BEHERA S S, RAY R C.Konjac glucomannan, a promising polysaccharide of Amorphophallus konjac K.Koch in health care[J].International Journal of Biological Macromolecules, 2016, 92:942-956.
[6] XUN Z Y, NI S P, GAO Z H, et al.Construction of polymer electrolyte based on soybean protein isolate and hydroxyethyl cellulose for a flexible solid-state supercapacitor[J].Polymers, 2019, 11(11):1895.
[7] 靳智. 大豆蛋白在仿生食品应用中的研究进展[J].农产品加工, 2015(4):73-75.
JIN Z.Research progress of soybean protein in bionic food[J].Farm Products Processing, 2015(4):73-75.
[8] ![]() G, JAMBRAK A R, LELAS V, et al.Influence of innovative technologies on rheological and thermophysical properties of whey proteins and guar gum model systems[J].Mljekarstvo, 2011, 61(1):64-78.
G, JAMBRAK A R, LELAS V, et al.Influence of innovative technologies on rheological and thermophysical properties of whey proteins and guar gum model systems[J].Mljekarstvo, 2011, 61(1):64-78.
[9] 黎智华, 王恬.辣椒红素的生物利用度、生理功能及机制研究进展[J].食品科学, 2020, 41(11):259-266.
LI Z H, WANG T.Progress in understanding the bioavailability, physiological functions and mechanisms of action of capsanthin[J].Food Science, 2020, 41(11):259-266.
[10] WU T, GAO Y F, HAO J Y, et al.Capsanthin extract prevents obesity, reduces serum TMAO levels and modulates the gut microbiota composition in high-fat-diet induced obese C57BL/6 J mice[J].Food Research International, 2020, 128:108774.
[11] MARTINS N, RORIZ C L, MORALES P, et al.Food colorants:Challenges, opportunities and current desires of agro-industries to ensure consumer expectations and regulatory practices[J].Trends in Food Science &Technology, 2016, 52:1-15.
[12] DE MEJIA E G, ZHANG Q Z, PENTA K, et al.The colors of health:Chemistry, bioactivity, and market demand for colorful foods and natural food sources of colorants[J].Annual Review of Food Science and Technology, 2020, 11:145-182.
[13] 朱坤, 刘缘勤, 范盛玉, 等.魔芋葡甘聚糖-大豆分离蛋白-辣椒红色素复合有色凝胶的制备及其性能研究[J].食品与发酵工业, 2021, 47(15):213-219.
ZHU K, LIU Y Q, FAN S Y, et al.Preparation and characteristics of konjac glucomannan-soybean protein isolate-capsanthin coloring composite gel[J].Food and Fermentation Industries, 2021, 47(15):213-219.
[14] SHANG L C, WU C L, WANG S S, et al.The influence of amylose and amylopectin on water retention capacity and texture properties of frozen-thawed konjac glucomannan gel[J].Food Hydrocolloids, 2021, 113:106521.
[15] ZHANG T, XUE Y, LI Z J, et al.Effects of deacetylation of konjac glucomannan on Alaska Pollock surimi gels subjected to high-temperature (120 ℃) treatment[J].Food Hydrocolloids, 2015, 43:125-131.
[16] LIU F, ZOU H L, PENG J B, et al.Removal of copper(II) using deacetylated konjac glucomannan conjugated soy protein isolate[J].International Journal of Biological Macromolecules, 2016, 86:338-344.
[17] GEREMIAS-ANDRADE I M, SOUKI N P D B G, MORAES I C F, et al.Rheological and mechanical characterization of curcumin-loaded emulsion-filled gels produced with whey protein isolate and xanthan gum[J].LWT, 2017, 86:166-173.
[18] GUO L P, YOKOYAMA W, CHEN L, et al.Characterization and physicochemical properties analysis of konjac glucomannan:Implications for structure-properties relationships[J].Food Hydrocolloids, 2021, 120:106818.
[19] 郭培, 申铉日, 周清平.添加紫苏籽油对罗非鱼鱼糜品质的影响[J].食品科技, 2016, 41(2):167-171.
GUO P, SHEN X R, ZHOU Q P.Effect of perilla seed oil on the quality of tilapia surimi[J].Food Science and Technology, 2016, 41(2):167-171.
[20] JIAO X D, CAO H W, FAN D M, et al.Effects of fish oil incorporation on the gelling properties of silver carp surimi gel subjected to microwave heating combined with conduction heating treatment[J].Food Hydrocolloids, 2019, 94:164-173.
[21] XIN C, CHEN J, LIANG H S, et al.Confirmation and measurement of hydrophobic interaction in sol-gel system of konjac glucomannan with different degree of deacetylation[J].Carbohydrate Polymers, 2017, 174:337-342.
[22] YU N N, XU Y S, JIANG Q X, et al.Molecular forces involved in heat-induced freshwater surimi gel:Effects of various bond disrupting agents on the gel properties and protein conformation changes[J].Food Hydrocolloids, 2017, 69:193-201.
[23] 周绪霞, 姜珊, 顾赛麒, 等.油茶籽油对鱼糜凝胶特性及凝胶结构的影响[J].食品科学, 2017, 38(9):27-33.
ZHOU X X, JIANG S, GU S Q, et al.Effect of Camellia tea oil on properties and structure of surimi gels[J].Food Science, 2017, 38(9):27-33.
[24] CHEN Z J, WANG S S, SHANG L C, et al.An efficient and simple approach for the controlled preparation of partially degraded konjac glucomannan[J].Food Hydrocolloids, 2020, 108:106017.
[25] 张芳.大豆油对大豆蛋白凝胶特性及其微结构的影响[D].武汉:华中农业大学, 2013.
ZHANG F.Effect of soybean oil on the gel properties and microstructure of the soy protein[D].Wuhan:Huazhong Agricultural University, 2013.