百香果皮作为百香果加工后产生的副产物,是生物活性化合物的丰富来源,因为果皮中含有大量的功能性化合物,尤其是酚类化合物。CAO等[1]研究发现紫百香果皮乙醇提取物中含有178种酚类物质,并发现百香果皮中牧荆素、木犀草素和槲皮素等苷元类黄酮具有消化酶抑制能力。紫皮百香果皮中含有丰富的以木犀草素、芹菜素、白杨素、槲皮素等为苷元的黄酮碳苷和氧苷类物质。而研究表明百香果皮中结合酚含量占比较高,且果皮结合酚中黄酮类和酚酸类物质更丰富[2]。相比游离酚,结合酚不易被人体胃肠道消化吸收,且抗氧化能力弱于前者,而水解产生的糖苷往往表现出更高的抗氧化能力[3]。因此促进结合酚的释放,糖苷类黄酮转化为苷元是提高果皮酚类化合物生物活性的有效途径。
乳酸菌(lactic acid bacteria,LAB)发酵最早用于延长食品保质期和改善风味,对活性成分生物转化及提取的特性被逐渐挖掘,如通过代谢转化多酚物质提高抗氧化活性。WU等[3]使用几种乳酸菌发酵苹果汁,结果表明一些酚类物质(没食子酸、表儿茶素和根皮苷)的含量显著增加,发酵苹果汁的抗氧化能力也得到改善。黄梅华等[4]用植物乳杆菌发酵火龙果皮,观察到总黄酮含量增加并且提高了抗氧化能力。尽管已有许多研究证明乳酸菌发酵会改变酚类物质,提高总酚含量,但对于这一变化原因多推测为乳酸菌的生物降解作用或酸水解反应将聚合酚类物质转化成更多简单酚类物质,或是由于微生物生长过程代谢的纤维素酶、木质素分解酶和果胶酶等的作用。β-葡萄糖苷酶(EC 3.2.1.21)作为一种纤维素水解酶,通过去糖基化过程参与酚类化合物的水解,破坏其与碳水化合物之间的化学键,将糖苷类黄酮转化为较高活性的苷元形式,这种转化利于提高基质的多酚含量和功能特性[5]。如高产β-葡萄糖苷酶乳酸菌发酵增强了猕猴桃底物的功能,添加到面包后增强了其抗氧化和风味特征[6]。关于乳菌酸发酵果蔬基质提高其功能活性的研究已有报道,然而具有产β-葡萄糖苷酶能力的乳酸菌发酵对基质的酚类含量和功能活性的影响研究仍旧有限。
因此,本文以富含酚类化合物的百香果皮为发酵基质,对比产糖苷酶和非产糖苷酶乳酸菌发酵对果皮酚类含量、抗氧化和抑制消化酶能力的影响,评估是否具有产糖苷酶能力的乳酸菌发酵更有利于酚类物质的释放和功能活性的增强。
1 材料与方法
1.1 菌株与试剂
戊糖乳杆菌L119(Lactobacillus pentosus,NCBI编号:ON705256)、戊糖乳杆菌L54(NCBI编号:ON705255)和戊糖片球菌(Pediococcus pentosaceus)WLT29(NCBI编号:ON705257),3株菌保藏于本实验室,其中L119、L54产葡萄糖苷酶,WLT29不产。
七叶苷,美国Solarbio公司;对硝基苯酚(p-nitrophenol,p-NP),成都艾科达化学试剂有限公司;DPPH自由基溶液,东京化成工业株式会社;α-葡萄糖苷酶、α-淀粉酶、对硝基苯酚β-葡萄糖苷(4-nitrophenyl-β-D-glucopyranoside,p-NPG),上海源叶生物科技有限公司;对硝基苯-α-D-葡萄糖苷,上海麦克林生物科技有限公司。
1.2 仪器与设备
pH计,梅特勒-托利多仪器(上海)有限公司;MI-250A细菌培养箱,上海施都凯仪器设备有限公司;CanLee 18R离心机,湖南湘立科学仪器有限公司;酶标仪,瑞士TECAN公司。
1.3 实验方法
1.3.1 乳酸菌发酵百香果皮浆
3株菌活化后经MRS液体培养基扩大培养至生长对数中期,取菌悬液于4 ℃、8 000 r/min离心5 min收集菌泥,使用无菌生理盐水洗涤2次后再次离心,取菌沉淀溶于无菌水中制成发酵种子液(OD600值约为0.8)。
将新鲜百香果皮洗净、擦干后切条,与水以质量比1∶3打浆至无大颗粒存在,加入2%(质量分数)白糖和1%(质量分数)脱脂乳粉混匀。使用柠檬酸和小苏打调节浆液pH值至5.7,然后分装于广口瓶中。灭菌(80 ℃,15 min),冷却后接入4%发酵种子液在37 ℃下无氧发酵48 h,并在0、8、16、24、36、48 h分别取样测定。
1.3.2 β-葡萄糖苷酶活性测定
参考 VILA等[7]的方法对粗酶液提取方法稍作修改。取2 mL发酵液,在4 ℃、10 000 r/min下离心15 min后收集沉淀,用磷酸钠缓冲液(0.5 mol/L、pH 6.5)清洗后再重复离心2次得到细胞沉淀。使用上述缓冲液调节其OD600值约为0.5,然后在细胞破碎仪中低温破碎(超声5 s,间歇5 s,超声功率600 W,循环200次),得到粗酶液。粗酶液在磷酸钠缓冲液中与p-NPG溶液反应后,测定400 nm处吸光值,并以加热失去活性的酶液(100 ℃、30 min)作为空白对照。以p-NP浓度(mmol/L)为横坐标,吸光值为纵坐标做标准曲线,得到回归方程y=1.074 4x-0.005 2,相关系数R2=0.999 7。
VILA等[7]的方法对粗酶液提取方法稍作修改。取2 mL发酵液,在4 ℃、10 000 r/min下离心15 min后收集沉淀,用磷酸钠缓冲液(0.5 mol/L、pH 6.5)清洗后再重复离心2次得到细胞沉淀。使用上述缓冲液调节其OD600值约为0.5,然后在细胞破碎仪中低温破碎(超声5 s,间歇5 s,超声功率600 W,循环200次),得到粗酶液。粗酶液在磷酸钠缓冲液中与p-NPG溶液反应后,测定400 nm处吸光值,并以加热失去活性的酶液(100 ℃、30 min)作为空白对照。以p-NP浓度(mmol/L)为横坐标,吸光值为纵坐标做标准曲线,得到回归方程y=1.074 4x-0.005 2,相关系数R2=0.999 7。
酶活力定义为每毫升粗酶液在37 ℃、pH 6.5条件下每分钟分解p-NPG产生1 μmol p-NP的活力。其计算如公式(1)所示:
(1)
式中:U,β-葡萄糖苷酶活力,U/mL;V1,总反应体系体积,mL;N,粗酶液稀释倍数;V2,粗酶液体积,mL;T,反应时间,min;x,吸光值带入标曲得到的p-NP浓度,μmol/L。
1.3.3 多酚含量测定
将发酵不同时间段百香果皮浆冻干后研磨成粉末状,放置干燥皿中以待提取。参照PAIVA等[8]的方法对酚类提取处理稍作修改并测定多酚含量。
游离酚的提取:取0.5 g百香果皮粉于50 mL离心管中,加入20 mL冷丙酮[V(丙酮)∶V(甲酸)=40∶1],在冰浴下超声提取30 min后离心10 min(4 ℃、5 000 r/min)。收集离心后的上清液,并将残余物重复提取2次。合并上清液,并在45 ℃下旋蒸。使用50%(体积分数)的甲醇将旋干物复溶至10 mL,得到游离酚提取液,置于4 ℃保存。
结合酚的提取:向游离酚提取后的残余物中加入10 mL NaOH(4 mol/L),充入氮气后密封。室温下振荡3 h,用HCl(6 mol/L)调节至pH=2。在4 ℃、5 000 r/min下离心10 min后收集上清液,用乙酸乙酯(体积比,1∶1)萃取滤液3次。收集合并乙酸乙酯相并在45 ℃下旋蒸直至除去乙酸乙酯后,使用50%的甲醇将其定容至10 mL,得到结合酚提取液,置于4 ℃保存。
含量的测定:采用Folin-Ciocalteu法测定酚含量,以没食子酸为标准品绘制标准曲线。含量以每克样品干基中所含没食子酸(gallate,GAE)当量的毫克数(mg/g)表示。总酚含量计为游离酚与结合酚含量之和。
1.3.4 乳酸菌总数测定
参照GB 4789.35—2016 中乳酸菌的计数方法。
1.3.5 pH值与总酸(total acid,TAC)测定
用pH计直接测定果皮浆pH值。参考GB 12456—2021测定发酵过程中的总酸含量。
1.3.6 抗氧化活性测定
ABTS阳离子自由基清除能力:参照DAHMOUNE等[9]的方法略加修改,以0.4 mL样品和1.6 mL ABTS阳离子自由基溶液反应测定。清除率计算如公式(2)所示:
清除率![]()
(2)
式中:A样、A空分别表示样品、空白对照组反应后的OD734值。
DPPH自由基清除能力和还原能力的测定参照LIU等[10]的方法测定,清除率计算同公式(2)。
1.3.7 消化酶抑制能力测定
样品处理:参考LORDAN等[11]的方法稍作修改。取0.2 g发酵各阶段冻干果皮粉,用10 mL 70%(体积分数)乙醇水溶液浸提1 h后,4 ℃、6 000 r/min下离心,重复提取沉淀后合并上清液,在55 ℃条件下旋干乙醇后用超纯水定容至25 mL,得到8 mg/mL的果皮样品提取液。随后稀释成不同浓度的待测液以测消化酶抑制率。
α-葡萄糖苷酶抑制:取100 μL pH 6.9的磷酸钠缓冲液(20 mmol/L)、50 μL待测液和50 μL对硝基苯酚-α-D-葡萄糖苷溶液(5 mmol/L)在96孔板中混匀37 ℃反应5 min。再加入100 μL 0.1 U/mL α-葡萄糖苷酶,37 ℃反应35 min后,加入50 μL 0.1 mol/L的NaHCO3终止反应,于405 nm处测定吸光度。以缓冲液作为空白对照组。抑制率按公式(3)计算,样品α-淀粉酶抑制能力用IC50值表示。
抑制率![]()
(3)
式中:B样、B空分别表示样品、空白对照组的OD405值。
α-淀粉酶抑制:将100 μL待测液与100 μL α-淀粉酶溶液(30 U/mL)混合。37 ℃水浴10 min后,加入100 μL 10 g/L淀粉溶液,在37 ℃水浴中再反应10 min,用200 μL 3,5-二硝基水杨酸(16.7 g/L)溶液终止反应,在540 nm处测量吸光度。以超纯水作为空白对照组。抑制率按公式(3)计算,样品α-淀粉酶抑制能力用IC50值表示。
1.3.8 数据分析
所有数据点均为至少3个独立实验的“平均值±标准偏差”。Excel 2021和SPSS 25整理实验数据,Duncan分析P<0.05水平的差异显著性,在0.01水平进行Pearson 相关性分析,由Origin 2021软件绘图。
2 结果与分析
2.1 发酵过程中果皮浆理化指标的变化
pH值和TAC是表征菌株生长和发酵程度的重要指标。发酵开始后,3组发酵浆的pH值快速下降至3.3左右,总酸含量和菌落总数显著升高,表明乳酸菌利用百香果皮浆中的糖分生长并产生有机酸,菌株对百香果皮浆底物具有良好的适应性(图1)。发酵48 h时,3组果皮浆的pH值稳定(2.8~3.0),TAC大量积累(9.4~9.8 g/kg),菌落数达到8.82~9.06 lg CFU/mL。不同样品的3个指标无显著差异,为分析多酚含量和功能活性提供了一致的基质环境。
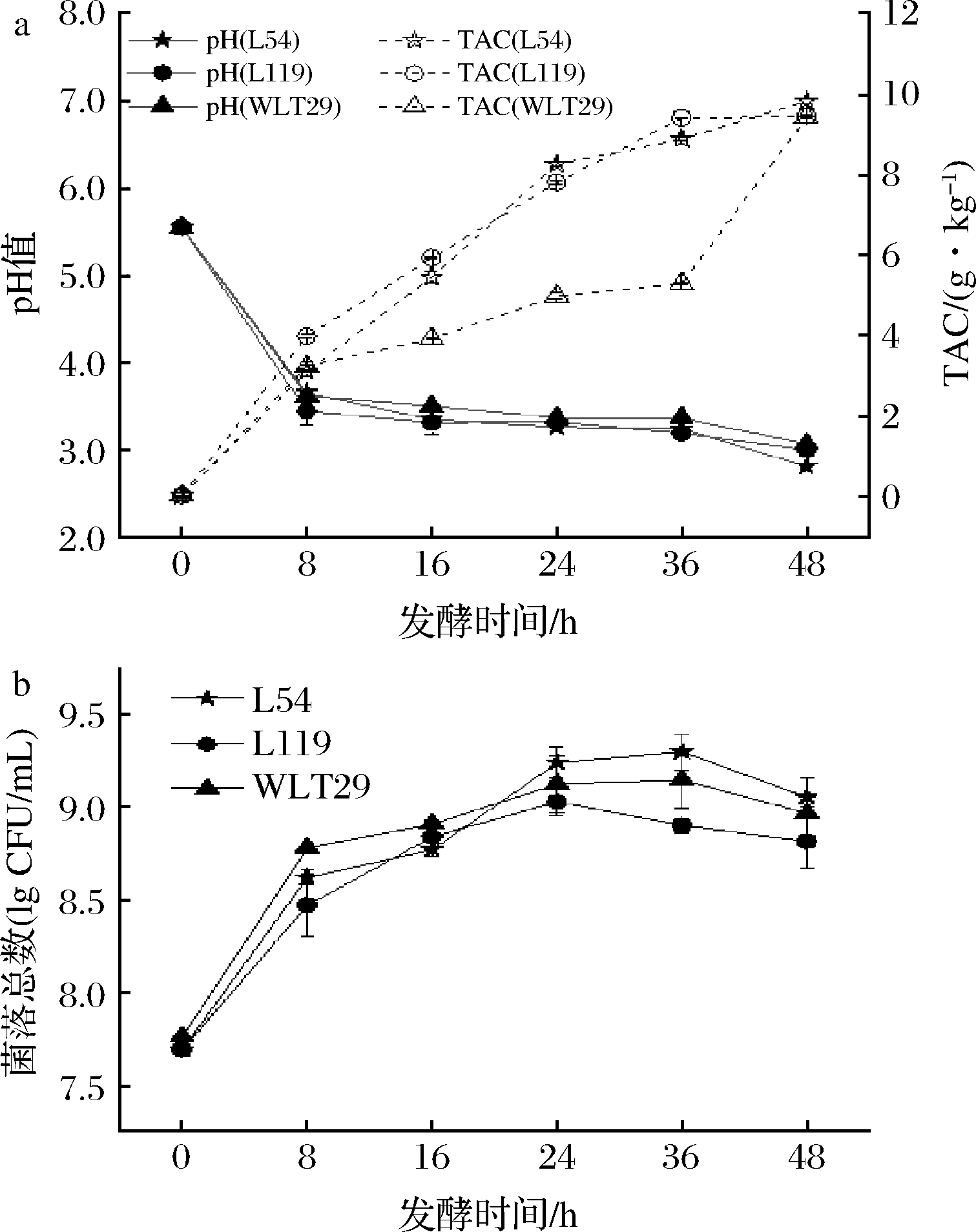
a-pH值与TAC;b-菌落总数
图1 接种乳酸菌发酵后百香果皮浆pH值、总酸含量及菌落总数变化
Fig.1 Changes in pH, total acid content, and colony number of passion fruit peel during LAB fermentation
2.2 发酵过程中酶活力的变化
为阐明β-葡萄糖苷酶对百香果皮浆酚类含量变化的影响,对发酵过程中β-葡萄糖苷酶活力进行测定。如表1所示,发酵过程中,L54和L119发酵组的β-葡萄糖苷酶活力呈现同样的变化趋势(先增后减),且均在24 h时达到最大值[(1.27±0.02)、(0.75±0.02) U/mL],随着发酵继续,糖苷酶活力开始下降。其中L54在发酵过程中表现出更高的酶活力,且酶活力规律与菌落总数变化规律相似,这与PYO等[12]的研究结果一致。L54发酵24 h后菌落总数虽短期升高,但增长速率已经减缓,L119菌株的菌落总数则呈降低趋势(图1)。可能是此时高酸环境抑制了菌体的生长与代谢活动,从而影响产酶活动,使得24 h时成为酶活力拐点。在哈尔滨乳杆菌J28和戊糖片球菌发酵猕猴桃实验中,发现类似的β-葡萄糖苷酶活性变化,但酶活力拐点出现在6 h[6]。另一方面,有研究指出来自植物乳杆菌的β-葡萄糖苷酶在pH 6.0时表现出最高活性,而在pH 3.0时仅保持约55%的活性[13]。尽管尚未有研究指出来自戊糖乳杆菌的β-葡萄糖苷酶的最适pH值,但高酸的抑制效果不容忽视。因此发酵液的总酸持续升高,可能也是酶活性受到抑制的因素。
表1 乳酸菌发酵百香果皮浆过程中的β-葡萄糖苷酶酶活力 单位:U/mL
Table 1 Enzymatic activity of β-glucosidase in passion fruit peel during LAB fermentation
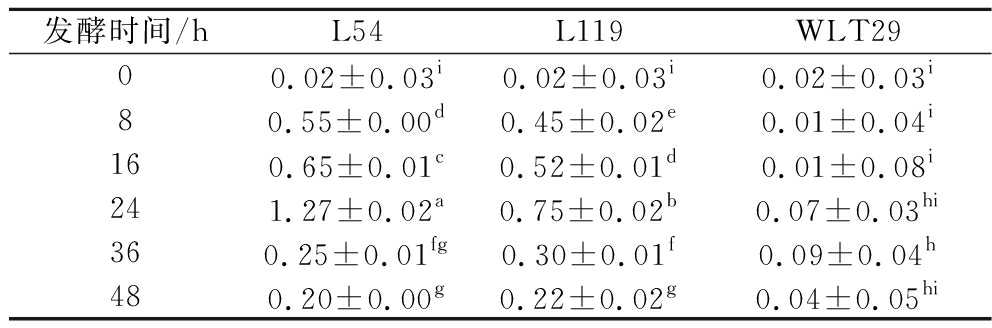
发酵时间/hL54L119WLT2900.02±0.03i0.02±0.03i0.02±0.03i80.55±0.00d0.45±0.02e0.01±0.04i160.65±0.01c0.52±0.01d0.01±0.08i241.27±0.02a0.75±0.02b0.07±0.03hi360.25±0.01fg0.30±0.01f0.09±0.04h480.20±0.00g0.22±0.02g0.04±0.05hi
注:不同上标字母代表显著性差异(P<0.05)
2.3 发酵过程中多酚含量的变化
如图2所示,各发酵组的游离酚含量为上升趋势,结合酚与总酚含量呈先减后增,并最终表现为增加。发酵结束时,L54高产酶组的游离酚和总酚含量[(25.30±1.02)、(70.85±2.26) mg/g DW]均高于L119低产酶组[(23.47±2.67)、(63.06±1.23) mg/g DW],且均远远高于WLT29非产酶组[(15.73±0.09)、(56.47±1.14) mg/g DW]。结合酚含量在降至同一水平后,L54高产酶组表现出更高的增加量,而L119低产酶组和非产酶组WLT29的含量变化类似。众所周知,简单的酚酸和类黄酮通常以共轭(糖苷)和结合形式出现,然而,酚酸可以通过酯或醚键与其他细胞壁组分连接,可以通过在室温下碱性水解酯键。在发酵后期,结合酚和总酚含量增加,这与许多研究结果相似[14-16],推测其原因可能是乳酸菌产生的酶会削弱结合的酚类物质和细胞壁组分之间的醚键,这使得结合酚更容易被提取。另一方面,在发酵过程中存在酶水解以释放酚类化合物,这有助于游离酚含量的显著增加。可能单一酶对结合酚转化的效力有限,导致发酵果皮中残留了大量的结合酚类物质。
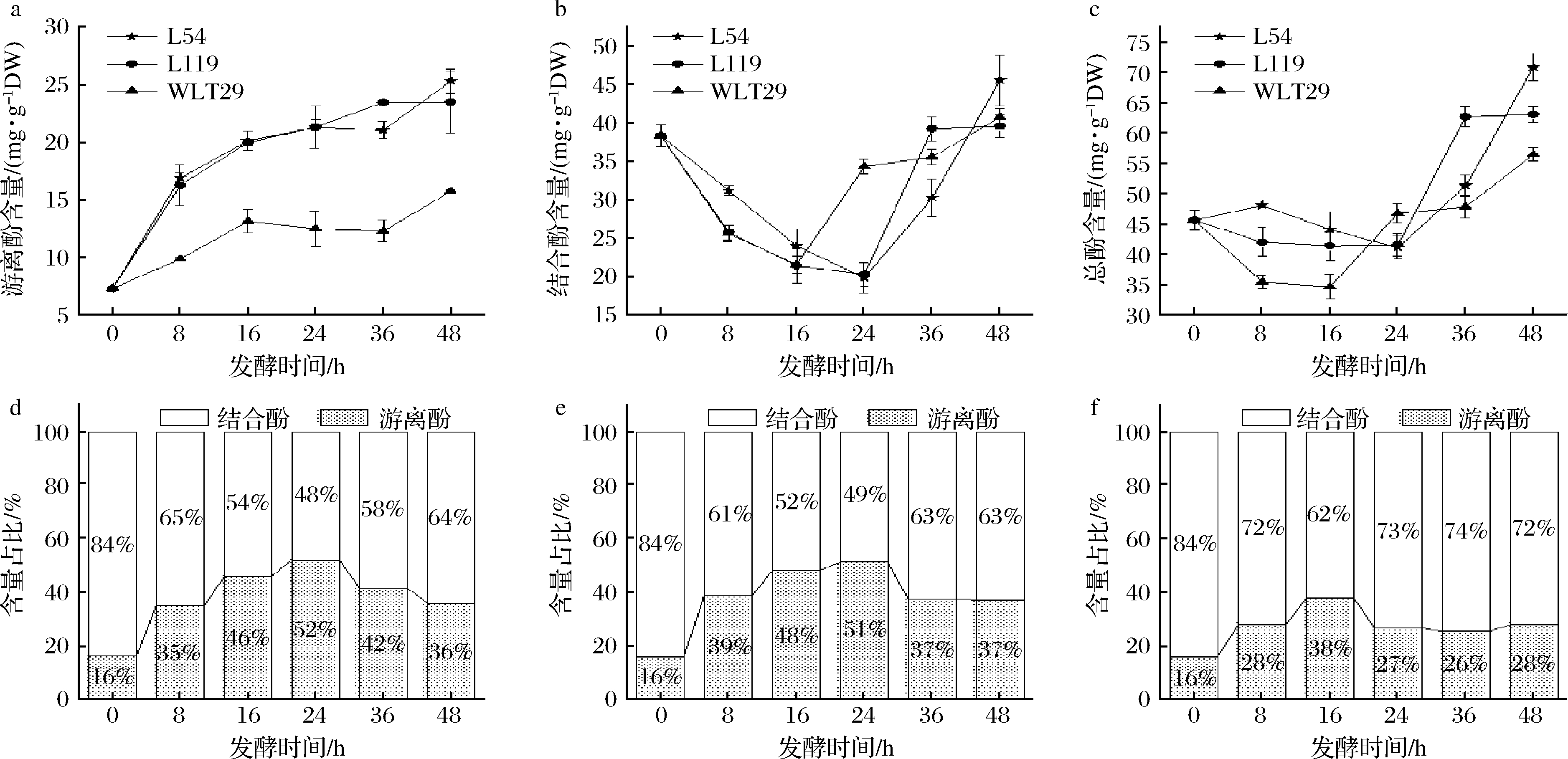
a-游离酚;b-结合酚;c-总酚;d-产β-葡萄糖苷酶的戊糖乳杆菌L54发酵;e-产β-葡萄糖苷酶的戊糖乳杆菌L119发酵;f-非产酶戊糖片球菌WLT29发酵
图2 乳酸菌发酵过程中百香果皮浆的多酚含量及组成变化
Fig.2 Changes in the content and composition of polyphenols in passion fruit peel pulp during LAB fermentation
图2表明乳酸发酵改变了百香果皮浆中游离酚与结合酚含量比例,且β-葡萄糖苷酶的存在利于游离酚含量占比的提高。百香果皮中多酚主要以共价键的形式与细胞壁的结构成分(纤维素、阿拉伯糖、木聚糖、木质素和果胶)相连接,形成不溶的结合态多酚。这与香蕉皮(82%)和橙子皮(80%)的不可提取多酚含量占比相近,高于苹果皮(32%)和梨皮(70%)[17],因此结合酚向游离酚的转化具有巨大潜力。L54、L119发酵组的结合酚含量与酶活力呈显著负相关(P<0.05)(图3)。β-葡萄糖苷酶通过弱化结合态多酚与细胞壁组间的共价键,从植物细胞壁中释放出可溶的共轭或不溶的结合酚类,为转化为游离酚提供机会。
此外,乳酸发酵积累大量乳酸,降低了果皮浆的pH值,更利于酚类物质的可提取性,表现为pH值、TAC与游离酚含量呈显著相关(P<0.05,图3)。pH值作为酚类提取的重要参数已在苹果中得到验证,即调整pH值从6.0降至3.0时,苹果多酚的提取率增长了近48%[18]。图2-c中总酚含量降低可能是发酵过程中酚类物质流动、大聚合酚类物质的形成及小酚类物质降解造成[19]。且福林酚法测定酚类含量易受到一些还原剂的影响,如抗坏血酸、柠檬酸、单糖或某些氨基酸。尽管乳酸发酵可以增加百香果皮浆的总酚含量,但实际代谢量可能低于本文结果[20]。综上,产β-葡萄糖苷酶的乳酸发酵更有利于结合多酚从基质中释放,以提高游离酚和总酚含量。
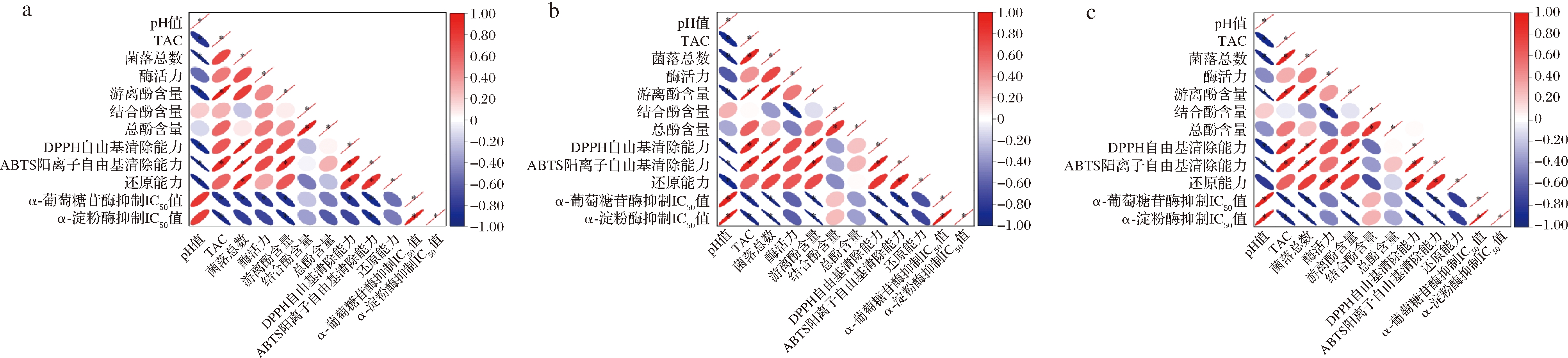
a-非产酶的戊糖片球菌WLT29;b-产β-葡萄糖苷酶的戊糖乳杆菌L54;c-产β-葡萄糖苷酶的戊糖乳杆菌L119
图3 乳酸菌发酵百香果皮浆过程中理化与活性指标的相关性
Fig.3 Correlation of physicochemical and bioactivity indexes of passion fruit peel during LAB fermentation
注:红色、蓝色分别代表正、负相关性;“*”表示在P<0.05水平上相关
2.4 发酵过程的抗氧化能力
如图4所示,乳酸发酵增强了百香果皮浆的抗氧化能力,并以ABTS阳离子自由基清除能力和铁离子还原能力的提高更为显著(P<0.05)。百香果皮发酵结束时,L54高产酶组提升了其34%的ABTS阳离子自由基清除率,高于L119低产酶组(20%),而WLT29非产酶组仅提升了9%;针对铁离子还原能力,L54高产酶组和L119低产酶组的提升能力类似(58%和56%),远低于WLT29非产酶组(86%);对于DPPH自由基清除能力,高产、低产与非产酶组的提升能力相近(3%~7%)。同时观察到游离酚含量与DPPH自由基、ABTS阳离子自由基呈显著正相关(P<0.05,图3)。
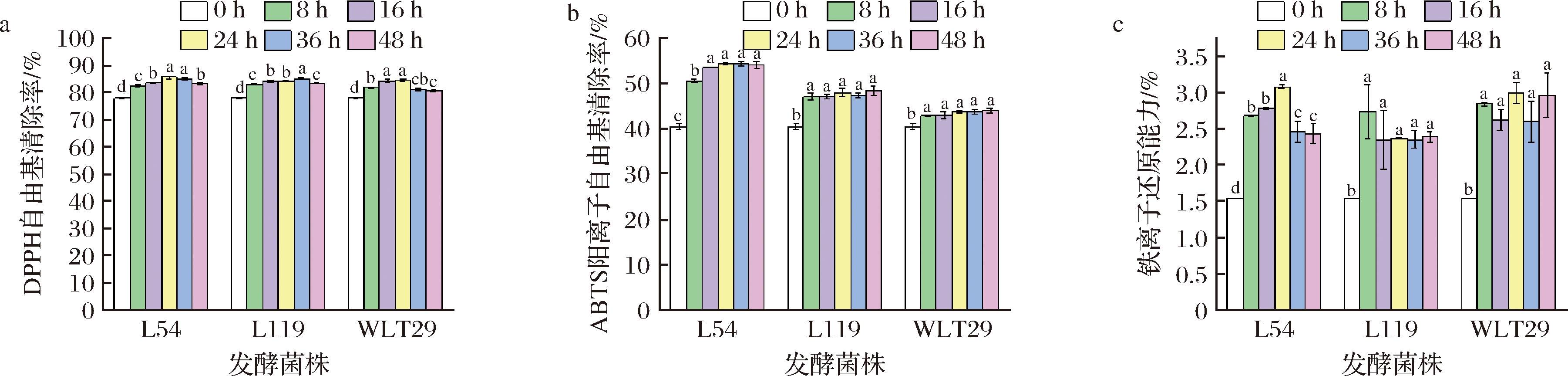
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-还原能力
图4 乳酸菌发酵过程中百香果皮浆DPPH自由基清除率、ABTS阳离子自由基清除率和还原能力的变化
Fig.4 Changes in DPPH free radical scavenging rate, ABTS cationic radical scavenging rate, and reducing capacity of passion fruit peel during LAB fermentation
注:不同上标字母代表显著性差异(P<0.05)(下同)
乳酸发酵对抗氧化力的改善与发酵橄榄汁的结果一致[21],对DPPH自由基、ABTS阳离子自由基产生的不同影响可归因于反应机制的差异。ABTS阳离子自由基为氢原子转移,DPPH自由基为电子转移,而还原能力主要取决于与苯环相连的羟基数量。种俸亭等[22]发现百香果皮中总酚、黄酮是发挥抗氧化活性的主要成分。故本研究中果皮浆游离酚含量的增加,利于其抗氧化能力的增强。β-葡萄糖苷酶可催化烷基和芳基β-D-葡萄糖苷中糖苷键水解,以及仅含有碳水化合物残基的糖苷。这种酶可能有助于糖间键的裂解,释放出具有更高活性的苷元,如植物乳杆菌产生的β-葡萄糖苷酶可水解橄榄苦苷[21],释放出橄榄苦苷苷元提高抗氧化活性,木犀草素和槲皮素苷元在抗氧化活性方面显著超过其3-/4′-/7-O-葡萄糖苷。
2.5 发酵过程中消化酶抑制活性测定
本研究测定了发酵过程中百香果皮浆的体外α-葡萄糖苷酶和α-淀粉酶抑制活性(图5),IC50值降低代表抑制活性增强。48 h时各样品处于相似的酸性环境,在两个产酶组中观察到更强的消化酶抑制活性,且L54高产酶组表现出更强的α-葡萄糖苷酶抑制活性。2株产酶菌在发酵前24 h,消化酶抑制活性不断显著降低。有研究发现百香果皮醇提物中存在数种α-葡萄糖苷酶和α-淀粉酶抑制剂,包括槲皮素、木犀草素、水杨酸等[1]苷元类黄酮,结合消化酶抑制IC50值与游离酚含量的显著负相关性(P<0.05,图3),推测β-葡萄糖苷酶通过将糖苷类黄酮转化为苷元类黄酮,进而提高其消化酶抑制能力。另一方面,消化酶抑制活性与pH值、TAC均呈强相关性(图3),证明乳酸发酵带来的酸度利于提高消化酶抑制能力,与前人的结论一致[23]。
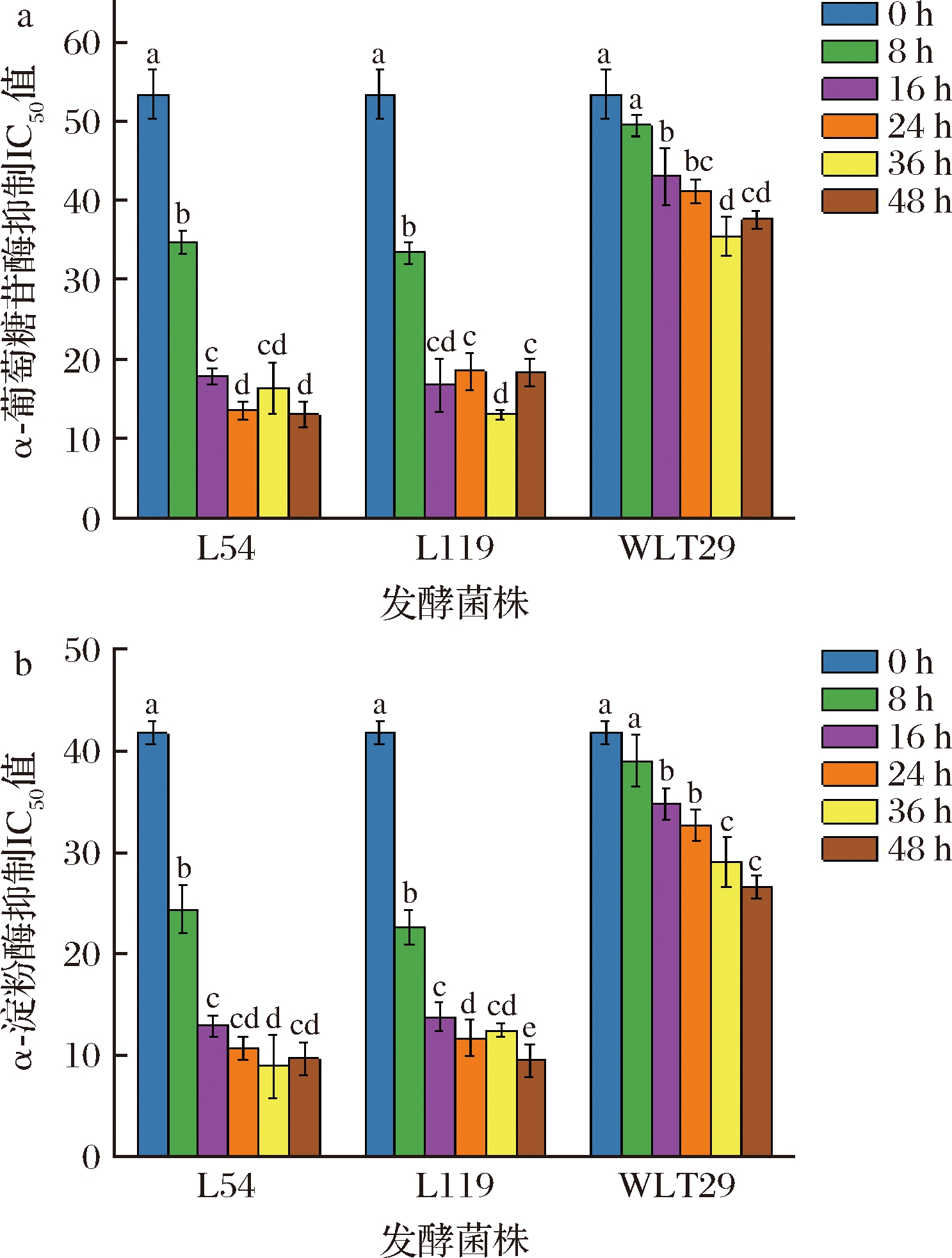
a-α-葡萄糖苷酶;b-α-淀粉酶
图5 乳酸发酵过程中百香果皮浆的α-葡萄糖苷酶和α-淀粉酶抑制能力
Fig.5 The α-glucosidase and α-amylase inhibition capacity of passion fruit peel during LAB fermentation
3 结论
与非产酶乳酸菌相比,接种产β-葡萄糖苷酶的乳酸菌发酵百香果皮释放出更多的游离酚,增加了总酚含量,并显著提高百香果皮的抗氧化活性和碳水化合物消化酶抑制活性。尽管仍需进一步研究产β-葡萄糖苷酶的乳酸菌对多酚物质代谢和转化的具体机理,但产β-葡萄糖苷酶的乳酸菌发酵在提高果蔬副产物多酚生物活性方面具有广阔前景。本文为功能菌株发酵百香果皮开发益生产品的研究提供参考,利用水果副产物创造更多经济价值。
[1] CAO Q Q, TENG J W, WEI B Y, et al.Phenolic compounds, bioactivity, and bioaccessibility of ethanol extracts from passion fruit peel based on simulated gastrointestinal digestion[J].Food Chemistry, 2021,356:129682.
[2] 黎宇田.火棘果渣及百香果皮中可萃取和未萃取多酚的组成与活性研究[D].武汉:华中科技大学, 2019.
LI Y T.Compositions and bioactivities of extractable and non-extractable polyphenols in Pyracantha fortuneana fruit and passion fruit pomace[D].Wuhan: Huazhong University of Science and Technology, 2019.
[3] WU C Y, LI T L, QI J, et al.Effects of lactic acid fermentation-based biotransformation on phenolic profiles, antioxidant capacity and flavor volatiles of apple juice[J].LWT, 2020,122:109064.
[4] 黄梅华, 何全光, 淡明, 等.火龙果皮乳酸菌发酵产品体外抗氧化能力研究[J].食品工业科技, 2017,38(17):70-74;79.
HUANG M H, HE Q G, DAN M, et al.Antioxidant activity of pitaya peel beverage fermented by lactic acid bacteria in vitro[J].Science and Technology of Food Industry, 2017,38(17):70-74;79.
[5] SEPTEMBRE-MALATERRE A, REMIZE F, POUCHERET P.Fruits and vegetables, as a source of nutritional compounds and phytochemicals:Changes in bioactive compounds during lactic fermentation[J].Food Research International, 2018,104:86-99.
[6] LIANG L T, OMEDI J O, HUANG W N, et al.Antioxidant, flavor profile and quality of wheat dough bread incorporated with kiwifruit fermented by β-glucosidase producing lactic acid bacteria strains[J].Food Bioscience, 2022,46:101450.
[7]  VILA M, HIDALGO M, S
VILA M, HIDALGO M, S NCHEZ-MORENO C, et al.Bioconversion of anthocyanin glycosides by Bifidobacteria and Lactobacillus[J].Food Research International, 2009,42(10):1 453-1 461.
NCHEZ-MORENO C, et al.Bioconversion of anthocyanin glycosides by Bifidobacteria and Lactobacillus[J].Food Research International, 2009,42(10):1 453-1 461.
[8] PAIVA F F, VANIER N L, DE JESUS BERRIOS J, et al.Physicochemical and nutritional properties of pigmented rice subjected to different degrees of milling[J].Journal of Food Composition and Analysis, 2014,35(1):10-17.
[9] DAHMOUNE F, NAYAK B, MOUSSI K, et al.Optimization of microwave-assisted extraction of polyphenols from Myrtus communis L.leaves[J].Food Chemistry, 2015,166:585-595.
[10] LIU L H, ZHANG C Y, ZHANG H M, et al. Biotransformation of polyphenols in apple pomace fermented by β-glucosidase-producing Lactobacillus rhamnosus L08[J]. Foods (Basel, Switzerland), 2021, 10(6):1343.
[11] LORDAN S, SMYTH T J, SOLER-VILA A, et al.The α-amylase and α-glucosidase inhibitory effects of Irish seaweed extracts[J].Food Chemistry, 2013,141(3):2 170-2 176.
[12] PYO Y H, LEE T C, LEE Y C.Enrichment of bioactive isoflavones in soymilk fermented with β-glucosidase-producing lactic acid bacteria[J].Food Research International, 2005,38(5):551-559.
[13] KO J A, KIM S Y, AHN H S, et al.Characterization of a lactic acid bacterium-derived β-glucosidase for the production of rubusoside from stevioside[J].Enzyme and Microbial Technology, 2022,153:109939.
[14] 王储炎, 张继刚, 杨柳青, 等.3种乳酸菌发酵对蓝莓多酚、原花青素含量及抗氧化活性的影响[J].食品科学, 2020,41(24):87-94.
WANG C Y, ZHANG J G, YANG L Q, et al.Comparative effects of fermentation with three species of lactic acid bacteria on polyphenol and proanthocyanidin contents and antioxidant activity of blueberry fruit[J].Food Science, 2020,41(24):87-94.
[15] BEI Q, WU Z Q, CHEN G.Dynamic changes in the phenolic composition and antioxidant activity of oats during simultaneous hydrolysis and fermentation[J].Food Chemistry, 2020,305:125269.
[16] 王静雯.乳酸菌发酵对蓝莓酚类物质组成和抗氧化活性的影响[D].沈阳:沈阳农业大学, 2020.
WANG J W.Study on iactic acid bacteria fermentation on phenolic composition and antioxidant activity of blueberries[D].Shenyang:Shenyang Agricultural University, 2020.
[17] PÉREZ-JIMÉNEZ J, SAURA-CALIXTO F.Fruit peels as sources of non-extractable polyphenols or macromolecular antioxidants:Analysis and nutritional implications[J].Food Research International, 2018,111:148-152.
[18] HOSSEINZADEH R, KHORSANDI K, HEMMATY S.Study of the effect of surfactants on extraction and determination of polyphenolic compounds and antioxidant capacity of fruits extracts[J].PLoS One, 2013,8(3):e57353.
[19] MUSTAFA S M, CHUA L S, EL-ENSHASY H A, et al.Effect of temperature and pH on the probiotication of Punica granatum juice using Lactobacillus species[J].Journal of Food Biochemistry, 2019,43(4):e12805.
[20] 唐富豪, 滕建文, 韦保耀, 等.基于非靶向代谢组学评价传统发酵对客家酸芥菜酚类化合物组成的影响[J].食品与发酵工业, 2021,47(8):128-133.
TANG F H, TENG J W, WEI B Y, et al.Evaluation of the influence of traditional fermentation on the composition of phenolic compounds in Hakka pickled mustard greens based on non-targeted metabolomics[J].Food and Fermentation Industries, 2021,47(8):128-133.
[21] CIAFARDINI G, MARSILIO V, LANZA B, et al. Hydrolysis of oleuropein by Lactobacillus plantarum strains associated with olive fermentation[J]. Applied and Environmental Microbiology, 1994, 60(11):4 142-4 147.
[22] 种俸亭, 黄子珍, 滕建文, 等.百香果皮体外抑制葡萄糖吸收、抗氧化及调节高血糖大鼠肠道菌群结构的作用[J].食品科学, 2021,42(5):193-200.
CHONG F T, HUANG Z Z, TENG J W, et al.Antioxidant effect of passion fruit peel and its effect on inhibiting glucose absorption in vitro and regulating intestinal microflora structure in hyperglycemic rats[J].Food Science, 2021,42(5):193-200.
[23] MUTLU C, CANDAL-USLU C, ÖZHANL H, et al.Modulating of food glycemic response by lactic acid bacteria[J].Food Bioscience, 2022,47:101685.
H, et al.Modulating of food glycemic response by lactic acid bacteria[J].Food Bioscience, 2022,47:101685.