蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质(GB 14963—2011)。蜂蜜的酿造是水分含量不断降低、多糖不断分解且营养物质不断积累直至蜂巢封盖成熟的过程。成熟蜂蜜是指蜜蜂将采回蜂巢中的花蜜经酿造、脱水,多糖和双糖充分酶解为单糖,葡萄糖和果糖的总含量达到70%以上,含水量降至18%以下,来自蜜蜂分泌物的活性成分充分积累,不能添加或移除任何物质[1]。蜂蜜的成熟度是表征蜂蜜质量的重要指标,不同成熟度蜂蜜的色泽、口感和营养价值都存在显著差异。非成熟蜂蜜水分含量大多高于25%,在适宜温度下,极易发酵产酸产气。为满足标准要求,工业生产中多对蜂蜜采取加热浓缩途径降低水分,但此过程会由于美拉德反应和氧化反应而生成大量的脂肪醛类、糠醛类和酮类等对人体健康有潜在危害的化合物[2-3],因此,加热浓缩降低了蜂蜜品质,增加了安全风险。具有较高成熟度的蜂蜜水分含量更低,香味更浓,营养物质更丰富,活性成分含量更高、保健功效更强,通过简单的过滤加工后即可上市销售,避免了因加工浓缩等工艺造成的有害物质积累和营养、风味成分的流失[4]。因此,成熟蜂蜜具有更高的营养价值和更全面的生物学功能[5],成熟度是蜂蜜质量评价的重要参考[6],成熟蜂蜜将成为市场的主流,而非成熟蜂蜜或经加热浓缩的蜂蜜必将被市场淘汰[7]。但由于利益驱使,不法分子常用非成熟蜂蜜冒充成熟蜂蜜,以次充好,扰乱蜂蜜市场,损害消费者利益。因此,对蜂蜜成熟度进行有效鉴别并由此评价蜂蜜的质量具有重要意义。
蜂蜜成分复杂,与蜂蜜成熟度相关的研究大多集中在不同成熟度蜂蜜的简单成分差异上,关于不同成熟度蜂蜜鉴别的研究较少。郭娜娜[7]研究发现未成熟油菜蜂蜜中有机酸、糖苷、植物碱等物质含量较多,而酚类物质更多地存在于成熟油菜蜂蜜中。马天琛[8]通过洋槐蜜的18个理化指标和电化学指纹图谱结合正交偏最小二乘判别分析建立了成熟蜂蜜、非成熟蜂蜜和浓缩洋槐蜜判别模型,验证识别正确率为100%。蜂蜜中含有大量的挥发性有机化合物(volatile organic compounds,VOCs),如醛类、酮类、烯烃、醇类和酯类等[9],每一种蜂蜜都具有自己独特的VOCs轮廓,这个轮廓能够较全面地揭示蜂蜜成分的复杂性和相关性[10],反映蜂蜜样品差异信息[11]。蜂蜜的独特香气与其成熟度密切相关[12],因此,VOCs测定与分析是鉴别蜂蜜成熟度的有效途径。
气相离子迁移谱(gas chromatography-ion mobility spectrometry, GC-IMS)是近年来发展起来的基于测定样品非靶向VOCs特征轮廓的新技术,兼具了气相色谱的高效分离性能和离子迁移谱灵敏度高、响应速度快的优势,不需要对样品进行预处理,可对样品中实现高效的二次分离,形成的三维图谱具有较强的可视化效果等优点。本文研究团队基于GC-IMS技术通过VOCs的分析在蜂蜜植物来源鉴别及产地溯源的研究中均得到了较好的结果[13]。基于成熟度在蜂蜜质量评价中的重要性和五倍子蜂蜜作为三峡库区重要特色商品蜂蜜的市场需求,本研究采用GC-IMS技术对采自重庆三峡库区由中华蜜蜂(中蜂)分别酿造1、3、6、9、12 d(成熟)共5个不同成熟度的五倍子蜂蜜进行VOCs测定,并对提取的差异信息建立偏最小二乘判别分析(partial least squares-discriminant analysis, PLS-DA)鉴别模型,为蜂蜜的成熟度鉴别提供新的技术参考。
1 材料与方法
1.1 实验材料
由中华蜜蜂分别酿造1、3、6、9、12 d(成熟)的五倍子蜂蜜样品各12个,共60个,样品采自重庆市万州区七和中蜂养殖合作社、重庆市万州区马槽寨农业专业合作社及养蜂个体户,蜂蜜采集地点位于重庆三峡库区的万州区、奉节县、云阳县、忠县、开州区、巫山县(每个区县均选取2个采样点,每个采样点均同时采集了5个不同成熟度的样品),测试前对所有样品进行了真实性验证,在4 ℃条件下保存。
1.2 仪器与设备
FlavourSpec 1H1-00053型气相色谱-离子迁移谱,德国G.A.S公司;CTC-PAL自动进样装置,瑞士CTC Analytics AG公司;FS-SE-54-CB-1,15 m×0.53 mm,0.25 μm(膜厚)毛细色谱柱,美国Restek公司。
1.3 GC-IMS检测条件
顶空进样条件:将2 g蜂蜜样品置于20 mL顶空进样瓶中,将进样瓶在60 ℃条件下孵育15 min后,以高纯N2为载气进样400 μL,进样针温度65 ℃。
气相色谱条件:色谱柱工作温度设定为60 ℃,载气高纯N2流速前2 min内为2 mL/min,2~20 min 线性上升至100 mL/min。
离子迁移谱条件:采用Tritium(6.5 keV)离子源的正离子模式,漂移气体在长度为9.8 cm的漂移管(温度为45 ℃)中以150 mL/min的流速流动;平均次数为12;电场强度:350 V/cm,网格脉冲宽度为100 μs,触发延迟时间为100 ms,采样频率为150 kHz,重复率为30 ms。
1.4 数据处理
采用GC-IMS Library Search V2.2.1 分析软件(G.A.S Inc.)对样品中的VOCs进行定性分析。采用MetaboAnalyst-5.0对所测多维数据进行可视化分析处理,应用PLS-DA评价VOCs与蜂蜜成熟度的相关性,建立鉴别模型。在GC-IMS三维图谱数据中,每一个特征峰代表一种VOCs,采用LAV 软件对不同样品中有明显差异的特征峰进行筛选标记,并以该特征区域离子强度的最大值作为特征变量,进行数据分析。
2 结果与分析
2.1 GC-IMS图谱分析
GC-IMS的检测结果以三维地图的形式呈现,显示了保留时间、迁移时间和信号强度等信息。GC-IMS图可以对不同样品之间的VOCs组成进行直观比较和初步判断,尤其是在二维俯视图中,不同样品中的VOCs种类及浓度差异比较直观,如图1所示,X轴表示归一化迁移时间,Y轴表示保留时间,离子信号强度用不同的颜色来表示,比如,当以酿造1 d的五倍子蜂蜜为参照进行差异对比时,其他4组样品对应的VOCs的浓度高低一目了然,红色越深,说明对应VOCs浓度比酿造1 d的蜂蜜样品中浓度高的越多;蓝色越深则反之。

a-1 d;b-3 d;c-6 d;d-9 d;e-12 d
图1 不同酿造时间的五倍子蜂蜜GC-IMS 谱图
Fig.1 GC-IMS spectra of gallnut honey at different brewing times
如图1所示,在不同成熟度的五倍子蜂蜜中,随着酿造时间的延长,有的成分减少了,有的成分消失了,同时也增加了一些成分,这种现象可以归因于蜂蜜在酿造过程中的物质转化。在GC-IMS 分析中,RI是一个稳定的色谱定性参数,反映了化合物与固定相的相互作用,具有良好的准确性和重现性。它是一个标准化的值,减少或消除特定实验条件如色谱柱、柱温、温度程序和压力等的因素影响[14],通过将实验计算的RI值与RI数据库或文献中的RI值比对可以有效地鉴别出化合物。GC-IMS Library Search 软件对标记成分RI进行检索,五倍子蜂蜜成熟度鉴别的部分特征峰对应的物质化学信息如表1所示。
表1 五倍子蜂蜜成熟度鉴别部分特征峰对应的VOCs名称
Table 1 VOCs names corresponding to some characteristic peaks of honey identification of gallnut honey maturity
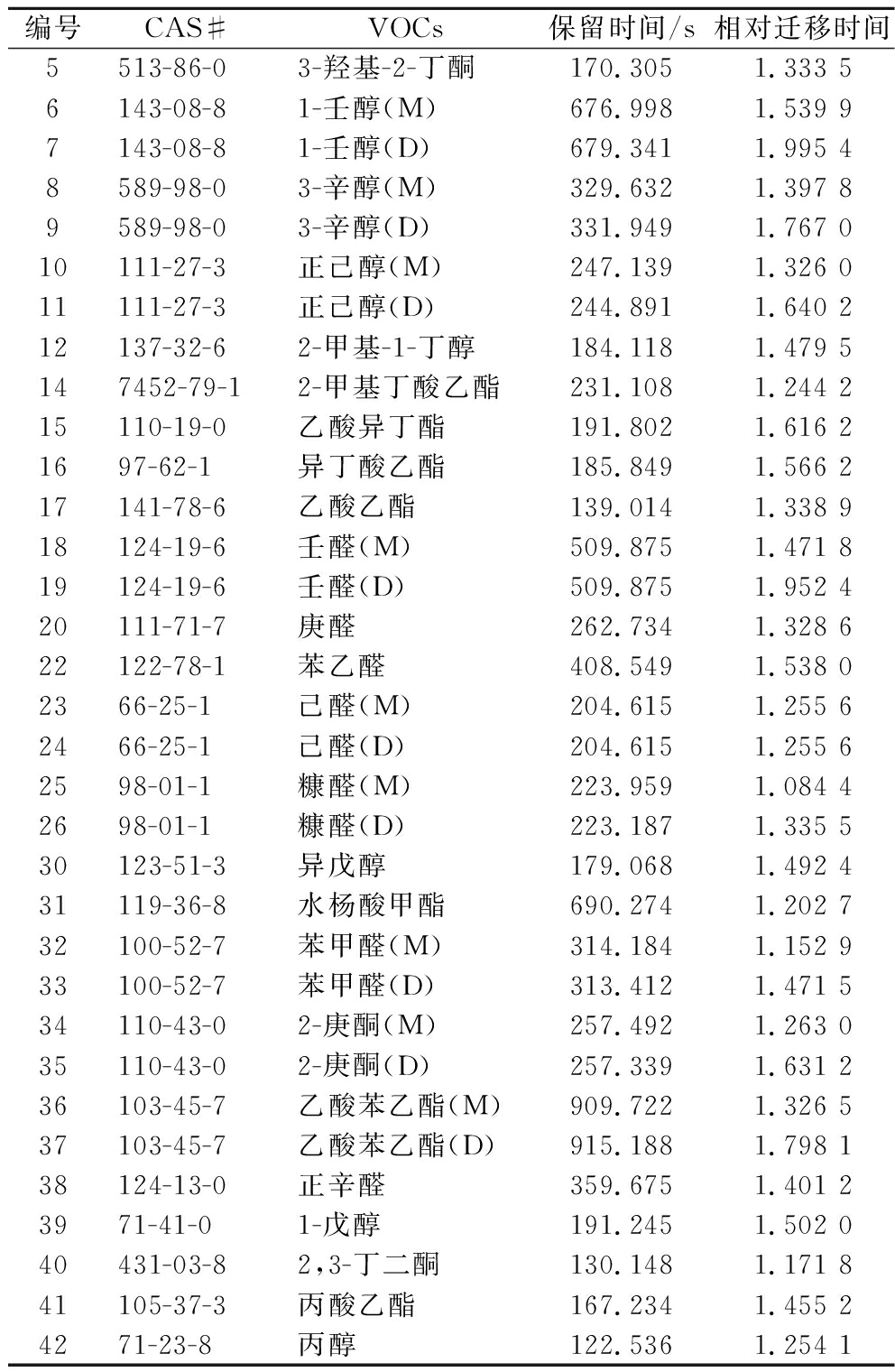
编号CAS#VOCs保留时间/s相对迁移时间5513-86-03-羟基-2-丁酮170.3051.333 56143-08-81-壬醇(M)676.9981.539 97143-08-81-壬醇(D)679.3411.995 48589-98-03-辛醇(M)329.6321.397 89589-98-03-辛醇(D)331.9491.767 010111-27-3正己醇(M)247.1391.326 011111-27-3正己醇(D)244.8911.640 212137-32-62-甲基-1-丁醇184.1181.479 5147452-79-12-甲基丁酸乙酯231.1081.244 215110-19-0乙酸异丁酯191.8021.616 21697-62-1异丁酸乙酯185.8491.566 217141-78-6乙酸乙酯139.0141.338 918124-19-6壬醛(M)509.8751.471 819124-19-6壬醛(D)509.8751.952 420111-71-7庚醛262.7341.328 622122-78-1苯乙醛408.5491.538 02366-25-1己醛(M)204.6151.255 62466-25-1己醛(D)204.6151.255 62598-01-1糠醛(M)223.9591.084 42698-01-1糠醛(D)223.1871.335 530123-51-3异戊醇179.0681.492 431119-36-8水杨酸甲酯690.2741.202 732100-52-7苯甲醛(M)314.1841.152 9 33100-52-7苯甲醛(D)313.4121.471 534110-43-02-庚酮(M)257.4921.263 035110-43-02-庚酮(D)257.3391.631 236103-45-7乙酸苯乙酯(M)909.7221.326 537103-45-7乙酸苯乙酯(D)915.1881.798 138124-13-0正辛醛359.6751.401 23971-41-01-戊醇191.2451.502 040431-03-82,3-丁二酮130.1481.171 841105-37-3丙酸乙酯167.2341.455 24271-23-8丙醇122.5361.254 1
注:M 表示单体,D 表示二聚体
依据不同成熟度五倍子蜂蜜中VOCs对应特征峰的差异,按照二维差谱原则[15-16],选取了45个特征峰进行排序对比,用以表征对应不同样品之间的差异信息。如图2所示,每种蜂蜜各取3个样品谱图以示意,横排为标记的特征成分对应的特征点,纵列为样品编号。在五倍子蜂蜜的酿造过程中,随着时间的延长,标记为2~7、14~16、36、37和41的特征VOCs明显减少,甚至消失;而标记为8、10、18~20、22~30、32、34、35和45的特征物质浓度明显增加,有的是从无到有,此结果进一步说明了蜂蜜的酿造过程是一个物质转化过程,在此过程中除了浓度明显变化的物质外还有些仅凭肉眼无法判断的变化。因此,为了更深入分析寻找规律,需引入统计分析方法。

图2 不同成熟度五倍子蜂蜜VOCs特征峰的对比库
Fig.2 Comparative GC-IMS spectra library of characteristic peaks corresponding to VOCs of gallnut honey with different maturity
热图是一种用颜色变化来反映数据信息的方式,可直观地将数据值的大小通过颜色深浅表示出来。如图3所示,在不同成熟度五倍子蜂蜜的特征VOCs数据热图中,每一列代表一个样品,每一排代表一种VOCs成分,每个小格代表某个样品中的某种VOCs成分,红色越深代表对应样品中的对应成分含量越高,蓝色越深则含量越低。因此,由图3可知,分别酿造1、3、6 d的五倍子蜂蜜中特征VOCs成分呈现明显的相似性,且与酿造9 d和12 d的有明显不同,但酿造9 d和12 d的五倍子蜂蜜中特征VOCs成分分布有较大程度的交叉,这说明了随着蜂蜜酿造时间的延长VOCs在不断发生着转化,酿造9 d的五倍子蜂蜜趋于成熟,同时也说明了成熟与不成熟的五倍子蜂蜜在VOCs特征成分上存在明显差异,这些差异是建立有效的蜂蜜成熟度鉴别模型的重要基础。

图3 不同成熟度五倍子蜂蜜GC-IMS数据热图
Fig.3 GC-IMS data heat map of gallnut honey from different maturity
2.2 成熟度鉴别模型的构建
本研究采用PLS-DA方法对GC-IMS测得并筛选出来的差异化VOCs分布进行分析,构建五倍子蜂蜜成熟度鉴别模型。图4为PLS-DA模型的二维得分图,由图4可知,酿造时间不同的5种五倍子蜂蜜分布在不同区域,酿造1、3、6 d的蜂蜜所在区域有部分重叠,但与酿造9 d和12 d即趋于成熟和成熟的五倍子蜂蜜所在区域无重叠,虽然酿造9 d和12 d所在区域距离较近,但也能较明显的将彼此分开,说明随着酿造时间的延长,蜂蜜中的VOCs在不断的变化,成熟蜂蜜或趋于成熟蜂蜜中的特征VOCs与非成熟蜂蜜有明显差异。因此,从上述结果可以明确,基于GC-IMS分析的VOCs可用于蜂蜜成熟度的有效鉴别。

图4 不同成熟度五倍子蜂蜜鉴别PLS-DA得分图
Fig.4 PLS-DA score diagram for identification of gallnut honey from different maturity
一般来说,PLS-DA模型是否发生过拟合可由内部交叉验证(cross-validation,CV)判定[17]。CV常被用作小样本模型的验证,一般分为留一法和留n法,留一法是指在构建模型时每次从总体样本中移出一个样本作为验证集,剩余的所有样本作为训练集,记录所有样本的预测残差平方和,留n法是将样本分成若干组,每次训练时删除一组作为验证集[18]。本研究采用10次交叉验证,将样品分成10组进行实验。在交叉验证中,预测能力参数(Q2)和拟合优度值(R2)是评价模型性能的主要指标,Q2和R2分别代表模型的预测能力和解释效果,Q2可通过交叉验证计算出来,R2是Q2经交叉验证前的值,它表示模型预测值与实际值的适应度,随着潜在变量的增加,R2逐渐接近1。在模型质量评价中Q2比R2更重要,Q2的极限值为1,一般认为Q2 >0.4表示所建模型是可接受的有效模型[17]。本研究的交叉验证结果如图5-a所示,五倍子蜂蜜成熟度鉴别模型中Q2和R2分别为0.706和0.880。

a-交叉验证结果;b-置换验证结果
图5 不同成熟度五倍子蜂蜜鉴别交叉验证结果和置换验证结果
Fig.5 Results of cross verification and permutation verification for identification of gallnut honey from different maturity
本研究对所构建的蜂蜜成熟度鉴别模型进行了置换模拟验证。置换验证通过执行随机安排的样本数据,Y-data的位置随机移位,以不同的顺序出现[19],然后统计推断,可增加模型中的样本数量,因此特别适用于样本较少的模型[20]。MetaboAnalyst-5.0中的置换模拟验证只要能推测出“只有极少数(5%)置换模拟的Q2值比当前的Q2值大”即可认为是没有出现过拟合。本研究进行100次置换验证的结果如图5-b所示,置换模拟中Q2值比当前的Q2值大的概率(P)均小于0.01,表明所构建的PLS-DA模型未出现过拟合,稳健有效。
2.3 基于变量投影重要性(variable importance for the projection,VIP)值的蜂蜜成熟度鉴别特征成分分析
利用VIP值进一步寻找能够有效区分五倍子蜂蜜成熟度的特征标志物。一个X变量VIP值的计算如公式(1)所示:
(1)
式中:VIPj表示第j个变量的VIP值;p为X变量的数量;k是h个潜变量中的第k个潜变量;ck为第k个潜变量的回归权值;wjk是X变量的权矩阵W的第k列的第j个元素[20]。
VIP值是PLS-DA模型中从不同类群中筛选出潜在标志物的主要参数,代表了特定标志物与蜂蜜聚类的相关性[21]。一般情况下,一种成分被认为是潜在标志物的条件是此成分的VIP 值应大于1[22-23]。
如图6所示,在五倍子蜂蜜成熟度鉴别模型中共筛选出VIP>1的特征标志物14个,其中能够被定性识别的包括:1-壬醇(D)、乙酸乙酯、苯甲醛(D)、乙酸苯乙酯(M)、乙酸苯乙酯(D)、3-辛醇(M)、壬醛(M)、壬醛(D)、苯乙醛,共9个。结合差异VOCs数据热图并对照表1对所筛选出的标志物进行分析得出,五倍子花蜂蜜随着酿造时间的延长,醇类和酯类物质如壬醇、辛醇、己醇、2-甲基丁醇、2-甲基丁酸乙酯、乙酸异丁酯、2-甲基丙酸乙酯、乙酸乙酯等含量逐渐减少,而醛类物质如壬醛、庚醛、苯乙醛、己醛、糠醛等逐渐增多。

图6 PLS-DA鉴别模型VIP >1的特征标志物
Fig.6 Characteristic markers of VIP>1 in PLS-DA identification model
3 结论
本研究首次将基于GC-IMS技术的VOCs测定与分析用于蜂蜜成熟度鉴别研究中,同时结合PLS-DA的理论与方法从整体VOCs分布轮廓的非靶向角度对5个不同成熟度的五倍子中蜂蜜进行了区分并建立稳健有效的PLS-DA鉴别模型。鉴别模型的拟合优度(R2)和预测能力(Q2)分别为0.880和0.706,交叉验证和置换模拟验证结果表明所构建鉴别模型未发生过拟合,稳健有效。另外,通过VIP值进一步筛选出了不同成熟度五倍子中蜂蜜中具有明显差异(VIP值>1)的9个的特征标志物,为五倍子蜂蜜成熟度的特征VOCs靶向鉴别研究奠定了基础。本研究从蜂蜜成熟度鉴别角度为蜂蜜的质量控制提供了新的技术参考。
[1] MONIRUZZAMAN M, KHALIL M I, SULAIMAN S A, et al.Physicochemical and antioxidant properties of Malaysian honeys produced by Apis cerana, Apis dorsata and Apis mellifera[J].BMC Complementary and Alternative Medicine, 2013, 13:43.
[2] TURHAN I, TETIK N, KARHAN M, et al.Quality of honeys influenced by thermal treatment[J].LWT-Food Science and Technology, 2008, 41(8):1 396-1 399.
[3] MOREIRA R F A, DE MARIA C A B, PIETROLUONGO M, et al.Chemical changes in the volatile fractions of Brazilian honeys during storage under tropical conditions[J].Food Chemistry, 2010, 121(3):697-704.
[4] 武文洲. 国内外蜂蜜加工工艺应用进展[J].现代食品, 2016(15):67-68.
WU W Z.Application progress of honey technology in china and abroad[J].Modern Food, 2016(15):67-68.
[5] 欧爱群, 郭娜娜, 刘富海, 等.蜂蜜成熟过程中主要成分和抑菌特性变化研究[J].中国农业科技导报, 2020, 22(2):101-106.
OU A Q, GUO N N, LIU F H, et al.Research on changes of main components and antibacterial properties during honey ripening process[J].Journal of Agricultural Science and Technology, 2020, 22(2):101-106.
[6] 王桃红, 张少博, 张会敏, 等.荞麦蜜中挥发性成分测定及其与成熟度的相关性分析[J].食品科学, 2020, 41(22):222-230.
WANG T H, ZHANG S B, ZHANG H M, et al.Determination of volatile components in buckwheat honey and correlation analysis with honey maturity[J].Food Science, 2020, 41(22):222-230.
[7] 郭娜娜. 酿造成熟与未成熟油菜蜂蜜成分组成及生物学活性比较研究[D].北京:中国农业科学院, 2020.
GUO N N.A comparative study on the composition and biological activity between naturally mature honey and immature honey from rape flower[D].Beijing:Chinese Academy of Agricultural Sciences, 2020.
[8] 马天琛. 成熟洋槐蜜的鉴别方法及其生物活性研究[D].西安:西北大学, 2020.
MA T C.Studies on the identification method and biological activity of mature Acacia honey[D].Xi′an:Northwestern University, 2020.
[9] ZHANG Y, TAO W Y.Flavor and taste compounds analysis in Chinese solid fermented soy sauce[J].African Journal of Biotechnology, 2009, 8:673-681.
[10] YANG Y, WANG B, FU Y, et al.HS-GC-IMS with PCA to analyze volatile flavor compounds across different production stages of fermented soybean whey tofu[J].Food Chemistry, 2021, 346:128880.
[11] ROMEO V, ZIINO M, GIUFFRIDA D, et al.Flavour profile of capers (Capparis spinosa L.) from the eolian archipelago by HS-SPME/GC-MS[J].Food Chemistry, 2007, 101(3):1 272-1 278.
[12] GERHARDT N, BIRKENMEIER M, SCHWOLOW S, et al. Volatile-compound fingerprinting by headspace-gas-chromatography ion-mobility spectrometry (HS-GC-IMS) as a benchtop alternative to 1H NMR profiling for assessment of the authenticity of honey[J].Analytical Chemistry, 2018, 9(30):1 777-1 785.
[13] 刘振平, 聂青玉, 庞钶靖, 等.气相离子迁移谱技术鉴别重庆三峡库区特色中蜂蜜研究[J].食品与发酵工业, 2021, 47(22):273-278.
LIU Z P, NIE Q Y, PANG K J, et al.Study on the identification of specialty honey of Apis cerana fabriciusin from the three Gorges Reservoir area of Chongqing based on gas chromatography-ion mobility spectrometry[J].Food and Fermentation Industries, 2021, 47(22):273-278.
[14] HE M, YAN P, YANG Z Y, et al.Multi-analytical strategy for unassigned peaks using physical/mathematical separation, fragmental rules and retention index prediction:An example of sesquiterpene metabolites characterization in Cyperus rotundus[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 154:476-485.
[15] HOLLINGSWORTH B V, REICHENBACH S E, TAO Q P, et al.Comparative visualization for comprehensive two-dimensional gas chromatography[J].Journal of Chromatography A, 2006, 1 105(1-2):51-58.
[16] CAVANNA D, ZANARDI S, DALL′ASTA C, et al. Ion mobility spectrometry coupled to gas chromatography: A rapid tool to assess eggs freshness[J]. Food Chemistry, 2019, 271:691-696.
[17] WOLD S, SJÖSTRÖM M, ERIKSSON L.PLS-regression:A basic tool of chemometrics[J].Chemometrics and Intelligent Laboratory Systems, 2001, 58(2):109-130.
[18] WORLEY B, POWERS R.Multivariate analysis in metabolomics[J].Current Metabolomics, 2013, 1(1):92-107.
[19] ![]() L, DEJA S, JASICKA-MISIAK I, et al.Chemometrics as a tool of origin determination of Polish monofloral and multifloral honeys[J].Journal of Agricultural and Food Chemistry, 2014, 62(13):2 973-2 981.
L, DEJA S, JASICKA-MISIAK I, et al.Chemometrics as a tool of origin determination of Polish monofloral and multifloral honeys[J].Journal of Agricultural and Food Chemistry, 2014, 62(13):2 973-2 981.
[20] AFANADOR N L, TRAN T N, BUYDENS L M C.Use of the bootstrap and permutation methods for a more robust variable importance in the projection metric for partial least squares regression[J].Analytica Chimica Acta, 2013, 768:49-56.
[21] WANG X R, ROGERS K M, LI Y, YANG S P, et al.Untargeted and targeted discrimination of honey collected by Apis cerana and Apis mellifera based on volatiles using HS-GC-IMS and HS-SPME-GC-MS[J].Journal of Agricultural and Food Chemistry, 2019, 67(43):12 144-12 152.
[22] CHENG Z, ZHANG X X, LIU X J, et al.Classification of different dried vine fruit varieties in China by HS-SPME-GC-MS combined with chemometrics[J].Food Analytical Methods, 2017, 10(8):2 856-2 867.
[23] LIU P, DUAN J N, WANG P J, et al.Biomarkers of primary dysmenorrhea and herbal formula intervention:An exploratory metabonomics study of blood plasma and urine[J].Molecular BioSystems, 2013, 9(1):77-87.