花生(Arachis hypogaea L.)又名“长生果”,在我国广泛种植,且产量丰富,是我国食用最多的坚果之一。花生是良好的蛋白质来源,其中含量最高的是花生球蛋白,占总蛋白的44.3%~62.7%[1]。研究表明花生球蛋白具有较好的乳化性、起泡性、吸水性和凝胶性等功能特性,可作为一种优良原料广泛应用于食品领域[2]。
蛋白质易受到活性氧等外界的影响而发生氧化变质,其中羟自由基是一种氧化能力最强的自由基,对细胞有高度的损伤性,也是引起蛋白质氧化的主要自由基之一[3]。研究发现,多酚的干预可抑制蛋白质的氧化修饰,改善蛋白质的功能特性。如XIONG[4]研究表明植物多酚(儿茶素、咖啡酸、绿原酸、迷迭香)可通过清除自由基的方式来抑制牛肉馅饼和炸丸子中蛋白质的氧化修饰;焦铭[5]发现在儿茶素的干预下,脂肪氧合酶催化亚油酸诱导大豆伴球蛋白氧化作用机理发生改变。上述报道主要针对多酚干预自由基氧化动物蛋白、大豆蛋白的作用解释,对于多酚干预花生球蛋白的相关研究鲜有报道。由于不同种类的多酚和蛋白质的性质、结构不一,其干预效果也不尽相同[6],因此,多酚对自由基氧化花生球蛋白的干预作用有待进一步探讨。
本研究以花生球蛋白为研究对象,通过铁/过氧化氢/抗坏血酸的氧化还原反应产生羟自由基,建立羟自由基氧化体系,对花生球蛋白进行模型氧化,采用杨梅素、儿茶素、绿原酸3种多酚对氧化体系进行干预,分析其氧化程度及结构的变化规律,从而探究多酚对羟自由基氧化花生球蛋白的影响,为花生蛋白的氧化抑制研究提供一些理论依据。
1 材料与方法
1.1 材料与试剂
云南红皮小花生,云南省昆明市;抗坏血酸(ascorbic acid,Asc)、乙二胺四乙酸(ethylene diamine tetraacetie acid, EDTA)、2,4-二硝基苯肼(2,4-dinitropHenylhydrazine,DNPH)、邻苯二甲醛(O-phthalaldehyde,OPA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇等,均为国产分析纯,北京索莱宝科技有限公司;牛血清蛋白标准品、儿茶素(catechin,C,纯度90%)、绿原酸(chlorogenic acid,CA,纯度98%)、杨梅素(myricetin,M,纯度96%),上海源叶生物科技有限公司。
1.2 仪器与设备
ZK-300B多功能小型高速粉碎机,德喜电器技术有限公司;5804R型多功能高速冷冻离心机,德国Eppendorf公司;MD SpectraMax Plus 384酶标仪,美国BIOTEK公司;UV-2600紫外可见分光光度计,苏州岛津;Lumina荧光分光光度计、Is50傅里叶红外光谱仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 花生球蛋白的制备
根据尹可宏等[2]方法略做修改,花生仁经脱脂后,按料液比1∶10(g∶mL)分散于0.05 mol/L pH 7.9的Tris-HCl缓冲液中,搅拌1 h后,4 ℃,4 000 r/min条件下离心10 min,取上清液加入0.01 mol/L亚硫酸氢钠,并以2 mol/L HCl将pH调至6.4,于4 ℃过夜贮存,同等条件下离心,弃上清液,取沉淀,用去离子水洗至中性,冻干后备用。
1.3.2 多酚干预羟自由基氧化体系建立
参照尹可宏等[2]和曹云刚[3]的方法略做修改,建立多酚干预羟自由基氧化体系。配制质量浓度为10 mg/mL的蛋白液,将蛋白粉溶于50 mmol/L pH 7.9的磷酸缓冲液后加入FeCl3和Asc,固定体系中二者终浓度为0.01 mmol/L,再向其分别添加不同量的儿茶素、绿原酸、杨梅素(13.33、40、66.67 μmol/g),37 ℃摇床中孵育12 h后,添加浓度为15 mmol/L的H2O2制备羟自由基氧化体系对其进行氧化修饰,37 ℃水浴恒温氧化1 h后加入EDTA终止氧化。透析、冻干备用。以冻干的花生球蛋白粉溶于磷酸缓冲液为模型组,在羟自由基氧化体系中氧化的花生球蛋白为氧化模型组。
1.3.3 羰基含量的测定
参照HUANG等[7]方法略作改动,采用DNPH显色法测定。用0.01 mol/L Tris-HCl缓冲液配制10 mg/mL的蛋白液,与DNPH在黑暗环境下反应后,添加三氯乙酸使其沉淀,用95%(体积分数)乙醇和乙酸乙酯按1∶1(体积比)混合洗涤沉淀后加入6 mol/L盐酸胍溶液在37 ℃下溶解15 min,离心后取上清液在370 nm处测吸光值,采用考马斯亮蓝法测定每组溶液的蛋白浓度,以22 000 L/(mol·cm)消光系数计算每毫克蛋白的羰基含量(nmol/mg)。羰基含量计算如公式(1)所示:
羰基含量![]()
(1)
式中:A370,上清液吸光值;A370对照,上清液对照组吸光值;b,比色半径,0.6 cm;c,蛋白质量浓度,mg/mL。
1.3.4 游离氨基的测定
参照HUANG等[7]采用OPA法略作改动测定游离氨基含量。用0.01 mol/L Tris-HCl缓冲液配制3 mg/mL的蛋白液,另外准确称取3 mg的OPA溶解于1 mL的乙醇中,加入质量分数为20%的SDS 2.5 mL和浓度为0.1 mol/L的硼砂25 mL以及100 μL β-巯基乙醇,最后用蒸馏水定容到50 mL。测定时,取3 mL OPA试剂于试管中,加入1 mL蛋白样液,混匀后室温下反应2 min。340 nm下测其吸光值,以L-亮氨酸表示游离氨基含量。
1.3.5 蛋白浊度的测定
依据WANG等[8]方法修改测定蛋白浊度。用0.01 mol/L Tris-HCl缓冲液配制质量浓度为3 mg/mL的蛋白液,12 000 r/min离心5 min,吸取上清液200 μL加入酶标板中,以不加蛋白的0.01 mol/L Tris-HCl缓冲溶液为空白(200 μL),在600 nm处测定吸光度,吸光度即为浊度。
1.3.6 紫外吸收光谱
参照ZHANG等[9]方法进行略微调整。用0.01 mol/L pH 7.4磷酸缓冲液配制1 mg/mL的蛋白液,4 ℃,12 000 r/min离心10 min,取上清液稀释为0.1 mg/mL,于190~500 nm、狭缝2 nm进行紫外扫描。
1.3.7 内源荧光的测定
样品制备方法同1.3.6,以290 nm为激发波长,发射波长范围为300~500 nm、狭缝5 nm,进行荧光扫描。
1.3.8 傅里叶红外变换光谱
采用李杨等[10]方法略作修改。取冻干蛋白样品粉末与溴化钾按照1∶100(质量比)充分研磨、混匀,在约22 MPa压力下加压10 s,扫描范围为400~4 000 cm-1,分辨率4 cm-1,波数精度0.01 cm-1,扫描次数32次。利用Peakfit Version 4.12软件,在1 600~1 700 cm-1进行基线校正后,在二阶导数谱基础上采用Gauss分峰拟合,根据二级结构分区计算各区域内子峰面积占总峰面积之比。
1.4 数据处理与分析
所有实验均进行3次重复实验,数据用Excel处理,用SPSS进行差异显著分析(P<0.05),Origin 2018作图。
2 结果与分析
2.1 多酚对花生球蛋白羰基含量的影响
羰基化是蛋白质氧化损伤后最明显的表征之一,因此该指标可作为判定花生球蛋白受羟自由基氧化损伤的程度[11]。如图1所示,羟自由基氧化使花生球蛋白羰基含量升高,这与尹可宏等[2]实验结果相似,说明花生球蛋白经羟自由基氧化后发生了损伤,使羰基含量升高。
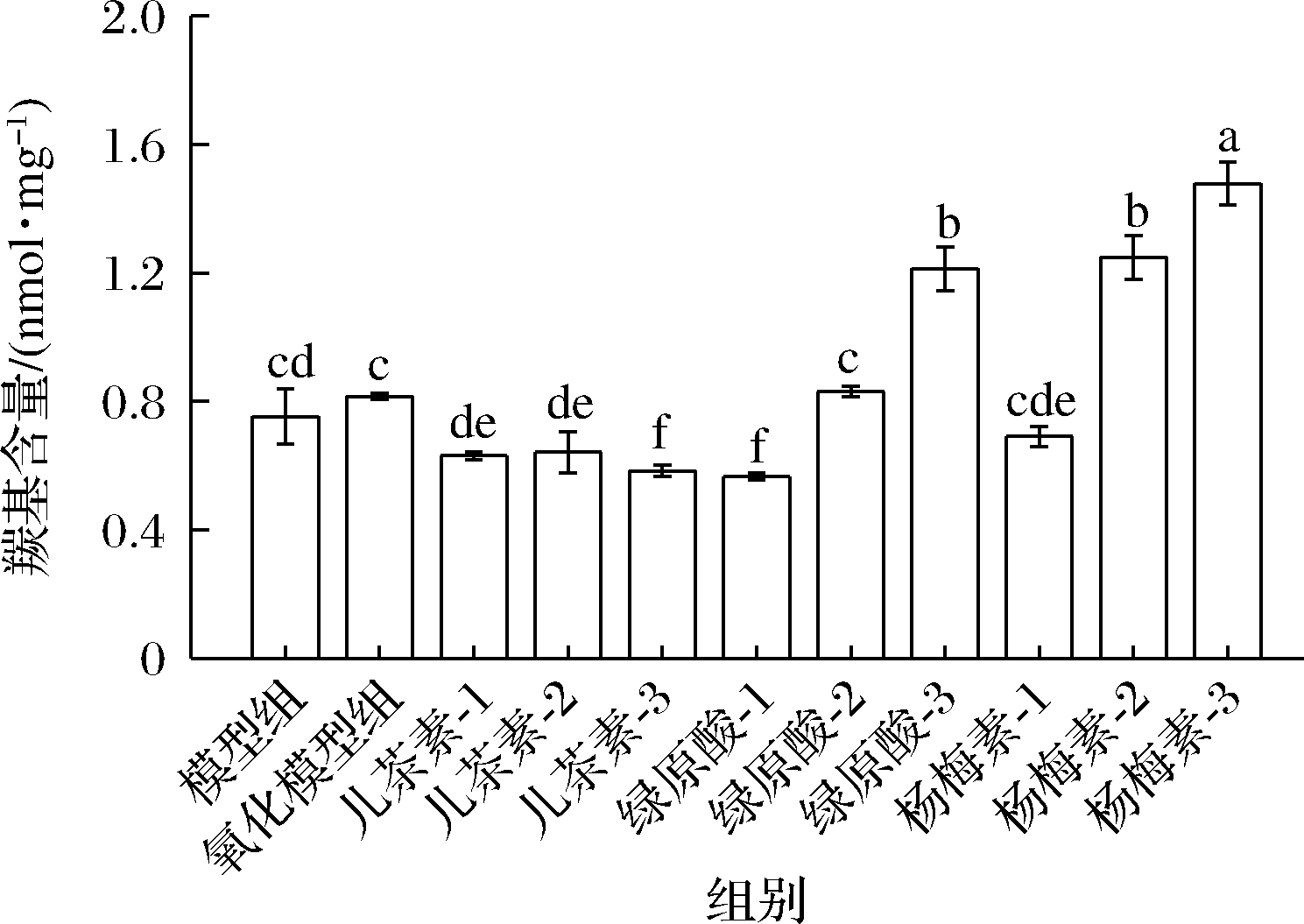
图1 多酚对花生球蛋白羰基含量的影响
Fig.1 Effects of polyphenols on the carbonyl content of arachin
注:图中不同小写字母表示差异显著(P<0.05);模型组:未氧化花生球蛋白;氧化模型组:经羟自由基氧化的花生球蛋白;儿茶素-1:氧化体系中添加儿茶素浓度为13.33 μmol/g;儿茶素-2:氧化体系中添加儿茶素浓度为40 μmol/g;儿茶素-3:氧化体系中添加儿茶素浓度为66.67 μmol/g;绿原酸和杨梅素的表示以此类推(下同)
多酚的干预使花生球蛋白的羰基含量发生相应的改变。与氧化模型组相比,当3种多酚干预浓度为13.33 μmol/g时,能显著抑制羟自由基氧化花生球蛋白羰基含量的增加(P<0.05)。儿茶素因含有大量的酚羟基,可作为氢供体与氧化体系中的自由基结合生成活性较低的多酚自由基,减少羰基含量的增加[12]。绿原酸、杨梅素因结构差异[6],当一定量的酚羟基与蛋白质结合达到饱和后,会通过特定的反应形成更多的自由基[12],随着二者浓度的继续增加,反而造成羰基含量的升高,促进花生球蛋白氧化的损伤。因此,儿茶素在抑制羰基含量增加的效果比绿原酸、杨梅素更好。由于多酚与蛋白质间的相互作用受很多因素的影响,除酚类物质的结构差异,与其氧化条件也有密切关系[3]。
2.2 多酚对花生球蛋白游离氨基的影响
氨基酸残基的—NH2在氧化过程中,容易受到羟自由基的攻击脱氨转化为羰基,同时形成的羰基及其衍生物又可进一步和—NH2基团发生共价结合,导致游离氨含量的降低[13]。如图2所示,氧化后的花生球蛋白游离氨基含量下降,这与贺宝玉等[14]的结果类似。该变化可能是蛋白质氨基酸侧链中含有—NH—或—NH2的氨基酸参与了羰基的形成,造成了游离氨基的减少[15]。
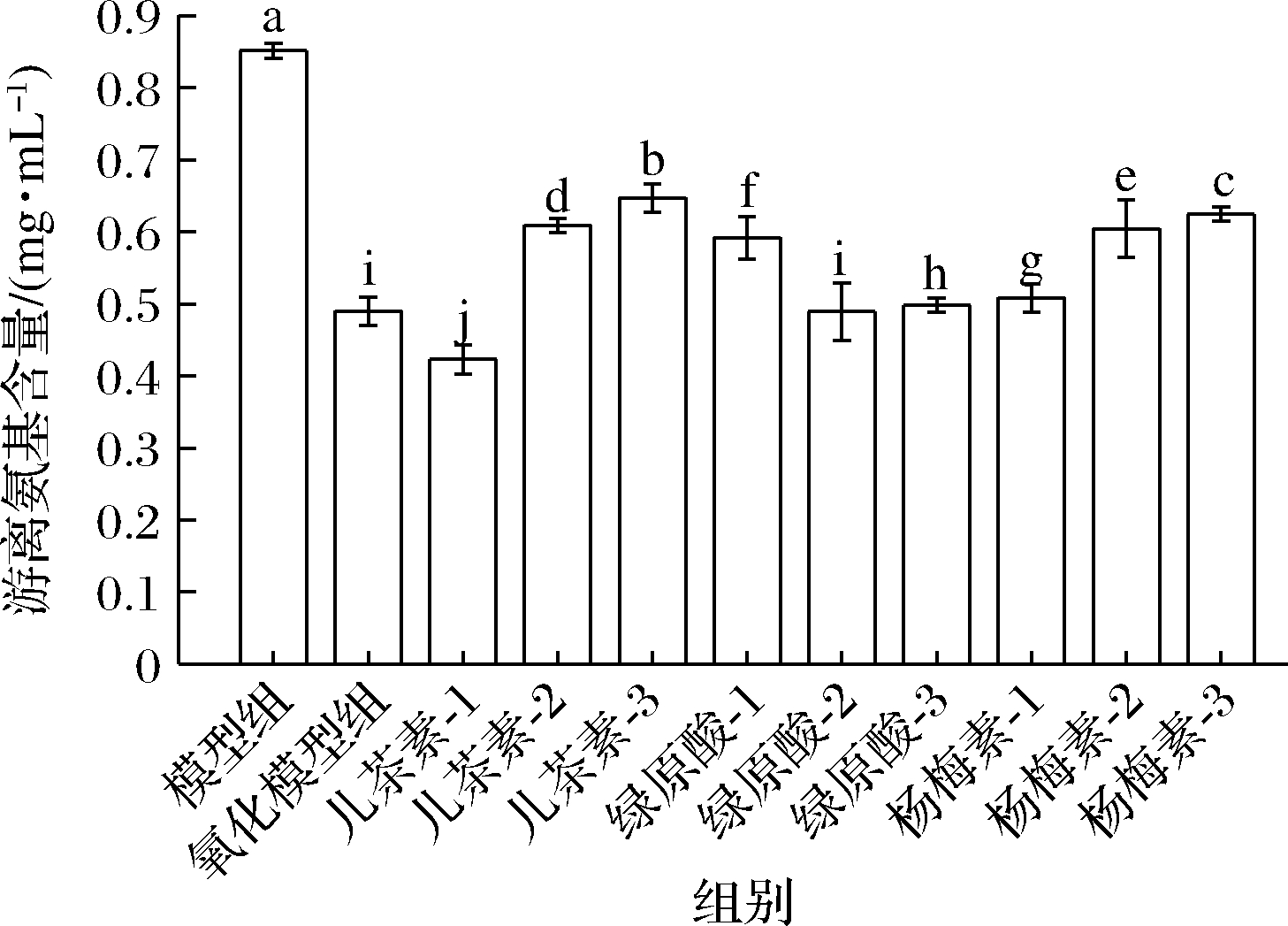
图2 多酚对花生球蛋白游离氨基的影响
Fig.2 Effects of polyphenols on free amino groups of arachin
与氧化模型组比较,66.67 μmol/g的儿茶素使花生球蛋白游离氨基升高32.08%(P<0.05),这与本研究中羰基含量的结果一致。其次是干预浓度为66.67 μmol/g的杨梅素,使游离氨基升高27.51%(P<0.05)。当绿原酸的添加量大于40 μmol/g时,游离氨基含量无明显变化。有研究表示,邻苯二酚结构(如儿茶素、绿原酸)的促氧化活性与醌类氧化产物的形成有关[5],儿茶素因其多羟基结构易被氧化形成邻醌,为邻苯二酚的自由基中间体,能抑制自由基对蛋白质的进一步作用[6],而绿原酸氧化后会转变成半醌或醌类化合物,其中包含大量的反应性亲电分子,这些分子很容易与蛋白质或氨基酸的官能团进一步共价结合[3],从而增强邻苯二酚结构的促氧化活性。因此,酚类物质的种类和浓度对其促氧化或抗氧化特性影响较大[12]。
2.3 多酚对花生球蛋白浊度的影响
浊度的大小可反映蛋白质的聚集程度,常用于研究酚类物质和蛋白质之间的共价或非共价相互作用[16]。图3显示,氧化后的花生球蛋白浊度明显上升,说明羟自由基氧化使蛋白质之间发生交联反应,导致蛋白溶液光学密度增加[17]。
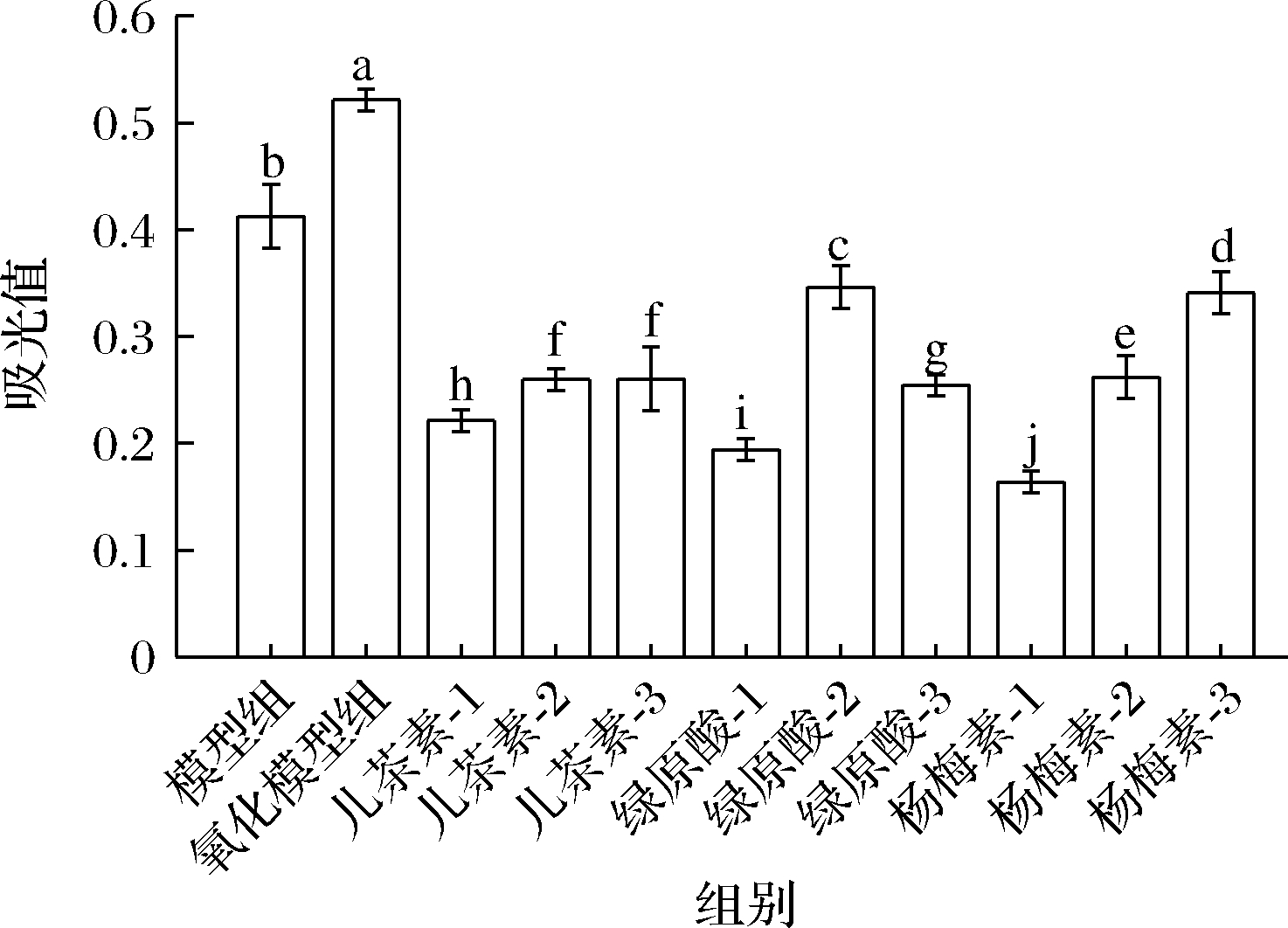
图3 多酚对花生球蛋白浊度的影响
Fig.3 Effects of polyphenols on turbidity of arachin
3种多酚的干预均使花生球蛋白浊度显著下降,其中添加13.33 μmol/g杨梅素干预后浊度降低68.63%(P<0.05),并随其浓度的增加浊度增大。当儿茶素的干预浓度超过66.67 μmol/g时,体系中蛋白浊度出现回升,这与李颖畅等[16]研究类似,说明添加一定浓度的多酚能够让蛋白悬浮颗粒变小,使蛋白分散均匀。
2.4 多酚对花生球蛋白紫外可见吸收光谱的影响
紫外-可见吸收光谱常用来研究蛋白和小分子相互作用的构象变化,蛋白质所含的氨基酸中色氨酸残基在270~290 nm处具有较强的紫外吸收峰[18]。因此可以通过紫外吸收光谱反映蛋白质构象的变化。如图4所示,与模型组比较,花生球蛋白经氧化后紫外吸光度值下降,最大吸收峰发生轻微蓝移,说明在氧化过程中酪氨酸或色氨酸含量降低,使其紫外吸光度值下降[19]。

图4 多酚对花生球蛋白紫外可见吸收光谱的影响
Fig.4 Effects of polyphenols on UV-vis absorption spectra of arachin
3种多酚的干预使花生球蛋白溶液的紫外吸光度值均升高,这可能是因为多酚本身含有的苯环基团会产生紫外吸收,另外,多酚与花生球蛋白发生相互作用产生“增色效应”[19],使紫外吸光度值升高。绿原酸干预浓度为66.67 μmol/g时,其紫外吸光度值升高最明显,其他不同浓度的多酚也使蛋白紫外吸光度呈不同程度的上升,说明一定浓度酚类物质的加入能够抑制花生球蛋白在270~280 nm处吸收峰的降低[19]。
2.5 多酚对花生球蛋白内源荧光的影响
蛋白质内源荧光的产生主要因为色氨酸、酪氨酸和苯丙氨酸残基的存在,其相对位置可通过荧光峰位来反映,因此常用来表征蛋白质构象的变化[20]。多酚对花生球蛋白的内源荧光最大波长和荧光强度如图5-a、图5-b所示。氧化后花生球蛋白最大峰值所在的波长由330 nm蓝移到328.5 nm,说明羟自由基氧化使花生球蛋白的结构部分或完全展开,蛋白中的色氨酸残基被氧化为犬尿氨酸,从花生蛋白分子的外部迁移至内部[20],色氨酸残基暴露溶剂的疏水环境中,使所处环境极性降低,导致花生球蛋白的聚集和结构变化。经儿茶素与绿原酸干预后,花生球蛋白最大波长分别红移至330.8、331 nm。

a-内源荧光最大波长;b-荧光强度
图5 多酚对花生球蛋白内源荧光的影响
Fig.5 Effects of polyphenols on endogenous fluorescence of arachin
不同浓度的多酚干预使花生球蛋白的荧光强度明显降低(图5-b)。可能是酚类物质与花生球蛋白发生了相互作用,产生非荧光性物质[21],亦或是分子之间相互碰撞,使蛋白的内源荧光发生不同程度的猝灭[22],且多酚的种类和浓度的不同对蛋白荧光猝灭效果也不同[23]。
2.6 多酚对花生球蛋白二级结构的影响
红外光谱中蛋白酰胺带Ⅰ常被划分为β-折叠(1 620~1 636 cm-1,1 677~1 696 cm-1)、无规则卷曲(1 640~1 648 cm-1)、α-螺旋(1 649~1 658 cm-1)、β-转角(1 659~1 670 cm-1)[24],经去卷曲、二阶导拟合后花生球蛋白的二级结构比率如图6所示。与模型组比较,氧化模型组中α-螺旋含量从26%下降至24.21%,无规则卷曲含量从22%上升至28.66%,β-折叠含量从37%下降至31.09%,β-转角增加不明显。α-螺旋含量的减少、无规则卷曲的增加说明氨基酸经羟自由基攻击后,花生球蛋白肽链结构的规律性被打乱,多肽链的空间走向发生重排,进而引起蛋白质的变性,而β-转角的氨基酸不易受到自由基的攻击[22]。
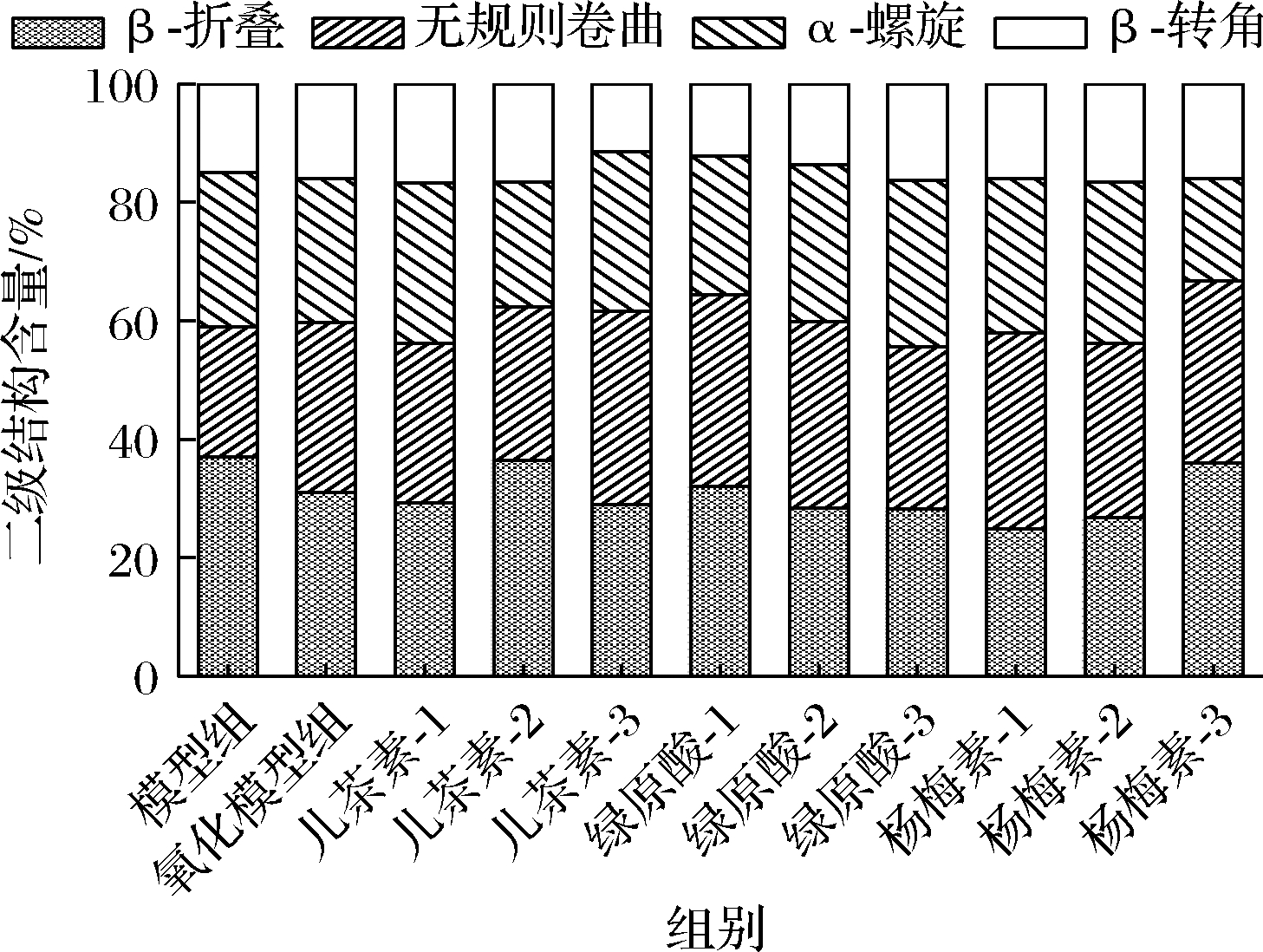
图6 多酚对花生球蛋白二级结构的影响
Fig.6 Effects of polyphenols on the secondary structure of arachin
与氧化模型组比较,添加不同浓度多酚均可使花生球蛋白中α-螺旋含量增加、无规则卷曲含量减少。其中添加66.67 μmol/g的绿原酸使α-螺旋含量上升至28.07%,并伴随无规卷曲含量上升,40 μmol/g的儿茶素使无规则卷曲含量下降至25.82%,α-螺旋含量轻微上升,这与前人报道的结果类似,说明多酚类物质的干预在一定程度上可使氧化蛋白的结构从无序向有序转化,有利于维持蛋白质的二级结构[25]。
3 结论
本研究通过建立羟自由基氧化体系,考察3种多酚对氧化花生球蛋白结构的影响。结果发现,花生球蛋白经羟自由基氧化后,羰基、游离氨基、浊度、紫外可见、荧光光谱及二级结构发生相应的变化,而经不同浓度的儿茶素、绿原酸、杨梅素干预后,可抑制氧化过程中花生球蛋白羰基的产生,内源荧光最大波长发生红移,游离氨基和α-螺旋含量上升,无规则卷曲含量和浊度降低,并获得最大紫外吸光值。由此可见,不同浓度的儿茶素、绿原酸、杨梅素对羟自由基引起的花生球蛋白氧化起一定程度的抑制作用,其中儿茶素的氧化抑制效果最好。在花生蛋白食品的贮藏和加工过程中,可通过添加适度多酚以减少过度氧化引起花生品质的劣变。
[1] 陈湘瑜, 徐日荣, 陈昊, 等.杜兰落花生球蛋白基因家族的生物信息学分析[J].中国油料作物学报, 2019, 41(3):391-398.
CHEN X Y, XU R R, CHEN H, et al.Bioinformatic analysis of globulin gene family in Arachis duranensis[J].Chinese Journal of Oil Crop Sciences, 2019, 41(3):391-398.
[2] 尹可宏, 杨茜, 赵秀飞, 等.羟自由基氧化对花生球蛋白结构和功能性质的影响[J].食品与发酵工业, 2022, 48(4):24-31.
YIN K H, YANG X, ZHAO X F, et al.Effects of hydroxyl radical oxidation on the structure and functional property of arachin[J].Food and Fermentation Industries, 2022, 48(4):24-31.
[3] 曹云刚. 植物多酚对肉蛋白氧化稳定性和功能特性的影响机理及应用[D].无锡:江南大学,2016.
CAO Y G.Effect of plant-derived polyphenols on oxidative stability and functional properties of meat proteins:Mechanism and application[D].Wuxi:Jiangnan University, 2016.
[4] XIONG Y L.Inhibition of hazardous compound formation in muscle foods by antioxidative phytophenols[J].Annals of the New York Academy of Sciences, 2017, 1 398(1):37-46.
[5] 焦铭. 儿茶素干预脂肪氧合酶催化亚油酸诱导大豆伴球蛋白氧化的作用机理研究[D].广州:华南理工大学,2018.
JIAO M.Intervention mechanism of catechin on β-conglycinin oxidation induced by lipoxygenase-catalyzed linoleic acid[D].Guangzhou:South China University of Technology, 2018.
[6] 王乐田, 贾娜.植物多酚对肉制品脂肪氧化和蛋白氧化的抑制机理及应用[J].中国食品学报, 2016, 16(8):205-210.
WANG L T, JIA N.Mechanisms and application of plant polyphenol in inhibiting lipid and protein oxidation in meat products[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(8):205-210.
[7] HUANG Y R, HUA Y F, QIU A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International, 2006, 39(2):240-249.
[8] WANG Y H, WAN Z L, YANG X Q, et al.Colloidal complexation of zein hydrolysate with tannic acid:Constructing peptides-based nanoemulsions for alga oil delivery[J].Food Hydrocolloids, 2016, 54:40-48.
[9] ZHANG D, LI H J, EMARA A M, et al.Effect of in vitro oxidation on the water retention mechanism of myofibrillar proteins gel from pork muscles[J].Food Chemistry, 2020, 315:126226.
[10] 李杨, 王中江, 王瑞, 等.不同热处理条件下大豆分离蛋白的红外光谱分析[J].食品工业科技, 2016, 37(8):104-109.
LI Y, WANG Z J, WANG R, et al.Fourier transform infrared spectroscopic analysis of soybean isolate protein at different heat treatment conditions[J].Science and Technology of Food Industry, 2016, 37(8):104-109.
[11] KHORASANI S, BOROUMAND N, PASAVEI A G, et al.A study on association between protein carbonyl and anti-cyclic citrullinated peptide antibody in rheumatoid arthritis:Introducing a new supplementary biomarker[J].Indian Journal of Clinical Biochemistry, 2020, 35(3):347-352.
[12] ESTÉVEZ M.Protein carbonyls in meat systems:A review[J].Meat Science, 2011, 89(3):259-279.
[13] CAO Y G, XIONG Y L.Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J].Food Chemistry, 2015, 180:235-243.
[14] 贺宝玉, 董秀芳, 奚倩, 等.海参肌原纤维蛋白在羟自由基生成体系中的结构变化[J].中国食品学报, 2020, 20(12):16-23.
HE B Y, DONG X F, XI Q, et al.Structural changes of sea cucumber(Stichopus japonicus) myofibrillar protein in hydroxyl radical-generated system[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(12):16-23.
[15] LI C Q, XIONG Y L, CHEN J.Oxidation-induced unfolding facilitates Myosin cross-linking in myofibrillar protein by microbial transglutaminase[J].Journal of Agricultural and Food Chemistry, 2012, 60(32):8 020-8 027.
[16] 李颖畅, 赵楠, 李园园, 等.儿茶素对鱿鱼肌肉-TMAOase体系中肌原纤维蛋白功能特性的影响[J].中国食品学报, 2021, 21(12):46-54.
LI Y C, ZHAO N, LI Y Y, et al.Effect of catechin on myofibrillar protein in squid muscle-TMAOase system[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):46-54.
[17] ESTEBAN P P, JENKINS A T A, ARNOT T C.Elucidation of the mechanisms of action of Bacteriophage K/nano-emulsion formulations against S.aureus via measurement of particle size and zeta potential[J].Colloids and Surfaces B:Biointerfaces, 2016, 139:87-94.
[18] ZHAO W, YANG R J.The effect of pulsed electric fields on the inactivation and structure of lysozyme[J].Food Chemistry, 2008, 110(2):334-343.
[19] 张驰. 多酚与花生蛋白相互作用及其对花生蛋白致敏性的影响[D].重庆:西南大学,2021.
ZHANG C.The interaction of polyphenols withpeanut protein and its effect on theallergenicity of peanut protein[D].Chongqing:Southwest University, 2021.
[20] 张雪春, 李如蕊, 程群, 等.羟自由基氧化对核桃蛋白性质和结构的影响[J].食品与发酵工业, 2021, 47(18):107-112.
ZHANG X C, LI R R, CHENG Q, et al.Effect of hydroxyl radical oxidation on properties and structure of walnut protein[J].Food and Fermentation Industries, 2021, 47(18):107-112.
[21] 张洪超, 薛张芝, 徐晓蓉, 等.羟基自由基氧化对乌贼蛋白分子间作用力及结构的影响[J].核农学报, 2020, 34(1):131-138.
ZHANG H C, XUE Z Z, XU X R, et al.Effect of hydroxyl radical oxidation on myofibrillar protein intermolecular force and structural of Sepia esculenta[J].Journal of Nuclear Agricultural Sciences, 2020, 34(1):131-138.
[22] 严新宇. 表儿茶素没食子酸酯和牛血清白蛋白在不同金属离子下的作用[D].聊城:聊城大学,2018.
YAN X Y.Studies on interaction between epi-catechin gallate and bovine serum albumin and effects of different metal ions on the reation[D].Liaocheng:Liaocheng University, 2018.
[23] 余霞. 茶多酚、茶黄素与蛋白质相互作用及其对茶乳酪形成的影响[D].重庆:西南大学,2021.
YU X.Interaction of tea polyphenols and theaflavin with proteins and their effects on the formation of tea cream[D].Chongqing:Southwest University, 2021.
[24] JACKSON M, HARIS P I, CHAPMAN D.Fourier transform infrared spectroscopic studies of lipids, polypeptides and proteins[J].Journal of Molecular Structure, 1989, 214:329-355.
[25] 陈晓思. 紫背菜提取物对兔肉糜品质影响及其对蛋白质氧化抑制作用研究[D].重庆:西南大学, 2021.
CHEN X S.Study on the effect of Gynura bicolor (roxb.ex Willd.) DC.Extract on the quality of minced rabbit meat and the inhibition of protein oxidation[D].Chongqing:Southwest University, 2021.