结构脂(structured lipids,SLs)是一种改性油脂,又常被称为设计脂。在早期的论文和书籍章节中,狭义的结构脂定义被明确为结构脂是根据脂质在体内消化和代谢过程所设计的一种特殊的脂肪,通过改变天然脂质中的脂肪酸组成以及各种脂肪酸在甘油三酯(triacylglycerol,TAG)中的位置,并将具有特殊营养或生理功能的脂肪酸结合到特定位置,从而最大限度地发挥各种脂肪酸的物理和功能性质[1]。而后,SLs的定义范围逐渐扩大,经化学或酶改性的油脂都属于结构脂的范畴,其中包括单甘酯、甘二酯、人乳脂、类可可脂、富含不饱和脂肪酸[花生四烯酸、二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)、共轭亚油酸等]油脂,还包括中链甘油三酯(medium chain triglycerides,MCT)、中长链甘油三酯、人造奶油和其他塑性脂肪等[2]。
中长链脂肪酸结构脂(medium- and long-chain triacylglycerol,MLCT)是一类新型的结构脂质,又常被称为中长链甘油三酯,由中链脂肪酸(medium-chain fatty acids,MCFA)和长链脂肪酸(long-chain fatty acids,LCFA)结合于同一甘油分子上而形成。因此,基于甘油三酯中sn-1、sn-2及sn-3位置的差异和脂肪酸碳链长度的不同,MLCT可分为LML型、LLM型、MLM型和MML型,如图1所示[3]。MLCT不仅可以发挥MCFA减少体脂肪累积的功能,还具有一般食用油的烹调特性,与MCFA相比,显著提高了烟点,减少了煎炸时起泡状况,扩大了MCFA在食用油中的应用[4]。
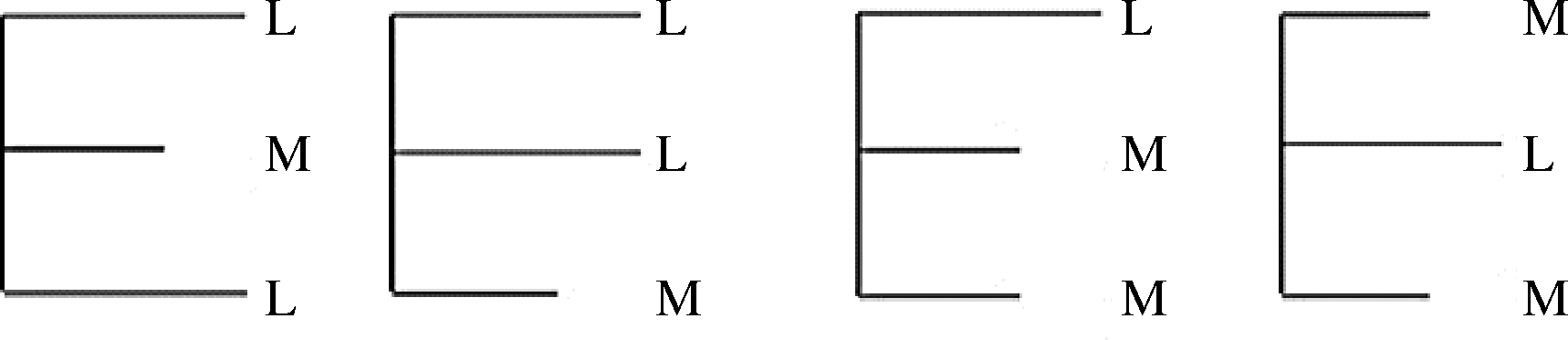
图1 MLCT结构简略示意图
Fig.1 Brief structure diagram of MLCT
注:M代表中链脂肪酸(C8∶0~C10∶0);L代表长链脂肪酸(C14∶0及以上)
1 酶的来源及位置特异性
MLCT在自然界中很少存在,YUAN等[5]研究发现,母乳中的MLCT约占总甘油三酯的30%,且与MML型甘油三酯相比,MLL型甘油三酯含量最多。除此之外,MLCT一般需要人工合成,常采用化学法及酶法。若采用化学合成法,则无法控制在甘油分子上定位分布某种特定脂肪酸,且副产物多,分离纯化困难,因此大多数研究者倾向于选择酶法合成MLCT[6]。酶法合成结构脂具有反应条件温和、安全性高、选择性高、副产物少等优点,近年来仍旧是油脂行业的研究热点之一。
脂肪酶属于水解酶,能够催化水解和酯化反应。通常,脂肪酶的活性位点负责其催化活性,它由丝氨酸、组氨酸和天冬氨酸或谷氨酸(His-Ser-Asp/Glu)的三联体组成。脂肪酶催化酯化的机理包括3个步骤。在第一步中,丝氨酸的活性位点通过使用组氨酸和天冬氨酸去质子化而被激活;然后,丝氨酸活性位点与底物的羰基反应形成酰基酶中间体,由氧阴离子孔稳定;最后,亲核试剂(例如甘油单酯)攻击酰基酶中间体以释放产物并再生未占据的催化位点,从而进行脱酰化[7]。
脂肪酶广泛存在于植物、动物、昆虫和微生物中。在脂肪酶的各种来源中,微生物是最具有研究价值的来源,因为它们具有巨大的工业潜力,易于培养处理,可获得性高,而且微生物脂肪酶比植物和动物脂肪酶具有更高的稳定性[8]。特异性是描述脂肪酶工业应用的一个重要标准,根据这一标准,脂肪酶可分为三大类:底物特异性、区域特异性和立体特异性脂肪酶,其中,区域特异性脂肪酶又分为非特异性、sn-1,3特异性和脂肪酸特异性酶[9]。针对MLM和LML型结构脂的酶法合成,大量研究者使用的是具有sn-1,3特异性的微生物脂肪酶,表1列出了一些合成MLCT的常见脂肪酶种类。
表1 MLCT合成常用的酶催化剂
Table 1 Enzyme catalysts for MLCT synthesis

名称来源特异性固定化材料参考价格参考文献Lipozyme RM IMRhizomucor miehei米黑根霉sn-1,3树脂3 000元/kg~6 000元/kg[10]Lipozyme TL IMThermomyces lanuginosus羊毛热霉菌sn-1,3硅胶300元/kg~600元/kg[11]Lipozyme AO-AB8Aspergillus oryzae lipase powder米曲霉sn-1,3大孔树脂AB-8-[12]Lipozyme 435Candida antartica南极假丝酵母sn-1,3树脂-[13]Novozym 40086Aspergillus oryzae米赫根毛霉sn-1,3树脂-[14]Lipase MAJ1海洋微生物Janibacter sp.菌株HTCC2649sn-1,3树脂-[15]Novozyme 435Candida antarctica B南极假丝酵母Bsn-1,3树脂15 000元/kg~20 000元/kg[16]
目前,研究使用最广泛的酶主要有Lipozyme RM IM、Lipozyme TL IM、Novozyme 435、Lipozyme 435,其中,Lipozyme TL IM的价格低于其他脂肪酶,且针对不同底物来说,这几种固定化脂肪酶的活性及特异性也有所差异。LU等[17]利用大豆油与MCT进行酯交换反应,发现几种固定化脂肪酶表现出的活性大小为Lipozyme 435 >Novozym 435 >Lipozyme RM IM >Lipozyme TL IM;同样的,KORMA等[18]将富含花生四烯酸的真菌油与MCT进行酶促酯交换反应,同样对这4种固定化脂肪酶进行了反应活性比较,结果表现为Lipozyme 435>Lipozyme TL IM>Lipozyme RM IM>Novozyme 435。基于此,脂肪酶的催化活性大小,在催化不同底物或在不同反应条件下常常有所差异。
2 MLCT的酶促催化合成方法
通常,酶促催化MLCT合成的方法包括直接法和间接法。直接法根据使用的底物不同,又分为直接酯化法、酯-酯交换法以及酸解法,间接法一般指两种直接法的组合,也称两步法。表2列举了近几年酶促催化合成MLCT的最新研究。
2.1 直接酯化法
以甘油和游离脂肪酸为底物,在脂肪酶的催化作用下合成MLCT的方法即为直接酯化法。反应方程如图2所示。

图2 直接酯化法制备MLCT的反应示意图
Fig.2 Reaction diagram for preparation of MLCT by direct esterification
注:RLCOOH表示长链脂肪酸;RMCOOH表示中链脂肪酸(下同)
直接酯化法的优点是反应一步完成,反应产物易分离且副产物少。杨剀舟[19]利用Novozym 435催化辛酸、癸酸、油酸和甘油酯化合成中长链甘油三酯,在最佳反应条件下合成再经纯化后得到含中长链甘油三酯77.11%的产品。但反应过程中产生的水可能会使得酶表面水膜加厚,从而阻碍底物与酶的结合反应[2]。此外,因为底物中不含任何来自植物油的天然抗氧化剂,导致产品的稳定性会大受影响[20]。
2.2 酯-酯交换法
两种甘油三酯之间或甘油三酯与脂肪酸酯之间在脂肪酶的催化作用下发生酰基交换的反应即为酯-酯交换。反应方程式如图3所示。

图3 酯-酯交换法制备MLCT的反应示意图
Fig.3 Reaction diagram for preparation of MLCT by transesterification
此方法下的底物常为MCT与长链甘油三酯(long chain triglycerides,LCT),原料易得且成本较低。酯-酯交换法目前是合成MLCT最广泛应用的手段[21]。周盛敏[4]利用Lipozyme TL IM催化菜油与MCT的酯交换反应,在优化条件下合成的毛油中MLCT含量约72%,而后通过分子蒸馏、脱色脱臭等工艺纯化后,MLCT含量达到91.5%。KORMA等[18]利用脂肪酶Lipozyme 435催化富含花生四烯酸的单细胞油与MCT在无溶剂系统中发生酯交换合成富含MLCT的结构脂,结果在最佳反应条件下MLCT的产率为53.75%[18]。不过,此法的问题在于难以控制产物结构的特异性,造成反应产物复杂不利于分离的弊端,因此仍需完善。
2.3 酸解法
酸解被认为是在甘油骨架上引入新型脂肪酸以改善甘油三酯分子的物理化学和营养特性的最成功的方法之一[22]。在酶的催化作用下,甘油三酯与游离脂肪酸之间发生酰基交换的反应称为酸解反应。反应方程如图4所示。

图4 酸解法制备MLCT的反应示意图
Fig.4 Reaction diagram for preparation of MLCT by acidolysis
基于sn-1,3特异性脂肪酶的广泛应用,酸解反应合成的最常见的结构脂是MLM型MLCT。LIANG等[23]以金枪鱼油和癸酸为原料制备富含DHA和EPA的甘油三酯,在最佳工艺条件下,制得的甘油三酯中DHA+EPA的含量为40.03%,比原料金枪鱼油中DHA+EPA含量高13.17%。酸解法具有反应产物易分离的优势,但由于脂肪酸价格高,且反应后仍会有相当数量的游离脂肪酸,甚至于高比例的脂肪酸产生的酸性条件可能会限制酶活力,因此酸解法的使用仍然受局限,暂不适于工业应用。
2.4 两步法
两步法合成结构化脂质的过程一般是指将两种方法组合起来进行酶促反应,如先酯化再酸解、先醇解再酸解等,后者是最典型的一种方法,具体为在脂肪酶的催化作用下,先对天然油脂进行醇解,产生的单甘酯再与脂肪酸酯化的反应,此过程又被称为醇解酯化反应。
两步法在结构脂的合成过程中可以使脂肪酸的插入率提高,有利于制备出高质量的结构脂质。HE等[24]第一步将微藻油和乙醇在Lipozyme TL IM催化下进行醇解反应,用于生产sn-2位单甘脂(sn-2-monoglycerides,2-MAG),然后第二步用辛酸对纯化的2-MAG进行酯化以生产辛酸-硬脂酸-辛酸型MLCT,最终产物中含有64.28%的辛酸和13.35%的ω-3多不饱和脂肪酸。与此类似的有,姜萱等[25]首先利用Lipozyme 435催化藻油发生醇解反应后获得富含DHA的单甘酯,再催化单甘酯和癸酸发生酯化反应合成sn-2位富含DHA的MLCT,结果所得的总MLCT含量占99.13%,含DHA的MLCT占67.61%,且DHA占sn-2位脂肪酸的72.15%。虽然此法下的合成产物纯度及得率较高,但反应时间过长,整个反应过程操作复杂繁琐,在MLCT的制备应用研究中并不广泛。
由表2可知,近年来研究学者对于生产MLCT的合成方法主要着眼于酯-酯交换法与酸解法,因为这两种方法较直接酯化法而言,原料植物油中具有天然存在的抗氧化物,可以弥补直接酯化法产品氧化稳定性较低的缺陷,较两步法而言,耗时相对较短且反应过程较简单。若是研究旨在合成某种特定构型的MLCT(如MLM型)时,酸解法比酯-酯交换法显示出更好的位置特异性,产品纯度相对较高;而若是研究目的仅是合成MLCT时,酯-酯交换法比酸解法成本更低,产物分离纯化时脱除的游离脂肪酸更少,即原料损耗更少成本低廉。基于此,针对研究目的的不同以及学者的需求,合成方法的选择也大不相同。
表2 MLCT酶促催化合成的最新研究
Table 2 The latest research on MLCT enzymatic synthesis
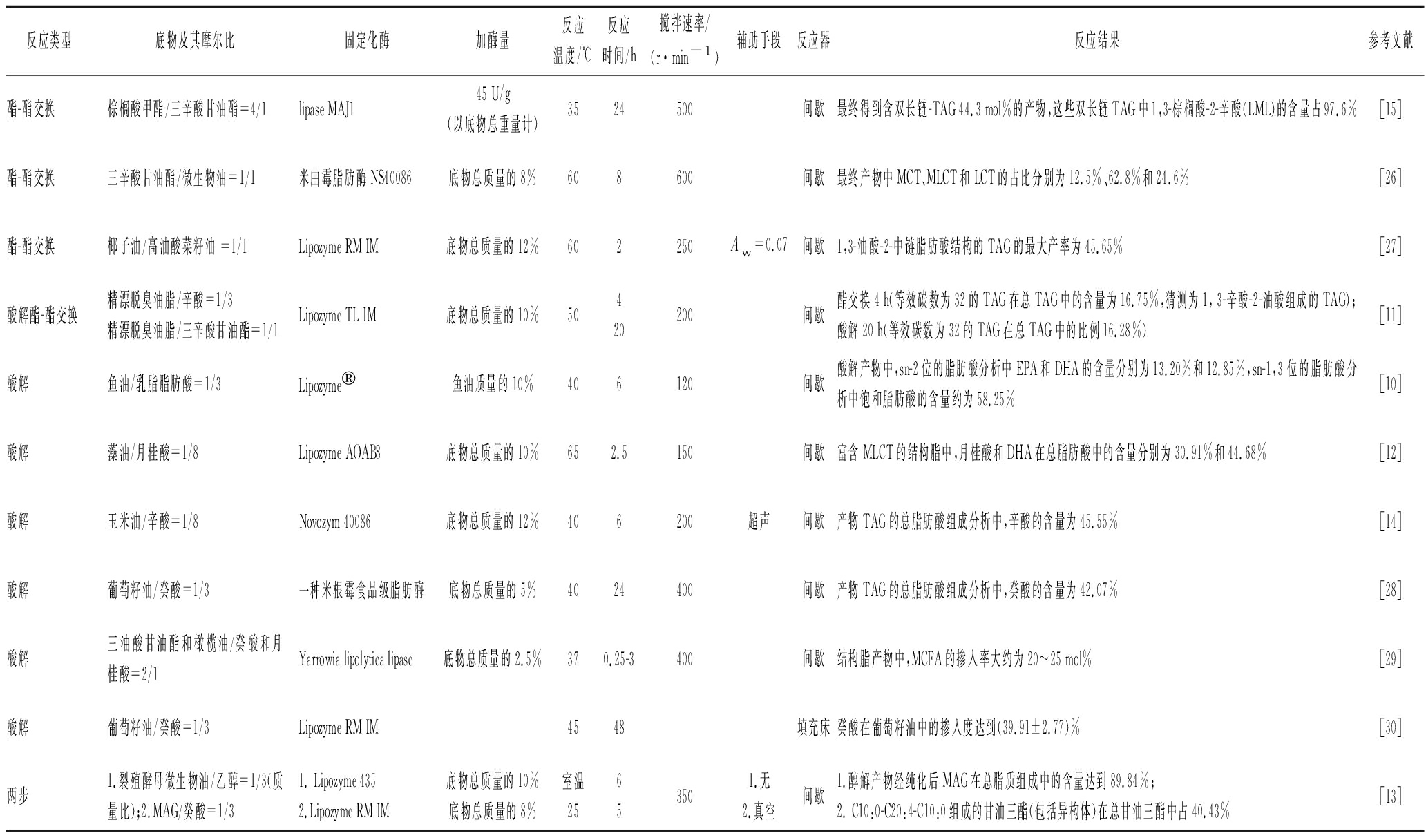
反应类型底物及其摩尔比固定化酶加酶量反应温度/℃反应时间/h搅拌速率/(r·min-1)辅助手段反应器反应结果参考文献酯-酯交换棕榈酸甲酯/三辛酸甘油酯=4/1lipase MAJ145 U/g(以底物总重量计)3524500间歇最终得到含双长链-TAG 44.3 mol%的产物,这些双长链TAG中1,3-棕榈酸-2-辛酸(LML)的含量占97.6%[15]酯-酯交换三辛酸甘油酯/微生物油=1/1米曲霉脂肪酶NS40086底物总质量的8%608600间歇最终产物中MCT、MLCT和LCT的占比分别为12.5%、62.8%和24.6%[26]酯-酯交换椰子油/高油酸菜籽油 =1/1Lipozyme RM IM底物总质量的12%602250Aw=0.07间歇1,3-油酸-2-中链脂肪酸结构的TAG的最大产率为45.65%[27]酸解酯-酯交换精漂脱臭油脂/辛酸=1/3精漂脱臭油脂/三辛酸甘油酯=1/1Lipozyme TL IM底物总质量的10%50420200间歇酯交换4 h(等效碳数为32的TAG在总TAG中的含量为16.75%,猜测为1, 3-辛酸-2-油酸组成的TAG);酸解20 h(等效碳数为32的TAG在总TAG中的比例16.28%)[11]酸解鱼油/乳脂脂肪酸=1/3Lipozyme鱼油质量的10%406120间歇酸解产物中,sn-2位的脂肪酸分析中EPA和DHA的含量分别为13.20%和12.85%,sn-1,3位的脂肪酸分析中饱和脂肪酸的含量约为58.25%[10]酸解藻油/月桂酸=1/8Lipozyme AOAB8底物总质量的10%652.5150间歇富含MLCT的结构脂中,月桂酸和DHA在总脂肪酸中的含量分别为30.91%和44.68%[12]酸解玉米油/辛酸=1/8Novozym 40086底物总质量的12%406200超声间歇产物TAG的总脂肪酸组成分析中,辛酸的含量为45.55%[14]酸解葡萄籽油/癸酸=1/3一种米根霉食品级脂肪酶底物总质量的5%4024400间歇产物TAG的总脂肪酸组成分析中,癸酸的含量为42.07%[28]酸解三油酸甘油酯和橄榄油/癸酸和月桂酸=2/1Yarrowia lipolytica lipase底物总质量的2.5%370.25-3400间歇结构脂产物中,MCFA的掺入率大约为20~25 mol%[29]酸解葡萄籽油/癸酸=1/3Lipozyme RM IM4548填充床癸酸在葡萄籽油中的掺入度达到(39.91±2.77)%[30]两步1.裂殖酵母微生物油/乙醇=1/3(质量比);2.MAG/癸酸=1/31. Lipozyme 4352.Lipozyme RM IM底物总质量的10%底物总质量的8%室温25653501.无2.真空间歇1.醇解产物经纯化后MAG在总脂质组成中的含量达到89.84%;2. C10:0-C20:4-C10:0组成的甘油三酯(包括异构体)在总甘油三酯中占40.43%[13]
在MLCT的合成中,通常使用两种类型的反应器系统,即间歇系统和连续系统。前者被广泛用于研究人员在实验室中收集数据,设备及操作较为简单;后者在工业应用中更为常见,表现为底物连续进料到反应器中,剩余的或未反应的底物与产物一起连续流出反应器[31]。此外,专利 US20180245111A1中曾报道了使用填充反应器代替普通搅拌釜反应器生产MLCT的酯化过程,表明了填充床反应器不仅可以防止固定化酶的断裂,且与在间歇反应器中进行酯交换相比,填充床反应器能显著缩短MLCT生产的持续时间[32]。在酶促反应中,温度、底物摩尔比、反应时间和加酶量等反应参数非常重要,它们会显著影响反应产物的得率,因此,多数研究中往往第一步就是反应条件的探索与优化。一般来说,MLCT合成的最佳反应条件范围一般是反应温度40~60 ℃,酶载量6%~12%,搅拌速度200~400 r/min和反应时间4~24 h。MLCT合成过程中酶的特异性也可能受到反应体系介质的影响。酶促催化合成MLCT的反应体系主要分为微水条件下的无溶剂体系[29]、有机溶剂体系和超临界体系[33-34]。虽然在食品系统中允许使用有机溶剂,但最好使用无溶剂系统,因为后者可以提供安全和高质量的产品,减少对环境的负担[35]。
因此,目前为止大多数研究都集中在无溶剂体系中的酶促酯交换。值得一提的是,为了能提高酶促反应中脂肪酶的催化活性,研究人员会利用不同的物理辅助手段对酶促反应的整个体系进行处理,或者直接处理脂肪酶而后再将其用于催化反应,这些处理手段有超声[33]、超临界[36]等。
3 MLCT的代谢途径、生理功能及应用
3.1 MLCT的代谢途径
MLCT的消化过程可分为十二指肠前消化(包括口腔和胃消化)和小肠消化[35]。尽管脂质在口腔和胃中的消化有限,但是十二指肠前消化产物可以促进MLCT的乳化,改变其界面特性,能够促进酶与脂肪滴的结合从而辅助MLCT的肠道消化[37]。如图5所示,MLCT在小肠消化过程中被水解为2-MAG和游离脂肪酸,其中一部分脂肪酸经过门静脉直接到达肝脏,氧化为人体供能[38]。在单甘酯酰基转移酶(monoacylglycerol acyltransferase,MGAT)和双甘酯酰基转移酶(diacylgycerol aeyltransferase,DGAT)作用下,小肠上皮细胞吸收的2-MAG和剩余脂肪酸重新合成新的甘油三酯,然后组装成乳糜微粒[39]。随后,乳糜微粒通过淋巴循环转移到血液中,可以进入肝脏后被肝脏内皮细胞代谢,也可以进入其他组织中被利用或贮存在脂肪组织中[38]。MLCT在代谢方面克服了LCT的劣势,在没有胰脂肪酶的情况下也可以水解,同时其可以通过进入门静脉直接吸收,或者不依赖转运蛋白,通过形成乳糜微粒进入淋巴系统[6]。

图5 MLCT的体内代谢途径
Fig.5 In vivo metabolic pathways of MLCT
3.2 MLCT的生理功能
MLCT在同一个甘油分子中同时含有LCFA和MCFA,既可以提供足够的能量和必需脂肪酸,同时也不易因β-氧化产生酮体[37]。MLCT产品作为一种替代传统油的新型健康食用油,其安全性和功能性已在欧美、日本等发达国家获得认可。2012年9月,我国卫生部也批准认可了中长链脂肪酸食用油作为新资源食品,这表明MLCT的安全性已大受认可。据报道,下面对MLCT的生理功能进行阐述。
3.2.1 有效抗肥胖和降低胰岛素抵抗
近年来,MLCT作为一种预防和控制肥胖的功能性油脂被广泛研究,诸多学者已经进行了多项动物实验和临床实验来研究其抗肥胖作用,虽然实验结果之间会存在一些差异,但的确证实了MLCT在控制体重、体脂和代谢方面具有重要意义。HU等[40]以山茶油和樟树籽油为原料,通过酶促反应合成了一种新的MLCT,将其用于饲养3~4周龄雄性小鼠(C57BL/6J),持续6周,同时与LCT组饲养组对照,结果发现MLCT组明显减轻了体重和脂肪沉积,血浆三酰甘油、血浆总胆固醇和肝脂分别降低了28.8%、16.0%和30.5%,另外MLCT组粪便脂质及与脂质动员相关的酶水平有所升高,由此判断MLCT可能是通过调节C57BL/6J小鼠中与脂质动员相关的酶来减少体脂沉积。类似地,MART NEZ-GAL
NEZ-GAL N等[28]利用瑞士雄性小鼠设置了4组饮食对比,分别是对照饮食、猪油高脂肪饮食(high-fat diet,HFD)、猪油和葡萄籽油等量混合饮食(HG)以及猪油和富含癸酸的结构油等量混合饮食(HG-MCT),研究表明HG-MCT组的小鼠体重增加减少,白色脂肪组织重量减少,因此由葡萄籽油和癸酸酸解合成的此类结构脂有望成为一种能够减轻肥胖并发症的功能性油[28]。
N等[28]利用瑞士雄性小鼠设置了4组饮食对比,分别是对照饮食、猪油高脂肪饮食(high-fat diet,HFD)、猪油和葡萄籽油等量混合饮食(HG)以及猪油和富含癸酸的结构油等量混合饮食(HG-MCT),研究表明HG-MCT组的小鼠体重增加减少,白色脂肪组织重量减少,因此由葡萄籽油和癸酸酸解合成的此类结构脂有望成为一种能够减轻肥胖并发症的功能性油[28]。
当前,体外细胞研究、动物研究以及一些临床人体研究揭示了MCFA/MCT在改善胰岛素敏感性方面具有有益作用[41],于是,含有MCFA的MLCT被合理推测具有改善胰岛素抵抗的功能性,且已有研究报道证明了此结论。TERADA等[42]比对了MLCT与LCT对糖尿病ob/ob小鼠高血糖的影响,观察到在自由进食状态下,MLCT组的血浆葡萄糖显著降低,胰岛素浓度显著高于LCT组(P<0.01),这表明饮食中MLCT的摄入能够延迟ob/ob小鼠高血糖症的发展,推测可能是通过刺激腹腔内脂肪组织摄取葡萄糖引起胰岛素分泌增强。LEE等[43]也证实了食用酶促酯交换MLCT可以改善胰岛素敏感性,可能是由于胰腺中内脏脂肪积累较少,导致对胰岛β细胞施加的压力较小,从而增加胰岛素敏感性,更加有效地调节血糖水平。因此,食用MLCT不仅可以减少体内脂肪堆积,还可以通过提高胰岛素敏感性来缓解2型糖尿病。
3.2.2 良好的临床营养治疗辅助
营养治疗是重症患者和术后患者综合治疗的重要组成部分,因为持续的营养不良会导致免疫功能障碍、代谢紊乱、肝功能损害,影响患者的恢复。与MCT/LCT相比,MLCT在降低早期肝脏生化指标[如天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸转氨酶(alanine aminotransferase,ALT)和总胆红素(total bilirubin,TBIL)]方面效果很好,MLM-MLCT治疗组在加速ALT和AST的降低方面表现出相较于其他脂肪内脂的优势,基于生物催化MLM的脂肪乳剂可以最大限度地利用脂肪酸进行肝脏再生[44]。此外,MLCT乳剂还被证明了对烧伤大鼠的体重增加、氮平衡和血清白蛋白浓度有良好影响,在接受脂质乳剂肠外营养的中国患者中,与MCT/LCT相比,MLCT可以改善机体的营养状况和免疫功能,并减少炎症和其他不良影响,缩短住院时间[45]。对癌症患者来说,免疫功能低下会在一定程度上加速癌细胞的扩散,因此,邹桂珍等[46]探讨了MLCT乳剂对胃肠癌患者术后细胞免疫功能的影响,认为术后及早给予胃肠道肿瘤病人结构脂肪乳营养支持能纠正免疫抑制, 对提高细胞免疫功能有十分重要的临床意义。值得一提的是,MLCT中含有的特殊长链脂肪酸如DHA和EPA,也能够抑制肿瘤细胞的生长,具有防癌抗癌的效果[47]。
3.2.3 其他功能性
除此之外,MLCT还有助于促进脂溶性微量营养素的生物利用度,也能在一定程度上改善抑郁。含有MCT的膳食脂质或药物递送系统可能更易消化,但脂溶性营养素或药物的生物利用度较低,相反,LCT可以被消化并形成混合胶束,可以溶解亲脂性生物活性物质,从而实现高生物利用度,因此与MCT相比,MLCT被认为可以提高脂溶性营养素的生物利用度[37]。针对MLCT对缓解抑郁的影响效果,SHINOHARA等[48]以小鼠为对象进行了研究,发现MLCT的摄入导致强迫游泳测试中的不动时间显著减少,而且,MLCT饮食组的小鼠海马pERK1/2与ERK1/2的比率显著高于LCT饮食组。这表明,MLCT将是一种富有潜力的食品补充剂,可以保持大脑健康避免抑郁症的出现。
3.3 MLCT的应用
基于MLCT的各类功能性,其被广泛应用于医药和食品领域。医药方面,MLCT常被用作术后患者的肠外营养补充,不仅可以提供能量和必需脂肪酸,还有助于改善免疫加速恢复。国外广泛应用的以MLCT为基料油的结构脂肪乳产品主要有瑞典的Structolipid(Pharmacia/Upjohn, Uppsala, Sweden)和FE73403(Kabi Pharmacia, AB, Stockholm, Sweden),另外ABITEC公司的Captex系列产品也多用于药品、营养保健等各种领域,国内的相关产品主要有力文(华瑞制药,技术来自德国费森尤斯卡比公司)[19,49]。食品方面,MLCT可以被用作健康食用油、能量棒、人造奶油、人造黄油和起酥油、饮料和煎炸油等[3]。第一个商业化的MLCT是Nisshin Oillio Group Ltd.(日清奥利友集团),它是将MCT与菜籽油发生酯交换反应生产的,商品名为Resettta。后来,MLCT产品引起广泛关注并逐渐兴起,美国P&G的Caprenin产品具有C22的超长碳链,具有与可可脂相似的熔融特性和口感质地,既可以用作糖果表面的巧克力涂层,也可以用于制作软点心。最近,由于发现MLCT与母乳具有相似的甘油三酯和脂肪酸组成,其又被认为是一种有价值的人乳脂肪替代品而受到诸多关注[13,50]。这些应用研究表明,MLCT产品具有广阔的商业化前景。
4 结语与展望
MLCT凭借其既能补充人体必需脂肪酸,又能快速代谢不堆积脂肪,且还可以提高人体免疫力等生理功能,在食品及医药领域成为瞩目的焦点,具有广阔的应用价值和开发前景。基于其应用度的不断提高,需要仔细选择合适的酶促合成方法、固定化酶的种类及优化反应条件等以提高MLCT的合成产率及效率并降低生产成本。酶法制备MLCT因其具有产物特异性高、反应条件温和、对环境友好等优点从而被广泛研究,催化剂固定化脂肪酶对不同的底物发挥出的催化能力也不同,需要探索更丰富的酶的来源以提高产物质量并降低成本。此外,针对不同种类的MLCT的消化吸收特性以及更详细的调节营养功能的机制仍需深入探索,以期拓宽MLCT的开发及应用。
[1] IWASAKI Y, YAMANE T.Enzymatic synthesis of structured lipids[J].Journal of Molecular Catalysis B:Enzymatic, 2000, 10(1-3):129-140.
[2] 王苑力, 李桐, 郭咪咪, 等.中长链脂肪酸结构脂质及其制备工艺研究进展[J].中国粮油学报, 2021, 36(1):195-202.
WANG Y L, LI T, GUO M M, et al.Research progress of medium-and long-chain triacylglycerols and its preparation technology[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(1):195-202.
[3] LEE Y Y, TANG T K, CHAN E S, et al.Medium chain triglyceride and medium-and long chain triglyceride:Metabolism, production, health impacts and its applications—A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(15):4 169-4 185.
[4] 周盛敏. 中长链脂肪酸结构脂的酶法合成、安全性评价及减肥功能研究[D].上海:上海交通大学, 2017.
ZHOU S M.Enzymatic synthesis, safety evaluation, and anti-obesity effects of medium- and long-chain triacylglycerols[D].Shanghai:Shanghai Jiao Tong University, 2017.
[5] YUAN T L, WEI W, ZHANG X H, et al.Medium- and long-chain triacylglycerols composition in preterm and full-term human milk across different lactation stages[J].LWT, 2021, 142:110907.
[6] 李闯. 中长链脂肪酸甘油三酯的酶法制备及对小鼠脂代谢的影响[D].石家庄:河北科技大学, 2020.
LI C.Enzymatic preparation of medium-and long-chain fatty acid triacylglycerols and its effect on lipid metabolism of mice[D].Shijiazhuang:Hebei University of Science and Technology, 2020.
[7] REIS P, HOLMBERG K, WATZKE H, et al.Lipases at interfaces:A review[J].Advances in Colloid and Interface Science, 2009, 147:237-250.
[8] 汪玲. 微生物脂肪酶的性质及应用[J].生物化工, 2020, 6(3):161-163.
WANG L.Study on the properties and application of microbial fecal enzymes[J].Biological Chemical Engineering, 2020, 6(3):161-163.
[9] SARMAH N, REVATHI D, SHEELU G, et al.Recent advances on sources and industrial applications of lipases[J].Biotechnology Progress, 2018, 34(1):5-28.
[10] SUBROTO E, TENSISKA, INDIARTO R, et al.Enzymatic acidolysis of fish oil with milk fat fatty acids for the synthesis of structured lipid[J].Pakistan Journal of Nutrition, 2019, 18(4):372-378.
[11] UTAMA Q D, SITANGGANG A, ADAWIYAH D, et al.Lipase-catalyzed synthesis of medium-long-medium-type of structured lipids from refined bleached deodorized olein[J].Applied Food Biotechnology, 2020, 7:85-94.
[12] LI Y, LI C, FENG F Q, et al.Synthesis of medium and long-chain triacylglycerols by enzymatic acidolysis of algal oil and lauric acid[J].LWT, 2021, 136:110309.
[13] JIANG X, HUANG J H, LI Y R, et al.Synthesis of symmetrical medium- and long-chain triacylglycerols rich in arachidonic acid at sn-2 position for infant formula[J].Food Bioscience, 2022, 45:101344.
[14] YUE C H, BEN H Y, WANG J W, et al.Ultrasonic pretreatment in synthesis of caprylic-rich structured lipids by lipase-catalyzed acidolysis of corn oil in organic system and its physicochemical properties[J].Foods (Basel, Switzerland), 2019, 8(11):566.
[15] CUI R G, XU L, LAN D M, et al.A novel sn-1, 3 specific lipase from Janibacter sp.as catalysts for the high-yield synthesis of long-medium-long type structured triacylglycerols[J].Food Chemistry, 2022, 366:130523.
[16] WILLETT S A, AKOH C C.Application of taguchi method in the enzymatic modification of menhaden oil to incorporate capric acid[J].Journal of the American Oil Chemists’ Society, 2018, 95(3):299-311.
[17] LU J Y, JIN Q Z, WANG X G, et al.Preparation of medium and long chain triacylglycerols by lipase-catalyzed interesterification in a solvent-free system[J].Process Biochemistry, 2017, 54:89-95.
[18] KORMA S A, ZOU X Q, ALI A H, et al.Preparation of structured lipids enriched with medium- and long-chain triacylglycerols by enzymatic interesterification for infant formula[J].Food and Bioproducts Processing, 2018, 107:121-130.
[19] 杨剀舟. 医用中长碳链甘三酯的研制[D].郑州:河南工业大学, 2012.
YANG K Z.The prepration of medium-and long-chain triglycerides in medicine[D].Zhengzhou:Henan University of Technology, 2012.
[20] LEE Y Y, TANG T K, LAI O M.Health benefits, enzymatic production, and application of medium- and long-chain triacylglycerol (MLCT) in food industries:A review[J].Journal of Food Science, 2012, 77(8):R137-R144.
[21] HUANG J H, LU Y T, JIN J, et al.Chemical transesterification of flaxseed oil and medium-chain triacylglycerols:MLCT yield, DAG content, physicochemical properties, minor compounds and oxidation stability[J].International Journal of Food Science &Technology, 2021, 56(10):5 160-5 167.
[22] JADHAV H B, ANNAPURE U.Designer lipids-synthesis and application—A review[J].Trends in Food Science &Technology, 2021, 116:884-902.
[23] LIANG S H, WANG M Y, ZHU L J, et al.Preparation of DHA- and EPA-enriched glycerides by enzymatic interesterification using tuna oil and capric acid[J].Grain &Oil Science and Technology, 2018, 1(2):97-104.
[24] HE Y J, LI J B, GUO Z, et al.Synthesis of novel medium-long-medium type structured lipids from microalgae oil via two-step enzymatic reactions[J].Process Biochemistry, 2018, 68:108-116.
[25] 姜萱, 杨瑶, 徐秀丽, 等.酶法合成sn-2位富含DHA的中长链结构脂[J].中国油脂, 2022, 47(6):71-76;99.
JIANG X, YANG Y, XU X L, et al.Enzymatic synthesis of medium and long-chain structured lipids rich in docosahexaenoic acid at sn-2 position[J].China Oils and Fats, 2022, 47(6):71-76;99.
[26] ZOU X Q, ZHANG S Q, CHENG Y, et al.Lipase-catalyzed interesterification of Schizochytrium sp.oil and medium-chain triacylglycerols for preparation of DHA-rich medium and long-chain structured lipids[J].Journal of the American Oil Chemists’ Society, 2021, 98(3):253-267.
[27] PENG B, CHEN F, LIU X B, et al.Trace water activity could improve the formation of 1, 3-oleic-2-medium chain-rich triacylglycerols by promoting acyl migration in the lipase RM IM catalyzed interesterification[J].Food Chemistry, 2020, 313:126130.
[28] MART NEZ-GAL
NEZ-GAL N J P, ONTIB
N J P, ONTIB N-ECHEVERRI C M, CAMPOS COSTA M, et al.Enzymatic synthesis of capric acid-rich structured lipids and their effects on mice with high-fat diet-induced obesity[J].Food Research International, 2021, 148:110602.
N-ECHEVERRI C M, CAMPOS COSTA M, et al.Enzymatic synthesis of capric acid-rich structured lipids and their effects on mice with high-fat diet-induced obesity[J].Food Research International, 2021, 148:110602.
[29] AKIL E, DA S PEREIRA A, EL-BACHA T, et al.Efficient production of bioactive structured lipids by fast acidolysis catalyzed by Yarrowia lipolytica lipase, free and immobilized in chitosan-alginate beads, in solvent-free medium[J].International Journal of Biological Macromolecules, 2020, 163:910-918.
[30] COZENTINO I S C, RODRIGUES M F, MAZZIERO V T, et al.Enzymatic synthesis of structured lipids from grape seed (Vitis vinifera L.) oil in associated packed bed reactors[J].Biotechnology and Applied Biochemistry, 2022, 69(1):101-109.
[31] COKER A K.Industrial and Laboratory Reactors-Chemical Reaction Hazards and Process Integration of Reactors[M]//Ludwig′s Applied Process Design for Chemical and Petrochemical Plants.Amsterdam:Elsevier, 2015:1 095-1 208.
[32] WANG Y, LIU M M, TENG Y L, et al.Method for preparing medium-long-chain triglyceride using packed bed reactor:US20180245111[P].2018-08-30.
[33] MORE S B, GOGATE P R, WAGHMARE J S, et al.Intensified synthesis of structured triacylglycerols from fish, flaxseed and rice bran oil using supercritical CO2 or ultrasound[J].Chemical Engineering and Processing-Process Intensification, 2019, 144:107650.
[34] MORE S, GOGATE P, WAGHMARE J, et al.Intensified synthesis of structured lipids from oleic acid rich moringa oil in the presence of supercritical CO2[J].Food and Bioproducts Processing, 2018, 112:86-95.
[35] UTAMA Q D, SITANGGANG A B, ADAWIYAH D R, et al.Lipase-catalyzed interesterification for the synthesis of medium-long-medium (MLM) structured lipids - A review[J].Food Technology and Biotechnology, 2019, 57(3):305-318.
[36] 滕桂平. 结构脂质合成及超临界流体色谱分析[D].贵阳:贵州大学, 2020.
TENG G P.Synthesis of structural lipids and analysis by supercritical fluid chromatography[D].Guiyang:Guizhou University, 2020.
[37] WANG Y D, ZHANG T, LIU R J, et al.Reviews of medium- and long-chain triglyceride with respect to nutritional benefits and digestion and absorption behavior[J].Food Research International, 2022, 155:111058.
[38] 熊超越. 中长链结构脂肪及其乳液的制备和减脂功效研究[D].南昌:南昌大学, 2017.
XIONG C Y.Study on the preparation of emulsions with medium- and long-chain triacylglycerols and its anti-obesity efficiency[D].Nanchang:Nanchang University, 2017.
[39] GIUFFRIDA F, MARMET C, TAVAZZI I, et al.Quantification of 1, 3-olein-2-palmitin (OPO) and palmitic acid in sn-2 position of triacylglycerols in human milk by liquid chromatography coupled with mass spectrometry[J].Molecules (Basel, Switzerland), 2018, 24(1):22.
[40] HU J N, SHEN J R, XIONG C Y, et al.Investigation of lipid metabolism by a new structured lipid with medium- and long-chain triacylglycerols from Cinnamomum camphora seed oil in healthy C57BL/6J mice[J].Journal of Agricultural and Food Chemistry, 2018, 66(8):1 990-1 998.
[41] HUANG L L, GAO L, CHEN C.Role of medium-chain fatty acids in healthy metabolism:A clinical perspective[J].Trends in Endocrinology &Metabolism, 2021, 32(6):351-366.
[42] TERADA S, SEKINE S, AOYAMA T.Dietary intake of medium- and long-chain triacylglycerols prevents the progression of hyperglycemia in diabetic ob/ob mice[J].Journal of Oleo Science, 2015, 64(6):683-688.
[43] LEE Y Y, TANG T K, PHUAH E T, et al.Structural difference of palm based medium- and long-chain triacylglycerol (MLCT) further reduces body fat accumulation in DIO C57BL/6J mice when consumed in low fat diet for a mid-term period[J].Food Research International, 2018, 103:200-207.
[44] LIU C S, CHEN A N, XU L, et al.Synthesis of middle-long-middle structured intralipids by biological catalysis and the evaluation of intralipids′ protective effect on liver injury rats[J].Food Science &Nutrition, 2021, 9(5):2 381-2 389.
[45] LI C, NI Q, PEI Y F, et al.Meta-analysis of the efficacy and safety of structured triglyceride lipid emulsions in parenteral nutrition therapy in China[J].Clinical Nutrition, 2019, 38(4):1 524-1 535.
[46] 邹桂珍, 魏凯.结构脂肪乳对胃肠道肿瘤病人术后细胞免疫功能的影响[J].临床外科杂志, 2018, 26(5):390-392.
ZOU G Z, WEI K.The effect of structured lipid emulsion on cellular immune function in patients with gastrointestinal cancer after operation[J].Journal of Clinical Surgery, 2018, 26(5):390-392.
[47] MOLOUDIZARGARI M, MORTAZ E, ASGHARI M H, et al.Effects of the polyunsaturated fatty acids, EPA and DHA, on hematological malignancies:A systematic review[J].Oncotarget, 2018, 9(14):11 858-11 875.
[48] SHINOHARA H, FUKUMITSU H, SETO A, et al.Medium-chain fatty acid-containing dietary oil alleviates the depression-like behaviour in mice exposed to stress due to chronic forced swimming[J].Journal of Functional Foods, 2013, 5(2):601-606.
[49] 钟凯, 葛赞, 计晓黎, 等.结构脂质的合成及应用[J].化学与生物工程, 2015, 32(8):1-4.
ZHONG K, GE Z, JI X L, et al.Synthesis and applications of structured lipids[J].Chemistry &Bioengineering, 2015, 32(8):1-4.
[50] YUAN T L, WEI W, WANG X G, et al.Biosynthesis of structured lipids enriched with medium and long-chain triacylglycerols for human milk fat substitute[J].LWT, 2020, 128:109255.