香菇富含多糖、蛋白质、矿物质、维生素等多种营养物质,在我国的市场需求量较大[1]。风味、色泽和质地等是评价香菇品质的一些关键指标,其中,风味不仅是衡量香菇质量的重要指标,而且极大地影响了消费者的偏好[2]。鲜香菇的含水量高,在贮藏过程中极易变质。干燥技术可用来延长香菇的保质期,它不仅能提高营养物质的保留率,也影响了香菇的味觉[3]。当前已有多种香菇干燥技术,且发展已较为成熟,但传统的单一干燥技术难以满足低能耗、高品质的市场需求,绿色环保、高产出低成本的联合干燥技术是香菇干制的发展趋势[4]。
红外辐射干燥被广泛应用于食品干燥,具有辐射能量高、干燥速率快的优点,但存在干燥不均匀的缺点[5]。喷动床干燥具有传热效率高、干燥均匀的特点,但由于出口风温较高,其热效率低。为克服单一干燥方法的局限性,利用红外辐射干燥与喷动床干燥相结合的方法,即红外喷动床干燥(infrared spouting bed drying,IRSBD)[6],可避免红外辐射干燥不均匀的问题,同时又解决了传统喷动床干燥热效率低的问题。红外喷动床干燥是一种具潜力的食品干燥技术,且已有相关研究者通过IRSBD对亚麻籽油进行干燥,得到了高质量的产品[7],其研究表明干燥速度随着气流温度的升高而增加,且与单一的喷动床干燥相比,红外喷动床能显著缩短干燥时间,IRSBD是获得优质亚麻籽油的最有效的干燥方式。但红外喷动床干燥对香菇品质及其风味的影响尚不明确。
本文以新鲜香菇为研究对象,采用红外喷动床干燥技术进行加工,探讨不同出风风温和出风风速条件下香菇干制品的干燥特性、水分比、单位能耗、复水比、色泽及微观结构,并基于以上指标的结果,确定较优干燥条件,进行红外喷动床干燥过程的跟踪取样,探究干燥过程中5′-核苷酸、游离氨基酸和等鲜浓度(equivalent umami concentration,EUC值)的变化,可为香菇干制品加工和风味食品及调味品的开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜香菇购于洛阳市大张超市,产自洛阳汝阳县。选取大小均匀、表面无皱痕的新鲜香菇,放置在4 ℃的冰箱中备用。
硫酸、无水乙醇、苯酚、葡萄糖均为分析纯,乙腈、甲醇均为色谱纯,洛阳奥龙化玻公司;5′-核苷酸标准品,上海源叶生物技术有限公司;氨基酸混合标准溶液,德国曼默博尔公司。
1.2 仪器与设备
本研究所用设备由实验室自制,结构如图1所示。该设备的喷动床干燥箱由顶部直径和高度分别为350 mm和220 mm的圆柱体及底部直径和高度分别为350 mm和235 mm的圆锥体组成。在干燥箱中部内壁装有3个角度均匀的红外加热器,在干燥过程中对箱内的样品进行红外辐射加热。物料经底部中心的出风风速垂直向上射入,升至一定高度后因重力而回落,形成喷泉状,回落的物料向下移动至床层下部,又会在向上的出风风速作用下形成有规律的内循环。在喷动上升与下落过程中,为避免热量流失,设备整体采用循环热风设计。出风风温经热敏传感器检测,出风风速经风速传感器检测,风机的变频可控制出风风速的气流速度[5,8]。
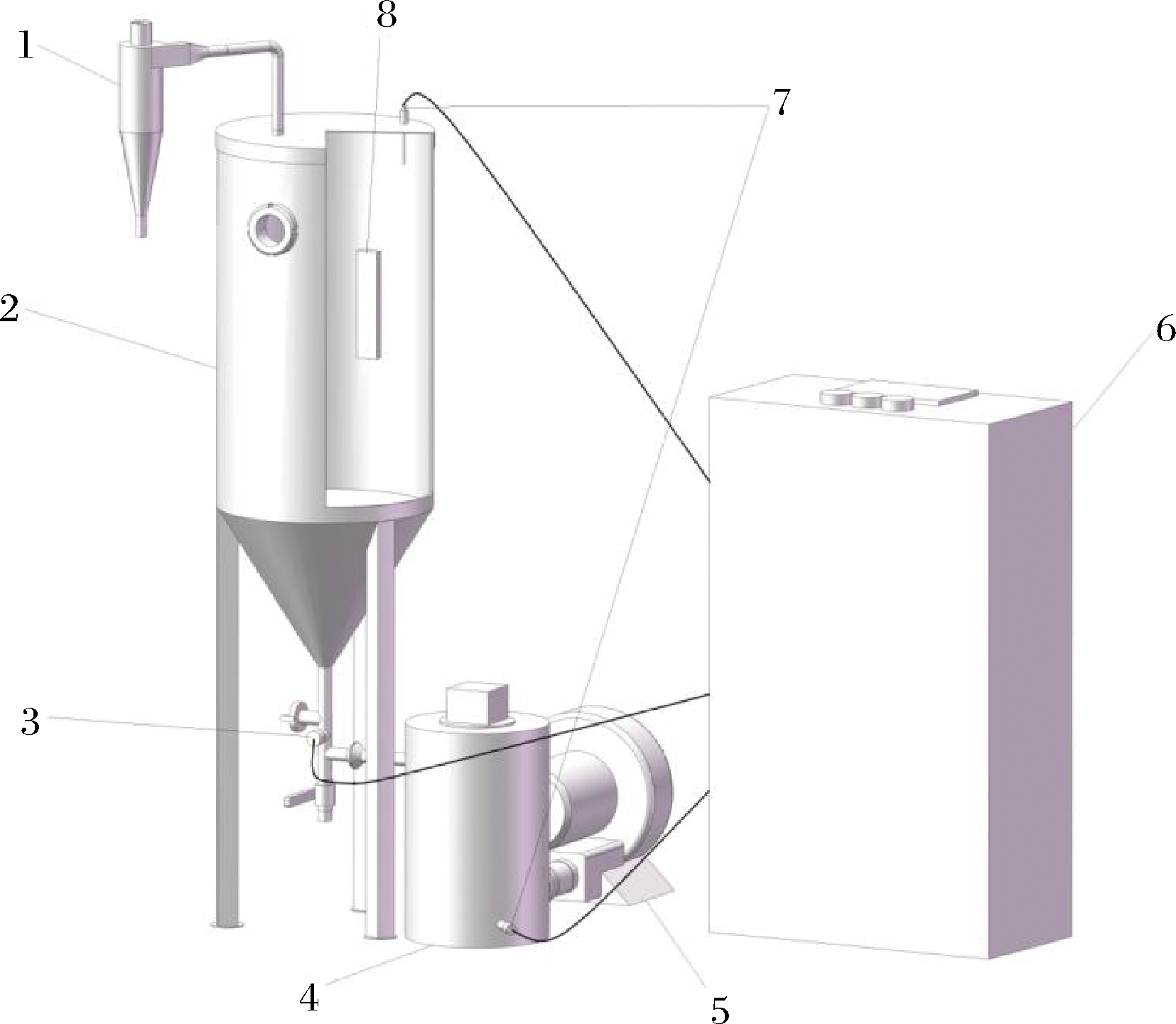
1-旋风分离器;2-喷动床干燥箱;3-风速传感器;4-加热罐;5-风机;6-控制柜;7-温度传感器;8-红外辐射板
图1 红外喷动床结构图
Fig.1 Structure of infrared spouted bed
X-rite Color I5色差仪,美国爱色丽公司;101型电热恒温鼓风干燥箱、HH-S4型电热恒温水浴锅,北京科伟永兴仪器有限公司;UV2006A型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;H1850R型高速冷冻离心机,湖南湘仪离心机有限公司;TM3000台式扫描电镜,日本日立高新技术公司;SMS TA.XT Epress型食品物性分析仪,Stable micro systems ltd;1260高效液相色谱仪,安捷伦科技(中国)有限公司;A300氨基酸自动分析仪,德国曼默博尔公司。
1.3 实验方法
1.3.1 工艺流程
将香菇去柄,采用12 mm×12 mm×12 mm(长×宽×高)的切丁器处理。每个实验条件取200 g香菇投入到红外喷动床内,新鲜香菇初始含水率为89.06%,在干燥过程中每隔20 min测定含水率变化,以含水率低于13%为干燥终点(GB 7096—2014《食品安全国家标准 食用菌及其制品》)。在较优干燥条件进行实验时,每隔40 min取样,测定5′-核苷酸和游离氨基酸的含量。每个处理组平行重复3次实验。
采用红外喷动床对香菇进行干燥时,实验条件如表1所示。本实验按照先干燥不同出风风温(1~4组)条件下的样品进行指标测定,后干燥不同出风风速(5~8组)条件下的样品进行指标测定的顺序。虽然第3组和第7组的干燥条件相同,但两组样品在存放、干燥和指标测定存在2 d的时间间隔,检测结果之间的差异可能与不同的干燥批次有关。
表1 香菇红外喷动床干燥实验条件
Table 1 Drying conditions of shiitake mushrooms by infrared spout bed

组别出风风温/℃出风风速/(m·s-1)1458.02508.03558.04608.05557.06557.57558.08558.5
1.3.2 干燥过程中样品湿基含水率测定
采用段续等[9]的方法,湿基含水率计算如公式(1)所示:
(1)
式中:ωt为任意t时刻样品的湿基含水率,%;ω0为初始湿基含水率,%;mt为任意t时刻样品的质量,g;m0为初始质量,g。
1.3.3 干燥速率[9]
干燥速率计算如公式(2)所示:
(2)
式中:DR表示干燥速率,%/min;Mt1和Mt2为干燥至t1和t2时刻样品的湿基含水率,%。
1.3.4 色泽的测定
采用色差仪测定香菇干制品的色泽,以新鲜样品作为对照。每组样品测3次,取平均值[10],色差(ΔE)的计算如公式(3)所示:
(3)
式中:L0、a0、b0,鲜香菇的色度值;L*、a*、b*,处理组的色度值。
1.3.5 粗多糖含量的测定
参考NY/T 1676—2008《食用菌中粗多糖含量的测定》测定粗多糖,单位为mg/g,结果均以样品干重计。
1.3.6 单位能耗的测定
根据红外喷动床控制柜内部的电表直接读取耗电量,单位为kW·h。
干燥能耗为干燥1 g水分的能耗(kJ),干燥过程的总脱水量和单位能耗参考张迎敏等[11]的方法。
按公式(4)、公式(5)进行计算:
(4)
(5)
式中:m1,脱水质量,g;m,干燥终点样品质量,g;C1,初始湿基水分含量,%;C2,最终湿基水分含量,%;W,干燥能耗,kJ/g;P0,功率,kW;t,时间,h。
1.3.7 微观结构的测定
将各试验条件下的干制品中心部位切成约2 mm大小的正方形薄片,喷金后采用台式扫描电镜观察其表面的微观结构,放大倍数为1 500倍。
1.3.8 收缩率的测定
收缩率采用游标卡尺分别测定干燥前后香菇丁的厚度[12]。按公式(6)计算:
收缩率![]()
(6)
式中:d0和dt分别为干燥前后香菇尺寸,mm。
1.3.9 复水比的测定
参考张海伟等[13]的方法,并稍作修改。称取1.50 g(以干重计)香菇丁置于温度为25 ℃的蒸馏水中,200 min后测其质量。平行测定3次,取其平均值。
复水比按公式(7)计算:
复水比![]()
(7)
式中:mt为复水后的样品质量,g;m0为干燥样品的初始质量,g。
1.3.10 质构特性的测定
参考赵圆圆等[14]的方法,并稍作修改。设置“二次压缩”模式进行物性分析,测定条件:探头P75,测前速率2 mm/s,测中速率2 mm/s,测后速率10 mm/s,压缩比45%,剪切感应力5 g,2次测定间隔时间5 s,自动触发。
1.3.11 5′-核苷酸的测定
参考LI等[15]的方法,并作出修改。称取0.500 0 g(以干重计)的香菇粉,与30 mL蒸馏水混合后加热,待煮沸后保持1 min,冷却并在4 000 r/min离心20 min。残渣用同样方法提取2次,收集上清液,旋蒸浓缩至10 mL,经0.45 μm微孔滤膜过滤后进行HPLC分析。
采用MP C18(250 mm×4.6 mm,5 μm)色谱柱进行HPLC检测,流动相为V(超纯水)∶V(甲醇)∶V(乙酸)∶V(四丁基氢氧化铵)=894.5∶100∶5∶0.5。流速为0.5 mL/min,进样量为20 μL,紫外检测波长为254 nm。根据标准物质的出峰时间和峰面积,绘制标准曲线。
1.3.12 游离氨基酸的测定
用氨基酸自动分析仪测定香菇中的游离氨基酸含量[16]。在0.500 0 g(以干重计)样品中加入磺基水杨酸(2 mL,10 g/L)和EDTA·Na2(1 mL,10 g/L)混合均匀,超声提取1 h,混合液放置过夜。取混合液用0.02 mol/L盐酸重溶,定容至25 mL备用。样品经0.45 μm微滤膜过滤后进行检测。
1.3.13 EUC值的测定
参考YANG等[17]的方法进行计算,如公式(8)所示:
Y=∑aibi+1 218(∑aibi)(∑ajbj)
(8)
式中:Y代表样品的EUC值[g (谷氨酸钠)/100g];ai表示天冬氨酸Asp或谷氨酸Glu的浓度(g/100g干重);bi指各鲜味氨基酸相对于谷氨酸的值(Asp=0.077,Glu=1);aj是5′-GMP或5′-AMP的浓度(g/100g干重);bj为每个呈味核苷酸相对于5′-肌苷酸的值(5′-AMP=0.18,5′-GMP=2.3),1 218为协同常数(g/100g干重)。
1.4 数据分析
实验数据经Origin 2017和SPSS 18.0软件进行绘图和统计学分析。
2 结果与分析
2.1 香菇红外喷动床干燥特性
由图2和图3可知,在不同出风风温和出风风速条件下,样品的湿基含水率在干燥过程中均呈现持续下降的趋势,前期下降迅速,后期较为平缓。随着出风风温和出风风速的升高,干燥时间逐渐缩短。香菇红外喷动床干燥时间最长为280 min,此时出风风温为45 ℃、出风风速为8.0 m/s;最短为160 min,此时出风风温为60 ℃、出风风速为8.0 m/s,干燥时间较出风风温为45 ℃时缩短了57.14%。在不同的干燥条件下,干燥速率均呈现先升速干燥后转为降速干燥趋势,且以降速过程为主,表明香菇的含水率在干燥初期迅速下降,之后下降较为缓慢,与XIAO等[18]的研究结果一致。不同干燥条件下的干燥速率均在湿基含水率50%~60%内达到最大值,考虑是由于随着干燥的进行,香菇的湿基含水率逐渐降低,可在喷动床内形成良好的喷动状态,即物料逐渐处于有规律的内循环运动,短时间内样品的失水量迅速增大。出风风温度的升高能在一定程度上加快物料的水分蒸发速度,且红外辐射使得热量由表面向内部传递,物料内部发生分子之间的碰撞,产生自热效应,部分水分子挣脱细胞内对它的束缚,增加水分子向外部运移的能力,从而快速有效地使物料自身升温,使得干燥速率增加,最终缩短了干燥时间[19]。出风风速的提高能加快物料循环,在一定程度上增大香菇与干燥箱内的传热、传质系数,促进香菇表面的水分扩散到空气中,其扩散速率大于物料内部水分扩散速率,有助于物料表面与空气介质之间的水分交换。且较高的出风风速会降低热边界层,促进热边界层之间的热交换,从而提高干燥效率[20]。通过采用红外喷动床进行干燥,增大出风风温和出风风速能明显缩短样品的干燥时间,提高干燥效率,加快干燥速率。

a-干燥曲线;b-干燥速率曲线
图2 不同出风风温下香菇的干燥曲线和干燥速率曲线
Fig.2 Drying curve and drying rate curve of shiitake mushrooms under different outlet temperature

a-干燥曲线;b-干燥速率曲线
图3 不同出风风速下香菇的干燥曲线和干燥速率曲线
Fig.3 Drying curve and drying rate curve of shiitake mushrooms under different airflow speeds
2.2 不同干燥条件对香菇色泽和粗多糖含量的影响
表观颜色与消费者的视觉接受度密切相关,进而影响食品的商业价值。较高的明度L*值和较低的ΔE值代表干香菇的色泽较优。由表2可知,香菇干制品在不同出风风速条件下表观色泽的L*值与鲜香菇最为接近。随着出风风温的升高,亮度L*值呈现先增加后降低的趋势。在45 ℃与60 ℃条件下香菇干制品亮度L*值最低,分别为68.69和68.89,也与新鲜香菇原样色差最大,表明该条件下香菇的色泽品质较差。原因可能是在出风风温为45 ℃时,红外喷动床干燥在较低的温度条件下对酶活性的影响较大、干燥时间较长,为香菇的酶促褐变和氧化反应提供的反应时间较其他出风风温条件下较长。此外,低温下也易发生美拉德反应,导致亮度较低。当出风风温为60 ℃时,虽然较高的温度有助于加快干燥速率,缩短干燥时间,减少结构内部化学反应发生的时间,但高温易使物料内部形成热点,这些热点可能促进了氨基酸和还原糖等化学物质发生美拉德反应以及焦糖化反应,使物料色泽变暗淡,因此无法保持香菇的色泽良好。与ZHANG等[21]采用红外热空气对流对香菇干燥得到其亮度L*值为52.04相对比,红外喷动床因干燥效率高,干燥时间短等特点,在一定程度上能有效地避免样品因干燥持续时间较长而引起的氧化和褐变,在维持样品表观色泽上具有优势。香菇的L*值和ΔE值在出风风速为8.0 m/s时,分别取得最大值86.45和3.84,与新鲜样品的色泽最为接近。
香菇多糖被视为一种功能性物质,具有抗氧化、抗衰老等特点[1],因此粗多糖含量的测定也是评价干燥方式对营养成分保留率的重要指标。由表2可知,不同干燥条件下的粗多糖含量均优于新鲜样品,且粗多糖含量随出风风温的升高而增加,在出风风速为8.0 m/s时取得最大值9.60 mg/g。粗多糖含量与加热温度和干燥时间有密切关系,出风风温的升高易发生美拉德反应,但在较高的出风风温条件下干燥时间有所缩短,为美拉德反应的发生提供的时间也相对减少,且随着含水率的降低,香菇物料干重逐渐增加,而干物质中粗多糖的含量便有所增加。在IRSBD过程中,出风风速的增加使得样品在干燥箱内的喷动更加剧烈,这对样品脱水起到了有利的作用,使得样品的失水速率加快,因此物料能较快处于中等水分含量的状态。相关研究表明,样品的含水率处于中等状态时,更易发生美拉德反应[22],可能因此造成了出风风速为8.5 m/s时,多糖含量较8.0 m/s时有所损失。且剧烈喷动状态也会使香菇样品在干燥箱内发生持续性的摩擦和碰撞,样品出现一定程度的破碎,导致含有多糖的结构减少,造成多糖含量的下降。综合来看,样品在出风风温为55 ℃、出风风速为8.0 m/s时色泽及粗多糖含量均取得最大值,样品的营养成分保留率较高,红外喷动床干燥可显著提高物料的粗多糖含量。
表2 不同干燥条件下香菇的色泽和粗多糖含量
Table 2 Color and crude polysaccharide contents of shiitake mushrooms under different drying conditions

干燥条件L*ΔE粗多糖含量/(mg·g-1)鲜样88.72±0.12 08.72±0.05 4568.69±0.21c20.09±0.20b9.09±0.03c出风风温/℃5081.17±0.19b7.87±0.21c9.22±0.22bc5582.91±0.07a5.74±0.11d9.42±0.11ab6068.89±0.16c21.23±0.13a9.53±0.16a7.084.92±0.10c10.05±0.04a9.16±0.09b出风风速/(m·s-1)7.585.84±0.15b5.37±0.05d9.27±0.07b8.086.45±0.14a3.84±0.02c9.60±0.14a8.584.23±0.14d8.65±0.03b9.41±0.19ab
注:同列肩标字母不同表示差异显著(P<0.05)(下同)
2.3 不同干燥条件对香菇单位能耗的影响
在评价干燥工艺的效率时,能耗是重要的指标之一,绿色低能的工艺方法能节省生产成本,满足当前社会发展的需求。红外喷动床干燥通常被认为是一个节能低耗的干燥时间,因它的干燥物料时间显著较短,且干燥速率快。经研究得到香菇红外喷动床干燥的单位能耗随着出风风温和出风风速的升高而逐渐下降,且差异显著(图4)。比较不同出风风温的单位能耗大小,得到出风风温60 ℃(97.17 kJ/g)<出风风温55 ℃(99.02 kJ/g)<出风风温50 ℃(117.77 kJ/g)<出风风温45 ℃(148.86 kJ/g)。在出风风温为60 ℃时取得最小值。当出风风速为8.5 m/s时,单位能耗较7.0 m/s时明显有所下降,且出风风速出风风速8.5 m/s(94.06 kJ/g)<出风风速8.0 m/s(98.74 kJ/g)<出风风速7.5 m/s(102.84 kJ/g)<7.0 m/s(139.26 kJ/g)。在干燥特性的研究中,得出在较高出风风温和出风风速条件下对物料进行干燥,干燥时间缩短,干燥速率快,因此单位能耗逐渐降低。在较低的出风风温和出风风速条件下干燥时,如出风风温为45 ℃及出风风速为7.0 m/s时,所用的干燥时间为280 min,这意味着将香菇干燥至含水率为13%以下时需要比其他干燥条件消耗更多的电量,从而导致单位能耗增加,加工成本也随之增高。出风风温为60 ℃时,达到干燥终点所需的干燥时间为160 min,出风风温为55 ℃所需的干燥时间为200 min,干燥时间的缩短,减少了耗电量,因此降低了单位能耗。同理可得,出风风速7.5 m/s、出风风速8.0 m/s以及出风风速8.5 m/s时,干燥时间依次为240、200、200 min,8.5 m/s与8.0 m/s的干燥时间一致,但能耗却略有差异,可能是高风速能在一定程度上使得物料在干燥箱内喷动更为剧烈,物料的干燥速率得到提升,在一定程度上耗费的电量较少。总的来说,在采用红外喷动床干燥样品时,可通过提高出风风温及风速降低能耗,增加产品经济效益。

a-出风风温;b-出风风速
图4 不同干燥条件下香菇的能耗
Fig.4 Energy consumption of shiitake mushrooms under different drying conditions
注:字母不同表示差异显著(P<0.05)(下同)
2.4 不同干燥条件对香菇微观结构的影响
图5是不同干燥条件下香菇样品的微观结构图。在干燥条件为出风风温55 ℃和60 ℃条件下的微观结构及不同出风风速干燥后的样品微孔分布较多,蜂窝状结构比较均匀,微孔分布大小相近且均匀,可知细胞结构受到破坏较小。随着出风风温和出风风速的升高,物料在短时间内的水分快速蒸发,即干燥速率较快,失水量增加,自热效应发生时,水分子从细胞内部结构中挣脱束缚,向外部运移的速度随之加快,易使得细胞内部结构的孔隙变大,维持样品较好的微观结构。而当出风风温为45 ℃和50 ℃时,干燥的样品的多孔蜂窝状结构非常不明显,纤维结构有层叠现象,细胞结构坍塌,说明样品细胞结构受到较为严重破坏[23]。可能是因为其在干燥过程中,水分的扩散速度较出风风温较高时较慢,干燥时间持续较长,造成细胞被破坏的程度较大。另外,出风风温55 ℃和出风风速8.0 m/s条件下的微观结构略有差异,考虑是与测定时切片选取的位点及香菇样品间的差异等因素有关。总的来看,应考虑在较高的出风风温条件下对香菇进行加工,而不同出风风速干燥条件下的香菇微观结构较好,当出风风速为8.0 m/s时的微孔分布相对更为均匀。

a~d-出风风温45、50、55、60 ℃;e~h-出风风速7.0、7.5、8.0、8.5 m/s
图5 不同干燥条件的香菇微观结构
Fig.5 Microstructure of shiitake mushrooms under different drying conditions
2.5 不同干燥条件对香菇收缩率、复水比和质构特性的影响
表3表明,随着出风风温的增加,干燥后的香菇的收缩率呈现先上升后下降的趋势,在出风风温55 ℃呈现最小值81.43%。收缩率的值越大,表明皱缩程度越明显,物料内部结构被破坏得程度越大,硬度也越大。温度升高导致结构中的细胞失水速率加快,细胞的孔隙也紧密皱缩,因此收缩率有所增加。在出风风温为60 ℃时,收缩率较55 ℃有所下降。当干燥时间较短时,意味着水分子被更快地逐出细胞组织,因此组织能够保持其结构的完整性,导致收缩减小,红外喷动床的干燥均匀性也在一定程度上降低了收缩率。
复水是评价物料干燥后外观形态恢复至初始状态的重要指标之一,也是衡量物料在干燥过程中结构被破坏程度的标准之一,直接影响着产品的质量。由表3可得,复水比随出风风温的升高呈现先增加后降低的趋势,其变化为:出风风温55 ℃(3.85)>出风风温60 ℃(3.70)>出风风温50 ℃(3.40)>出风风温45 ℃(3.23);复水比随出风风速的升高逐渐增大,其变化为:出风风速8.5 m/s(3.82)>出风风速8.0 m/s(3.80)>出风风速7.5 m/s(3.74)>出风风速7.0 m/s(3.67),在出风风温为55 ℃时复水比取得最大值,表明在该条件下样品的结构被损害得程度较小。孔隙率对复水比有一定的影响,孔隙率越大,复水比就越大,而孔隙率受收缩率影响,收缩严重时,物料孔隙较小。另外,在干燥过程中,高温和水分的流失可能会在物料的细胞结构中产生的应激反应,从而导致不可逆转的收缩。然而,虽然经红外喷动床干燥后的香菇样品收缩较为明显,但因其干燥速率高,水分蒸发较快,并未出现不可逆转的收缩现象,样品经复水后能较好的恢复其形态。总的来说,在干燥条件为出风风温55 ℃、出风风速为8.0 m/s的条件下,样品的收缩率较小,样品结构维持较好,与微观结构观察结果一致。复水后香菇的质构特性是决定口感的重要指标。样品的复水比越大,物料复水后质地柔软。如表3所示,出风风温为55 ℃时的硬度最小、弹性最大、挤压复原力较大,说明在该条件下香菇复水后韧性较大。挤压复原力表示样品经挤压后恢复原状的能力,也侧面反映了样品的弹性,所以弹性越大,挤压复原力越大。综合来看,在出风风温为55 ℃时,其收缩率和硬度最小,弹性和复水比分别取得最大值,表明该干燥条件下获得的香菇干制品品质较好。
表3 不同干燥条件下香菇的收缩率、复水比和质构特性
Table 3 Shrinkage rate, rehydration ratio, and textural properties of shiitake mushrooms under different drying conditions

干燥条件收缩率复水比硬度/g弹性/g咀嚼性/g挤压复原力/g4587.58±0.15a3.23±0.05d463.58±4.64a0.91±0.12b483.46±5.79a0.53±0.06a出风风温/℃5084.78±0.18b3.40±0.06c384.90±4.13b1.07±0.11b350.83±5.40c0.56±0.05a5581.43±0.33d3.85±0.02a308.14±5.87d1.63±0.10a441.36±6.71b0.60±0.01a6082.05±0.20c3.70±0.05b372.48±2.14c1.56±0.16a508.77±4.76d0.59±0.07a7.082.95±0.26a3.67±0.06b452.49±6.31a0.92±0.04b242.07±4.91d0.54±0.05a出风风速/(m·s-1)7.581.62±0.19d3.74±0.04ab365.44±5.30b0.93±0.07b295.52±5.13c0.55±0.05a8.082.29±0.22b3.80±0.08ab316.46±3.56d1.51±0.14a432.58±3.93a0.58±0.07a8.581.89±0.17bc3.82±0.10a348.67±4.81c1.01±0.12b327.07±5.63b0.60±0.06a
2.6 香菇干燥过程中5′-核苷酸的变化
综合以上的各指标检测结果得出,在出风风速为8.0 m/s、出风风温为55 ℃条件下,香菇品质较优,微观结构也保持较好。因此,选择此干燥条件进行跟踪取样,观察干燥过程中的5′-核苷酸含量动态变化,结果如表4所示。
5′-核苷酸不仅在食用菌中含量丰富,而且是食用菌的主要风味来源之一。由表4得干燥过程中的5′-核苷酸的总含量变化范围为6.50~8.00 mg/g干重。与新鲜样品相比,干燥过程中5′-核苷酸总含量持续显著增加(P<0.05),这可能与干燥过程中样品的DNA或RNA不断发生热降解有关。红外喷动床的均匀性,在一定程度上有效避免了红外辐射使得干燥物料中心温度较高,从而导致的样品细胞中的核酸变性[24]。样品中的5′-AMP和5′-CMP含量较高,其最大值分别总含量的28.25%和26.25%。在干燥至40 min时,5′-AMP的含量较新鲜样品的含量来说有所下降,考虑可能是由于实验误差所致。其中,5′-GMP和5′-AMP分别能提供肉味和甜味,5′-AMP还能有效抑制苦味。有相关研究将风味核苷酸的含量分为低(<1 mg/g)、中(1~5 mg/g)和高(>5 mg/g)3个等级[25]。显然,本研究中新鲜香菇和干制香菇的5′-核苷酸总含量处于较高范围(>5 mg/g)。经红外喷动床干燥后的香菇样品中,5′-核苷酸含量显著增加,表明红外喷动床可保持香菇干制品较好的5′-核苷酸风味成分。
表4 不同干燥条件下香菇的5′-核苷酸含量
Table 4 5′-nucleotide content of shiitake mushrooms under different drying conditions

干燥条件5'-核苷酸/(mg·g-1干重)5'-CMP5'-AMP5'-GMP5'-UMP总含量鲜样1.62±0.02e1.87±0.05cd1.36±0.06e1.42±0.05e6.27±0.18e40 min1.71±0.01d1.84±0.05d1.45±0.06d1.50±0.06d6.50±0.18de55 ℃80 min1.75±0.01d1.92±0.04bc1.52±0.02c1.55±0.05cd6.74±0.12cd8.0 m/s120 min1.82±0.05c1.94±0.03bc1.58±0.02c1.60±0.02c6.94±0.12c160 min1.90±0.04b1.97±0.04b1.66±0.03b1.68±0.04b7.21±0.15b200 min2.10±0.01a2.26±0.02a1.86±0.01a1.78±0.03a8.00±0.07a
2.7 香菇干燥过程中游离氨基酸的变化
游离氨基酸是食用菌的重要风味成分,特别是Asp和Glu,对食用菌鲜味有一定的贡献。如表5所示,香菇经红外喷动床干燥后的游离氨基酸主要由Thr、Asp、Lys、Ala、Arg、Glu和Phe组成。与新鲜香菇相比,香菇干燥过程中游离氨基酸含量变化显著。除Asp、Glu和Ser在干燥过程中持续增加外,其余游离氨基酸的含量均呈现先增加后降低的趋势。天冬酰胺酶和谷氨酰胺酶在氨基酸代谢过程中可分别将Asn和Gln水解为Asp和Glu,因此Asp和Glu含量有所增加。Thr在干燥至120 min时取得最大值13.90 mg/g,约占甜味氨基酸的60%,在游离氨基酸中含量最多。4种风味游离氨基酸中甜味氨基酸含量最多,其次是苦味氨基酸,而鲜味氨基酸含量与苦味氨基酸含量接近,甜味氨基酸可以掩盖苦味,因此推测香菇样品经红外喷动床干燥后能保持可口的风味。有研究表明,在样品含水率处于中等状态时,易发生美拉德反应[22],游离氨基酸的动态变化也在一定程度上反映了在干燥中期游离氨基酸含量下降的过程,在前文的研究中也观察到美拉德反应的发生使得香菇样品的色泽L*值降低。游离氨基酸数量由蛋白质分解产生的氨基酸数量和美拉德反应消耗的氨基酸数量决定。本研究中游离氨基酸总量在干燥至120 min时取得最大值110.02 mg/g,干燥后的游离氨基酸总量为76.88 mg/g,可能是在120 min继续干燥的过程中,美拉德反应消耗的游离氨基酸数量比蛋白质分解产生的游离氨基酸数量大,从而导致含量有所下降,但干燥后的游离氨基酸含量依然比新鲜样品的游离氨基酸含量(75.36 mg/g)高。虽然较高的出风风温会加快蛋白质水解生成氨基酸的速度,也会在一定程度上促进样品中的氨基酸参与美拉德反应,但出风风温越高,干燥时间便越短,为美拉德反应所提供的化学反应时间较短,因此在一定程度上保留了风味成分。
表5 不同干燥条件下香菇的游离氨基酸含量
Table 5 Free amino acid content of shiitake mushrooms under different drying conditions

呈味游离氨基酸含量/(mg·g-1干重)鲜样40 min80 min120 min160 min200 min天冬氨酸Asp3.39±0.15e3.60±0.13de3.77±0.12cd5.09±0.12a4.14±0.12b3.84±0.12c鲜味谷氨酸Glu2.35±0.05d3.91±0.08c5.87±0.15b6.52±0.16a6.52±0.15a3.94±0.07c合计5.74±0.20e7.51±0.21c6.64±0.27d11.61±0.28a10.66±0.27b7.78±0.19c苏氨酸Thr10.86±0.23de11.34±0.31d12.62±0.32c13.90±0.33a13.25±0.19b10.67±0.40e丝氨酸Ser1.33±0.06f2.12±0.03d2.32±0.05c3.13±0.05a2.90±0.02b1.52±0.02e甜味甘氨酸Gly1.37±0.02d1.62±0.02c1.81±0.01b2.13±0.01a1.61±0.03c1.20±0.03e丙氨酸Ala2.61±0.06c2.67±0.08c3.39±0.08b3.58±0.04a3.47±0.05ab2.48±0.05d脯氨酸Pro0.96±0.01d0.99±0.01cd1.10±0.04b1.25±0.04a1.03±0.03c0.87±0.02e合计17.13±0.38e18.74±0.45d21.24±0.50c23.99±0.47a22.26±0.32b16.74±0.52e缬氨酸Val1.65±0.02cd1.71±0.02c1.78±0.03b1.93±0.06a1.93±0.03a1.59±0.04d甲硫氨酸Met0.18±0.01e0.29±0.01d0.33±0.01c0.58±0.03a0.54±0.01b0.17±0.02e异亮氨酸Ile0.69±0.01d0.91±0.06c1.00±0.01b1.25±0.05a1.28±0.01a0.65±0.05d苦味亮氨酸Leu2.01±0.05d2.08±0.02c2.20±0.04b2.54±0.01a2.26±0.02b1.81±0.03e苯丙氨酸Phe2.28±0.02c2.53±0.09b2.59±0.12ab2.61±0.15ab2.76±0.04a2.15±0.08c组氨酸His1.14±0.01c1.29±0.03b1.36±0.04a1.38±0.02a1.24±0.04b0.88±0.02d精氨酸Arg2.53±0.02d2.71±0.06c3.02±0.04b3.01±0.04b3.43±0.05a2.50±0.03d合计10.48±0.14d11.52±0.29c12.28±0.29b13.30±0.36a13.44±0.20a9.75±0.27e半胱氨酸Cys0.88±0.01e1.07±0.01d1.39±0.02c1.47±0.02b1.53±0.03a0.85±0.03e无味酪氨酸Tyr0.72±0.02d1.10±0.05c1.29±0.05b1.44±0.03a1.48±0.04a0.67±0.03d赖氨酸Lys2.73±0.01d3.05±0.06c3.15±0.08bc3.20±0.09b3.49±0.09a2.65±0.03d合计4.33±0.04e5.22±0.12d5.83±0.15c6.11±0.14b6.50±0.16a4.17±0.09e总量75.36±1.52e85.98±2.14d94.98±2.42c110.02±2.50a105.72±1.90b76.88±2.14e
2.8 香菇干燥过程中EUC值的变化
5′-核苷酸与鲜味氨基酸具有协同作用,可显著改善食用菌的风味。如图6所示,新鲜香菇的EUC值为89.77 g/100g,经红外喷动床干燥后的样品EUC值在159.22~303.85 g/100g内变化,EUC值显著增加。在干燥至160 min时取得的最大值303.85 g/100g,在200 min时降至205.69 g/100g,仍高于鲜样的EUC值。且在干燥过程中,EUC值的变化趋势与总游离氨基水平的变化趋势一致。说明红外喷动床干燥不仅提高了样品的EUC值,而且其鲜味成分得到了保留。EUC值的研究可能有助于食品调味料的生产以及营养和功能俱全的美味食品开发。

图6 不同干燥条件下的香菇EUC值
Fig.6 EUC values of shiitake mushrooms under different drying conditions
3 结论
研究结果表明,随着出风风温和风速的升高,干燥时间缩短,干燥效率提高,干燥速率加快;样品L*值随出风风温的升高呈先增加后降低趋势,在不同出风风速条件下与鲜香菇L*值最为接近;粗多糖含量随出风风温的升高而增加,随出风风速的升高先增加后降低;单位能耗随着出风风温和出风风速的升高而下降,在出风风速出风风速8.5 m/s时取得最小值94.06 kJ/g;微观结构在出风风温为55、60 ℃及不同出风风速下的蜂窝状结构均匀,在出风风温为45、50 ℃时,样品的细胞结构被破坏较为严重;收缩率和复水比随出风风温的增加先上升后下降,出风风速对其影响不显著。
综合对比得出最佳干燥条件为出风风温55 ℃,出风风速8.0 m/s。在该条件下,干燥时间为200 min,L*值和ΔE值分别取得最大值86.45和最小值3.84,粗多糖含量取得最大值9.60 mg/g,单位能耗为98.74 kJ/g,微孔分布更为均匀,微观结构维持较好,收缩率和复水比分别取得最小值81.43%和最大值 3.85,样品硬度最小、弹性最大。在最佳干燥条件下,得到4种5′-核苷酸含量、Asp、Glu和Ser在干燥过程中持续增加(P<0.05),其余游离氨基酸的含量和EUC值均在干燥过程中先增加后降低,游离氨基酸总量和EUC值分别在干燥至120、160 min时取得的最大值110.02、303.85 g/100g,且含量均优于鲜样。
总的来说,采用红外喷动床对香菇进行干燥,提高出风风温和出风风速能提升样品品质和干燥效率,在出风风温55 ℃,出风风速8.0 m/s条件下样品的品质佳,营养成分和风味成分保留较多。研究可为香菇干制品加工和风味食品及调味品的开发利用提供理论参考。
[1] CHEN C, CHEN G T, WANG S, et al.Speciation changes of three toxic elements in Lentinus edodes after drying and soaking[J].Journal of Food Processing and Preservation, 2017, 41(2):e12772.
[2] DERMIKI M, PHANPHENSOPHON N, MOTTRAM D S, et al.Contributions of non-volatile and volatile compounds to the umami taste and overall flavour of shiitake mushroom extracts and their application as flavour enhancers in cooked minced meat[J].Food Chemistry, 2013, 141(1):77-83.
[3] TIAN Y T, ZHAO Y T, HUANG J J, et al.Effects of different drying methods on the product quality and volatile compounds of whole shiitake mushrooms[J].Food Chemistry, 2016, 197:714-722.
[4] 王教领, 宋卫东, 任彩红, 等.我国香菇干燥技术研究进展[J].中国农机化学报, 2021, 42(7):76-83.
WANG J L, SONG W D, REN C H, et al.Research on the drying progress of Lentinus edodes in China[J].Journal of Chinese Agricultural Mechanization, 2021, 42(7):76-83.
[5] LI L L, CHEN J L, ZHOU S Q, et al.Quality evaluation of probiotics enriched Chinese yam snacks produced using infrared-assisted spouted bed drying[J].Journal of Food Processing and Preservation, 2021, 45(4):e15358.
[6] 马立, 段续, 任广跃, 等.红外—喷动床联合干燥设备研制与分析[J].食品与机械, 2021, 37(2):119-124;129.
MA L, DUAN X, REN G Y, et al.Development and analysis of infrared-spouted bed combined drying equipment[J].Food &Machinery, 2021, 37(2):119-124;129.
[7] DEHGHAN-MANSHADI A, PEIGHAMBARDOUST S H, AZADMARD-DAMIRCHI S, et al.Effect of infrared-assisted spouted bed drying of flaxseed on the quality characteristics of its oil extracted by different methods[J].Journal of the Science of Food and Agriculture.2020, 100(1):74-80.
[8] 段续, 张萌, 任广跃, 等.玫瑰花瓣红外喷动床干燥模型及品质变化[J].农业工程学报, 2020, 36(8):238-245.
DUAN X, ZHANG M, REN G Y, et al.Drying models and quality changes of rose subjected to infrared assisted spouted bed drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(8):238-245.
[9] 段续, 刘文超, 任广跃, 等.双孢菇微波冷冻干燥特性及干燥品质[J].农业工程学报, 2016, 32(12):295-302.
DUAN X, LIU W C, REN G Y, et al.Drying characteristics and quality of button mushrooms during microwave freeze drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(12):295-302.
[10] 裴斐. 双孢蘑菇冷冻干燥联合微波真空干燥传质动力学及干燥过程中风味成分变化研究[D].南京:南京农业大学, 2014.
PEI F.Mass transfer characteristics and changes in flavour compounds of Agaricus bisporus during freeze drying conbined with mircowave vacuum drying[D].Nanjing:Nanjing Agricultural University, 2014.
[11] 张迎敏, 任广跃, 段续, 等.红薯叶粉热泵-热风联合干燥工艺优化[J].食品与发酵工业, 2021, 47(1):198-205.
ZHANG Y M, REN G Y, DUAN X, et al.Optimization of heat pump-hot air combined drying on sweet potato leaf powder[J].Food and Fermentation Industries, 2021, 47(1):198-205.
[12] BANIN E, BRADY K M, GREENBERG E P.Chelator-induced dispersal and killing of Pseudomonas aeruginosa cells in a biofilm[J].Applied and Environmental Microbiology, 2006, 72(3):2 064-2 069.
[13] 张海伟, 鲁加惠, 张雨露, 等.干燥方式对香菇品质特性及微观结构的影响[J].食品科学, 2020, 41(11):150-156.
ZHANG H W, LU J H, ZHANG Y L, et al.Effects of drying methods on the quality characteristics and microstructure of shiitake mushrooms (Lentinus edodes)[J].Food Science, 2020, 41(11):150-156.
[14] 赵圆圆, 易建勇, 毕金峰, 等.干燥方式对复水香菇感官、质构及营养品质的影响[J].食品科学, 2019, 40(3):101-108.
ZHAO Y Y, YI J Y, BI J F, et al.Sensory, texture and nutritional quality of dried shiitake mushrooms (Lentinus edodes) as affected by different drying methods[J].Food Science, 2019, 40(3):101-108.
[15] LI B, KIMATU B M, PEI F, et al.Non-volatile flavour components in Lentinus edodes after hot water blanching and microwave blanching[J].International Journal of Food Properties, 2017, 20(sup3):S2 532-S2 542.
[16] 卢晓烁, 张毅航, 方东路, 等.香菇真空冷冻干燥过程中滋味物质动态变化及鲜味评价[J].食品科学, 2021, 42(20):91-97.
LU X S, ZHANG Y H, FANG D L, et al.Dynamic change of taste compounds and umami evaluation of Lentinula edodes during vacuum freeze-drying process[J].Food Science, 2021, 42(20):91-97.
[17] YANG X, ZHANG Y Y, KONG Y, et al.Comparative analysis of taste compounds in shiitake mushrooms processed by hot-air drying and freeze drying[J].International Journal of Food Properties, 2019, 22(1):1 100-1 111.
[18] XIAO H W, LAW C L, SUN D W, et al.Color change kinetics of American ginseng (Panax quinquefolium) slices during air impingement drying[J].Drying Technology, 2014, 32(4):418-427.
[19] 朱凯阳, 任广跃, 段续, 等.红外辐射技术在农产品干燥中的应用[J].食品与发酵工业, 2021, 47(20):303-311.
ZHU K Y, REN G Y, DUAN X, et al.Application of infrared radiation technology in drying of agricultural products[J].Food and Fermentation Industries, 2021, 47(20):303-311.
[20] ZHU Y Q, WANG P, SUN D L, et al.Multiphase porous media model with thermo-hydro and mechanical bidirectional coupling for food convective drying[J].International Journal of Heat and Mass Transfer, 2021, 175(1):121356.
[21] ZHANG J, YAGOUB A E A, SUN Y H, et al.Role of thermal and non-thermal drying techniques on drying kinetics and the physicochemical properties of shiitake mushroom[J].Journal of the Science of Food and Agriculture, 2022, 102(1):214-222.
[22] ZHANG L H, ZHANG M, MUJUMDAR A S.Development of flavor during drying and applications of edible mushrooms:A review[J].Drying Technology, 2021, 39(11):1 685-1 703.
[23] YI J Y, ZHOU L Y, BI J F, et al.Influences of microwave pre-drying and explosion puffing drying induced cell wall polysaccharide modification on physicochemical properties, texture, microstructure and rehydration of pitaya fruit chips[J].LWT-Food Science and Technology, 2016, 70:271-279.
[24] LI X B, FENG T,ZHOU F, et al.Effects of drying methods on the tasty compounds of Pleurotus eryngii[J].Food Chemistry, 2015, 166:358-364.
[25] YANG J H, LIN H C, MAU J L.Non-volatile taste components of several commercial mushrooms[J].Food Chemistry, 2001, 72(4):465-471.