萝卜硫素又称莱菔硫烷,是一种异硫氰酸酯类有机物。萝卜硫素在常规贮存条件下表现为黄色或无色液体状态,其在有机溶剂中的溶解性极强,在水中的溶解度较低[1]。在十字花科植物中,萝卜硫素是在黑芥子酶的作用下由萝卜硫苷酶解而成的代谢产物,是十字花科芸苔属植物中独有的物质[2]。萝卜硫素具有抗氧化、抑菌、抗癌、缓解非酒精性脂肪肝、高血糖以及抵抗新型冠状病毒肺炎等多种生理功能,是现有研究中发现的在蔬菜中抗癌作用最强的物质之一[3-11]。萝卜硫素虽然具有很多生理功能,但该分子在高温和碱性等条件下非常活泼,在较短时间内即可分解失去活性,造成其结构非常不稳定[12-14]。如在以西兰花为代表的十字花科植物中生成的萝卜硫素因迅速降解而无法高效获取,且获取的萝卜硫素无法长期保存[15]。因此,限制了人类对萝卜硫素的使用,也限制了萝卜硫素在食品或医疗领域中的应用。
为解决萝卜硫素不稳定的问题,研究人员研究了向萝卜硫素粗提液中添加抗氧化剂来抑制萝卜硫素失活,但上述方法抑制粗提液中萝卜硫素失活的效果仍然很差[16]。为从其他途径解决萝卜硫素易失活和难以利用的问题,研究人员逐渐将关注点集中到萝卜硫素的前体物——萝卜硫苷。由于萝卜硫苷是一种稳定的物质,且目前有多种高效制备萝卜硫素的方法。因此,研究人员研究了高效制备萝卜硫素技术以降低萝卜硫素失活率,主要包括黑芥子酶酶解技术、微生物转化技术和人工合成技术[17-18]。酶解技术主要利用了植物内源黑芥子酶和外源黑芥子酶,及异源表达的黑芥子酶等酶解萝卜硫苷[19]。微生物转化技术主要利用了微生物能够分泌黑芥子酶的特性,实现对萝卜硫苷定向转化[20]。人工合成技术主要利用高温高压水解和化学反应途径提高萝卜硫素生成率。人工合成途径中的半合成法涉及到的葡萄糖苷和硫代葡糖糖苷是萝卜硫苷的结构类似物,特性与萝卜硫苷相似,可以通过化学反应转化成萝卜硫苷。
1 黑芥子酶酶解技术
1.1 黑芥子酶来源及结构
黑芥子酶(myrosinase),又名β-硫代葡萄糖苷酶,属于糖苷水解酶家族I中的一员,其结构非常稳定[21]。黑芥子酶主要分散在十字花科植物中的根、茎、叶韧皮部的韧皮薄壁细胞之间的芥子细胞中,研究发现黑芥子酶的含量会伴随种子发芽而先上升后下降[22]。植物中生成的黑芥子酶均为糖蛋白,主要以糖基化的二聚体蛋白质形式存在,西兰花种子中黑芥子酶分子质量大小约为50 kDa[23]。不同品种植物合成的黑芥子酶在其表观分子质量、侧链中的糖链含量和亚基的数目方面均会存在较大差异,上述黑芥子酶对相同底物进行酶解反应时会产生不同的产物[24-26]。与此同时,黑芥子酶具有较多二聚物形式的同工酶,分子质量在65~75 kDa [27-29]。研究表明黑芥子酶由MA、MB以及MC基因进行分别编码,MA基因编码的黑芥子酶的游离二聚体,仅在种子的发育过程中表达。由MB和MC基因进行编码的黑芥子酶将与蛋白质以复合体形式存在,因此,黑芥子酶协助蛋白、黑芥子酶、黑芥子酶结合蛋白是该复合体的主要组成部分[30]。
1.2 黑芥子酶活性影响因素
研究表明,当黑芥子酶的来源不同时,其活性同样存在较大差异。以油菜籽饼粕中的硫代葡萄糖苷(glucosinolates,GSL)为底物,对不同来源的黑芥子酶活性进行研究,发现GSL被降解为不同的产物且速率不同[31]。来源于西兰花的黑芥子酶会增加萝卜硫苷的降解,其中对抗营养物质种类影响较为明显。此外,反应底物选择性以及活性的差异也体现在源于相同植物的黑芥子酶对不同结构的GSL上[32]。黑芥子酶会因所存在的组织部位和生长阶段而产生活性方面的差异,黑芥子酶在种子中以及植株发育的幼苗时期活性最高[33]。
黑芥子酶的活性易被pH值、压力、维生素C含量和环境温度变化等因素所影响。(1)pH=5~8时,GSL在黑芥子酶的作用下可以转化为异硫氰酸酯。当pH<5时,GSL在黑芥子酶的作用下生成腈类和硫氰酸酯等抗营养物质[34]。(2)施加200~400 MPa压力,可以使黑芥子酶活性稳定并用于水解硫代葡萄糖硫苷[35]。(3)维生素C具有激活黑芥子酶的能力,来源不同的黑芥子酶最适浓度存在差异。维生素C处于低浓度情况下,可以激活黑芥子酶从而产生异硫氰酸酯,然而在其浓度增加之后,生成的异硫氰酸酯量会降低[36]。1 mmol/L的维生素C可使黑芥子硫苷酸钾的水解速率提升25倍[37]。(4)黑芥子酶易于在高温的条件下变性而失活,但最适温度会因其来源不同而存在差异。如辣根中合成的黑芥子酶最适温度为35 ℃,甘蓝中合成的黑芥子酶的最适温度为60 ℃[38]。(5)十字花科植物合成的黑芥子酶活性会因植物对盐离子的耐受程度而存在差异,因为高浓度的NaCl会降低黑芥子酶的活性[39]。
1.3 萝卜硫素生成效能
研究表明,细胞中的GSL与黑芥子酶处在不同位置,只有在组织破坏时GSL与黑芥子酶才会接触[40]。植物组织受到机械破坏时,原本在胞质中存在的黑芥子酶会与存在于液泡中的GSL结合,进而发生水解反应生成萝卜硫素[41]。以西兰花种子提取液作为底物,通过对催化条件进行优化,可将萝卜硫苷的摩尔转化率提高至99.6%,是目前制备萝卜硫素可达到的最高水平[19]。研究表明,GSL与黑芥子酶结合后,GSL会在黑芥子酶的作用下脱去1分子葡萄糖后生成不稳定的中间代谢物,而中间代谢物会在不同pH条件下经过洛森型重排转化为萝卜硫腈、萝卜硫素和硫氰酸酯等物质,其中萝卜硫素仅可在pH=5~8的条件下生成(图1)。
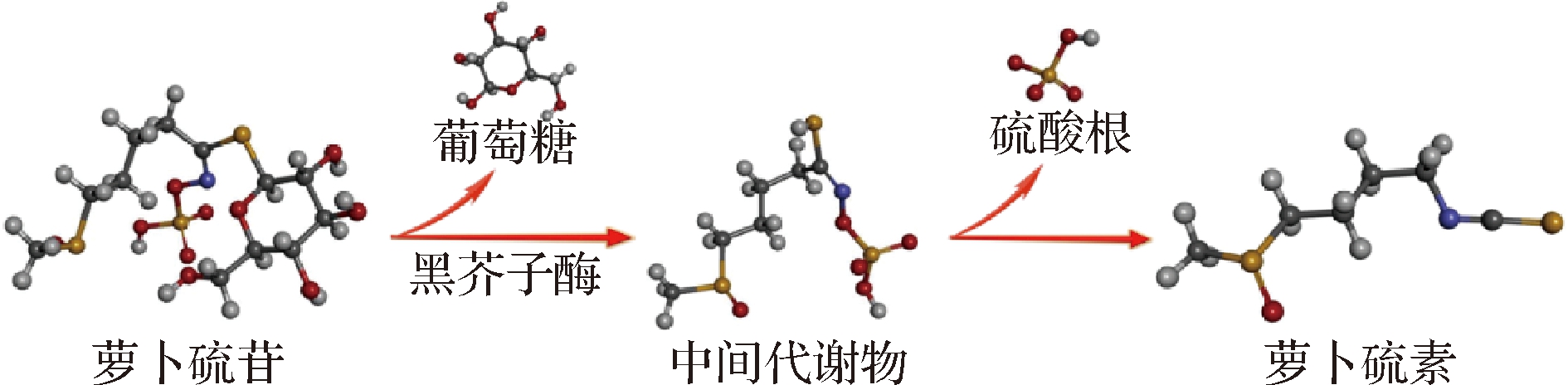
图1 萝卜硫素的生成机制
Fig.1 Formation mechanism of sulforaphane
2 微生物转化技术
2.1 体外和体内应用
微生物转化法是利用微生物产生黑芥子酶,通过黑芥子酶降解GSL制备萝卜硫素的一种方法。研究表明,微生物对萝卜硫苷的降解和转化对萝卜硫素的合成具有重要作用。微生物转化途径比化学合成法更加容易控制,而且工艺流程较为简单。与黑芥子酶酶解方式相比,微生物转化法所需要的反应条件较简单,微生物产酶能力更强。因此以微生物转化法制备萝卜硫素的工艺具有产率高、成本低的巨大优势[42]。随着对黑芥子酶的深入研究,研究人员发现黑芥子酶不仅存在于十字花科植物中,同时存在于以十字花科植物为营养来源的真菌和多型拟杆菌等的微生物中[43-45]。因此,研究人员开展了利用微生物降解萝卜硫苷的方式制备萝卜硫素的研究。阳晖等[42]研究了大肠杆菌、黑曲霉、枯草芽孢杆菌等微生物降解萝卜硫苷生成萝卜硫素的最佳反应条件,发现黑曲霉发酵可以使萝卜硫素提取量达到最优值。结果表明在合适的条件下利用黑曲霉可以稳定地产生萝卜硫素,同时还有很多其他微生物都可以通过各种方法将萝卜硫苷转化为萝卜硫素。
微生物转化法除在体外有较大的应用外,其在体内同样能够发挥转化作用,且胃肠道微生物中的黑芥子酶可以将1%~40%的GSL转化为异硫氰酸酯[46-48]。特定微生物菌株(如盲肠微生物群)在体内同样具有类似芥子酶的活性并将萝卜硫苷水解为萝卜硫素,但当前对特定微生物分泌黑芥子酶的研究仍处于探索阶段。研究人员发现在食用黑芥子酶灭活的西兰花后,肠道中仍能产生萝卜硫素。研究人员分析发现萝卜硫苷在通过消化道时不会被消化酶破坏,能够完整地抵达肠道,而肠道中存在可以水解萝卜硫苷的微生物群,能够将萝卜硫苷水解为萝卜硫素[49]。为进一步证实肠道中存在可以降解萝卜硫苷的微生物,研究人员分析了人类在食用西兰花芽后萝卜硫素腈的含量,随后利用肠道菌群模型明确了两个与萝卜硫素腈含量相关的微生物群落亚群,结果表明萝卜硫腈的产量与肠道微生物有密切关系。且梭状芽孢杆菌科与萝卜硫素腈含量有正相关性,肠杆菌与萝卜硫素腈含量的相关性较低[50]。上述结果表明,人体肠道菌群可以水解萝卜硫苷,并且萝卜硫素腈的产生受到肠道微生物组分的影响。因此,向富含GSL的食物中添加此类有益微生物可促进GSL在肠道内转化为萝卜硫素[51]。故可利用肠道微生物将GSL转化为萝卜硫素的特性,实现在肠道中获得萝卜硫素并且迅速吸收的效果。
2.2 微生物种类及转化效率
通过长期研究,研究人员从自然界中分离出大量可用于转化萝卜硫素的微生物,如鸡肠球菌HG001、大肠杆菌HG002、乳酸杆菌R16、曲霉属NR-4201、曲霉属NR46F13、勒克氏菌、柠檬酸杆菌Wye1、植物乳杆菌KW30、乳酸乳球菌亚种和大肠杆菌Nissle 1917 等[51-56]。通过对上述微生物进行分析发现,有较多益生菌与萝卜硫素的转化相关。其中肠杆菌科可以将萝卜硫苷降解成异硫氰酸酯以及少量的硫代氰酸酯腈和芥酸腈。乳酸菌将GSL转化为硫代氰酸酯腈、芥酸腈、萝卜硫素和其他未知代谢物。除此之外,研究人员通过分析微生物转化制备萝卜硫素的机制发现,微生物主要通过分泌黑芥子酶的方式实现萝卜硫素的转化(图2)。目前研究人员自啤酒酵母、交链孢霉属以及茎点霉属的微生物中提取出了黑芥子酶[57]。进一步证实,微生物将萝卜硫苷转化为萝卜硫素的途径为分泌黑芥子酶,并最终实现萝卜硫素的转化。

图2 微生物转化技术制备萝卜硫素的机制
Fig.2 Mechanism of preparing sulforaphane by microbial transformation technology
综上,微生物转化获取萝卜硫素的途径主要包括体外培养基转化和体内肠道微生物转化。其主要是利用可以分泌黑芥子酶的微生物来降解萝卜硫苷。虽然利用微生物将萝卜硫苷转化为萝卜硫素的反应条件较易控制、成本低且产量高,但是人类对于利用微生物转化制备萝卜硫素的技术仍处在探索阶段,至今未应用于生产。
3 化学合成途径
由于化学合成途径中的反应条件以及环境条件的控制较为精细化,因此认为化学合成途径在人工合成萝卜硫素中具有广阔的应用前景。目前化学合成途径主要包括两种类型,分别为从头合成法和半合成法。
20世纪90年代末期,有研究人员以立体化学的途径研究了萝卜硫素化学合成的工艺,但该方法对反应条件的要求较为严格无法得到广泛应用,因此,在此基础上,借助同位素标记技术,通过优化合成工艺,实现了五步反应便可合成萝卜硫素的工艺,但该工艺的最终产率很低,只有10%左右[58]。VO等[59]为进一步改善合成工艺,提出使用四氢噻吩、甲基碘与 NaBF4作为原料合成萝卜硫素。该方法的优点是反应步骤进一步减少,产率提升至41%,且产物也无需进行纯化。但该方法需使用危险化学品,因未被广泛应用[59]。我国科学家为优化萝卜硫素合成工艺,开发了四步合成法。谷茂然等[60]以邻苯二甲酰亚胺钾和1, 2-二溴乙烷为起始原料研究了从头合成法制备萝卜硫素的反应条件及流程,通过向反应体系中添加K2CO3和N,N-二甲基甲酰胺等化学物质后,最终得到与萝卜硫素结构类似的异硫氰酸酯类化合物。该方法使得合成反应的步骤减少,成本降低,转化率增加。但仍存在工艺流程步骤复杂,反应条件苛刻,涉及致癌物,有机物质还会污染环境,操作危险,反应时间过长,副产物产量增加和萝卜硫素产率降低等问题,因此该技术同样未被推广。因此,从头合成法虽然反应条件容易控制,但因涉及有毒试剂,不仅对人体健康产生极大威胁,同时存在环境污染的风险,因而未被广泛应用。
与从头合成途径相比,半合成法的步骤相对简单,反应条件相对温和,危害较小。半合成法的原料是萝卜硫苷的结构类似物(例如葡萄糖苷、硫代葡糖糖苷等),具体方法是在高温高压的条件下,以葡萄糖苷为原料,通过以氧化铂、碳钯等为催化剂催化加氢的方法,进行催化加氢,从而获得萝卜硫苷,之后进行水解反应,得到了萝卜硫素(图3)[61]。如IORI等[62]以GSL为原料,设计了萝卜硫素的工艺步骤,其主要原料为GSL,先用H2O2氧化得到萝卜硫苷,再经水解反应得到萝卜硫素[62]。

图3 半合成法制备萝卜硫素反应机制
Fig.3 Reaction mechanism of sulforaphane preparation by semi-synthetic method
由于萝卜种子或西蓝花种子中含有丰富的葡萄糖苷,芝麻菜种子富含GSL,因此半合成法的成本相对较低,且该方法有望具有良好的研究前景,能较好的应用于工业生产中。但半合成法仍存在两点不足:(1)转化率和萝卜硫素的产量相对较低;(2)半合成法在预处理阶段需钝化内源酶活性,且后期仍然需要添加外源酶。因化学合成途径制备萝卜硫素的方法仍存在较多缺点、技术难点需要克服,未来仍需要探索出多种提高转化率的合成技术。
4 结论
黑芥子酶酶解技术、微生物转化技术和化学合成技术是目前高效制备萝卜硫素的主要方法,但上述方法在应用方面均存在一定的局限性。黑芥子酶水解技术虽然可以高效的降解GSL并制备萝卜硫素,但黑芥子酶的活性容易受到外界环境的影响,且产物不唯一。化学合成技术虽然具备反应条件相对可控以及反应结果较为直观的优点,但是仍存在危险系数高和转化率低等缺点。而微生物转化技术能够将黑芥子酶酶解技术和化学合成技术的优缺点进行有机结合,其优点是反应条件较易控制、成本相对较低和产率高,更有利于制备萝卜硫素。
5 展望
萝卜硫素是蔬菜中抗癌效果最优的活性物质之一,在医疗和食品行业中都有较大的发展空间。以萝卜硫苷作为原料,经转化后生成萝卜硫素,是一种成本较低的制备途径。但因萝卜硫素的制备工艺存在较多亟待克服的问题,致使无法大规模制备萝卜硫素,造成萝卜硫素未能广泛的应用于食品和医疗行业。在今后的研究中,各种制备萝卜硫素的研究应重点关注保持黑芥子酶活性的稳定,对黑芥子酶进行筛选以获得活性更高和更稳定的黑芥子酶;化学合成途径应关注反应条件的安全性,寻找高危化学品的替代物,探索更安全高效的反应条件,同时需要克服内源酶对反应的影响;微生物转化技术制备并培育萝卜硫素的优势菌株,可通过多种优势菌株共同作用,使萝卜硫素的制备效率最大化。同时,还可探究多种转化途径相结合的条件下,能否对转化率起到正面的影响,探究出更多不同的转化途径。实现萝卜硫素的规模化生产,使萝卜硫素能广泛地应用于食品和医疗领域,以提高人类的健康水平。
[1] 张胜智. 西兰花种子中硫代葡萄糖苷的提取及高纯度莱菔硫烷的制备工艺研究[D].北京:北京化工大学, 2012.
ZHANG S Z.Separation of glucosinolates in broccoli seeds and the preparation of high purity sulforaphane[D].Beijing:Beijing University of Chemical Technology, 2012.
[2] 祝亚辉, 李修德, 郭俸钰, 等.萝卜硫苷提取工艺的响应面优化研究[J].食品科技, 2022, 47(4):239-246.
ZHU Y H, LI X D, GUO F Y, et al.Optimization on extraction of glucoraphanin from broccoli seeds by response surface method[J].Food Science and Technology, 2022, 47(4):239-246.
[3] 郭楠. 西兰花副产物中萝卜硫素提取及其对癌症转移的影响[D].太原:山西大学, 2019.
GUO N.Extraction of sulforaphane from broccoli by-products and its effect on cancer metastasis[D].Taiyuan:Shanxi University, 2019.
[4] OH S, TSUKAMOTO C, KIM K, et al.Investigation of glucosinolates, and the antioxidant activity of Dolsan leaf mustard kimchi extract using HPLC and LC-PDA-MS/MS[J].Journal of Food Biochemistry, 2017, 41(3):e12366.
[5] 张睿, 于建丽, 宋璇, 等.西兰花萝卜硫苷提取物的抑菌及体外免疫活性探究[J].食品研究与开发, 2021, 42(4):1-7.
ZHANG R, YU J L, SONG X, et al.Antibacterial and immunomodulatory activity in vitro of glucoraphanin extracted from broccoli[J].Food Research and Development, 2021, 42(4):1-7.
[6] 张尧, MAKAZA N, 吕城枝, 等.提取方式对十字花科蔬菜中异硫氰酸酯的影响[J].食品研究与开发, 2022, 43(8):47-53.
ZHANG Y, MAKAZA N, LYU C Z, et al.Effect of different extraction methods on isothiocyanate contents measured in seeds of cruciferous vegetables[J].Food Research and Development, 2022, 43(8):47-53.
[7] 高擎, 葛亚中, 谢家翠, 等.素养汤预防治疗大鼠胃癌的药效学及机制[J].热带医学杂志, 2020, 20(1):18-22;145.
GAO Q, GE Y Z, XIE J C, et al.Prevention and treatment of gastric cancer rats by SuYang Decoction[J].Journal of Tropical Medicine, 2020, 20(1):18-22;145.
[8] HAHM E R, SINGH S V.Sulforaphane inhibits constitutive and interleukin-6-induced activation of signal transducer and activator of transcription 3 in prostate cancer cells[J].Cancer Prevention Research (Philadelphia, Pa.), 2010, 3(4):484-494.
[9] 魏黎阳. 西兰花萝卜硫素的采后富集调控及肠保护性作用研究[D].合肥:合肥工业大学, 2021.
WEI L Y.Research on the enrichment of sulforaphane in postharvest broccoli and its protective effect on intestinal[D].Hefei:Hefei University of Technology, 2021.
[10] KOW C S, RAMACHANDRAM D S, HASAN S S.Use of sulforaphane in COVID-19:Clinical trials are needed[J].Molecular Immunology, 2022, 145:78-79.
[11] LI J W, XIE S Y, TENG W D.Sulforaphane attenuates nonalcoholic fatty liver disease by inhibiting hepatic steatosis and apoptosis[J].Nutrients, 2021, 14(1):76.
[12] MAHN A, SAAVEDRA A.Kinetic study of sulforaphane stability in blanched and un-blanched broccoli (Brassica oleracea var.italica) florets during storage at low temperatures[J].Journal of Food Science and Technology, 2018, 55(11):4 687-4 693.
[13] 王枭, 孟官丽, 王齐蕾, 等.基于静电喷雾法萝卜硫素微胶囊的制备与表征[J].食品科学, 2021, 42(7):113-119.
WANG X, MENG G L, WANG Q L, et al.Preparation and characterization of sulforaphane microcapsules by electrospraying[J].Food Science, 2021, 42(7):113-119.
[14] 董俊杰, 施琪浩, 张英杰, 等.拓展实验萝卜硫素质谱分析与指认[J].当代化工, 2020, 49(8):1 643-1 646;1 663.
DONG J J, SHI Q H, ZHANG Y J, et al.Mass spectroscopic analysis and identification of sulforaphane for materials and pharmaceutical professional expansion experiments[J].Contemporary Chemical Industry, 2020, 49(8):1 643-1 646;1 663.
[15] ZHANG J, LI X Q, GE P, et al.Sulforaphene:Formation, stability, separation, purification, determination and biological activities[J].Separation &Purification Reviews, 2022, 51(3):330-339.
[16] ZHAO G, LI B, GUO Y.Effect of rosemary extract and tbhq on the stability of radish seed oil[J].Journal of the Chemical Society of Pakistan, 2016, 38(4):631-637.
[17] 高诗薇, 朱禹蒙, 王齐蕾, 等.等离子体处理对西兰花芽苗生产及活性物质含量的影响[J].食品工业科技, 2022, 43(12):117-123.
GAO S W, ZHU Y M, WANG Q L, et al.Effects of cold plasma treatment on production and contents of bioactive substances in broccoli sprouts[J].Science and Technology of Food Industry, 2022, 43(12):117-123.
[18] 卢旭. 烹饪方式及体外模拟胃肠环境对西兰花中萝卜硫苷和萝卜硫素含量的效应[D].兰州:甘肃农业大学, 2019.
LU X.Effect of cooking methods and simulating the gastrointestinal environment in vitro on the content of glucoraphanin and sulforaphane in broccoli[D].Lanzhou:Gansu Agricultural University, 2019.
[19] 黄河鸥, 郑璞, 吴丹, 等.异源表达黑芥子酶及其用于制备萝卜硫素的研究[J].食品与发酵工业, 2022, 48(22):76-81.
HUANG H O, ZHENG P, WU D, et al.Heterologous expression of myrosinase and its application for preparation of sulforaphane[J].Food and Fermentation Industries, 2022, 48(22):76-81.
[20] 魏世锦. 茉莉酸甲酯和水杨酸对西兰花硫代葡萄糖苷含量调控和营养品质的影响[D].张家口:河北北方学院, 2021.
WEI S J.Effects of methyl jasmonate and salicylic acid on glucosinolates content and nutritional quality of broccoli[D].Zhangjiakou:Hebei North University, 2021.
[21] 张凯鑫, 赵海燕, 李晶.芥子油苷-黑芥子酶防御系统的最新研究进展[J].植物生理学报, 2017, 53(12):2 069-2 077.
ZHANG K X, ZHAO H Y, LI J.Recent research advances on glucosinolate-myrosinase defense system[J].Plant Physiology Journal, 2017, 53(12):2 069-2 077.
[22] 吕城枝. 萝卜硫素提取及其对B16细胞氧化损伤的保护作用研究[D].杭州:浙江科技学院, 2021.
LYU C Z.Study on extraction of sulforaphane and its protective effect on oxidative damage in B16 cells[D].Hangzhou:Zhejiang University of Science &Technology, 2021.
[23] 侯海亮, 邓莉, 杨黾, 等.西兰花种子中黑芥子酶酶解性质及其应用研究[J].食品科学技术学报, 2019, 37(5):98-102.
HOU H L, DENG L, YANG M, et al.Study on enzymatic degradation properties of myrosinase in broccoli seeds and its application[J].Journal of Food Science and Technology, 2019, 37(5):98-102.
[24] FAHEY J W, TALALAY P.Antioxidant functions of sulforaphane:A potent inducer of phase Ⅱ detoxication enzymes[J].Food and Chemical Toxicology, 1999, 37(9-10):973-979.
[25] ZHANG Y, KENSLER T W, CHO C G, et al.Anticarcinogenic activities of sulforaphane and structurally related synthetic norbornyl isothiocyanates[J].Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(8):3 147-3 150.
[26] MATUSHESKI N V, JEFFERY E H.Comparison of the bioactivity of two glucoraphanin hydrolysis products found in broccoli, sulforaphane and sulforaphane nitrile[J].Journal of Agricultural and Food Chemistry, 2001, 49(12):5 743-5 749.
[27] GAL DOV
DOV H, POLOZS
H, POLOZS NYI Z, BREIER A, et al.Sulphoraphane affinity-based chromatography for the purification of myrosinase from Lepidium sativum seeds[J].Biomolecules, 2022, 12(3):406.
NYI Z, BREIER A, et al.Sulphoraphane affinity-based chromatography for the purification of myrosinase from Lepidium sativum seeds[J].Biomolecules, 2022, 12(3):406.
[28] GONDA S, SZÜCS Z, PLASZK T, et al.A simple method for on-gel detection of myrosinase activity[J].Molecules (Basel, Switzerland), 2018, 23(9):2204.
T, et al.A simple method for on-gel detection of myrosinase activity[J].Molecules (Basel, Switzerland), 2018, 23(9):2204.
[29] SHIKITA M, FAHEY J W, GOLDEN T R, et al.An unusual case of ‘uncompetitive activation’ by ascorbic acid:Purification and kinetic properties of a myrosinase from Raphanus sativus seedlings[J].The Biochemical Journal, 1999, 341:725-732.
[30] 张静. 西蓝花中萝卜硫素的提取工艺优化及其活性功能研究[D].哈尔滨:哈尔滨商业大学, 2021.
ZHANG J.Optimization of extraction process and activity function of sulforaphane from broccoli[D].Harbin:Harbin University of Commerce, 2021.
[31] 丁艳, 李丽倩, 顾振新, 等.7种十字花科种子中黑芥子酶降解油菜籽饼粕中硫苷的产物比较分析[J].食品科学, 2014, 35(13):1-7.
DING Y, LI L Q, GU Z X, et al.Comparative effects of myrosinase from cruciferous seeds on the glucosinolate degradation products in rapeseed meal[J].Food Science, 2014, 35(13):1-7.
[32] PIEKARSKA A, KUSZNIEREWICZ B, MELLER M, et al.Myrosinase activity in different plant samples;optimisation of measurement conditions for spectrophotometric and pH-stat methods[J].Industrial Crops and Products, 2013, 50:58-67.
[33] 黄晓欣. 不同切割方式处理青花菜贮藏过程中硫苷代谢及抗氧化活性研究[D].北京:北京中医药大学, 2021.
HUANG X X.Study on glucosinolate metabolism and antioxidant activity of broccoli treated by different cutting methods during storage[D].Beijing:Beijing University of Chinese Medicine, 2021.
[34] HEBERT M, SERRA E, VOROBIEV E, et al.Isolation and purification of mustard glucosinolates by macroporous anion-exchange resin:Process optimization and kinetics’ modelling[J].Processes, 2022, 10(2):191.
[35] CURIQUEO C, MAHN A, CASTILLO A.Broccoli myrosinase cDNA expression in Escherichia coli and Saccharomyces cerevisiae[J].Biomolecules, 2022, 12(2):233.
[36] 丁艳, 李丽倩, 曹蓉, 等.油菜籽饼粕中硫苷的酶解条件优化及降解产物分析[J].中国农业科学, 2014, 47(2):383-393.
DING Y, LI L Q, CAO R, et al.Effect of enzymolysis conditions on glucosinolates in rapeseed meal and identification of their degradation products[J].Scientia Agricultura Sinica, 2014, 47(2):383-393.
[37] 杨佳航. 西兰花中萝卜硫苷的提取和纯化研究[D].杭州:浙江工商大学, 2018.
YANG J H.Study on extraction and purification of glucoraphanin from broccoli[D].Hangzhou:Zhejiang Gongshang University, 2018.
[38] 孙艳伟, 张泽生, 王田心, 等.十字花科植物中黑芥子酶的研究进展[J].食品研究与开发, 2017, 38(11):216-220.
SUN Y W, ZHANG Z S, WANG T X, et al.The research progress of myrosinase in cruciferous plants[J].Food Research and Development, 2017, 38(11):216-220.
[39] ![]() I, SALOPEK-SONDI B.Salinity stress as an elicitor for phytochemicals and minerals accumulation in selected leafy vegetables of Brassicaceae[J].Agronomy, 2021, 11(2):361.
I, SALOPEK-SONDI B.Salinity stress as an elicitor for phytochemicals and minerals accumulation in selected leafy vegetables of Brassicaceae[J].Agronomy, 2021, 11(2):361.
[40] BELL L, WAGSTAFF C.Glucosinolates, myrosinase hydrolysis products, and flavonols found in rocket (Eruca sativa and Diplotaxis tenuifolia)[J].Journal of Agricultural and Food Chemistry, 2014, 62(20):4 481-4 492.
[41] 毛舒香. 硒硫互作对青花菜萝卜硫素合成的影响研究[D].长沙:湖南农业大学, 2019.
MAO S X.Effect of selenium-sulfur interaction on the biosynthesis of sulforaphane in broccoli[D].Changsha:Hunan Agricultural University, 2019.
[42] 阳晖, 卢凌霄, 王晴, 等.发酵法制备萝卜硫素的工艺优化[J].食品工业, 2021, 42(12):218-223.
YANG H, LU L X, WANG Q, et al.Optimization of preparation of sulforaphane by fermentation[J].The Food Industry, 2021, 42(12):218-223.
[43] KLIEBENSTEIN D, PEDERSEN D, BARKER B, et al.Comparative analysis of quantitative trait loci controlling glucosinolates, myrosinase and insect resistance in Arabidopsis thaliana[J].Genetics, 2002, 161(1):325-332.
[44] FRANCIS F, LOGNAY G, WATHELET J P, et al.Characterisation of aphid myrosinase and degradation studies of glucosinolates[J].Archives of Insect Biochemistry and Physiology, 2002, 50(4):173-182.
[45] ERIKSSON S, ANDRÉASSON E, EKBOM B, et al.Complex formation of myrosinase isoenzymes in oilseed rape seeds are dependent on the presence of myrosinase-binding proteins[J].Plant Physiology, 2002, 129(4):1 592-1 599.
[46] FAHEY J W, WEHAGE S L, HOLTZCLAW W D, et al.Protection of humans by plant glucosinolates:Efficiency of conversion of glucosinolates to isothiocyanates by the gastrointestinal microflora[J].Cancer Prevention Research (Philadelphia, Pa.), 2012, 5(4):603-611.
[47] CONAWAY C C, GETAHUN S M, LIEBES L L, et al.Disposition of glucosinolates and sulforaphane in humans after ingestion of steamed and fresh broccoli[J].Nutrition and Cancer, 2000, 38(2):168-178.
[48] ROUZAUD G, YOUNG S A, DUNCAN A J.Hydrolysis of glucosinolates to isothiocyanates after ingestion of raw or microwaved cabbage by human volunteers[J].Cancer Epidemiology, Biomarkers &Prevention:a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, 2004, 13(1):125-131.
[49] WU Y F, SHEN Y K, ZHU Y, et al.Broccoli ingestion increases the glucosinolate hydrolysis activity of microbiota in the mouse gut[J].International Journal of Food Sciences and Nutrition, 2019, 70(5):585-594.
[50] BOURANIS J A, BEAVER L M, CHOI J, et al.Composition of the gut microbiome influences production of sulforaphane-nitrile and iberin-nitrile from glucosinolates in broccoli sprouts[J].Nutrients, 2021, 13(9):3013.
[51] WATANABE H, USAMI R, KISHINO S, et al.Enzyme systems involved in glucosinolate metabolism in Companilactobacillus farciminis KB1089[J].Scientific Reports, 2021, 11(1):1-10.
[52] ZHANG Y, HUANG S S, SUN J, et al.Isolation and characterization of glucosinolate-hydrolysis Enterococcus gallinarum HG001 and Escherichia coli HG002 from C57BL/6 mouse microbiota[J].Indian Journal of Microbiology, 2022, 62(2):273-279.
[53] RAKARIYATHAM N, SAKORN P.Biodegradation of glucosinolates in brown mustard seed meal (Brassica juncea) by Aspergillus sp.NR-4201 in liquid and solid-state cultures[J].Biodegradation, 2002, 13(6):395-399.
[54] TIE Y, ZHU W Y, ZHANG C, et al.Identification of two myrosinases from a Leclercia adecarboxylata strain and investigation of its tolerance mechanism to glucosinolate hydrolysate[J].Journal of Agricultural and Food Chemistry, 2021, 69(47):14 151-14 164.
[55] CEBECI F, MAYER M J, ROSSITER J T, et al.Molecular cloning, expression and characterisation of a bacterial myrosinase from Citrobacter Wye1[J].The Protein Journal, 2022, 41(1):131-140.
[56] MULLANEY J A, KELLY W J, MCGHIE T K, et al.Lactic acid bacteria convert glucosinolates to nitriles efficiently yet differently from Enterobacteriaceae[J].Journal of Agricultural and Food Chemistry, 2013, 61(12):3 039-3 046.
[57] 刘月萍, 王向阳.黑芥子酶研究进展[J].生物技术通讯, 2006, 17(5):837-839.
LIU Y P, WANG X Y.Research advances on myrosinase[J].Letters in Biotechnology, 2006, 17(5):837-839.
[58] 罗容珍, 杜怀明, 张利, 等.萝卜硫素制备及检测技术研究进展[J].广州化工, 2012, 40(23):11-13.
LUO R Z, DU H M, ZHANG L, et al.The new advances of preparation and analysis in sulforaphane[J].Guangzhou Chemical Industry, 2012, 40(23):11-13.
[59] VO D V, TRUONG V D, TRAN T D, et al.A new and effective approach to the synthesis of sulforaphane[J].Letters in Organic Chemistry, 2015, 13(1):7-10.
[60] 谷茂然, 冯文, 宋煌旺, 等.萝卜硫素类化合物的合成及抑菌活性研究[J].化学研究与应用, 2017, 29(1):118-122.
GU M R, FENG W, SONG H W, et al.Synthesis and biological activity of sulforaphane compounds[J].Chemical Research and Application, 2017, 29(1):118-122.
[61] 高荣凯. 莱菔子中4-甲基亚磺酰基-3-丁烯基硫代葡萄糖苷及其加氢产物的制备工艺研究[D].北京:北京中医药大学, 2019.
GAO R K.Study on preparation technology of 4- methylsulfonyl-3- butenyl glucosinolate and its hydrogenation products in radish seeds[D].Beijing:Beijing University of Chinese Medicine, 2019.
[62] IORI R, BERNARDI R, GUEYRARD D, et al. Formation of glucoraphanin by chemoselective oxidation of natural glucoerucin: A chemoenzymatic route to sulforaphane[J]. Bioorganic &Medicinal Chemistry Letters, 1999, 9:1047-1 048.