伏马毒素(fumonisins,FBs)又称烟曲霉毒素,是由串珠镰刀菌(Fusarium monitiforme)、轮状镰刀菌(Fusarium rerticillioides) 等镰刀菌在合适环境下产生的一种水溶性次级代谢产物[1],由多氢醇和丙三羧酸组成,包括1条由19或20个碳原子组成的直链及羧基、羟基及酯键组成的侧链[2]。其结构性质稳定,易溶于水、甲醇、乙腈,并对热稳定,加工过程中很难被破坏[3]。自1988年GELDERBLOM首次发现FBs后,目前为止已发现28种异构体,主要以FA、FB、FC、FP四种类型形式存在[4]。
研究表明,FBs可导致全身性毒性,包括神经毒性、肝脏毒性、肾脏毒性、肠毒性、免疫毒性、生殖毒性和联合毒性[5]。FBs污染范围已经遍及全球,主要集中在玉米、水稻、高粱、小麦等粮食作物及其制品中,并通过食物链危害人体和动物健康,甚至导致死亡[6]。其中,以伏马毒素B1(FB1)的污染最为严重,毒性最强,已被国际癌症研究机构列为2B级别致癌物[7]。
本研究通过对食品中FBs的前处理和检测分析技术进行综述。前处理技术围绕免疫亲和柱、固相萃取、磁性固相萃取、分子印迹技术和QuEChERS;检测分析技术则围绕高效液相色谱法和液相色谱-串联质谱法、酶联免疫法、免疫层析技术以及生物传感器法,旨在展开分析现有前处理技术和检测分析技术的优势和局限性,为食品中FBs检测发展提供理论参考。
1 前处理技术研究进展
1.1 免疫亲和柱
免疫亲和柱(immnuoffinity column, IAC)是利用抗原和抗体特异性可逆结合的原理,目标物抗体与凝胶共价结合填充柱子。样品提取液流过免疫亲和柱,最后通过洗脱液破坏抗原抗体之间的键,将目标物洗脱,具有高速、高效、选择性好等优点[8]。
GB 5009.240—2016《食品安全国家标准 食品中伏马毒素的测定》采用免疫亲和柱净化,高效液相色谱仪测定FB1、FB2和FB3,检出限为8~17 μg/kg,定量限为25~50 μg/kg;施雅[9]通过伏马毒素免疫亲和柱净化,外标法定量测定乳制品中FB1、FB2残留,回收率为80.3%~96.7%,检出限为0.5 μg/kg,定量限为1.0 μg/kg;张太等[10]建立了免疫亲和柱净化-自动化柱前衍生-高效液相色谱测定FB1、FB2和FB3的方法,平均回收率80%,检出限为6~10 μg/kg,定量限为20~30 μg/kg。
近年来,同时测定多种毒素的需求日益增多,陈悦铭等[11]采用11+Myco MS-PREP多功能免疫亲和柱净化同时测定咖啡豆中的FBs、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)等11种真菌毒素,平均回收率为80.2%~114%,检出限为0.008~0.544 μg/kg。免疫亲和柱虽然选择性强,净化效果好,但价格一般较高,不能重复使用,应用性不强。
1.2 固相萃取
固相萃取(solid phase extraction, SPE)是基于样品基质和目标物的性质,选择特定的固体吸附剂吸附目标物,再通过加热解吸或洗脱液洗脱等方式,达到分离、净化与富集目标物的目的。
田苗[12]比较了免疫亲和柱和SAX强阴离子固相萃取柱测定粮谷、饲料中FB1和FB2,回收率均大于70%,但SAX强阴离子固相萃取柱净化法成本较低;薛秋艳等[13]、林维宣等[14]采用C18固相萃取柱处理玉米中FB1,回收率大于70%;孙晓冬等[15]、张宇等[16]分别利用固相萃取柱HLB处理液态乳和小麦及其制品中FBs,回收率达88.8.%~104.1%。马皎洁等[17]采用MultiSep 211净化柱富集净化测定面粉、玉米及其制品中的FBs,检出限为0.2 μg/kg,定量限为0.6 μg/kg,平均回收率为69.44%~114.69%。
固相萃取基质干扰较少、净化效果较好、回收率稳定、节省溶剂、成本较低;但步骤较繁琐,需要通过柱预处理、上样、淋洗除杂、洗脱一系列预处理来收集目标物,并且吸附剂对目标物存在一定的吸附作用,只能净化一种或一类真菌毒素,不能重复使用。
1.3 磁性固相萃取
磁性固相萃取技术(magnetic solid phase extraction, MSPE)是一种以磁性纳米粒子及其表面功能化的新型纳米材料作为吸附剂的固相萃取技术。通过磁性吸附剂与含有目标物的待测体系充分接触,在外加磁场作用下中实现目标物与样品基质的分离,再选用合适溶剂洗脱目标物,达到分析检测的目的[18]。
ZHAO等[19]采用涂有双层Si02磁性纳米颗粒作为MSPE吸附剂,植物油样品中FB1的检测限为0.210 μg/kg;WANG等[20]采用CNBr磁性固相萃取对花生、玉米、小麦中FB1、黄曲霉毒素B1(aflatoxin B1,AFB1)等7种毒素进行分析,15 min内即可完成纯化,回收率为84.5%~112.7%,检出限为0.04~0.16 μg/kg。
磁性固相萃取技术适用范围广,萃取效率高,并且磁性吸附剂可以回收使用,不需要填充柱子,克服了固相萃取柱易堵塞的困难,节约了时间成本。但磁性纳米颗粒易聚集影响磁性,选择性较差。
1.4 分子印迹技术
分子印迹技术(molecular imprinting technology, MIT)是在适当的条件下,以特定的目标分子为模板,与合适的功能单体及交联剂聚合形成聚合物母体,再通过物理或化学途径将聚合物母体的模板分子去除,得到的一种特异性聚合物即为分子印迹聚合物(molecularly imprinted polymers, MIPs)[21]。
MAO等[22]采用分子印迹技术与光电化学相结合,制备了一种用于检测FB1的分子印迹电化学传感器,检测限可达到4.7 pg/mL;MUNAWAR等[23]通过固相合成制备分子印迹聚合物纳米颗粒(nanoMIPs),测定了53个玉米样品的FB1,结果跟液相色谱法具有高度关联性;SINGH等[24]使用化学氧化聚合法合成聚苯胺作为分子印迹聚合物基体,结合傅里叶变换红外光谱和电化学技术同时检测FB1和AFB1,检出限分别为0.322 pg/mL和0.313 pg/mL;RAMALHO等[25]采用1,2,3-丙氨酸为模板分子,在纤维素膜上直接合成分子印迹聚合物,建立了一种玉米制品中FB1的快速检测方法,检出限为22.0 μg/L,回收率为98%~105.2%。
1.5 QuEChERS
QuEChERS是基于固相萃取技术和基质固相分散的一种前处理技术,将固相萃取吸附剂分散到样品的萃取液中,吸附杂质从而达到净化的目的[26]。QuEChERS方法最早应用于农药残留检测前处理,由于其快速、简便、节约、高效、可靠、安全等优点,近年来发展迅速,已经广泛应用于兽药残留、毒素、污染物、非法添加物等物质的检测。
李莉等[27]通过QuEChERS净化前处理,超高效液相色谱-串联质谱测定玉米油中FB1、FB2和FB3,回收率为83.2%~108.0%,检出限为0.12~0.70 μg/kg,定量限为0.42~2.40 μg/kg;吴基任等[28]采用QuEChERS分散吸附剂(150 mg C18+900 mg MgSO4+10 mg超高比表面积单壁碳纳米管)净化除杂,超高效液相色谱-串联质谱外标法定量测定花生及土榨花生油中9种真菌毒素,其中FB1回收率为73.1%~117.7%,检出限为0.18 μg/kg,定量限为0.61 μg/kg;LAGO等[29]通过QuEChERS-LC-QTOFMS测定麦芽和啤酒中FBs,回收率为71%~102%;徐子婷等[30]通过固相萃取HLB小柱,再加入QuEChERS分散吸附剂(150 mg无水硫酸镁+50 mg乙二胺-N-丙基硅烷+30 mg C18+30 mg中性氧化铝粉末)净化测定调味面制品中12种真菌毒素,平均回收率为84.2%~97.2%,检出限为0.10~3.0 μg/kg,定量限为0.30~10.0 μg/kg。QuEChERS操作简便,溶剂使用量少,污染小,检测成本较低,回收率高,精密度与准确度好。但是易受基质效应干扰,净化效果欠佳。
FBs前处理主要集中在免疫亲和柱、固相萃取、磁性固相萃取、分子印迹技术和QuEChERS,不同前处理技术均有各自的优势和局限性,详见表1。对于不同基质,应选择合适前处理技术,提高纯化效率;也可以采用多种前处理并用、新型标记材料等手段用于FBs的提取和纯化。
表1 不同前处理技术在前处理过程中的比较
Table 1 Advantages and disadvantages of different pre-treatment technologies

前处理技术优势局限性免疫亲和柱选择性强、净化效果好价格高、应用性不强固相萃取基质干扰少、净化效果好、回收率稳定、溶剂少、成本低步骤繁琐、存在吸附作用、只能净化一种或一类真菌毒素、不能重复使用磁性固相萃取适用范围广、萃取效率高、不需要填充柱子、可以回收使用磁性纳米颗粒易聚集、选择性较差分子印迹技术选择性强、化学性质稳定、简单、成本低易受溶剂影响、吸附容量较低QuEChERS操作简便、溶剂使用量少、污染小、成本低、回收率高、精密度好、准确度好基质效应明显、净化效果欠佳
2 检测分析技术研究进展
2.1 高效液相色谱法和液相色谱-串联质谱法
HPLC和液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry, LC-MS/MS)通过采用不同的前处理技术,提取、分离、纯化FBs,达到快速检测目的,具有分离效果好、灵敏度高、简单、快速、重复性好的特点。
由于FBs本身不具有荧光,HPLC定量需采用衍生化试剂进行衍生,较大程度上限制了HPLC的应用。王军淋等[31]比较了邻苯二甲醛(O-phthaldialdehyde,OPA)、萘-2,3-二甲醛、丹磺酰氯和6-氨基喹啉-N-羟基琥珀酰亚胺氨基甲酸酯4种FBs柱前衍生剂效果,发现OPA衍生效果好且成本低,FB1、FB2和FB3定量限低,分别为25.0、14.0、17.0 μg/kg;陈同强等[32]优化了OPA柱前衍生-HPLC法检测条件,采用甲醇和甲酸铵-甲酸缓冲体系梯度洗脱测定婴幼儿配方乳粉中FB1、FB2和FB3,定量限分别为30、15、15 μg/kg。
相比HPLC法,LC-MS/MS检出限更低、分辨率更高、抗干扰能力更强,应用更为广泛。郑嘉等[33]采用乙腈-水-甲酸溶液(50∶49∶1,体积比)提取玉米中FBs,超高效液相色谱预分离,高分辨质谱定量,检出限和定量限分别为0.16~0.31 μg/kg和0.52~1.01 μg/kg;胡琳等[34]采用甲醇-水-甲酸溶液(体积比70∶29∶1)提取普洱茶中FBs、AFB1、DON等16种真菌毒素,LC-MS/MS分析,检出限和定量限分别为0.20~0.50 μg/kg 和0.60~1.50 μg/kg。
2.2 酶联免疫法
酶联免疫法(enzyme linked immunosorbent assay,ELISA)一般分为直接免疫法和间接免疫法,是利用酶标记抗原或抗体,形成具有免疫活性和酶催化活性的共价化合物,通过底物显色程度或发光来进行结果判定的一种抗体或抗原测定方法[35]。
权英等[36]改变了传统的ELISA板式定量检测,以膜为载体,开发了一种谷物类样品中FB1的快速定性和半定量检测的直接竞争酶标试纸条,大大缩短了检测时间,20 min即可通过目视辨别毒素水平是否为1 000 μg/kg。
近年来,纳米颗粒和磁性材料广泛应用于ELISA检测,CHEN等[37]基于金纳米粒子(gold nanoparticles,AuNP)建立了一种测定玉米样品的FB1的新型直接竞争酶联免疫吸附法(dc-pELISA),颜色变化明显,灵敏度高,可见检测限可达12.5 ng/mL。管笛等[38]分别采用羊抗兔抗体磁微粒偶联物、蛋白A-磁微粒替代酶标板作为固相载体,检测限可达0.024 μg/mL和0.030 μg/mL;于瑶等[39]基于FB1单克隆抗体建立了间接竞争酶联免疫吸附法,优化条件后最低检测限为24.5 μg/kg。ELISA法灵敏度高、操作简便快速,但是易出现假阳性,适用于快速筛选和定性测定。
2.3 免疫层析技术
免疫层析技术(immu-nochromatography assay, ICA)是利用层析膜作为载体,采用标记材料标记抗原或抗体,待测物通过层析作用移动到反应区域发生特异性反应,通过快速的色度、荧光信号检测实现对目标物进行定性或定量分析的目的[40]。作为一种将层析技术和抗原-抗体特异性相结合的新兴免疫检测技术,标记材料也呈现出多样化发展,胶体金、时间分辨荧光微球、量子点、上转纳米粒子等已广泛应用于FBs的检测[41]。
2.3.1 胶体金免疫层析技术
胶体金免疫层析技术(colloidal gold immune chromate graphic assay, GICA)是利用硝酸纤维素膜作为特异性的抗原或抗体的固相载体,胶体金作为显色物,待测物通过层析作用与胶体金颗粒结合,移动至固定的抗原或抗体区发生特异性反应而被聚集或截留,目测即可得到结果[42]。
YAO等[43]采用胶体金标记抗FB1 McAb探针制备了一种可以同时测定玉米中FB1、FB2和FB3的试纸条,具有较高的准确性和精确度,平均回收率为90.42%~95.29%,FB1的检出限可达11.24 ng/mL。
胶体金免疫层析技术检测范围广、操作简单、检测灵敏度较高、便于现场携带、使用安全,但是制作成本高、重复性差、稳定性差、渗透能力差、碰到基质较复杂的样品时,会造成高假阳性、假阴性,适用于定性或者半定量。
2.3.2 时间分辨荧光免疫分析技术
时间分辨荧光免疫分析(time resolved fluoroimmunoassay, TRFIA)是利用镧系元素标记抗原或抗体,根据镧系元素螯合物的发光特点,用时间分辨技术测量荧光,同时检测波长和时间2个参数进行信号分辨,可有效地排除非特异荧光的干扰,极大地提高了分析灵敏度。
2020年,GUO等[44]建立了一种基于铕荧光微球的时间分辨荧光免疫层析分析法,用于检测玉米、玉米粉、小麦、大米和糙米5种谷物中的FB1,30 min即可完成检测,检出限为8.26 μg/kg,检测范围为13.81~1 000 μg/kg,回收率为82.85%~103.62%。
作为超微量检测领域中的一项新兴技术,时间分辨荧光免疫分析技术简单、快速、检测范围宽、灵敏度高、特异性好、重复性和稳定性好,但荧光寿命短、背景干扰大,适用于FBs的批量筛检。
2.3.3 量子点免疫层析技术
量子点(quantum dots, QDs)是一种粒径为1~10 nm的半导体荧光纳米颗粒,一般由Ⅱ~Ⅵ族(如CdSe、CdTe、Cds、ZnSe等)或Ⅲ~V族(如InP、InAs等)元素组成[45]。量子点生物相容性高,光化学稳定性好,紫外激发光谱宽且连续,荧光发射光谱窄且对称,标记前后不改变抗体等大分子物质的生物活性,荧光寿命长,是一种理想的荧光标记物。
HOU等[46]利用量子点纳米珠(quantum dots nanobeads,QDNBs,100 nm)标记FB1、DON和玉米赤霉烯酮(zearalenone,ZEN)的单克隆抗体,与传统的ELISA相比,基于McAb@QDNBs的免疫测定更加敏感,FB1、DON和ZEN的IC50值分别为12.66、2.97、0.87 ng/mL。
2.3.4 上转换纳米粒子免疫层析技术
上转换纳米粒子(upconverting nanoparticles,UCNPs)是一种低能辐射转换为高能辐射的荧光纳米材料,通常由基质材料、激活剂和敏化剂3个部分组成。长波长激发短波长发射、背景干扰小、光化学稳定性好、灵敏度高,特别适合复杂生物样本中的荧光标记[47]。
LI等[48]利用UCNPs作为上转换荧光探针,固定有单克隆抗体的磁性纳米颗粒作为免疫捕获探针,构建了一种同时检测FB1和ZEN的快速检测方法。FB1和ZEN的检出限分别为0.016 ng/mL、0.012 ng/mL,平均回收率分别为89.48%~113.69%、85.97%~113.82%。该方法具有高选择性,利用UCNPs的多重标记特性,可以进一步实现多组分的同时检测。
2.3.5 化学发光免疫分析技术
化学发光免疫分析技术(chemiluminescence enzyme immunoassay, CLEIA)利用化学发光物质标记抗体或抗原,与待测抗原或抗体反应后,形成抗原-抗体复合物,再加入氧化剂或酶的发光底物,化学发光物质经氧化剂氧化后,形成一个激发态的中间体,会发射光子释放能量从激发态回到基态,利用发光信号测量仪器检测发光强度从而达到检测目的[49-50]。
徐杰[51]基于水凝胶光子镜头微球和化学发光法建立了用于农产品中FB1、AFB1、赭曲霉毒素的多重检测方法,回收率为(74.96±5.82)%~(104.87±5.77)%;JIE等[52]以金包裹的磁性纳米颗粒Fe3O4 @Au作为固相载体,辣根过氧化物酶作为标记物,通过傅里叶变换红外光谱、扫描电子显微镜和电位分析等方法测定谷物中FBs,检测低限达0.027 ng/mL,回收率为91%~110%。化学发光免疫分析技术方便快捷、高通量、灵敏度高、成本低,已经被广泛用于食品中真菌毒素的检测。
2.4 生物传感器
生物传感器由生物感受器和信号转换器组成。采用酶、抗体、核酸、细胞受体、适配体或仿生材料等作为生物感受器识别目标分析物,通过光学、电化学、机械等信号转换器将生物响应信号转化为电、热或光信号,最后测量信号变化强度来实现分析目的[53-54]。根据信号转导方式的不同,可分为光学生物传感器和电化学生物传感器等。
2.4.1 光学生物传感器
比色生物传感器是一种极具吸引力的光学生物传感器,无需仪器,直接通过肉眼观察反应体系颜色变化进行检测分析,结果直观、成本低廉。LI等[55]利用磁性分离技术,铂纳米颗粒/金属有机气溶胶(Pt NPs/Fe-MOG)复合材料作为过氧化物酶模拟物,建立了一种用于FB1检测的比色传感器,线性范围宽达0.01~ 2 000.0 ng/mL,检测限为2.7 pg/mL;YU等[56]开发了一种基于Mn2+介导的金纳米粒子(AuNPs)聚集的比色生物传感器,通过智能手机读取AuNPs聚集引起的溶液颜色变化,避免了主观差异,检测限为0.15 ng/mL。
荧光生物传感器是一种基于荧光现象的光学生物传感器,分析时间短、操作简单、检测限低。王琦等[57]利用核酸适配体(aptamer,APT) 与氧化石墨烯(graphene oxide,GO)之间的荧光共振能量转移效应,建立了可同时检测食品中AFB1和FB1的荧光适配体传感器,检出限达0.12 ng/mL;QIN等[58]利用UCNPs和GO组装了一种荧光传感器,并通过催化发夹组装提高检测的灵敏度,实现了玉米、燕麦和婴幼儿营养品中的FB1高通量荧光检测,检测范围为0.032~500 ng/mL,检出限低至0.012 1 ng/mL。
2.4.2 电化学生物传感器
电化学生物传感器将物理技术与生物技术相结合,兼具物理学的高灵敏性、高准确率和生物学的特异选择性。DONG等[59]建立了一种fg/mL水平检测FB1的四面体DNA电化学传感器,检测线性范围为0.500 fg/mL~1.00 ng/mL,检测限为0.306 fg/mL,灵敏度高,线性范围宽;MUNAWAR等[60]设计了一种采用nanoMIPs识别FB1的高灵敏度和高选择性的电化学传感器,通过纳米MIPs颗粒识别FB1,电化学阻抗光谱和差分脉冲伏安法用于传递信号,在1 fmol/L~10 pmol/L的浓度内,传感器灵敏度为0.442 kΩ/(pmol·L-1)和0.281 μA/(pmol·L-1),检测限分别为0.03 fmol/L和0.7 fmol/L。
近年来,研究人员已经开发出多种用于FBs快速筛查和精确定量的检测技术,研究报道主要集中在液相色谱法和液相色谱-质谱联用法、酶联免疫法、免疫层析技术和生物传感器,关于不同基质中FBs的检测参数概况详见表2。如表3所示,检测分析技术各有优势、局限性和适用范围,在实际应用过程中需要结合具体情况进行方法的选择。
表2 不同基质中FBs的检测分析比较
Table 2 Comparison of analysis of fumonisins in different samples
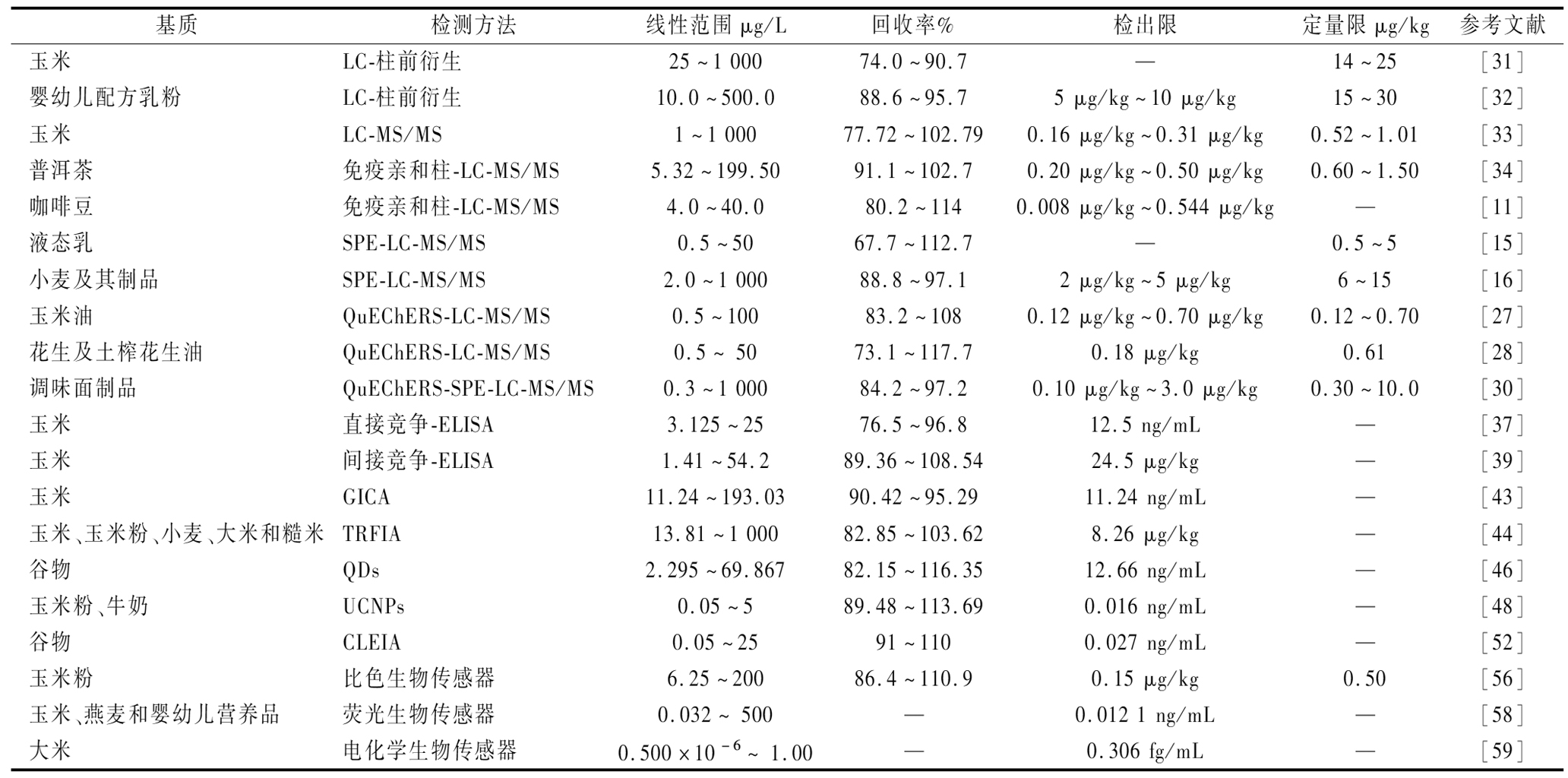
基质检测方法线性范围μg/L回收率%检出限定量限μg/kg参考文献玉米LC-柱前衍生25~1 00074.0~90.7—14~25[31]婴幼儿配方乳粉LC-柱前衍生10.0~500.088.6~95.75 μg/kg~10 μg/kg15~30[32]玉米LC-MS/MS1~1 00077.72~102.790.16 μg/kg~0.31 μg/kg0.52~1.01[33]普洱茶免疫亲和柱-LC-MS/MS5.32~199.5091.1~102.70.20 μg/kg~0.50 μg/kg0.60~1.50[34]咖啡豆免疫亲和柱-LC-MS/MS4.0~40.080.2~1140.008 μg/kg~0.544 μg/kg—[11]液态乳SPE-LC-MS/MS0.5~5067.7~112.7—0.5~5[15]小麦及其制品SPE-LC-MS/MS2.0~1 00088.8~97.12 μg/kg~5 μg/kg6~15[16]玉米油QuEChERS-LC-MS/MS0.5~10083.2~1080.12 μg/kg~0.70 μg/kg0.12~0.70[27]花生及土榨花生油QuEChERS-LC-MS/MS0.5~ 5073.1~117.70.18 μg/kg0.61[28]调味面制品QuEChERS-SPE-LC-MS/MS0.3~1 00084.2~97.20.10 μg/kg~3.0 μg/kg0.30~10.0[30]玉米直接竞争-ELISA3.125~2576.5~96.812.5 ng/mL—[37]玉米间接竞争-ELISA1.41~54.289.36~108.5424.5 μg/kg—[39]玉米GICA11.24~193.0390.42~95.2911.24 ng/mL—[43]玉米、玉米粉、小麦、大米和糙米 TRFIA13.81~1 00082.85~103.628.26 μg/kg—[44]谷物 QDs2.295~69.86782.15~116.3512.66 ng/mL—[46]玉米粉、牛奶UCNPs0.05~589.48~113.690.016 ng/mL—[48]谷物CLEIA0.05~2591~1100.027 ng/mL—[52]玉米粉比色生物传感器6.25~20086.4~110.90.15 μg/kg0.50[56]玉米、燕麦和婴幼儿营养品荧光生物传感器0.032~ 500—0.012 1 ng/mL—[58]大米电化学生物传感器0.500×10-6~ 1.00—0.306 fg/mL—[59]
注:“—”表示无数据
表3 不同检测分析技术的比较
Table 3 Comparison of different analytical techniques for different assays

方法类型优势局限性液相色谱法和液相色谱-质谱联用法仪器分析法分离效果好、灵敏度高、重复性好、检出限低、回收率高、精密度好、抗干扰能力强成本高、周期较长、不适合大批量样品的快速筛选酶联免疫法免疫学分析方法特异性好、灵敏度高、操作简便、成本低易出现假阳性、适用于快速筛选和定性测定免疫层析技术免疫学分析方法检测范围宽、灵敏度高、特异性好、重复性好、使用安全、操作简便、便于现场携带胶体金制作成本高、稳定性差;时间分辨荧光寿命短、背景干扰大;量子点易与蛋白质结合导致荧光减弱或淬灭;上转换纳米粒子技术设备要求较高;化学发光本底高、精密度差光学生物传感器生物传感器高效迅速、结果直观、成本低廉、选择性好、分析速度快比色主观差异大;荧光团分子易被生物受体标记,荧光寿命短,荧光响应稳定性差,不适合现场分析电化学生物传感器生物传感器检测范围宽、灵敏度高、抗干扰能力强、便携生物相容性材料价格昂贵、传感器寿命短
3 结论与讨论
FBs作为镰刀菌的次级代谢产物,对粮食作物及其制品的污染水平已经严重影响了我国经济发展,并且危及人类生命健康。因此,建立快速、高效、便携的FBs检测方法仍是食品安全监管的重点方向。本研究综述了近年来应用于 FBs的前处理和检测技术,对各自优势和局限性进行了分析和比较。
FBs的提取和净化极为重要,直接影响最终结果的准确性,在实际检测中可以选择多种前处理并用、开发新型纳米材料(石墨烯类材料、碳纳米管、金属有机框架材料、共价有机框架材料等磁性纳米材料)、聚合物材料(分子印迹聚合物、功能化聚合物)和生物材料(适配体材料、免疫亲和材料)等新型前处理材料来提高FBs的提取率和纯化率。
FBs的检测技术主要集中在液相色谱法和液相色谱-质谱联用法为代表的仪器分析法、以酶联免疫法、免疫层析技术为代表的免疫学分析方法以及生物传感器法。免疫学分析法适用于快速筛选、定性或者半定量测定,仪器分析法适用于准确定量检测,生物传感器则适用于低浓度的快速检测和实时监测。在实际检测中,可以采用多类方法相辅相成,以提高检测效率和准确度;同时,开发各种新型的、快速简单、灵敏的检测技术,如流式微球技术、免疫芯片技术、智能手机微阵列技术、便携式近红外光谱技术等来提高检测灵敏度、降低检测成本,推动食品中FBs的检测迈向新台阶。
[1] 坚乃丹, 常晓娇, 孙晶, 等.伏马毒素的危害及防控技术研究进展[J].食品工业科技, 2018, 39(7):335-339:347.
JIAN N D, CHANG X J, SUN J, et al.Research advances on the hazards and control of fumonisins[J].Science and Technology of Food Industry, 2018, 39(7):335-339;347.
[2] VOSS K A, RILEY R T, GARDNER N M, et al.Reproductive and Developmental Toxicology[M].Amsterdam:Elsevier, 2017:925-943.
[3] 黎晓雯, 罗俊崇, 张梦丹, 等.伏马毒素B1的毒性和检测方法[J].动物医学进展, 2019, 40(6):112-115.
LI X W, LUO J C, ZHANG M D, et al.Toxicity and detection methods of fumonisin B1[J].Progress in Veterinary Medicine, 2019, 40(6):112-115.
[4] 赫丹, 徐剑宏, 仇剑波, 等.伏马毒素的理化性质、检测方法及在我国玉米和玉米制品中的污染现状综述[J].江苏农业科学, 2021, 49(21):33-39.
HE D, XU J H, QIU J B, et al.Physical and chemical properties, detection methods and pollution status of fumonisins in corn and its products in China:A review[J].Jiangsu Agricultural Sciences, 2021, 49(21):33-39.
[5] CHEN J, WEN J, TANG Y T, et al.Research progress on fumonisin B1 contamination and toxicity:A review[J].Molecules (Basel, Switzerland), 2021, 26(17):5 238.
[6] 郭志青, 张霞, 刁立功, 等.镰刀菌及其伏马毒素的危害和防控[J].山东农业科学, 2022, 54(1):157-164.
GUO Z Q, ZHANG X, DIAO L G, et al.Hazards and control of Fusarium spp.and its metabolites fumonisins[J].Shandong Agricultural Sciences, 2022, 54(1):157-164.
[7] IARC. Some Traditional Herbal Medicines, Some Mycotoxins, Naphthalene and Styrene[M]. Lyon: IARC Press, 2002: 64-78.
[8] 袁艺, 陆廷瑾, 沈腾腾, 等.免疫亲和柱的制备及在真菌毒素检测中应用的研究进展[J].食品工业科技, 2013, 34(24):396-400.
YUAN Y, LU T J, SHEN T T, et al.Preparation of immunoaffinity column and advances in application of mycotoxin analysis[J].Science and Technology of Food Industry, 2013, 34(24):396-400.
[9] 施雅. UPLC-MS/MS测定乳制品中伏马毒素B1、B2残留[J].食品工业, 2019, 40(11):312-315.
SHI Y.Determination of fumonisin B1, B2 in dairy products by UPLC-MS/MS[J].The Food Industry, 2019, 40(11):312-315.
[10] 张太, 毛丹, 王少敏, 等.免疫亲和柱净化-柱前衍生-高效液相色谱法测定中药薏苡仁中的伏马毒素[J].分析科学学报, 2022, 38(2):233-236.
ZHANG T, MAO D, WANG S M, et al.Determination of fumonisins in Coix seed by HPLC coupled with immunoaffinity column purification-precolumn derivatization[J].Journal of Analytical Science, 2022, 38(2):233-236.
[11] 陈悦铭, 黄景初, 徐婷, 等.多功能免疫亲和柱净化-超高效液相色谱串联质谱法快速检测咖啡豆中的11种真菌毒素[J].食品工业科技, 2021, 42(16):285-293.
CHEN Y M, HUANG J C, XU T, et al.Rapid determination of 11 mycotoxins in coffee bean through multifunctional purification and immunoaffinity column coupled to high-performance liquid chromatography tandem mass spectrometry[J].Science and Technology of Food Industry, 2021, 42(16):285-293.
[12] 田苗. 免疫亲和柱、固相萃取-高效液相色谱法测定粮谷饲料中伏马毒素B1、B2的研究[C]. 长沙:第十七届全国色谱学术报告会及仪器展览会会议论文集,2009.
TIAN M. Determination of fumonisins B1 and B2 in cereals and feeds by high performance liquid chromatography with immunoaffinity column and solid phase extraction cleanup[C]. Changsha:Proceedings of the 17th National Chromatography Symposium and Instrument Exhibition,2009.
[13] 薛秋艳, 徐剑宏, 祭芳, 等.玉米中伏马毒素FB1液相色谱-电喷雾串联质谱测定方法的建立[J].江苏农业学报, 2010, 26(3):627-630.
XUE Q Y, XU J H, JI F, et al.Establishment of high performance liquid chromatography-electrospray ionization tandem mass spectrometry for detecting fumonisin B1 in maize[J].Jiangsu Journal of Agricultural Sciences, 2010, 26(3):627-630.
[14] 林维宣, 裴轶君, 董伟峰.固相萃取-高效液相色谱法测定玉米中伏马毒素B1[J].大连轻工业学院学报, 2004, 23(1):15-17.
LIN W X, PEI Y J, DONG W F.Determination of fumonisins B1 in corn by solid phase extraction-high performance liquid chromatography[J].Journal of Dalian Institute of Light Industry, 2004, 23(1):15-17.
[15] 孙晓冬, 郝杰, 毛婷, 等.固相萃取柱净化-超高效液相色谱-串联质谱法快速测定液态乳中14种真菌毒素[J].食品科学, 2018, 39(18):292-301.
SUN X D, HAO J, MAO T, et al.Determination of 14 mycotoxins in liquid milk by solid-phase extraction coupled with ultra-performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2018, 39(18):292-301.
[16] 张宇, 包小兵, 王冬梅, 等.超高效液相色谱串联质谱法同时测定小麦及其制品中玉米赤霉烯酮和伏马毒素的方法优化[J].河南预防医学杂志, 2021, 32(8):612-615.
ZHANG Y, BAO X B, WANG D M, et al.Optimization of the method for simultaneous determination of Zearalenone and fumonisins in wheat and its products by ultra high performance liquid chromatography-tandem mass spectrometry[J].Henan Journal of Preventive Medicine, 2021, 32(8):612-615.
[17] 马皎洁, 胡骁, 邵兵, 等.超高效液相色谱-串联质谱法测定面粉、玉米及其制品中的伏马菌素研究[J].山东大学学报(医学版), 2012, 50(4):115-120.
MA J J, HU X, SHAO B, et al.Ultra performance liquid chromatography-tandem mass spectrometry method for determination of fumonisins in wheat flour, corn and corn-based products[J].Journal of Shandong University (Health Sciences), 2012, 50(4):115-120.
[18] YU X, ZHONG T, ZHANG Y J, et al.Design, preparation, and application of magnetic nanoparticles for food safety analysis:A review of recent advances[J].Journal of Agricultural and Food Chemistry, 2022, 70(1):46-62.
[19] ZHAO Y, WAN L H, BAI X L, et al.Quantification of mycotoxins in vegetable oil by UPLC-MS/MS after magnetic solid-phase extraction[J].Food Additives &Contaminants.Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2017, 34(7):1 201-1 210.
[20] WANG W H, ZHANG Q, MA F, et al.Simultaneous determination of aflatoxins, fumonisin B1, T-2 and cyclopiazonic acid in agri-products by immunomagnetic solid-phase extraction coupled with UHPLC-MS/MS[J].Food Chemistry, 2022, 378:132020.
[21] 郝铖, 王思齐, 李腾飞, 等.分子印迹技术在黄曲霉毒素检测中的最新研究进展[J].分析试验室, 2022, 41(3):350-356.
HAO C, WANG S Q, LI T F, et al.Recent research advances in aflatoxin detection by molecular imprinting technique[J].Chinese Journal of Analysis Laboratory, 2022, 41(3):350-356.
[22] MAO L B, JI K L, YAO L L, et al.Molecularly imprinted photoelectrochemical sensor for fumonisin B1 based on GO-CdS heterojunction[J].Biosensors and Bioelectronics, 2019, 127:57-63
[23] MUNAWAR H, SAFARYAN A H M, DE GIROLAMO A, et al.Determination of fumonisin B1 in maize using molecularly imprinted polymer nanoparticles-based assay[J].Food Chemistry, 2019, 298:125044.
[24] SINGH A K, LAKSHMI G B V S, FERNANDES M, et al.A simple detection platform based on molecularly imprinted polymer for AFB1 and FuB1 mycotoxins[J].Microchemical Journal, 2021, 171:106730.
[25] RAMALHO R R F, PEREIRA I, DA S LIMA G, et al.Fumonisin B1 analysis in maize by molecularly imprinted polymer paper spray ionization mass spectrometry(MIP-PSI-MS)[J].Journal of Food Composition and Analysis, 2022, 107:104362.
[26] 李俊超, 秦学磊, 吴圣江, 等.QuEChERS前处理方法在食品检测中的应用进展[J].食品研究与开发, 2021, 42(24):206-212.
LI J C, QIN X L, WU S J, et al.Progress in the applications of the QuEChERS method in the food determination process[J].Food Research and Development, 2021, 42(24):206-212.
[27] 李莉, 李硕.QuEChERS-超高效液相色谱-串联质谱法测定玉米油中伏马毒素B1、B2、B3[J].食品安全质量检测学报, 2020, 11(19):7 006-7 011.
LI L, LI S.Determination of fumonisins B1, B2 and B3 in corn oil by QuEChERS-ultra performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2020, 11(19):7 006-7 011.
[28] 吴基任, 潘望, 谭高好, 等.QuEChERS-超高效液相色谱-串联质谱法测定花生及土榨花生油中9种真菌毒素[J].食品安全质量检测学报, 2021, 12(10):3 927-3 935.
WU J R, PAN W, TAN G H, et al.Determination of 9 kinds of mycotoxins in peanuts and flavor peanut oil by QuEChERS-ultra performance liquid chromatographytandem mass spectrometry[J].Journal of Food Safety &Quality, 2021, 12(10):3 927-3 935.
[29] LAGO L O, NIEVIEROWSKI T H, MALLMANN L P, et al.QuEChERS-LC-QTOFMS for the simultaneous determination of legislated and emerging mycotoxins in malted barley and beer using matrix-matched calibration as a solution to the commercial unavailability of internal standards for some mycotoxins[J].Food Chemistry, 2021, 345:128744.
[30] 徐子婷, 郝莉花, 马静, 等.QuEChERS-SPE-超高效液相色谱-串联质谱法测定调味面制品中的12种真菌毒素[J].食品工业科技, 2022, 43(6):311-319.
XU Z T, HAO L H, MA J, et al.Determination of 12 mycotoxins in seasoning flour products by QuEChERS-SPE-ultra performance liquid chromatography-tandem mass spectrometry[J].Science and Technology of Food Industry, 2022, 43(6):311-319.
[31] 王军淋, 胡玲玲, 蔡增轩, 等.超高压液相色谱法同时检测玉米中的伏马毒素B1、B2、B3[J].食品安全质量检测学报, 2013, 4(1):215-223.
WANG J L, HU L L, CAI Z X, et al.Simultaneous determination of fumonisin B1, B2 and B3 in maize by ultra pressure liquid chromatography[J].Journal of Food Safety &Quality, 2013, 4(1):215-223.
[32] 陈同强, 郭锦材, 李灿, 等.柱前衍生-高效液相色谱法测定婴幼儿配方乳粉中3种伏马毒素[J].乳业科学与技术, 2021, 44(6):11-14.
CHEN T Q, GUO J C, LI C, et al.Determination of three fumonisins in infant formula by high performance liquid chromatography with precolumn derivatization[J].Journal of Dairy Science and Technology, 2021, 44(6):11-14.
[33] 郑嘉, 王红旗, 刘继红, 等.轻简化液质联用法检测玉米中的伏马毒素B1、B2和B3[J].河南农业科学, 2021, 50(9):172-180.
ZHENG J, WANG H Q, LIU J H, et al.Simplified liquid-mass coupling method for detection of fumonisins B1, B2 and B3 in corn[J].Journal of Henan Agricultural Sciences, 2021, 50(9):172-180
[34] 胡琳, 师真, 赵丽, 等.液相色谱-串联质谱法同时测定普洱茶中16种真菌毒素[J].浙江农业学报, 2019, 31(10):1 700-1 708.
HU L, SHI Z, ZHAO L, et al.Simultaneous detection and analysis of 16 kinds of mycotoxins in Pu-erh tea[J].Acta Agriculturae Zhejiangensis, 2019, 31(10):1 700-1 708.
[35] 王蕾, 张莉蕴, 王玉可, 等.快速检测技术在食品真菌毒素检测中的研究进展[J].食品研究与开发, 2021, 42(4):187-192.
WANG L, ZHANG L Y, WANG Y K, et al.Research progress of rapid detection technology in the detection of mycotoxins in food[J].Food Research and Development, 2021, 42(4):187-192.
[36] 权英, 詹月华, 张根华, 等.伏马毒素B1酶标试纸条检测方法[J].食品研究与开发, 2011, 32(6):97-100.
QUAN Y, ZHAN Y H, ZHANG G H, et al.Development of a dipstick immunoassay for rapid detecting fumonisin B1 in food samples[J].Food Research and Development, 2011, 32(6):97-100.
[37] CHEN X R, LIANG Y, ZHANG W J, et al.A colorimetric immunoassay based on glucose oxidase-induced AuNP aggregation for the detection of fumonisin B1[J].Talanta, 2018, 186:29-35.
[38] 管笛, 潘灿平, 王文, 等.磁微粒酶联免疫吸附法测定玉米中的伏马毒素B1[J].食品科学, 2014, 35(8):208-211.
GUAN D, PAN C P, WANG W, et al.Development of a magnetic particle-based enzyme-linked immunosorbent assay for determining fumonisin B1 in corn[J].Food Science, 2014, 35(8):208-211.
[39] 于瑶, 李岩松, 卢士英, 等.玉米中伏马毒素B1、B2间接竞争酶联免疫吸附方法的建立[J].食品与发酵工业, 2020, 46(23):193-197.
YU Y, LI Y S, LU S Y, et al.An indirect competitive ELISA method for detecting fumonisin B1 and B2 in maize[J].Food and Fermentation Industries, 2020, 46(23):193-197.
[40] 李向梅, 刘志威, 陈晓敏, 等.食品安全免疫层析检测技术研究进展[J].食品安全质量检测学报, 2020, 11(15):4 939-4 955.
LI X M, LIU Z W, CHEN X M, et al.Advances of immunochromatography assay for food safety[J].Journal of Food Safety &Quality, 2020, 11(15):4 939-4 955.
[41] 刘畅, 杨琳燕, 王艺霞, 等.免疫层析技术研究及应用[J].动物医学进展, 2021, 42(2):117-121.
LIU C, YANG L Y, WANG Y X, et al.Research and application of immunochromatographic analysis[J].Progress in Veterinary Medicine, 2021, 42(2):117-121.
[42] 董旭旭, 孙威, 曹攀, 等.胶体金免疫层析试纸条技术在病毒检测领域的应用研究现状[J].生物工程学报, 2022, 38(9):3 243-3 254.
DONG X X, SUN W, CAO P, et al.Colloidal gold immunochromatographic test strip for virus detection:A review[J].Chinese Journal of Biotechnology, 2022, 38(9):3 243-3 254.
[43] YAO J J, SUN Y N, LI Q M, et al.Colloidal gold-McAb probe-based rapid immunoassay strip for simultaneous detection of fumonisins in maize[J].Journal of the Science of Food and Agriculture, 2017, 97(7):2 223-2 229.
[44] GUO L L, WANG Z X, XU X X, et al.Europium nanosphere-based fluorescence strip sensor for ultrasensitive and quantitative determination of fumonisin B1[J].Analytical Methods:Advancing Methods and Applications, 2020, 12(43):5 229-5 235.
[45] 胡高爽, 吴天琪, 苏丹, 等.基于新型标记材料的免疫分析技术在真菌毒素检测中应用的研究进展[J].食品工业科技, 2021, 42(12):398-404.
HU G S, WU T Q, SU D, et al.Research progress on application of new labeling materials based immunoassay on the detection of mycotoxin[J].Science and Technology of Food Industry, 2021, 42(12):398-404.
[46] HOU S L, MA J J, CHENG Y Q, et al.Quantum dot nanobead-based fluorescent immunochromatographic assay for simultaneous quantitative detection of fumonisin B1, dexyonivalenol, and Zearalenone in grains[J].Food Control, 2020, 117:107331.
[47] 关桦楠, 龚德状, 韩博林, 等.上转换纳米粒子在食品分析中的应用研究进展[J].食品工业, 2019, 40(3):207-211.
GUAN H N, GONG D Z, HAN B L, et al.Research progress in application of up-conversion nanoparticles in food analysis[J].The Food Industry, 2019, 40(3):207-211.
[48] LI J Z, ZHAO X D, WANG Y, et al.A highly sensitive immunofluorescence sensor based on bicolor upconversion and magnetic separation for simultaneous detection of fumonisin B1 and Zearalenone[J].The Analyst, 2021, 146(10):3 328-3 335.
[49] AZIM M A U, HASAN M, ANSARI I H, et al.Chemiluminescence immunoassay:Basic mechanism and applications[J].Bangladesh Journal of Nuclear Medicine, 2018, 18(2):171-178.
[50] XIAO Q, XU C X.Research progress on chemiluminescence immunoassay combined with novel technologies[J].TrAC Trends in Analytical Chemistry, 2020, 124:115780.
[51] 徐杰. 基于水凝胶光子晶体微球低背景化学发光技术在农产品真菌毒素检测中的应用研究[D].南京:南京师范大学, 2015.
XU J.Low background chemiluminescence detection for mycotoxins in agriculture productions based on hydrogel photonic beads[D].Nanjing:Nanjing Normal University, 2015.
[52] JIE M S, YU S C, YU F, et al.An ultrasensitive chemiluminescence immunoassay for fumonisin B1 detection in cereals based on gold-coated magnetic nanoparticles[J].Journal of the Science of Food and Agriculture, 2018, 98(9):3 384-3 390.
[53] 窦博鑫, 张云亮, 王艳, 等.生物传感器在食品检测领域的应用研究进展[J].食品安全质量检测学报, 2022, 13(3):845-851.
DOU B X, ZHANG Y L, WANG Y, et al.Advances in the application of biosensors in the field of food detection[J].Journal of Food Safety &Quality, 2022, 13(3):845-851.
[54] 钱佳婕, 黄迪, 徐颖华, 等.食源性致病微生物检测技术研究进展[J].食品安全质量检测学报, 2021, 12(12):4 775-4 785.
QIAN J J, HUANG D, XU Y H, et al.Research progress of detection technologies for foodborne pathogens[J].Journal of Food Safety &Quality, 2021, 12(12):4 775-4 785.
[55] LI M, LI D Y, LI Z Y, et al.A visual peroxidase mimicking aptasensor based on Pt nanoparticles-loaded on iron metal organic gel for fumonisin B1 analysis in corn meal[J].Biosensors and Bioelectronics, 2022, 209:114241.
[56] YU Y, LI Y S, ZHANG Q, et al.Colorimetric immunoassay via smartphone based on Mn2+-Mediated aggregation of AuNPs for convenient detection of fumonisin B1[J].Food Control, 2022, 132:108481.
[57] 王琦, 杨庆利, 吴薇.基于氧化石墨烯的荧光适配体传感器检测食品中真菌毒素[J].食品科学, 2021, 42(24):318-322.
WANG Q, YANG Q L, WU W.A graphene oxide-based fluorescent aptasensor for determination of mycotoxins in foods[J].Food Science, 2021, 42(24):318-322.
[58] QIN Y K, LI S, WANG Y, et al.A highly sensitive fluorometric biosensor for fumonisin B1 detection based on upconversion nanoparticles-graphene oxide and catalytic hairpin assembly[J].Analytica Chimica Acta, 2022, 1207:339811.
[59] DONG N, LIU D, MENG S Y, et al.Tetrahedral DNA nanostructure-enabled electrochemical aptasensor for ultrasensitive detection of fumonisin B1 with extended dynamic range[J].Sensors and Actuators B:Chemical, 2022, 354:130984.
[60] MUNAWAR H, GARCIA-CRUZ A, MAJEWSKA M, et al.Electrochemical determination of fumonisin B1 using a chemosensor with a recognition unit comprising molecularly imprinted polymer nanoparticles[J].Sensors and Actuators B:Chemical, 2020, 321:128552.