鳙鱼是我国重要的经济鱼种之一,与青鱼、草鱼和鲢鱼并称为“四大家鱼”。鳙鱼肉土腥味较大、受消费者喜爱程度较低,是提取多肽的优质原料。随着近年来越来越多的食源性抗氧化肽被发掘,研究发现食源性抗氧化肽不仅可以清除自由基、螯合金属离子、调节氧化应激、延缓细胞损伤,更具有安全、高效、易吸收等特点[1]。但作为蛋白的酶解产物,抗氧化肽对环境敏感,极易受到加工生产过程中条件和体内消化酶的影响,导致其活性丧失。
抗氧化肽在加工生产、运输贮藏过程中会受到环境变化的影响,亲核的羧基和巯基很容易发生化学反应[2],导致其生物利用度降低。罗小婵等[3]报道了干发酵牛肉香肠肽在高温中能保持较好的活性。ALAHYARIBEIK等[4]认为从鸡羽毛中获得的抗氧化肽对温度不敏感,但酸碱环境对其影响较大。另外,胃肠道上的消化酶会改变多肽的结构,进而影响其活性。LEE等[5]研究表明牛肉肌原纤维蛋白抗氧化肽在模拟消化后ABTS阳离子自由基、DPPH自由基清除率都呈现下降趋势,而且抗氧化肽活性的降低与多肽分子质量大小没有关系。由于多肽氨基酸的组成和排列顺序不同,经过模拟消化后多肽仍可能保持活性或者活性增强。WONG等[6]证实了肽Met-Tyr-Pro-Gly-Leu-Ala在模拟胃肠道消化中依然能保持良好的活性,而杨玉亮等[7]发现体外模拟消化能够增强牦牛骨胶原蛋白肽的抗氧化活性。
本实验通过酶解法从鳙鱼肌原纤维蛋白中获得抗氧化肽,研究温度、酸碱度、食品原料、金属离子和模拟肠胃消化对鳙鱼肌原纤维蛋白抗氧化肽稳定性的影响,以期为鳙鱼肌原纤维蛋白抗氧化肽在食品和医药中的加工生产提供一定的参考。
1 材料与方法
1.1 材料与试剂
鳙鱼肌原纤维蛋白抗氧化肽,实验室自制;胃蛋白酶、胰蛋白酶、2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐,上海源叶生物科技有限公司;DPPH(分析纯),梯希爱(上海)化成工业发展有限公司;磺基水杨酸、蔗糖、葡萄糖、NaCl(均为分析纯),国药集团化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
SHJ-6A磁力搅拌水浴锅,常州金坛良友仪器有限公司;GL-21M高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;HPP.L2-600/2超高压设备,天津华泰森淼生物工程技术股份有限公司;AH-BASIC实验通用型高压均质机,ATS工业系统有限公司;Waters 2695高效液相色谱仪(配2487紫外检测器和Empower工作站GPC软件),美国Waters公司;L5S紫外可见分光光度计,上海仪电分析仪器有限公司;F-4600日立荧光光谱仪,日本岛津公司;Nicolet iS50傅里叶变换红外光谱仪,美国热电公司;SU8010扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 鳙鱼肌原纤维蛋白抗氧化肽的制备
肌原纤维蛋白的提取:鳙鱼购于本地(武汉)菜市场,重击致死,去除头部、内脏和可见红肉,冲洗取白肉并斩碎。加入相当于鱼肉质量10倍的(g∶mL,1∶10)低盐溶液(20 mmol/L Tris-KCl,pH 7.0),冰浴均质60 s,分3次,每次20 s,混合溶液用300目纱布过滤后留下沉淀,沉淀重复上述操作1次。沉淀加入5倍体积高盐溶液(0.6 mol/L Tris-KCl,pH 7.0),4 ℃环境下静提22 h,间隙搅拌。静提后的混合溶液4 ℃、12 000 r/min离心15 min,取上清液。在上清液中加入5倍体积4 ℃的预冷水,混匀后4 ℃、12 000 r/min离心20 min,留沉淀。重复预冷水洗涤操作2次,所得膏状沉淀即为肌原纤维蛋白。采用考马斯亮蓝法测定肌原纤维蛋白含量,以牛血清白蛋白作为标准蛋白。
蛋白处理:将膏状肌原纤维蛋白溶于高盐溶液(0.6 mol/L Tris-KCl,pH 7.0),将蛋白溶液装袋置于装满冰水的压力容器内,300 MPa下处理20 min,随后将蛋白溶液在30 MPa、4 ℃下均质2次。
酶解:用1 mol/L的HCl调整蛋白溶液的pH为3,加入胃蛋白酶,加酶量为4 000 u/g,55 ℃酶解6 h。酶解后于沸水中灭酶15 min,冷却至室温后12 000 r/min,4 ℃离心20 min,去沉淀留上清液,用100 Da透析袋脱盐至电导率低于100 μS/cm,脱盐后离心去除沉淀留上清液,经双缩脲法测得多肽得率为28.4%,上清液冻后密封放置在-20 ℃条件下备用。
1.3.2 鳙鱼肌原纤维蛋白抗氧化肽酶解液分子质量分布
采用Waters 2695高效液相色谱仪(配2487紫外检测器和Empower工作站GPC软件)测定酶解液的分子质量分布。取样品100 mg左右于10 mL容量瓶,用流动相稀释至刻度,超声5 min,离心后经过0.22 μm尼龙膜过滤后上机分析。色谱条件:色谱柱TSKgel G2000 SWXL(7.8 mm×300 mm),检测波长220 nm,柱温30 ℃,流动相为V(乙腈)∶V(水)∶V(三氟乙酸)=40∶60∶0.1,流速0.5 mL/min,通过5种不同分子质量的标准品[细胞色素C(12 384 Da),抑肽酶(6 511 Da),杆菌肽(1 450 Da),Gly-Gly-Tyr-Arg(451 Da),Gly-Gly-Gly(189 Da)]的洗脱体积建立标准曲线并计算样品的分子质量分布。
1.3.3 鳙鱼肌原纤维蛋白抗氧化肽环境稳定性分析
1.3.3.1 pH对肽抗氧化活性的影响
配制质量浓度为5 mg/mL的粗肽溶液,用1 mol/L盐酸和氢氧化钠调整溶液pH值分别为3、5、7、9、11,室温振荡保持1 h后测定DPPH自由基清除能力、ABTS阳离子自由基清除能力、还原能力。
1.3.3.2 温度对肽抗氧化活性的影响
配制质量浓度为5 mg/mL的粗肽溶液,将粗肽液置于25、40、60、80、100 ℃的水浴中2 h,然后在冰水中快速冷却至室温后测定DPPH自由基清除能力、ABTS阳离子自由基清除能力、还原能力。
1.3.3.3 金属离子对肽抗氧化活性的影响
配制质量浓度为5 mg/mL的粗肽溶液,分别添加50、100、150、200、250 μg/mL的CuCl2、MgCl2、KCl室温振荡,反应2 h后测定DPPH自由基清除能力、ABTS阳离子自由基清除能力、还原能力。
1.3.3.4 食品原料对肽抗氧化活性的影响
配制质量浓度为5 mg/mL的粗肽液,分别添加质量分数为2%、4%、6%、8%、10%的NaCl、葡萄糖、蔗糖,室温振荡,2 h后测DPPH自由基清除能力、ABTS阳离子自由基清除能力、还原能力。
1.3.3.5 体外模拟胃肠消化对肽活性的影响
配制质量浓度为5 mg/mL的粗肽溶液。
胃蛋白酶消化:用1 mol/L HCl将粗肽液的pH值调至2.0,加入4%(质量分数)的胃蛋白酶在37 ℃下水浴磁力搅拌2 h后,沸水浴15 min灭酶,冷却至室温后离心(10 000 r/min,10 min),上清液即为胃蛋白酶消化样品。
胰蛋白酶消化:将胃蛋白酶消化后的上清液的pH值先用0.9 mol/L碳酸氢钠调至5.3,再用1 mol/L氢氧化钠调至7.5。加入4%(质量分数)的胰蛋白酶并在37 ℃下水浴磁力搅拌2 h后,沸水浴15 min灭酶,冷却至室温后离心(10 000 r/min,10 min),收集上清液,即为胰蛋白酶消化后的样品。将胃蛋白酶和胰蛋白酶消化后的样品用100 Da透析袋脱盐48 h,分别测定未消化、胃蛋白酶处理、胰蛋白酶处理后多肽的抗氧化活性、荧光强度、二级结构、表面微观结构的变化。
1.3.4 荧光光谱分析
参考方顺翔[8]的方法并稍作修改,取不同消化阶段的肽冻干粉,用去离子水配制成0.05 mg/mL的溶液,在激发波长290 nm、扫描范围300~400 nm范围内测定荧光强度,选取的狭缝宽5 nm,反应时间0.1 s。
1.3.5 傅里叶红外光谱分析
参考石嘉怿等[9]的方法并稍作修改。利用单点衰减全反射(attenuated total reflection,ATR)模式对样品信息进行采集,扫描波数范围4 000~600 cm-1,使用软件PeakFitv 4.12对1 600~1 700 cm-1的区域进行基线校正以及二阶导数拟合对样品的二级结构进行分析。
1.3.6 表面微观结构分析
取少量消化前后冻干粉末涂抹于带有导电胶的样品盘上,用洗耳球吹去没有粘牢固的粉末,将样品盘置于离子溅射仪的样品舱中,喷金2 min后,将样品盘放入扫描电子显微镜观察室,选取不同放大倍数进行观察。
1.3.7 DPPH自由基清除能力测定
参考SHIMADA等[10]报道的方法稍作修改,测定粗肽液的DPPH自由基清除能力。
1.3.8 ABTS阳离子自由基清除能力测定
参考ZHENG等[11]报道的方法稍作修改,测定粗肽液的ABTS阳离子自由基清除能力。
1.3.9 还原能力的测定
参考SARABANDI等[12]报道的方法稍作修改,测定粗肽液的还原能力。
1.4 数据分析
每个处理进行3次平行,使用SPSS 20软件对数据进行处理,Origin 2018软件进行绘图。
2 结果与分析
2.1 鳙鱼肌原纤维蛋白酶解液的相对分子质量分布
由图1-a可知,酶解产物出峰时间集中在15~23 min。鳙鱼肌原纤维蛋白酶解液的分子质量分布如图1-b所示,分子质量小于1 000 Da的肽占比最多,达到55.3%,说明在该酶解条件下酶解效果良好,小分子寡肽含量高。另外,分子质量小于3 000 Da的肽占比95.89%。多肽的抗氧化性与肽链长短密切相关,其中抗氧化肽活性较强部分分布在500~2 500 Da[13]。因此,鳙鱼肌原纤维蛋白肽具有较高的抗氧化能力与较低分子质量肽的广泛分布有关。

a-鳙鱼肌原纤维蛋白酶解液凝胶色谱图;b-鳙鱼肌原纤维蛋白酶解液分子质量分布
图1 鳙鱼肌原纤维蛋白酶解液的凝胶色谱图及分子质量分布
Fig.1 Gel chromatogram and molecular weight distribution of big-head carp myofibril proteolysis solution
2.2 pH对抗氧化肽稳定性的影响
pH对粗肽液抗氧化性的影响如图2所示,中性和偏酸环境下DPPH自由基清除能力和还原能力保持在较高水平,碱性环境下DPPH自由基清除能力和还原能力显著下降(P<0.05)。其中,在pH 11的环境下反应2 h,还原能力下降17%,DPPH自由基清除能力下降79%,相比于还原能力,DPPH自由基清除能力对碱性环境更加敏感。这与栾晓旭等[14]研究发酵香肠抗氧化肽活性随pH变化趋势相同,该研究同时还表明多肽抗氧化活性的减弱可能是发生外消旋或脱酰胺等反应,L-型氨基酸转化为D-型氨基酸,造成多肽的极性和空间位置等性质发生变化,进而影响活性的变化。反应体系的pH也可能极大影响抗氧化剂的活性,在缺乏抗氧化剂的情况下,ABTS阳离子自由基衰变速度是随着体系pH增加而增加的[11]。在本研究中ABTS阳离子自由基清除能力与pH值呈正相关。在pH为11时ABTS阳离子自由基清除率高达98%。MUZOLF等[15]研究发现儿茶素的ABTS阳离子自由基清除能力随着培养体系pH的增加而增加,与本实验趋势相同。综合考虑抗氧化肽的自由基清除能力与还原能力,鳙鱼肌原纤维蛋白抗氧化肽宜在偏酸或中性条件下加工生产。
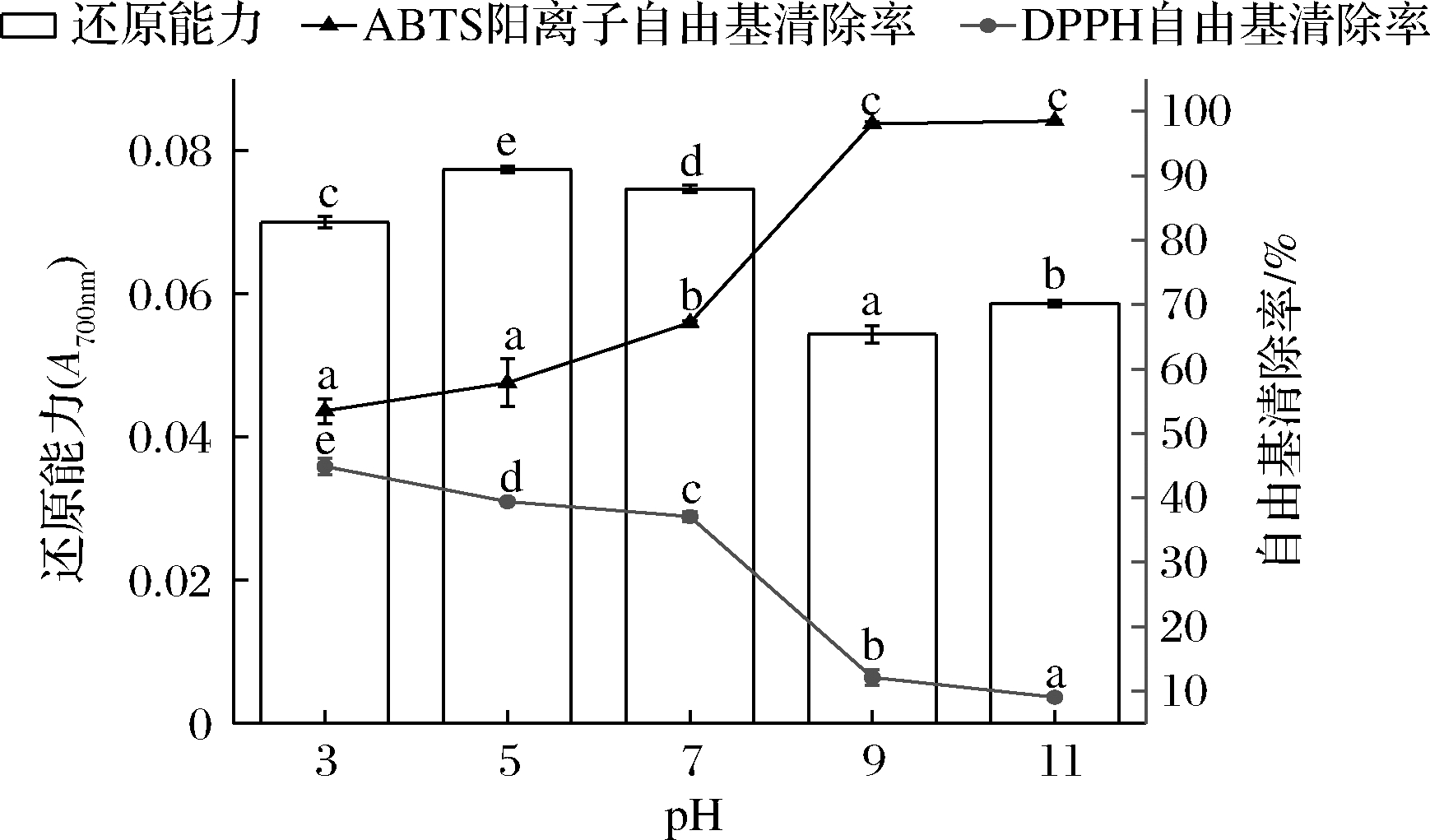
图2 pH对鳙鱼肌原纤维蛋白抗氧化肽活性的影响
Fig.2 Effect of pH conditions on antioxidant activities of peptides extracted from bighead carp myofibril protein
注:相同小写字母表示同一指标无显著性差异(P<0.05)(下同)
2.3 温度对抗氧化肽稳定性的影响
许多食品在加工生产中常采取热处理灭菌,因此确定不同温度对多肽抗氧化活性的影响至关重要。如图3所示,粗肽液的自由基清除能力与还原能力均与温度呈负相关。温度从室温升高到100 ℃,DPPH自由基、ABTS阳离子自由基清除能力分别下降14%、15%。高温会破坏多肽一级肽链和二级结构中的化学键,导致多肽结构发生裂解,从而使其活性受到影响[16]。与室温相比80 ℃时还原能力下降了9.7%,100 ℃时还原能力略有上升,但仍显著低于室温条件下(P<0.05)。虽然粗肽液的抗氧化活性受温度影响略有变化,但仍保留了大部分活性,这可能与小分子质量的肽占比较多有关(图1)。肽段分子质量小,结构简单,在温度升高的过程中,没有受到高温分解发生不可逆的变性。考虑到多肽在实际加工生产中的应用,在下一步的实验中可以探究鳙鱼肌原纤维蛋白抗氧化肽在更高温度下活性的变化。
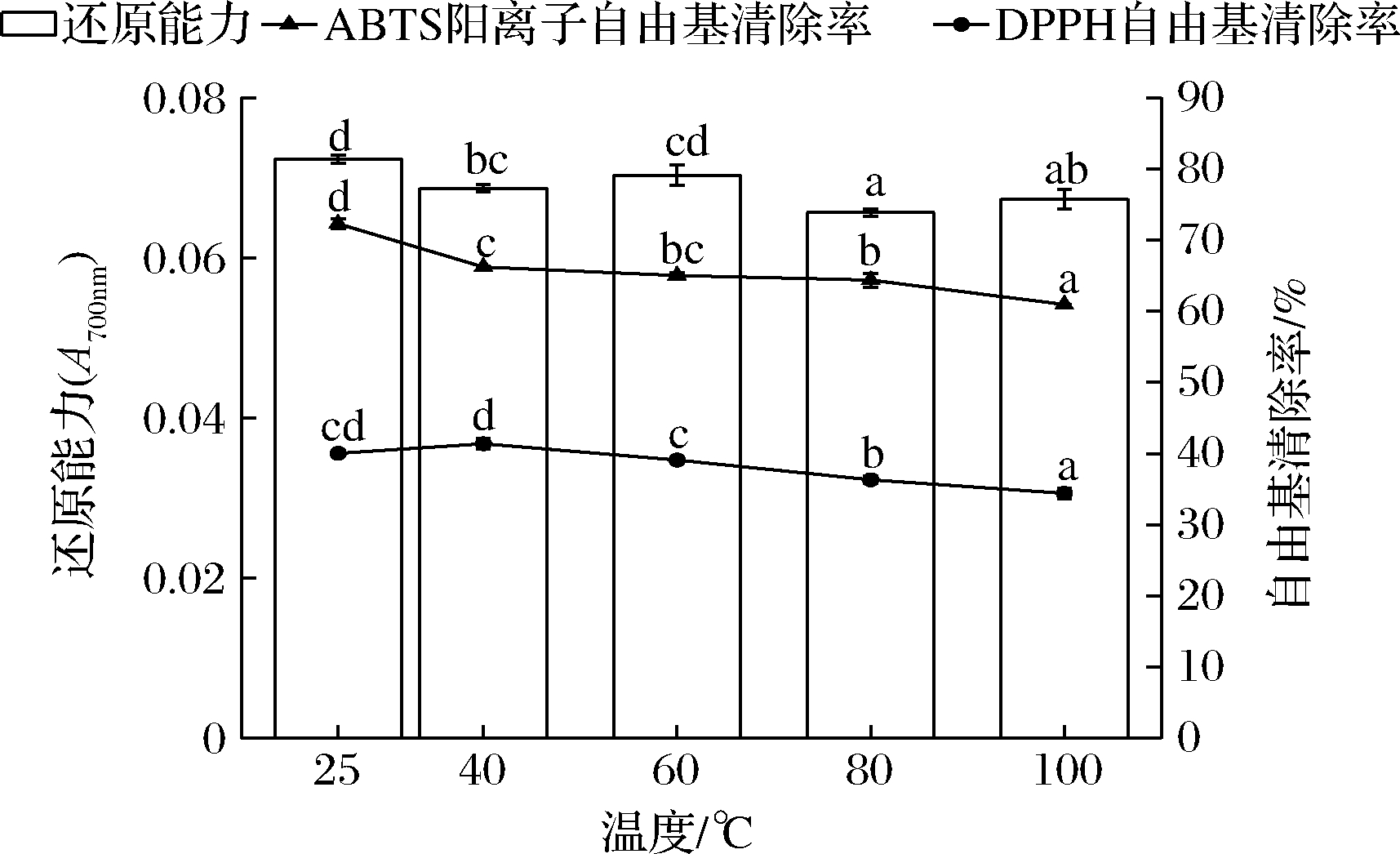
图3 温度对鳙鱼肌原纤维蛋白抗氧化肽活性的影响
Fig.3 Effect of temperature on antioxidant activities of peptides extracted from bighead carp myofibril protein
2.4 食品原料对抗氧化肽稳定性的影响
多肽在食品加工生产中不可避免地会与糖类等其他食品原料相互作用。如图4-a所示,加入质量分数10%的葡萄糖后粗肽液的ABTS阳离子自由基清除能力增加了27%,还原能力随着葡萄糖含量的增加而增加。据唐宁等[17]报告,多肽、氨基酸等与糖类可以发生美拉德反应,生成的酮、醛等还原物质具有增加多肽抗氧化活性的作用。DPPH自由基清除能力随着葡萄糖含量的增加而增加,在含量为8%时显著下降(P<0.05),但仍高于未添加葡萄糖的组。
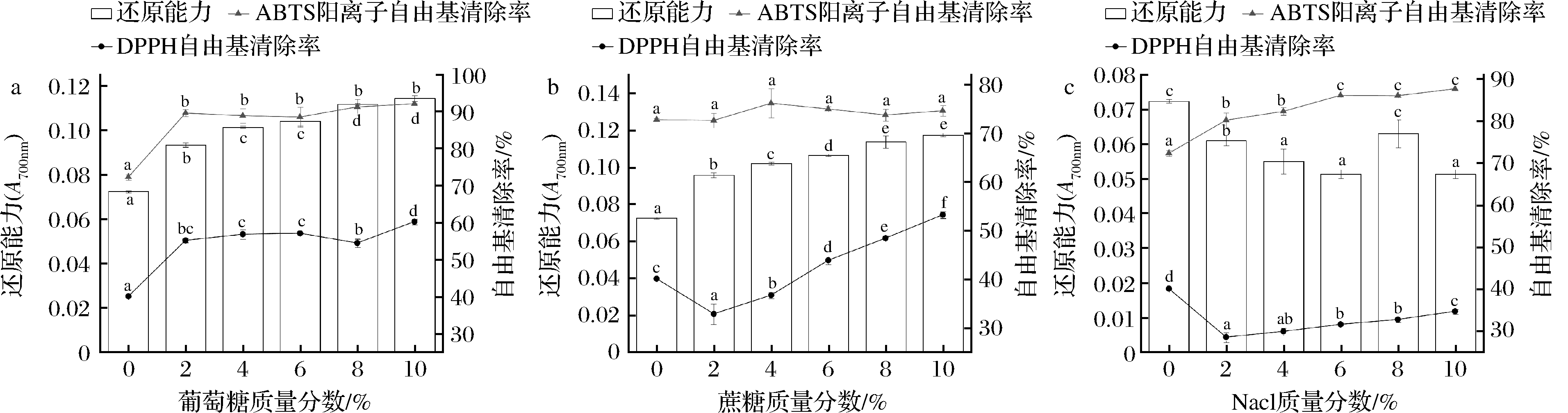
a-葡萄糖质量分数对多肽抗氧化活性的影响;b-蔗糖质量分数对多肽抗氧化活性的影响;c-NaCl质量分数对多肽抗氧化活性的影响
图4 食品原料对鳙鱼肌原纤维蛋白抗氧化肽活性的影响
Fig.4 Effect of food materials on antioxidant activities of peptides extracted from bighead carp myofibril protein
图4-b中,蔗糖加入后,还原能力变化趋势与葡萄糖相同,当添加量相同时,蔗糖组还原能力与葡萄糖组大致相同。粗肽液的ABTS阳离子自由基清除能力对蔗糖浓度不敏感,清除率上下波动,变化不显著(P>0.05)。在蔗糖的添加量为10%时,DPPH自由基清除率是对照组的1.3倍,但仍低于加入相同含量葡萄糖的组。有研究表明,蔗糖是非还原性糖且常温条件下水解不完全,由此造成了美拉德反应受阻[18]。
苦味是蛋白水解物的不良特性,限制了多肽在食品加工中的应用。食盐的加入不仅可以延长食品保质期,还可以掩盖苦味,改善口感。加入NaCl后粗肽液的抗氧化活性如图4-c所示,ABTS阳离子自由基清除能力随NaCl含量的增加而增强。在NaCl添加量范围内DPPH自由基清除能力先降低后升高,添加量2%时清除率最低,仅为28%。推断原因可能是加入低浓度NaCl时特定的肽结构和具有清除能力的氨基酸侧链遭到破坏[19],随着粗肽液中NaCl浓度的升高,肽与NaCl相互作用更加充分或有利于活性的保持。PEREIRA等[20]研究表明,多肽与含有NaCl的食品基质之间的相互作用有利于多肽活性的保持。还原能力总体呈下降趋势,当NaCl添加量为10%时,还原能力下降了29%。结果表明,NaCl的添加有利于多肽抗氧化活性的提高。为了在加工生产中保持鳙鱼肌原纤维蛋白肽的最佳活性,可以将NaCl的添加量控制在8%左右。
2.5 金属离子对抗氧化肽稳定性的影响
抗氧化肽在食品药物的加工生产中会与金属器具接触,不同金属离子对粗肽液的影响如图5-a~图5-c所示,Cu2+、K+和Mg2+均显著降低粗肽液的自由基清除能力(P<0.05)。相比于其他2种离子,Cu2+抑制效果更显著,当Cu2+质量浓度为250 μg/mL时,DPPH自由基清除率仅为19.8%,在浓度相同的情况下,其他2种离子的DPPH自由基清除率分别为27%和26%。有研究表明,抗氧化物对金属离子敏感,过渡金属Cu2+、K+等更容易与多肽形成配合物,对自由基的清除具有阻碍作用[21]。当K+质量浓度从50 μg/mL增加至250 μg/mL的过程中,ABTS阳离子自由基清除能力变化并不显著(P>0.05),栾晓旭等[14]探究K+对发酵香肠抗氧化肽ABTS自由基清除能力的影响时得出与此相同的结论。Mg2+同样也能降低粗肽液的ABTS阳离子自由基清除能力,Mg2+质量浓度为250 μg/mL时ABTS阳离子自由基清除率为47%,相比于未添加Mg2+时清除率降低了34%。
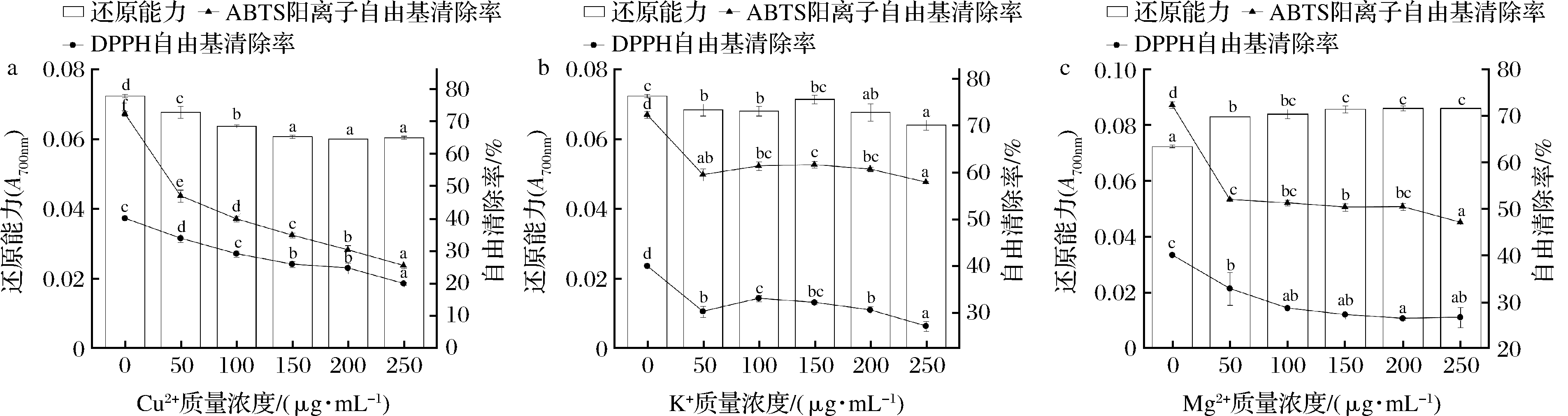
a-Cu2+质量浓度对多肽抗氧化活性的影响;b-K+质量浓度对多肽抗氧化活性的影响;c-Mg2+质量浓度对多肽抗氧化活性的影响
图5 金属离子对鳙鱼肌原纤维蛋白抗氧化肽活性的影响
Fig.5 Effect of metal ions on antioxidant activities of peptides extracted from bighead carp myofibril protein
3种金属离子对粗肽液还原能力影响不一,其中,粗肽液的还原能力与Cu2+质量浓度呈负相关,Cu2+质量浓度从50 μg/mL提高到250 μg/mL时,还原能力从0.067下降到0.060,原因可能是Cu2+与肽链上某些氨基酸存在相互作用,抑制了粗肽液的还原能力[22]。K+对粗肽液的还原能力同样具有抑制作用,K+质量浓度为250 μg/mL时的还原能力相对于对照组下降了11%,而Mg2+的加入可以显著增强还原能力(P<0.05),当离子质量浓度为200 μg/mL时还原能力最强,是未添加Mg2+的1.2倍。郭世良等[23]在酸肉肽中加入500 μg/mL的Mg2+后还原能力也得到增强,与本实验结果类似。因此在抗氧化肽的加工、运输等过程中应避免与金属制器接触,同时减少与含有Cu2+的原料混合。
2.6 模拟消化对抗氧化肽的影响
2.6.1 模拟消化对抗氧化肽活性的影响
抗氧化肽在消化过程中会被降解,其活性会被激活或失活,因此确定抗氧化肽在消化后是否能保持结构的完整性和生物活性至关重要。如图6所示,经历2 h胃消化后多肽液的还原能力和DPPH自由基清除能力分别增加55.5%和7.5%左右。ZHU等[19]报道胃蛋白酶可以将肽段分解成更小的片段,从而暴露出更多内部基团,其中一些疏水性氨基酸的暴露可以提高抗氧化活性。再经过肠消化后DPPH自由基清除能力和还原能力显著下降(P<0.05),胰蛋白酶可以将多肽更完全水解从而使其更亲水,因此更难与脂溶性DPPH自由基反应[24]。ABTS阳离子自由基清除能力在胃消化阶段显著下降,与DPPH自由基清除能力和还原能力不同的是ABTS阳离子自由基清除能力在肠消化阶段依旧能保持81%的水平,原因是肠消化阶段的pH值有利于多肽活性的保持(图2)。

图6 模拟胃肠消化对鳙鱼肌原纤维蛋白抗氧化肽活性的影响
Fig.6 Effect of digestion stages on antioxidant activities of peptides extracted from bighead carp myofibril protein
2.6.2 模拟消化对抗氧化肽荧光强度的影响
模拟消化对抗氧化肽荧光强度的影响如图7所示,多肽经胃蛋白酶和胰蛋白酶消化后暴露出的酪氨酸和色氨酸残基会引起荧光强度的变化[25]。经胃消化后多肽的荧光强度变弱,多肽结构发生变化,暴露在水中的色氨酸残基减少,原因可能是经过胃蛋白酶的消化后导致多肽内部残基通过化学作用力重新发生聚集埋没了色氨酸等基团[26]。经过肠消化后多肽荧光强度增强,最大荧光发射波长(λmax)也发生红移。表明胰蛋白酶在消化过程中可以使多肽结构更加舒展,暴露出更多的疏水性基团。石嘉怿等[9]利用胰蛋白酶模拟肠消化谷蛋白,结果显示荧光强度不断升高,最大荧光发射波长(λmax)也发生红移,与本实验趋势相同。
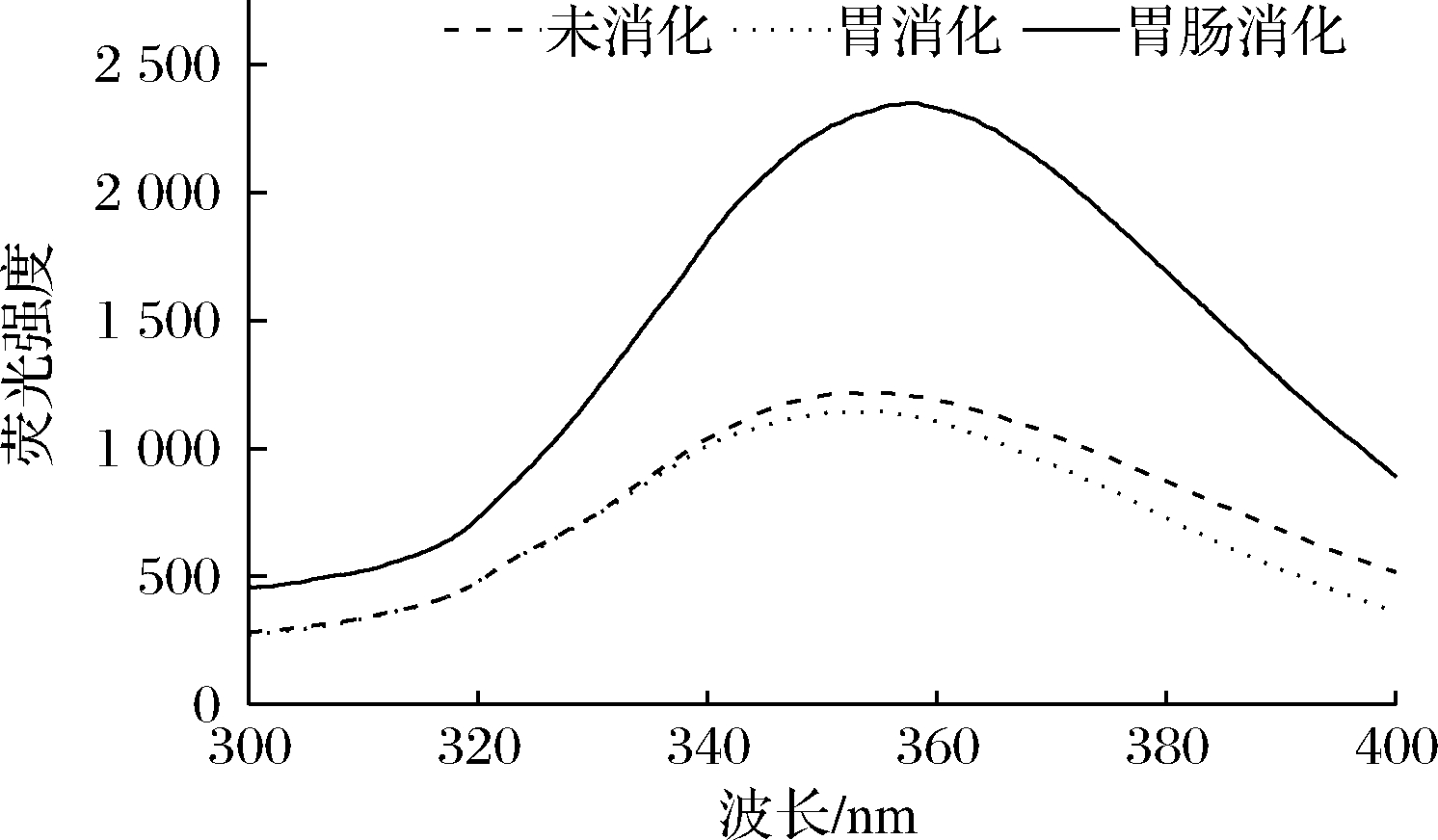
图7 模拟胃肠消化对鳙鱼肌原纤维蛋白抗氧化肽荧光强度的影响
Fig.7 Effect of simulated gastrointestinal digestion on the fluorescence intensity of antioxidant peptide of bighead carp myofibrillar protein
2.6.3 模拟消化前后抗氧化肽红外光谱分析及二级结构变化
模拟消化后多肽红外光谱图如图8-a所示,酰胺A带由于N—H伸缩振动吸收,在3 270 cm-1附近出现吸收峰,经过胃和肠的消化后发生红移,这与曹振海等[27]模拟消化胶原蛋白肽的结果一致。经过胃肠消化后,多肽峰形发生了变化。由于C![]() O的振动收缩,酰胺Ⅰ带在1 638 cm-1处出现吸收峰,在消化后移至1 643 cm-1推测原因可能是分子间氢键断裂,C
O的振动收缩,酰胺Ⅰ带在1 638 cm-1处出现吸收峰,在消化后移至1 643 cm-1推测原因可能是分子间氢键断裂,C![]() O的电子云密度高,导致吸收峰向波数高的方向移动。酰胺Ⅱ带由于C—N伸缩和N—H弯曲振动在1 533 cm-1出现吸收峰,在消化前后出峰位置基本不变。酰胺Ⅲ带在1 238 cm-1处有明显的吸收峰,经胃消化后出现红移,肠消化后出现蓝移。
O的电子云密度高,导致吸收峰向波数高的方向移动。酰胺Ⅱ带由于C—N伸缩和N—H弯曲振动在1 533 cm-1出现吸收峰,在消化前后出峰位置基本不变。酰胺Ⅲ带在1 238 cm-1处有明显的吸收峰,经胃消化后出现红移,肠消化后出现蓝移。
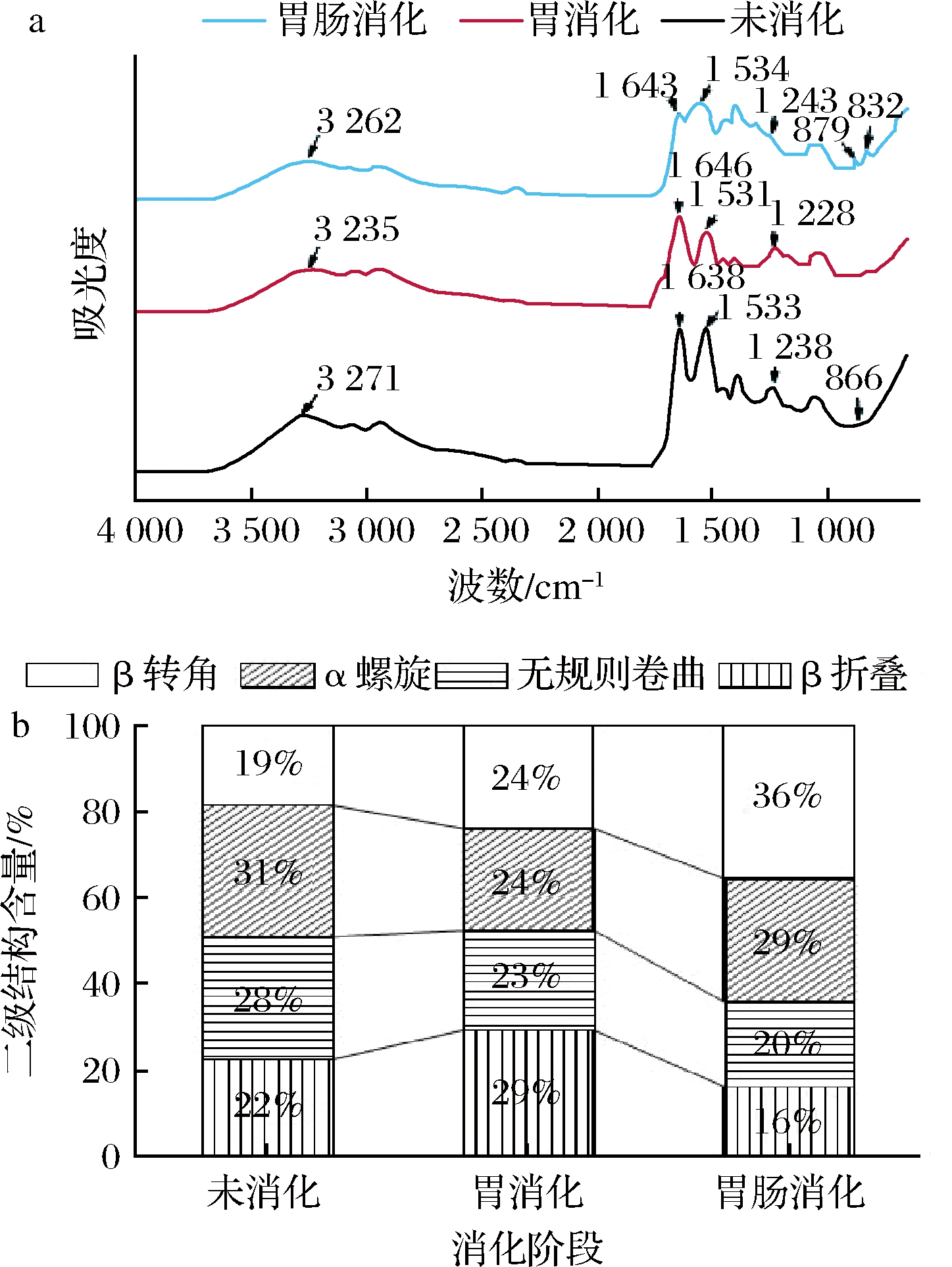
a-鳙鱼肌原纤维蛋白抗氧化肽消化前后红外光谱图;b-鳙鱼肌原纤维蛋白抗氧化肽消化前后二级结构含量
图8 鳙鱼肌原纤维蛋白抗氧化肽消化前后红外光谱图及二级结构含量
Fig.8 Infrared spectra and secondary structure contents of bighead carp myofibril antioxidant peptides during each digestion stage
二级结构中的α-螺旋和β-折叠对维持多肽的有序结构具有重要意义。如图8-b所示,鳙鱼肌原纤维蛋白抗氧化肽消化前α-螺旋和β-折叠总含量占53%,在胃消化后含量不变,表明鳙鱼肌原纤维蛋白抗氧化肽二级结构可以抵抗胃蛋白酶的消化[28]。经胰蛋白酶消化后α-螺旋含量增加,β-折叠含量减少,总含量有所下降,表明在胰蛋白酶的作用下,抗氧化肽的结构得到舒展,这同时也对应了胰蛋白酶消化后荧光强度出现上升的现象(图7)。另外,经过胰蛋白酶处理后,抗氧化肽的β-折叠减少,α-螺旋和β-转角含量增加,原因可能是β-折叠含量减少有助于α-螺旋的形成[29]。
2.6.4 模拟消化前后抗氧化肽表面微观结构的变化
由扫描电镜(scanning eletron microscope,SEM)图9-A、图9-a可知,抗氧化肽在放大150倍下呈现大小不一的碎片状和棒状且排列毫无规律,放大到500倍后可以观察到碎片表面光滑,且有光滑球状结构。由图9-B、图9-b可知,抗氧化肽经胃消化后在150倍下可以观察到更多的球状和棒状出现,交联度也更加紧密,可能是由于酸性条件下蛋白分子间的静电斥力减小,同时酶解作用引起解聚以及重新聚合引起的。由图9-C、图9-c可知,抗氧化肽经过肠消化后在150倍下多成块状,形状不规则,500倍下可以观察到多肽表面粗糙,有少量细小颗粒形成,这与毛小雨[30]体外模拟消化芸豆蛋白的实验结果类似。

A~C为鳙鱼肌原纤维蛋白抗氧化肽未消化、胃消化、胃肠消化阶段在×150的SEM图;a~c分别为鳙鱼肌原纤维蛋白抗氧化肽未消化、胃消化、胃肠消化阶段在×500的SEM图
图9 鳙鱼肌原纤维蛋白抗氧化肽消化前后扫描电镜图
Fig.9 SEM of bighead carp myofibril antioxidant peptides during each digestion stage
3 结论
本研究测定了鳙鱼肌原纤维蛋白源抗氧化肽的分子质量分布,并探究了不同环境因素和模拟消化对抗氧化肽稳定性的影响。结果表明,小分子寡肽占比较多;高温、碱性环境不利于抗氧化活性的保持;糖类和NaCl可以促进自由基的清除,但对还原能力的影响不一致。相比于Cu2+、K+,Mg2+对还原能力具有抑制作用;模拟消化后DPPH自由基清除率显著下降,这与消化酶改变了多肽的二级结构和荧光强度有关,模拟消化同样改变了多肽的表面结构。
[1] ESFANDI R, WALTERS M E, TSOPMO A.Antioxidant properties and potential mechanisms of hydrolyzed proteins and peptides from cereals[J].Heliyon, 2019, 5(4):e01538.
[2] UDENIGWE C C, FOGLIANO V.Food matrix interaction and bioavailability of bioactive peptides:Two faces of the same coin?[J].Journal of Functional Foods, 2017, 35:9-12.
[3] 罗小婵, 张永东, 孔祥颖, 等.干发酵牛肉香肠肽的抗氧化稳定性研究[J].食品与发酵工业, 2022,48(10):28-34.
LUO X C, ZHANG Y D, KONG X Y, et al.Antioxidant stability of peptides extracted from dry fermented beef sausages[J].Food and Fermentation Industries, 2022,48(10):28-34.
[4] ALAHYARIBEIK S, SHARIFI S D, TABANDEH F, et al. Stability and cytotoxicity of DPPH inhibitory peptides derived from biodegradation of chicken feather[J].Protein Expression and Purification, 2021, 177:105748.
[5] LEE S Y, LEE D Y, HUR S J.Changes in the stability and antioxidant activities of different molecular weight bioactive peptide extracts obtained from beef during in vitro human digestion by gut microbiota[J].Food Research International, 2021, 141:110116.
[6] WONG F C, XIAO J B, ONG M G L, et al.Identification and characterization of antioxidant peptides from hydrolysate of blue-spotted stingray and their stability against thermal, pH and simulated gastrointestinal digestion treatments[J].Food Chemistry, 2019, 271:614-622.
[7] 杨玉亮, 衣大龙, 刘春雨, 等.体外模拟消化对牦牛骨胶原蛋白肽抗氧化活性的影响[J].食品与发酵工业, 2021, 47(13):79-84.
YANG Y L, YI D L, LIU C Y, et al.Effects of in vitro simulated digestion on the antioxidant activity of yak bone collagen peptides[J].Food and Fermentation Industries, 2021, 47(13):79-84.
[8] 方顺翔. 核桃多肽纳米脂质体制备、结构及稳定性研究[D].北京:北京林业大学, 2020.
FANG S X.Production of nanoliposomes loaded with walnut protein hydrolysates: Structure and stability[D].Beijing:Beijing Forestry University, 2020.
[9] 石嘉怿, 张太, 梁富强.体外模拟消化对大米谷蛋白结构及水解产物生物活性的影响[J].食品科学, 2021, 42(1):59-66.
SHI J Y, ZHANG T, LIANG F Q.Effect of in vitro simulated digestion on the structure of rice glutelin and the biological activity of hydrolysates[J].Food Science, 2021, 42(1):59-66.
[10] SHIMADA K, FUJIKAWA K, YAHARA K, et al.Antioxidative properties of xanthan on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry, 1992, 40(6):945-948.
[11] ZHENG L, ZHAO M M, XIAO C Q, et al.Practical problems when using ABTS assay to assess the radical-scavenging activity of peptides:Importance of controlling reaction pH and time[J].Food Chemistry, 2016, 192:288-294.
[12] SARABANDI K, SADEGHI MAHOONAK A, HAMISHEKAR H, et al.Microencapsulation of casein hydrolysates:Physicochemical, antioxidant and microstructure properties[J].Journal of Food Engineering, 2018, 237:86-95.
[13] 高云龙, 徐梦豪, 赵祥忠.响应面优化冰岛刺参内脏团抗氧化肽制备工艺及其组成分析[J].食品工业科技, 2022, 43(1):235-243.
GAO Y L, XU M H, ZHAO X Z.Optimization of preparation process of antioxidant peptides in the visceral mass of Cucumaria frondosa by response surface methodology and its composition analysis[J].Science and Technology of Food Industry, 2022, 43(1):235-243.
[14] 栾晓旭, 冯美琴, 孙健.发酵香肠源抗氧化肽的稳定性[J].食品科学, 2020, 41(16):1-7.
LUAN X X, FENG M Q, SUN J.Stability of antioxidant peptides extracted from fermented sausages[J].Food Science, 2020, 41(16):1-7.
[15] MUZOLF M, SZYMUSIAK H, ![]() A, et al.pH-Dependent radical scavenging capacity of green tea catechins[J].Journal of Agricultural and Food Chemistry, 2008, 56(3):816-823.
A, et al.pH-Dependent radical scavenging capacity of green tea catechins[J].Journal of Agricultural and Food Chemistry, 2008, 56(3):816-823.
[16] LIU K L, DU R F, CHEN F S.Stability of the antioxidant peptide SeMet-Pro-Ser identified from selenized brown rice protein hydrolysates[J].Food Chemistry, 2020, 319:126540.
[17] 唐宁, 庄红.玉米抗氧化肽Leu-Pro-Phe抗氧化稳定性研究[J].中国食品学报, 2015, 15(2):49-55.
TANG N, ZHUANG H.Studies on the antioxidative stability of corn antioxidant peptide Leu-Pro-Phe[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(2):49-55.
[18] 姚轶俊, 张晶, 鞠兴荣, 等.菜籽抗氧化肽WDHHAPQLR的环境稳定性研究[J].中国粮油学报, 2019, 34(8):54-60.
YAO Y J, ZHANG J, JU X R, et al.Environmental stability of rapeseed antioxidant peptide WDHHAPQLR[J].Journal of the Chinese Cereals and Oils Association, 2019, 34(8):54-60.
[19] ZHU C Z, ZHANG W G, KANG Z L, et al.Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science, 2014, 96(2):783-789.
[20] PEREIRA A M, LISBOA C R, SANTOS T D, et al.Bioactive stability of microalgal protein hydrolysates under food processing and storage conditions[J].Journal of Food Science and Technology, 2019, 56(10):4 543-4 551.
[21] 郭其洪, 李兴丽, 范江平, 等.辣木籽抗氧化肽的分离鉴定及其稳定性分析[J].食品工业科技, 2022, 43(5):41-47.
GUO Q H, LI X L, FAN J P, et al.Isolation, identification and stability analysis of antioxidant peptides from Moringa oleifera seeds[J].Science and Technology of Food Industry, 2022, 43(5):41-47.
[22] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al.The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freeze-thaw cycles[J].Food Chemistry, 2006, 95(4):591-599.
[23] 郭世良, 吴慧琳, 朱瑶迪, 等.发酵酸肉肽的抗氧化稳定性分析[J].现代食品科技, 2021, 37(8):226-233;83.
GUO S L, WU H L, ZHU Y D, et al.Antioxidant stability of fermented sour meat peptides[J].Modern Food Science and Technology, 2021, 37(8):226-233;83.
[24] ZHU L J, CHEN J, TANG X Y, et al.Reducing, radical scavenging, and chelation properties of in vitro digests of alcalase-treated zein hydrolysate[J].Journal of Agricultural and Food Chemistry, 2008, 56(8):2 714-2 721.
[25] WANG K Q, SUN D W, PU H B, et al.Principles and applications of spectroscopic techniques for evaluating food protein conformational changes:A review[J].Trends in Food Science &Technology, 2017, 67:207-219.
[26] RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al.Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota)[J].Food Hydrocolloids, 2009, 23(1):26-39.
[27] 曹振海, 乐彩虹, 陶宁萍, 等.体外模拟消化对暗纹东方鲀鱼皮胶原蛋白肽结构特征及抗氧化活性的影响[J].食品与发酵工业, 2021, 47(23):61-69.
CAO Z H, LE C H, TAO N P, et al.Effects of structural characteristics and antioxidant activity of collagen bioactive peptides from Takifugu obscurus skin during simulated gastrointestinal digestion[J].Food and Fermentation Industries, 2021, 47(23):61-69.
[28] 冯晓文, 赵晓涵, 潘骁琦, 等.海洋鱼蛋白低聚肽结构和抗氧化活性的体外消化稳定性[J].现代食品科技, 2021, 37(5):109-116.
FENG X W, ZHAO X H, PAN X Q, et al.In vitro digestion stability of structure and antioxidant activity of marine fish protein oligopeptides[J].Modern Food Science and Technology, 2021, 37(5):109-116.
[29] GUO W B, ZHAO Y, YAO Y, et al.Relationship between protein structure changes and in vitro digestion of preserved egg white during pickling[J].International Journal of Biological Macromolecules, 2019, 138:116-124.
[30] 毛小雨. 体外模拟消化对芸豆蛋白结构特征及抗氧化活性的影响研究[D].大庆:黑龙江八一农垦大学, 2020.
MAO X Y.Effects of simulated digestion in vitro on structural characteristics and antioxidant activity of kidney bean protein[D].Daqing:Heilongjiang Bayi Agricultural University, 2020.