植物中的黏液质由植物薄壁组织的黏液分泌细胞产生,是一种结构复杂的多糖和蛋白质的复合物,在水中溶解可形成网状的胶质结构[1]。与不溶性的膳食纤维相比,可溶性的黏液质更容易作为增稠剂、乳化剂、稳定剂和脂肪替代物等在食品、医药等行业加以利用,亚麻籽黏液质可作为胶凝剂和增稠剂[2],罗望子种子黏液质可用作乳化剂[3]。
山药(Dioscorea opposita Thunb.)作为一种药食同源的植物,含有多糖、黏蛋白、尿囊素、胆碱、氨基酸、植物甾醇等多种活性成分[4]。山药黏液质是一种半透明的黏稠液体,由蛋白质和多糖等物质组成,具有抗氧化[5]、降血压[6]、增强免疫力[7]等功能,被广泛应用于食品、制药、化妆品等行业。铁棍山药黏液配制的乳液可用于马铃薯涂膜保鲜[8],还可以促进小鼠脾淋巴细胞的增殖转化[9]。MA等[10]报道,怀山药的黏液质与阿拉伯树胶有协同增效的作用,可用作食品天然乳化剂。
文成山药作为浙江省温州市文成县特有的山药品种,支链淀粉含量高,糯性强,并具有较高的糊化温度、焓值、峰值黏度和溶胀力[11]。文成山药含有丰富的黏液质,但是还没有相关的研究报道。
山药在加工过程中会有多种因素影响黏液质的稳定性以及表观黏度,因此本文除分析了文成山药黏液质的成分、结构、以及体外抗氧化活性之外,还研究了温度、pH、质量浓度对文成山药黏液质稳定性、表观黏度的影响,为文成山药黏液质的加工利用提供依据。
1 材料与方法
1.1 材料与试剂
温州文成糯山药“文糯一号”的成熟块茎(Dioscorea opposita Thunb.),浙江省温州市文成县;药品级阿拉伯树胶(>99%)、果胶、半乳糖醛酸(干基计)≥74%、叔丁基对苯二酚(tert-butylhydroquinone,TBHQ)、抗坏血酸(维生素C)、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA·Na2)、柠檬酸,分析纯,上海阿拉丁生化科技股份有限公司;其他分析纯试剂购自国药集团化学试剂有限公司。
1.2 仪器与设备
EL20 pH计,上海Mettler Toledo公司;800Y高速多功能破碎机,中国武夷海纳电器有限公司;5810R高速冷冻离心机,德国Eppendorf 公司;UV-2600i紫外可见分光光度计,日本岛津公司;is50 FT-IR分光光度计,美国Thermo Fisher Science公司;Nano Zs90纳米粒径及电位分析仪,英国马尔文公司;MCR302旋转流变仪,奥地利安东帕公司,配有PP50转子。
1.3 实验方法
1.3.1 文成山药黏液质的提取
将山药用削皮刀去皮后切成约2 mm厚的薄片,用高速多功能破碎机打成浆,然后在10 000×g下离心10 min,取上清液即得文成山药黏液质原液,冷冻干燥后得文成山药黏液质,然后将其在-80 ℃中贮存备用,图1为主要提取工艺流程。黏液质原液得率的计算如公式(1)所示:
图1 黏液质提取工艺流程
Fig.1 Extraction process of mucilage
黏液质原液得率![]()
(1)
式中:m1表示黏液质原液的质量,g;m2表示新鲜文成山药的质量,g。
1.3.2 成分分析
参照苯酚-硫酸法测定黏液质中总糖含量[10],参照DNS法测定还原糖含量[12],参照福林酚法[13]测定蛋白质含量。用水分含量测定仪直接测定水分含量,并用pH计测量样品溶液(1 mg/mL)的pH,多糖含量计算如公式(2)所示:
多糖含量![]()
(2)
式中:m1表示总糖质量,g;m2表示还原糖质量,g;m3表示文成山药黏液质的质量,g。
1.3.3 无机盐含量分析
称取0.1 g黏液质样品放入具塞试管中,加入3 mL浓硝酸,盖好但不拧紧,在120 ℃下加热1 h后冷却至室温后加入蒸馏水定容至50 mL,过0.22 μm滤膜,用电感耦合等离子体-质谱仪测定黏液质中无机盐的含量[14],无机盐含量的计算如公式(3)所示:
无机盐含量![]()
(3)
式中:m1表示无机盐质量,mg;m2表示文成山药黏液质的质量,kg。
1.3.4 傅里叶红外光谱(Fourier transform infrared spectrometer,FT-IR)分析
在干燥条件下,将约1 mg黏液质与KBr(100 mg)混合压成1 mm左右的薄片,然后用FT-IR分光光度计在4 000~400 cm-1内扫描,分辨率4 cm-1[14]。
1.3.5 稳定性与黏度分析
1.3.5.1 溶液制备
将黏液质、阿拉伯树胶、果胶分别溶解在蒸馏水中,于室温(25 ℃)下搅拌均匀,各自配制成质量浓度为4、8、12、16、20 mg/mL的溶液。
用pH 6.5、5 mmol/L磷酸盐缓冲液配制8 g/L的黏液质溶液,通过加入盐酸和NaOH来调节pH为pH 5和pH 9。
取8 g/L的黏液质水溶液,分别在40、60、80、100 ℃下水浴20 min,然后在室温(25 ℃)下放置3 h后进行分析。
1.3.5.2 粒径与zeta电位测定
用纳米粒径及电位分析仪分析其粒径、粒度分布、多分散系数(polydispersity index, PDI)和zeta电位。分析溶液浓度、温度及pH处理对黏液质粒径大小、分布和电位的影响。
1.3.5.3 表观黏度测定
在不同的剪切速率和25 ℃的恒定温度下,用流变仪测定其黏度。另外,设置剪切速率为1 s-1,设置温度范围为5~90 ℃,测定温度对黏液质溶液黏度的影响。
1.3.6 体外抗氧化性分析
1.3.6.1 还原力测定
采用SAVI等[15]方法进行测定并稍作修改。取不同质量浓度(0~4 mg/mL)的黏液质水溶液(1 mL)与0.2 mol/L磷酸钠缓冲液(pH 6.6,0.2 mL)和10 g/L铁氰化钾溶液(0.2 mL)混合后于50 ℃下水浴20 min,迅速冷却至室温,加入100 g/L三氯乙酸溶液(0.2 mL)结束反应。然后在3 000×g下离心10 min,取上清液(0.5 mL)与蒸馏水(0.7 mL)和1 g/L的氯化铁溶液(0.1 mL)混合,在700 nm处测量吸光度。
1.3.6.2 DPPH自由基清除率测定
采用AHMAD等[16]方法并适当修改。制备不同质量浓度的黏液质水溶液(0~4 mg/mL)。用50%(体积分数)的甲醇溶液配制成0.2 mmol/L DPPH-50%甲醇溶液(0.5 mL),然后与0.5 mL黏液质溶液混合,在室温下避光反应30 min。然后,用紫外可见分光光度计在517 nm处测量吸光度。DPPH自由基的清除率计算如公式(4)所示:
DPPH自由基清除率![]()
(4)
式中:AS为与DPPH溶液(0.5 mL样品溶液+0.5 mL DPPH溶液)混合的试样的吸光度;AP是被测样品与50%甲醇溶液(0.5 mL样品溶液+0.5 mL 50%甲醇溶液)混合后的吸光度;AO是DPPH溶液与50%甲醇溶液(0.5 mL DPPH溶液+0.5 mL 50%甲醇溶液)混合后的吸光度。
1.3.6.3 羟自由基清除率测定
根据SAVI等[15]的方法并适当修改,测定黏液质的羟基自由基的清除率。将5 mmol/L 1,10-菲咯啉(0.15 mL)与7.5 mmol/L硫酸亚铁溶液(0.5 mL)和0.2 mol/L磷酸钠缓冲液(pH 7.4,0.4 mL)混合,并快速混匀。将不同质量浓度(0~4 mg/mL)的黏液质水溶液(0.5 mL)和1%(体积分数)H2O2溶液(0.1 mL)依次添加到混合物中。充分摇动混合物并在37 ℃下水浴60 min,然后在510 nm处测量吸光度。羟自由基清除率计算如公式(5)所示:
羟自由基清除率![]()
(5)
式中:AS是加入黏液质溶液(0.5 mL)的吸光度;AP是以蒸馏水(0.5 mL)代替黏液质溶液的吸光度;AH是用蒸馏水(0.1 mL)代替过氧化氢的吸光度;AO是加入蒸馏水(0.6 mL)代替黏液质和过氧化氢的吸光度。
1.3.6.4 亚铁离子螯合力测定
按照MA等[17]的方法测定。取0.5 mL每种质量浓度(0~4 mg/mL)的黏液质溶液,加入1 mL蒸馏水和2 mmol/L FeCl2溶液(0.05 mL),混匀后加入5 mmol/L菲啰嗪溶液(0.05 mL)启动反应。然后在室温下反应10 min后测量562 nm处吸光度。亚铁离子的螯合力计算如公式(6)所示:
亚铁离子螯合力![]()
(6)
式中:AS是加入黏液质溶液(1 mL)的吸光度;AO是以蒸馏水(1 mL)代替黏液质溶液的吸光度。
1.4 数据分析
实验做3次平行,数据表示为平均值±标准差,用IBM SPSS Statistics 17.0软件进行数据分析,用OriginPro 2018软件绘图。
2 结果与分析
2.1 黏液质主要成分
文成山药黏液质原液的得率为(17.57±2.13)%,黏液质中含有多糖(14.99±1.27)%、水(14.29±0.08)%、蛋白质(57.16±7.24)%、还原糖(0.012±0.002)%,1 mg/mL黏液质溶液的pH值为6.85±0.03。黏液质中无机盐含量如图2所示。黏液质中含有人体所需的K、Ca、Na、Mg、Fe、Zn等元素,其中Mg含量最高,为(2 654±44) mg/kg,高于其他山药中Mg的含量(1 737±288) mg/kg[18],可为富镁食品和保健品的研究提供参考。
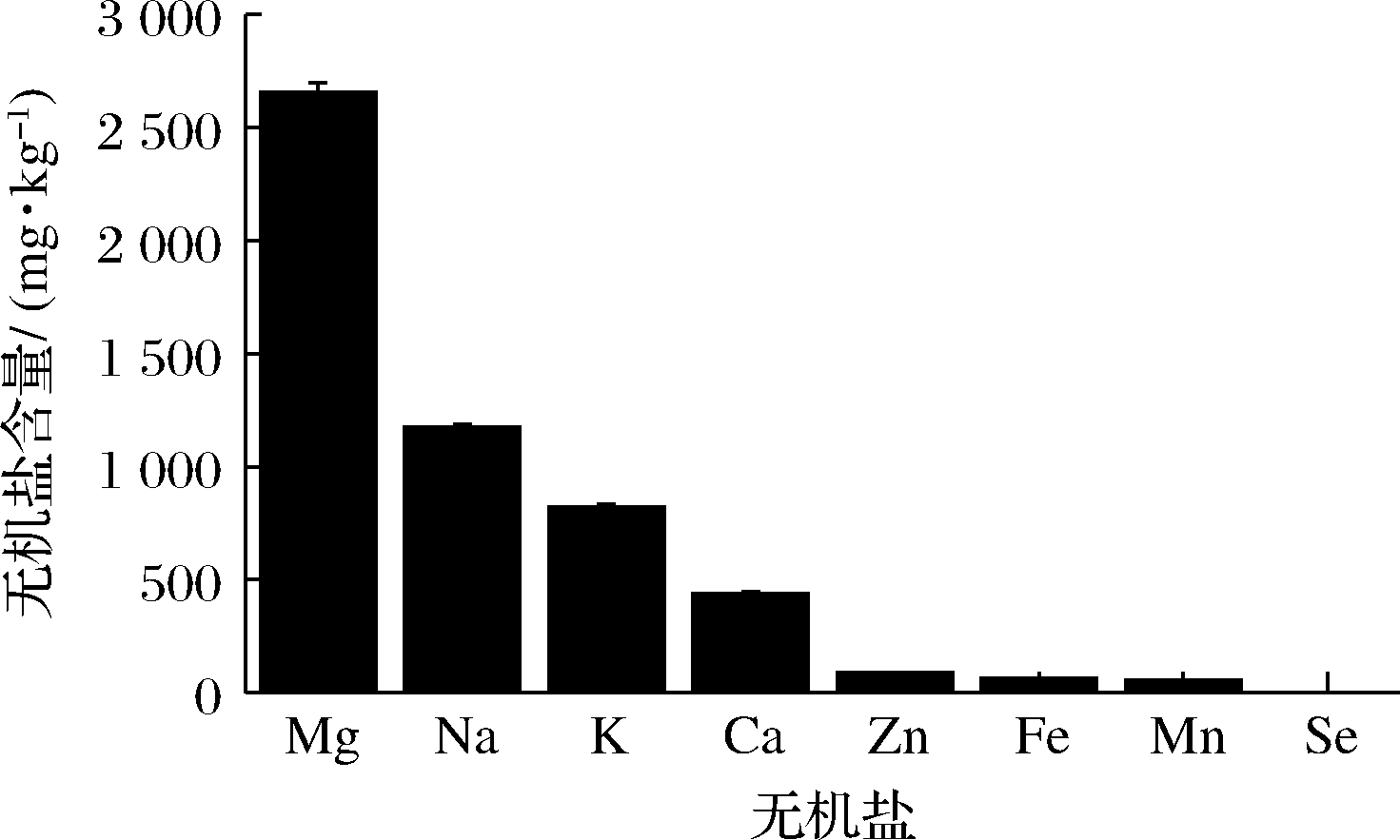
图2 黏液质中的无机盐含量
Fig.2 Contents of residual metals in mucilage
2.2 短程结构分析
通过FT-IR分析对黏液质进行短程结构表征,如图3所示,黏液质在3 386 cm-1处有一个具有相对较高的强度宽吸收带,可能由羟基的伸缩振动产生,也可能因为N—H的伸缩振动,与黏液质中含有多糖和蛋白质相吻合。2 931 cm-1处的吸收带是由于C—H的伸缩振动产生,1 729 cm-1处的吸收峰可能由与C![]() O的伸缩振动,1 637 cm-1处的吸收峰可能由与多糖分子相结合的水分子的剪切振动引起,1 404 cm-1处的吸收峰可能是由O—H键的变形振动引起,1 254 cm-1处的吸收峰可能是由于羧酸中O—H的伸缩振动[19]。FT-IR光谱表明黏液质具有多糖的典型吸收峰。
O的伸缩振动,1 637 cm-1处的吸收峰可能由与多糖分子相结合的水分子的剪切振动引起,1 404 cm-1处的吸收峰可能是由O—H键的变形振动引起,1 254 cm-1处的吸收峰可能是由于羧酸中O—H的伸缩振动[19]。FT-IR光谱表明黏液质具有多糖的典型吸收峰。

图3 黏液质的红外光谱图
Fig.3 FT-IR spectrum of mucilage
2.3 黏液质的稳定性
2.3.1 黏液质的粒径分析
溶液中粒径越小,峰值越低,体系越稳定[20]。由图4可知,在3种溶液中,阿拉伯树胶溶液粒径最小,为0.88 μm,黏液质溶液次之为1.45 μm,果胶粒径最大,为1.65 μm,黏液质表现出比果胶较好的稳定性。蛋白质的存在可能影响了多糖的活动空间以及分子间相互作用,进而影响到溶液中的粒径大小。图5-a显示,在质量浓度为4~8 mg/mL时,黏液质粒径相对较小,且随着浓度的增加,粒径有增大的趋势,可能由于此时黏液质在溶液中扩散范围较大,分子间发生碰撞、摩擦的几率较小,分散度也相对较大,粒径分布呈现出2个峰(图5-b)。而随着溶液质量浓度逐渐增加,分子间发生碰撞、摩擦的几率变大,可能开始发生絮凝,所以12~20 g/L的黏液质溶液粒径变大,为1.7~1.9 μm。

a-粒径和PDI;b-粒径分布
图4 不同种类溶液的粒径、PDI与粒径分布(8 mg/mL)
Fig.4 Droplet diameter, particle size distribution, and PDI (8 mg/mL) in different solution

a-粒径和PDI;b-粒径分布
图5 浓度对溶液的粒径、PDI与粒径分布的影响
Fig.5 Effect of mucilage solution concentration on droplet diameter, particle size distribution, and PDI
温度变化导致黏液质溶液粒径发生变化。低于60 ℃时,显示有2个峰,而经高温处理后,分布相对集中,PDI减小(图6),可能是因为温度升高,分子间作用力加强,蛋白质与多糖之间分子运动加剧,分子间结合更加牢固,而过高的温度使得其结构发生变化,所以粒径减小,分布更均匀,此时的黏液质溶液更稳定。粒径的减小有利于向空气/油/水界面扩散[21],因此经高温处理后的黏液质有利于其界面性质的改善。

a-粒径和PDI;b-粒径分布
图6 温度对溶液的粒径、PDI与粒径分布的影响
Fig.6 Effect of mucilage solution temperature on droplet diameter, particle size distribution, and PDI
在酸性和碱性环境下,黏液质粒径均有一定程度的减小,且未处理组>pH 9>pH 5,pH 5时黏液质的粒径分布相对集中,只有一个峰,粒径大小在0.96~1.17 μm,PDI为0.17(图7)。相比之下,原始状态以及碱性处理之后的黏液质有2个峰,说明黏液质在酸性条件下粒径最小,分散度最小,稳定性更好。pH测定显示黏液质溶液显示弱酸性,额外H+的加入可能使得多糖分子之间相互排斥,难以絮凝,从而粒径减小。而在碱性条件下,引入了额外的OH-与游离的H+结合,可能使得溶液中多糖分子间排斥增强,导致黏液质结构的变化,从而改变黏液质的粒径大小[22]。

a-粒径和PDI;b-粒径分布
图7 pH对溶液的粒径、PDI与粒径分布的影响
Fig.7 Effect of mucilage pH on droplet diameter, particle size distribution, and PDI
2.3.2 黏液质的电位分析
zeta电位的绝对值越大,液滴间的静电排斥越大,溶液稳定性越好,若zeta电位的绝对值大于30,则认为体系稳定[10]。由图8-a可知,果胶溶液的zeta电位绝对值接近30,阿拉伯树胶溶液的zeta电位绝对值大于20,而黏液质溶液的zeta电位绝对值接近40,这表明黏液质具有较好的稳定性,且在质量浓度≥16 mg/mL时,zeta电位绝对值变大,可能由于黏液质溶液浓度变大,离子间静电斥力变大,体系趋于稳定。图8-b显示,温度升高,可能导致分子间相互作用力发生变化,从而改变官能基团等结构排布,但该变化可能并没有在电位上有显著的表现(P>0.05)。由图8-c可知,与原始黏液质溶液的zeta电位绝对值相比,pH 9的zeta电位绝对值较高,而pH 5则较小。pH值的变化使得溶液中H+或OH-增加,与黏液质溶液中一些游离离子结合,使得结构和官能团发生变化,从而引起zeta电位的变化。因此,对黏液质进行酸碱处理会引起zeta电位的变化。然而,zeta电位值不是决定溶液稳定性的唯一标准,氨基酸组成、多糖构象和多糖浓度都有可能影响溶液体系的稳定性[23]。

a-质量浓度;b-温度;c-pH
图8 质量浓度、温度、pH对溶液电位的影响
Fig.8 Effect of mucilage solution concentration, temperature, and pH on zeta potential
注:字母不同,表示同一指标差异显著(P<0.05)
文成山药黏液质中含有多糖(14.99±1.27)%、蛋白质(57.16±7.24)%。黏液质溶液浓度的变化可能影响多糖与蛋白质之间的分子碰撞几率,弱酸性的黏液质溶液在经过酸碱度的改变后可能会影响多糖或者蛋白质结构的变化从而影响分子间的相互作用力,影响了黏液质的结构以及粒径大小和zeta电位,进而影响其稳定性。
2.4 黏液质的表观黏度
图9-a显示,黏液质溶液的黏度与质量浓度呈正相关,可能是由于浓度的增加使得分子间的相互作用力加强,碰撞、摩擦几率增大,胶凝性增强。而随剪切速率的增加,各浓度黏液质溶液的黏度均逐渐下降,这呈现出典型的假塑性和剪切稀化,显著剪切稀化有助于作为性能优良的增稠剂或稳定剂在饮料工业中广泛应用[24]。由图9-b可知,pH的变化影响了黏液质溶液的黏度,可能由于黏液质溶液为弱酸性溶液pH为6.85±0.03,所以黏液质溶液在碱性条件下的变化较酸性条件下更明显。另外,H+和OH-的加入,可能改变了黏液质中蛋白质的等电点,影响了多糖和蛋白质的带电性以及相互作用力,促进了分子间氢键的形成,影响了黏液质的结构,导致溶液黏度增加,但均表现出假塑性流体的性质。图9-c显示,在温度扫描时,黏液质溶液的黏度呈现出先降后升再降的趋势,低浓度的黏液质溶液在50 ℃时黏度开始增加,而质量浓度在8~20 mg/mL内的黏液质溶液黏度则在60 ℃之后开始增加,超过80 ℃后逐渐下降。在温度较低的情况下,多糖以及蛋白质能够维持其自身的网络结构。随着温度升高,黏液质中含有的少量淀粉开始糊化,黏度增大。黏液质中含有57%左右的蛋白质,温度过高,黏液质中的蛋白质可能发生热变性,影响了黏液质的结构,使得黏液质溶液黏度降低。

a-质量浓度;b-pH;c-质量温度
图9 浓度、温度、pH对黏液质溶液的黏度的影响
Fig.9 Effect of mucilage solution concentration, temperature, and pH on viscosity
2.5 黏液质的体外抗氧化性
在本研究的浓度范围内,黏液质的还原力远低于TBHQ和维生素C(图10-a),与AHMAD等[25]分离得到大麦多糖的还原力相似,介于0.09到0.28之间。黏液质的羟自由基清除能力弱于TBHQ和维生素C,但仍表现出较强的羟自由基清除潜力,在质量浓度为4 mg/mL时的清除率可达到75.7%(图10-b)。黏液质对DPPH自由基的清除能力随浓度增加逐渐增加提高,但变化不大,在1 mg/mL时清除率为60.86%,在4 mg/mL时清除率为67.45%(图10-c),与维生素C和TBHQ相比差异并不显著,且比从薯蓣中提取的多糖略强[15]。黏液质亚铁离子螯合能力较差,在0~1 mg/mL时对亚铁离子的螯合能力随着质量浓度的增加而不断增强,在1 mg/mL时达到18%,之后则趋于平稳(图10-d),其螯合能力明显弱于传统螯合剂EDTA·Na2,与柠檬酸无显著差异,这与MA等[17]提取得到秋葵皮多糖表现出的金属离子螯合能力相似。

a-还原力;b-羟自由基清除率;c-DPPH自由基清除率;d-亚铁离子螯合率
图10 浓度对黏液质体外抗氧化性的影响
Fig.10 Effect of mucilage solution concentration on antioxidant activity in vitro
文成山药黏液质表现出比较好的DPPH自由基和羟自由基清除能力,推测这可能与多糖和蛋白质的结合有关[15]。多糖与蛋白质之间通过共价和非共价结合的方式进行相互作用,使其中存在的亲电基团如醛和酮等与自由基结合,从而发挥其抗氧化能力。FT-IR光谱结果显示,文成山药黏液质在1 637 cm-1附近有较强吸收峰,证明有糖醛酸的存在,且自由基清除能力与糖醛酸含量呈正相关。粒径及zeta电位分析表明,文成山药黏液质具有较好的稳定性,这有利于其抗氧化能力的发挥。黏液质溶液的表观黏度随浓度增加而逐渐增强,这可能由于溶液中黏液质的增多加强了分子间的相互作用力,使多糖和蛋白质能够更好地维持网络空间结构,保护能够与自由基结合的羟基等活性基团,从而提高抗氧化能力。
3 结论
文成山药黏液质是一种主要由多糖和蛋白质组成的黏稠状假塑性液体,富含含量高出其他山药的Mg元素含量。黏液质溶液的液滴直径大于果胶但小于阿拉伯树胶,zeta电位绝对值比二者都大,且在弱酸、弱碱以及温度较高的条件处理后粒径较小,有较好的稳定性。黏液质溶液的黏度随浓度的增加而增加,且在60~80 ℃时黏度显著增加,同时呈现出明显的假塑性和剪切细化现象。黏液质有较好的羟自由基和DPPH自由基清除能力,但还原力和亚铁离子螯合能力较差。总而言之,从文成山药中提取得到的黏液质可以被认为是一种抗氧化剂和增稠剂。
[1] KREITSCHITZ A, KOVALEV A, GORB S N.Sticky invasion-the physical properties of Plantago lanceolata L.seed mucilage[J].Beilstein Journal of Nanotechnology, 2016, 7:1 918-1 927.
[2] BEKHIT A E D A, SHAVANDI A, JODJAJA T, et al.Flaxseed:Composition, detoxification, utilization, and opportunities[J].Biocatalysis and Agricultural Biotechnology, 2018, 13:129-152.
[3] ALPIZAR-REYES E, CARRILLO-NAVAS H, GALLARDO-RIVERA R, et al.Functional properties and physicochemical characteristics of tamarind (Tamarindus indica L.) seed mucilage powder as a novel hydrocolloid[J].Journal of Food Engineering, 2017, 209:68-75.
[4] MA F Y, WANG R J, ZHU J H, et al.Characterisation comparison of polysaccharides from Dioscorea opposita Thunb.growing in sandy soil, loessial soil and continuous cropping[J].International Journal of Biological Macromolecules, 2019, 126:776-785.
[5] NAGAI T, SUZUKI N, KAI N, et al.Functional properties of autolysate and enzymatic hydrolysates from yam tsukuneimo (Dioscorea opposita Thunb.) tuber mucilage tororo:Antioxidative activity and antihypertensive activity[J].Journal of Food Science and Technology, 2014, 51(12):3 838-3 845.
[6] 李晓静, 马凡怡.山药黏液的研究进展[J].广东化工, 2020, 47(7):104-106.
LI X J, MA F Y.Research progress of mucilage from Chinese yam[J].Guangdong Chemical Industry, 2020, 47(7):104-106.
[7] 林鹏, 李银保.山药的化学成分及其生物活性研究进展[J].广东化工, 2015, 42(23):118-119.
LIN P, LI Y B.Review of chemical composition and biological activity in Dioscorea opposita Thunb[J].Guangdong Chemical Industry, 2015, 42(23):118-119.
[8] 杨丽嫔, 杨倩, 王黎丽, 等.铁棍山药黏液复合乳液保鲜鲜切马铃薯研究[J].食品与发酵工业, 2021, 47(8):46-53.
YANG L P, YANG Q, WANG L L, et al.Preservation effects of composite emulsion from iron yam mucilage on fresh-cut potatoes[J].Food and Fermentation Industries, 2021, 47(8):46-53.
[9] 任国艳, 吴婷婷, 张凡, 等.山药黏液质及其酶解物的微观结构及免疫活性[J].食品科学, 2016, 37(11):58-64.
REN G Y, WU T T, ZHANG F, et al.Microstructure and immunomodulating activity of mucilage from “tiegun” yam tubers (Dioscorea opposita Thunb.cv.Tsukune) and its hydrolysates[J].Food Science, 2016, 37(11):58-64.
[10] MA F Y, ZHANG Y, YAO Y N, et al.Chemical components and emulsification properties of mucilage from Dioscorea opposita Thunb[J].Food Chemistry, 2017, 228:315-322.
[11] SHAO Y L, MAO L C, GUAN W L, et al.Physicochemical and structural properties of low-amylose Chinese yam (Dioscorea opposita Thunb.) starches[J].International Journal of Biological Macromolecules, 2020, 164:427-433.
[12] 张永勤, 薛长湖, 汤浩源, 等.还原糖的可见分光光度法研究进展[J].食品与发酵工业, 2007, 33(5):97-99;104.
ZHANG Y Q, XUE C H, TANG H Y, et al.The development of vis-spectrophotometric methods for the determination of reducing sugars[J].Food and Fermentation Industries, 2007, 33(5):97-99;104.
[13] FARINHA I, DUARTE P, PIMENTEL A, et al.Chitin-glucan complex production by Komagataella pastoris:Downstream optimization and product characterization[J].Carbohydrate Polymers, 2015, 130:455-464.
[14] 洪雅雯. 贵州鸡枞菌水溶性多糖及非水溶性多糖的结构和性质研究[D].杭州:浙江大学, 2020.
HONG Y W.Study on structure and properties of water-soluble and water-insoluble polysaccharides from Termitomyces albuminosus (berk.) heim from Guizhou province[D].Hangzhou:Zhejiang University, 2020.
[15] SAVI A, CALEGARI G C, SANTOS V A Q, et al.Chemical characterization and antioxidant of polysaccharide extracted from Dioscorea bulbifera[J].Journal of King Saud University - Science, 2020, 32(1):636-642.
[16] AHMAD M M.Characterization and antioxidant activities of polysaccharides extracted from flageolet bean pods waste[J].Current Research in Green and Sustainable Chemistry, 2021, 4:100154.
[17] MA L Y, XU R, LIN H F, et al.Structural characterization and antioxidant activities of polysaccharides from okra (Abelmoschus esculentus (L.) Moench) pericarp[J].Bioactive Carbohydrates and Dietary Fibre, 2021, 26:100277.
[18] 马蕊, 杨珂, 杨惠辛, 等.ICP-MS法测定山药、山药皮和零余子中19种无机元素含量[J].食品研究与开发, 2017, 38(24):141-146.
MA R, YANG K, YANG H X, et al.Determination of 19 inorganic elements in yam, yam peel and yam bulbils by inductively coupled plasma mass spectrometry[J].Food Research and Development, 2017, 38(24):141-146.
[19] ANDRADE L A, NUNES C A, PEREIRA J.Relationship between the chemical components of taro rhizome mucilage and its emulsifying property[J].Food Chemistry, 2015, 178:331-338.
[20] 蔡天. 控温超声辅助酶解对苹果浊汁稳定性及风味的影响[D].锦州:渤海大学, 2021.
CAI T.Effect of temperature-controlled ultrasound-assisted enzymatic hydrolysis on stability and flavor of cloudy apple juice[D].Jinzhou:Bohai University, 2021.
[21] NOSKOV B A, BYKOV A G.Dilational rheology of monolayers of nano- and micropaticles at the liquid-fluid interfaces[J].Current Opinion in Colloid &Interface Science, 2018, 37:1-12.
[22] MA F Y, WANG R J, LI X J, et al.Physical properties of mucilage polysaccharides from Dioscorea opposita Thunb[J].Food Chemistry, 2020, 311:126039.
[23] WU Y, CUI W, ESKIN N A M, et al.Fractionation and partial characterization of non-pectic polysaccharides from yellow mustard mucilage[J].Food Hydrocolloids, 2009, 23(6):1 535-1 541.
[24] 李秀秀, 尚静, 杨曦, 等.多糖的增稠、胶凝及乳化特性研究进展[J].食品科学, 2021, 42(15):300-308.
LI X X, SHANG J, YANG X, et al.A review on thickening, gelling and emulsifying properties of polysaccharides[J].Food Science, 2021, 42(15):300-308.
[25] AHMAD M, GANI A, SHAH A, et al.Germination and microwave processing of barley (Hordeum vulgare L) changes the structural and physicochemical properties of β-d-glucan &enhances its antioxidant potential[J].Carbohydrate Polymers, 2016, 153:696-702.