葡萄(Vitis vinifera L.)属于多年落叶藤本植物,富含蛋白质、维生素、氨基酸及矿物质等多种营养成分,具有抗炎、抗癌、抗氧化和保护心血管等功效,深受大家喜爱[1]。2019年的种植面积与产量分别比2018年增加了0.11万hm2和52.86万t,达到 72.62万hm2和1 419.54万t[2],是我国主要的水果品种之一。‘阳光玫瑰’葡萄是以安芸津21号和白南为亲本杂交选育而成,果实呈黄绿色,皮薄多汁,核小肉脆,且有浓厚的玫瑰香味,但果实在采后贮藏期间易发生褐变,造成营养成分流失,货架期短,不利于商品化进程,降低了经济效益。
褐变是植物体在受到逆境胁迫后发生一系列生理生化反应的结果,可分酶促褐变和非酶促褐变两类。酶促褐变是果实内酚类物质在有氧条件下经多酚氧化酶(polyphenol oxidase,PPO)催化产生黑色素的反应。组织受逆境胁迫时,脂氧合酶(lipoxygenase,LOX)启动并参与膜系统的脂质过氧化进程,加剧细胞膜降解,导致最终代谢产物丙二醛(malondialdehyde,MDA)积累。植物体内过氧化物酶(peroxidase,POD)、超氧化物歧化酶(superoxide dismutase,SOD)等活性氧清除酶活性降低,使得果实清除自由基的能力下降,活性氧在组织内积累,氧化进程大大加快,果蔬防御能力减弱,抗性降低,导致褐变[3]。非酶促褐变是果实在贮藏或加工过程中没有酶参与而发生颜色逐渐加深的反应,包括维生素C氧化反应、多酚自氧化反应、美拉德反应及焦糖化反应,其中果蔬内维生素C、总酚和还原糖等成分的含量决定了其发生非酶促褐变的速率与程度。目前国内外对白巧克力[4]、蜂蜜[5]等加工食品的褐变机理已有不少研究,但对葡萄褐变的研究主要集中在方法控制方面,如利用保鲜膜[6]、1-甲基环丙烯[7]等处理抑制褐变的发生,对葡萄尤其是‘阳光玫瑰’葡萄褐变机理的研究未见报道。
本实验通过色泽参数L*值、a*值、b*值、ΔE和褐变指数反映SO2保鲜剂处理组和对照组葡萄在贮藏60 d期间的褐变程度,同时对致褐变因子维生素C、总酚、还原糖、MDA和酶(LOX、POD、PPO和SOD)进行分析,并通过相关性分析和主成分分析(principal component analysis,PCA)解析SO2保鲜剂抑制氧化褐变的机制,为‘阳光玫瑰’葡萄贮藏保鲜的进一步研究提供理论依据,对维持其品质和延长货架期有重要意义。
1 材料与方法
1.1 材料与试剂
‘阳光玫瑰’葡萄采自于湖南省张家界市,选择成熟度一致、颗粒大小及颜色均匀、无褐变腐烂和机械擦伤、无病原菌感染的葡萄。采后立即用冷链车运入冷库,放入有聚乙烯膜的塑料筐内,每筐装10 kg葡萄,在-1~0 ℃温度下预冷12 h。预冷后一部分放SO2胶囊贴片保鲜剂,每筐1张;一部分放SO2片剂,每筐20包(每包内有两小片);另一部分放SO2粉剂,每筐10包(每包上扎2个直径为0.55~0.85 mm的孔),均匀放置后扎口。对照组不采用任何保鲜剂处理,直接扎口。每隔10 d进行取样测定,并取部分果实进行液氮磨粉,粉末样品保存于-80 ℃超低温冰箱中用于后期检测。实验设3个平行。
SO2粉剂,陕西鲜博士保鲜剂厂;SO2片剂,天津绿达保鲜工程技术有限公司;SO2胶囊贴片,南非优卫士有限公司。
草酸、碳酸氢钠、浓盐酸(分析纯)、甲醇、葡萄糖(分析纯)、酒石酸钾钠、氢氧化钠、3,5-二硝基水杨酸、结晶酚、亚硫酸钠、三氯乙酸、硫代巴比妥酸、亚油酸(化学纯)、吐温20、曲拉通X-100、磷酸氢二钠、磷酸二氢钠、乙酸、乙酸钠、聚乙二醇6000(polyethylene glycol 6000,PEG 6000)、愈创木酚、H2O2、邻苯二酚,国药集团化学试剂有限公司;维生素C标准品、2,6-二氯酚靛酚钠盐、聚乙烯吡咯烷酮(polyvinyl-polypyrrolidone,PVPP),上海瑞永生物科技有限公司;二硫苏糖醇(dithiothreitol,DTT)、氮蓝四唑(nitro-blue tetrazolium,NBT),合肥博美生物科技有限责任公司。
1.2 仪器与设备
Color Quest XE型全自动色度分析仪,美国Hunter Lab公司;JE502型分析天平(感量0.001 g),梅特勒-托利多仪器上海有限公司;UV-1800型紫外可见分光光度计,岛津仪器(苏州)有限公司;26XP型冷冻离心机,美国Beckman公司;DHG-9053A型电热恒温鼓风干燥箱,上海精宏试验设备厂。
1.3 实验方法
1.3.1 腐烂率与失水率的测定
参考曹建康等[8]的方法。
1.3.2 色泽参数与褐变指数的测定
参考LIU等[9]的方法,每组随机取20个葡萄,根据果实褐变面积占总表面积的比例评估:无症状=0级,0~10%=1级,10%~25%=2级,25%~50%=3级,超过50%=4级。
1.3.3 维生素C含量的测定
采用2,6-二氯靛酚滴定法[8]。
1.3.4 总酚含量的测定
参考曹建康等[8]的方法。
1.3.5 还原糖含量的测定
采用3,5-二硝基水杨酸法[10]。
1.3.6 MDA含量与LOX、PPO活性的测定
参考曹建康等[8]的方法。
1.3.7 POD与SOD活性的测定
参考SGHERRI等[11]的方法。
1.3.8 SO2残留量测定
参考GB 5009.34—2022《食品安全国家标准 食品中二氧化硫的测定》。
1.4 数据处理
采用Excel 2019软件进行整理和统计数据;采用SPSS 26软件进行显著性分析、相关性分析和PCA法;采用Origin 2021b软件进行图形绘制。
2 结果与分析
2.1 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间腐烂率与失水率的影响
葡萄在贮藏期间,果实腐烂率和失水率均随贮藏时间的延长而升高。如图1所示,贮藏初期葡萄果实较少出现腐烂及失水现象,在贮藏20 d后,果实腐烂率及失水率逐渐增加,且对照组果实的增加速率显著快于处理组。贮藏第60天时,对照组果实的腐烂率为12.36%,分别比SO2粉剂组、SO2片剂组和SO2胶囊贴片组高26.21%、39.89%和45.85%;对照组果实的失水率在贮藏20~60 d内升高了75.96%,分别是SO2粉剂组、SO2片剂组和SO2胶囊贴片组的1.23、0.91和1.86倍。因此,SO2保鲜剂处理在一定程度上延缓了果实的腐烂和失水,其中胶囊贴片处理组果实,品质最佳,可能因为SO2胶囊贴片是将SO2封在极小的胶囊中,胶囊再均匀分布于两层膜之间的蜡格内,保证贮藏期间均有适量的SO2释放,作用时间长且效果稳定,使葡萄品质得到保障。

a-SO2保鲜剂处理对腐烂率的影响;b-SO2保鲜剂处理对失水率的影响
图1 不同SO2保鲜剂处理组葡萄贮藏过程中腐烂率与失水率的变化
Fig.1 Changes of grape decay rate and water loss rate in different SO2 preservative treatment groups during storage
注:图中不同小写字母表示相同处理的样品在不同贮藏期有显著差异(P<0.05)(下同)
2.2 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间色泽参数与褐变指数的影响
色泽参数代表了葡萄果实的新鲜程度。L*值越大,则葡萄表面亮度越高;a*值负值越小,则葡萄越绿;b*值正值越大,则葡萄褐变程度越小;总色差ΔE越大,则葡萄在贮藏一段时间后与贮藏初期相比,色泽差异越大。如图2所示,葡萄L*值、a*值、b*值以及ΔE在贮藏60 d内呈现不同的变化趋势。SO2胶囊贴片处理的葡萄L*值、a*值、b*值以及ΔE的变化程度最小,与贮藏初期相比,第60天时L*值和b*值分别下降了6.71%和9.20%,a*值和ΔE分别增加了17.50%和5.17%;SO2粉剂组的L*值、a*值、b*值和ΔE分别是SO2胶囊贴片组的2.21、1.77、1.41和1.39倍,SO2片剂组分别是其1.33、1.25、1.27和1.19倍。对照组的色泽参数变化最快,贮藏60 d内,L*值和b*值分别下降30.06%和15.78%,a*值持续上升50.85%,造成ΔE上升了14.25%。因此,SO2胶囊贴片处理的葡萄褐变程度最小,顺序依次为:胶囊贴片组<片剂组<粉剂组<对照组,说明不同形式SO2保鲜剂能直接影响葡萄的褐变程度。
如图2-d所示,SO2胶囊贴片组褐变指数在贮藏60 d内略有上升,但上升幅度不大;SO2粉剂组和SO2片剂组上升速度均较快,但总体低于对照组,与色差测定结果一致。随着贮藏时间的延长,SO2粉剂组和SO2片剂组葡萄的褐变程度较SO2胶囊贴片组严重,进一步说明,保鲜剂的存在形式是影响褐变的重要因素,SO2以胶囊贴片形式存在时可明显抑制葡萄褐变,保持‘阳光玫瑰’葡萄果皮青绿。

a-SO2保鲜剂处理对L*值的影响;b-SO2保鲜剂处理对a*值的影响;c-SO2保鲜剂处理对b*值的影响;d-SO2保鲜剂处理对ΔE值的影响;e-SO2保鲜剂处理对褐变指数的影响
图2 不同SO2保鲜剂处理组葡萄贮藏过程中色泽参数与褐变指数的变化
Fig.2 Changes of color parameters and browning index of grapes treated with different SO2 preservative ways during storage
2.3 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间维生素C含量的影响
在果蔬非酶褐变反应体系中,维生素C作为抗坏血酸氧化褐变的呋喃前体,其含量变化对褐变机理有重要影响[12]。如图3所示,对照组维生素C含量在贮藏期间以较快速度下降,60 d内下降56.82%。SO2粉剂组和SO2片剂组维生素C含量分别在贮藏第20天和第30天时开始快速下降,50~60 d内下降速度减慢。SO2胶囊贴片组葡萄维生素C含量在整个贮藏期间内略有下降,其含量在贮藏结束时仍保持较高,分别是SO2片剂、SO2粉剂和对照组的1.26、1.32和1.83倍,说明SO2保鲜剂能保护葡萄中维生素C不被氧化,其中以胶囊贴片形式存在的SO2保鲜剂效果最好,片剂次之,维生素C氧化产物参与了葡萄非酶褐变进程。

图3 不同SO2保鲜剂处理组葡萄贮藏过程中维生素C含量的变化
Fig.3 Vitamin C content changes in grapes treated with different SO2 preservatives ways during storage
2.4 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间总酚含量的影响
酚类物质是果蔬内的次生代谢产物,易发生自身氧化而产生褐变。如图4所示,葡萄中总酚含量随贮藏时间的延长而不断下降,且在任意时间点上,处理组内总酚含量均始终高于对照组。各处理组内总酚含量在贮藏前20 d内下降缓慢且无显著差别(P<0.05);20~60 d内下降快速,SO2胶囊贴片组下降速度始终低于粉剂组和片剂组;贮藏第60天时,SO2胶囊贴片组总酚含量为贮藏初期的62.45%,分别是SO2粉剂组和SO2片剂组的1.40倍(44.76%)和1.29倍(48.49%),且总酚含量下降越显著,褐变程度越明显,说明葡萄中酚类物质的自氧化与褐变有密切关系。

图4 不同SO2保鲜剂处理组葡萄贮藏过程中总酚含量的变化
Fig.4 Changes of total phenolic content in grapes treated with different SO2 preservative ways during storage
2.5 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间还原糖含量的影响
果蔬中还原糖的羰基与氨基化合物发生美拉德反应,生成的产物也可导致褐变。如图5所示,各处理组葡萄的还原糖含量在贮藏初期(0~10 d)无显著差异;贮藏第20天时,SO2胶囊贴片组还原糖含量明显高于SO2粉剂组和SO2片剂组;SO2粉剂、SO2片剂和SO2胶囊贴片组葡萄中还原糖含量的下降幅度在第30天时开始有所增加,后30 d内分别下降了50.05%、34.97%和20.62%,可能因为在贮藏前30 d内维生素C被消耗,H+含量减少,有利于美拉德反应的发生[13]。第60天时,SO2粉剂、SO2片剂和SO2胶囊贴片组还原糖含量分别为对照组的2.87、3.84和5.11倍,说明以胶囊贴片形式存在的SO2保鲜剂对还原糖反应的抑制效果明显优于粉剂和片剂,显著减少了引起褐变的黑色产物积累。

图5 不同SO2保鲜剂处理组葡萄贮藏过程中还原糖含量的变化
Fig.5 Changes of reducing sugar content in grapes treated with different SO2 preservative ways during storage
2.6 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间MDA含量与LOX活性的影响
果蔬在衰老或遭受逆境损害时易发生膜脂过氧化反应,其终产物MDA可导致褐变。如图6-a所示,葡萄内MDA含量随贮藏时间的延长呈上升趋势。各处理组MDA含量在贮藏0~20 d内增长缓慢,可能葡萄在贮藏初期会产生足量的酶来诱导机体做出抵御氧化褐变的反应。SO2粉剂组和SO2片剂组MDA含量在贮藏20 d时开始急剧上升,而SO2胶囊贴片组在第40天时才缓慢升高;第60天时,SO2粉剂、SO2片剂和SO2胶囊贴片组MDA含量分别比对照组低20.21%、39.85%和54.67%,表明SO2保鲜剂对葡萄的贮存保鲜有显著作用,且不同形式SO2保鲜剂对脂膜过氧化的抑制效果不同,以胶囊贴片形式存在的SO2保鲜剂抑制效果最好,其MDA积累量最少,减弱了褐变的发生。

a-SO2保鲜剂处理对MDA含量的影响;b-SO2保鲜剂处理对LOX活性的影响
图6 不同SO2保鲜剂处理组葡萄贮藏过程中MDA含量与LOX活性的变化
Fig.6 Changes of MDA content and LOX activity in different SO2 preservative treatment groups during storage
LOX通过与细胞膜中多聚不饱和脂肪酸发生反应,改变了膜通透性的同时破坏了膜结构的完整。如图6-b所示,在整个贮藏期间内,葡萄内LOX活性总体呈上升趋势。各处理组LOX活性在贮藏前20 d内差异不显著;SO2粉剂组和SO2片剂组LOX活力从贮藏第20天时开始持续增加,而SO2胶囊贴片组在贮藏30~40 d内上升速度较快,第60天时,LOX活性分别为1.562、1.363、1.071 U/mg;此时,对照组LOX活性为2.315 U/mg,大于各处理组,说明SO2保鲜剂可明显抑制葡萄内LOX活性的升高,且SO2胶囊贴片处理的效果最好,SO2粉剂组与SO2片剂组对LOX活性的抑制无显著差异(P>0.05)。
2.7 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间PPO活性的影响
PPO是广泛存在于果蔬体内的氧化酶,能催化酚类物质生成醌类。如图7所示,PPO活性在贮藏60 d内呈不断上升趋势,其中,对照组PPO活性上升幅度最大(78.94%),SO2胶囊贴片组上升幅度最小(60.43%)。SO2粉剂和SO2片剂组分别在贮藏第20天和第30天时上升速度加快,可能是当葡萄受到逆境胁迫或病菌感染时,组织细胞通过升高PPO活性来保护其不遭损害[14]。贮藏第60天时,对照组PPO活性分别比SO2粉剂组、SO2片剂组和SO2胶囊贴片组高18.77%、25.79%和44.42%,说明以胶囊贴片形式存在的SO2保鲜剂钝化PPO活性的效果最好,依次为:胶囊贴片组>片剂组>粉剂组>对照组。

图7 不同SO2保鲜剂处理组葡萄贮藏过程中PPO活性的变化
Fig.7 Changes of PPO activity in different SO2preservative treatment groups during storage
2.8 不同SO2保鲜剂处理对‘阳光玫瑰’葡萄贮藏期间POD活性和SOD活性的影响
POD是一种具有清除过氧化物和自由基作用的氧化还原酶,是果蔬衰老褐变的重要指标之一。如图8-a所示,葡萄在贮藏60 d内,其POD活性呈先增大后减小的趋势。SO2胶囊贴片组POD活性上升幅度最大,SO2片剂次之,均于贮藏第20天时达到峰值,分别为37.929 U/g和33.447 U/g;粉剂组POD活性在贮藏第30天时达到峰值(30.067 U/g),显著高于对照组(P<0.05),可能是因为保鲜剂在前期释放SO2气体造成葡萄损伤,从而刺激了POD活性的升高。POD活性在贮藏后期缓慢下降,可能是因为细胞代谢紊乱,POD功能部分丧失,对有害物质的清除能力降低[15]。对照组POD活性明显低于处理组,第60天时,SO2粉剂、SO2片剂和SO2胶囊贴片组POD活性分别是对照组的2.40、2.54和3.60倍,说明SO2保鲜剂处理可有效减缓葡萄的褐变速度,其中,胶囊贴片处理的效果最显著。

a-SO2保鲜剂处理对POD活性的影响;b-SO2保鲜剂处理对SOD活性的影响
图8 不同SO2保鲜剂处理组葡萄贮藏过程中POD活性和SOD活性的变化
Fig.8 Changes of POD activity and SOD activity in grapes treated with different SO2 preservative ways during storage
SOD是果蔬自由基清除系统中的抗氧化酶,可有效阻止活性氧积累,减轻氧化褐变。如图8-b所示,葡萄SOD活性在贮藏前期呈上升趋势,且SO2保鲜剂处理可使SOD活性上升且推迟峰值的出现。对照组SOD活性在贮藏第20天时达到峰值,而经保鲜剂处理的峰值出现在第30天,且SO2粉剂组、SO2片剂组和SO2胶囊贴片组的峰值分别是对照组的1.018、1.024和1.074倍,可能是因为SOD对逆境比较敏感,保鲜剂中SO2的产生激发了植物体组织细胞对自身的保护作用[16]。SOD活性在贮藏中后期开始下降,可能是由于葡萄果实内发生的过氧化反应积累了大量活性氧,组织细胞受到不可逆伤害,导致其自我修复能力大大下降[17]。处理组SOD活性下降速度比对照组慢,且胶囊贴片组的SOD活性始终比粉剂组和片剂组高,说明3种不同形式的SO2保鲜剂可不同程度抑制SOD活性的下降,其中,以胶囊贴片形式存在的保鲜剂,其SO2释放量少,对葡萄的危害小,抑制SOD活性的效果更显著。
2.9 SO2残留量
如表1所示,经不同SO2保鲜剂处理的葡萄果实在贮藏60 d内均能检出SO2残留,但SO2残留含量均不超过50 mg/kg,符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》的要求;而对照组果实内未检测出SO2。不同SO2保鲜剂中SO2的释放速度及释放方式对葡萄果肉中SO2的残留有较大影响,贮藏期前30 d内各处理残留含量均快速增加,第30天时,SO2残留量依次为11.40、8.23、5.92 mg/kg,后30 d内处理组缓慢下降。由于SO2胶囊贴片独特的二段释放工艺,其SO2残留量始终低于SO2粉剂组和SO2片剂组。
表1 不同SO2保鲜剂处理的‘阳光玫瑰’葡萄在贮藏末期的SO2残留量 单位:mg/kg
Table 1 SO2 residues of ‘Sunshine Rose’ grape treated with different SO2 preservative ways at the end of storage
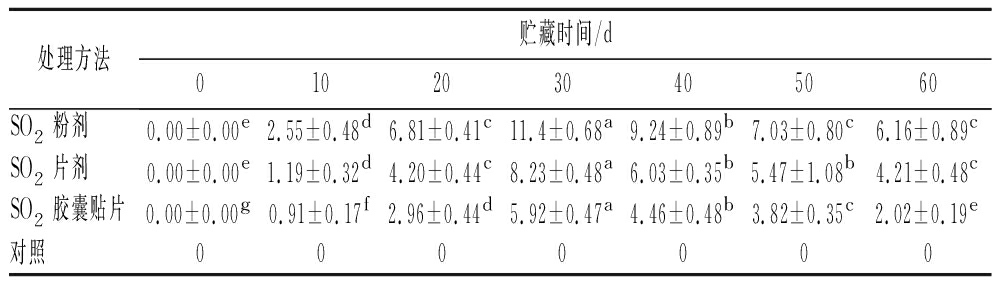
处理方法贮藏时间/d0102030405060SO2粉剂0.00±0.00e2.55±0.48d6.81±0.41c11.4±0.68a9.24±0.89b7.03±0.80c6.16±0.89cSO2片剂0.00±0.00e1.19±0.32d4.20±0.44c8.23±0.48a6.03±0.35b5.47±1.08b4.21±0.48cSO2胶囊贴片0.00±0.00g0.91±0.17f2.96±0.44d5.92±0.47a4.46±0.48b3.82±0.35c2.02±0.19e对照0000000
注:图中不同小写字母表示相同处理的样品在不同贮藏期有显著差异(P<0.05)
2.10 ‘阳光玫瑰’葡萄色泽参数与致褐变因子的相关性分析和PCA
由表2可知,L*值与维生素C、总酚、还原糖含量和SOD活性呈极显著或显著正相关(P<0.01,P <0.05),与MDA含量和LOX、PPO活性呈极显著负相关(P<0.01);a*值与维生素C、总酚、还原糖、MDA含量和LOX、PPO活性呈极显著正相关(P <0.01);b*值与维生素C、总酚、还原糖含量呈极显著正相关(P<0.01),与MDA含量和LOX、PPO活性呈极显著负相关(P <0.01);ΔE与维生素C、总酚、还原糖含量和SOD活性呈极显著或显著负相关(P<0.01,P<0.05),与MDA含量和LOX、PPO活性呈极显著正相关(P<0.01);褐变指数与维生素C、总酚、还原糖含量呈极显著负相关(P<0.01),与MDA含量和LOX、PPO活性呈极显著正相关(P<0.01)。相关性分析结果表明,与色泽参数有极显著相关性的有维生素C、总酚、还原糖、MDA含量和LOX、PPO活性,说明葡萄在贮藏期间的褐变程度不仅受维生素C氧化褐变、多酚自氧化褐变等非酶因素的影响,也与LOX、PPO等酶活性及脂膜过氧化反应密切相关。
表2 色泽参数与维生素C、总酚、还原糖、MDA含量和酶活性之间的相关性分析
Table 2 Correlation analysis of color parameters with vitamin C,total phenol,reducing sugar,MDA content and enzyme activity

指标L*a*b*ΔE褐变指数维生素C含量0.951**-0.966**0.964**-0.949**-0.968**总酚含量0.913**-0.950**0.962**-0.909**-0.942**还原糖含量0.955**-0.972**0.960**-0.952**-0.950**MDA含量-0.939**0.970**-0.949**0.937**0.951**LOX活性-0.949**0.889**-0.848**0.950**0.892**POD活性0.229-0.0850.062-0.234-0.103PPO活性-0.934**0.961**-0.961**0.930**0.971**SOD活性0.381*-0.1960.139-0.387*-0.236
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)
PCA利用降维的思想,将多个指标的信息综合到少数几个指标上,保留数据中最重要的方面。如表3所示,对葡萄的色泽参数与致褐变因子进行PCA,特征值>1的主成分有2个,第一主成分(PC1)和第二主成分(PC2)贡献率分别为68.035%和23.572%,累积贡献率达到91.067%,因此13个色泽参数和致褐变因子指标综合而成的两个主成分充分表达了葡萄氧化褐变的大部分信息。如表4所示,PC1中载荷大于0.8的有L*值、a*值、b*值、ΔE、褐变指数、维生素C含量、总酚含量、还原糖含量、MDA含量和LOX活性、PPO活性,其中维生素C和总酚含量的成分载荷最高,说明其与葡萄褐变的关系最密切,可直接影响葡萄的表观色泽。
表3 葡萄成分分析提取的主成分特征值和贡献率
Table 3 Principal component eigenvalues and contribution rate extracted from grape component analysis

主成分数特征值贡献率/%累积贡献率/%116.32868.03568.03525.65723.57291.607
表4 提取主成分的成分负荷
Table 4 Component load of principal component extraction

变量PC1PC2L*值1.056 48-0.205 7a*值-0.929 06-0.118 02b*值1.113 98-0.698 56ΔE-0.898 67-0.591 54褐变指数-1.007 76-0.194 68维生素C含量1.184 54-0.267 07总酚含量1.248 38-0.704还原糖含量1.049 54-0.130 01MDA含量-0.990 72-0.468 07LOX活性-0.838 09-0.933 42POD活性0.104 862.085PPO活性-1.094 77-0.020 3SOD活性0.001 272.246 36
如图9所示,维生素C、还原糖、总酚与L*值和b*值分布在Y轴右侧且距离较近,说明维生素C、还原糖、总酚含量的变化与葡萄表观白度和黄度有直接关系;MDA、LOX、PPO与褐变指数、ΔE和a*值分布在Y轴左侧且距离较近,说明MDA、LOX、PPO活性的变化与葡萄表观红度、总色差和褐变度有直接关系。保鲜剂处理组和CK组葡萄在贮藏0~10 d时主要分布在PCA图右下方区域,与还原糖、维生素C和总酚分布区域一致,说明葡萄在贮藏初期的褐变与果实内还原糖、维生素C和总酚含量有关;贮藏20~40 d的胶囊贴片组、20~30 d的粉剂和片剂组葡萄果实主要分布在PCA图上方区域,靠近SOD和POD分布,说明SO2保鲜剂处理组葡萄在贮藏中期的褐变与果实内SOD和POD活性有关,且胶囊贴片组果实内抗氧化酶活性比粉剂、片剂组更大;保鲜剂处理组贮藏后期(40~60 d)和CK处理组贮藏中后期(20~60 d)的葡萄分布于PCA图左下方区域,与MDA、PPO和LOX分布区域一致,说明在贮藏中后期,果实内MDA含量、PPO活性和LOX活性对葡萄褐变的影响最大。另外,对照组葡萄主要分布于PCA图左下方区域,各处理组葡萄随着贮藏时间的延长在PCA图中逐渐由右下方区域向左下方移动,说明随着贮藏时间的延长,葡萄褐变越显著,且SO2保鲜剂处理可有效减慢葡萄的氧化损伤,延缓其衰老褐变。

图9 葡萄果实致褐变因子的PCA
Fig.9 Principal component analysis of browning factors in grape fruit
注:F-0~60 d表示SO2粉剂贮藏0~60 d;P-0~60 d表示SO2片剂贮藏0~60 d;J-0~60 d表示SO2胶囊贴片贮藏0~60 d;CK-0~60 d表示对照组贮藏0~60 d
3 讨论与结论
葡萄在长期贮藏过程中,腐烂率增加,失水率升高,且组织结构发生改变;PPO与底物接触发生酶促褐变,产生了大量攻击细胞膜脂的物质,加剧膜脂过氧化,最终产生MDA[11,18],而膜脂过氧化需要LOX启动和参与[19]。本研究中,褐变速度最慢的SO2胶囊贴片组葡萄,其LOX活性在贮藏期间上升速率较平缓,且始终保持最低,与FAN等[20]对梨的研究结果相似,说明LOX活力与葡萄的褐变密切相关,也与SO2保鲜剂的不同形式密切相关。另外,葡萄内MDA含量在贮藏期间呈不断上升趋势,各处理组MDA含量显著低于对照组,而胶囊贴片组MDA含量低于粉剂组和片剂组。由PCA可知,在贮藏期间,对照组葡萄的氧化褐变程度高于各处理组,说明SO2保鲜剂处理可减少果实中活性氧的积累,抑制膜脂过氧化的发生,降低褐变速率,在对龙眼的研究中有相似结果[21]。又由相关性分析可知,葡萄MDA含量与色泽参数、褐变指数均呈极显著相关,进一步证实了SO2保鲜剂通过抑制MDA的产生抑制了葡萄褐变的发生,与李具鹏等[7]对葡萄的研究结果相似。
自由基积累会加速葡萄中酶促褐变的发生,而果蔬内自由基清除剂POD和SOD可消除组织内过量自由基。本研究中,葡萄内POD和SOD活性在贮藏前中期不断上升,分别在第20天和第30天达到最大值,SOD高活性作用时间长,推测在葡萄中SOD对自由基的清除作用要大于POD,可最大程度清除活性氧,减轻氧化伤害[21]。在贮藏后期,由于组织细胞受到不可逆损伤,POD和SOD活性降低,自由基快速积累,加快了膜脂过氧化进程。另外,在过氧化物存在的条件下,POD也能氧化酚类物质,生成褐色素[18],加快葡萄的褐变速度,与桃果肉[8]的抗氧化研究结果相似。在整个贮藏过程中,各处理组POD和SOD活力均显著高于对照组,说明SO2保鲜剂处理可通过提高葡萄中的抗氧化酶活力,抑制贮藏过程中的褐变反应,其中以胶囊贴片形式存在的SO2保鲜剂处理,其葡萄内酶活力最高。
非酶促褐变是引起葡萄褐变的另一重要原因[22]。对葡萄的色泽参数与致褐变因子进行PCA,得出还原糖、总酚和维生素C含量直接影响葡萄的表观白度L*值和黄度b*值;MDA含量、LOX和PPO活性直接影响葡萄的表观红度a*值、总色差ΔE和褐变指数,与张春岭等[23]对桃的研究结果相似。由相关性分析可知,维生素C、总酚和还原糖与色泽参数都呈极显著相关,但从主成分的成分负荷表中可看出,第一主成分中总酚和维生素C含量的载荷最高,说明在葡萄的非酶褐变反应中,多酚自氧化和维生素C氧化的贡献最大,这与藕片[24]、橙汁[25]的非酶褐变研究结果相似。另外,通过对葡萄SO2残留量检测可知,SO2保鲜剂处理后葡萄果实中残留的SO2远低于国家标准,其中SO2胶囊贴片组的SO2残留量最低。因此,可通过不同SO2保鲜剂处理来调节葡萄内褐变因子含量和抗氧化酶活性,达到葡萄褐变得到抑制的同时,其食用安全得到保障的目的。
本研究采用3种不同形式SO2保鲜剂处理‘阳光玫瑰’葡萄,测定其在长期贮藏过程中腐烂率、失水率、色泽参数与致褐变因子的变化。在整个贮藏期间,葡萄的腐烂率及失水率不断升高,果实内维生素C含量、总酚含量和还原糖含量不断降低,MDA含量和LOX活性、PPO活性随贮藏时间的延长呈上升趋势。SO2保鲜剂处理能有效延缓葡萄的腐烂及失水,减缓维生素C、总酚和还原糖含量在贮藏过程中的下降,降低MDA含量,抑制LOX和PPO活性,提高抗氧化相关酶(SOD、POD)活力,且SO2胶囊贴片组的抑制效果始终优于SO2片剂组和SO2粉剂组。结合主成分分析和相关性分析,果实色泽参数与维生素C含量、总酚含量、还原糖含量、MDA含量、LOX活性、PPO活性呈极显著相关(P<0.01),维生素C和总酚含量在第一主成分中载荷最高,则多酚自氧化和维生素C氧化是导致褐变的主要原因。另外,所有处理葡萄中残留SO2均远低于国标,不存在残留量超标现象。因此,可通过使用SO2保鲜剂处理来调节葡萄内褐变因子含量和抗氧化酶活性,达到抑制果实褐变、延长产品货架期的目的。
[1] IANNONE M, MARE R, PAOLINO D, et al.Characterization and in vitro anticancer properties of chitosan-microencapsulated flavan-3-ols-rich grape seed extracts[J].International Journal of Biological Macromolecules, 2017, 104:1 039-1 045.
[2] 张放. 2019年我国主要水果生产变化简析[J].中国果业信息, 2021, 38(3):23-33.
ZHANG F.Analysis on the production changes of main fruits in China in 2019[J].China Fruit News, 2021, 38(3):23-33.
[3] HEITMANN M, ZANNINI E, ARENDT E.Impact of Saccharomyces cerevisiae metabolites produced during fermentation on bread quality parameters:A review[J].Critical Reviews in Food Science and Nutrition, 2018, 58(7):1 152-1 164.
[4] VERCET A.Browning of white chocolate during storage[J].Food Chemistry, 2003, 81(3):371-377.
[5] DA SILVA P M, GAUCHE C, GONZAGA L V, et al.Honey:Chemical composition, stability and authenticity[J].Food Chemistry, 2016, 196:309-323.
[6] 魏宝东, 谷佰宇, 张鹏, 等.不同保鲜膜对‘阳光玫瑰’葡萄贮藏品质的影响[J].包装工程, 2021, 42(15):39-48.
WEI B D, GU B Y, ZHANG P, et al.Effect of different fresh-keeping film on the storage quality of ‘shine-Muscat’ grape[J].Packaging Engineering, 2021, 42(15):39-48.
[7] 李具鹏, 傅茂润, 杨晓颖.1-MCP处理对采后葡萄果梗褐变及叶绿素降解相关基因的影响[J].食品工业科技, 2018, 39(20):268-273;285.
LI J P, FU M R, YANG X Y.Effect of 1-MCP treatment on postharvest browning and chlorophyll breakdown pathway related genes in grape Rachis[J].Science and Technology of Food Industry, 2018, 39(20):268-273;285.
[8] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.
CAO J K, JIANG W B, ZHAO Y M.Guidance of Postharvest Physiological and Biochemical Experiments of Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[9] LIU H, JIANG W B, CAO J K, et al.Effect of chilling temperatures on physiological properties, phenolic metabolism and antioxidant level accompanying pulp browning of peach during cold storage[J].Scientia Horticulturae, 2019, 255(20):175-182.
[10] BA KAN K S, TÜTEM E, AKYÜZ E, et al.Spectrophotometric total reducing sugars assay based on cupric reduction[J].Talanta, 2016, 147:162-168.
KAN K S, TÜTEM E, AKYÜZ E, et al.Spectrophotometric total reducing sugars assay based on cupric reduction[J].Talanta, 2016, 147:162-168.
[11] SGHERRI C, SCATTINO C, PINZINO C, et al.Ultraviolet-B radiation applied to detached peach fruit:A study of free radical generation by EPR spin trapping[J].Plant Physiology and Biochemistry, 2015, 96:124-131.
[12] CIMINO P, TROIANI A, PEPI F, et al.From ascorbic acid to furan derivatives:The gas phase acid catalyzed degradation of vitamin C[J].Physical Chemistry Chemical Physics:PCCP, 2018, 20(25):17 132-17 140.
[13] 贾尚云. 基于虚拟仪器的葡萄叶片还原糖含量检测系统研究[D].兰州:甘肃农业大学,2018.
JIA S Y.Study on the determination system for reducing sugar content in grape leaves based on virtual instrument[D].Lanzhou:Gansu Agricultural University, 2018.
[14] 朱志强, 高丕生, 张平, 等.不同保鲜剂结合冰温对玫瑰香葡萄贮藏品质和生理生化的影响[J].食品工业科技, 2013, 34(5):333-337.
ZHU Z Q, GAO P S, ZHANG P, et al.Effects of different preservatives combined with controlled freezing-point on the storage quality and physiological-biochemical index of Muscat Hamburg grape[J].Science and Technology of Food Industry, 2013, 34(5):333-337.
[15] BOCHAROVA O, BOCHAROVA M.The dual role of phenolic compounds in oxidative changes in fruit products[J].International Food Research Journal, 2017, 24(3):1 261-1 269.
[16] MINAS I S, VICENTE A R, DHANAPAL A P, et al.Ozone-induced kiwifruit ripening delay is mediated by ethylene biosynthesis inhibition and cell wall dismantling regulation[J].Plant Science, 2014, 229:76-85.
[17] MONDAL K, SHARMA N S, MALHOTRA S P, et al.Antioxidant systems in ripening tomato fruits[J].Biologia Plantarum, 2004, 48(1):49-53.
[18] LIN Y F, LIN H T, LIN Y X, et al.The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-induced pericarp browning of harvested longan fruit[J].Postharvest Biology and Technology, 2016, 111:53-61.
[19] 周琪, 陈晨, 周福慧, 等.短波紫外线控制鲜切苹果褐变与其活性氧代谢的相关性[J].食品科学, 2019, 40(5):102-109.
ZHOU Q, CHEN C, ZHOU F H, et al.Correlation between enzymatic browning inhibition by UV-C treatment and reactive oxygen species metabolism of fresh-cut apples[J].Food Science, 2019, 40(5):102-109.
[20] FAN M C, LI W X, HU X L, et al.Effect of micro-vacuum storage on active oxygen metabolism, internal browning and related enzyme activities in Laiyang pear (Pyrus bretschneideri Reld)[J].LWT-Food Science and Technology, 2016, 72:467-474.
[21] LIN Y F, LIN H T, ZHANG S, et al.The role of active oxygen metabolism in hydrogen peroxide-induced pericarp browning of harvested longan fruit[J].Postharvest Biology and Technology, 2014, 96:42-48.
[22] GAO K, ZHOU L Y, BI J F, et al.Research on the nonenzymatic browning reactions in model systems based on apple slices dried by instant controlled pressure drop drying[J].Drying Technology, 2017, 35(11):1 302-1 311.
[23] 张春岭, 刘慧, 刘杰超, 等.基于主成分分析与聚类分析的中、早熟桃品种制汁品质评价[J].食品科学, 2019, 40(17):141-149.
ZHANG C L, LIU H, LIU J C, et al.Evaluation of juice quality of mid-early ripening peach varieties based on principal component analysis and cluster analysis[J].Food Science, 2019, 40(17):141-149.
[24] 曹一菲, 严守雷, 李洁, 等.水煮藕带贮藏期非酶褐变的主要影响因素探究[J].食品科学, 2021, 42(3):251-257.
CAO Y F, YAN S L, LI J, et al.Major factors affecting non-enzymatic browning of boiled lotus sprout during storage[J].Food Science, 2021, 42(3):251-257.
[25] PARAVISINI L, PETERSON D G.Mechanisms non-enzymatic browning in orange juice during storage[J].Food Chemistry, 2019, 289:320-327.