陕西是我国优质苹果生产的大省[1],是全球连片种植苹果最大的区域[2],2020年全省苹果产量为1 185.21 万t,同比增长4.37%。目前,浓缩苹果汁加工企业是我省最具前景的龙头企业之一,但由于浓缩果汁加工的特殊性,我省每年产生约60万t苹果渣[3],如何低成本、绿色地处理大量苹果渣是苹果汁加工业高质量发展面临的严峻挑战。
不同产地苹果渣中不溶性膳食纤维含量为49.24%~61.03%[4],不溶性膳食纤维主要包括纤维素、半纤维素以及木质素等[5]。有研究发现,对纤维素进行化学改性可改善其物化性能[6]。CHEN等[7]构建了基于纤维素的可注射水凝胶,并嵌入pH响应性二嵌段共聚物胶束,最终获得可注射水凝胶复合系统,可用于局部药物缓释递送。SULTANA等[8]开发的改性纳米纤维素基热敏水凝胶具有细胞相容性、机械稳定性、可降解性、可注射性以及对丝裂霉素C的控制释放可防止术后黏连等优点。LIU等[9]制备了酰胺化纤维素基吸附剂,其对染料酸性黑1、酸性红18和铜离子的最大吸附容量分别为751.8、417.9、51.3 mg/g,表明该吸附剂可用于处理工业废水。李宏振等[10]制备了一种功能高分子吸附材料聚乙烯亚胺-微晶纤维素,其对胆红素显示出良好的吸附作用。
因此,本研究从果汁生产企业实际技术需求出发,以苹果渣纤维素为原料,对其进行胺化改性,以产品中氮元素增加量为评价指标,采用单因素和正交试验考察了影响苹果渣纤维素胺化改性效果的主要因素,并对改性前、后苹果渣纤维素进行表征。以期为胺化苹果渣纤维素的工业化制备提供一定的理论参考,并促进苹果产业提质增效。
1 材料与方法
1.1 材料与试剂
苹果渣,陕西海升果业发展股份有限公司(乾县分公司);氢氧化钠、乙二胺,天津市天力化学试剂公司;无水乙醇、碳酸氢钠、甲酸、溴化钾,天津市科密欧化学试剂有限公司;环氧氯丙烷,天津市致远化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
BSA224S-CW电子天平,德国Sartorius公司;LYZ-2102恒温摇床,上海龙跃仪器公司;Vario Macro Cube型元素分析仪,德国Elementar公司;TENSOR 27傅立叶红外光谱仪,德国Bruker公司;FEI Q45环境扫描电子显微镜,美国FEI公司;MiniFlex Ⅱ X-射线衍射仪,日本RIGAKU理学公司。
1.3 实验方法
1.3.1 苹果渣纤维素的提取
参照李列琴等[3]方法略作修改。具体步骤如下:称取适量苹果渣(过60目筛),按料液比1∶25(g∶mL)加入蒸馏水,于60 ℃浸提1.5 h,水洗至中性,留滤渣,按料液比1∶20(g∶mL)加入质量分数为4%的NaOH溶液,于45 ℃振荡1.5 h,水洗至中性,留滤渣,按料液比1∶20(g∶mL)加入体积分数为2%的HCl溶液,于60 ℃振荡1.5 h,水洗至中性,滤渣用无水乙醇、丙酮轮流洗涤数次。滤渣按料液比1∶25(g∶mL)加入质量分数为14%的NaOH溶液,于35 ℃振荡15 h,该步骤重复两次,于60 ℃干燥至恒重即得苹果渣纤维素,并利用甲酸对其进行脱色。
1.3.2 胺化苹果渣纤维素的制备
参照黄琴等[11]和马波等[12]方法略作修改。具体步骤如下:向1.0 g苹果渣纤维素中加入50 mL 0.1 mol/L NaOH溶液,再加入5 mL环氧氯丙烷,于50 ℃以160 r/min振荡6 h,滤渣用丙酮和去离子水反复洗至中性,于50 ℃下干燥至恒重即得环氧化苹果渣纤维素。
向1.0 g环氧化苹果渣纤维素中依次加入一定体积分数的乙二胺和一定量的NaHCO3,并于一定温度下以160 r/min振荡一段时间,滤渣用丙酮和去离子水反复洗至中性,于50 ℃下干燥至恒重即得产品,并利用元素分析仪测定改性前、后产品中氮元素含量。
1.3.3 苹果渣纤维素胺化改性的单因素试验
向1.0 g环氧化苹果渣纤维素中加入200 mL乙二胺溶液进行胺化反应。分别考察了乙二胺体积分数(5%、15%、25%、35%、45%)、反应温度(35、45、55、65、75、85 ℃)、反应时间(2.5、3.5、4.5、5.5、6.5、7.5 h)、NaHCO3添加量(1.0、2.0、3.0、4.0、5.0 g)等对产品中氮元素增加量的影响。
1.3.4 苹果渣纤维素胺化改性的正交试验
在单因素试验最佳条件的基础上,以产品中氮元素增加量(%)为指标,设计4因素3水平,进行正交试验,其因素及水平设计见表1。
表1 苹果渣纤维素胺化改性正交试验因素水平
Table 1 Orthogonal test factors and levels for preparation of aminated cellulose of apple pomace

水平因素A(乙二胺体积分数)/%B(反应温度)/℃C(反应时间)/hD(NaHCO3添加量)/g115655.52.0225756.53.0335857.54.0
1.3.5 傅里叶红外光谱(Fourier transfrm infrared spectroscopy,FTIR)分析
分别称取4.0 mg改性前、后苹果渣纤维素(苹果渣纤维素按1.3.1方法制备、环氧化苹果渣纤维素按1.3.2方法制备、胺化苹果渣纤维素按1.3.4正交试验获得的最佳条件制备),加入400.0 mg KBr粉末混匀后压片处理,检测波数为4 000~400 cm-1,并绘制红外光谱图。
1.3.6 X-射线衍射(X-ray diffraction,XRD)分析
分别称取适量改性前、后苹果渣纤维素(与1.3.5相同),设置X-射线衍射仪扫描角度为5°~60°,铜靶,电压40 kV,电流40 mA,并绘制X-射线衍射图。
1.3.7 扫描电镜(scanning electron microscope,SEM)分析
分别称取适量改性前、后苹果渣纤维素(与1.3.5相同),固定于载物台上,喷金后置于仪器内,并观察其表面形态。
1.4 数据分析
每组数据重复测定3次取平均值,并通过SPSS 22.0统计软件进行分析;使用Origin 9.0软件作图。
2 结果与分析
2.1 苹果渣纤维素胺化改性单因素试验结果分析
2.1.1 乙二胺体积分数对产品中氮元素增加量的影响
固定反应温度55 ℃,反应时间4.5 h,NaHCO3添加量2.0 g,确定较佳的乙二胺体积分数,结果见图1。经测定,苹果渣纤维素中氮元素含量约0.20%,因此,本研究采用产品中氮元素增加量为指标。由图1可知,在5%~25%的乙二胺体积分数范围内,氮元素增加量随着乙二胺体积分数的增加而显著增加(P<0.05),在25%时达到最大值1.26%。当乙二胺体积分数>25%时,氮元素增加量趋于平缓(P>0.05),这可能是由于产品中氮元素增加量受环氧化苹果渣纤维素中环氧基数量决定[11]。因此,确定后续反应中乙二胺体积分数为25%。
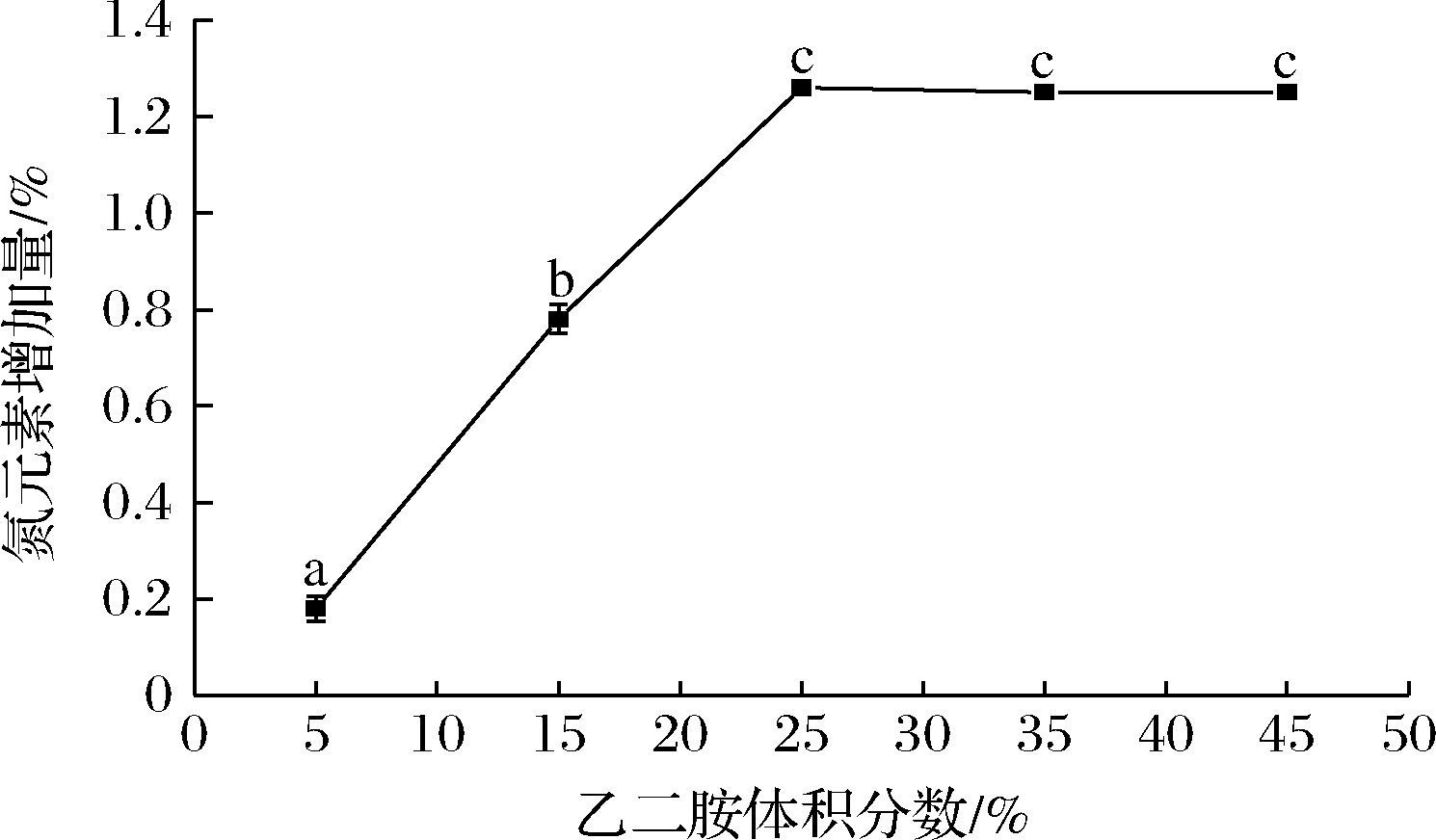
图1 乙二胺体积分数对产品中氮元素增加量的影响
Fig.1 Effect of ethylenediamine volume fraction on the increase of nitrogen in products
注:图中不同字母表示存在显著性差异(P<0.05)(下同)
2.1.2 反应温度对产品中氮元素增加量的影响
固定乙二胺体积分数25%,反应时间4.5 h,NaHCO3添加量2.0 g,确定较佳的反应温度,结果见图2。由图2可知,在35~75 ℃的反应温度内,氮元素增加量随着反应温度的升高而显著增加(P<0.05),在75 ℃时达到最大值1.18%。当反应温度>75 ℃时,氮元素增加量显著下降(P<0.05),这可能是由于环氧化苹果渣纤维素在高温条件下易降解。因此,确定后续反应温度为75 ℃。
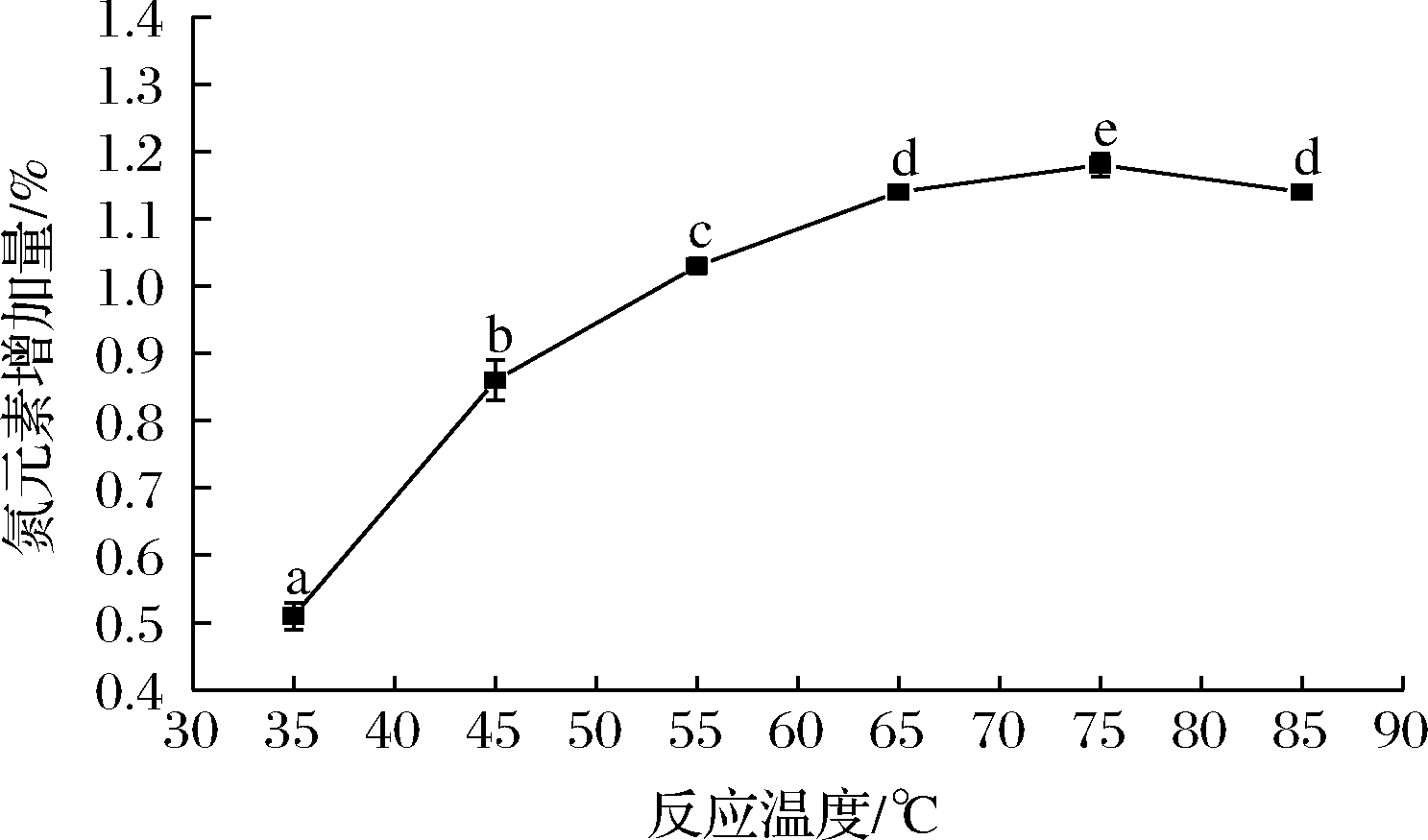
图2 反应温度对产品中氮元素增加量的影响
Fig.2 Effect of reaction temperature on the increase of nitrogen in products
2.1.3 反应时间对产品中氮元素增加量的影响
固定乙二胺体积分数25%,反应温度75 ℃,NaHCO3添加量2.0 g,确定较佳的反应时间,结果见图3。由图3可知,在2.5~6.5 h的反应时间内,氮元素增加量随着反应时间的延长而显著增加(P<0.05),在6.5 h时达到最大值1.30%。当反应时间>6.5 h时,氮元素增加量趋于平缓(P>0.05),这可能是反应6.5 h时,环氧化苹果渣纤维素中可以参与反应的环氧基被完全取代。因此,确定后续反应时间为6.5 h。
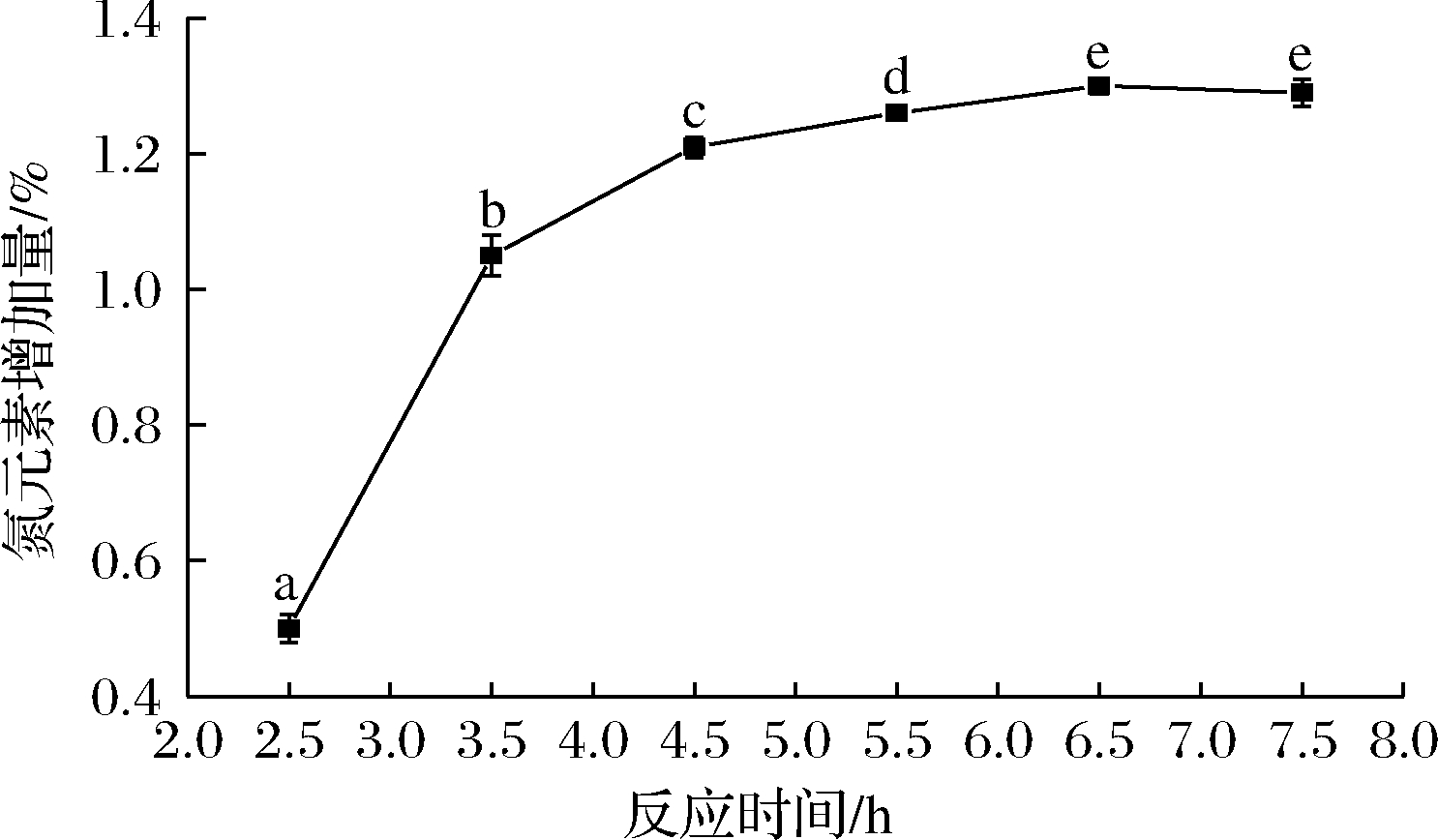
图3 反应时间对产品中氮元素增加量的影响
Fig.3 Effect of reaction time on the increase of nitrogen in products
2.1.4 NaHCO3添加量对产品中氮元素增加量的影响
固定乙二胺体积分数25%,反应温度75 ℃,反应时间6.5 h,确定较佳的NaHCO3添加量,结果见图4。由图4可知,在1.0~3.0 g的NaHCO3添加量内,氮元素增加量随着NaHCO3添加量的增加而显著增加(P<0.05),这可能是由于弱碱环境更有利于胺化改性反应的进行。但当NaHCO3添加量为3.0 g时达到最大值1.25%,继续添加NaHCO3,氮元素增加量无显著变化(P>0.05),这可能是因为苹果渣纤维素上的环氧基反应至饱和状态[11]。因此,确定NaHCO3添加量为3.0 g。
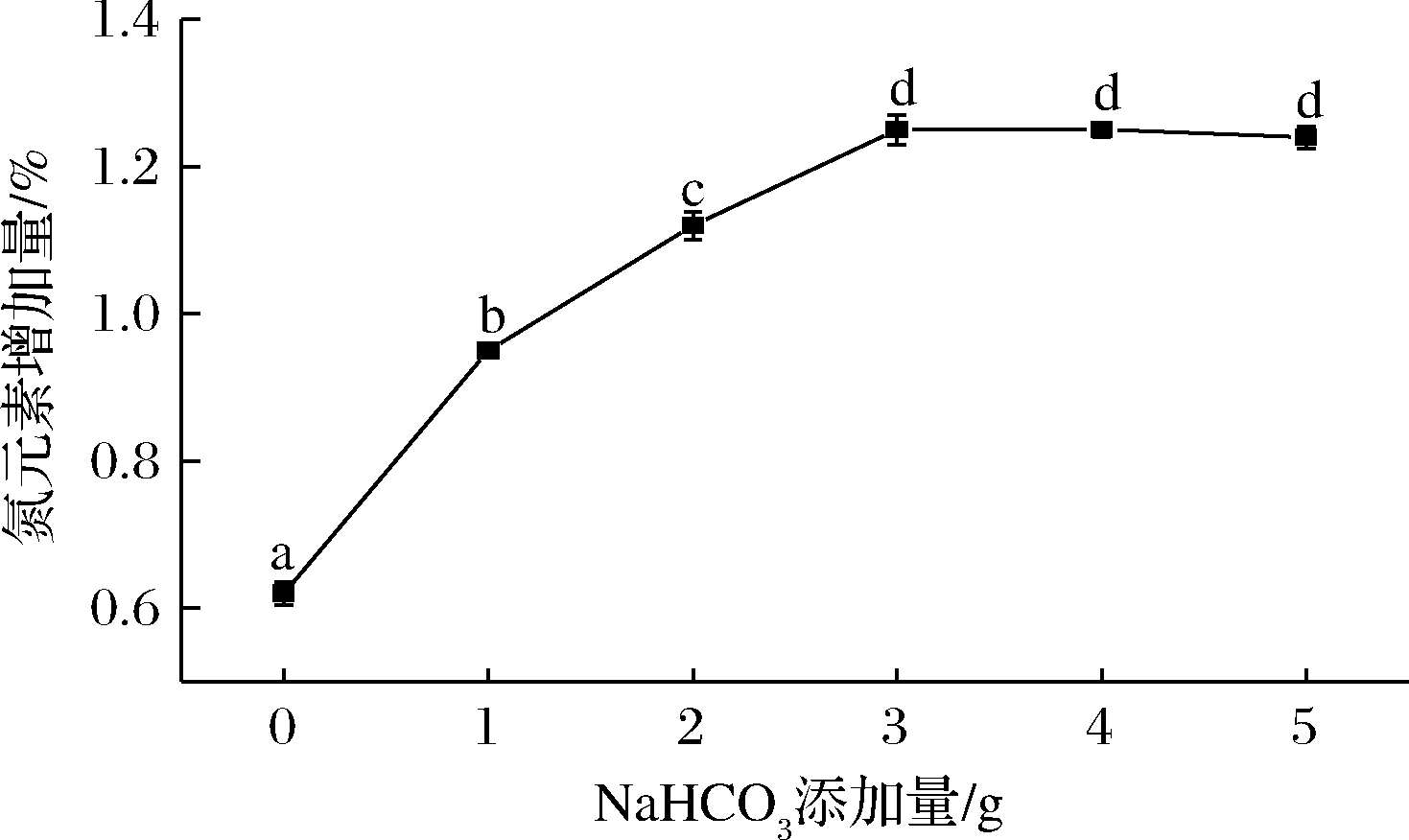
图4 NaHCO3添加量对产品中氮元素增加量的影响
Fig.4 Effect of NaHCO3 added amount on the increase of nitrogen in products
2.2 苹果渣纤维素胺化改性正交试验结果分析
由表2可知,影响苹果渣纤维素胺化改性效果的因素依次为:A(乙二胺体积分数)>C(反应时间)>B(反应温度)>D(NaHCO3添加量)。且因素A对苹果渣纤维素胺化改性效果影响显著,因素B、C和D对苹果渣纤维素胺化改性效果影响不显著,胺化苹果渣纤维素最佳制备工艺:乙二胺体积分数25%,反应温度75 ℃,反应时间7.5 h,NaHCO3添加量3.0 g。在此条件下进行重复验证试验,结果表明,氮元素增加量为1.34%,高于优化之前。
表2 苹果渣胺化改性正交试验结果
Table 2 Orthogonal experiment results of apple pomace amination modification
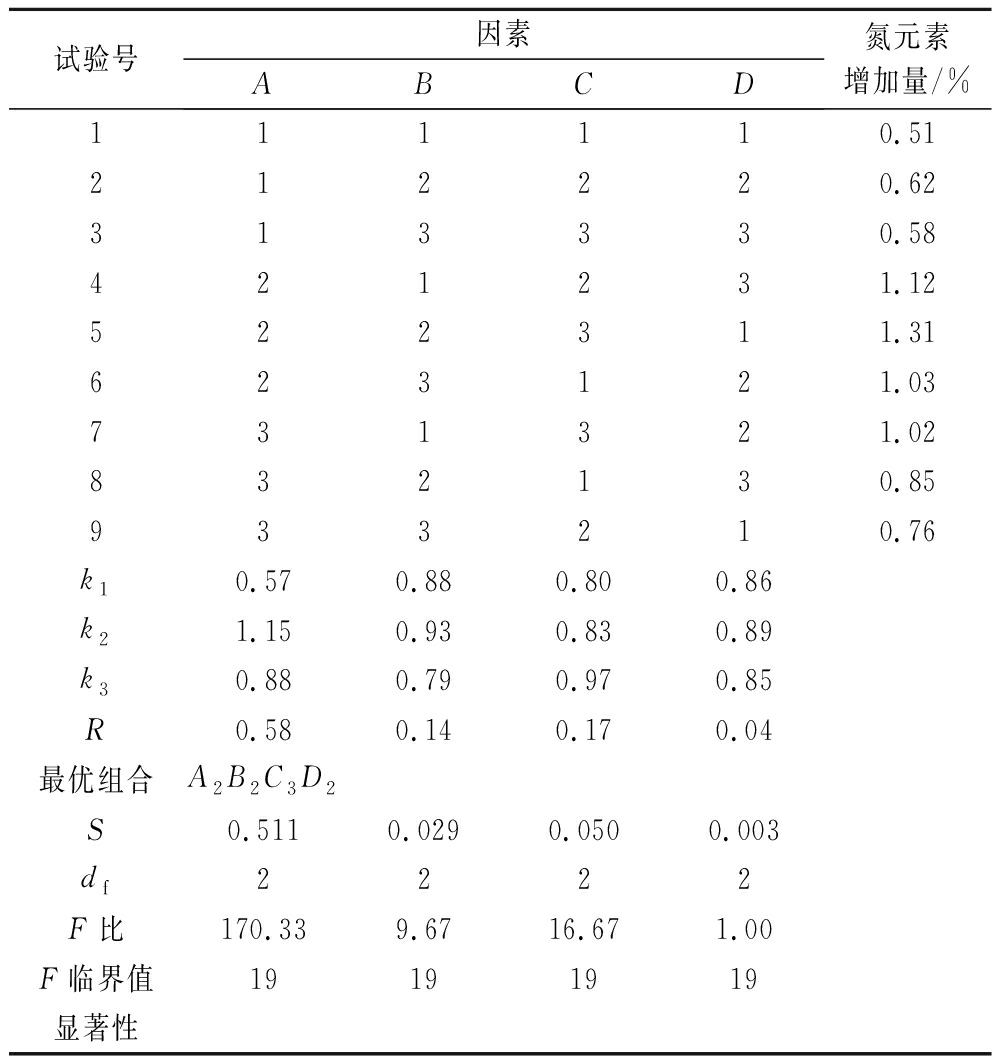
试验号因素ABCD氮元素增加量/%111110.51212220.62313330.58421231.12522311.31623121.03731321.02832130.85933210.76k10.570.880.800.86k21.150.930.830.89k30.880.790.970.85R0.580.140.170.04最优组合A2B2C3D2S0.5110.0290.0500.003df2222F比170.339.6716.671.00F临界值19191919显著性
2.3 改性前、后苹果渣纤维素FTIR分析
图5为改性前、后苹果渣纤维素的红外光谱图。由图5可知,改性前、后苹果渣纤维素在3 400、890、670 cm-1附近均存在吸收峰[13-15],它们分别归属于O—H伸缩振动吸收峰、β构型糖苷键的特征峰及O—H面外弯曲振动峰。经改性后,图5-a中的O—H伸缩振动峰从3 400 cm-1附近蓝移至3 500 cm-1附近,且峰形变窄,这表明O—H连接减弱[16]。图5-c中3 200 cm-1和830 cm-1附近新出现了2个特征峰,它们分别归属于N—H伸缩振动峰和N—H弯曲振动峰[17]。这表明苹果渣纤维素成功被胺基化修饰。
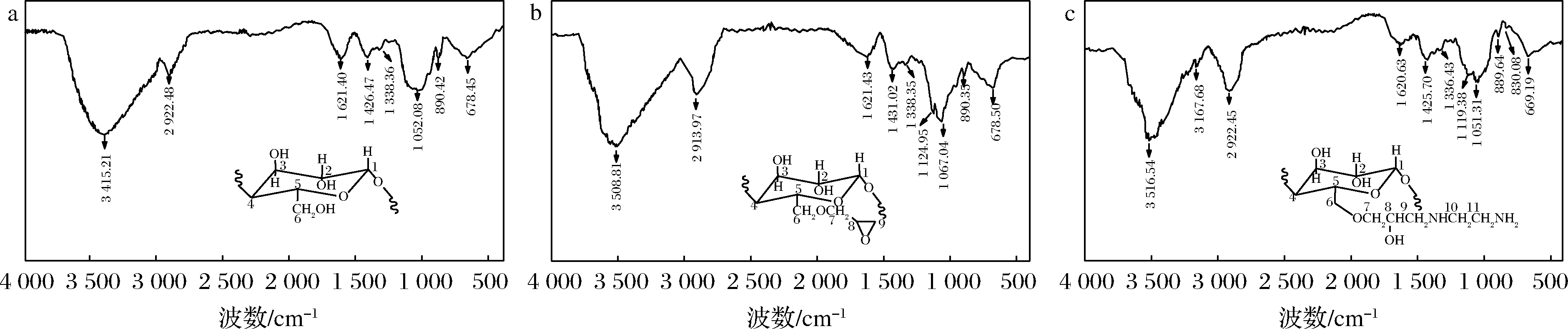
a-苹果渣纤维素;b-环氧化苹果渣纤维素;c-胺化苹果渣纤维素
图5 改性前、后苹果渣纤维素红外谱图
Fig.5 FTIR spectra of apple pomace cellulose before and after modification
2.4 改性前、后苹果渣纤维素XRD分析
图6为改性前、后苹果渣纤维素的X-射线衍射图。由图6可知,苹果渣纤维素在12.63°出现衍射弱峰,在21.46°出现衍射强峰,这表明苹果渣纤维素晶型为典型的纤维素Ⅱ型[18],这可能是本研究采用NaOH溶液提取苹果渣纤维素,使其从天然纤维素I型转变为典型的纤维素Ⅱ型[19]。经环氧氯丙烷和乙二胺处理后,苹果渣纤维素在29°附近新出现了1个峰,12°和20°附近的衍射峰强度均减弱,其中12°附近的衍射峰几乎消失,这可能是由于苹果渣纤维素在改性过程中无定形区域被破坏,导致其结晶度降低。这说明改性后苹果渣纤维素的晶型不再是典型的纤维素Ⅱ型,且结晶度降低。
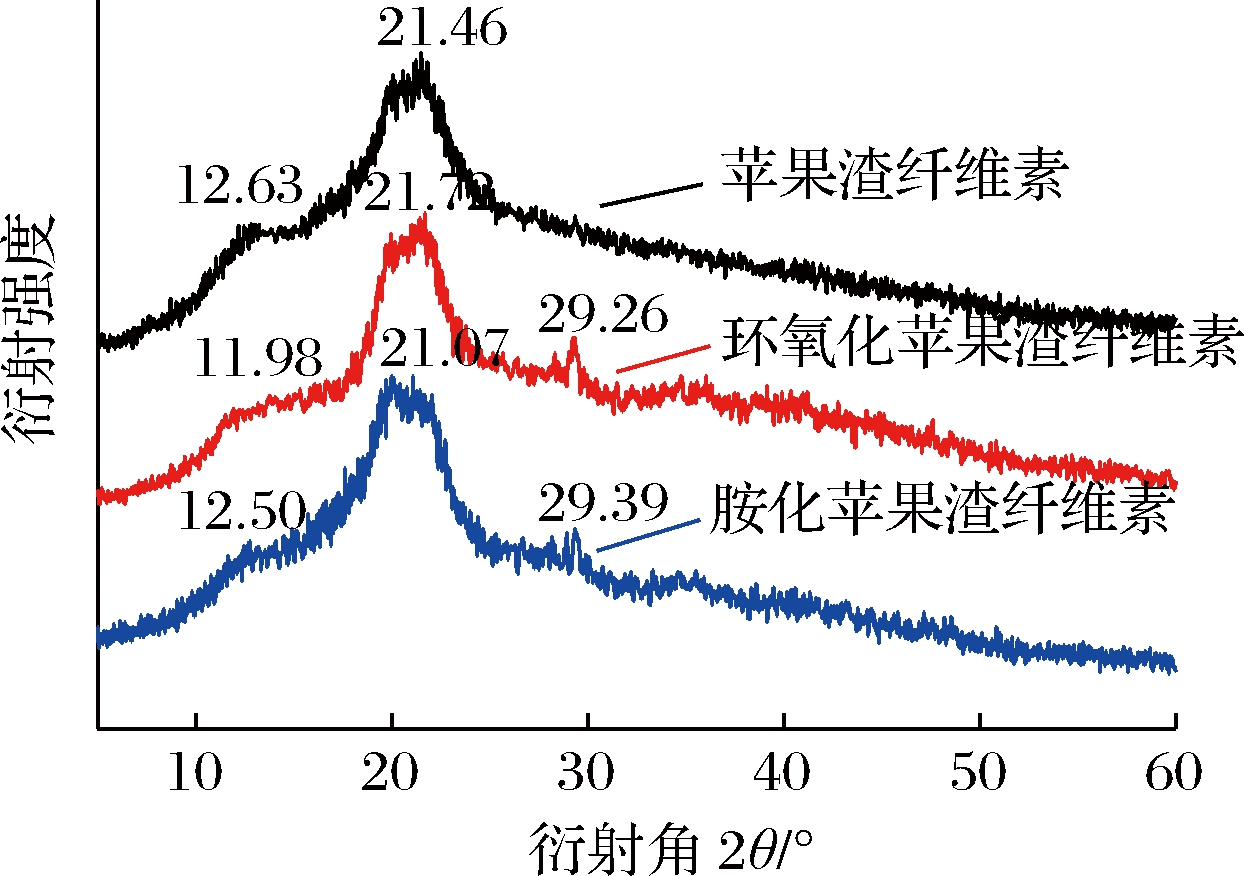
图6 改性前、后苹果渣纤维素XRD谱图
Fig.6 XRD spectra of apple pomace cellulose before and after modification
2.5 改性前、后苹果渣纤维素SEM分析
图7为改性前、后苹果渣纤维素放大2 000倍的扫描电镜图。由图7可知,改性前、后苹果渣纤维素表观均呈长条状。苹果渣纤维素(图7-a)的表面光滑,且结构致密。经环氧化和胺化处理后,如图7-b和图7-c所示,环氧化苹果渣纤维素表面粗糙,胺化苹果渣纤维素表面有明显褶皱、结构疏松多孔,这可能是由于苹果渣纤维素在改性过程中主链被破坏,无定形区域被降解。

a-苹果渣纤维素;b-环氧化苹果渣纤维素;c-胺化苹果渣纤维素
图7 改性前、后苹果渣纤维素扫描电镜图(2 000×)
Fig.7 SEM pictures of apple pomace cellulose before and after modification(2 000×)
3 结论
采用单因素、正交试验优化苹果渣纤维素的胺化改性工艺,优化结果为:乙二胺体积分数25%,反应温度75 ℃,反应时间7.5 h,NaHCO3添加量3.0 g,此时产品中氮元素增加量为1.34%。且改性前、后苹果渣纤维素表征结果显示:胺化改性后出现了—NH2特征吸收峰,且其结晶度降低,产品表面粗糙,结构疏松多孔。黄琴等[11]制备的胺化甜菜粕纤维素可极大降低糖液浊度和色度,其中氮元素增加量为1.23%。柴博华[20]制备了改性甘蔗渣吸附剂,其中氮元素含量可达0.92%,对糖液中色素有良好的吸附能力。本研究制备的胺化苹果渣纤维素与其他类似研究相比,产品中氮元素增加量更高,这对其今后工业化生产十分有利,研究结果为苹果渣纤维素的高值化利用奠定理论基础。
[1] 汪烨. 陕西打造千亿苹果产业[J].农经, 2019(12):56-59.
WANG Y.Shaanxi builds 100 billion apple industry[J].Agriculture Economics, 2019(12):56-59.
[2] 卢新智. 陕西苹果, 大产业大经营[J].西北园艺(果树), 2019(1):46-48.
LU X Z.Shaanxi apple, big industry and big management[J].Northwest Horticulture, 2019(1):46-48.
[3] 李列琴, 陈雪峰, 刘宁, 等.苹果渣氧化纤维素的制备及表征[J].食品与发酵工业, 2018, 44(2):129-134.
LI L Q, CHEN X F, LIU N, et al.Preparation and characterization of apple pomace oxidized cellulose[J].Food and Fermentation Industries, 2018, 44(2):129-134.
[4] 耿乙文, 靳婧, 李庆鹏, 等.不同产地苹果渣营养成分差异性分析研究与评价[J].核农学报, 2016, 30(2):288-294.
GENG Y W, JIN J, LI Q P, et al.Evaluation of analyzing apple pomace nutrient substances from difference locations[J].Journal of Nuclear Agricultural Sciences, 2016, 30(2):288-294.
[5] 王浩, 崔敬悦, 李红丽, 等.膳食纤维的来源及应用进展研究[J].农业科技与装备, 2021(6):92-93.
WANG H, CUI J Y, LI H L, et al.Study on the source and application of dietary fiber[J].Agricultural Science&Technology and Equipment, 2021(6):92-93.
[6] 张勇, 鄢勇气.苎麻纤维化学改性研究进展[J].化学研究, 2021, 32(3):277-282.
ZHANG Y, YAN Y Q.Research progress on chemical modification of ramie fiber[J].Chemical Research, 2021, 32(3):277-282.
[7] CHEN N S, WANG H, LING C, et al.Cellulose-based injectable hydrogel composite for pH-responsive and controllable drug delivery[J].Carbohydrate Polymers, 2019, 225:115207.
[8] SULTANA T, HAI H V, PARK M, et al.Controlled release of Mitomycin C from modified cellulose based thermo-gel prevents post-operative de novo peritoneal adhesion[J].Carbohydrate Polymers, 2020, 229:115552.
[9] LIU J, CHEN T W, YANG Y L, et al.Removal of heavy metal ions and anionic dyes from aqueous solutions using amide-functionalized cellulose-based adsorbents[J].Carbohydrate Polymers, 2020, 230:115619.
[10] 李宏振, 方桂珍, 李俊业, 等.聚乙烯亚胺-纤维素的合成及对胆红素吸附性能[J].林产化学与工业, 2009, 29(5):99-103.
LI H Z, FANG G Z, LI J Y, et al.Synthesis of polyethyleneimine-microcrytalline cellulose and its adsorption character for bilirubin[J].Chemistry and Industry of Forest Products, 2009, 29(5):99-103.
[11] 黄琴, 陈博儒, 高梓原, 等.改性甜菜纤维的制备及其在糖液脱色中的应用[J].中国食品学报, 2019, 19(2):116-124.
HUANG Q, CHEN B R, GAO Z Y, et al.Preparation of modified sugar beet pulp fiber and application in sugar decolorization[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(2):116-124.
[12] 马波, 孙东平, 朱春林, 等.乙二胺螯合细菌纤维素的制备及其吸附Cu2+研究[J].工业水处理, 2009, 29(7):60-62;79.
MA B, SUN D P, ZHU C L, et al.Preparation of ethylenediamine chelating bacterial cellulose for the adsorption of copper ions[J].Industrial Water Treatment, 2009, 29(7):60-62;79.
[13] 温俊峰, 王超, 李瑞, 等.沙柳纤维素提取工艺研究与结构表征[J].榆林学院学报, 2019, 29(2):17-21.
WEN J F, WANG C, LI R, et al.Extraction technique and structure representation of cellulose from Salix psammophila[J].Journal of Yulin University, 2019, 29(2):17-21.
[14] 赵永会, 顾丹丹, 冯俊霞, 等.二维红外光谱法分析纤维素[J].理化检验-化学分册, 2015, 51(11):1 497-1 500.
ZHAO Y H, GU D D, FENG J X, et al.Two-dimensional IR spectral analysis of cellulose[J].Physical Testing and Chemical Analysis (Part B:Chemical Analysis), 2015, 51(11):1 497-1 500.
[15] 戴宏杰. 菠萝皮渣纤维素基水凝胶的制备、表征及其性能研究[D].广州:华南理工大学, 2018.
DAI H J.A study on preparation, characterization and properties of pineapple peel cellulose-based hydrogels[D].Guangzhou:South China University of Technology, 2018.
[16] 郭静, 谢飘, 管福成, 等.预处理溶剂对纤维素预处理效果的影响[J].林产化学与工业, 2014, 34(2):85-90.
GUO J, XIE P, GUAN F C, et al.Influences on the effect of pretreating cellulose by pretreatment solvents[J].Chemistry and Industry of Forest Products, 2014, 34(2):85-90.
[17] 朱恒. 胺烷基纤维素的制备及其对TNT吸附性能的研究[D].绵阳:西南科技大学, 2011.
ZHU H.Preparation of aminoalky cellulose and its 2,4,6-trinitrotoluene adsorption capacity[D].Mianyang:Southwest University of Science and Technology, 2011.
[18] 马继玮, 姜泽明, 高鑫, 等.离子液体中再生纤维素纤维的制备及表征[J].高分子材料科学与工程, 2019, 35(10):176-182;190.
MA J W, JIANG Z M, GAO X, et al.Preparation and characterization of regenerated cellulose fibers in ionic liquid[J].Polymer Materials Science &Engineering, 2019, 35(10):176-182;190.
[19] 张云飞, 李坚斌, 莫志鹏, 等.NaOH溶液处理甘蔗渣过程中纤维素晶体结构的变化[J].中国调味品, 2019, 44(7):53-58.
ZHANG Y F, LI J B, MO Z P, et al.Changes of cellulose crystal structure in the process of treating bagasse with NaOH solution[J].China Condiment, 2019, 44(7):53-58.
[20] 柴博华. 改性甘蔗渣吸附剂的制备及其对糖液脱色作用的研究[D].广州:华南理工大学, 2013.
CHAI B H.Preparation of modified sugarcane bagasse and its application in sugar decolorization[D].Guangzhou:South China University of Technology, 2013.