冷鲜肉是指冷却肉、排酸肉或冰鲜肉,指在兽医检疫要求下,对宰杀胴体快速冷却处理得到的,1 d之内使其温度降至0~4 ℃,并在之后的加工、运输和销售期间始终保持在该温度范围内,冷鲜肉具有安全卫生、滋味香鲜、口感嫩、营养价值高等优点,越来越受到人们的欢迎[1]。然而,冷鲜肉在生产、运输、销售和贮藏过程中都极有可能受到微生物污染,从而使其货架期变短,所以如何延长冷鲜肉的货架期,保持冷鲜肉的品质,仍是重要的研究内容。
生姜为多年生草本植物姜(Zingiber officinale Rosc)的根茎,是一种重要的“药食同源”植物资源,既可作蔬菜和调味料使用,又是传统中药材。生姜因其丰富的生物活性成分而具有多重功能活性,在抗氧化、抗肿瘤、抑菌、抗炎、镇痛和保护心血管方面都有发挥良好的作用,可作天然抗氧化剂。姜辣素(主要成分姜酚、姜黄酮)、姜精油、姜油树脂和生姜多糖是生姜的主要活性成分[2],STOILOVA等[3]研究了生姜提取物(ginger extracts,GE)的抗氧化活性,GE对DPPH自由基的清除率达到了90.1%,比2,6-二叔丁基-4-甲基苯酚更强,在37 ℃时对·OH的清除率为79.6%。此外,该研究还表明每克生姜的乙醇提取物中含有870.1 mg/g的酚类化合物,这可能是其具有比槲皮黄酮更强的抗氧化活性的一个重要原因。
由于GE良好的抗氧化作用,国内外研究学者已经开始将生姜提取物用于食品的防腐保鲜,主要应用于食用油类和容易腐败的肉制品上[4]。GE还常与其他防腐保鲜剂复合成涂膜联合发挥防腐保鲜作用。壳聚糖(chitosan,CS)为天然多糖甲壳素脱除部分乙酰基的产物,具有抑菌、抗癌等生理功能[5]。CS具有良好的成膜性、广谱抗菌性、生物相容性和降解性,通过CS涂膜解决食品易腐败的问题已成为当前食品保鲜研究的热点。例如GE与CS复合,抑制鲜切莲藕贮存期的关键褐变酶类和氧化产物的累积[6-7]。YUAN等[8]利用1% CS和1.5%石榴皮提取物复合,可显著延长虾肉货架期。近年来,已有诸多采用天然植物提取物进行肉类保鲜的研究。SHAN等[9]研究了肉桂、葡萄籽和丁香提取物对冷鲜肉的保鲜效果,结果表明这几种保鲜液可有效抑制冷鲜肉中的油脂氧化和微生物的生长,从而延长冷鲜肉的货架期。DEVATKAL等[10]采用人参果和香蕉的果皮提取物处理猪肉,发现这2种提取物均可以保护猪肉的色泽,减少硫代巴比妥酸反应产物的产生,抑制猪肉中的油脂氧化。本研究将GE用于猪肉的冷藏保鲜,并以CS为阳性对照,通过测定冷鲜猪肉的理化指标和微生物指标:汁液损失率、pH值、色差值、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)、菌落总数、大肠菌群数、乳酸菌数、假单胞菌数,评价其保鲜效果,以期延长冷鲜猪肉的货架期并扩大GE在食品保鲜领域的应用前景。
1 材料与方法
1.1 材料与试剂
本实验所用小黄姜,贵州省镇宁县;新鲜猪肉,当地农贸市场。芦丁、福林酚、食品级壳聚糖(脱乙酰度>95%),上海国药集团化学试剂有限公司;没食子酸、DPPH、ABTS,美国Sigma试剂公司;假单胞菌CFC选择性培养基及添加剂,青岛高科技工业园海博生物技术有限公司;平板计数琼脂(plate count agar,PCA)、结晶紫中性红胆盐琼脂(violet red bile agar,VRBA)、煌绿乳糖胆盐肉汤(bright green lactose bile salt broth,BGLB),上海博微生物科技有限公司;其余分析试剂,上海国药集团化学试剂有限公司。
1.2 仪器与设备
UV-2550紫外分光光度计,日本岛津;RE-2000B旋转蒸发仪,上海亚荣生化仪器厂;LDZM-60L立式高压蒸汽灭菌器,上海申安医疗器械厂;YS3060色差仪,深圳三恩时科技有限公司;PHS-3C pH计,上海仪电科学仪器股份有限公司;DH600H电热恒温培养箱,天津市泰斯特仪器有限公司;SW-CJ-1FD超净工作台,苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 生姜处理及GE制备
小黄姜用水洗净,擦干,切片(厚度0.3 cm),放入60 ℃烘箱烘干至恒重,用打粉机打粉,20目过筛,粉末备用。
参照唐仕荣等[11]的方法略作修改,准确称取50 g姜粉于圆底烧瓶,加入500 mL 75%(体积分数)乙醇,使用带有有磁力搅拌的电加热套加热保持微沸,回流提取2.5 h后,减压抽滤得滤液,滤渣按相同方法再回流提取2次,3次滤液合并,用旋转蒸发仪浓缩至无乙醇味,得到浸膏状提取物。加蒸馏水定容至400 mL,得到GE试液,质量浓度为125 mg姜粉/mL,保存在4 ℃冰箱待用。
1.3.2 GE抗氧化活性检测
分别取1 mL质量浓度为1.25、2.50、3.75、5.00、6.25、7.50 mg/mL的GE溶液与4 mL 0.1 mmol/L的DPPH乙醇溶液混匀后,于室温下避光反应30 min,利用紫外分光光度计测定样品在517 nm处的吸光值。配制7 mmol/L的ABTS乙醇溶液,用乙醇稀释[在734 nm处吸光值为(0.700 ± 0.02)为宜]后备用。分别取2 mL质量浓度为0.012 5、0.037 5、0.062 5、0.087 5、0.112 5、0.137 5 mg/mL的GE溶液与2 mL稀释后的 ABTS乙醇溶液混合均匀,在734 nm处测定吸光值。DPPH自由基和ABTS阳离子自由基清除率按公式(1)计算:
自由基清除率![]()
(1)
式中:Ai为加入GE后自由基溶液的吸光值;A0为未加GE时自由基溶液的吸光值;Aj为GE溶液的吸光值。
1.3.3 GE总酚和总黄酮含量测定
(1)总酚含量测定:参照谭晓舒等[12]的方法并做适当改动。用福林酚法测定GE中的总酚含量。准确称取没食子酸标准品0.020 g于烧杯中,加适量蒸馏水溶解后,用蒸馏水定容到100 mL容量中,得到质量浓度为0.20 mg/mL的没食子酸标准溶液。精确移取没食子酸标准溶液0、0.1、0.2、0.3、0.4、0.5、0.6 mL于干净的具塞试管中,再加入0.25 mL福林酚显色剂,避光、静置3 min,然后加入1 mol/L碳酸钠溶液1 mL,加水定容至10 mL,摇匀,放入预热好的40 ℃水浴锅中反应40 min,在685 nm下测定吸光值。
精确移取蒸馏水稀释后的GE溶液(7.5 mg姜粉/mL)0.5 mL于具塞试管中,按照标准曲线的测定方法测定其吸光值,空白组加入0.5 mL蒸馏水。
(2)总黄酮含量的测定:参照李静舒等[13]的方法并作适当改动。用亚硝酸盐-硝酸铝-氢氧化钠比色方法测定。准确称取芦丁标准品0.02 g放入烧杯中,加适量蒸馏水溶解后,用蒸馏水定容到100 mL容量瓶中,得到质量浓度为0.20 mg/mL的芦丁标准溶液,精确移取芦丁标准溶液0、2、4、6、8、10、12 mL于具塞试管中,加入5%(质量分数)亚硝酸钠溶液1 mL,摇匀后静置6 min,然后加10%(质量分数)硝酸铝溶液1 mL,摇匀后同样静置6 min再加4%(质量分数)氢氧化钠溶液10 mL,加蒸馏水定容至25 mL,摇匀,做好标记,静置15 min后在510 nm处测得吸光度值。
精确移取5 mL蒸馏水稀释后的GE溶液(7.5 mg姜粉/mL)于具塞试管中,按照标准曲线的测定方法测定其吸光度值,空白组加入5 mL蒸馏水。
1.3.4 GE对冷鲜猪肉的保鲜实验
1.3.4.1 涂膜肉样准备
新鲜猪肉去掉可见筋膜和脂肪后,分成50 g/块,放入灭菌后的培养皿中。每组3块猪肉样品,空白组肉样加入无菌水,实验组分别加入GE(125 mg/mL)和2%(质量分数) CS溶液,浸渍30 s后取出置于超净工作台上沥干,分组放入无菌保鲜袋中密封封口,然后放入4 ℃冰箱冷藏,分别在第0、1、3、5、7、9天取样,测定各组样品的理化指标和微生物指标。实验中所用器材均在前一天于121 ℃高压灭菌锅内灭菌20 min,烘箱烘干备用,整个实验操作过程均在紫外辐照后的无菌超净工作台上操作。
1.3.4.2 汁液损失率测定
在第0天时称取空白组、GE组、CS组的肉样初始质量,记为m0;第1、3、5、7、9天从无菌保鲜袋中称取肉样,称量各组肉样的质量记为m,汁液损失率的计算如公式(2)所示:
汁液损失率![]()
(1)
式中:m0为各组肉样初始质量;m为贮存后各组肉样的重量。
1.3.4.3 pH值
准确称取10 g肉样,剪碎放于锥形瓶中,加入90 mL双重蒸馏水,不停振荡混匀0.5 h后过滤,用pH计测定滤液的pH值。
1.3.4.4 色差
用色差仪测定空白组、GE组、CS组贮藏期间的L*值(明度)、a*值(红度)、b*值(黄度),每个样品随机测定7次,取其平均值。色差ΔE的计算如公式(3)所示:
(2)
式中:Lt*,at*,bt*为样品贮藏第t天时的色泽;L0*,a0*,b0*为样品的初始色泽。
1.3.4.5 TVB-N含量测定
TVB-N含量测定参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》的方法执行。
1.3.4.6 微生物指标测定
肉样处理:在超净工作台上,称取10 g肉样用灭菌剪刀剪碎后放入装有90 mL灭菌生理盐水(0.85%)的锥形瓶中。密封后放置于摇床振摇30 min,得到均匀的稀释液,按照预实验结果进行10倍递增稀释。
平板接种涂布:首先把灭菌后冷却到45 ℃的PCA培养基、VRBA培养基、MRS培养基和假单胞菌CFC选择性培养基分别依次倒入编号的培养皿中,每个培养皿中约15 mL。待培养基凝固,移取0.1 mL 肉样稀释液于培养皿,用灭菌涂布棒涂布均匀,翻转所有涂布均匀的平板。每个稀释度的样品重复3次。
培养及计数:根据国标GB 4789.2—2022《食品安全国家标准 食品微生物菌落总数测定》中的指定做法计算菌落总数,PCA培养基置于(37±1) ℃条件下培养(48±2) h后观察计数;根据GB 4789.3—2016指定方法进大肠菌群计数,VRBA培养基在(37±1) ℃条件下培养18~24 h后观察并计数,典型大肠菌群菌落为紫红色,菌落附近有红色沉淀环,其直径约为0.5 mm或更大,然后随机选取10个种类不同的典型以及可疑的菌落,转移至BGLB肉汤管中开始验证试验;根据GB 4789.35—2016的指定方法进行乳酸菌的计数,MRS培养基置于(37±1) ℃条件下厌氧培养(72±2) h后观察计数;根据SN/T 4033—2014指定做法进行假单胞菌计数,CFC选择性培养基置于(25±1) ℃,培养(44±4) h后再观察计数,然后随机选取5个不同类型的菌落进行氧化酶确证实验。
1.4 数据统计与分析
为保证实验数据的准确性,所有实验均重复3次,实验结果用SPSS 18.0方差分析法(ANOVA)进行差异显著性分析(P<0.05),所有实验结果以平均值±标准偏差表示。
2 结果与分析
2.1 GE的抗氧化活性
生姜中含有丰富的黄酮(如姜黄酮)和酚(如姜烯酚)类化合物,具有良好的杀菌消毒和抗氧化作用[14]。GE中总酚总黄酮含量如图1所示。生姜提取液质量浓度为7.5 mg/mL,其总酚含量以没食子酸当量表示,为1.35 mg/mL;总黄酮含量以芦丁当量表示,为1.98 mg/mL。由图2可知,GE具有DPPH自由基和ABTS阳离子自由基清除能力,且呈显著的量效关系。随着GE浓度的增加,DPPH自由基清除率显著升高(P<0.05),当GE质量浓度为7.5 mg/mL时,对自由基的清除率达89.05%(图2-a)。由图2-b可知,GE对ABTS阳离子自由基的清除能力更强,GE质量浓度为0.137 5 mg/mL时,ABTS阳离子自由基清除率高达99.51%。孙昕[15]的研究结果表明生姜提取物对ABTS阳离子自由基的清除力能强于DPPH自由基,这与本研究结果一致。
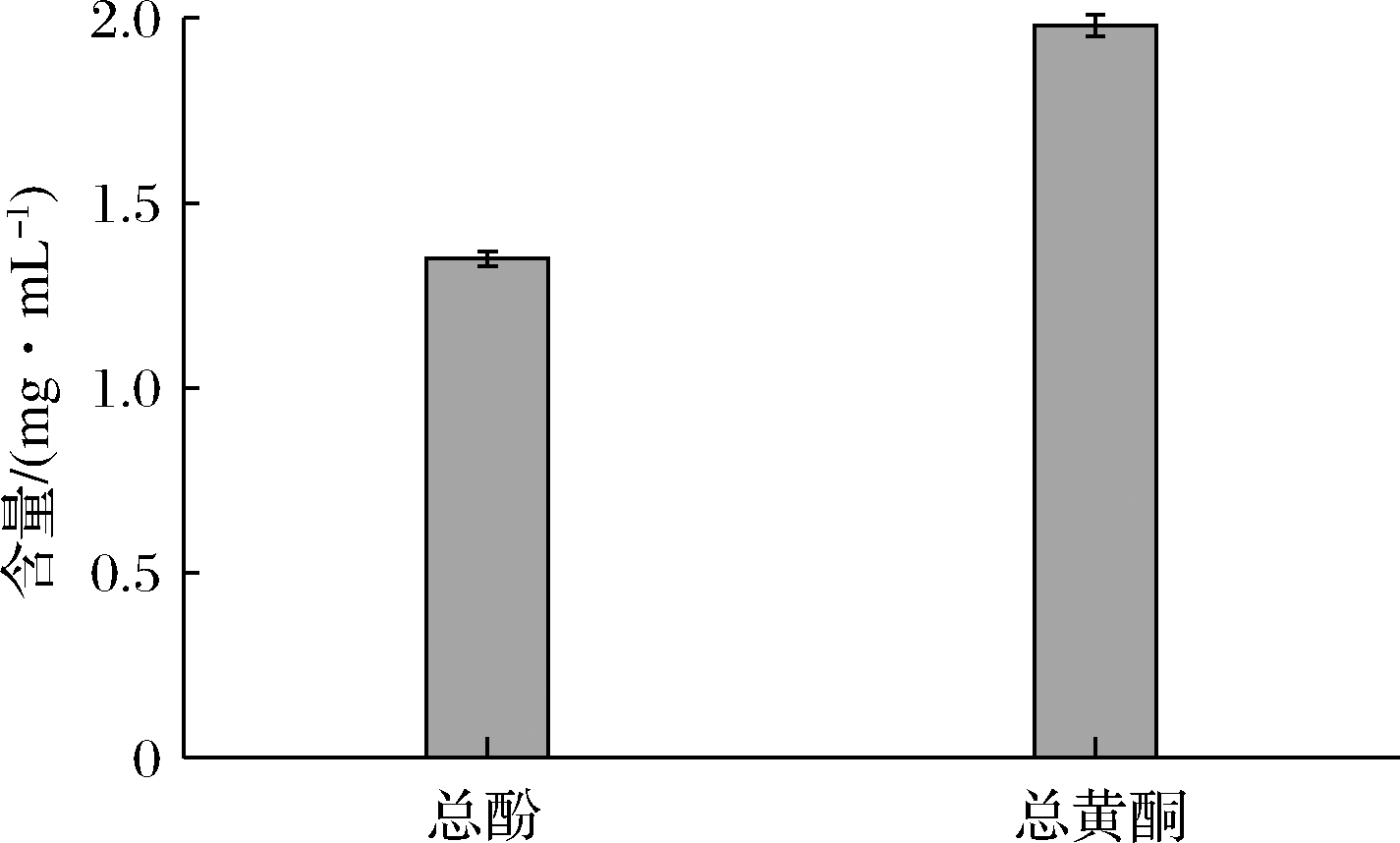
图1 GE总酚和总黄酮含量
Fig.1 The contents of total phenols and total flavonids in GE

a-DPPH自由基;b-ABTS阳离子自由基
图2 GE的自由基清除能力
Fig.2 The free radical scavenging ability of GE
注:图中不同字母表示存在显著性差异(P<0.05)(下同)
2.2 不同保鲜剂处理对冷鲜肉贮藏期间理化性质的影响
2.2.1 冷鲜肉汁液损失率的变化
经不同保鲜剂处理的冷鲜肉的汁液损失率如图3所示。肉制品在贮藏过程中会挥发、渗出部分汁液, 汁液损失过多将导致肉质口感僵硬,从而影响感官品质。不同保鲜剂处理组的汁液损失率均呈显著上升趋势,主要是因为冷藏过程中蛋白质胶体发生不可逆转变、微生物生长繁殖破坏肉组织引起的[16]。贮藏9 d后,空白组汁液损失率达到7.28%,GE组和CS组汁液损失率分别为4.96%和6.02%,显著低于空白组(P<0.05)。CS优良的成膜性和抗菌性有利于阻止冷鲜肉中的汁液流失,GE含有黄酮、酚类、活性多糖和糖蛋白等化合物,具有抑菌作用,可减少微生物代谢活动,从而降低汁液损失率[17]。据前人研究报道,多糖与肉蛋白相互作用可增强肉制品的持水力,从而减少汁液损失[18]。CS和GE均可有效降低冷鲜肉的汁液损失,且GE维持冷鲜肉汁液的效果更好。采用1.5% CS与蒜姜提取液复合处理冷鲜肉时,其汁液损失率在第10天时为6.89%,而空白组汁液损失率达10.9%,均显著高于本实验研究结果[19]。一方面可能是因为肉样的处理和贮藏方式不同,另一方面可能是CS的浓度不同导致的结果差异。
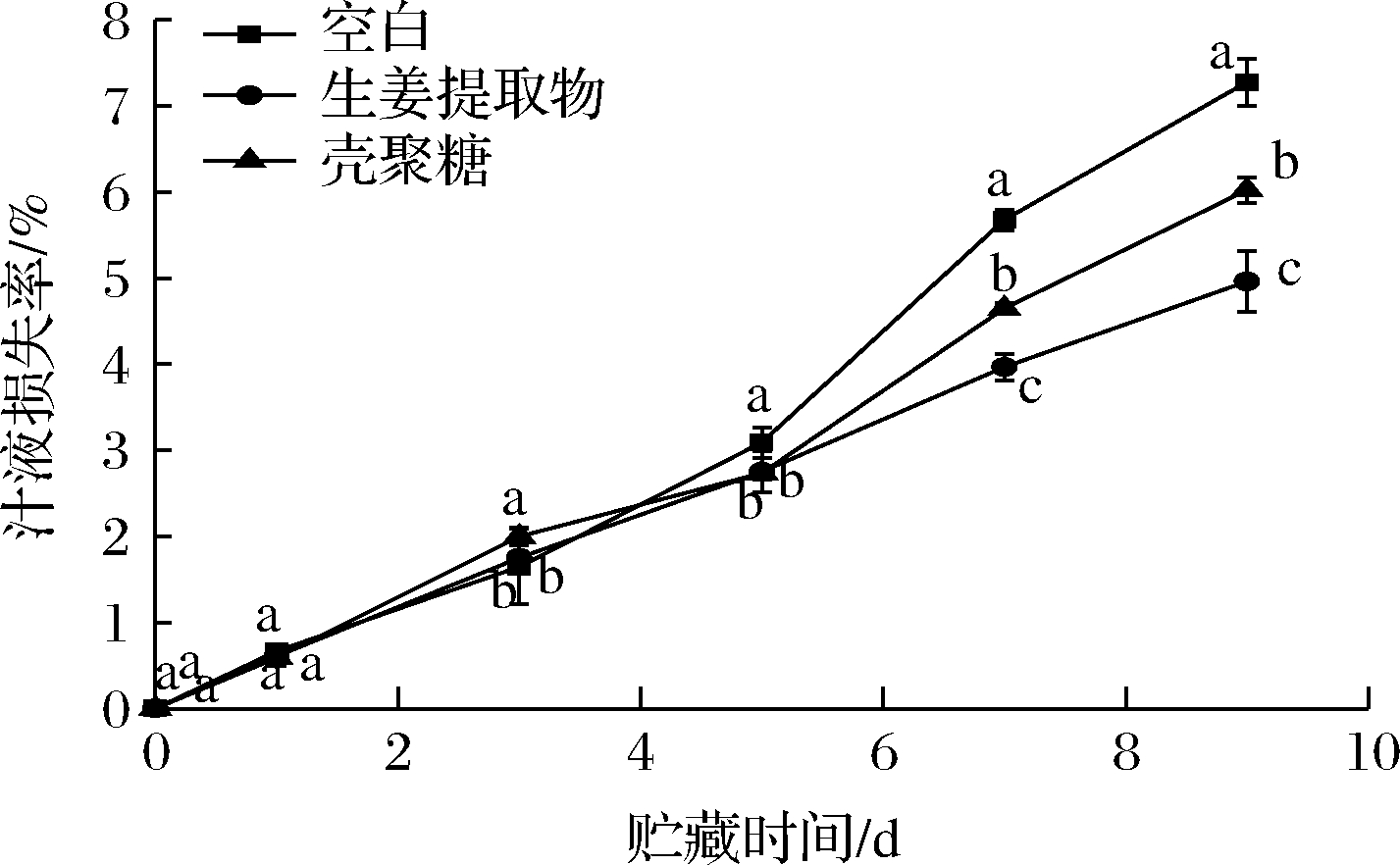
图3 不同保鲜剂处理的冷鲜肉在贮藏期间汁液损失率的变化
Fig.3 Changes in juice loss of cooled pork treated with different preservatives during storage
2.2.2 冷鲜肉的pH值变化
在肉制品贮藏期间,pH值是反映冷鲜肉品质的重要指标,当冷鲜肉腐败变质时,其蛋白质等营养物质会被酶和微生物分解产生胺类等碱性物质,从而导致pH值增长。根据国家标准,pH>6.4的肉品为变质肉[20]。如图4所示,新鲜处理的冷鲜肉均呈弱酸性,在4 ℃冰箱贮藏期间,空白组pH值显著(P<0.05)高于GE和CS组的pH值,空白组pH值在贮藏第5天时pH为6.40,即肉样已变质。贮藏9 d后,空白组、GE和CS组的pH值分别为6.91、6.25、6.09,即GE和CS在一定程度上减缓了冷鲜肉的腐败。王正荣等[21]利用CS保鲜冷却猪肉,贮藏9 d时pH值为6,与本实验结果相似;CS和GE复合膜处理冷却肉,效果优于单独的CS。CS良好的成膜性使其在肉样表面形成一层膜从而抑制了好氧菌与肉品的接触,减缓蛋白质的分解速度[22]。GE中的黄酮和酚类物质具有抗菌作用,从而抑制腐败微生物的代谢。
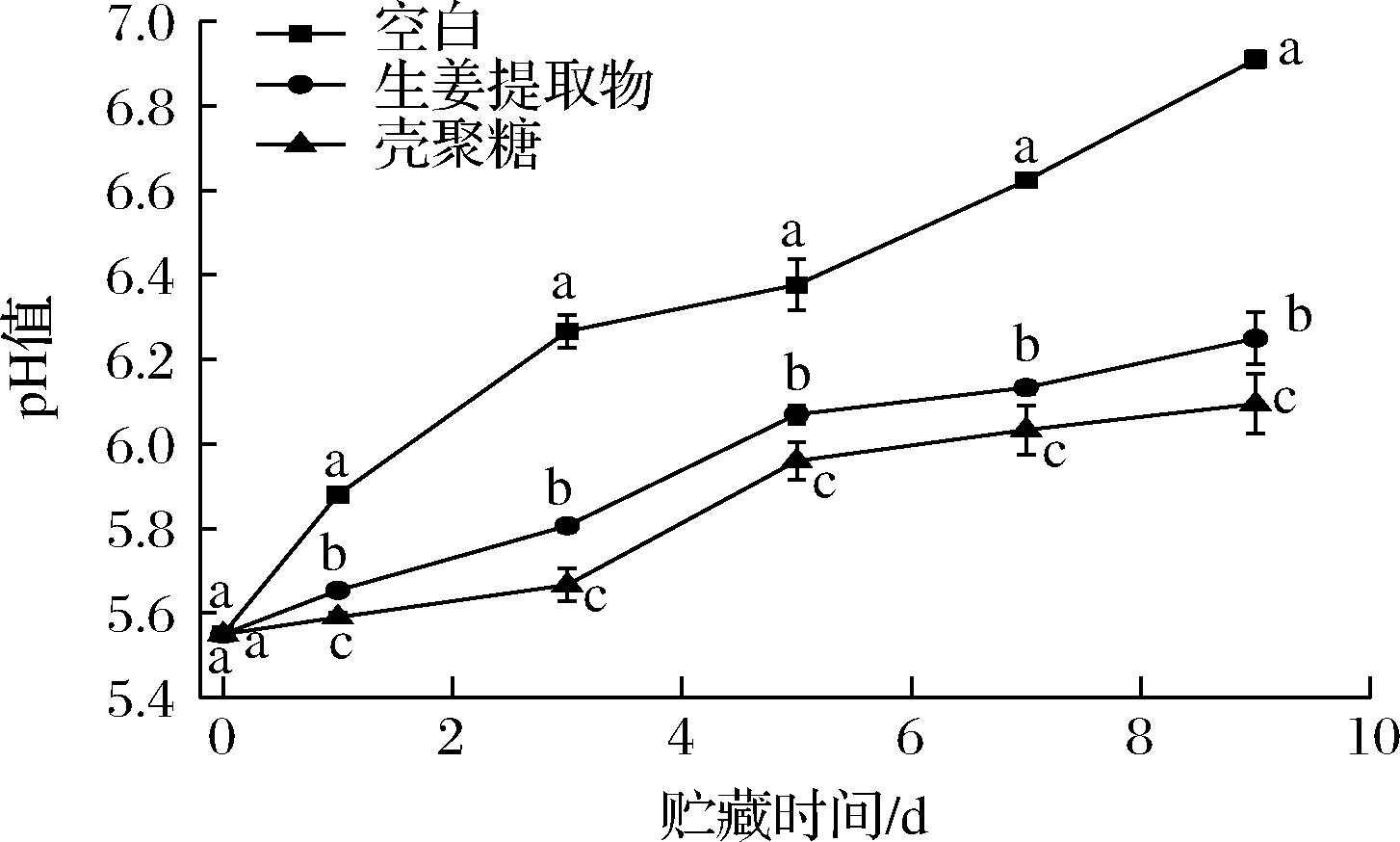
图4 不同保鲜处理的冷鲜肉在贮藏期间的pH值变化
Fig.4 Changes in pH value of cooled pork treated with different preservatives during storage
2.2.3 冷鲜肉的TVB-N含量变化
冷鲜肉在贮藏过程中,蛋白质由于酶和细菌的作用会产生氨和胺类等碱性含氮挥发物,即TVB-N,当TVB-N含量超过20 mg/100g时为变质肉[23]。如图5所示,不同保鲜处理组的冷鲜肉的TVB-N含量均呈快速上升趋势,空白组在第7天时TVB-N含量已达到20.16 mg/100g,即空白组的肉样已开始变质,而GE和CS组TVB-N含量分别为17.44 mg/100g和14.19 mg/100g。随着贮藏时间的延长,微生物大量繁殖,蛋白质分解速度加快,TVB-N含量持续升高。贮藏9 d后,空白组TVB-N含量高达22.03 mg/100g,GE和CS 组TVB-N含量分别为19.07 mg/100g和16.89 mg/100g,表明GE和CS均能有效减缓冷鲜肉的腐败速度。GE因其抑菌性在一定程度上减缓了蛋白质的分解,但其中所含的其他营养成分(如多糖)有利于微生物生长,因此抑制TVB-N含量增长的效果不如CS。这些结果与pH值变化结论一致。严碧云等[19]研究表明,1.5% CS与姜蒜提取液复合处理冷鲜肉可有效减缓TVB-N的生成,贮藏15 d后,肉样中TVB-N含量为19 mg/100g。由此可见,CS与其他天然保鲜剂的复合保鲜效果优于单独的CS。
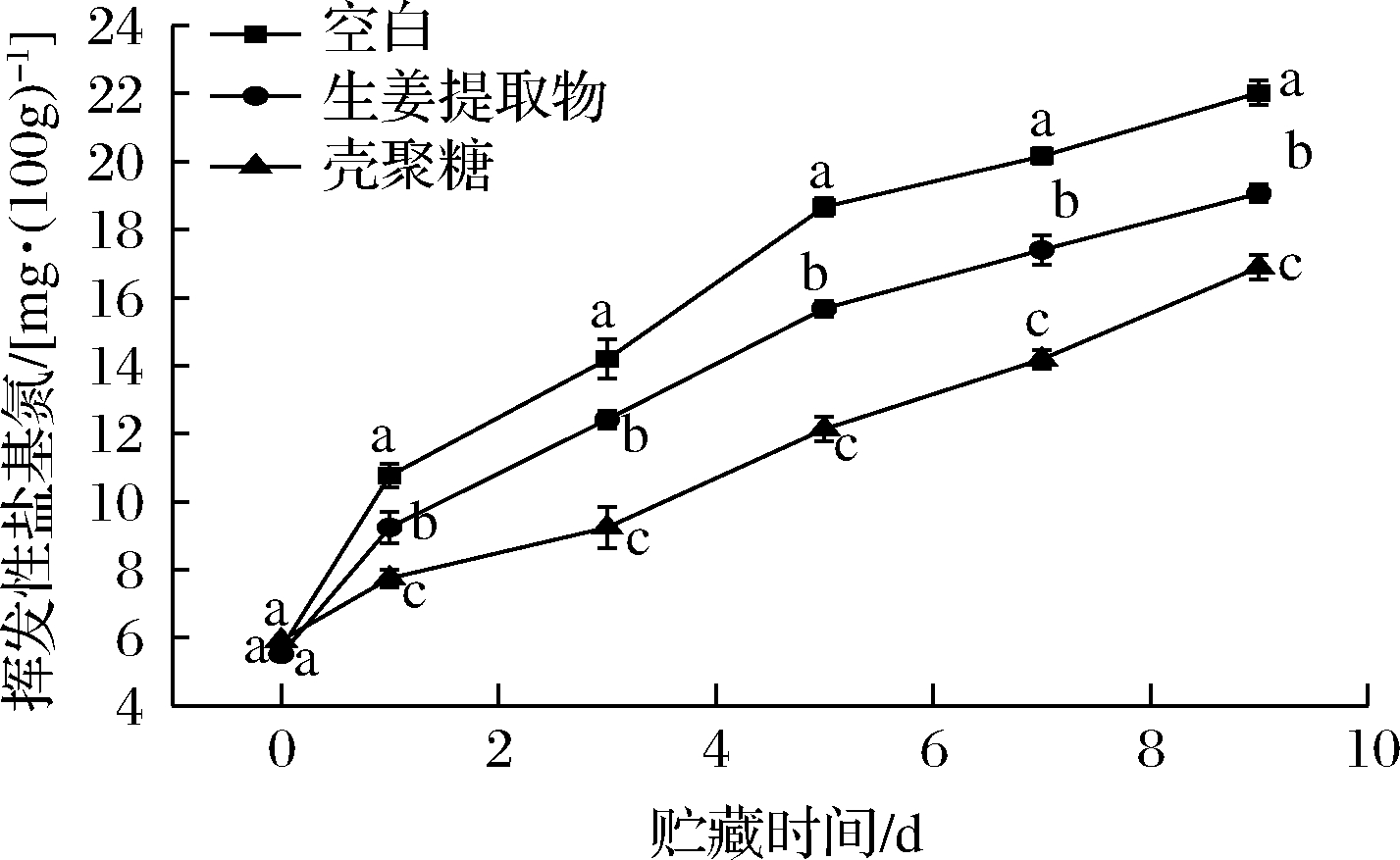
图5 不同保鲜处理的冷鲜肉在贮藏期间的TVB-N含量变化
Fig.5 Changes in TVB-N content of cooled pork treated with different preservatives during storage
2.2.4 冷鲜肉的色泽变化
色泽是衡量肉品新鲜程度和卫生状况的重要指标,这也是消费者常用于判断肉品质量的一个重要参数[24]。不同保鲜处理的冷鲜肉在贮藏期间的色差值(ΔE)变化如表1所示,ΔE越大表明冷鲜肉的色泽与原始色泽相差越大。随着贮藏时间的延长,各组ΔE显著增大,这可能是因为肉样发生腐败变质导致的。空白组ΔE显著(P<0.05)高于GE组和CS组的ΔE,表明GE和CS均具有良好的护色作用,且GE的护色作用更佳,这可能与GE中的色素有关。肉类的氧化会导致其色度发生变化,CS良好的成膜性可减少肉品与氧气的接触,从而抑制肉类氧化并维持其颜色。GE含有黄酮、酚类等活性物质,这些物质的抗菌和抗氧化活性延缓了肉品的颜色变化。
表1 不同保鲜剂处理的冷鲜肉在贮藏期间的ΔE变化
Table 1 Changes in color difference of cooled pork treated with different preservatives during storage
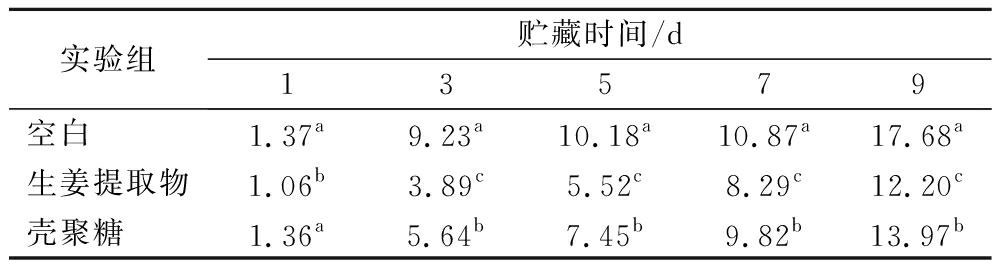
实验组贮藏时间/d13579空白 1.37a 9.23a 10.18a 10.87a 17.68a 生姜提取物1.06b 3.89c 5.52c 8.29c 12.20c 壳聚糖 1.36a 5.64b7.45b 9.82b 13.97b
注:同列不同字母标注表示差异显著(P<0.05)
2.3 不同保鲜剂处理的冷鲜肉贮藏期间的微生物指标
肉类腐败变质主要是因为微生物的生长繁殖,微生物利用肉品中的营养物质快速繁殖,从而加速肉类腐败。大肠杆菌、假单胞菌和乳酸菌是冷鲜肉中的优势菌种,这些微生物在冷鲜肉上的生长繁殖是致使其腐败变质的主要因素[25]。如图6-a所示,菌落总数随着贮藏时间延长而呈不同程度的增加趋势。当菌落总数超过6 lgCFU/g时表明肉已经变质。肉样中的初始菌落总数为3.76 lgCFU/g,与前人研究结果相似。空白组在贮藏第7天时菌落总数为6.39 lgCFU/g,说明空白组的冷鲜肉可能在第6天时已经变质,这与前人研究结果一致[21]。第1天,CS组菌落总数明显下降,这是因为CS既具有良好的成膜性,阻止氧气与肉面接触,又具有抑菌作用且初始抑菌效果显著。CS带正电荷的质子化氨基与细菌细胞膜相互作用,导致蛋白及其他胞内成分外泄,干扰细菌正常代谢,从而造成菌落总数下降[26]。在贮藏9 d后,GE(6.07 lgCFU/g)和CS(5.63 lgCFU/g)组的菌落总数均显著低于空白组菌落总数(7.81 lgCFU/g,表明生GE和CS能有效抑制冷鲜肉中的微生物生长,且CS效果更显著。吴涛[27]采用GE处理白鲢鱼肉,4 ℃贮藏9 d后其菌落总数从1.24 lgCFU/g增长至3.14 lgCFU/g,显著低于本实验研究结果,这可能与肉样中的初始菌落数和GE的浓度有关。王正荣等[21]采用单独的CS处理的肉样,贮藏9 d后其菌落总数约为6 lgCFU/g,与本实验结果相似。1.5% CS与蒜姜提取液复合保鲜处理的冷却猪肉贮藏10 d后菌落数仅为5.3 lgCFU/g,属于2级鲜肉,在15 d后其菌落总数超过6 lgCFU/g,为不可食肉[19]。这些结果表明GE的添加使CS对肉类的保鲜鲜果得到进一步提升。
通常大肠菌群对人体无害,但其中存在一些致病性大肠杆菌,可引起人和动物感染。此外,部分肠杆菌群具有较强的致腐能力[28]。由图6-b可知,CS能显著抑制冷鲜肉中大肠菌群数的增长,贮藏9 d后大肠菌群数仅为2.66 lgCFU/g。在0~3 d,GE组大肠菌群数与空白组差异不显著(P>0.05)。在贮藏9 d后,GE组(4.44 lgCFU/g)大肠菌群数显著(P<0.05)低于空白组(4.97 lgCFU/g)。假单胞菌在低温条件下生长快,是冷鲜肉中的优势菌,能产生氨等难闻物质并使肉品表面形成粘液,肉色改变。不同保鲜剂处理的冷鲜肉中的假单胞菌群数随着贮藏时间的延长而不同程度的增加(图6-c)。GE和CS均能显著抑制假单胞菌菌落数的增长,贮藏9 d后,分别增长了1.99 lgCFU/g和1.38 lgCFU/g。乳酸菌是引起肉类腐败的主要菌群,由图6-d可知,贮藏9 d后,空白组、GE和CS组的乳酸菌群增长数分别为4.37 lgCFU/g、3.47 lgCFU/g、1.60 lgCFU/g。GE和CS均能显著抑制乳酸菌菌落数的增长,从而减缓肉品腐败变味。综合来看,CS组的大肠菌群、假单胞菌和乳酸菌菌落数在第1天均显著降低,随着贮藏时间的延长而平稳上升,与菌落总数结果相似。一方面是因为CS溶液具有黏性,肉样在浸渍过程中部分表面细菌被粘掉;另一方面是因为CS良好的成膜性和抑菌作用干扰细菌的生长繁殖。CS的抑菌效果优于GE,这可能是因为GE中除了黄酮、多酚等抑菌物质外,还含有多糖等有利于微生物生长的活性成分。王正荣等[21]的研究表明CS与GE的复合抑菌效果优于单独的CS,且抑菌效果与GE的浓度呈正相关。
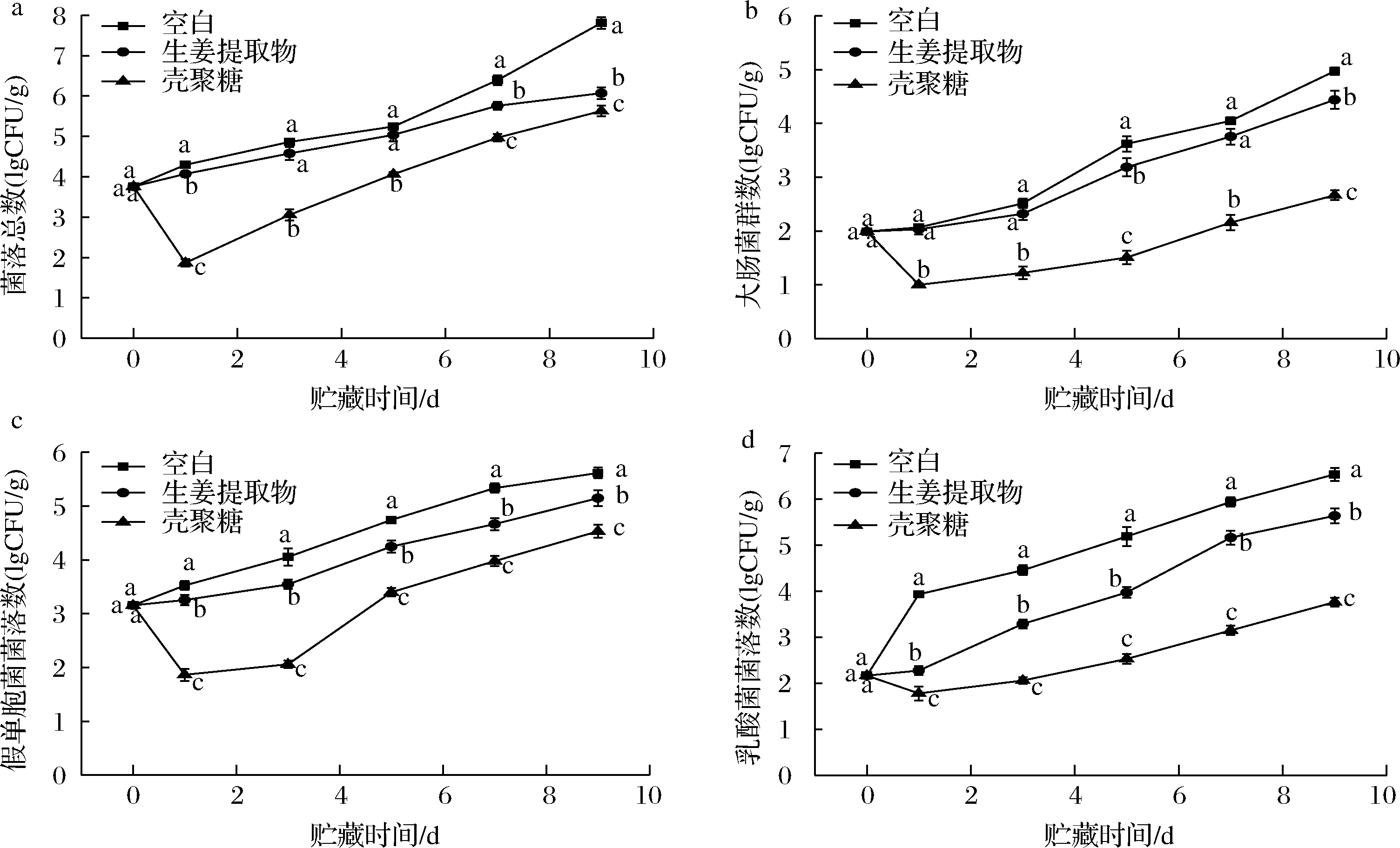
a-菌落总数;b-大肠菌群数;c-假单胞菌菌落数;d-乳酸菌菌落数
图6 不同保鲜处理的冷鲜肉在贮藏期间的微生物指标变化
Fig.6 Changes in microbial indicators of cooled pork treated with different preservatives during storage
3 结论
GE含有黄酮和酚类物质,在低浓度下有较强的自由基清除能力和抑菌作用,对冷鲜猪肉有良好的保鲜效果。空白组冷鲜猪肉在贮藏第7天时,汁液损失达5.68%、pH值为6.62,TVB-N含量20.16 mg/100g,菌落总数为6.39 lgCFU/g,即肉样已经严重变质。GE和CS均能有效延缓冷鲜肉腐败变质,在贮藏9 d后仍可食用。与CS相比,GE能更有效地控制冷鲜肉中的汁液流失,维持其色泽。然而,CS的抑菌效果更好,在延缓冷鲜肉pH值升高,减少TVB-N产生,抑制大肠菌群、乳酸菌、假单胞菌的生长繁殖方面效果更加显著。综上,GE作为天然的抗氧化和抑菌剂,能有效延长冷鲜肉的货架期,在肉类的冷藏保鲜中具有广泛的应用前景。此外,GE和CS的复合保鲜效果及作用机制有待进一步探索。
[1] 王永红,张淑蓉.冷鲜肉的保鲜技术研究进展[J].粮油食品科技, 2012, 20(1):48-51.
WANG Y H, ZHANG S R.Research progress on keeping chilled meat fresh[J].Science and Technology of Cereals,Oils and Foods, 2012, 20(1):48-51.
[2] 朱茂田. 生姜功能因子的分离和纯化[D].成都:西华大学, 2006.
ZHU M T.Separation and purification of functional factors from ginger[D].Chengdu:Xihua University, 2006.
[3] STOILOVA I, KRASTANOV A, STOYANOVA A, et al.Antioxidant activity of a ginger extract (Zingiber officinale)[J].Food Chemistry, 2007, 102(3):764-770.
[4] 吴涛.生姜提取液对白鲢鱼肉的保鲜作用研究[J].长江大学学报(自然科学版)农学卷, 2010, 37(1):79-82.
WANG T.Research of extract of ginger (Zingiber officinale roscoe) in the preservation of silver carp (Hypophthalmichthys molitrix)[J]. Journal of Yangtze University (Natural Science Edition) Agricultural Science Volume, 2010, 7(1):79-82; 8
[5] 于军香, 郑亚琴, 房克艳.壳聚糖涂膜结合冰温贮藏对蓝莓活性成分及抗氧化活性的影响[J].食品科学, 2015, 36(14):271-275.
YU J X, ZHENG Y Q, FANG K Y.Effect of chitosan coating combined with freezing-point storage on active compounds and antioxidant capacity of blueberry fruits[J].Food Science, 2015, 36(14):271-275.
[6] 李湘利, 刘静, 魏子浩, 等.姜蒜浸提液与壳聚糖复合保鲜切分莲藕护色效果的研究[J].食品科技, 2010, 35(1):253-256;259.
LI X L, LIU J, WEI Z H, et al.Study on the color preservation effects of complex antistaling agent of chitosan and extraction from ginger and garlic on fresh-cut lotus roots[J].Food Science and Technology, 2010, 35(1):253-256;259.
[7] 郁志芳, 李宁, 赵友兴,等.鲜切莲藕贮藏中的酚类物质变化及控制褐变的抑制剂组合筛选[J].南京农业大学学报, 2003, 26(l):78-81.
YU Z F, LI N, ZHAO Y X,et al.Change of phenol substances and browning inhibition by inhibitor combination in fresh-cut lotus roots[J].Journal of Nanjing Agricultural University, 2003, 26(l):78-81.
[8] YUAN G F,LYU H, TANG W Y, et al.Effect of chitosan coating combined with pomegranate peel extract on the quality of Pacific white shrimp during iced storage[J].Food Control, 2016, 59:818-823.
[9] SHAN B, CAI Y Z, BROOKS J D, et al.Antibacterial and antioxidant effects of five spice and herb extracts as natural preservatives of raw pork[J].Journal of the Science of Food &Agriculture, 2009, 89(11):1 879-1 885.
[10] DEVATKAL S K, KUMBOJ R, PAUL D.Comparative antioxidant effect of BHT and water extracts of banana and sapodilla peels in raw poultry meat[J].Journal of Food Science &Technology, 2014, 51(2):387-391.
[11] 唐仕荣, 李超, 宋慧, 等.生姜多酚的优化提取及其抗氧化性研究[J].食品工业科技, 2010,31(4):256-259.
TANG S R, LI C, SONG H, et al.Study on extraction and antioxidation of ginger polyphenols[J].Science and Technology of Food Industry, 2010,31(4):256-259.
[12] 谭晓舒, 吴建文, 梨贵卿, 等.火麻仁油总酚含量福林酚测定法的优化[J].食品研究与开发, 2021, 42(2):166-173.
TAN X S, WU J W, LI G Q, et al.Optimization of folin-ciocalteu method for the determination of total polyphenols in hemp seed oil[J].Food Research and Development, 2021, 42(2):166-173.
[13] 李静舒, 贺东亮.荞麦芽菜黄酮类物质含量和胰蛋白酶抑制率变化研究[J].农业与技术, 2021, 41(7):12-14.
LI J S, HE D L.Study on the changes of flavonoids content and trypsin inhibition rate in buckwheat sprouts[J].Agriculture and Technology, 2021, 41(7):12-14.
[14] 王啸. 生姜活性部位与成分研究进展[J].中医研究, 2009, 22(12):53-55.
WANG X.Research progress on active situs and active components from ginger[J].Traditional Chinese Medicinal Research, 2009, 22(12):53-55.
[15] 孙昕. 生姜提取物抗氧化及清除亚硝酸盐的活性研究[D].杭州:浙江大学, 2018.
SUN X.Study of antioxidant activity and nitrite scavenging capacity of ginger extract[D].Hangzhou:Zhejiang University, 2018.
[16] 张晓燕, 云雪艳, 梁敏, 等.含有海藻糖的生物可降解薄膜对冷鲜肉的保鲜与护色作用[J].食品工业科技, 2015, 36(8):298-304.
ZHANG X Y, YUN X Y, LIANG M, et al.Influence of biodegradable film containing trehalose on fresh-keeping and colour protection of chilled meat[J].Science and Technology of Food Industry, 2015, 36(8):298-304.
[17] YEH H Y, CHUANG C H, CHEN H C, et al.Bioactive components analysis of two various gingers(Zingiber officinale Roscoe) and antioxidant effect of ginger extracts[J].LWT-Food Science and Technology, 2014, 55(1):329-334.
[18] GHARIBZAHEDI S M T, MOHAMMADNABI S.Effect of novel bioactive edible coatings based on jujube gum and nettle oil-loaded nanoemulsions on the shelf-life of Beluga sturgeon fillets[J].International Journal of Biological Macromolecules, 2017, 95:769-777.
[19] 严碧云, 李西, 黄爱妮, 等.壳聚糖蒜姜复合膜在冷却猪肉保鲜中的应用[J].中国食品添加剂, 2021, 32(12):72-81.
YAN B Y, LI X, HUANG A N, et al.Application of chitosan ginger garlic composite film in chilled pork preservation[J].China Food Additives, 2021,32(12):72-81.
[20] GILL C O.Extending the storage life of raw chilled meats[J].Meat Science, 1996, 43:99-109.
[21] 王正荣,马汉军.壳聚糖与生姜提取物复合膜在冷却猪肉保鲜中的应用[J].保鲜与加工, 2017, 17(1):12-16.
WANG Z R, MA H J.Preservation effects of complex film of chitosan and ginger extract on chilled pork[J].Storage and Process, 2017, 17(1):12-16.
[22] HAMEDI H, KARGOZARI M, SHOTORBANI P M, et al.A novel bioactive edible coating based on sodium alginate and galbanum gum incorporated with essential oil of Ziziphora persica:The antioxidant and antimicrobial activity, and application in food model[J].Food Hydrocolloids, 2017, 72:35-46.
[23] 张依洁, 汪兰, 吴文锦, 等.丁香和青花椒精油在酱卤鸭肉保鲜中的应用[J].食品工业科技, 2016, 37(2):339-342.
ZHANG Y J, WANG L, WU W J, et al.Effect of clove oils and green zanthoxylum oils on the preservation of bittern duck[J].Science and Technology of Food Industry, 2016, 37(2):339-342.
[24] NOORI S, ZEYNALI F, ALMASI H.Antimicrobial and antioxidant efficiency of nanoemulsion-based edible coating containing ginger (Zingiber officinale) essential oil and its effect on safety and quality attributes of chicken breast fillets[J].Food Control, 2018, 84:312-320.
[25] FERN NDEZ-PAN I, CARRI
NDEZ-PAN I, CARRI N-GRANDA X, MATÉ J I.Antimicrobial efficiency of edible coatings on the preservation of chicken breast fillets[J].Food Control, 2014, 36(1):69-75.
N-GRANDA X, MATÉ J I.Antimicrobial efficiency of edible coatings on the preservation of chicken breast fillets[J].Food Control, 2014, 36(1):69-75.
[26] ALISHAHI A, AÏDER M.Applications of chitosan in the seafood industry and aquaculture:A review[J].Food and Bioprocess Technology, 2012, 5(3):817-830.
[27] 吴涛. 生姜提取液对白鲢鱼肉的保鲜作用研究[J].长江大学学报(自然科学版), 2010, 7(1):79-82.
WU T.Research of extract of ginger (Zingiber officinale roscoe) in the preservation of silver carp (Hypophthalmichthys molitrix)[J].Journal of Yangtze University (Natural Science Edition) Agricultural Science Volume, 2010, 7(1):79-82;8.
[28] ZHOU G H, XU X L, LIU Y.Preservation technologies for fresh meat—A review[J].Meat Science, 2010, 86(1):119-128.