中国白酒酿造已有2 000多年历史,浓香型白酒是白酒四大香型(浓、酱、清、米)之一,具有窖香浓郁、绵甜醇厚、香味协调、尾净余长等特点[1]。窖池是浓香型白酒的发酵容器,不同窖池生产的白酒品质存在差异,常言道“老窖产好酒”,窖池的窖龄和窖泥质量优劣一定程度上决定了白酒品质。研究表明,老窖窖泥具有相对稳定且较为复杂的微生物菌群环境。酵母是完成酒精发酵的主体微生物,己酸菌利用酵母代谢生成的乙醇及其他微生物生成的有机酸合成己酸,己酸与乙醇酯化形成浓香型白酒的特征风味物质——己酸乙酯,这些微生物菌群通过协同生长代谢和群落演替对白酒质量和特征风味产生显著影响[2-3]。可见,浓香型白酒是多种微生物协同作用的过程,其中窖泥微生物菌群是影响白酒品质的关键因素,针对特定酿酒企业解析窖泥微生物多样性具有重要意义。
常用的窖泥微生物研究方法主要包括16S rRNA基因克隆文库分析法、磷脂脂肪酸分析法、高通量测序法、变性梯度凝胶电泳法等[4-5]。其中,高通量测序技术可以在较短时间内产生大量数据,并全面反映样品微生物群落信息,已广泛用于不同老熟程度窖泥微生物菌群的构成分析。不同时间(窖龄)、空间(产区之间及窖池内部)及质量等级(退化、正常及优质)窖泥的微生物群落α及β多样性、理化性质以及两者之间的相关性变得越来越清晰[6]。TAO等[7]研究了不同窖龄(1、10、25和50年)窖泥中的原核微生物群落变化,发现随着窖泥窖龄从1年增加到25年,窖泥微生物菌群丰度逐渐增加,而25年和50年窖龄的窖泥微生物菌群结构最为相近且无明显差异,但其多样性和丰富度明显高于新窖泥。张会敏等[8]分析了新窖泥(4年)和老窖泥(50年以上)的细菌菌群结构差异,也发现老窖泥的菌群多样性和丰富度高于新窖泥,尤其Lactobacillus在新窖泥中的平均相对丰度远高于老窖泥。另一方面,窖泥也会因位置(窖壁上、中、下层和窖底)不同而形成差异化的微生物群落结构,如窖底泥长期浸泡在黄水中,上层窖壁泥则不会接触到黄水,导致不同位置窖泥的微生物群落存在一定差异[9]。张朝正等[10]发现相同窖龄池底泥的微生物群落多样性高于池壁泥。DING等[11]在窖壁泥中检出Acinetobacter,而窖底泥未检出。WANG等[12]报道Lactobacillus的相对丰度随窖池深度增加而减小,而Clostridium则与之相反。因此,不同窖龄和窖池位置的窖泥微生物组成都存在一定的差异性。
四川、湖北、江苏和安徽等地区是我国浓香型白酒的主要产区,这些省份酿酒企业的窖泥微生物研究起步早,已有较多成果报道。本文以甘肃省陇南市金徽酒公司的新、老窖池(5、7、10、30、50年)窖泥为研究对象,采用高通量测序技术对窖泥中的细菌群落结构进行分析,比较不同窖龄及空间位置窖泥的相似性及差异性,并使用PICRUSt软件对窖泥微生物功能基因进行预测分析,以期详细了解金徽酒窖池的窖泥细菌群落结构,为企业窖泥驯化和酿酒品质提升奠定理论基础。
1 材料与方法
1.1 样品收集
样品:窖泥取自甘肃金徽酒股份有限公司5年、7年、10年、30年和50年等不同窖龄的发酵窖池。
取样方法如图1所示,窖池长、宽、高分别为3、2、2.2 m,每个窖龄窖池分别从窖池壁上层、中层和窖底泥进行无菌取样,共14个代表样品,无菌密封后贮存于-80 ℃备用待测。池底泥采用5点取样法,从窖池池底4个对称角和中心点取样混合,作为池底窖泥样品(pit bottom,PB),5个窖龄的窖泥样品分别命名为PB5、PB7、PB10、PB30和PB50,其余样品参照该法进行命名。从距离窖沿0.3 m处的四面池壁中心点取样混合,作为池壁上层窖泥样品(wall top,WT);从距离窖底1 m处的四面池壁中心点取样混合,作为池壁中层窖泥样品(wall mezzanine,WM)。

图1 窖泥的取样位置
Fig.1 Sampling locations of pit muds
1.2 窖泥基因组提取及Illumina MiSeq测序
采用MO Bio强力土壤DNA提取试剂盒(DNeasy Power Soil Kit)并参照说明书对窖泥基因组 DNA 进行提取,利用琼脂糖凝胶电泳技术检测 DNA纯度和浓度,将合格DNA样本送上海欧易生物医学科技有限公司进行建库及Illumina MiSeq双端测序,16S rDNA扩增子引物对为343F(5′- TACGGRAGGCA GCAG-3′)和 798R(5′- AGGGTATCTAATCCT-3′),扩增区域为16SrDNA的V3~V4区。PCR扩增反应体系:2×Gflex PCR Buffer 15 μL,TksGflex DNA Polymerase (1.25 U/μL) 0.6 μL,模板DNA 50 ng,上下游引物各1 μL,用dd H2O(双蒸水)补足体积到30 μL。反应条件:预变性94 ℃ 5 min,变性94 ℃ 30 s,退火56 ℃ 30 s,延伸72 ℃ 20 s,终延伸72 ℃ 5 min,26个循环。
1.3 高通量测序数据分析
采用Trimmomatic(version 0.35)、Flash(version 1.2.11)、QIIME(version 1.8.0)及UCHIME(version 2.4.2)软件对测序序列进行质控,包括序列拼接,以及去除含有N的序列、引物和接头、质量值低于20的碱基、长度低于200 bp的序列及嵌合体序列得到有效序列。使用Vsearch(version 2.4.2)软件对质控得到的有效序列进行分类,其中相似性高于97%的序列归为1个可操作分类单元(operational taxonomic units,OTU),选取每个OTU中丰度最大的序列作为代表序列。利用贝叶斯(RDP classifier Naive Bayesian)分类算法对OTU代表性序列进行物种分类学分析,并在物种分类水平统计每个样本的细菌群落组成。基于OTU分析结果,分别计算Shannon、Chao1等α多样性指数。同时,对所有数据使用统计学分析方法,采用SPSS 20软件完成Pearson相关性分析。
2 结果与分析
2.1 不同窖龄及位置窖泥细菌多样性分析
2.1.1 测序数据合理性分析
通过Illumina MiSeq平台测序分析,获得1 426 984条平均长度为407.23~425.68 bp的有效序列。按照97%的默认值对优化序列进行分组,共得到4 510个OTU,各窖泥样本中的OTU个数分布介于445~1 416。每个样本的覆盖率均大于99%,说明测序数目足够,测序序列可以代表微生物菌群组成。由图2可知,14个窖泥样本在测序深度达到25 000条后,水平方向增加相同序列数,竖直方向OTU数目并不增多,曲线趋向平行直线,说明所取样品基本可以真实反映出窖泥样品中大多数微生物的群落构成,实验结果真实可靠[13]。

图2 不同窖龄及位置窖泥样品的细菌群落OTU稀释性曲线
Fig.2 OTU dilution curves of bacterial community in pit muds for different ages and locations
2.1.2 细菌群落α-多样性分析
如表1所示,随着窖泥窖龄的增加,同一位置窖泥的Chao1指数总体呈现上升态势,说明老窖泥中的微生物菌群更趋于丰富,这一点可从同一窖池位置50年窖龄的窖泥Chao1指数最高得到印证。另一方面,对于50年窖龄窖泥而言,窖池池壁中层的窖泥Chao1指数最大,显示该区域具有最为丰富的微生物菌群组成[14]。从细菌群落多样性角度分析,同一位置窖泥的Shannon指数随着窖龄的增加总体呈现上升趋势,其中10年窖龄窖泥的Shannon 指数达到峰值,随着窖龄的增加窖泥微生物多样性略有下降,这与黄治国等[15]研究结果一致。这可能是微生物菌群对窖泥环境(富含有机物、酸性、缺氧等)逐步适应的结果,经长时间窖泥驯化和菌群动态更替,适应性微生物逐渐丰富并形成优势种,最终发展成稳定的窖泥微生物群落结构[16-17]。Pearson相关性分析显示,Simpson指数与窖泥窖龄呈现极显著的正相关关系(P<0.01),说明新窖泥中微生物群落分配更均匀。
表1 不同窖龄及位置窖泥中细菌群落的α-多样性
Table 1 α-Diversity of bacterial community in pit mud with different cellar ages and locations

取样位置窖龄/年有效序列数目OTU数目Chao1指数Shannon指数Simpson指数覆盖率/%WT587 166 445 654.671.390.2799.74787 398484790.821.000.2799.641078 9861 0331 218.187.640.9999.703076 9741 0581 335.765.970.9599.525075 6071 4161 771.336.940.9899.38WM589 235 486 765.321.690.3599.71785 017666915.611.940.4099.671086 577495814.565.250.8699.693080 4948031 191.514.280.8599.495075 6071 4161 771.336.940.9899.38PB586 369 499 720.411.780.4499.73779 7948291 159.424.300.8299.581085 178678918.296.640.9799.733086 6559321 313.105.600.9199.555079 8691 1071 399.116.330.9799.50
注:50年窖池由于修复缘故,层次不明晰,故池壁中层和上层窖泥只取其一进行微生物分析
2.2 不同窖龄及位置窖泥细菌群落β-多样性分析
2.2.1 不同窖龄及位置窖泥细菌群落相似性分析
基于Bray-Curtis距离的细菌群落非加权组平均法(unweighted pair-group method with arithmetic means,UPGMA)聚类结果如图3所示。一般而言,样品越靠近,枝长越短,说明2个样品的物种组成越相似。由图3-a可知,所有窖泥样品共分为2个大簇,所有30年与50年窖泥样品单独聚为一簇,其他3个窖龄的窖泥样品聚为另一簇,表明窖池在长期生产使用过程中,窖泥微生物菌群存在明显的时间异质性。从图3-b可知,30年和50年窖龄的5个样品距离较近,5年和7年窖龄的6个窖泥样品距离较近,而10年窖龄的窖泥样品则较为分散,这与TAO等[7]研究结果相似。综合UPGMA聚类和主坐标分析(principal coordinate analysis,PCoA),二者结果基本一致,新、老窖池窖泥根据细菌群落能较好地进行聚类,说明其细菌群落较为相似,反之,10年窖龄的窖泥细菌群落结构存在较大差异性。另一方面,窖龄较短(5年和7年)的新窖池所处的理化环境普遍受酿酒环境的影响较小,制作窖泥的黏土理化性质差异不大,导致其微生物菌群组成较为相似[18]。而10年窖龄的窖泥则处于细菌菌群的过渡演变阶段,故样品分布较为分散。30年和50年窖泥中的细菌群落多样性基本保持不变,达到较为稳定的状态,与TAO等[7]和LIU等[19]报道的成熟期(25~50年)和更长窖龄(400年)窖泥的微生物菌群结构基本无明显差异的结论相一致。

a-UPGMA聚类分析;b-PCoA
图3 不同窖泥细菌群落 UPGMA 聚类分析和PCoA图
Fig.3 UPGMA cluster analysis and PCoA plots of bacterial communities in different of pit muds
2.2.2 窖泥细菌群落的门水平组成分析
如图4所示,OTU注释得到的细菌门中,平均相对丰度超过0.1%的门有9个,其中厚壁菌门(Firmicutes,73.39%)、拟杆菌门(Bacteroidetes,18.74%)和变形菌门(Proteobacteria,5.30%)为优势菌门,此外还有较低丰度的放线菌门(Actinobacteria,0.92%)。随着窖龄的增加,同一位置窖泥的Firmicutes细菌的相对丰度总体呈现先下降后上升的趋势,与TAO等[7]结论相似。Firmicutes细菌中的某些微生物能代谢合成己酸,己酸可进一步通过酯化作用形成己酸乙酯[20],因此,Firmicutes细菌能够在窖泥微生物群落结构中被检测到,是窖泥中的绝对优势菌门。Bacteroidetes和Actinobacteria细菌的相对丰度则随着窖龄的增加总体上呈现上升趋势,这与胡晓龙等[9]和LIU等[19]报道的老窖泥中Bacteroidetes(16.3%)和 Actinobacteria(50年,1.09%~7.58%)相对丰度较高的结果相一致。其中Bacteroidetes能将窖泥中的Fe3+转化成Fe2+,使窖泥颜色由红棕黄褐等转向灰白青,表现出老熟特征。TAO等[7]认为Proteobacteria一般是新窖或退化窖泥中的优势菌门,老窖泥中的含量则相对较少,而本研究中50年窖泥的Proteobacteria相对丰度(10.81%~27.40%)显著高于5年和7年(0.48%~2.03%)的窖泥,推测该菌门可能是金徽酒窖池老窖泥的特色菌门,这与酿酒企业所处的地理位置环境、生产工艺传承、窖泥制备原料等因素密切有关。
从窖池空间位置来看,随着窖池深度的增加,窖龄为5年、7年和10年的窖泥中Firmicutes细菌平均相对丰度呈现下降趋势,而在30年和50年窖泥中则呈现先降低后升高的趋势,其中PB30窖泥的Firmicutes相对丰度(75.05%)明显高于WM30(46.99%)。但无论是窖底泥还是窖壁泥,Firmicutes始终是优势微生物。Firmicutes是窖泥产酸产香的关键微生物菌群,其丰度常被用来评价窖泥质量[21]。不同位置窖泥Firmicutes细菌的平均相对丰度均达到70%以上,说明金徽酒企窖泥质量整体水平较为优异。Bacteroidetes细菌具有代谢糖类物质产生小分子酸的能力,是窖泥微生态中主导碳循环的重要微生物。由图4还能看出,Bacteroidetes的相对丰度随着窖池深度的增加呈现总体升高趋势,尤其在池底窖泥中的相对丰度较高,但与其他位置窖泥样品的差异不显著。Proteobacteria和Actinobacteria的相对丰度变化呈现先增高后降低的趋势,二者也是池壁中层窖泥的优势菌门,平均相对丰度分别为8.05%和1.23%。此外,Actinobacteria在池壁中层的平均相对丰度(1.23%)最高,其次是窖底泥(1.06%),说明白酒风味物质的产生主要在窖池中部以下,与张朝正等[10]结论相似。
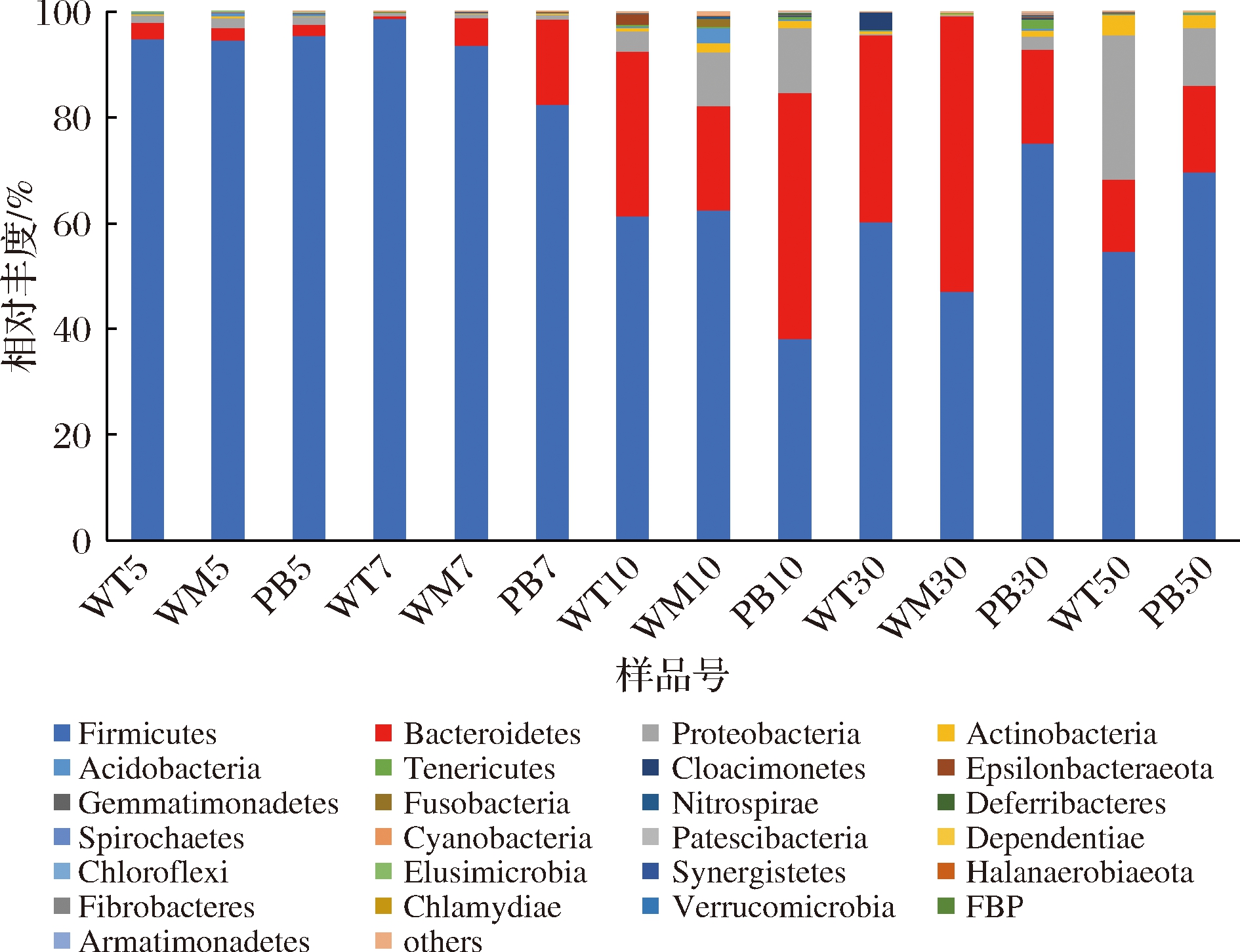
图4 不同窖龄及位置窖泥样品细菌群落门水平分布
Fig.4 The bacterial communities in pit muds for different ages and locations at phylum level
2.2.3 窖泥细菌群落属水平组成分析
将平均相对丰度≥1%的属定义为优势菌属,共有11个,窖泥样本的属水平细菌菌群组成如图5所示。乳杆菌(Lactobacillus)在新窖泥(5年和7年)中是第一优势菌属,平均相对丰度高达80%以上。随着窖龄的增加,不同窖泥样品中的优势菌由Lactobacillus占据主导逐渐演变为包含Lactobacillus、己酸菌(Caproiciproducens,4.61%)、拟杆菌(Bacteroides,3.76%)、理研菌(Petrimonas,4.26%)、互营单胞菌(Syntrophomonas,2.40%)、蛋白杆菌(Proteiniphilum,2.16%)和沉积菌(Sedimentibacter,2.71%)等11个菌属在内的复杂微生物菌群。其中Lactobacillus相对丰度随着窖龄的增加而呈现下降趋势,其他优势菌属的相对丰度则呈现不同程度的提升。具体而言,Caproiciproducens是30年和50年窖龄窖泥的优势菌属,尤其在50年窖底泥中含量最高,相对丰度高达23.37%。己酸菌和梭菌等菌群产生的中长链脂肪酸(如己酸)具有抑制Lactobacillus的功能[22],随着Caproiciproducens相对丰度的增加,其产生的己酸、丁酸等中长链脂肪酸对Lactobacillus抑制作用增强,导致其优势地位下降[8]。Bacteroides和Lachnospiraceae_NK4A136_group的相对丰度总体上呈现先增加后降低的趋势,在10年窖龄窖泥中丰度最高,分别为13.60%和5.02%;随着窖龄继续增加,二者平均相对丰度又降至1%以下。

图5 不同窖龄及位置窖泥样品细菌群落属水平分布
Fig.5 The bacterial communities in pit muds for different ages and locations at genus level
此外,Petrimonas、Syntrophomonas、Proteiniphilum和Sedimentibacter均为老窖泥中的优势菌属,其中Proteiniphilum和Petrimonas属于产乙酸细菌,其代谢物构成了重要的白酒风味物质或前体物质,能与标志窖泥老熟的甲烷菌共生[23]。Syntrophomonas则可以降解C4-C8中长链脂肪酸产生乙酸、丙酸和 H2[24]。Sedimentibacter能与甲烷菌共生,具有降解氨基酸生成乙酸、丙酸、丁酸和铵态氮等小分子物质的功能[25]。Petrimonas、Syntrophomonas、Proteiniphilum和Sedimentibacter这4种菌也常作为优势菌广泛存在于四川、湖北、江苏[26]和河南[9]等地区酒企的老窖泥、老熟窖泥或优质窖泥中。
从窖池空间位置分布来看,随着窖池深度的增加,Lactobacillus的相对丰度变化幅度并不明显,但其在窖底泥中的平均相对丰度最低(38.40%)。除Lactobacillus外,上层窖泥中Sedimentibacter(3.78%)、Lachnospiraceae_NK4A136_group(2.53%)和鞘脂杆菌(Pedobacter,1.80%)的平均相对丰度最高,3种菌属随窖池深度的增加均呈现逐渐下降趋势。Petrimonas、Syntrophomonas、Proteiniphilum为池壁中层的优势菌属。Caproiciproducens、Bacteroides和栖粪杆菌(Faecalibacterium)的相对丰度随窖池深度增加而呈现增长趋势,在窖底泥中的相对丰度高于任一取样位置的窖壁泥,这可能与窖池底部的严格厌氧程度有关[27-28]。此外,相比于窖壁泥而言,7年窖龄窖底泥的微生物多样性和老窖泥更相似,表明池底泥比池壁泥老熟速度快,这与TAO等[7]研究结论基本一致。
进一步利用热图显示窖泥中各菌属的时空分布差异,选取相对丰度位居前30的菌属进行分析(图6)。不同窖池位置和窖龄的窖泥样品清晰地聚成2个大簇,其中30年和50年的窖泥单独聚为一簇,再次表明窖池中的微生物有明显的时间异质性,这与图3结果相吻合。采用SPSS软件进行Pearson相关性分析,发现新窖泥中的优势菌属Lactobacillus与窖龄呈现极显著负相关关系(P<0.01),且随着窖龄的增加其相对丰度显著下降。而Caproiciproducens、Sedimentibacter、Caldicoprobacter和Fermentimonas与窖龄呈极显著正相关关系(P<0.01),这些菌属在新窖泥中的相对丰度很低,随着窖龄的增加逐渐演变成为老窖泥中的优势微生物。另一方面,微生物群落结构与窖池位置也有一定的相关性,但相关性不显著(P>0.05),这与胡晓龙等[29]的研究结果一致。以优势菌属为例,Caproiciproducens、Bacteroides和Faecalibacterium与窖池深度呈正相关关系(相关性系数r>0),随着窖池深度的增加相对丰度增多;而Lactobacillus、Petrimonas等菌属则与窖池深度呈负相关(r<0),其中Sedimentibacter和Lachnospiraceae_NK4A136_group的相关性系数较高,为池壁上层的优势菌属,与图5一致。总之,窖泥微生物菌群的空间分布与窖池空间位置密切相关。
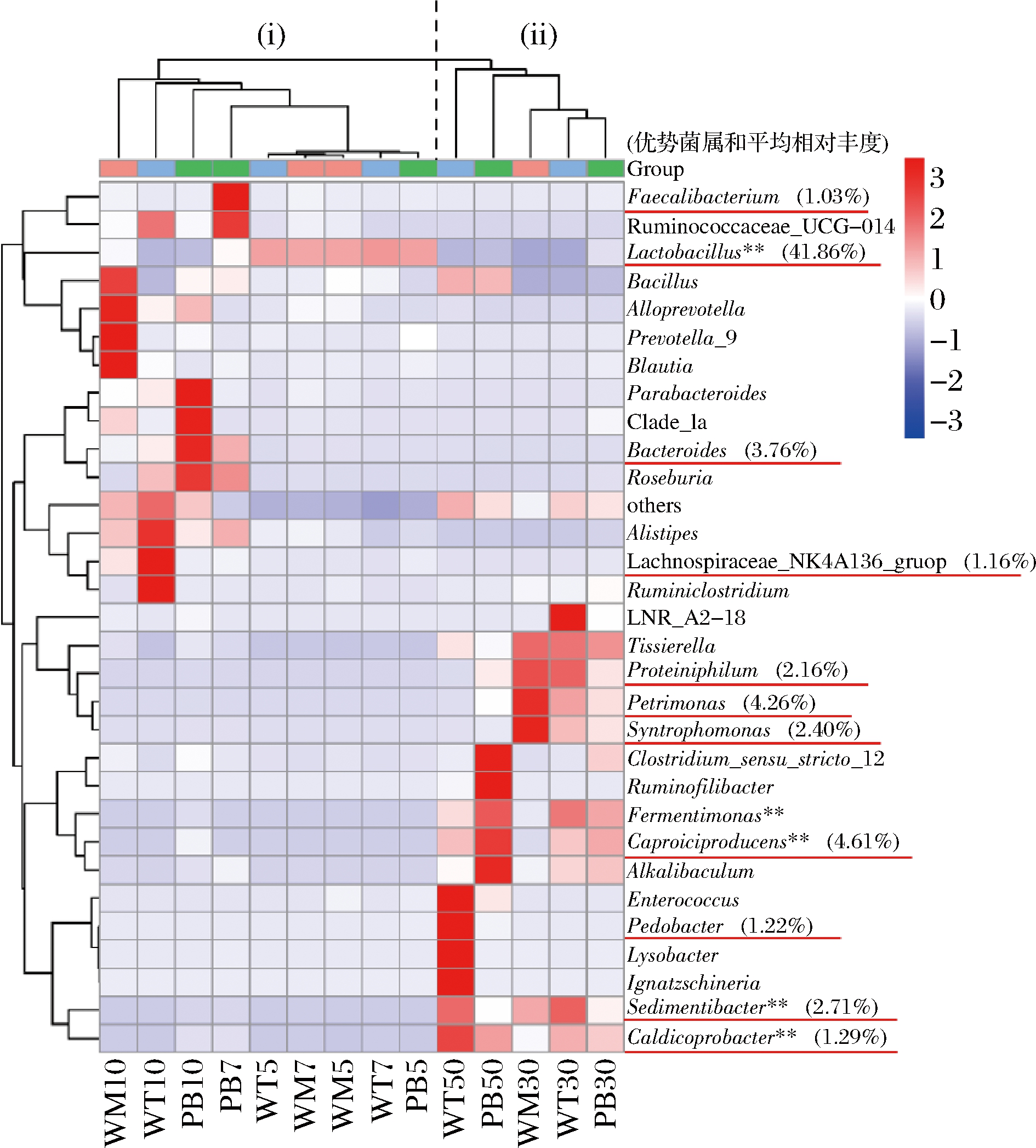
图6 不同窖泥属水平优势细菌群落组成热图
Fig.6 Heat map of dominant bacterial communities in pit muds at genus level
注:图中“**”表示相关性极显著,蓝色表示呈负相关关系,红色表示呈正相关关系
2.3 优势菌群的相关性网络分析
基于Spearman相关性(P>0.8,P<0.01)分析总丰度水平位居前50的属水平微生物,如图7所示。图中所有节点分别隶属于7个可鉴定门,主要集中在Firmicutes(占总节点数量50%)和Bacteroidetes(26.32%)。窖泥中大部分微生物之间呈正相关关系,共存在9个枢纽(多于10条边的节点为枢纽)[23],分别为Petrimonas、互营单胞菌属(Syntrophomonas)、蛋白杆菌属(Proteiniphilum)、沉积菌属(Sedimentibacter)、棒状杆菌属(Caldicoprobacter)、Fermentimonas、泰式菌属(Tissierella)、Alkalibaculum和Fastidiosipila,这9个枢纽分别隶属于Bacteroidetes(3个)、Firmicutes(6个)两个门。枢纽的平均相对丰度随着窖龄的增加呈先上升后下降的趋势,即5年(0.01%)<7年(0.08%)<10年(0.10%)<50年(2.10%)<30年(5.68%)。随着窖池深度的增加这些菌属存在着相同的变化趋势,即池壁中层的平均丰度最高(2.13%),这是由于中层窖泥所处的发酵环境营养物质丰富,pH值、温度等发酵条件适宜,导致中层窖泥中的原核微生物数量最多,群落多样性最为丰富,刘森等[30]研究结果也印证了这一点。同时,相关性网络图中出现了2个独立的模块,这可能是由于能链接2个模块的节点或枢纽含量极少或消失。图中共出现了2对负相关关系,分别为Lactobacillus和其他菌属之间以及瘤胃纤毛杆菌(Ruminofilibacter)和颤螺旋菌属(Oscillibacter)之间。一方面,Lactobacillus代谢物乳酸大量积累造成窖泥pH值下降,进而导致包括正相关网络枢纽在内的大量微生物(多数最适生长pH值为近中性)减少甚至消失[31],推测Lactobacillus是打破窖泥菌群网络平衡的主要微生物;另一方面,Ruminofilibacter相对丰度随O2消耗而逐渐升高,而Oscillibacter则可利用糖发酵产生酸及少量O2,抑制窖泥中Ruminofilibacter属微生物菌群的产生。
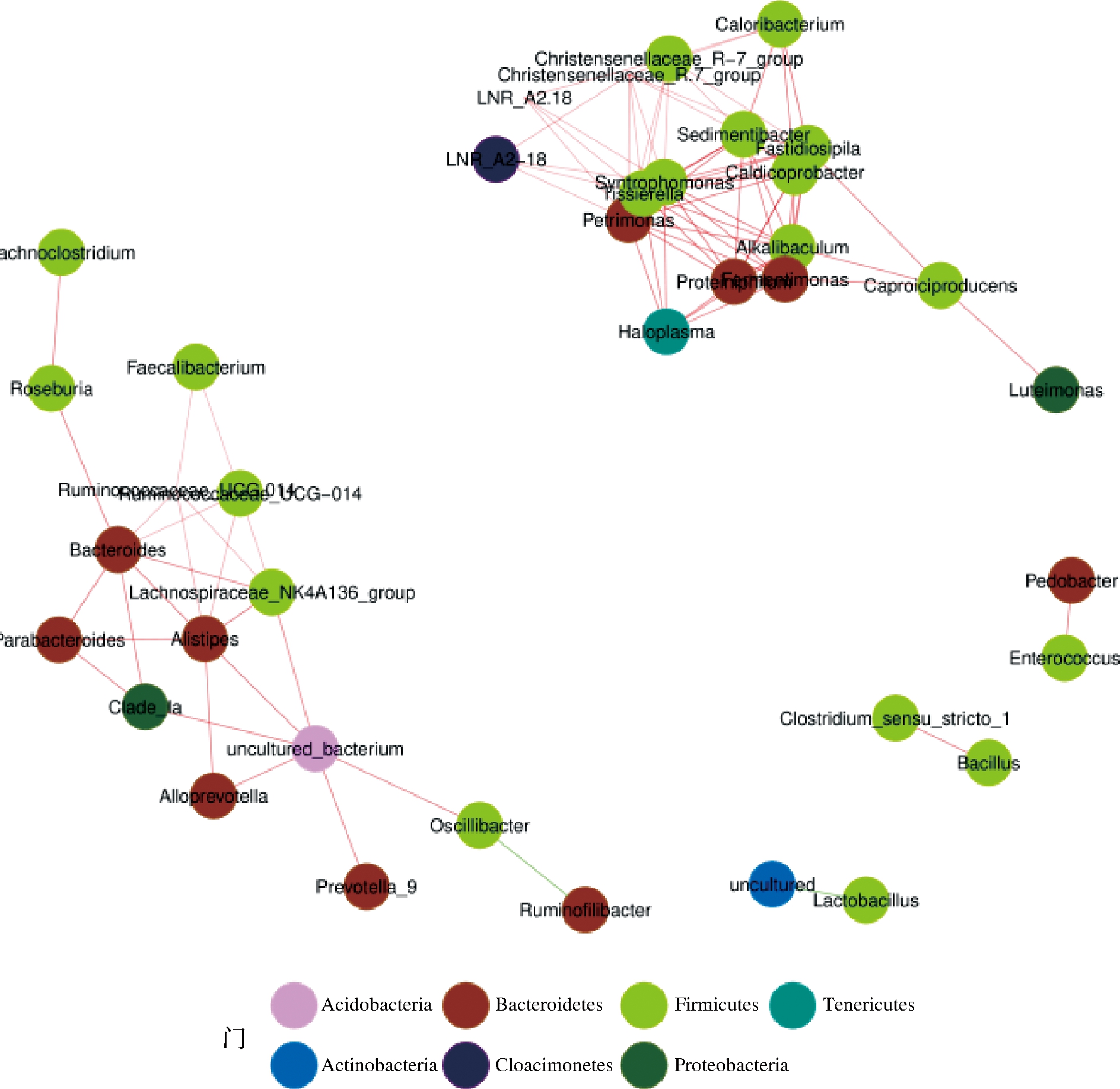
图7 窖泥细菌群落关联网络分析
Fig.7 Network analysis of bacterial communities in pit muds
注:每个节点代表一个属,节点的大小表示物种丰度大小,不同颜色表示不同的物种;连线的颜色表示正负相关性,红色表示正相关,绿色表示负相关;线越多,表示该物种与其他物种之间的联系越密切
2.4 基于16S rDNA的KEGG功能预测
基于16S rDNA基因序列数据的PICRUSt的功能预测分析来揭示微生物基因功能。KEGG是系统分析基因产物和化合物在细胞中的代谢途径以及这些基因产物的功能的数据库,其中包含KEGG通路(KEGG pathway),用于分析代谢通路、基因信息处理、有机系统等信息,在提供相关代谢通路的同时对催化各步反应的酶进行了全面的注释[32]。对窖泥中所有功能基因进行KEGG功能注释,所有基因注释到41条二级代谢通路上,不同窖龄及窖池不同位置窖泥样品中富集基因数量最多的二级代谢通路分别如图8所示。由图8-a可知,在富集基因数量最多的二级代谢通路“Translation(翻译)”、“Replication and Repair(复制和修复)”、“Membrane Transport(膜转运)”、“Energy Metabolism(能量代谢)”、“Carbohydrate Metabolism(碳水化合物代谢)”、“Amino Acid Metabolism(氨基酸代谢)”中,随着窖龄的增加,窖泥中功能基因的数量总体上呈现上升趋势,但在30年窖龄窖泥中略有下降。在酒醅发酵过程中,各种有机酸会影响窖泥中的总酸含量并使窖泥呈酸性,这不仅关系到窖泥微生物生长,而且对产酒质量有重要影响[16]。能量代谢、碳水化合物代谢和氨基酸代谢恰好是涉及到酿酒原料被微生物利用分解转化的途径。其中碳水化合物经糖酵解、丙酮酸代谢及三羧酸循环等代谢途径可产生CO2、水和能量,以及乙醇、乙酸、乳酸和丁酸等物质[33]。这就解释了为什么随着窖龄的增加,窖泥对产酒品质的提高是有益的。因为,老窖泥贡献了更多有利于酿酒原料分解利用代谢的功能基因,正是这几类有关物质代谢基因数量的细微调整,造成了白酒品质上的差异。

a-不同窖龄;b-窖池不同位置
图8 不同窖龄和窖池不同位置窖泥微生物基因功能统计
Fig.8 Function statistics of microbial gene in pit mud for different ages and pit locations
不同位置窖池窖泥微生物基因的功能分布总体差异不显著,但在某些代谢途径上存在细微偏差。池壁上层窖泥的功能基因在“Membrane Transport(膜转运)”上略微强于池壁中层和窖底泥,而窖底泥中“Carbohydrate Metabolism(碳水化合物代谢)”和“Amino Acid Metabolism(氨基酸代谢)”功能基因的分布则略多于窖壁泥,随着窖池深度的增加功能基因数量也有所增加。结合微生物多样性分析,窖底泥的Shannon指数大于窖壁泥,原因可能在于底层功能基因在氨基酸代谢分布上的略微加强[34]。乳酸、乙酸、丁酸和己酸是浓香型白酒的主要有机酸,对白酒风味和品质具有重要影响[16]。由图8-b可知,窖壁上层窖泥在碳水化合物代谢这一代谢通路上所富集的基因数量略低于中层,这就导致了相关发酵产物如乙酸、己酸等含量低于中层,从而在一定程度上影响了白酒品质,使得中层窖泥的酒质优于上层窖泥。
3 结论
利用高通量测序技术对甘肃金徽酒业浓香型白酒新、老窖池(5、7、10、30和50年)3个不同位置(窖壁上、中层和窖底)窖泥的微生物多样性进行研究,发现窖泥细菌菌群的结构多样性与窖龄年份呈现极显著正相关关系,与窖池空间位置存在差异但差异不显著。在供试窖泥样品中,Firmicutes、Bacteroidetes、Proteobacteria和Actinobacteria为其优势菌门;Lactobacillus、Caproiciproducens、Bacteroides和Petrimonas等11个属为其优势菌属。门和属水平微生物群落β多样性结果表明,窖龄对窖泥微生物群落组成的影响程度要强于窖池位置。新窖泥(5年和7年)中相对丰度最高的是Lactobacillus,随着窖龄的增加,由Lactobacillus占据主导优势逐渐演变为Caproiciproducens等11个优势菌属共存的复杂微生态环境。窖泥微生物群落组成随窖池位置的变化较小,Caproiciproducens、Bacteroides等菌属在窖底泥中的平均相对丰度略高于窖壁泥,为窖池底部的优势菌属。除此之外,窖泥中的主要微生物菌群之间呈正相关关系,相关性网络图中共有9个枢纽,各枢纽均与Lactobacillus呈负相关关系。能量代谢、氨基酸代谢以及碳水化合物代谢等是富集基因数量最多的代谢通路,这也是影响金徽酒公司白酒产量和质量的关键代谢通路。
[1] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].Journal of Agricultural and Food Chemistry, 2018, 66(22):5 425-5 432.
[2] ZHANG Q Y, YUAN Y J, LUO W, et al.Characterization of prokaryotic community diversity in new and aged pit muds from Chinese Luzhou-flavor liquor distillery[J].Food Science and Technology Research, 2017, 23(2):213-220.
[3] LUO Q C, LIU C L, WU Z Y, et al.Monitoring of the prokaryotic diversity in pit mud from a Luzhou-flavour liquor distillery and evaluation of two predominant Archaea using qPCR assays[J].Journal of the Institute of Brewing, 2014, 120(3):253-261.
[4] 颜慧, 蔡祖聪, 钟文辉.磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J].土壤学报, 2006, 43(5):851-859.
YAN H, CAI Z C, ZHONG W H.PLFA analysis and its applications in the study of soil microbial diversity[J].Acta Pedologica Sinica, 2006, 43(5):851-859.
[5] EICKHORST T, TIPPKÖTTER R.Improved detection of soil microorganisms using fluorescence in situ hybridization (FISH) and catalyzed reporter deposition (CARD-FISH)[J].Soil Biology and Biochemistry, 2008, 40(7):1 883-1 891.
[6] 辜杨, 项兴本, 王少磊, 等.基于窖泥微生物相对定量与绝对定量联用的窖泥老熟特征分析[J].微生物学报, 2021, 61(11):3 444-3 457.
GU Y, XIANG X B, WANG S L, et al.Profiling the community structure of pit clay during aging process with the combination of relative and absolute quantitative approaches[J].Acta Microbiology China, 2021, 61(11):3 444-3 457.
[7] TAO Y, LI J B, RUI J P, et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Applied and Environmental Microbiology, 2014, 80(7):2 254-2 260.
[8] 张会敏, 王艳丽, 孟雅静, 等.浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J].食品科学, 2020, 41(6):207-214.
ZHANG H M, WANG Y L, MENG Y J, et al.Differences in physicochemical properties and prokaryotic microbial communities between young and old pit mud from Chinese strong-flavor Baijiu brewing[J].Food Science, 2020, 41(6):207-214.
[9] 胡晓龙, 王康丽, 余苗, 等.浓香型窖泥原核微生物群落多样性及其在窖池中的空间异质性[J].食品与发酵工业, 2020, 46(11):77-84.
HU X L, WANG K L, YU M, et al.Biodiversity and spatial heterogeneity of prokaryote community in strong-flavor Baijiu fermentation pit muds[J].Food and Fermentation Industries, 2020, 46(11):77-84.
[10] 张朝正, 张天爽, 董思文, 等.窖泥中挥发性物质和微生物群落的空间分布规律及其关系[J].食品工业科技, 2022, 43(5):147-157.
ZHANG C Z, ZHANG T S, DONG S W, et al.Spatial distribution and relationship of volatile compounds and microbial community in pit mud[J].Science and Technology of Food Industry, 2022, 43(5):147-157.
[11] DING X F, WU C D, ZHANG L Q, et al.Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavor liquor by nested PCR-DGGE[J].World Journal of Microbiology and Biotechnology, 2014, 30(2):605-612.
[12] WANG C D, CHEN Q, WANG Q, et al.Long-term batch brewing accumulates adaptive microbes, which comprehensively produce more flavorful Chinese liquors[J].Food Research International, 2014, 62:894-901.
[13] 梁欢. 北方浓香型白酒窖泥品质及微生物多样性分析[D].石家庄:河北经贸大学, 2021.
LIANG H.Study on the quality and microbial diversity of northern Luzhou-flavor liquor pit mud[D].Shijiazhuang:Hebei University of Economics and Business, 2021.
[14] 孔德杰. 秸秆还田和施肥对麦豆轮作土壤碳氮及微生物群落的影响[D].杨凌:西北农林科技大学, 2020.
KONG D J.Effect on nitrogen and carbon content and microbial community structure of wheatsoybean rotation soil under straw return and fertilizer application treatments[D].Yangling:Northwest A &F University, 2020.
[15] 黄治国, 赵斌, 卫春会, 等.浓香型白酒窖泥古菌群落结构研究及其系统发育学分析[J].现代食品科技, 2014, 30(3):28-32.
HUANG Z G, ZHAO B, WEI C H, et al.Community structure and phylogenetic diversity analysis of archaeal in the mud pit[J].Modern Food Science and Technology, 2014, 30(3):28-32.
[16] 吴浪涛, 丁文骏, 谢专, 等.不同时期窖泥理化因子、风味物质和细菌组成的相关性[J].微生物学通报, 2022, 49(3):1 030-1 047.
WU L T, DING W J, XIE Z, et al.Characterization and correlation analysis of the bacterial composition, physicochemical properties and volatiles in Baijiu fermentation pit mud of different ages[J].Microbiology China, 2022, 49(3):1 030-1 047.
[17] 黄莹娜, 熊小毛, 胡远亮, 等.基于PCR-DGGE和高通量测序分析白云边酒窖泥细菌群落结构与多样性[J].微生物学通报, 2017, 44(2):375-383.
HUANG Y N, XIONG X M, HU Y L, et al.Bacterial community and diversity in pit mud of Baiyunbian liquor analyzed by PCR-DGGE and high-throughput sequencing[J].Microbiology China, 2017, 44(2):375-383.
[18] 王艳丽, 张会敏, 孟雅静, 等.基于16S rDNA V4与V3-V4可变区高通量测序对浓香型白酒窖泥菌群组成的比较分析[J].现代食品科技, 2020, 36(6):147-154.
WANG Y L, ZHANG H M, MENG Y J, et al.Comparative analysis of strong-flavor Baijiu pit-mud microbial community using high-throughput sequencing based on 16S rDNA V4 and V3-V4 variable regions[J].Modern Food Science and Technology, 2020, 36(6):147-154.
[19] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Research International, 2017, 102:68-76.
[20] BAUTISTA-GALLEGO J, ALESSANDRIA V, FONTANA M, et al.Diversity and functional characterization of Lactobacillus spp.isolated throughout the ripening of a hard cheese[J].International Journal of Food Microbiology, 2014, 181:60-66.
[21] LIANG H P, LI W F, LUO Q C, et al.Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J].Journal of the Science of Food and Agriculture, 2015, 95(13):2 729-2 735.
[22] ANDERSEN S J, DE GROOF V, KHOR W C, et al.A Clostridium group IV species dominates and suppresses a mixed culture fermentation by tolerance to medium chain fatty acids products[J].Frontiers in Bioengineering and Biotechnology, 2017, 5:8.
[23] 胡晓龙, 余苗, 曹振华, 等.基于高通量测序的窖泥原核微生物群落多样性在退化窖池中的空间异质性[J].食品科学, 2021, 42(10):86-93.
HU X L, YU M, CAO Z H, et al.Spatial heterogeneity of prokaryotic microbial community diversity in pit mud from degraded cellar for the production of strong-flavor Baijiu revealed by high throughput sequencing[J].Food Science, 2021, 42(10):86-93.
[24] ZHANG C Y, LIU X L, DONG X Z.Syntrophomonas erecta sp.nov., a novel anaerobe that syntrophically degrades short-chain fatty acids[J].International Journal of Systematic and Evolutionary Microbiology, 2005, 55(Pt 2):799-803.
[25] IMACHI H, SAKAI S, KUBOTA T, et al.Sedimentibacter acidaminivorans sp.nov., an anaerobic, amino-acid-utilizing bacterium isolated from marine subsurface sediment[J].International Journal of Systematic and Evolutionary Microbiology, 2016, 66(3):1 293-1 300.
[26] 张应刚, 许涛, 郑蕾, 等.窖泥群落结构及功能微生物研究进展[J].微生物学通报, 2021, 48(11):4 327-4 343.
ZHANG Y G, XU T, ZHENG L, et al.Research progress on community structure and functional microorganisms of pit mud[J].Microbiology China, 2021, 48(11):4 327-4 343.
[27] HE J, HAI L, ORGOLDOL K, et al.High-throughput sequencing reveals the gut microbiome of the Bactrian camel in different ages[J].Current Microbiology, 2019, 76(7):810-817.
[28] HAMDI O, BEN HANIA W, POSTEC A, et al.Aminobacterium thunnarium sp.nov., a mesophilic, amino acid-degrading bacterium isolated from an anaerobic sludge digester, pertaining to the Phylum Synergistetes[J].International Journal of Systematic and Evolutionary Microbiology, 2015, 65(Pt 2):609-614.
[29] 胡晓龙, 余苗, 王康丽, 等.浓香型白酒窖泥微生物群落多样性及理化因素对其影响[J].食品研究与开发, 2021, 42(2):178-185;204.
HU X L, YU M, WANG K L, et al.Diversity of microbial community and its correlation with physicochemical factors in Luzhou-flavor liquor pit mud[J].Food Research and Development, 2021, 42(2):178-185;204.
[30] 刘森, 李林光, 李可, 等.中国浓香型白酒窖池窖泥中原核微生物群落的空间异质性[J].食品科学, 2013, 34(21):221-226.
LIU S, LI L G, LI K, et al.Spatial heterogeneity of prokaryotic microbial communities in Luzhou-flavor liquor pit mud[J].Food Science, 2013, 34(21):221-226.
[31] ROUSK J, BÅÅTH E, BROOKES P C, et al.Soil bacterial and fungal communities across a pH gradient in an arable soil[J].The ISME Journal, 2010, 4(10):1 340-1 351.
[32] KANEHISA M, GOTO S, KAWASHIMA S, et al.The KEGG databases at GenomeNet[J].Nucleic Acids Research, 2002, 30(1):42-46.
[33] 王康丽. 基于宏转录组学的浓香型酒醅微生物群落多样性及代谢特征研究[D].郑州:郑州轻工业大学, 2021.
WANG K L.Study of the diversity and metabolic characteristics of microbial community harbored in fermented grains for the Chinese strong-flavor Baijiu production based on metatran scriptome[D].Zhengzhou:Zhengzhou University of Light Industry, 2021.
[34] 郭明遗. 基于宏基因组高通量测序窖泥微生态及其基因多样性研究[D].重庆:重庆大学, 2020.
GUO M Y.Metagenomic approach studying the taxonomic diversity and functional genes of the pit-mud of Chinese liquor[D].Chongqing:Chongqing University, 2020.