芦笋富含多糖、蛋白质、多种维生素和矿物质等营养成分,以及黄酮、谷胱甘肽、皂苷和植物甾醇等生物活性物质,具有抗肿瘤、降血脂、减缓衰老、免疫调节、抗氧化等功能,享有“蔬菜之王”的美誉。近年来,随着消费者营养健康意识的增强,市场对于芦笋类产品的需求也在稳步提高[1]。芦笋常见的商品形式包括芦笋茶、芦笋酒、芦笋饮料等,其中芦笋汁发酵型饮品在芦笋营养功效的基础上又融合了益生菌的优势,具有更加广阔的市场前景。
益生菌发酵可改善果蔬汁中酚类、糖类、维生素等营养活性成分,而混菌发酵能协同利用不同菌种代谢途径促进生物转化,有利于提高益生菌活性、赋予产品独特风味及丰富的代谢产物[2]。乳酸菌与酵母菌是传统发酵食品中的经典菌种,酵母产生的代谢物质能诱导乳酸菌中氨基肽酶的合成,使氨基酸含量增加,而乳酸菌也可利用酵母菌发酵产生的代谢产物,促进自身的生长[3]。在乳酸菌发酵的豆乳中添加酵母可明显提高乳酸菌的活菌数[4],泡菜中加入酿酒酵母可明显提高乳酸菌菌落数和泡菜风味[5],酿酒酵母与旧金山乳杆菌互作可提高营养成分的利用、改善酸面团风味[6]。目前,芦笋发酵的研究已经取得较好进展,但是相关研究多以单菌发酵为主,很少涉及最适菌种及组合的筛选,且未见乳酸菌与酵母菌共发酵芦笋汁的研究报道。
鉴于此,本研究通过筛选适合芦笋汁发酵的乳酸菌和酵母菌确定最佳发酵菌种与组合,并利用筛选出的菌种组合发酵芦笋汁,监测发酵过程中菌落数、pH、总酸、活性成分和抗氧化能力的变化,评价其发酵特性;以乳酸菌菌落数和铁离子还原/抗氧化能力(ferric ion reducing antioxidant power, FRAP)值为评价指标,通过单因素优化和响应曲面法优化发酵参数。此外,还比较了发酵和未发酵芦笋汁在风味成分上的差异,解析双菌共发酵对芦笋汁风味的影响,以期为研发芦笋汁功能性饮品提供技术支持和参考。
1 材料与方法
1.1 菌种与样品
植物乳杆菌(Lactiplantibacillus plantarum)DY-1、嗜酸乳杆菌(Lactobacillus acidophilus)KDB-03、干酪乳杆菌(Lacticaseibacillus casei)KDB-LC,实验室自行分离菌种,分别简称为LP、LA、LC;凝结芽孢杆菌(Bacillus coagulans)GIM 1.645、酿酒酵母(Saccharomyces cerevisiae)GDMCC 2.37、马克斯克鲁维酵母(Kluyveromyces marxianus)GDMCC 2.119,广州微生物保藏中心,分别简称为BC、SC、KM;芦笋,山东郓城久源农业科技有限公司。
1.2 主要试剂与设备
琼脂粉、邻苯二甲醛,北京索莱宝科技有限公司;蛋白胨、牛肉膏、酵母提取物,北京奥博星生物技术有限公司;Na2CO3、NaCl、NaNO3、FeSO4、CaCl2、葡萄糖、KH2PO4、K2HPO4、柠檬酸氢二胺、MnSO4、Na2SO4、NaNO2、AlCl3、钼酸铵、乙酸钠、芦丁、福林酚、没食子酸等(均为分析纯),国药集团化学试剂有限公司。
L18-Y920型破壁料理机,九阳股份有限公司;YT-CJ-2D/B型超净台,北京亚泰科隆仪器技术有限公司;HZQ-X100型微生物培养箱,中国哈尔滨市东明医疗仪器厂。
1.3 培养基的制备
芦笋汁:取新鲜绿芦笋500 g,洗净、切段,加入500 mL蒸馏水,破壁机榨汁过滤。
YPD培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母浸粉10.0。固体培养基另加琼脂粉18.0。
MRS培养基(g/L):牛肉膏10.0,酵母膏5.0,柠檬酸氢二铵2.0,葡萄糖20.0,乙酸钠5.0,K2HPO4 2.0,MgSO4 0.58,MnSO4 0.25,蛋白胨10.0。固体培养基另加琼脂粉18.0。
以上培养基均115 ℃高压灭菌20 min。
1.4 菌种的活化及菌悬液的制备
将-80 ℃保藏的乳酸菌和酵母菌分别在MRS和YPD平板上划线,35 ℃培养,其中酵母菌培养24 h,乳酸菌培养48 h,挑取单菌落继代培养2次后,转接至液体培养基,以1%接种量接种至10 mL新鲜培养基中培养24 h,于3 000 r/min、4 ℃离心10 min,将菌体沉淀用无菌水洗涤2次后重悬制成菌悬液。乳酸菌与酵母菌菌悬液菌体密度约为7.0 lg CFU/mL。
1.5 接种及发酵
将乳酸菌与酵母菌按1%接种量分别接种至芦笋汁中,酵母菌与乳酸菌共发酵时乳酸菌与酵母菌各按0.5%接种量接种于芦笋汁中,32 ℃恒温培养箱中静置培养至所需时间。
1.6 菌落计数
采用平板菌落计数法。将样品梯度稀释,在MRS固体培养基涂布稀释液,于37 ℃下恒温培养48 h,统计乳酸菌菌落数;在YPD固体培养基涂布稀释液,于30 ℃下恒温培养24 h,统计酵母菌菌落数。
1.7 pH值与总酸的测定
采用pH计测定样品pH值。总酸的测定参考国标GB/T 12456—2008《食品中总酸的测定》。
1.8 总酚和总黄酮的测定
总酚的测定采用福林酚法[7],黄酮的测定采用氯化铝比色法[8]。
1.9 抗氧化能力测定
DPPH自由基清除能力和FRAP值测定参考CHEN等[9]的方法。
1.10 单因素实验设计
以乳酸菌菌落数和FRAP值为指标确定最适发酵条件。其中,接种量选择0.1%、1%、2%、4%、6%,菌种比例1∶1,发酵温度32 ℃;接种比例选择菌悬液体积比3∶1、2∶1、1∶1、1∶2、1∶3,接种量4%,发酵温度32 ℃;发酵温度选择28、30、32、34、36 ℃,接种量4%,接种比例1∶2。
1.11 响应面优化设计
在单因素的实验结果基础上,根据Box-Behnken的中心组合实验设计,采用Design Expert 11软件对芦笋汁发酵条件进行优化。实验因素水平及其编码见表1,发酵时间为24 h。
表1 发酵工艺优化Box-Behnken实验因素和水平
Table 1 Factors and levels of the Box-Behnken
experiment for fermentation process optimization

水平因素A(接种量)/%B(接种比例)C(发酵温度)/℃-161∶336041∶234121∶132
1.12 风味物质分析
参照LENG等[10]的方法,取2.0 g样品,在50 ℃样品罐中500 r/min孵化15 min后,自动注入进行分析。顶空气相进样体积500 μL,进样针温85 ℃。美国RESTEK MXT-5色谱柱(15 m×0.53 mm×1.0 μm),柱温60 ℃,进样温度45 ℃,载气(纯度99.99%的N2)前2 min流速为2 mL/min,2~20 min内线性增加至100 mL/min。使用分析软件包括VOCal和3款插件(Reporter、Gallery Plot和Dynamic PCA)从不同角度分析样品中的挥发性风味化合物[11]。风味分析使用VOCal分析谱图,并对数据进行定性和定量分析。使用Gallery Plot插件比较指纹图谱。
1.13 数据统计与分析
所有实验均重复3次,采用Excel 2019整理实验数据,采用SPSS 26统计分析实验数据,采用Origin Pro 2022绘图。不同处理间比较采用单因素方差分析,多重比较采用Duncan法,当P<0.05时,判定为显著性差异。
2 结果与分析
2.1 适合芦笋汁发酵的菌种及组合的筛选
如图1所示,各乳酸菌与酵母菌在芦笋汁中均能达到106 CFU/mL以上,可见芦笋汁中富含糖类、蛋白质等成分,可满足乳酸菌和酵母菌的基本生长需求,与苏政波等[12]的研究结果一致。其中,乳酸菌数量中以LP为最高,酵母菌以SC为最高。酵母菌产生的CO2、丙酮酸等代谢物可促进乳酸菌的生长,乳酸菌对发酵环境的改造也有利于酵母菌的快速生长,然而二者也存在抑制作用,如乳酸菌产生的苯乳酸可抑制酵母菌,而酵母菌产生的脂肪酸则抑制乳酸菌[4]。因此,针对不同菌种复配有必要筛选最佳组合,本文中以LA+SC组合以及LP+KM组合的总菌量最高。

图1 乳酸菌与酵母菌及其组合发酵芦笋汁24 h后的菌量
Fig.1 Lactic acid bacteria and yeast counts in asparagus juice after 24 h fermentation of different strains and their combination
注:不同小写字母之间具有显著差异(P<0.05)(下同)
如图2所示,芦笋汁发酵后总黄酮与总酚含量总体上呈下降趋势,其中,芦笋汁中总黄酮含量经LA、SC及其组合发酵后显著下降(P<0.05)(图2-a),下降幅度分别为33%、27%、27%,芦笋汁中芦丁、槲皮素等成分可能经过益生菌发酵后被降解或合成其他化合物,这与TABIBPOUR等[13]研究结果一致。但是,KM发酵芦笋汁后黄酮含量有所升高,LA+SC双菌共发酵芦笋汁的总酚含量也显著增加(P<0.05)(图2-b)。益生菌利用底物进行活性化合物的合成和降解代谢途径,活性化合物可以生物转化为其他代谢物或合成新化合物,造成了总酚和黄酮等活性化合物含量的改变[14]
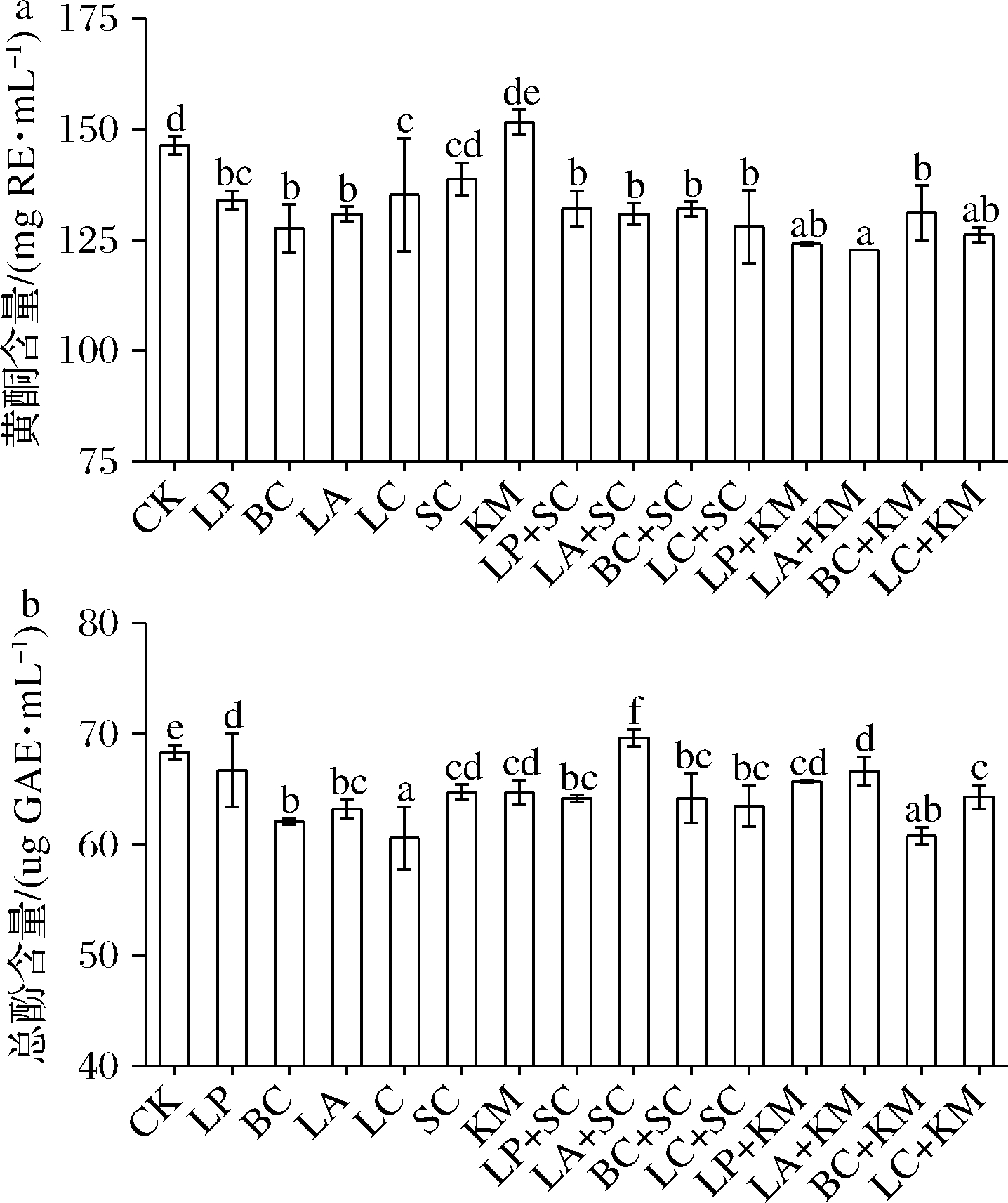
a-黄酮;b-总酚
图2 乳酸菌与酵母菌及其组合发酵芦笋汁24 h后的黄酮和总酚含量
Fig.2 Total flavonoids and phenols content in asparagus juice after 24 h fermentation by lactic acid bacteria and yeast and their combinations
注:CK为未发酵芦笋汁(下同)
如图3所示,发酵明显提高了芦笋汁的DPPH自由基清除能力和FRAP值,其中LA和SC组合提升幅度最大(P<0.05),与未发酵芦笋汁相比,DPPH自由基清除能力提高了40%(图3-a),FRAP值提高了1.3倍(图3-b)。

图3 乳酸菌与酵母菌及其组合发酵芦笋汁24 h后的抗氧化能力
Fig.3 Antioxidative capacity of asparagus juice after 24 h fermentation by lactic acid bacteria and yeast and their combinations
可见,LA+SC是发酵芦笋汁的最适菌种组合。益生菌在代谢过程中对活性物质的合成和降解形成了复杂多样的代谢产物,从而使得发酵物的抗氧化能力发生变化[15]。本文筛选的LA+SC可促进芦笋汁中抗氧化活性物质的积累,而双菌共发酵中不同代谢途径的协同作用可能生成了更多的活性成分[3],使抗氧化能力提升更加明显。
2.2 最适菌种及组合发酵对芦笋汁菌量、pH和总酸的影响
由图4-a可知,芦笋汁单菌和双菌发酵乳酸菌菌落数均在24 h后达到最高,分别为8.78和8.88 lg CFU/mL,酵母菌菌落数也均在24 h后达到最高,分别为8.00和7.34 lg CFU/mL。双菌共发酵中乳酸菌菌量显著高于单菌发酵(P<0.05),酵母菌菌落数则明显降低。由图4-b和4-c可见,乳酸菌单菌发酵芦笋汁的pH最低,为3.35,总酸7.07 g/kg,双菌共发酵芦笋汁pH和总酸含量介于单菌发酵之间。乳酸菌可将芦笋汁中的糖分代谢成有机酸,其中嗜酸乳杆菌产生的可能是乙酸[16,18],从而造成发酵物pH的下降和总酸的升高。乳酸菌与酵母菌共发酵不仅可以促进乳酸菌的生长,还可产生更多的乳酸从而抑制酵母菌的生长[17],导致双菌共发酵中酿酒酵母菌量低于单菌发酵。相反,酿酒酵母的代谢产物有利于嗜酸乳杆菌的生长,而酿酒酵母还可将芦笋汁中的双糖和多糖分解为单糖,为乳酸菌提供稳定的碳源[18],使得双菌共发酵中乳酸菌菌量高于单菌发酵。

a-菌量;b-pH;c-总酸
图4 乳酸菌与酵母菌及其组合发酵芦笋汁发酵液的菌量、pH和总酸
Fig.4 Microorganism amount, pH, and total acids of asparagus juice fermented by lactic acid bacteria and yeast and their combinations
注:SC-酿酒酵母;MIX SC-共发酵中的SC;LA-乳酸菌;MIX LA-共发酵中的LA;MIX-双菌共发酵芦笋汁
从发酵过程中菌量、pH和总酸的变化来看,乳酸菌与酵母菌在芦笋汁中生长周期与培养基基本一致[19],发酵24 h即可达到最大菌量,代谢活动也趋于稳定。因此,确定24 h为LA与SC组合发酵芦笋汁最佳发酵时间。
2.3 不同发酵条件对双菌共发酵芦笋汁中乳酸菌菌量和FRAP值的影响
2.3.1 接种量对双菌共发酵芦笋汁中乳酸菌菌量和FRAP值的影响
如图5所示,乳酸菌菌量随双菌共发酵接种量增加先升高后降低,接种量为4%时,乳酸菌活菌数最大。FRAP值与菌量基本呈正相关关系。接种量的增加可使乳酸菌菌群快速适应芦笋汁培养基环境,促进乳酸菌快速增长,但当接种量达到一定程度时,菌群会竞争营养成分和生存环境导致乳酸菌菌量下降[3]。

a-菌量;b-FRAP值
图5 接种量对乳酸菌菌量和FRAP值的影响
Fig.5 Effects of inoculation on the lactic acid bacteria count and FRAP value
2.3.2 接种比例对双菌共发酵芦笋汁中乳酸菌菌量和FRAP值的影响
如图6所示,不同接种比例显著影响芦笋汁发酵的活菌数和抗氧化能力。当乳酸菌与酵母菌接种比例为1∶2时,乳酸菌菌量和FRAP值最高。酵母菌接种量较大可以快速改善发酵环境,中和乳酸菌产生的酸性物质,反而更适合乳酸菌的生长,使乳酸菌菌量达到最大[17]。研究表明,酿酒酵母代谢分解产生的单糖可促进乳酸菌增殖,且消耗O2和产生CO2为乳酸菌提供良好的无氧环境[20-21]。乳酸菌和酵母菌适宜的接种比例,可促进共发酵体系中乳酸菌的生长。
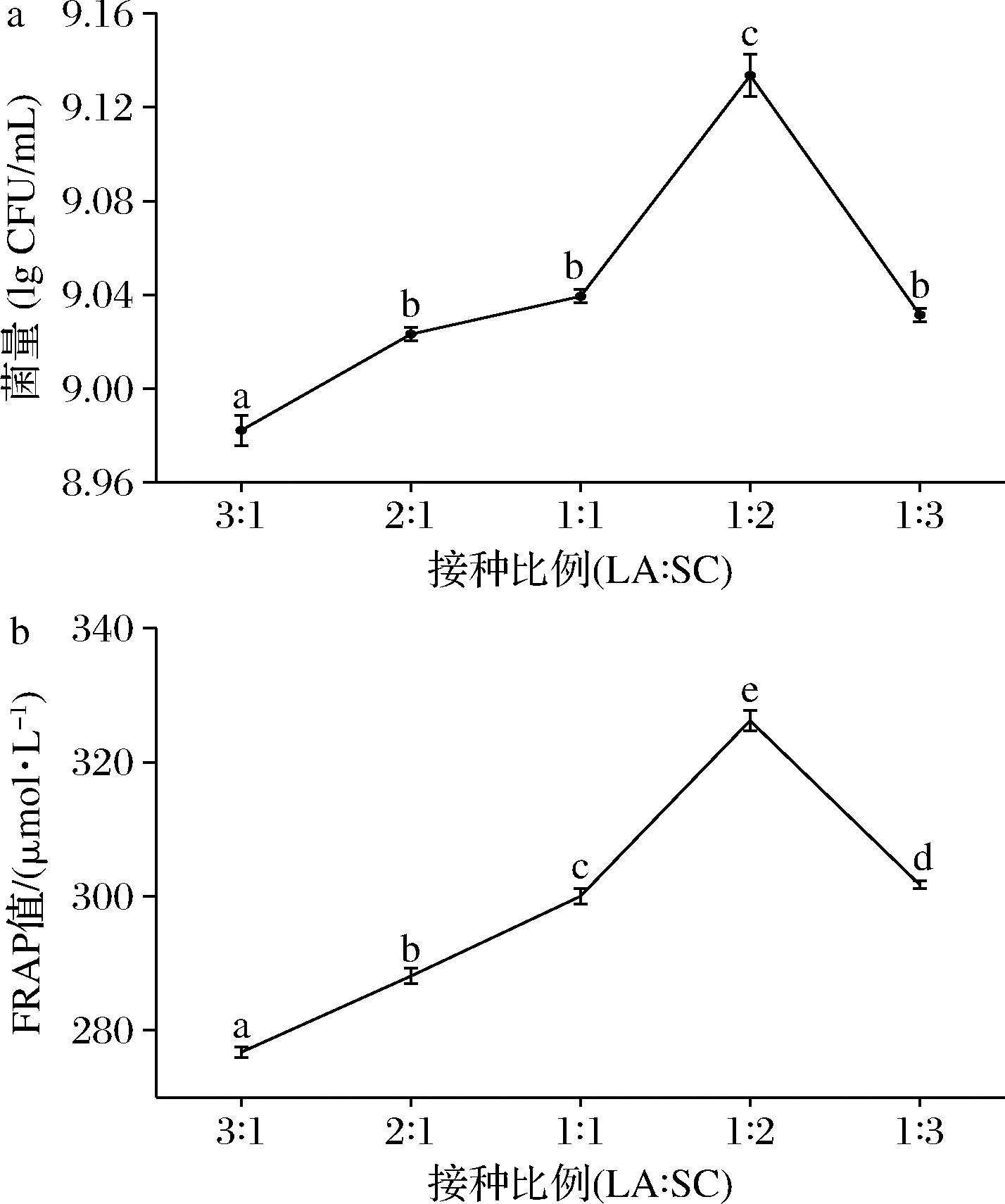
图6 接种比例对乳酸菌菌量和FRAP值的影响
Fig.6 Effects of inoculation ratio on the lactic acid bacteria count and FRAP value
2.3.3 发酵温度对双菌共发酵芦笋汁中乳酸菌菌量和FRAP值的影响
如图7所示,双菌共发酵温度为34 ℃时,乳酸菌菌量和FRAP值最高。

图7 发酵温度对乳酸菌菌量和FRAP值的影响
Fig.7 Effects of fermentation temperature on the lactic acid bacteria count and FRAP value
当温度高于到36 ℃时,乳酸菌菌量的生长显著下降(P<0.05),抗氧化能力也随之降低。乳酸菌与酵母菌的生长都有各自的最适温度,最适温度影响着菌种生长的代谢水平,更直接影响菌种的菌量[22]。
2.3.4 响应面分析结果
根据单因素实验结果,根据Box-Behnken的中心组合实验设计三因素三水平的响应面分析实验,实验方案和结果见电子增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.032662)。根据附表1的结果,利用Design Expert 11软件得到拟合模型:FRAP值(μmol/L)=326.49-7.59A+6.24B+6.58C-0.060 8AB-2.75AC-0.75BC-47.99A2-27.3B2-16.38C2,运用Design Expert 11软件对回归模型进行方差分析,结果见电子增强出版附表2(https://doi.org/10.13995/j.cnki.11-1802/ts.032662)。由F值可知,影响FRAP值的因素依次为接种量>发酵温度>接种比例。
2.3.5 最佳发酵条件预测和验证实验
根据回归方程和实际操作需要,确定最佳发酵条件为接种量3.8%、乳酸菌与酵母菌接种比例1∶2、发酵温度34.5 ℃。用上述最佳培养基配方进行5次平行验证实验,FRAP值平均值为329.19 μmol/L,与预测值327.84 μmol/L非常接近。
2.4 双菌共发酵对芦笋汁风味物质成分的影响
在最优发酵条件下,对比分析了发酵与未发酵样品在风味物质上的差异。样品共检测到59种已鉴定挥发性成分和11种未鉴定挥发性成分,与未发酵芦笋汁相比,发酵显著改变了挥发性成分的丰度谱(图8)。
电子增强出版附表3(https://doi.org/10.13995/j.cnki.11-1802/ts.032662)记录了双菌共发酵前后芦笋汁挥发性化合物的种类与含量变化,芦笋汁的主要风味成分包括醇、醛和酮。从相对含量来看,发酵后醛和醇的含量明显增加。检测到的成分可分为3类:第一类是未发酵样品中含量较高的成分,包括苯甲醛、E-3-戊烯-2-酮、糠醛、2-甲基丁醛、戊醛、庚醛、戊醇、3-甲基丁醛、己醛、辛醛、环己酮、E-2-己烯醛;第二类是发酵后显著增加的成分,包括1-戊烯-3-酮、2-己酮、2-戊酮、2-丁酮、1-辛烯-3-酮、2-庚酮;第三类是含量没有明显变化的成分,包括1-戊醇、D-糖醛、E-2-戊烯醛、2-甲基丁醛、1-戊烯-3-酮、己酸。

a-三维谱图;b-Gallery Plot指纹谱图
图8 发酵(FLS)和未发酵(UFLS)样品中挥发性物质成分谱图
Fig.8 Spectrum of volatile compounds in fermented (FLS) and unfermented (UFLS) samples
发酵前醛类物质含量最高,而发酵后醇类物质的含量明显增加,赋予了芦笋汁特有的发酵香味。醇类化合物的增加一方面是酿酒酵母通过糖分解代谢或脱羧反应而形成的代谢产物,另一方面是芦笋原料中蛋白质分解或微生物菌体蛋白水解成氨基酸,在发酵过程中,氨基酸发生脱氨、脱羧反应,并降解成各种醇类[23-24]。研究发现,混菌发酵中酿酒酵母的加入可明显提高醇类和醛类化合物的含量,2-甲基丁醛作为典型的啤酒挥发性化合物,在发酵芦笋汁中有明显提高[25]。相较于单一的酵母发酵,混合发酵明显提高了挥发性化合物的种类[11]。此外,发酵后芦笋汁中己醛的含量下降,作为明显具有生青味的物质[26],己醛的降低大大缓解了芦笋汁的青草味,提升了感官风味。乳酸菌与酵母共发酵不仅在改善产品风味上作用显著,在提升食品安全性能上也有一定效果。2-戊基呋喃是变质大豆油致癌的主要原因[13]。芦笋汁中也含有2-戊基呋喃,发酵后该成分明显下降,与KOCHHAR[27]的研究结果一致。
3 结论
本研究筛选出适合芦笋汁发酵的嗜酸乳杆菌KDB-03和酿酒酵母GDMCC 2.37,二者共发酵可显著提高芦笋汁发酵液中的乳酸菌菌量、总酚含量和抗氧化活性,但是降低了总黄酮的含量。采用单因素和响应面分析方法,明确了双菌共发酵芦笋汁的最佳发酵条件:接种量3.8%、接种比例1∶2和发酵温度34.5 ℃。气相色谱-离子迁移谱风味分析表明双菌共发酵提高了芦笋汁中醇类物质,降低了醛类物质,显著改善了风味。然而,关于菌间互作机制尚不明确,有待于进一步研究。总之,本研究筛选出的乳酸菌、酵母菌及其组合在芦笋汁发酵上具有潜在的应用价值,可用于开发新型芦笋汁发酵饮品。
[1] CHITRAKAR B, ZHANG M, ADHIKARI B.Asparagus (Asparagus officinalis):Processing effect on nutritional and phytochemical composition of spear and hard-stem byproducts[J].Trends in Food Science &Technology, 2019, 93:1-11.
[2] PANDA S K, SHETTY P H.Innovations in Technologies for Fermented Food and Beverage Industries[M].Cham:Springer International Publishing, 2018.
[3] STEINKRAUS K.Handbook of Indigenous Fermented Foods, revised and expanded[M].2nd ed.Boca Raton:CRC Press, 2018.
[4] 王龄焓, 陈辰, 万洋灵, 等.乳酸菌在豆乳中的生长特性及其与酵母菌联合发酵作用[J].食品工业科技, 2019, 40(19):129-135.
WANG L H, CHEN C, WAN Y L, et al.Growth characteristics of lactic acid bacteria in soymilk and its combined fermentation with yeast[J].Science and Technology of Food Industry, 2019, 40(19):129-135.
[5] 张文娟, 陈安特, 韩宇琴, 等.酿酒酵母对萝卜泡菜发酵的影响[J].食品与发酵工业, 2017, 43(8):134-137.
ZHANG W J, CHEN A T, HAN Y Q, et al.Effects of Saccharomyces cerevisiae on the fermentation of radish pickle[J].Food and Fermentation Industries, 2017, 43(8):134-137.
[6] 杨浣漪. 传统酸面团中酿酒酵母和旧金山乳杆菌的种内多样性及其互作研究[D].杭州:浙江大学, 2018.
YANG H Y.Intraspecific diversity of Saccharomvces cerevisiae and Lactobacillus sanfranciscensis isolates from Chinese traditional sourdough and their interaction[D].Hangzhou:Zhejiang University, 2018.
[7] PAN Y M, ZHU J C, WANG H S, et al.Antioxidant activity of ethanolic extract of Cortex fraxini and use in peanut oil[J].Food Chemistry, 2007, 103(3):913-918.
[8] GONG Y, HOU Z Q, GAO Y X, et al.Optimization of extraction parameters of bioactive components from defatted marigold (Tagetes erecta L.) residue using response surface methodology[J].Food and Bioproducts Processing, 2012, 90(1):9-16.
[9] CHEN X H, QIN W D, MA L H, et al.Effect of high pressure processing and thermal treatment on physicochemical parameters, antioxidant activity and volatile compounds of green asparagus juice[J].LWT- Food Science and Technology, 2015, 62(1):927-933.
[10] LENG P, HU H W, CUI A H, et al.HS-GC-IMS with PCA to analyze volatile flavor compounds of honey peach packaged with different preservation methods during storage[J].LWT, 2021, 149:111963.
[11] SUN Z L, LYU Q Y, CHEN L, et al.An HS-GC-IMS analysis of volatile flavor compounds in brown rice flour and brown rice noodles produced using different methods[J].LWT, 2022, 161:113358.
[12] 苏政波, 刘宝祥, 傅茂润, 等.基于芦笋榨汁残渣发酵生产超氧化物歧化酶酵素[J].食品工业, 2021, 42(11):37-41.
SU Z B, LIU B X, FU M R, et al.Optimization of fermentation process of probiotic fermented asparagus pomace rich in superoxide dismutase[J].The Food Industry, 2021, 42(11):37-41.
[13] TABIBPOUR M, YAMINI Y, AHMADI S H, et al.Carbon fibers modified with polypyrrole for headspace solid phase microextraction of trace amounts of 2-pentyl furan from breath samples[J].Journal of Chromatography.A, 2020, 1609:460497.
[14] LIZARDO R C M, CHO H D, WON Y S, et al.Fermentation with mono-and mixed cultures of Lactobacillus plantarum and L.casei enhances the phytochemical content and biological activities of cherry silverberry (Elaeagnus multiflora Thunb.) fruit[J].Journal of the Science of Food and Agriculture, 2020, 100(9):3 687-3 696.
[15] DE OLIVEIRA S D, ARA JO C M, DA SILVA CAMPELO BORGES G, et al.Improvement in physicochemical characteristics, bioactive compounds and antioxidant activity of acerola (Malpighia emarginata D.C.) and guava (Psidium guajava L.) fruit by-products fermented with potentially probiotic lactobacilli[J].LWT, 2020, 134:110200.
JO C M, DA SILVA CAMPELO BORGES G, et al.Improvement in physicochemical characteristics, bioactive compounds and antioxidant activity of acerola (Malpighia emarginata D.C.) and guava (Psidium guajava L.) fruit by-products fermented with potentially probiotic lactobacilli[J].LWT, 2020, 134:110200.
[16]  LVAREZ-MART
LVAREZ-MART N P, FL
N P, FL REZ A B, HERN
REZ A B, HERN NDEZ-BARRANCO A, et al.Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J].Food Control, 2008, 19(1):62-70.
NDEZ-BARRANCO A, et al.Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J].Food Control, 2008, 19(1):62-70.
[17] 廖一漠, 敖晓琳, 康海燕, 等.传统发酵食品中乳酸菌与酵母菌互作机制研究进展[J].食品与发酵工业, 2023, 49(3):340-346.
LIAO Y M, AO X L, KANG H Y, et al.Research progress on the interaction mechanism between lactic acid bacteria and yeast in traditional fermented foods[J].Food and Fermentation Industries, 2023, 49(3):340-346.
[18] GOBBETTI M, CORSETTI A, ROSSI J.The sourdough microflora.Interactions between lactic acid bacteria and yeasts:Metabolism of carbohydrates[J].Applied Microbiology and Biotechnology, 1994, 41(4):456-460.
[19] BOUDAOUD S, AOUF C, DEVILLERS H, et al.Sourdough yeast-bacteria interactions can change ferulic acid metabolism during fermentation[J].Food Microbiology, 2021, 98:103790.
[20] SIEUWERTS S, BRON P A, SMID E J.Mutually stimulating interactions between lactic acid bacteria and Saccharomyces cerevisiae in sourdough fermentation[J].LWT, 2018, 90:201-206.
[21] BARTLE L, SUMBY K, SUNDSTROM J, et al.The microbial challenge of winemaking:Yeast-bacteria compatibility[J].FEMS Yeast Research, 2019, 19(4):foz040.
[22] 李晏蝶, 李珊, 高云云, 等.副干酪乳杆菌和马克斯克鲁维酵母混合发酵条件优化[J].中国乳品工业, 2020, 48(10):8-12.
LI Y D, LI S, GAO Y Y, et al.Interaction between a Lactobacillus and yeast[J].China Dairy Industry, 2020, 48(10):8-12.
[23] 周文杰, 张芳, 王鹏, 等.基于GC-MS/GC-O结合化学计量学方法研究库尔勒香梨酒的特征香气成分[J].食品科学, 2018, 39(10):222-227.
ZHOU W J, ZHANG F, WANG P, et al.GC-MS/GC-O combined with chemometrics for the screening and identification of aroma characteristics of Korla pear wine[J].Food Science, 2018, 39(10):222-227.
[24] ZHANG S J, PETERSEN M A, LIU J, et al.Influence of pre-fermentation treatments on wine volatile and sensory profile of the new disease tolerant cultivar solaris[J].Molecules (Basel, Switzerland), 2015, 20(12):21 609-21 625.
[25] HUANG Y, TIPPMANN J, BECKER T.A kinetic study on the formation of 2-and 3-methylbutanal[J].Journal of Food Process Engineering, 2017, 40(2):e12375.
[26] 李凯, 王金晶, 李永仙, 等.红心火龙果果酒特征香气分析[J].食品与发酵工业, 2019, 45(13):217-223.
LI K, WANG J J, LI Y X, et al.Characteristic aroma components of red pitaya wine[J].Food and Fermentation Industries, 2019, 45(13):217-223.
[27] KOCHHAR S P.Oxidative pathways to the formation of off-flavours[M]//Food Taints and Off-Flavours.Boston:Springer US, 1996:168-225.