脂肪是加工食品中不可或缺的重要成分,它能够赋予食品风味、质地及口感等特性。目前,国内市场上以氢化油脂为主的涂抹奶油、蛋糕和威化类等食品中反式脂肪酸含量较高(质量分数为5%~11%)[1]。尽管已经开发的多糖、蛋白质等脂肪替代物能够在一定程度上模仿脂肪的质构特性、减少氢化油脂的摄入,但在口感、风味等方面与脂肪存在较大差异[2]。油凝胶是凝胶因子通过自组装或结晶的方式捕集液态油(一般为植物油)形成三维网络结构[3],其不仅具有半固态油脂黏弹性、低反式脂肪酸和饱和脂肪酸(saturated fatty acid,SFA)等优点[4],还可以改善油脂氧化、油脂易迁移等缺点,在替代氢化油方面具有较大潜力。
近年来学者们的研究主要集中在富含甘油三酯(triacylglycerol, TAG)的油脂种类和凝胶因子的种类与浓度等对油凝胶的理化性质的影响。用于制备油凝胶的凝胶因子主要有:单甘酯(monoacylglycerol, MAG),甘油二酯(diacylglycerol, DAG)、植物甾醇和谷维素、乙基纤维素(ethyl cellulose, EC)等[5]。王晓晨等[6]研究发现添加20%(质量分数)DAG制备出的大豆油凝胶的油结合能力达到93.2%。然而,以DAG食用油(DAG质量分数>80%)作为原料(连续相)制备油凝胶尚未见报道。DAG存在1,3-DAG和1,2-DAG两种形式,其中1,3-DAG在抑制餐后TAG累积和预防糖尿病等[7]方面具有显著效果。因此,以DAG为连续相,探索其他凝胶因子对DAG油凝胶的理化性质的影响以及组分间(凝胶因子与DAG)相互作用,这对开发新型健康油凝胶及其在面包、糖果、肉糜等食品的应用具有重要意义。
目前,常用红外光谱分析油凝胶组分的相互作用。QIU等[8]在以中长链DAG和β-谷甾醇混合制备大豆油油凝胶时,利用红外光谱证明2种凝胶因子间存在氢键相互作用,使得油凝胶形成致密的网络结构。而FAYAZ等[9]发现蜂蜡基油凝胶中没有形成氢键。简而言之,红外光谱难以对除氢键之外的其他非共价弱作用力进行分析。近年来,理论计算的方法逐渐应用于食品领域。JIANG等[10]基于分子动力学模拟和独立梯度模型,说明了12-羟基硬脂酸二聚体间的强相互作用使得葵花籽油凝胶的强度偏高。可以推测出,采用量子化学的方法来探索油凝胶组分间相互作用的机制是可行的。
本研究通过实验和理论计算联合的方法,初步探究油种类对油凝胶的物理性质影响机理。首先,对比分析2种液态油(大豆油和大豆二酯食用油)的甘油酯和脂肪酸组成。其次,制备EC与不同液态油形成的油凝胶,探究油种类对油凝胶的物理性质的影响。最后,通过密度泛函理论定量地研究EC与不同油种类分子间非共价相互作用,从分子水平上解释油种类对油凝胶结构性能的影响,为油相-EC复合物形成的驱动力提供一些新的见解。本研究有望为新型健康油凝胶食品的开发提供参考。
1 材料与方法
1.1 材料与试剂
大豆二酯食用油(soybean DAG oil, SDO),广东粤膳特医营养科技有限公司;大豆油(soybean oil, SO),益海嘉里金龙鱼粮油食品股份有限公司(中国上海);乙基纤维素(特性黏度值18~22 mPa·s)(CAS:9004-5-3),上海阿拉试剂有限公司。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;LC-OES-60悬臂式电动搅拌器,上海力辰邦西仪器有限公司;RXZ-50A智能人工气候箱,宁波市科技园区新江南仪器有限公司;TA.XT plus质构仪,英国Stable Micro Systems公司;DHR-1旋转流变仪,美国TA公司;TGL-16G台式离心机,上海安亭科学仪器厂;2695型高效液相色谱仪,美国Waters公司;7890A气相色谱仪,美国安捷伦科技有限公司。
1.3 实验方法
1.3.1 油凝胶的制备
参照LAREDO等[11]的方法并稍作修改。分别将10 g SO或SDO加至50 mL三口烧瓶中,再加入不同质量分数的EC(8%和10%,基于油的质量),并在油浴锅中搅拌3 min(室温,130 r/min)。随后,调速至300 r/min并持续搅拌至温度达到140 ℃(高于玻璃化转变温度),延长10 min以确保EC完全溶解。最后,将该混合物立刻转移至玻璃瓶(20 mL)中,置于25 ℃的恒温箱中冷却24 h直至形成凝胶。整个加热过程始终在氮气环境下进行。
1.3.2 油脂的总脂肪酸和甘油酯组成的测定
甘油酯组成参照LI等[12]的方法进行。取40 mg油脂样品(SO或SDO)于2 mL离心管中,使用1 mL流动相(正己烷、异丙醇、甲酸=21∶1∶0.003,体积比)溶解,加入适量无水Na2SO4除去痕量水,涡旋混匀后10 000 r/min离心3 min,上清液经0.45 μm滤膜过滤后进行高效液相色谱分析。色谱条件:配备Waters 2414示差折光检测器的Waters 2695系统,分离柱为Luna硅胶柱(250 mm×4.6 mm i.d.,5 μm粒径,Phenomenex Corporation,USA),流动相流速1.0 mL/min,进样量10 μL,柱温箱温度30 ℃。根据已知标准品的保留时间分析高效液相色谱图中的峰,对TAG、DAG、MAG和游离脂肪酸(free fatty acid, FFA)进行定性和定量分析。
总脂肪酸组成参考XU等[13]的方法进行测定。取60 mg油脂样品(SO或SDO)溶于4 mL异辛烷,加入0.2 mL KOH-甲醇溶液(2 mol/L),涡旋混合30 s后进行甲酯化反应15 min。反应结束后,加入1 g NaHSO4后剧烈摇晃以除去过量的KOH。静置40 min,取上清液(1 mL)经0.45 μm滤膜过滤后用气相色谱测定。测定条件:CP-Sil 88色谱柱(60 m×0.25 mm×0.20 μm);采用100∶1分流模式,空气、氮气和氢气的流速分别为400、50和35 mL/min。柱初始温度为180 ℃并保持5 min,然后以2 ℃/min的速率升高至220 ℃,以5 ℃/min的速率进一步升高至240 ℃,最后在240 ℃保持10 min。采用峰面积归一化法分析脂肪酸组成。
1.3.3 油凝胶的外观观察
将25 ℃下放置24 h的油凝胶倒置并拍照观察。
1.3.4 质构测定
参照COTABARREN等[14]的方法并稍作修改,将盛装油凝胶样品的玻璃瓶置于质构仪测试平台上,测定其质构特性。测定条件:TPA模式,P/0.5R柱状探头,测试速度1.0 mm/s,压缩程度50%,触发点载荷5.0 g。
1.3.5 油结合能力的测定
参照Y LMAZ等[15]的方法并稍作修改。取1.5 mL在80 ℃下熔化的油凝胶于事先称重的2 mL离心管中,并在4 ℃下储存1 h后称重,然后在室温下离心(8 318×g,15 min)。将离心后的离心管倒置在滤纸上以吸干沥出的油脂,时间持续1 h,最后称取其质量。
LMAZ等[15]的方法并稍作修改。取1.5 mL在80 ℃下熔化的油凝胶于事先称重的2 mL离心管中,并在4 ℃下储存1 h后称重,然后在室温下离心(8 318×g,15 min)。将离心后的离心管倒置在滤纸上以吸干沥出的油脂,时间持续1 h,最后称取其质量。
1.3.6 流变学性质测定
静态流变性试验:取适量油凝胶均匀涂布于样品台上,选用直径为40 mm的平行板夹具,间隙500 μm,剪切速率范围为10~400 s-1,在25 ℃条件下测定油凝胶的表观黏度[6]。所得结果在Ostwald-de Wale幂律方程中进行拟合[16]。
动态流变性试验参照ZETZL等[17]的方法并稍作修改:在室温的低应变水平下(0.05%),对油凝胶进行频率扫描,测定弹性模量(G′)和黏性模量(G″)随频率变化的曲线,频率范围为0.1~100 Hz。
1.4 计算细节
1.4.1 构象搜索和量子化学计算
在Gaussview 5.0.9中构建DAG、EC和TAG的结构。使用Gaussian 09[18]在B3LYP-D3(BJ)/6-31G(d)理论水平的密度泛函理论下,分别对EC、TAG和DAG的初始结构进行优化和频率振动分析,得到无虚频的结构。随后,用GaussView 5.0.9将优化后的结构分别构建了DAG-EC和TAG-EC复合物的初始团簇结构。参照DAI等[19]的方法并稍作修改,筛选出相对能量在5 kcal/mol以内的4个团簇结构。再次使用Gaussian 09,在B3LYP-D3(BJ)/6-31G(d)理论水平对该4个结构进行优化和振动分析,获得稳定的构象。最后,使用ORCA(Version 5.0.3)[20]在wB97M-V/def2-TZVP理论水平上计算单点能,选用溶剂模型CPCM。
1.4.2 结合能和能量分解的计算
读取单点能计算后输出文件中的能量,并使用公式(1)(2)计算结合能。
Gbinding1=Gcomplex1-(GDEC+GDAG)
(1)
Gbinding2=Gcomplex2-(GTEC+GTAG)
(2)
式中:Gbinding1,DAG-EC复合物的结合能;Gbinding2,TAG-EC复合物的结合能,Gcomplex1,DAG-EC复合物的总能量;Gcomplex2, TAG-EC复合物的总能量;GDEC和GDAG分别为DAG-EC复合物中EC和DAG的总自由能,GTEC和GTAG分别为TAG-EC复合物中EC和TAG的总自由能。
为定量分析复合物分子间弱相互作用,参照LU等[21]的方法使用Multiwfn 3.8(dev)[22]对复合物结构进行基于经典分子力场的能量分解(energy decomposition analysis based on force field, EDA-FF)分析。
1.4.3 基于Hirshfeld分子密度划分的独立梯度模型(independent gradient model based on Hirshfield partition, IGMH)
将生成的波函数导入Multiwfn中选择中等质量的格点进行IGMH分析[23]。Multiwfn基于实际电子密度开始计算原子梯度密度(δg)、电子密度(ρ)和拉普拉斯符号中第二Hessian特征值的sign(λ2)。得到的δg包括δgintra和δginter,分别代表原子对之间的片段内和片段间相互作用。随后,将结果导入VMD可视化软件(version 1.9.3)[24]分析。
1.4.4 相互作用区域指示函数(interaction region indicator, IRI)
对最稳定的复合物结构生成的波函数进行IRI分析[25]。
1.5 数据处理
各试验重复2次,各样品的指标至少进行3次平行测定,结果以平均值±标准偏差表示。用统计软件SPSS进行单因素ANOVA分析(P<0.05时为差异显著)。
2 结果与分析
2.1 甘油酯和脂肪酸组成分析
图1-a显示,SO中以TAG为主,其含量高达94.36%,而FFA和DAG含量较少,分别为4.10%和1.53%。而SDO中以DAG为主,其含量达到了81.84%,其余为TAG(16.65%)和MAG(0.50%)。图1-b显示,SO和SDO的不饱和脂肪酸(unsaturated fatty acid,USFA)含量分别高达82.78%和82.92%,两者之间没有明显差异。
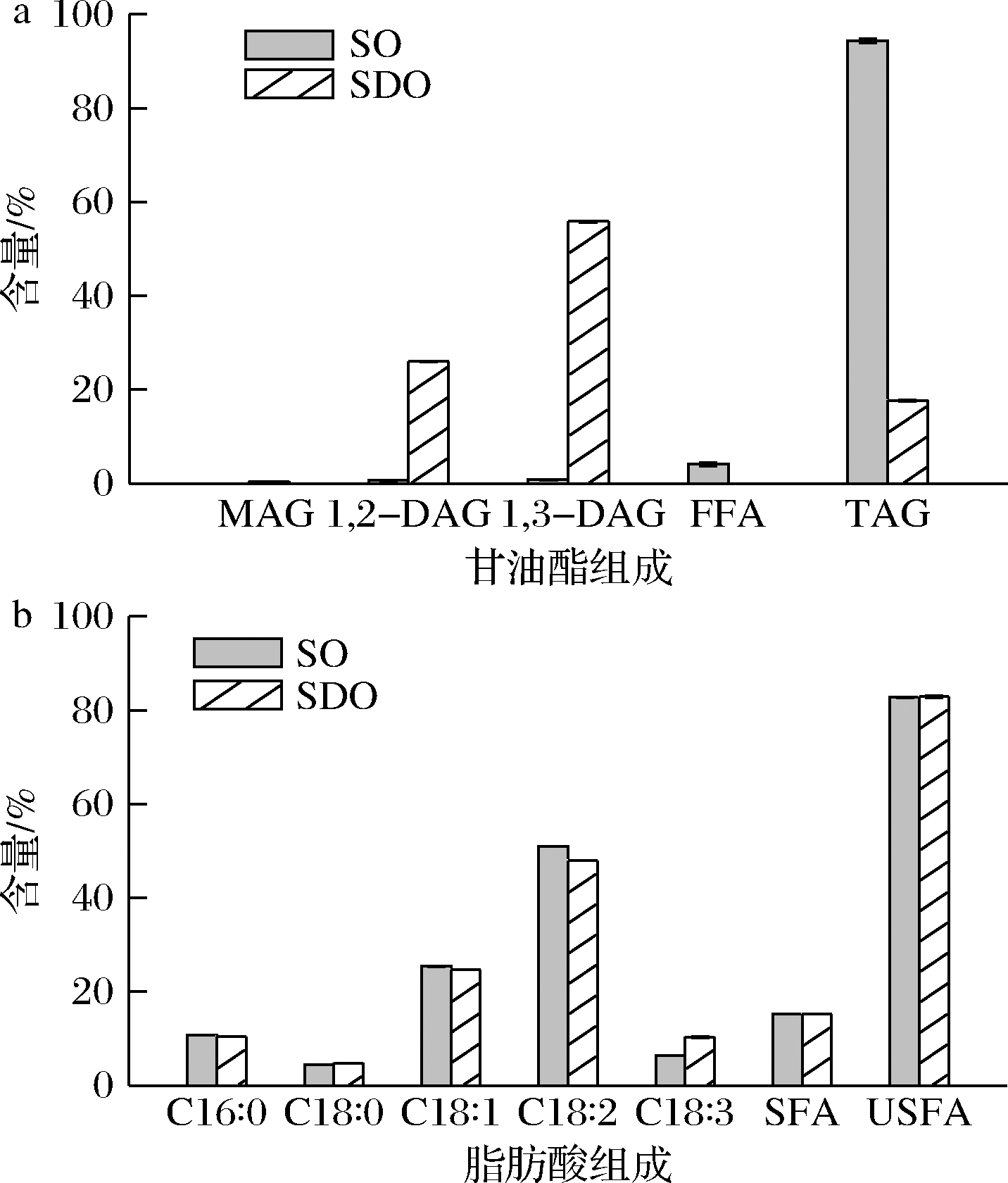
a-甘油酯组成;b-总脂肪酸组成
图1 SO和SDO中甘油酯和总脂肪酸组成图
Fig.1 Glyceride composition and total fatty acid composition of SO and SDO
连伟帅[26]研究发现SO经酶法修饰制备SDO(DAG含量为70%~90%)后,SDO的黏度(8.6~8.7 mPa·s)略高于SO(8.5 mPa·s)。研究表明,植物油的不饱和程度、黏度与其油凝胶的强度相关。例如,LAREDO等[11]研究发现植物油的不饱和程度越高,有助于形成更多的聚合物连接区,使得凝胶强度增加。VALOPPI等[27]研究发现具有长碳链和较高黏度的油可形成具有较高硬度的油凝胶。在本研究中,SO和SDO在总脂肪酸组成上大体相似,而在甘油酯组成上存在明显差异。因此,本研究将对比和探讨这种差异对油凝胶性质的影响。
2.2 油凝胶的外观与油结合能力
图2-a中,以SO为连续相时,添加8%和10%的EC均可获得SO油凝胶。然而,以SDO为连续相时,添加8%的EC不能获得SDO油凝胶,主要表现在该油凝胶经倒立后发生表面流动现象;当EC添加量增加到10%时,才可以制备出SDO油凝胶。采用油结合能力进一步评估同种凝胶因子对不同液相油脂的束缚能力(图2-b)。

a-外观;b-油结合能力
图2 EC添加量对SO油凝胶和SDO油凝胶的外观和油结合能力的影响
Fig.2 Effect of EC concentration on the appearance and oil binding capacity of SO and SDO oleogels
当EC质量浓度从8%增大至10%时,2类油凝胶的油结合能力均有显著增强。当EC质量浓度为10%,SDO油凝胶的油结合能力是SO油凝胶油结合能力的1.42倍。这可能是由于EC与SO之间相互作用较强,阻碍了EC分子间氢键的形成,延缓了SO的凝胶化[28]。另外一个可能原因是DAG也是一种凝胶因子,对SDO油凝胶的形成也有一定贡献。王晓晨等[6]研究发现添加质量分数为8%和20%的DAG,SO油凝胶的油结合能力分别为62.8%和93.2%。这说明适量DAG(质量分数≤20%)为凝胶因子形成的油凝胶油结合能力较强。
2.3 油凝胶的质构特性
因添加质量分数为8%EC制备的SDO为溶胶,具有一定的流动性,不能形成SDO油凝胶(图2),因此测定了10%EC含量下SO油凝胶和SDO油凝胶的质构特性(表1)。SO油凝胶和SDO油凝胶在硬度、回复性、黏附性和咀嚼性方面存在显著差异,这提示油凝胶的质构特性可能与甘油酯组成有关。SDO油凝胶的硬度是SO油凝胶硬度的10.12倍,说明SDO油凝胶的网络结构更强、更致密。罗淑玲等[29]以EC(8%)为凝胶因子,所得的SO凝胶的硬度值为60 g。类似的研究也显示,当以EC(8%)为凝胶因子时,所制得棕榈油凝胶和菜籽油凝胶的硬度分别为75 g[30]和30 g[31],均比本研究制备的SO油凝胶的硬度(15 g)大。这些结果表明,即使采用相同质量浓度的凝胶因子时,凝胶的质构特性还可能与油种类和组成、油凝胶制备时加热和冷却条件有关。在本研究中,确保其他条件(EC质量浓度及制备条件等)一致的情况下,富含DAG的SDO比富含TAG的SO更适合制成硬度较大和油结合能力较好的油凝胶。此外,SDO油凝胶的回复性(0.07)显著高于SO油凝胶的回复性(0.01),这说明SDO油凝胶的柔韧性更强。
表1 不同的油种类制备油凝胶的质构特性*
Table 1 Texture of different oil-based oleogels

样品硬度/g弹性/mm内聚性黏附性/g咀嚼性/mJ回复性SO油凝胶15.10±1.53b0.96±0.05a0.31±0.06a4.74±1.37b4.57±1.57b0.01±0.00bSDO油凝胶152.81±12.45a0.93±0.00a0.41±0.02a62.62±1.74a58.00±1.33a0.07±0.00a
注:同一列的不同小写字母表示存在显著性差异(P<0.05)
2.4 油凝胶的流变学分析
2.4.1 静态流变学分析
本实验条件下所制得的SO油凝胶在外观上虽然可形成凝胶(图2-a),表面形成一层看似坚硬的外壳,但当表层被破坏后,凝胶内部的液体开始流动;而且从油结合能力和质构结果也反映SO油凝胶的油结合能力和硬度较差(图2-b和表1),因此,只探讨SDO油凝胶的流变学性质。图3显示,SDO油凝胶的表观黏度随着剪切速率的增加而降低,说明SDO凝胶属于剪切变稀的假塑性流体。这可能是由于剪切力损害了油凝胶的结构。一般假塑性流体表观黏度与剪切速率的关系符合幂律方程(η=Kγn)。表观黏度-剪切速率曲线通过Origin软件拟合之后得到的稠度系数(K)值和幂律指数(n)值分别为(847.34±52.45) Pa·sn和(-1.00±0.02)。拟合函数的相关系数平方值(R2)为0.979,>0.95,说明幂律方程拟合良好。SDO油凝胶的n<1,且偏离1较大,说明该体系越易剪切变稀,即假塑性程度越大。

图3 剪切速率对SDO油凝胶(10%EC)表观黏度的影响
Fig.3 Effect of shear rate on the apparent viscosity of SDO oleogels made with 10% EC
2.4.2 动态流变学分析
当G′>G″时,主要发生弹性形变,体系呈固体状;反之,发生黏性形变,体系呈液体状[32]。图4中,SDO油凝胶的G′和G″随着频率的增大而增大,显示出G′和G″对频率有较大的依赖性,反映了油凝胶内部网络结构是由非共价“物理”交联组成的[33]。在以谷甾醇和卵磷脂为凝胶因子制得的凝胶中也观察到类似现象[33]。SDO油凝胶在0.1~5 Hz和 10~100 Hz的频率范围内,G′明显大于G″,在5~10 Hz的频率范围内,G′略大于G″,表明SDO油凝胶样品的固体性质占主导地位,同时也说明样品形成了凝胶化结构。

图4 频率对SDO油凝胶(10%EC)G′和 G″值的影响
Fig.4 Effect of frequency on the G′ and G″ values of SDO oleogels made with 10% EC
2.5 计算结果分析
2.5.1 结合能和能量分解分析
由公式(1)、(2)计算和能量分解的结果得出,TAG-EC复合物的结合能分别为-61.70和-255.77 kJ/mol,DAG-EC复合物的结合能分别为-55.32和-249.65 kJ/mol,均为负值,说明有利于复合物的形成。由于密度泛函理论和基于分子力场的计算精度存在差异,使得结合能的绝对数值相差较大。实际上,2种方法计算的TAG-EC与DAG-EC复合物之间的结合能相对能量分别为-6.38和-6.12 kJ/mol,显示出这2种方法计算的不同复合物之间结合能差异较小,这主要是密度泛函理论计算的精度优于基于分子力场计算的精度。TAG-EC复合物的结合能低于DAG-EC复合物的结合能,这表明TAG与EC的结合能力强于DAG与EC的结合能力[34]。与静电能和排斥能相比,色散能占结合能的贡献较大,表明范德华相互作用中的色散能在复合物的稳定性中起重要作用。其次,静电能对结合能也有一定的积极贡献。为了显示特定片段间的相互作用类型和强度,对EDA-FF分析的结果在可视化软件中进行原子着色(图5-b、图5-c)。

a-总能量贡献的分解;b-TAG-EC复合物;c-DAG-EC复合物
图5 总能量贡献的分解,TAG-EC和DAG-EC复合物分子间氢键的原子着色图
Fig.5 The decomposition of the total energetic contribution, atomic coloring diagrams of intermolecular hydrogen bond for TAG-EC and DAG-EC complexes
TAG-EC复合物中O11和H215原子为蓝色,DAG-EC复合物中O13、H166、O6和H270原子为蓝色,表明TAG-EC和DAG-EC复合物中分别形成了1个氢键(O11…H215)和2个氢键(O13…H166、O6…H270),有利于复合物结构的稳定。综上,EC与TAG间的结合能小于EC与DAG间的结合能,说明EC与TAG间存在更强的凝胶因子-溶剂的相互作用,这可能削弱了EC分子支链上的乙氧基和糖苷元上未取代的—OH之间氢键的形成[35],降低了凝胶网络结构的紧密程度,进而导致凝胶强度下降(图2-b和表1)。此外,SDO中存在的羟基增加了连续相的极性,有助于凝胶因子-凝胶因子键合的形成,使得油凝胶的硬度增加[36]。
2.5.2 IGMH分析
将sign(λ2)ρ函数通过不同颜色投影到δg等值面上可清楚地分辨弱相互作用类型和强度,等值面中蓝色、绿色和红色区域分别代表了氢键、范德华相互作用和排斥相互作用。TAG-EC和DAG-EC复合物的δginter vs.sign(λ2)ρ散点图(图6-a和图6-c)大部分呈现绿色,且在IGMH等值面图(图6-b和图6-d)中TAG和EC、DAG和EC分子之间也主要被绿色原片包围,验证了范德华力在这2种复合物的分子间相互作用中起主导作用(图5-a)。

a-TAG-EC复合物的散点图;b-TAG-EC复合物的等值面图;c-DAG-EC复合物的散点图;d-TAG-EC复合物的等值面图
图6 TAG-EC和DAG-EC的δginter与sign(λ2)ρ之间的散点图以及复合物的彩色填充等值面图
Fig.6 Scatter plots between δginter vs.sign(λ2)ρ of TAG-EC and DAG-EC and corresponding color filled isosurface of TAG-EC and DAG-EC complexes
注:等值面为0.005 Å
2.5.3 IRI分析
在IGMH展现2种复合物的弱相互作用的分析基础上,对复合物所生成的波函数进行IRI分析以展现同一个等值面图中共价键和弱相互作用区域。图7中,红色的圆片区域,多位于EC的糖苷元环中,表明该区域存在着位阻效应。而等值面的大部分区域为绿色,代表范德华相互作用,表明范德华力在复合物分子间相互作用中起主导作用。此外,在TAG-EC复合物中,EC羟基上的H215原子与TAG的O11原子之间有蓝色的圆片,表明形成了分子间氢键(O11…H215)。在DAG-EC复合物中,EC羟基上的H166原子与DAG的O13原子,DAG的H270原子与EC的O6原子之间均有蓝色的圆片,表明也形成了分子间氢键(O13…H166和O6…H270)。上述结果与EDA-FF观察的结果(图5-b和图5-c)一致。

a-TAG-EC复合物;b-DAG-EC复合物
图7 TAG-EC和DAG-EC复合物IRI=0.8的等值面图
Fig.7 Isosurface of IRI=0.8 for the TAG-EC and DAG-EC complexes
3 结论
本研究以EC为凝胶因子,成功地制备SDO油凝胶,探讨了油种类(SDO和SO)对油凝胶的物理性质影响机理。EC添加量的增加显著增强了2类油凝胶的油结合能力。当EC添加量为10%时,SDO油凝胶的油结合能力和硬度分别是SO油凝胶的1.42倍和10.12倍,表明SDO油凝胶具有更强的持油能力。采用构象搜索和密度泛函理论计算的方法获取TAG-EC和DAG-EC复合物最稳定的构象,并通过EDA-FF、IGMH和IRI评估了复合物各组分之间的相互作用。结果表明,TAG-EC和DAG-EC复合物形成的主要驱动力是范德华力;TAG与EC的相互作用强于DAG与EC的相互作用,这可能影响了凝胶强度。综上,以EC凝胶化SDO时可获得凝胶强度更大的油凝胶,后续研究可关注其他食品组分(如色素、抗氧化剂)对油凝胶的质构特性、流变学性质和氧化稳定等方面的影响。
[1] 傅红, 赵霖, 杨琳, 等.中国市售食品中反式脂肪酸含量的现状研究[J].中国食品学报, 2010, 10(4):48-52.
FU H, ZHAO L, YANG L, et al.Survey of trans fatty acids in foods in Chinese market[J].Journal of Chinese Institute of Food Science and Technology, 2010, 10(4):48-52.
[2] YASHINI M, C K S, SAHANA S, et al.Protein-based fat replacers:A review of recent advances[J].Food Reviews International, 2021, 37(2):197-223.
[3] 钟金锋, 覃小丽, 刘雄.凝胶油及其在食品工业中的应用研究进展[J].食品科学, 2015, 36(3):272-279.
ZHONG J F, QIN X L, LIU X.Advances in oleogels and their applications in food industry[J].Food Science, 2015, 36(3):272-279.
[4] TAN S Y, PEH E, SIOW P C, et al.The role of ethylcellulose oleogel in human health and its potential applications[M]//Edible Oleogels.Amsterdam:Elsevier, 2018.
[5] LI L L, LIU G Q, BOGOJEVIC O, et al.Edible oleogels as solid fat alternatives:Composition and oleogelation mechanism implications[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2 077-2 104.
[6] 王晓晨, 杨雪, 陈琼, 等.大豆油基甘油二酯凝胶油的制备与表征研究[J].中国油脂, 2017, 42(1):60-65.
WANG X C, YANG X, CHEN Q, et al.Preparation and characterization of soybean oil based diacylglycerol oleogels[J].China Oils and Fats, 2017, 42(1):60-65.
[7] LEE Y Y, TANG T K, PHUAH E T, et al.Production, safety, health effects and applications of diacylglycerol functional oil in food systems:A review[J].Critical Reviews in Food Science and Nutrition, 2020, 60(15):2 509-2 525.
[8] QIU C Y, LEI M T, LEE W J, et al.Fabrication and characterization of stable oleofoam based on medium-long chain diacylglycerol and β-sitosterol[J].Food Chemistry, 2021, 350:129275.
[9] FAYAZ G, GOLI S A H, KADIVAR M.A novel propolis wax-based organogel:Effect of oil type on its formation, crystal structure and thermal properties[J].Journal of the American Oil Chemists’ Society, 2017, 94(1):47-55.
[10] JIANG Z J, LU X X, GENG S, et al.Structuring of sunflower oil by stearic acid derivatives:Experimental and molecular modelling studies[J].Food Chemistry, 2020, 324:126801.
[11] LAREDO T, BARBUT S, MARANGONI A G.Molecular interactions of polymer oleogelation[J].Soft Matter, 2011, 7(6):2 734-2 743.
[12] LI Z G, CHEN H, FANG Y L, et al.A highly efficient three-liquid-phase-based enzymatic one-pot multistep reaction system with recoverable enzymes for the synthesis of biodiesel[J].Journal of Agricultural and Food Chemistry, 2021, 69(19):5 481-5 490.
[13] XU Q Q, QIN X L, LAN D M, et al.Water-in-oil emulsions enriched with alpha-linolenic acid in diacylglycerol form:Stability, formation mechanism and in vitro digestion analysis[J].Food Chemistry, 2022, 391:133201.
[14] COTABARREN I M, CRUCES S, PALLA C A.Extrusion 3D printing of nutraceutical oral dosage forms formulated with monoglycerides oleogels and phytosterols mixtures[J].Food Research International, 2019, 126:108676.
[15] Y LMAZ E, Ö
LMAZ E, Ö ÜTCÜ M.Properties and stability of hazelnut oil organogels with beeswax and monoglyceride[J].Journal of the American Oil Chemists’ Society, 2014, 91(6):1 007-1 017.
ÜTCÜ M.Properties and stability of hazelnut oil organogels with beeswax and monoglyceride[J].Journal of the American Oil Chemists’ Society, 2014, 91(6):1 007-1 017.
[16] 侯万国. 应用胶体化学[M].北京:科学出版社, 1998.
HOU W G.Applied Colloid Chemistry [M].Beijing:Science Press, 1998.
[17] ZETZL A K, GRAVELLE A J, KURYLOWICZ M, et al.Microstructure of ethylcellulose oleogels and its relationship to mechanical properties[J].Food Structure, 2014, 2(1-2):27-40.
[18] FRISCH M, TRUCKS G W, SCHLEGEL H B, et al.Gaussian 09, Rev. C01[Z]. Wallingford, CT, 2009.
[19] DAI Y X, ZHONG J F, LI J Q, et al.Interaction mechanism of cholesterol/β-cyclodextrin complexation by combined experimental and computational approaches[J].Food Hydrocolloids, 2022, 130:107725.
[20] NEESE F.Software update:The ORCA program system, version 4.0[J].Wiley Interdisciplinary Reviews:Computational Molecular Science, 2018, 8(1):e1327.
[21] LU T, LIU Z Y, CHEN Q X.Comment on “18 and 12-Member carbon rings (cyclo[n]carbons)-A density functional study”[J].Materials Science and Engineering:B, 2021, 273:115425.
[22] LU T, CHEN F W.Multiwfn:A multifunctional wavefunction analyzer[J].Journal of Computational Chemistry, 2012, 33(5):580-592.
[23] LU T, CHEN Q X.Independent gradient model based on Hirshfeld partition:A new method for visual study of interactions in chemical systems[J].Journal of Computational Chemistry, 2022, 43(8):539-555.
[24] HUMPHREY W, DALKE A, SCHULTEN K.VMD:Visual molecular dynamics[J].Journal of Molecular Graphics, 1996, 14(1):33-38.
[25] LU D T, CHEN Q X.Interaction region indicator:A simple real space function clearly revealing both chemical bonds and weak interactions[J].Chemistry - Methods, 2021, 1(5):231-239.
[26] 连伟帅. 甘油二酯、LML型结构脂的酶法制备与应用研究[D].广州:华南理工大学, 2019.
LIAN W S.Study on the enzymatic preparation and application characteristics of diacylglycerols and LML-type structured lipids[D].Guangzhou:South China University of Technology, 2019.
[27] VALOPPI F, CALLIGARIS S, BARBA L, et al.Influence of oil type on formation, structure, thermal, and physical properties of monoglyceride-based organogel[J].European Journal of Lipid Science and Technology, 2017, 119(2):1500549.
[28] EDWARDS W, LAGADEC C A, SMITH D K.Solvent-gelator interactions—Using empirical solvent parameters to better understand the self-assembly of gel-phase materials[J].Soft Matter, 2011, 7(1):110-117.
[29] 罗淑玲, 傅红, 张虹, 等.乙基纤维素对油脂流变性质和凝胶特性的影响[J].中国粮油学报, 2015, 30(12):70-75.
LUO S L, FU H, ZHANG H, et al.Effect of ethyl cellulose on the rheological properties and oleo gel property of oil[J].Journal of the Chinese Cereals and Oils Association, 2015, 30(12):70-75.
[30] ONACIK-GÜR S,  BIKOWSKA A.Effect of high-oleic rapeseed oil oleogels on the quality of short-dough biscuits and fat migration[J].Journal of Food Science and Technology, 2020, 57(5):1 609-1 618.
BIKOWSKA A.Effect of high-oleic rapeseed oil oleogels on the quality of short-dough biscuits and fat migration[J].Journal of Food Science and Technology, 2020, 57(5):1 609-1 618.
[31] EISA A H, LAUFER S, ROSEN-KLIGVASSER J, et al.Stabilization of ethyl-cellulose oleogel network using lauric acid[J].European Journal of Lipid Science and Technology, 2020, 122(2):1900044.
[32] 刘国琴, 南阳, 刘新旗.单甘酯添加量对油脂凝胶物理性质与晶体结构的影响[J].华南理工大学学报(自然科学版), 2016, 44(11):1-6.
LIU G Q, NAN Y, LIU X Q.Effect of monoglyceride amount on physical properties and crystal texture of organogels[J].Journal of South China University of Technology (Natural Science Edition), 2016, 44(11):1-6.
[33] HAN L J, LI L, ZHAO L, et al.Rheological properties of organogels developed by sitosterol and lecithin[J].Food Research International, 2013, 53(1):42-48.
[34] 杨珏, 罗霄, 刘芳, 等.基于网络药理学和分子对接分析厚朴治疗消化性溃疡的作用机制[J].中国中药杂志, 2021, 46(17):4 522-4 530.
YANG J, LUO X, LIU F, et al.Mechanism of Magnoliae Officinalis Cortex in treatment of peptic ulcer based on network pharmacology and molecular docking[J].China Journal of Chinese Materia Medica, 2021, 46(17):4 522-4 530.
[35] LUPI F R, GRECO V, BALDINO N, et al.The effects of intermolecular interactions on the physical properties of organogels in edible oils[J].Journal of Colloid and Interface Science, 2016, 483:154-164.
[36] GRAVELLE A J, DAVIDOVICH-PINHAS M, ZETZL A K, et al.Influence of solvent quality on the mechanical strength of ethylcellulose oleogels[J].Carbohydrate Polymers, 2016, 135:169-179.