淀粉是人们日常饮食结构中不可缺少的部分。2020年,我国淀粉表观需求量为3 606.1万t,与2016年(2 553.2万t)相比增长了41.2%。但淀粉进入人体胃肠后被迅速消化,导致餐后血糖值的快速上升,长期血糖大幅波动使得Ⅱ型糖尿病等代谢性疾病的患病率增加[1]。膳食纤维主要包括纤维素、半纤维素、果胶、菊粉及木质素等[2]。半纤维素不是均一聚糖,而是由β-1,4糖苷键连接的复合聚糖的总称,原料不同,复合聚糖的组分也不同,其单糖组成主要包括木糖、阿拉伯吡喃糖、葡萄糖、半乳糖、甘露糖以及少量糖醛酸[3-4]。据报道,水溶性膳食纤维能够在一定程度上抑制淀粉消化,从而达到调控餐后血糖值的目的[5-6]。有学者认为,膳食纤维调节餐后血糖水平的能力与其黏度有关,水溶性膳食纤维相比于不溶性膳食纤维表现出更高的黏度,其黏度大小受分子质量控制[7-9]。然而,水溶性膳食纤维分子质量对淀粉消化性的影响目前没有定论,调控分子质量是否能成为调节淀粉消化性的手段亟待验证。
本文以玉米加工副产物麸皮为原料研制不同分子质量水溶性半纤维素(corn bran hemicellulose,CBH),对其流变学特性进行表征,并通过体外实验研究胃肠环境下半纤维素对淀粉消化的影响,建立半纤维素在模拟胃肠蠕动时的表观黏度与小麦淀粉抗性(resistant starch,RS)比例之间的构效关系,探究半纤维素抑制淀粉消化的机理,为功能性食品原料的研制与推广提供理论依据。
1 材料与方法
1.1 材料与仪器
玉米麸皮,中粮集团有限公司;小麦淀粉,新乡良润全谷物食品有限公司;α-淀粉酶(4 000 U/g)、半纤维素酶(6 000 U/mg),北京科奥科技有限公司;碱性蛋白酶(200 U/mg),南宁东恒华道生物科技有限责任公司;淀粉葡萄糖苷酶(260 U/mL)、胰脂肪酶(8×USP)、阿拉伯糖(Ara)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)标准品,美国Sigma公司;GOPOD试剂盒,爱尔兰Megazyme公司;NaOH,天津市永大化学试剂有限公司;无水乙醇,天津市致远化学试剂有限公司;冰醋酸,天津市富宇精细化工有限公司;正己烷(色谱纯),德国Meker公司;GF254薄层色谱硅胶,青岛海洋化工厂。所有分离用有机溶剂均为国产分析纯。
JSM-7610F型扫描电子显微镜,日本电子公司(JEOL);旋转流变仪,沃特世科技(上海)有限公司;傅里叶红外光谱,美国尼高力仪器公司;GPC-20A凝胶渗透色谱仪,日本Shimadzu(岛津)公司;ICS5000离子色谱仪,美国Thermo公司;UV-2800A型紫外分光光度计,尤尼柯(上海)仪器有限公司;ME2002电子天平,梅特勒-托利多仪器(上海)有限公司;数显恒温水浴锅,金坛区西城新瑞仪器厂;低速离心机,上海安亭科学仪器厂;RE-52AA旋转蒸发器,上海亚荣生化仪器厂;全温培养摇床,常州恒得仪器制造有限公司;旋涡振荡器,江苏金怡仪器科技有限公司。
1.2 试验方法
1.2.1 不同分子质量水溶性半纤维素制备
将洗净的玉米麸皮干燥粉碎,过80目筛。玉米麸皮粉末以料液比1∶15(g∶mL)加水混合均匀,加入α-淀粉酶和碱性蛋白酶以除去玉米麸皮中的淀粉及蛋白质。
参考薛占峰等[10]的方法。加入半纤维素酶180 U/g,40 ℃反应5 h,反应结束后沸水浴灭酶10 min。3 000×g离心5 min,收集上清液,3倍体积浓缩后,用3倍无水乙醇沉淀,离心收集沉淀,40 ℃烘干,得到半纤维素CBH-L[11]。
参考ILANGOVAN等[12]的方法,稍作修改。将前处理后的玉米麸皮用5%的NaOH溶液,料液比1∶25,80 ℃下搅拌2 h,离心5 min,收集上清液,用冰醋酸将调上清液pH至6.0~7.0,3倍无水乙醇沉淀,离心5 min,收集沉淀,将沉淀溶于水后冻干,得到半纤维素CBH-H[11]。
1.2.2 不同分子质量水溶性半纤维素功能基团分析
采用KBr压片法。取2 mg样品和200 mg KBr在石英研钵中充分研磨,将混合粉末全部装入压片器中制成透明薄片,将薄片放入傅里叶红外光谱仪中,在500~4 000 cm-1区间进行扫描,得到红外光谱图。
1.2.3 水溶性半纤维素分子量的测定
利用GPC-20A凝胶渗透色谱仪(gel permeation chromatography,GPC)测定CBH的分子质量。色谱柱:TSKgel GMPWXL水相凝胶色谱柱;流动相:0.1 mol/L NaNO3+0.06% NaN3 水溶液;流速:0.6 mL/min;测试柱温:35 ℃;检测器:RID-20A示差折光检测器。
1.2.4 水溶性半纤维素单糖组分的测定
利用Thermo ICS5000离子色谱系统测定CBH样品的单糖组分。利用电化学检测器对单糖组分进行分析检测。采用DionexTM CarboPacTM PA20(150 mm×3.0 mm,10 μm)液相色谱柱;进样量为5 μL。流动相A(0.1 mol/L NaOH),流动相B(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温为30 ℃;洗脱梯度:0 min A相/B相(95∶5, 体积比),30 min A相/B相(80∶20, 体积比),30.1 min A相/B相(60∶40, 体积比),45 min A相/B相(60∶40, 体积比),45.1 min A相/B相(95∶5, 体积比),60 min A相/B相(95∶5, 体积比)。
1.2.5 水溶性半纤维素的形貌结构观察
利用JSM-7610F型扫描电子显微镜(scanning electron microscope,SEM)观察CBH样品的形貌结构。取少量样品在样品台上固定,喷金后,在电压20.0 kV下观察其形貌结构。
1.2.6 水溶性半纤维素的流变学特性测试
配制质量分数为0.24%、0.96%、1.68%、2.4%、4.8%的CBH水溶液,吸取适量溶液滴于流变仪载物台。使用旋转流变仪AR15000测定其表观黏度。
1.2.6.1 剪切速率对不同质量分数CBH水溶液表观黏度的影响
测试程序:选择60 mm夹具,设置剪切速率1~100 s-1,温度25 ℃。
1.2.6.2 温度对不同质量分数CBH水溶液表观黏度的影响
测试程序:选择60 mm夹具,设置温度变化25~75 ℃,剪切速率20 s-1。
1.2.6.3 恒定剪切速率对不同质量分数CBH水溶液表观黏度的影响
测试程序:选择60 mm夹具,分别设置温度为25和37 ℃,剪切速率50 s-1,持续时间5 min。
1.2.7 淀粉消化性模拟试验
参考ENGLYST等[13]的方法分析半纤维素对小麦淀粉消化性的影响。实验所使用的小麦淀粉中淀粉含量为97.5%。具体方法如下:称取300 mg淀粉放入50 mL离心管中;分别加入0、30、120、210、300、600 mg的半纤维素和7.5 mL蒸馏水,再向所有样品中加入2.5 mL乙酸缓冲液、25 mg瓜尔胶,并在37 ℃水浴中平衡样品10~15 min;加入2.5 mL酶混合物[V(淀粉葡萄糖苷酶)∶V(胰脂肪酶)=1∶9],充分涡旋,37 ℃反应。在水解后20 min(G20)和120 min(G120)时,取出250 μL样品,并将其转移至10 mL 66%的乙醇管充分涡旋;乙醇管于3 000×g离心10 min,用GOPOD试剂盒测定葡萄糖浓度,需要乙醇管上清液100 μL加3 mL GOPOD溶液。计算小麦淀粉快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)、抗性淀粉(resistant starch,RS)含量。计算如公式(1)(2)(3)所示:
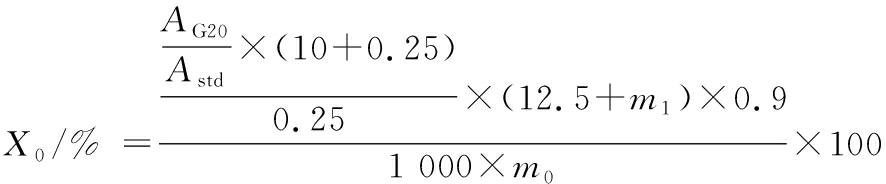
(1)
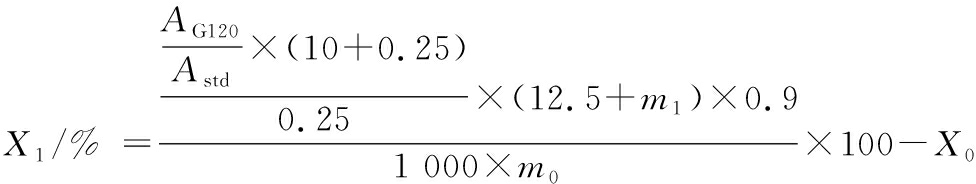
(2)
X2/% =97.5-X0-X1
(3)
式中:X0,来自G20的RDS含量,%;X1,来自G120-G20的SDS含量,%;X2,RS含量,%;AG20,G20样品的吸光度;AG120,G120样品的吸光度;Astd,葡萄糖标准液的吸光度;m1,淀粉湿基质量,g;m0,淀粉干基质量,g;10,乙醇体积,mL;0.25,加入乙醇管的样品体积,mL;12.5,淀粉消化液总体积,mL;0.9,葡萄糖含量转换为淀粉含量的换算系数;97.5,小麦淀粉中淀粉的含量,%。
1.2.8 水溶性半纤维素在胃肠道中的表观黏度与RS比例之间关系的建立
参考李智等[14]的方法,稍作修改。建立不同质量分数(0.24%、0.96%、1.68%、2.4%、4.8%)的CBH水溶液在胃肠道蠕动时(剪切速率为50 s-1)的表观黏度与小麦淀粉RS比例之间的关系。
1.3 统计与分析方法
本实验数据均重复3次测定,不同数据间的显著性及相关性分别采用SPSS 24.0软件中的单因素方差分析(Tukey)及相关性分析(Pearson)进行检验,数据拟合采用Excel 2007和Origin 8.0等软件进行处理。
2 结果与分析
2.1 不同分子质量水溶性半纤维素功能基团分析
玉米麸皮水溶性半纤维素CBH-L和CBH-H的红外光谱图如图1所示。3 398和3 391 cm-1处的吸收峰为O—H键的伸缩振动峰[15], 2 901和2 931 cm-1处的吸收峰为烷基中的C—H键非对称伸缩振动峰[16],1 600和1 577 cm-1处的吸收峰为羧基中的C![]() O键反对称伸缩振动和对称伸缩振动,表明样品中存在糖醛酸[17]。在1 412 cm-1处的吸收峰为羧酸盐的对称伸缩振动[17]。1 151~996 cm-1处是阿拉伯木聚糖的典型波段[18]。
O键反对称伸缩振动和对称伸缩振动,表明样品中存在糖醛酸[17]。在1 412 cm-1处的吸收峰为羧酸盐的对称伸缩振动[17]。1 151~996 cm-1处是阿拉伯木聚糖的典型波段[18]。
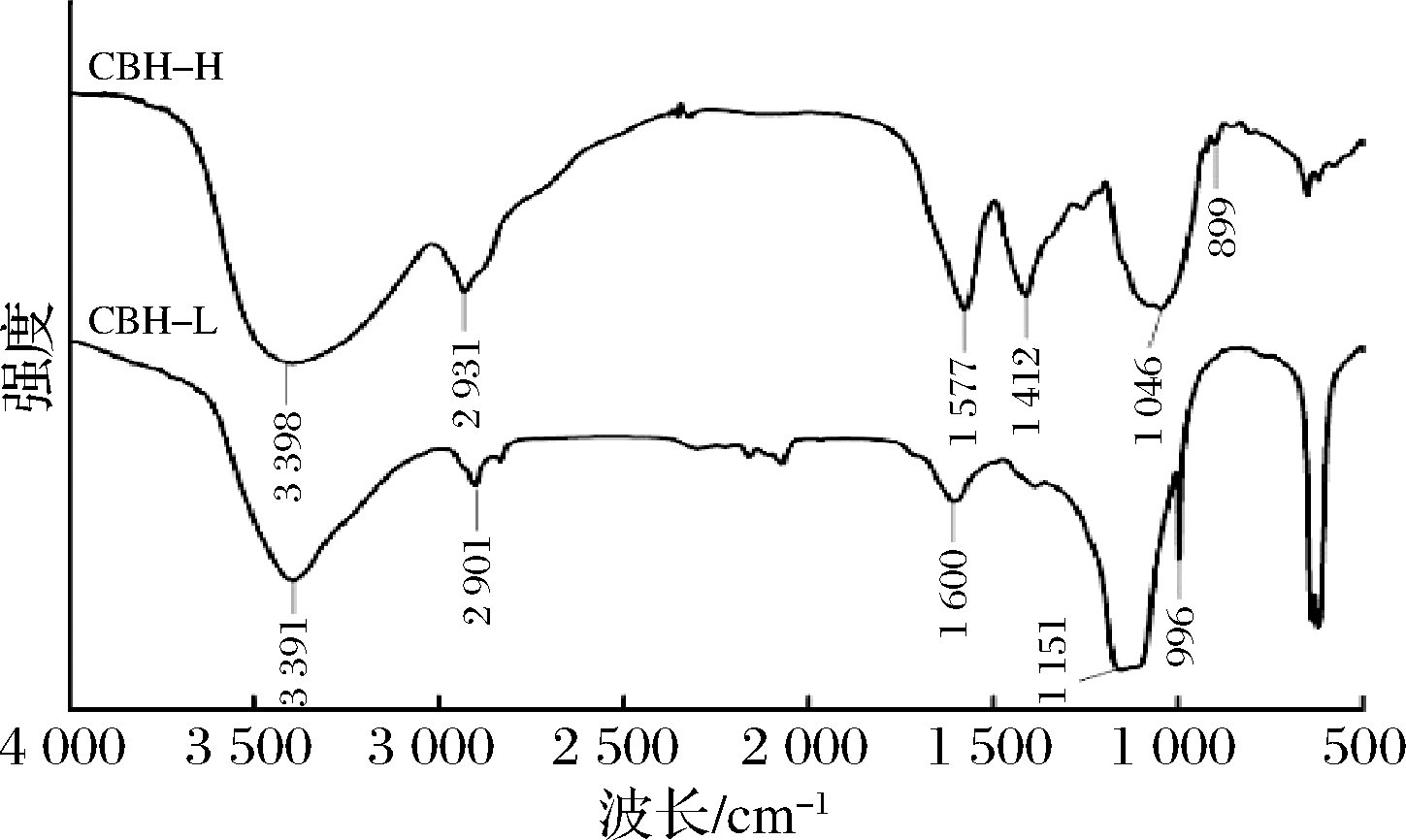
图1 两种分子质量半纤维素红外图谱
Fig.1 FT-IR spectra of two molecular weight hemicelluloses
2.2 水溶性半纤维素分子质量及单糖组分分析
玉米麸皮半纤维素CBH-L和CBH-H的分子质量测定结果如表1所示。其分子质量分别为1.9×103和5.1×105 Da,与实验室前期制得半纤维素分子量结果一致[11]。半纤维素的分子质量分散度用Mw/Mn表示,CBH-H的分子质量分布更宽,CBH-L的分子质量相对分布更为均匀[11,19]。
表1 玉米麸皮水溶性半纤维素分子质量
Table 1 Molecular weight of corn bran hemicelluloses
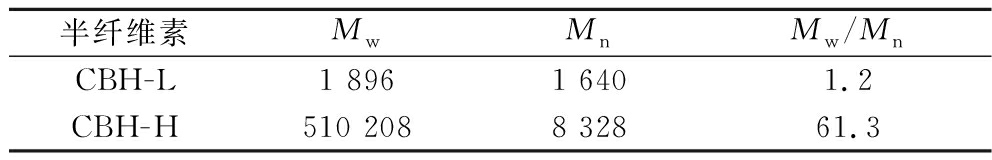
半纤维素MwMnMw/MnCBH-L1 8961 6401.2CBH-H510 2088 32861.3
玉米麸皮半纤维素CBH-L和CBH-H的单糖组分结果如表2所示。Ara/Xyl(阿拉伯糖基与木糖基的比值)表示半纤维素的侧链取代度。据报道,禾本科植物的半纤维素主要是由β-1,4糖苷键连成的木糖链状分子,如4-O-甲基葡萄糖醛酸阿拉伯木聚糖,而碱液提取可破坏阿拉伯糖基与木糖的连接[4,20]。CBH-L的侧链取代度0.72高于CBH-H的侧链取代度0.66,这表明,通过酶解法可得到高支链度的CBH样品。
表2 玉米麸皮水溶性半纤维素的单糖组成
Table 2 Monosaccharide composition of CBH
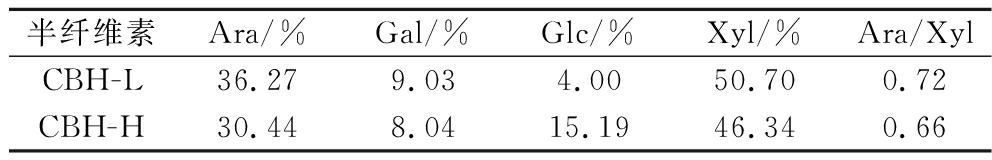
半纤维素Ara/%Gal/%Glc/%Xyl/%Ara/XylCBH-L36.279.034.0050.700.72CBH-H30.448.0415.1946.340.66
2.3 不同分子质量水溶性半纤维素表面形貌观察
CBH的形貌结构如图2所示。CBH-H冻干后聚集体形态呈片状,具有一定的孔隙结构;与CBH-H相比,CBH-L干燥后聚集体结构更为松散,且出现更多的碎片状结构,形状不规则。这是由于半纤维素酶酶解后,大分子的CBH降解,分子链被切断,导致其干燥后聚集体结构尺寸变小、结构变松散。

a-CBH-L形貌结构;b-CBH-H形貌结构
图2 CBH形貌结构图
Fig.2 CBH morphology and structure diagram
2.4 水溶性半纤维素的流变学特性分析
2.4.1 剪切速率对CBH水溶液表观黏度的影响
剪切速率对不同质量分数半纤维素的表观黏度影响如图3所示。在一定温度下,不同质量分数的CBH-L和CBH-H水溶液的表观黏度均随着剪切速率的升高而降低,且出现 “剪切稀化”现象。在剪切速率0~10 s-1内,表观黏度急剧下降,随后快速进入稳定状态。这种现象是由于剪切速率增大,水溶液中的多糖分子链自主定向排列,彼此间摩擦力降低,从而表现出更低的表观黏度[21]。与CBH-L相比,CBH-H表现出更高的表观黏度,且随着浓度的升高,CBH-H水溶液稳定状态时的黏度也在升高,这种差异主要是由于CBH-H的分子质量远高于CBH-L。
该结果表明,不同质量分数的CBH-L和CBH-H水溶液均具有一定的抗剪切性,可用于饮料或调味料等多种液体食品等生产加工[22]。

a-CBH-L水溶液;b-CBH-H水溶液
图3 CBH水溶液表观黏度随剪切速率的变化
Fig.3 The viscosity of CBH solution varies with shear rate
幂律定律t=Kγn常用来描述流体的剪切变稀行为。式中,τ为剪切应力(Pa)、K为黏度系数(Pa·sn)、γ为剪切速率(1/s)、n为幂律指数。当n<1时,流体为假塑性流体,表现为剪切稀化行为,且n值越小,越偏离牛顿流体,剪切变稀性质越显著[23]。
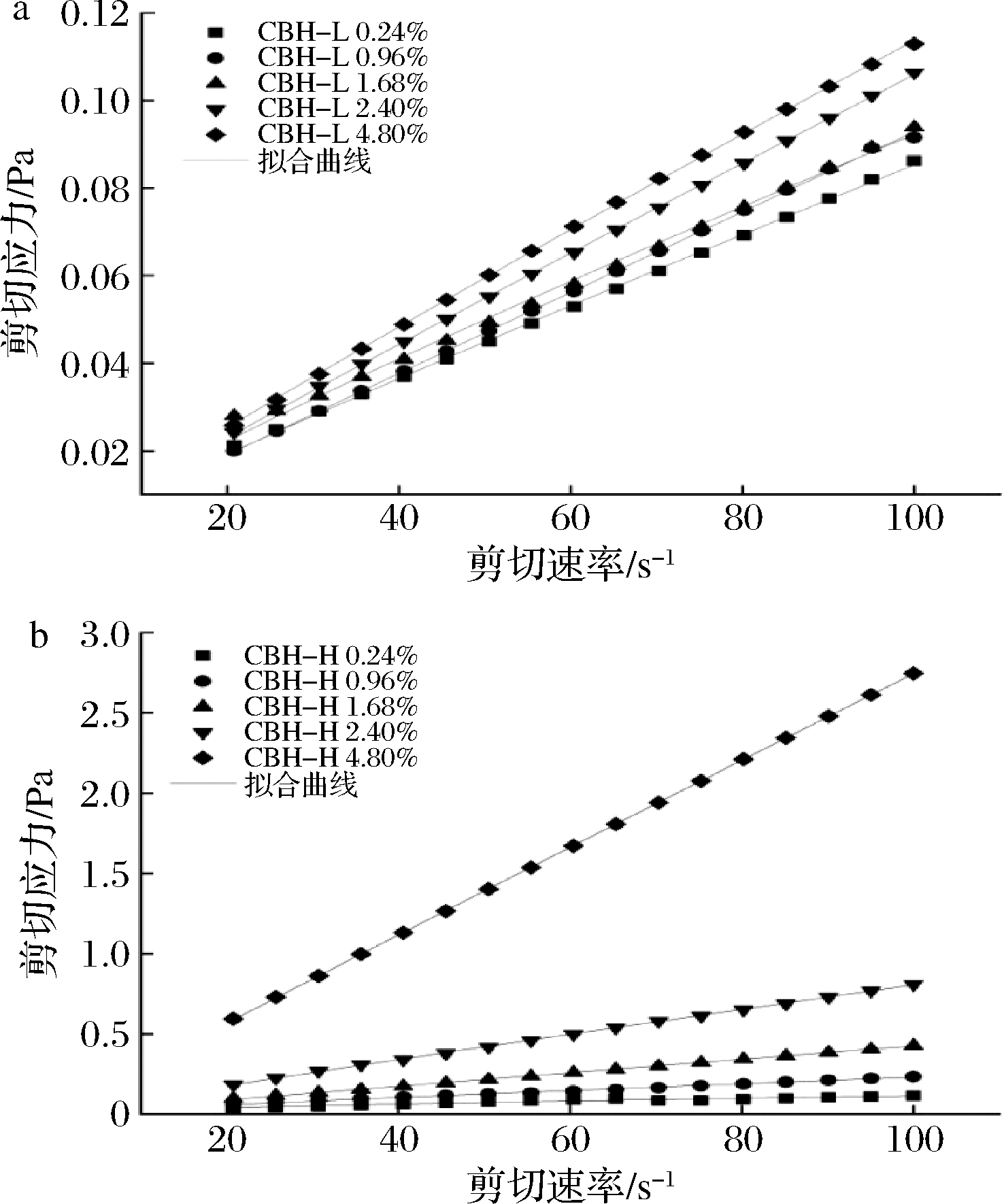
对不同质量分数的CBH-L和CBH-H水溶液进行幂律拟合,选取剪切速率范围20~100 s-1的应力-剪切速率进行幂律拟合,拟合曲线如图4所示,幂律方程拟合参数结果如表3所示。
a-CBH-L水溶液;b-CBH-H水溶液
图4 CBH水溶液的剪切应力随剪切速率的变化及拟合曲线
Fig.4 The variation of shear stress with shear rate in CBH aqueous solution and its fitting curve
表3 CBH水溶液流动曲线的幂律方程拟合参数
Table 3 Power law equation fitting parameters of CBH aqueous solution flow curve
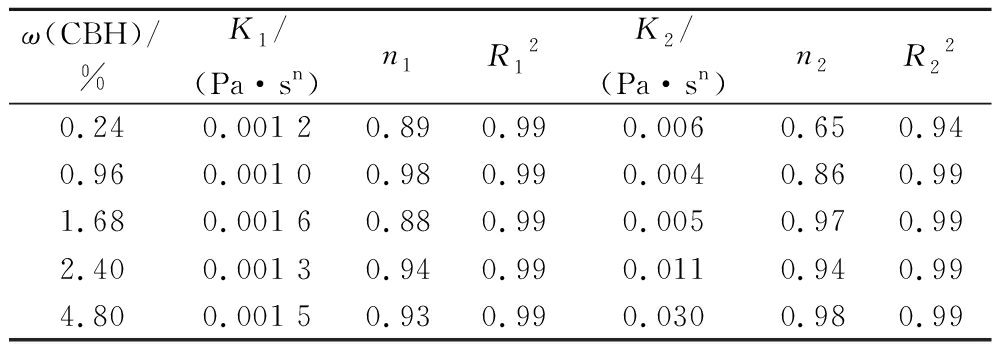
ω(CBH)/%K1/(Pa·sn)n1R12K2/(Pa·sn)n2R220.240.001 20.890.990.0060.650.940.960.001 00.980.990.0040.860.991.680.001 60.880.990.0050.970.992.400.001 30.940.990.0110.940.994.800.001 50.930.990.0300.980.99
注:下标1为CBH-L水溶液;下标2为CBH-H水溶液。
由表3可知,CBH-L和CBH-H的幂律指数n均低于1.0,说明2种分子质量的半纤维素水溶液均为假塑性流体,会产生剪切稀化现象。此外,结合图3和图4,剪切应力随样品质量分数的升高而增大,与黏度变化表现一致,说明样品存在较强的质量分数依赖性[24]。
2.4.2 温度对CBH水溶液表观黏度的影响
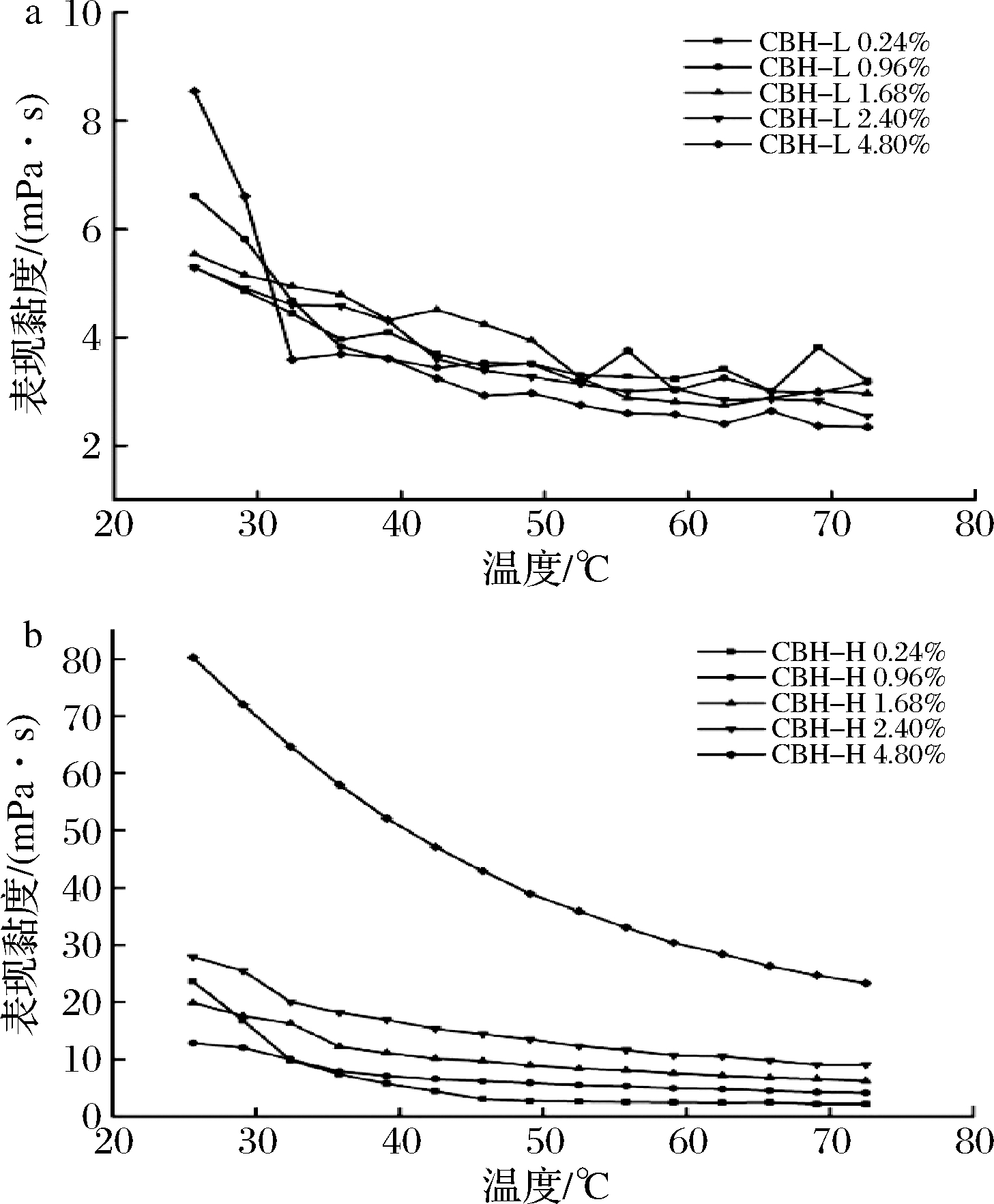
温度对不同质量分数CBH水溶液表观黏度的影响如图5所示。在一定剪切速率作用下,不同质量分数的CBH-L和CBH-H水溶液的表观黏度随温度的升高而降低,且随着质量分数升高,黏度下降加快。由于在升温过程中,CBH分子热运动随温度升高而加快,分子间相互作用力减弱,多糖分子间的黏滞阻力也随之下降,从而表现为CBH水溶液的黏度下降[25]。在质量分数从2.4%提高至4.8%时,两种样品黏度下降速度均加快,说明低质量分数CBH水溶液受温度变化影响小,更有利于在食品热加工过程中的应用。
a-CBH-L水溶液;b-CBH-H水溶液
图5 CBH水溶液的表观黏度随温度的变化
Fig.5 The viscosity of CBH aqueous solution varies with temperature
2.4.3 恒定剪切速率对CBH水溶液表观黏度的影响
50 s-1可用于模拟胃肠道蠕动时引起的剪切力,且该剪切速率可模拟流体食物在容器中被轻微搅动时受到的剪切作用[26]。不同分子质量CBH在50 s-1的剪切速率下的表观黏度如图6所示。
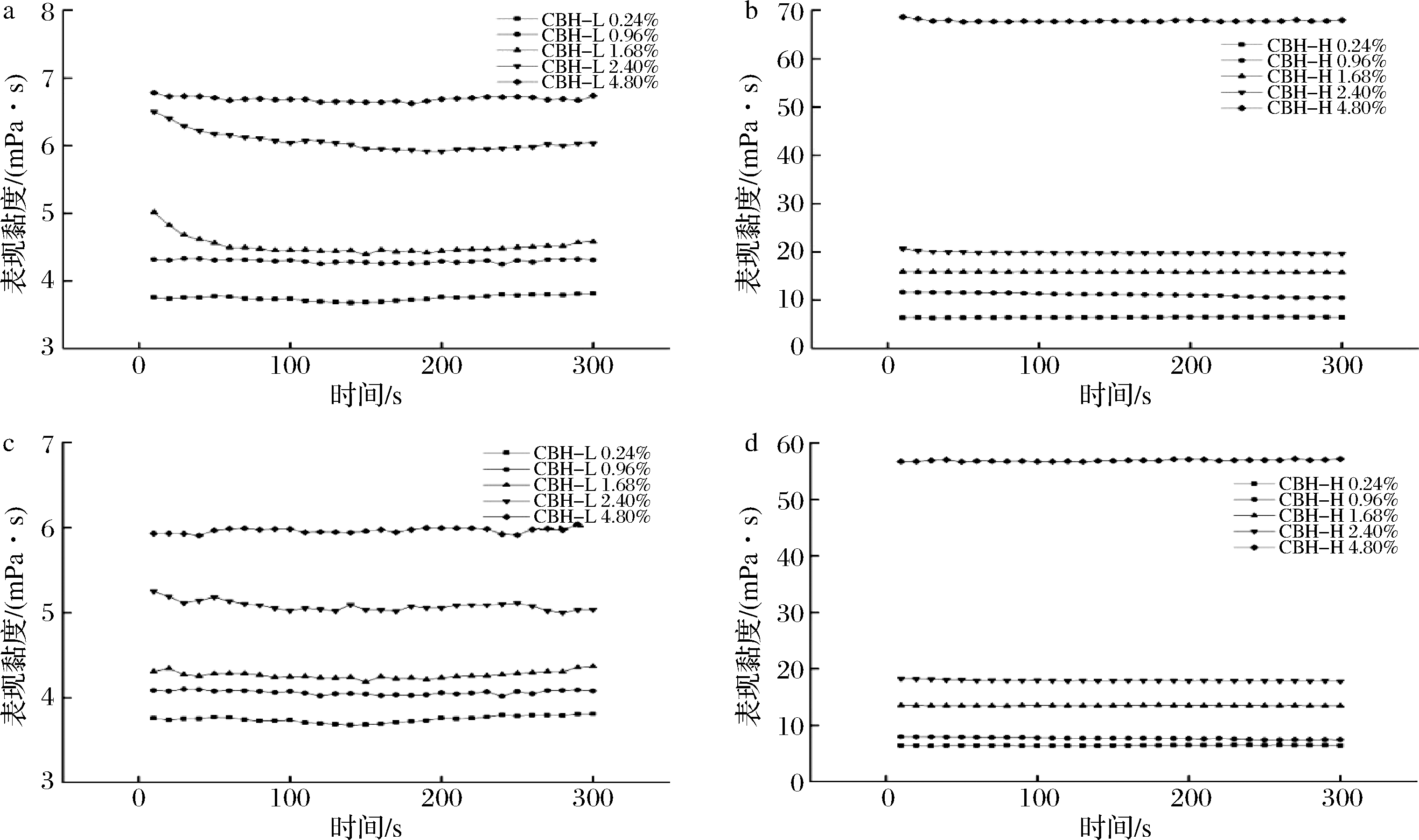
a-25 ℃时CBH-L水溶液;b-25 ℃时CBH-H水溶液;c-37 ℃时CBH-L水溶液;d-37 ℃时CBH-H水溶液
图6 CBH水溶液的表观黏度随时间的变化
Fig.6 The viscosity of CBH aqueous solution varies with time
CBH水溶液的表观黏度随剪切时间的延长变化不明显,无明显的剪切时间依赖性,且随着分子质量、质量分数的升高,黏度也随之增大。用剪切速率50 s-1、温度37 ℃模拟胃肠道蠕动环境,如图6-c、图6-d可得,此环境下的CBH水溶液的表观黏度降低,但黏度变化仍与其分子质量、质量分数有关。
2.5 CBH对淀粉消化的影响
2.5.1 不同质量分数CBH对小麦淀粉消化率的影响
RDS在口腔和小肠中可以迅速被消化,为酶解开始后20 min消化淀粉的量;SDS指在人体小肠中能够完全消化,但速度较缓慢,为酶解开始后20~120 min内消化淀粉量;RS是120 min后水解淀粉与总淀粉的差值[13]。
不同质量分数CBH对小麦淀粉体外消化率的影响结果如表4所示。在小麦淀粉中加入CBH-L,小麦淀粉RDS比例下降,当CBH-L质量分数低于2.4%时,RDS比例与小麦原淀粉差异不显著,当质量分数≥2.4%时,RDS比例与原淀粉相比最高可降低19.0%;小麦淀粉SDS比例随CBH-L含量增加呈下降趋势,但和小麦原淀粉比较差异不显著,SDS比例最高可降低5.6%;当CBH-L质量分数≥1.68%时,RS比例与原淀粉相比显著增加,最高可增加36.5%。
表4 不同浓度CBH对小麦淀粉体外消化率的影响
Table 4 Effects of different concentration of CBH on digestibility of wheat starch in vitro
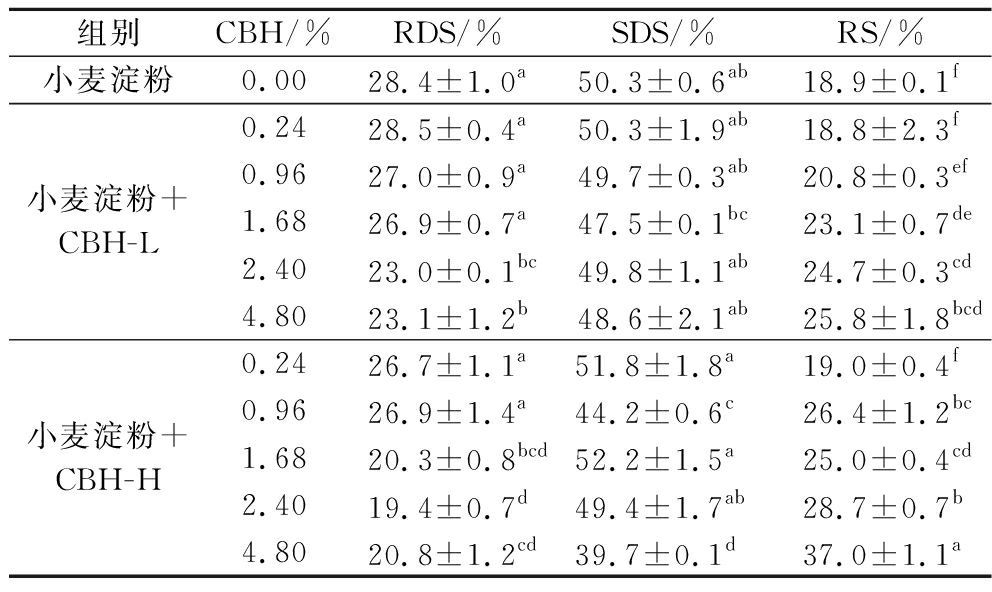
组别CBH/%RDS/%SDS/%RS/%小麦淀粉0.0028.4±1.0a50.3±0.6ab18.9±0.1f小麦淀粉+CBH-L0.2428.5±0.4a50.3±1.9ab18.8±2.3f0.9627.0±0.9a49.7±0.3ab20.8±0.3ef1.6826.9±0.7a47.5±0.1bc23.1±0.7de2.4023.0±0.1bc49.8±1.1ab24.7±0.3cd4.8023.1±1.2b48.6±2.1ab25.8±1.8bcd小麦淀粉+CBH-H0.2426.7±1.1a51.8±1.8a 19.0±0.4f0.9626.9±1.4a44.2±0.6c26.4±1.2bc1.6820.3±0.8bcd52.2±1.5a25.0±0.4cd2.4019.4±0.7d49.4±1.7ab28.7±0.7b4.8020.8±1.2cd39.7±0.1d37.0±1.1a
注:同一列不同上标字母表示差异显著(P<0.05)。
在小麦淀粉中加入CBH-H,小麦淀粉中RDS比例下降,当CBH-H质量分数低于1.68%时,RDS比例与小麦原淀粉相比无显著差异,随着CBH-H质量分数增加,小麦淀粉中RDS比例最高可降低31.7%。加入0.24%和1.68% CBH-H后,SDS比例与原淀粉相比无显著变化。CBH-H质量分数为4.8%时,小麦淀粉SDS比例降低最多,与原淀粉相比降低了21.1%;此时小麦淀粉RS比例显著增加,增加了95.8%。
结果表明,较低质量分数的CBH对小麦淀粉的消化性无明显的抑制作用;在相同质量分数下,CBH-H提高小麦淀粉RS比例的效果优于CBH-L。CBH的分子质量是影响淀粉消化性的因素之一。结合图6-c、图6-d,在模拟胃肠道蠕动的环境中,随着CBH分子质量增大、水溶液质量分数升高,CBH表观黏度也随之上升。因此,我们推测CBH水溶液的黏度也是调控小麦淀粉消化的重要因素。
2.5.2 胃肠道中表观黏度与淀粉抗性比例的构效关系
对CBH表观黏度和RS比例进行Pearson相关性分析,结果发现二者具有显著的正相关关系,相关系数R=0.89(P<0.1)。
CBH-H和CBH-L在胃肠体系中的表观黏度与小麦淀粉RS比例之间的关系如图7所示。在CBH-H和CBH-L的质量分数分别为0.24%、0.96%、1.68%、2.4%、4.8%时,其在胃肠蠕动时的表观黏度与RS比例之间存在一定非线性关系,且均满足对数方程:y=a×ln(x)+b。当CBH水溶液质量分数升高、黏度增大,RS比例上升速率逐渐减缓,说明黏度作用逐渐达到极限。
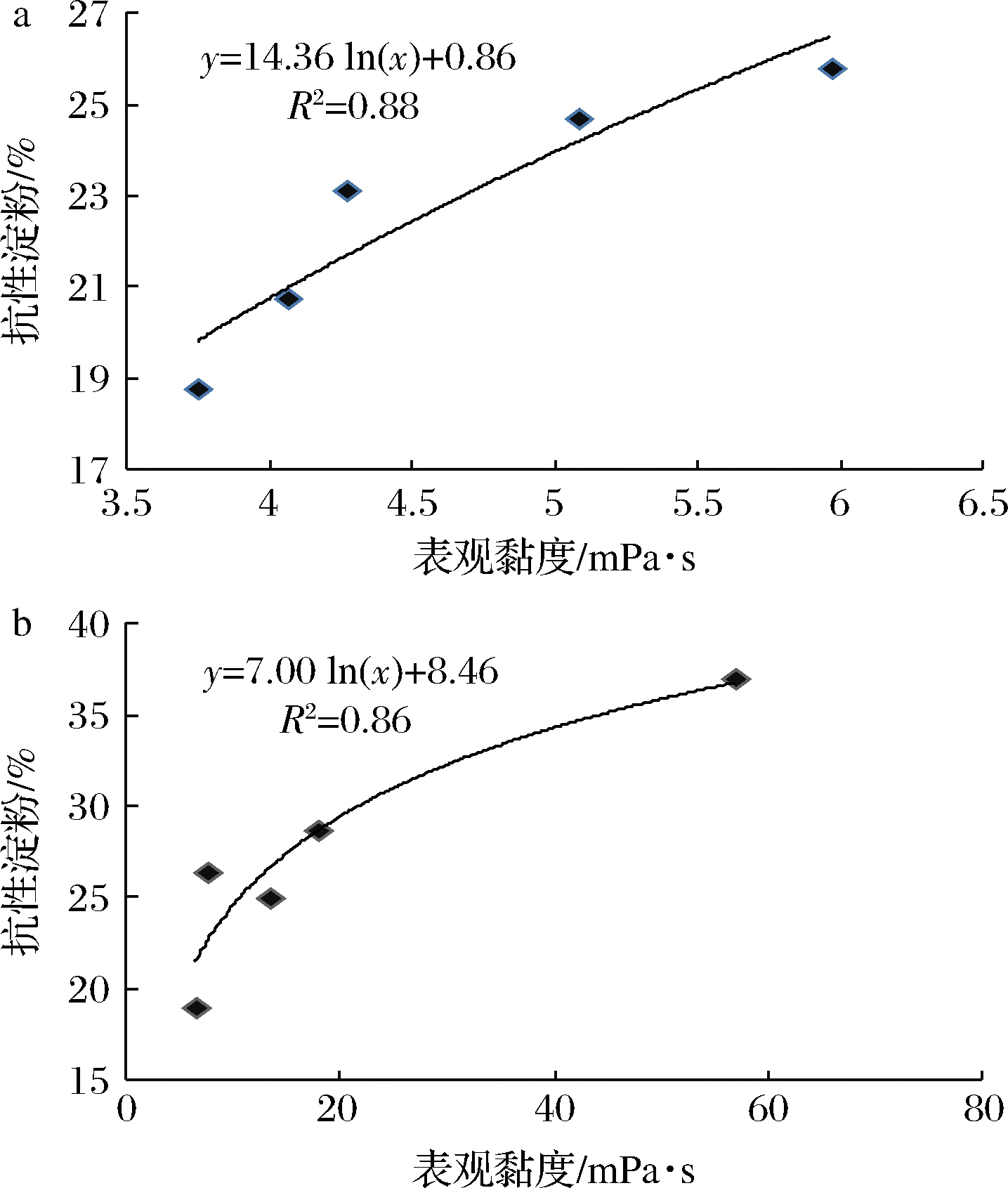
a-CBH-L水溶液;b-CBH-H水溶液
图7 CBH在胃肠中的表观黏度与淀粉抗性比例的关系
Fig.7 Relationship between viscosity of CBH and starch resistance ratio in gastrointestinal tract
3 结论
通过酶法与化学法分别研制获得分子质量为1.9×103和5.1×105 Da的水溶性半纤维素CBH-L和CBH-H。CBH-L和CBH-H均具有半纤维素典型特征,且CBH-L支链度更高。扫描电镜结果表明CBH-L和CBH-H干燥后聚集体尺寸和结构与其分子质量有关,分子质量越低,聚集体尺寸越小,结构越松散。不同质量分数的两种半纤维素水溶液均表现出良好的抗剪切性,且低质量分数半纤维素水溶液具有一定的温度抗逆性。CBH-H和CBH-L均可通过降低RDS和SDS比例,增加RS比例来改变淀粉消化,从而达到抑制淀粉消化的目的,且RS比例的上升与半纤维素分子质量及黏度成正相关关系,水溶性半纤维素的黏度是抑制淀粉消化的重要因素。具有抑制淀粉消化作用的水溶性半纤维素可以作为功能性原料应用在面制品、固体饮料和佐餐饮品。
[1] LUDWIG D S.The glycemic index:Physiological mechanisms relating to obesity, diabetes, and cardiovascular disease[J].JAMA, 2002, 287(18):2 414-2 423.
[2] RAGHAVENDRA S, RASTOGI N, RAGHAVARAO K, et al.Dietary fiber from coconut residue:Effects of different treatments and particle size on the hydration properties[J].European Food Research and Technology, 2004, 218:563-567.
[3] 张力田,罗志刚.碳水化合物化学[M].北京:中国轻工业出版社, 2013:441-443.
ZHANG L T, LUO Z G.Carbohydrate Chemistry[M].Beijing:China Light Industry Press, 2013:441-443.
[4] HANSEN N M L, PLACKETT D.Sustainable films and coatings from hemicelluloses:A review[J].Biomacromolecules, 2008, 9(6):1 493-1 505.
[5] REGAND A, CHOWDHURY Z, TOSH S M, et al.The molecular weight, solubility and viscosity of oat beta-glucan affect human glycemic response by modifying starch digestibility[J].Food Chemistry, 2011, 129(2):297-304.
[6] RADOVANOVIC A, STOJCESKA V, PLUNKETT A, et al.The use of dry Jerusalem artichoke as a functional nutrient in developing extruded food with low glycaemic index[J].Food Chemistry, 2015, 177:81-88.
[7] 吴其晔,巫静安.高分子材料流变学[M].北京:高等教育出版社, 2002:130-145.
WU Q Y, WU J A.Polymer Rheology[M].Beijing:Higher Education Press, 2002:130-145.
[8] 姜莹, 周雅婷.明胶分子量与黏度的关系[J].明胶科学与技术, 2010, 30(3):132-135.
JIANG Y, ZHOU Y T.Relationship between molecular weight and viscosity of gelatin[J].The Science and Technology of Gelatin, 2010, 30(3):132-135.
[9] NSOR-ATINDANA J, ZHONG F, MOTHIBE K J.In vitro hypoglycemic and cholesterol lowering effects of dietary fiber prepared from cocoa (Theobroma cacao L.) shells[J].Food &Function, 2012, 3(10):1 044-1 050.
[10] 薛战锋,郭玉蓉,付成程,等.半纤维素酶法对苹果肉渣膳食纤维的提取[J].天然产物研究与开发, 2013, 25(11):1 474-1 479.
XUE Z F, GUO Y R, FU C C, et al.Extraction of dietary fiber from apple flesh pomace using hemicellulase[J].Natural Product Research and Development, 2013, 25(11):1 474-1 479.
[11] 张嘉茜,刘思源,王鹏杰,等.不同分子量水溶性半纤维素对面包品质的影响[J].甘肃农业大学学报, 2023, 58(1-2).
ZHANG J X, LIU S Y, WANG P J, et al.Effect of hemicellulose with different molecular weight on bread quality[J].Journal of Gansu Agricultural University, 2023, 58(1-2).
[12] ILANGOVAN M, GUNA V, PRAJWAL B, et al.Extraction and characterisation of natural cellulose fibers from Kigelia africana[J].Carbohydrate Polymers, 2020, 236:115996.
[13] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(Suppl 2):S33-S50.
[14] 李智, 艾连中, 丁文宇, 等.可溶性膳食纤维对玉米淀粉体外消化的抑制作用[J].食品工业科技, 2019, 40(19):1-6;12.
LI Z, AI L Z, DING W Y, et al.Inhibitory effects of soluble dietary fibers on the in vitro digestion of corn starch[J].Science and Technology of Food Industry, 2019, 40(19):1-6;12.
[15] 陈雪峰, 张振华, 王锐平.苹果膳食纤维中半纤维素的化学组成[J].食品与发酵工业, 2010, 36(1):77-80.
CHEN X F, ZHANG Z H, WANG R P.Chemical composition of hemicellulose in apple dietary fiber[J].Food and Fermentation Industries, 2010, 36(1):77-80.
[16] 李蕊, 杨桂花, 吕高金, 等.玉米秸秆半纤维素的逐级分离及其结构表征[J].中国造纸学报, 2017, 32(3):1-6.
LI R, YANG G H, LYU G J, et al.Separation and characterization of hemicelluloses of corn stalks[J].Transactions of China Pulp and Paper, 2017, 32(3):1-6.
[17] ZHOU J, ZHANG J, LI H M, et al.Extraction of hemicellulose from corn stover by KOH solution pretreatment and its characterization[J].Advanced Materials Research, 2013, 821-822:1 065-1 070.
[18] XU F, SUN J X, GENG Z C, et al.Comparative study of water-soluble and alkali-soluble hemicelluloses from perennial ryegrass leaves (Lolium peree)[J].Carbohydrate Polymers, 2007, 67(1):56-65.
[19] 胡卫珍,齐振宇,陈晓芳,等.凝胶渗透色谱联用多角度激光光散射测定铁皮石斛多糖分子量及其分布[J].浙江农业科学, 2020, 61(6):1166-1167;1175.
HU W Z, QI Z Y, CHEN X F, et al.Determination of molecular weight and distribution of polysaccharide from dendrobium officinale by gel permeation chromatography combined with multi-angle laser light scattering[J].Journal of Zhejiang Agricultural Sciences, 2020, 61(6):1166-1167;1175.
[20] 杨莎. 碱提阿拉伯木聚糖对小麦面团及其组分特性的影响[D].无锡:江南大学, 2017.
YANG S.Effects of alkaline extractable Arabinoxylan on wheat dough and dough components properties[D].Wuxi:Jiangnan University, 2017.
[21] YU F Y, ZHANG F, LUAN T, et al.Rheological studies of hyaluronan solutions based on the scaling law and constitutive models[J].Polymer, 2014, 55(1):295-301.
[22] 黄政.水溶性抗性糊精的性质及其对面粉加工品质的影响[D].广州:华南理工大学, 2019.
HUANG Z.Properties of water-soluble resistant dextrin and its effects on the processing quality of flour products[D].Guangzhou:South China University of Technology, 2019.
[23] 史铁钧,吴德峰.高分子流变学基础[M].北京:化学工业出版社, 2009:27-30.
SHI T J, WU D F.Fundamentals of Polymer Rheology[M].Beijing:Chemical Industry Press, 2009:27-30.
[24] 贾丰, 刘冬, 郭玉蓉, 等.发酵对苹果渣多糖流变性的影响[J].食品科学, 2017, 38(14):106-111.
JIA F, LIU D, GUO Y R, et al.Effect of fermentation on rheology of apple pomace polysaccharides[J].Food Science, 2017, 38(14):106-111.
[25] FARHOOSH R, RIAZI A.A compositional study on two current types of salep in Iran and their rheological properties as a function of concentration and temperature[J].Food Hydrocolloids, 2007, 21(4):660-666.
[26] LIU Y, WANG S W, KANG J, et al.Arabinoxylan from wheat bran:Molecular degradation and functional investigation[J].Food Hydrocolloids, 2020, 107:105914.