熊果酸是一种五环三萜类小分子化合物,因具有较强的抗氧化、抗炎和抗肿瘤等药理作用而被广泛关注[1-2]。但由于熊果酸具有极低的水溶性和生物利用度而使其在功能性食品中的应用受限[3]。近年来,壳聚糖纳米粒子包埋生物活性物质不仅可以提高活性物质稳定性,还可以调控被包埋活性物质的释放速率和生物利用度[4],因此,被广泛用于纳米粒子的载体。如张晓明等[5]利用聚电解质复合凝聚法原理,壳聚糖和海藻酸钠为壁材,包埋多孔淀粉为芯材载体吸附的茶树精油,结果表明该微胶囊具有一定的缓释性能,且提高了茶树精油的储存稳定性。李嫄等[6]通过体外释放和药代动力学实验研究了壳聚糖包埋的姜黄素脂质体中姜黄素的释放行为,结果表明壳聚糖包覆的姜黄素脂质体可以显著改善姜黄素的体外释放行为,提高其生物利用度。以上研究提示,壳聚糖是负载活性成分的优良载体。但是,目前关于壳聚糖纳米粒子改善熊果酸稳定性及其抗氧化活性的研究鲜有报道。
为了实现熊果酸在胃肠内的缓释效果,增加熊果酸的生物利用率,本文采用具有反应条件简单温和、方便、无毒等优点[7]的离子凝胶法制备熊果酸壳聚糖纳米粒子,并评价了熊果酸纳米粒子在贮藏条件及模拟胃肠消化液条件下的稳定性及抗氧化活性,旨在为熊果酸纳米粒子在功能性食品中的应用提供参考。
1 材料与方法
1.1 材料与试剂
熊果酸(纯度≥98%),成都普瑞法科技发展有限公司;壳聚糖(脱乙酰化≥90.0%),上海蓝季科技发展有限公司;三聚磷酸钠(分析纯),天津市风船化学试剂科技有限公司;吐温-80(分析纯),天津市德恩化学试剂有限公司;胃蛋白酶(1∶30 000)、胰蛋白酶(BR,1∶250)、胆盐(胆盐含量≥60%),上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),上海蓝季科技发展有限公司。其余试剂均为分析纯。
1.2 仪器与设备
SHZ-D(Ⅲ)型循环水式真空泵,巩义市予华仪器有限责任公司;KQ-500DE型数控超声波清洗器,昆山市超声仪器有限公司;UV-2600型紫外可见分光光度计,岛津(中国)分析检测仪器有限公司;HJ-6A型数显磁力加热搅拌器,常州普天仪器制造有限公司;TG16-WS型台式高速离心机,湖南湘仪实验室仪器开发有限公司;HSP-150B型恒温恒湿箱,上海坤天实验室仪器有限公司。
1.3 熊果酸壳聚糖纳米粒子的制备
按参考文献[8],根据离子凝胶法的原理制备熊果酸纳米粒子。以壳聚糖为壁材,壳聚糖溶于水中,加入吐温-80,充分搅拌,按照壳聚糖与熊果酸质量比4∶1加入适量溶于乙醇中的熊果酸溶液,搅拌30 min,以壳聚糖与三聚磷酸钠质量比4∶1向溶液中加入三聚磷酸钠溶液,搅拌后获得熊果酸纳米粒子悬浮液。离心并充分洗涤沉淀物,沉淀物用冷冻干燥、微波冷冻干燥和喷雾干燥3种干燥方式干燥[9],将纳米粒子粉末储存在干燥器中直至分析。
1.4 体外模拟消化试验测定壳聚糖纳米粒子中熊果酸释放率
参考文献[10]和[11]。取浓盐酸溶于去离子水中,加入适量胃蛋白酶,充分溶解,定容,配制成胃蛋白酶溶液。称取不同干燥方式制备得到的负载熊果酸的壳聚糖纳米粒子和熊果酸,加入离心管中,用PBS缓冲液溶解,加入CaCl2,用HCl溶液调节pH值,加入胃消化液,置于37 ℃,100 r/min的恒温摇床振荡处理2 h。在5、10、20、30、60、90、120 min时间点吸取500 μL消化液,同时补充相应体积的胃消化液。用NaHCO3溶液调节PBS缓冲液pH,取胆盐和胰蛋白酶混合溶解,配制成模拟肠液。模拟胃消化2 h后取出样液,5 000 r/min离心15 min,倒出上清液,加入模拟肠液,继续在37 ℃,100 r/min的恒温摇床振荡处理3 h,在5、10、20、30、60、90、120、150、180 min时间点吸取500 μL消化液,同时补充相应体积的肠消化液。取出的样品消化液10 000 r/min离心15 min,上清液在-40 ℃冷冻贮存备用,用紫外分光光度计测定上清液中熊果酸含量,熊果酸释放率按公式(1)计算:
熊果酸释放率![]()
(1)
式中:m0,释放到模拟胃肠液中的熊果酸质量,mg;m,壳聚糖纳米粒子中的熊果酸质量,mg。
1.5 熊果酸壳聚糖纳米粒子体外消化中的抗氧化活性变化
DPPH自由基清除能力的测定参考雷雨晴等[12]的方法稍作修改。将4 mg DPPH溶解在100 mL乙醇溶液中得到DPPH乙醇溶液。取100 μL体外消化样品溶液加到1 900 μL DPPH乙醇溶液,避光反应30 min后,在517 nm处测量吸光度。以维生素C浓度为横坐标,以清除率为纵坐标,绘制标准曲线,得到的回归方程为y=32.148x+0.127 3,R2=0.994 5。根据公式(2)计算体外消化过程中熊果酸清除DPPH自由基能力:
DPPH自由基清除率![]()
(2)
式中:As,样品与DPPH乙醇溶液混合后的吸光度值;A0,DPPH乙醇溶液的吸光度值。
1.6 熊果酸壳聚糖纳米粒子贮藏稳定性
1.6.1 温度对熊果酸壳聚糖纳米粒子贮藏期间熊果酸含量的影响
称取相同质量的通过不同干燥方式制备的熊果酸纳米粒子和熊果酸分别放置于4、25、37 ℃下,避光保存28 d,每隔7 d取样测定样品中熊果酸含量,按公式(3)计算熊果酸保留率[13]:
熊果酸保留率![]()
(3)
式中:m1,贮存一段时间后纳米粒子中熊果酸质量,mg;m2,贮存前纳米粒子中熊果酸质量,mg。
1.6.2 温度对熊果酸壳聚糖纳米粒子贮藏期间抗氧化活性的影响
称取一定量的贮存在不同温度条件下的通过不同干燥方式制备的熊果酸壳聚糖纳米粒子和熊果酸,加入相同体积的乙醇溶解,在超声功率300 W条件下超声10 min,12 000 r/min离心15 min,取适量样品溶液测定熊果酸的DPPH自由基清除能力。
1.6.3 光照对熊果酸壳聚糖纳米粒子中熊果酸含量的影响
称取相同质量的通过不同干燥方式制备的熊果酸壳聚糖纳米粒子和熊果酸分别放置于避光和自然光下,室温下保存28 d,每隔7 d取样测定样品中熊果酸含量,计算熊果酸保留率。
1.6.4 光照对熊果酸壳聚糖纳米粒子中抗氧化活性的影响
称取一定量的贮存在避光和自然光条件下的通过不同干燥方式制备的熊果酸壳聚糖纳米粒子和熊果酸,加入相同体积的乙醇进行溶解,在超声功率300 W条件下超声10 min,12 000 r/min 离心15 min,取适量样品溶液测定熊果酸的DPPH自由基清除能力。
1.7 数据统计及分析
每组试验平行进行3次,使用Origin 2017软件对试验数据进行分析,为了确定组样本之间的显著差异,置信区间选择为95%(P<0.05)。
2 结果与讨论
2.1 熊果酸壳聚糖纳米粒子模拟体外消化过程中的熊果酸释放率
由图1可知,在胃消化阶段,胃蛋白酶对熊果酸和熊果酸纳米粒子影响较小,在模拟胃液中都较稳定,熊果酸释放量较少。冷冻干燥、微波冷冻干燥和喷雾干燥制备的熊果酸纳米粒子在胃消化阶段的熊果酸释放率分别为8.4%、6.4%和6.9%,这可能是因为壳聚糖-三聚磷酸钠壁材在酸性条件下比较稳定,熊果酸纳米粒子因而具有较高的稳定性。在肠消化阶段,熊果酸和熊果酸纳米粒子的变化均非常明显。对于熊果酸而言,在肠消化开始的50 min内释放率显著提高,之后一直呈现上升的趋势,说明熊果酸在肠液环境中的稳定性较差。熊果酸纳米粒子在肠消化阶段开始也出现熊果酸显著释放,可能是因为熊果酸与壳聚糖-三聚磷酸钠结合时被嵌在壁材表层,遇到碱性环境时使熊果酸剥离下来[14]。在肠消化阶段,不同干燥方式制备的熊果酸纳米粒子的熊果酸释放率变化明显。肠消化阶段熊果酸释放率排序为冷冻干燥(59%)>微波冷冻干燥(55%)>喷雾干燥(50%)。可能是因为不同干燥制备熊果酸纳米粒子过程中水的存在导致纳米粒子团聚程度不同,干燥温度不同导致团聚程度不同,从而导致粒径不同[15],因而纳米粒子具有的比表面积不同,从而肠消化液中熊果酸的释放率存在差异。
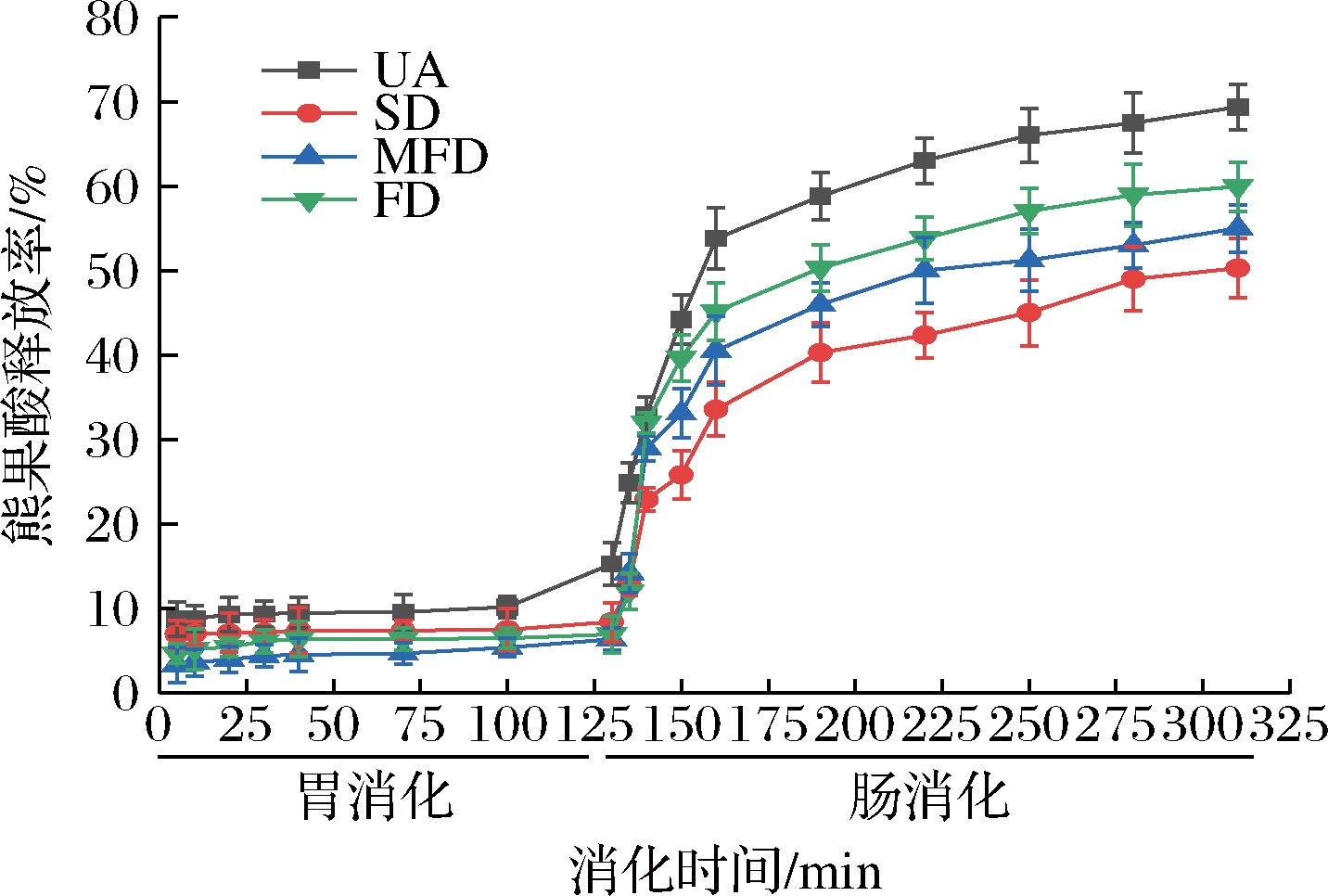
图1 熊果酸和熊果酸纳米粒子在模拟胃、肠体系中的稳定性
Fig.1 Stability of UA and UA loaded chitosan nanoparticles in SGF and SIF models
2.2 熊果酸壳聚糖纳米粒子体外消化中的抗氧化活性
由图2可知,熊果酸和不同干燥方式制备的壳聚糖熊果酸纳米粒子在模拟胃肠液中的清除DPPH自由基能力具有显著性差异。经过包埋的熊果酸纳米粒子清除DPPH自由基能力明显高于未经包埋的熊果酸,可能是因为熊果酸经过包埋之后稳定性增加,清除DPPH自由基的能力更强。熊果酸和熊果酸纳米粒子在肠消化阶段的抗氧化活性均高于胃消化阶段,可能是胰蛋白酶处理使得纳米粒子中的熊果酸充分释放[16],熊果酸本身具有较强的抗氧化性。同时,从图2可知,不同干燥方式制备的壳聚糖纳米粒子清除DPPH自由基能力在肠消化阶段也有所差异,不同干燥方式下清除DPPH自由基能力顺序为:冷冻干燥(2.72 mg/g)>微波冷冻干燥(1.75 mg/g)>喷雾干燥(1.04 mg/g),可能是由于不同干燥方式制备的熊果酸纳米粒子载药量不同所决定的,或者不同干燥方式制备的壳聚糖纳米粒子的粒径有差异,导致纳米粒子的表面积不同,从而与DPPH乙醇溶液接触不同导致的[17]。

图2 熊果酸和熊果酸纳米粒子在模拟胃、肠体系中的抗氧化活性
Fig.2 Antioxidant activities of UA and UA loaded chitosan nanoparticles in SGF and SIF models
2.3 温度对熊果酸壳聚糖纳米粒子贮藏期间熊果酸含量的影响
由图3可知,4 ℃条件下避光贮藏28 d,熊果酸和通过不同干燥方式制备的熊果酸壳聚糖纳米粒子的保留率较高,均在80%以上。在25 ℃避光条件下,熊果酸和通过不同干燥方式制备的熊果酸纳米粒子的稳定性都降低,但不同干燥方式制备的熊果酸纳米粒子的保留率高于熊果酸,且不同干燥方式下的熊果酸保留率顺序为冷冻干燥(69%)>微波冷冻干燥(64%)>喷雾干燥(59%)。在37 ℃避光条件下,熊果酸保留率下降较快,不同干燥方式制备的熊果酸纳米粒子的保留率比熊果酸的保留率要高,28 d后,熊果酸的保留率仅为38%。这表明,熊果酸和不同干燥方式制备的熊果酸纳米粒子在4和25 ℃条件下,稳定性较高,37 ℃条件下稳定性降低,壳聚糖纳米粒子包埋熊果酸具有一定的保护作用,这与石泽栋等[18]较低温度更利于牛至精油微胶囊贮藏的研究结果一致。
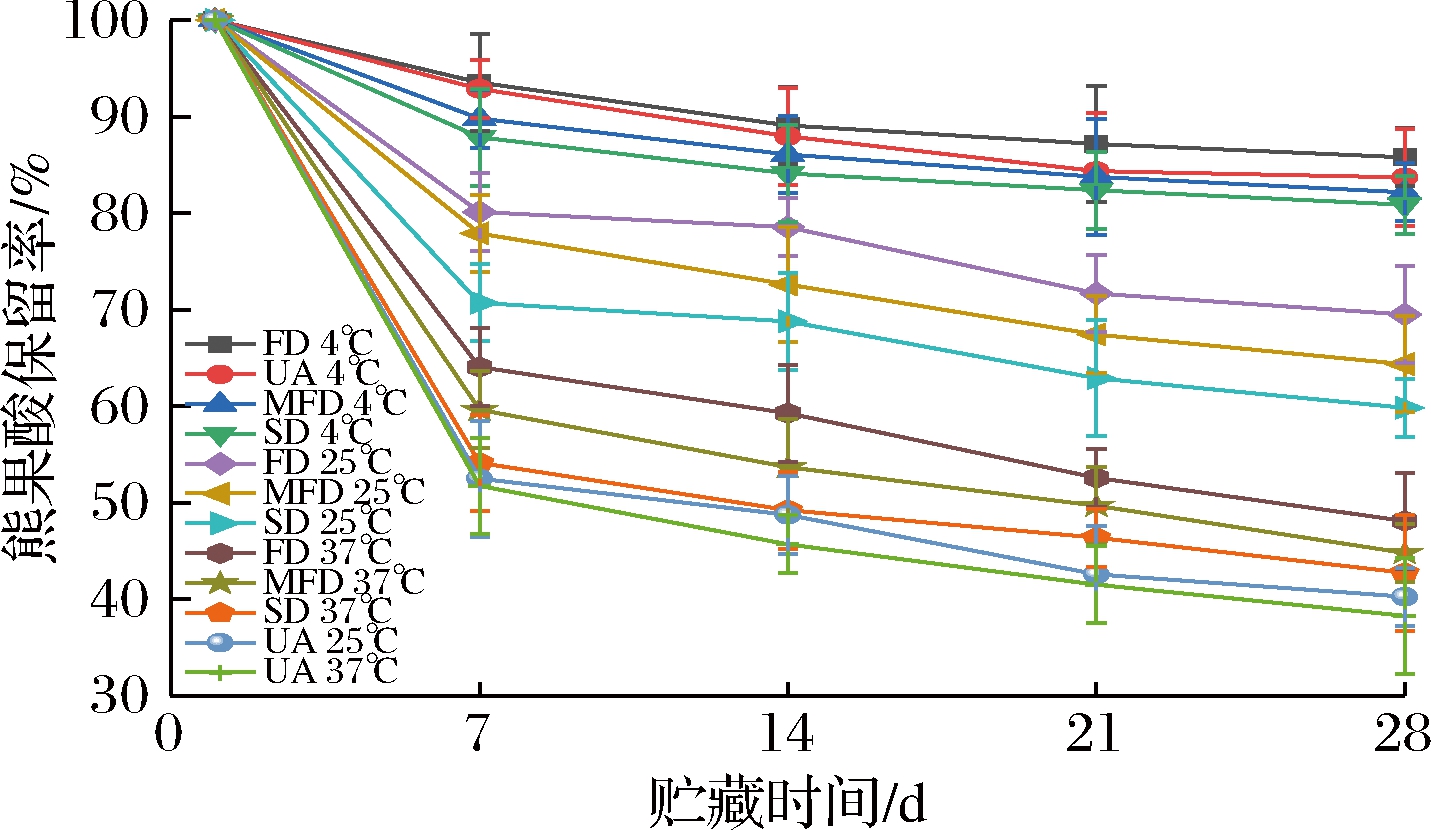
图3 温度对熊果酸壳聚糖纳米粒子稳定性的影响
Fig.3 Effect of temperature on the stability of UA loaded chitosan nanoparticles
2.4 温度对熊果酸壳聚糖纳米粒子贮藏期间抗氧化活性的影响
由图4可知,不同温度下的熊果酸纳米粒子清除DPPH自由基能力有明显差异。

图4 温度对熊果酸壳聚糖纳米粒子抗氧化活性的影响
Fig.4 Effect of temperature on antioxidant activities of UA loaded chitosan nanoparticles
熊果酸纳米粒子清除DPPH自由基能力均高于熊果酸,表明纳米粒子包埋可以提高熊果酸的稳定性。在贮藏温度为4 ℃时,冷冻干燥制备的熊果酸纳米粒子DPPH清除率(2.32 mg/g)均高于在贮藏温度25 ℃时的DPPH清除率(2.20 mg/g)和37 ℃下时的DPPH清除率(2.16 mg/g),可能是当温度高于25 ℃时,熊果酸发生不同程度的分解,熊果酸稳定性下降,导致清除DPPH自由基能力下降。在4 ℃时,不同干燥方式制备的熊果酸纳米粒子清除DPPH自由基能力顺序为:冷冻干燥(2.32 mg/g)>微波冷冻干燥(2.01 mg/g)>喷雾干燥(1.87 mg/g),说明冷冻干燥制备的熊果酸纳米粒子稳定性最高,微波冷冻干燥制备的稳定性次之,而喷雾干燥制备的稳定性最低,可能是因为冷冻干燥和微波冷冻干燥是在较低温度下进行干燥,对熊果酸的活性影响小,熊果酸稳定性较高,表明这2种干燥方式较适合制备熊果酸纳米粒子。
2.5 光照对熊果酸壳聚糖纳米粒子中熊果酸含量的影响
由图5可知,在避光条件下,熊果酸和不同方式干燥的熊果酸纳米粒子的保留率都比较高,其中冷冻干燥、微波冷冻干燥和喷雾干燥制备的纳米粒子中熊果酸保留率分别为66%、64%和60%,说明避光保存能提高熊果酸的保留率,增强其稳定性。在光照条件下,贮藏28 d后,熊果酸的保留率仅为35%,而不同干燥方式制备的熊果酸纳米粒子的保留率均在50%以上,这说明壳聚糖纳米粒子在一定程度上可以保护熊果酸,降低光照对熊果酸的降解作用,从而可以提高熊果酸的贮藏时间。这与花色苷微胶囊保护花色苷未直接暴露在光照条件下而保持稳定,能够明显提高花色苷的保留率的研究结果一致[19]。

图5 光照对熊果酸壳聚糖纳米粒子稳定性的影响
Fig.5 Effect of light on the stability of UA loaded chitosan nanoparticles
2.6 光照对熊果酸壳聚糖纳米粒子贮藏期间抗氧化活性的影响
由图6可知,在光照和避光2种条件下,熊果酸纳米粒子清除DPPH自由基能力均明显高于熊果酸,表明壳聚糖包埋熊果酸可以提高其稳定性。在相同温度条件下,随着贮藏时间的延长,避光条件下贮藏的冷冻干燥、微波冷冻干燥和喷雾干燥制备的熊果酸纳米粒子DPPH清除率(2.09、2.03、1.99 mg/g)均高于光照条件下贮藏的冷冻干燥、微波冷冻干燥和喷雾干燥的熊果酸纳米粒子DPPH清除率(1.90、1.88、1.76 mg/g),表明熊果酸在避光条件下稳定性相对较高。可能是因为熊果酸在光照条件下会发生不同程度的分解,导致熊果酸的稳定性下降[20]。由图6可知,不同干燥方式下制备的熊果酸纳米粒子清除DPPH自由基能力具有显著性差异,可能是因为冷冻干燥跟微波冷冻干燥在低温下进行对熊果酸的活性影响相对较小,还可能是不同干燥方式制备的纳米粒子载药量不同导致熊果酸清除DPPH自由基能力存在差异。

图6 光照对熊果酸壳聚糖纳米粒子抗氧化活性的影响
Fig.6 Effect of light on antioxidant activities of UA loaded chitosan nanoparticles
3 结论
本试验通过离子凝胶法制备熊果酸-壳聚糖纳米粒子,对其进行模拟胃肠液消化特性及贮藏条件(光照、温度)对熊果酸纳米粒子的稳定性影响。结果表明,熊果酸纳米粒子可以显著提高熊果酸的稳定性,熊果酸纳米粒子在低温、避光条件下的稳定性较好。熊果酸纳米粒子在模拟胃肠液中较稳定,其抗氧化能力高于熊果酸。说明壳聚糖纳米粒子具有较好的保护作用,能防止胃肠液对熊果酸的破坏。不同干燥方式下的熊果酸纳米粒子稳定性总体顺序为冷冻干燥>微波冷冻干燥>喷雾干燥,通过冷冻干燥和微波冷冻干燥制备的熊果酸纳米粒子稳定性整体上高于喷雾干燥,说明熊果酸纳米粒子适合用低温干燥方法制备,从而在通过干燥方式制备过程中提高熊果酸的稳定性。
[1] 周茜, 韩雪, 韩晓梅, 等.响应面试验优化乌梅熊果酸提取工艺及其对大肠杆菌的抑制作用[J].食品科学, 2016, 37(8):67-73.
ZHOU Q, HAN X, HAN X M, et al.Optimization of ursolic acid extraction from Fructus mume and evaluation of its antibacterial activity against Escherichia coli[J].Food Science, 2016, 37(8):67-73.
[2] 张梦, 何曼, 孙强, 等.基于Hedgehog信号通路的熊果酸诱导结直肠癌SW480细胞凋亡的机制研究[J].中草药, 2021, 52(8):2 365-2 373.
ZHANG M, HE M, SUN Q, et al.Mechanism study on ursolic acid induced apoptosis of colorectal cancer SW480 cells based on Hedgehog signaling pathway[J].Chinese Traditional and Herbal Drugs, 2021, 52(8):2 365-2 373.
[3] L PEZ-HORTAS L, PÉREZ-LARR
PEZ-HORTAS L, PÉREZ-LARR N P, GONZ
N P, GONZ LEZ-MU
LEZ-MU OZ M J, et al.Recent developments on the extraction and application of ursolic acid.A review[J].Food Research International, 2018, 103:130-149.
OZ M J, et al.Recent developments on the extraction and application of ursolic acid.A review[J].Food Research International, 2018, 103:130-149.
[4] 孙涛, 刘伟佳, 谢晶, 等.纳米壳聚糖的制备及其在食品保鲜应用中的研究进展[J].食品与发酵工业, 2020, 46(8):293-299.
SUN T, LIU W J, XIE J, et al.Preparation of nano-chitosan and its application in food preservation[J].Food and Fermentation Industries, 2020, 46(8):293-299.
[5] 张晓明, 朱良奎, 成蕾, 等.壳聚糖/海藻酸钠/多孔淀粉-茶树精油微胶囊制备及释放性能分析[J].分析化学, 2019, 47(6):862-868.
ZHANG X M, ZHU L K, CHENG L, et al.Preparation and release behavior analysis of chitosan/sodium alginate/porous starch-tea tree essential oil microcapsule[J].Chinese Journal of Analytical Chemistry, 2019, 47(6):862-868.
[6] 李嫄, 赵静, 余忠姝, 等.壳聚糖包覆姜黄素脂质体体外释放和药代动力学研究[J].中国药理学通报, 2018, 34(6):810-814.
LI Y, ZHAO J, YU Z S, et al.Release characteristics in vitro and pharmacokinetics of chitosan coated curcumin liposomes in rats[J].Chinese Pharmacological Bulletin, 2018, 34(6):810-814.
[7] 谭啸, 邱婷婷, 李若男, 等.壳聚糖纳米粒子的制备和在食品抑菌中的研究进展[J].食品科学, 2020, 41(23):347-353.
TAN X, QIU T T, LI R N, et al.Recent progress in the preparation and application of chitosan nanoparticles as an antimicrobial in foods[J].Food Science, 2020, 41(23):347-353.
[8] 赵路洁, 段续, 曹伟伟, 等.熊果酸壳聚糖纳米颗粒的制备工艺优化及评价[J].食品与发酵工业, 2022, 48(12):46-51.
ZHAO L J, DUAN X, CAO W W, et al.Optimization and evaluation of preparation of ursolic acid loaded chitosan nanoparticles[J].Food and Fermentation Industries, 2022, 48(12):46-51.
[9] ZHAO L J, DUAN X, CAO W W, et al.Effects of different drying methods on the characterization, dissolution rate and antioxidant activity of ursolic acid-loaded chitosan nanoparticles[J].Foods (Basel, Switzerland), 2021, 10(10):2470.
[10] 张秀玲, 李晨, 汲润, 等.不同保护剂对蓝靛果冻干粉理化和花色苷缓释特性的影响[J/OL].食品科学:1-12[2022-03-06].http://kns.cnki.net/kcms/detail/11.2206.TS.20210816.1510.078.html.
ZHANG X L, LI C, JI R, et al.Effects of different protective agents on the physicochemical and anthocyanin sustained-release properties of freeze-dried powder of Lonicera edulis[J].Food Science, 1-12[2022-03-06].http://kns.cnki.net/kcms/detail/11.2206.TS.20210816.15 10.078.html.
[11] 孙亚利, 周文美, 黄永光, 等.以聚合乳清蛋白为壁材的苦荞黄酮微胶囊化及其品质分析[J].食品科学, 2020, 41(12):259-266.
SUN Y L, ZHOU W M, HUANG Y G, et al.Microencapsulation and quality analysis of tartary buckwheat flavonoids using polymerized whey protein as wall material[J].Food Science, 2020, 41(12):259-266.
[12] 雷雨晴, 王康平, 余雄伟, 等.卵白蛋白-菊糖-茶多酚微胶囊对石榴籽油稳定性的影响[J].食品科学, 2020, 41(21):58-65.
LEI Y Q, WANG K P, YU X W, et al.Stability of pomegranate seed oil loaded in ovalbumin-inluin-tea polyphenol microcapsules[J].Food Science, 2020, 41(21):58-65.
[13] 王枭, 孟官丽, 王齐蕾, 等.基于静电喷雾法萝卜硫素微胶囊的制备与表征[J].食品科学, 2021, 42(7):113-119.
WANG X, MENG G L, WANG Q L, et al.Preparation and characterization of sulforaphane microcapsules by electrospraying[J].Food Science, 2021, 42(7):113-119.
[14] 廖霞, 杨小兰, 李瑶, 等.槲皮素微胶囊的贮藏稳定性及抗氧化活性[J].食品科学, 2017, 38(1):60-66.
LIAO X, YANG X L, LI Y, et al.Storage stability and antioxidant activity of quercetin microcapsules[J].Food Science, 2017, 38(1):60-66.
[15] 康明, 孙蓉, 谢克难, 等.纳米碳酸钙干燥方式的研究[J].四川大学学报(工程科学版), 2004, 36(1):57-60.
KANG M, SUN R, XIE K N, et al.Study on drying processes of nanosized calcium carbonate[J].Journal of Sichuan University (Engineering Science Edition), 2004, 36(1):57-60.
[16] 尹乐斌, 刘桠丽, 何平, 等. 低苦味多肽固体饮料的制备及其体外模拟消化研究[J]. 食品与发酵工业, 2023, 49(4):189-195.
YIN L B, LIU Y L, HE P, et al. Preparation of low-bitter polypeptide solid beverage and study on its simulated digestion in vitro[J]. Food and Fermentation Industries, 2023, 49(4):189-195.
[17] 黄珊, 刘嘉, 李贵华, 等.壁材对方竹叶黄酮微胶囊结构及抗氧化性能的影响[J].食品工业科技, 2021, 42(22):55-61.
HUANG S, LIU J, LI G H, et al.Effects of wall materials on the structure and antioxidant activities of the bamboo leaves flavonoids microcapsules[J].Science and Technology of Food Industry, 2021, 42(22):55-61.
[18] 石泽栋, 蒋雅萍, 孙英杰, 等.牛至精油微胶囊的制备、表征及在杏贮藏期的抑菌效果[J].食品科学, 2021, 42(11):186-194.
SHI Z D, JIANG Y P, SUN Y J, et al.Preparation and characterization of oregano essential oil microcapsules and its effect on quality preservation of apricot fruit during storage[J].Food Science, 2021, 42(11):186-194.
[19] 毛莹, 帅晓艳, 王惠玲, 等.基于内源乳化法和喷雾干燥优化制备花色苷微胶囊及其稳定性分析[J].食品科学, 2020, 41(2):267-275.
MAO Y, SHUAI X Y, WANG H L, et al.Preparation and stability evaluation of anthocyanin microcapsules by emulsification/internal gelation with optimized spray drying[J].Food Science, 2020, 41(2):267-275.
[20] 赵彦巧, 王月, 孟翔宇, 等.喷雾干燥法制备玫瑰茄花色苷微胶囊条件优化[J].福建农业学报, 2021, 36(1):104-114.
ZHAO Y Q, WANG Y, MENG X Y, et al.Optimized preparation of spray-dried anthocyanins microcapsules[J].Fujian Journal of Agricultural Sciences, 2021, 36(1):104-114.