黏附能力是细菌在人和动物胃肠道中生存的基本特性,有助于其在机体肠道上的定植,增强菌株与肠道之间的信号交流并发挥其生理功能;因此,乳酸菌在肠上皮细胞上的黏附是其在机体内发挥益生功能的重要基础[1]。乳酸菌进入机体肠道后,首先与肠道上皮细胞表面的黏液层接触,然后再黏附于肠上皮细胞,而其表面的蛋白、多糖及脂磷壁酸等黏附素与肠上皮细胞或肠黏液层中的黏附受体进行特异性结合是其发挥黏附作用的关键[2]。黏附的乳酸菌不仅可以通过竞争、抑制和排斥与肠道致病菌竞争黏膜界面的附着位点,并代谢产生有益物质来抑制致病菌的入侵和定植[3],还可以通过刺激肠道微生物和机体相互作用来保护肠道黏膜屏障[4];同时,黏附的乳酸菌还能通过激活巨噬细胞、增强自然杀伤细胞的活性和免疫球蛋白的分泌水平等来调节机体的免疫能力[5]。
随着乳酸菌的益生功能被广泛发现以及人们对健康关注度的日益突出,乳酸菌的生产应用技术成为当今的研究热点;其中,真空冷冻干燥以其较高的存活率、较长的保藏时间及易于应用等特点而被广泛用于酸奶发酵剂、益生乳酸菌颗粒及益生乳酸菌固体饮料等深受市场欢迎的产品生产中。但真空冷冻干燥过程中的不良环境会对乳酸菌菌体造成一定的伤害,形成的冰晶会损伤菌体细胞膜的通透性和代谢,造成菌体细胞溶质浓度的变化以及机械损伤;同时,细胞浆剩余溶液浓度的增大还会改变胞内的pH和离子强度,减弱DNA碱基对间的疏水作用,从而影响菌株DNA稳定性及其存活[6]。β-半乳糖苷酶和乳酸脱氢酶是乳酸菌重要的代谢酶,Na+-K+ATP酶是维持乳酸菌细胞Na+、K+吸收等正常生理功能的重要酶系[7-8],冻干过程中这些酶活力的降低也会对乳酸菌的存活造成较大的影响[9]。而脱脂乳、糖类及氨基酸类等单一保护剂及其复合保护剂的添加会起到良好的保护作用,能够提高冻干后乳酸菌的存活[10-11];然而,单一冻干保护剂及复合保护剂在真空冷冻干燥过程中对乳酸菌表面黏附素及其黏附能力的影响尚不明确。因此,本文以具有潜在益生功能的植物乳杆菌67为研究对象[12],研究了单一保护剂及其浓度对冻干后菌株67黏附率和存活率的影响;并以黏附率和存活率为指标进一步优化了复合保护剂的配方,探讨了优化后的复合保护剂对冻干后菌株67的黏附能力、表面微观形态及其抑制肠道致病菌黏附肠上皮细胞能力的保护作用,为益生菌的功能机制探究及其生产应用提供参考依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌67,江苏省乳品生物技术与安全控制重点实验室;人结肠腺癌细胞系Caco-2细胞株,湖南丰晖生物科技有限公司;大肠杆菌CICC 10899、金黄色葡萄球菌CICC 10201,中国工业微生物菌种保藏中心。
谷氨酰胺、最低必需培养基(minimum essential medium,MEM)、非必需氨基酸,美国Gibco公司;血清,美国CLARK Bioscience公司;脱脂乳(skimmedmilk,S),新西兰恒天然集团;海藻糖(trehalose,T)、山梨醇、甘油、谷氨酸钠(sodium glutamate,G)、蔗糖(sucrose,C)、NaIO4,国药集团化学试剂有限公司;牛血清白蛋白(bovine serum albumin,BSA),生工生物工程(上海)股份有限公司;LiCl、β-半乳糖苷酶(β-Galactosidase,β-GAL)、乳酸脱氢酶(lactate dehydrogenase,LDH)、Na+-K+ ATP酶活性检测试剂盒,北京Solarbio科技有限公司。
1.2 仪器与设备
SX-700全自动高压灭菌锅,日本TOMY公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;Legendmach1.6R高速冷冻离心机,美国Thermo Fisher Scientific有限公司;UV-2250可见紫外分光光度计,日本岛津公司;150i型CO2细胞培养箱,中国力康生物医疗科技控股有限公司;IC1000细胞计数仪,上海睿钰生物科技有限公司;IX2-ILL100荧光倒置显微镜,日本OLYMPUS公司;S-4800II冷场发射扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 乳酸菌的真空冷冻干燥
将MRS活化后的乳酸菌8 000×g离心10 min收集菌体,无菌磷酸盐缓冲液(phosphate buffer saline,PBS,pH 7.4)洗涤后重新悬浮,并稀释至不同的浓度,分别测定其600 nm处的吸光度(OD)和活菌数,建立标准曲线;根据标准曲线将菌悬液的OD值调至108 CFU/mL对应的OD值,离心收集菌体。将灭菌后的保护剂与菌体按照质量比1∶1在无菌环境下混匀后进行真空冷冻干燥(冻干);冻干程序:-80 ℃预冻6 h,冷凝器-70 ℃,隔板控温-10 ℃升华干燥30 h,10 ℃解析干燥10 h,压力0.3 Pa。
1.3.2 乳酸菌黏附率和存活率的测定
乳酸菌对黏蛋白和Caco-2细胞的黏附能力能够反映其在肠道内的黏附能力,前期研究发现,植物乳杆菌67对黏蛋白的黏附能力和对Caco-2细胞的黏附能力呈显著正相关[13];因此,本文以对Caco-2细胞的黏附能力来研究菌株67的黏附能力。
调节Caco-2细胞浓度为2×105 cells/mL,吸取0.5 mL至24孔板中,置于CO2培养箱培养至形成单层。将冻干后的菌体按照1∶8(质量比)加入无菌PBS(pH 7.4),重复清洗3次,并调整活菌数至108 CFU/mL,吸取0.5 mL至24孔板中,于CO2培养箱37 ℃培养2 h;然后用无菌PBS清洗24孔板,加入0.3 mL胰酶消化液,待细胞完全从板上脱落,加入0.7 mL的MEM完全培养液终止消化[14]。吸取菌体与细胞的混合液进行乳酸菌活菌计数,按照公式(1)计算菌株的黏附率[14]。将冻干后的菌体重悬于无菌PBS进行梯度稀释计数,按照公式(2)计算冻干后的菌株存活率。
黏附率![]()
(1)
存活率![]()
(2)
1.3.3 冻干菌粉水分含量的测定
将冻干后的菌粉在烘箱干燥至恒重,采用称量法测定菌粉的含水量。
1.3.4 乳酸菌酶活力的测定
β-GAL活力的测定:收集冻干后的菌体于15 mL离心管内,PBS调节至适当梯度,8 000×g、4 ℃离心10 min弃上清液,加入提取液,并在冰浴中进行破碎,破碎条件为超声波功率20%、超声波处理3 s、间隔10 s,重复60次;破碎后的菌液于15 000×g,4 ℃离心20 min,取上清液置于冰上待测;后续操作按照检测试剂盒说明进行,并计算β-GAL活力。
LDH活力和Na+-K+ ATP酶活力的测定:收集冻干后的菌体于15 mL离心管内,PBS调节至适当梯度,8 000×g,4 ℃离心10 min弃上清液;按照相关的酶活性检测试剂盒要求加入提取液,然后在冰浴中进行破碎,破碎条件为超声波功率20%、超声波处理3 s、间隔10 s,重复60次;破碎后的菌液于8 000×g、4 ℃离心10 min,取上清液置于冰上待测;后续操作按照相关的酶活性检测试剂盒说明进行,并计算LDH活力和Na+-K+ ATP酶活力。
1.3.5 不同种类保护剂对冻干后乳酸菌的黏附率和存活率等影响
根据参考文献[15-17]中对植物乳杆菌的冻干存活率及酶活力等维持较好的复合保护剂配方,以及对其黏附影响较大的单一冻干保护剂[18-20],选择了复合保护剂8(表1)作为参照。分别去除复合保护剂中的脱脂乳、海藻糖、蔗糖等7种单一保护剂,研究去除单一保护剂后的复合保护剂对菌株冻干后黏附率、存活率、水分含量等的影响,筛选出对菌株黏附率和存活率影响较为显著的单一保护剂。
表1 植物乳杆菌67冻干保护剂的配方 单位:g/L
Table 1 Composition of freeze-drying protectant for Lactobacillus plantarum 67
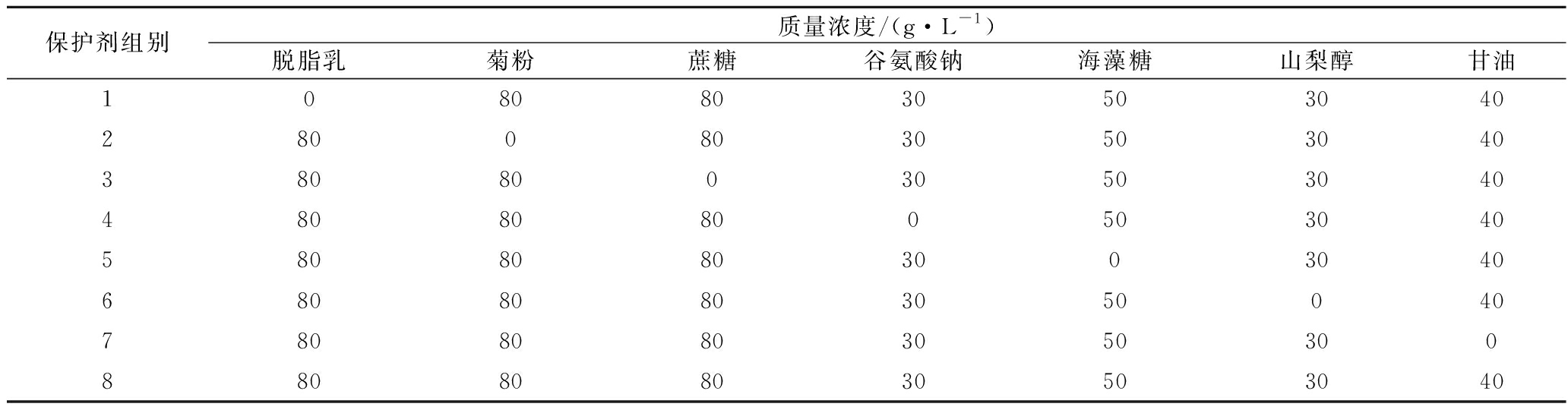
保护剂组别质量浓度/(g·L-1)脱脂乳菊粉蔗糖谷氨酸钠海藻糖山梨醇甘油10808030503040280080305030403808003050304048080800503040580808030030406808080305004078080803050300880808030503040
1.3.6 保护剂浓度对冻干后乳酸菌的黏附率和存活率等的影响
根据1.3.5试验结果,分别将不同浓度的单一保护剂灭菌后与菌体按照质量比1∶1进行混匀冻干,研究单一保护剂的不同浓度对冻干后菌株黏附率和活菌数等的影响。
1.3.7 乳酸菌复合保护剂的正交优化
根据1.3.6试验结果确定单一保护剂的较优添加范围,以菌株的黏附率和存活率等为指标,设计正交试验,研究菌株的最优冻干保护剂配比,并进行验证。
1.3.8 乳酸菌表面微观形态观察
用2.5%的戊二醛磷酸缓冲液固定活化后的菌株或菌株与细胞混合物,用不同浓度的乙醇脱水,然后进行干燥、镀金及扫描电镜(scanning electron microscope,SEM)观察,具体参考文献[21]的方法。
1.3.9 乳酸菌抑制肠道致病菌黏附能力的测定
将0.5 mL 2×105 cells/mL Caco-2细胞接种于24孔板中,培养至单层,无菌PBS洗涤细胞2次,根据文献[14]的方法研究菌株通过竞争、取代和排斥方式来抑制金黄色葡萄球菌和大肠杆菌黏附Caco-2细胞的能力。
1.3.10 乳酸菌表面黏附素的测定
分别利用LiCl去除乳酸菌菌株表面非共价结合的表面蛋白、NaIO4裂解菌株表面的多糖及BSA抑制脂磷壁酸分泌来研究乳酸菌表面的主要黏附素,具体操作根据文献[14]的方法进行。
1.4 数据处理
所有试验均重复3次,采用SPSS 26.0软件对数据进行处理,以单因素方差分析进行显著性检验,P<0.05表示差异显著;数据均以“平均值±标准差”表示;利用Origin 2018软件作图。
2 结果与分析
2.1 不同冻干保护剂对植物乳杆菌67黏附率和存活率等的影响
分别去除复合保护剂中的S、T、C、G、L、O和Y,研究不同单一保护剂对冻干后菌株67的黏附率、存活率及酶活力等的影响,结果见图1。

a-黏附率;b-存活率;c-水分含量;d-β-GAL活力;e-LDH活力;f-Na+-K+ ATP酶活力
图1 单一冻干保护剂对植物乳杆菌67的黏附率、存活率、水分含量及酶活力的影响(n=3)
Fig.1 Effect of different single freeze-drying protective agents on the adhesion rate, survival rate, moisture content, and enzyme activity of L.plantarum 67 (n=3)
注:不同字母表示差异显著(P<0.05)
由图1可知,添加第1、2、3、4及5种复合保护剂冻干后,菌株67的黏附率均小于13.98%,显著低于第8种保护剂(20.47%)及其他复合保护剂(P<0.05);添加第2、4及6种复合保护剂冻干后,菌株的存活率均低于55.30%,显著低于第8种保护剂(76.31%)及其他复合保护剂(P<0.05);添加第1、2、3、5、7及8种复合保护剂冻干后,菌粉的水分含量均高于3.49%,显著高于其他复合保护剂(P<0.05)。
添加第1、2、3、4、5、6及7种复合保护剂冻干后,菌株的β-GAL活力均低于2.53 U,显著低于第8种保护剂的2.93 U(P<0.05);添加第2、3、5及6种复合保护剂冻干后,菌株的LDH活力均低于0.28 U,显著低于第8种保护剂(0.463 U)及其他保护剂(P<0.05);添加2、3、4、6及7种复合保护剂冻干后,菌株的Na+-K+ ATP酶活力均低于0.69 U,显著低于第8种保护剂(0.946 U)及其他保护剂(P<0.05)。综合以上结果表明,S、L、C、G及T等单一保护剂对菌株67的黏附率、存活率、菌粉水分含量及酶活力产生较大的影响。
2.2 冻干保护剂浓度对冻干后植物乳杆菌67黏附率和存活率等的影响
根据2.1的研究结果,选取60、80、100、120、140、160 g/L的S,20、40、60、80、100、12 g/L的L,40、60、80、100、120、140 g/L的C,10、30、50、70、90、110 g/L的G及40、60、80、100、120、140 g/L的T分别与菌体混匀后冻干,进一步筛选对冻干后菌株67黏附率和存活率等维持较好的单一保护剂浓度,结果见表2。
表2 冻干保护剂浓度对植物乳杆菌67黏附率、存活率、水分含量及酶活的影响(n=3)
Table 2 Effect of freeze-drying protective agents content on the adhesion rate, survival rate, moisture content, and enzyme activity of L.plantarum 67 (n=3)
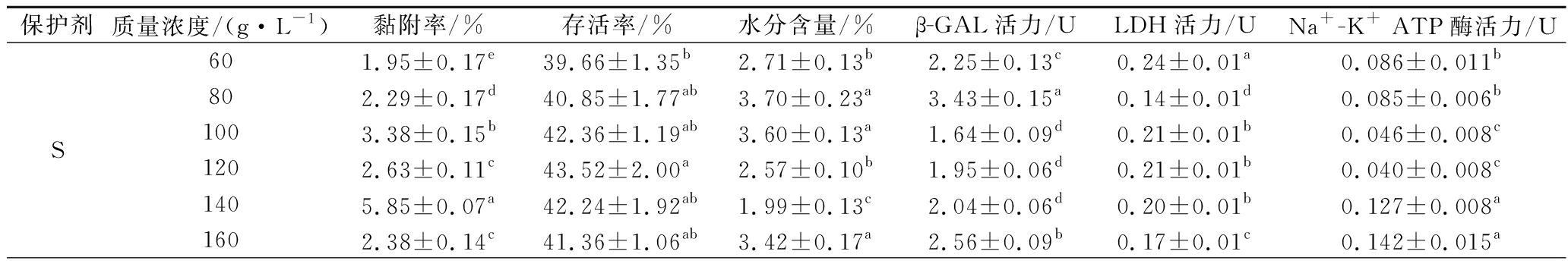
保护剂质量浓度/(g·L-1)黏附率/%存活率/%水分含量/%β-GAL活力/ULDH活力/UNa+-K+ ATP酶活力/US601.95±0.17e39.66±1.35b2.71±0.13b2.25±0.13c0.24±0.01a0.086±0.011b802.29±0.17d40.85±1.77ab3.70±0.23a3.43±0.15a0.14±0.01d0.085±0.006b1003.38±0.15b42.36±1.19ab3.60±0.13a1.64±0.09d0.21±0.01b0.046±0.008c1202.63±0.11c43.52±2.00a2.57±0.10b1.95±0.06d0.21±0.01b0.040±0.008c1405.85±0.07a42.24±1.92ab1.99±0.13c2.04±0.06d0.20±0.01b0.127±0.008a1602.38±0.14c41.36±1.06ab3.42±0.17a2.56±0.09b0.17±0.01c0.142±0.015a
续表2
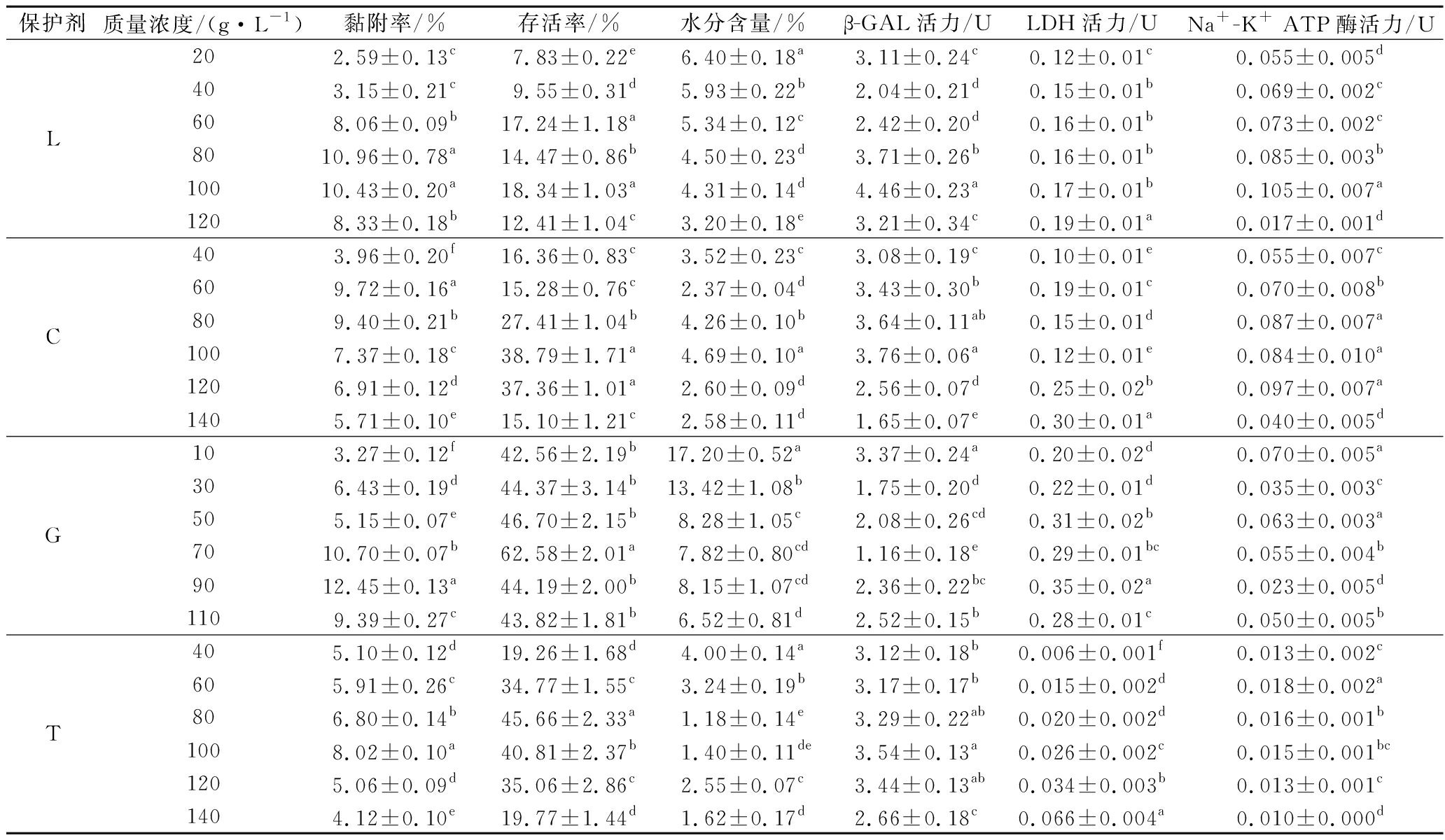
保护剂质量浓度/(g·L-1)黏附率/%存活率/%水分含量/%β-GAL活力/ULDH活力/UNa+-K+ ATP酶活力/UL202.59±0.13c7.83±0.22e6.40±0.18a3.11±0.24c0.12±0.01c0.055±0.005d403.15±0.21c9.55±0.31d5.93±0.22b2.04±0.21d0.15±0.01b0.069±0.002c608.06±0.09b17.24±1.18a5.34±0.12c2.42±0.20d0.16±0.01b0.073±0.002c8010.96±0.78a14.47±0.86b4.50±0.23d3.71±0.26b0.16±0.01b0.085±0.003b10010.43±0.20a18.34±1.03a4.31±0.14d4.46±0.23a0.17±0.01b0.105±0.007a1208.33±0.18b12.41±1.04c3.20±0.18e3.21±0.34c0.19±0.01a0.017±0.001dC403.96±0.20f16.36±0.83c3.52±0.23c3.08±0.19c0.10±0.01e0.055±0.007c609.72±0.16a15.28±0.76c2.37±0.04d3.43±0.30b0.19±0.01c0.070±0.008b809.40±0.21b27.41±1.04b4.26±0.10b3.64±0.11ab0.15±0.01d0.087±0.007a1007.37±0.18c38.79±1.71a4.69±0.10a3.76±0.06a0.12±0.01e0.084±0.010a1206.91±0.12d37.36±1.01a2.60±0.09d2.56±0.07d0.25±0.02b0.097±0.007a1405.71±0.10e15.10±1.21c2.58±0.11d1.65±0.07e0.30±0.01a0.040±0.005dG103.27±0.12f42.56±2.19b17.20±0.52a 3.37±0.24a0.20±0.02d0.070±0.005a306.43±0.19d44.37±3.14b13.42±1.08b1.75±0.20d0.22±0.01d0.035±0.003c505.15±0.07e46.70±2.15b8.28±1.05c2.08±0.26cd0.31±0.02b0.063±0.003a7010.70±0.07b62.58±2.01a7.82±0.80cd1.16±0.18e0.29±0.01bc0.055±0.004b9012.45±0.13a44.19±2.00b8.15±1.07cd2.36±0.22bc0.35±0.02a0.023±0.005d1109.39±0.27c43.82±1.81b6.52±0.81d2.52±0.15b0.28±0.01c0.050±0.005bT405.10±0.12d19.26±1.68d4.00±0.14a3.12±0.18b0.006±0.001f0.013±0.002c605.91±0.26c34.77±1.55c3.24±0.19b3.17±0.17b0.015±0.002d0.018±0.002a806.80±0.14b45.66±2.33a1.18±0.14e3.29±0.22ab0.020±0.002d0.016±0.001b1008.02±0.10a40.81±2.37b1.40±0.11de3.54±0.13a0.026±0.002c0.015±0.001bc1205.06±0.09d35.06±2.86c2.55±0.07c3.44±0.13ab0.034±0.003b0.013±0.001c1404.12±0.10e19.77±1.44d1.62±0.17d2.66±0.18c0.066±0.004a0.010±0.000d
注:同列比较,同一个保护剂不同浓度的不同字母表示差异显著(P<0.05)
由表2可知,当S、L、C、G及T的添加量分别为140、80、60、90及100 g/L时,冻干后菌株的黏附率分别为5.85%、10.96%、9.72%、12.45%及8.02%,显著高于各自保护剂的其他浓度(P<0.05);当添加量分别为120、100、100、70及80 g/L时,冻干后菌株的存活率分别为43.52%、18.34%、38.79%、62.58%及45.66%,显著高于各自保护剂的其他浓度(P<0.05);当添加量分别为140、120、60、110及80 g/L时,冻干后菌粉含水量分别为1.99%、3.20%、2.37%、6.52%及1.18%,显著低于各自保护剂的其他浓度(P<0.05)。
当S、L、C、G及T的添加量分别为80、100、100、10及100 g/L时,冻干后菌株的β-GAL活力分别为3.43、4.46、3.76、3.37及3.54 U,显著高于各自保护剂的其他浓度(P<0.05);当添加量分别为60、120、140、90及140 g/L时,冻干后菌株的LDH活力分别为0.24、0.19、0.30、0.35及0.066 U,显著高于各自保护剂的其他浓度(P<0.05);当添加量分别为160、100、120、10及60 g/L时,冻干后菌株的Na+-K+ ATP酶活力分别为0.142、0.105、0.097、0.070及0.018 U,显著高于各自保护剂的其他浓度(P<0.05)。
2.3 植物乳杆菌67的复合保护剂正交优化
在单因素试验基础上,选取对菌株67黏附和存活影响较大的5个因素,即S(A)、L(B)、C(C)、G(D)及T(E)进行5因素4水平L16(45)正交试验,以菌株黏附率、存活率等为指标,优化菌株67的复合保护剂配比,正交试验结果见表3。
表3 复合保护剂正交试验结果
Table 3 Orthogonal test results of freeze-drying composite protective agent

试验号A(S)/(g·L-1)B(L)/(g·L-1)C(C)/(g·L-1)D(G)/(g·L-1)E(T)/(g·L-1)黏附率/%存活率/%酶活力/Uβ-GALLDHNa+K+-ATP11004040506010.7968.864.140.761.3421006060708020.9873.203.230.841.02310080809010012.2286.121.400.801.18410010010011012023.3366.022.010.781.34512040609012014.8758.852.920.691.656120604011010014.3990.732.320.741.02712080100508011.1574.644.740.750.78
续表3

试验号A(S)/(g·L-1)B(L)/(g·L-1)C(C)/(g·L-1)D(G)/(g·L-1)E(T)/(g·L-1)黏附率/%存活率/%酶活力/Uβ-GALLDHNa+K+-ATP812010080706019.5587.553.530.851.26914040801108013.6684.681.130.811.50101406010090602.3020.521.710.871.021114080407012015.4161.722.620.660.2312140100605010013.0176.072.200.681.5713160401005012019.4584.302.270.640.941416060807010021.3890.431.710.711.261516080601106018.2891.862.620.651.811616010040908028.6195.324.420.671.10K116.8314.6917.3014.0812.73K214.9914.7616.7918.8518.60K311.1014.2716.7014.5014.77K421.9321.1314.0617.4218.75R10.846.863.244.766.02K173.5574.1779.1677.5067.20K277.9468.7275.0076.6981.96K360.7578.5987.2065.2084.31K490.4881.2461.3783.3269.26R29.7312.5225.8318.1217.11K12.702.623.383.203.00K23.382.242.742.913.38K31.922.851.942.612.05K42.763.042.682.022.32R1.460.801.431.181.33K10.800.730.780.730.78K20.760.790.720.750.77K30.760.720.790.760.72K40.670.750.760.750.71R0.130.080.090.030.07K11.221.360.921.241.36K21.181.081.510.861.10K31.081.001.301.241.18K41.281.321.021.421.12R0.200.360.590.560.026
由表3可知,各因素对菌株67黏附率影响的主次顺序为:A>B>E>D>C,即S对黏附的影响最大,其次为L、T、G和C;对菌株存活率影响的主次顺序为:A>C>D>E>B;对菌株 β-GAL活力影响的主次顺序为:A>C>E>D>B;对菌株LDH活力影响的主次顺序为:A>C>B>E>D;对菌株67 Na+-K+ ATP酶活力影响的主次顺序为:C>D>B>A>E。
以菌株黏附率作为指标,试验的最佳复合保护剂为A4B4C1D2E4,即160 g/L S、100 g/L L、40 g/L C、70 g/L G及120 g/L T。对正交试验优化的复合保护剂进行验证,发现添加优化的复合保护剂的菌株67冻干后的黏附率和存活率分别为28.73%和93.52%,均显著高于未优化的20.47%和76.31%(P<0.05);β-GAL、LDH及Na+-K+ ATP酶活力分别为4.34、0.77和1.29 U,与预测值接近,且菌株存活率和β-GAL、LDH及Na+-K+ ATP酶活力均与试验最优值接近;同时,测得水分含量为3.25%。
2.4 复合保护剂对植物乳杆菌67菌体表面微观形态的影响
利用SEM观察优化的复合保护剂对冻干后植物乳杆菌67微观形态的影响,结果见图2。

a-未冻干;b-添加PBS冻干;c-添加未优化的复合保护剂冻干;d-添加优化的复合保护剂冻干
图2 植物乳杆菌67扫描电镜图
Fig.2 Scanning electron microscope of L.plantarum 67
由图2可知,未冻干菌株67的菌体呈现出较为平滑和规则的形态,表面及边缘光滑清晰,且呈典型的杆状,菌体大小较为均一,单个排列;而在PBS中冻干后,菌体大小不一、菌体的杆状缩短,较未冻干发生了较大的变化,菌体表面褶皱、菌体塌缩,甚至破裂(箭头标示);在未优化的复合保护剂中冻干后,菌体大小和形状较未冻干有一定的变化,菌体的杆状缩短,有塌缩和破裂现象(箭头标示);而添加优化的复合保护剂冻干后,菌株的菌体大小均一,较未冻干的形态变化较小,菌体表面虽有褶皱,但未破裂,表明优化的复合保护剂对菌株具有良好的保护作用。
2.5 复合保护剂对植物乳杆菌67黏附Caco-2细胞表面微观形态的影响
利用SEM进一步观察优化的复合保护剂对冻干后植物乳杆菌67黏附Caco-2细胞表面微观形态的影响,结果见图3。

a-未冻干;b-添加PBS冻干;c-添加未优化的复合保护剂冻干;d-添加优化的复合保护剂冻干
图3 植物乳杆菌67黏附Caco-2细胞扫描电镜图
Fig.3 Scanning electron microscope of L.plantarum 67 adhering to Caco-2 cells
由图3可知,未冻干菌株67的菌体能够紧密地黏附在Caco-2细胞上,且菌体表面及边缘光滑清晰,为典型的杆状,菌体大小均一;在PBS中冻干后,菌体较为松散地黏附于Caco-2细胞上,且褶皱多,塌缩(箭头标示);在未优化的复合保护剂中冻干后,菌株较为紧密地黏附于Caco-2细胞上,部分菌体表面褶皱,并破裂(箭头标示);而添加优化的复合保护剂冻干后,菌体形状和大小与未冻干的较为一致,更为紧密地黏附于Caco-2细胞上,且在Caco-2细胞表面的聚集程度要高于PBS和未优化的复合保护剂,表明优化的复合保护剂能够提高冻干后菌株对Caco-2细胞的黏附能力。
2.6 复合保护剂对植物乳杆菌67黏附素的影响
优化后的复合保护剂对冻干后植物乳杆菌67的黏附素影响见图4。

图4 复合保护剂对植物乳杆菌67表面黏附素的影响(n=3)
Fig.4 Effect of composite protective agent on surface adhesion of L.plantarum 67 (n=3)
注:NV,未冻干;PV,添加PBS冻干;CV,添加优化的复合保护剂冻干(下同);不同字母表示差异显著(P<0.05)
由图4可知,未冻干、添加PBS及优化的复合保护剂冻干后的菌株67在LiCl分别去除表面蛋白后,其黏附率分别为12.14%、6.29%及11.69%,显著低于各自保护剂的未处理、BSA处理及NaIO4处理(P<0.05),表明表面蛋白是菌株67主要的黏附素,且冻干对菌株的主要黏附素影响较小。
添加PBS冻干后的菌株67在未处理、LiCl处理、BSA处理及NaIO4处理后,其黏附率显著低于未冻干的菌株(P<0.05),而优化的复合保护剂则显著提高了冻干后菌株在各个处理后的黏附率(P<0.05),表明冻干显著降低了菌株67的黏附能力,而优化的复合保护剂能够较好地恢复菌株的黏附能力。
2.7 复合保护剂对植物乳杆菌67抑制肠道致病菌的影响
由2.6研究结果发现,冻干对菌株的黏附能力产生了较大的影响。因此,进一步研究了优化的复合保护剂对冻干后菌株抑制肠道致病菌黏附Caco-2细胞的影响,结果见图5。
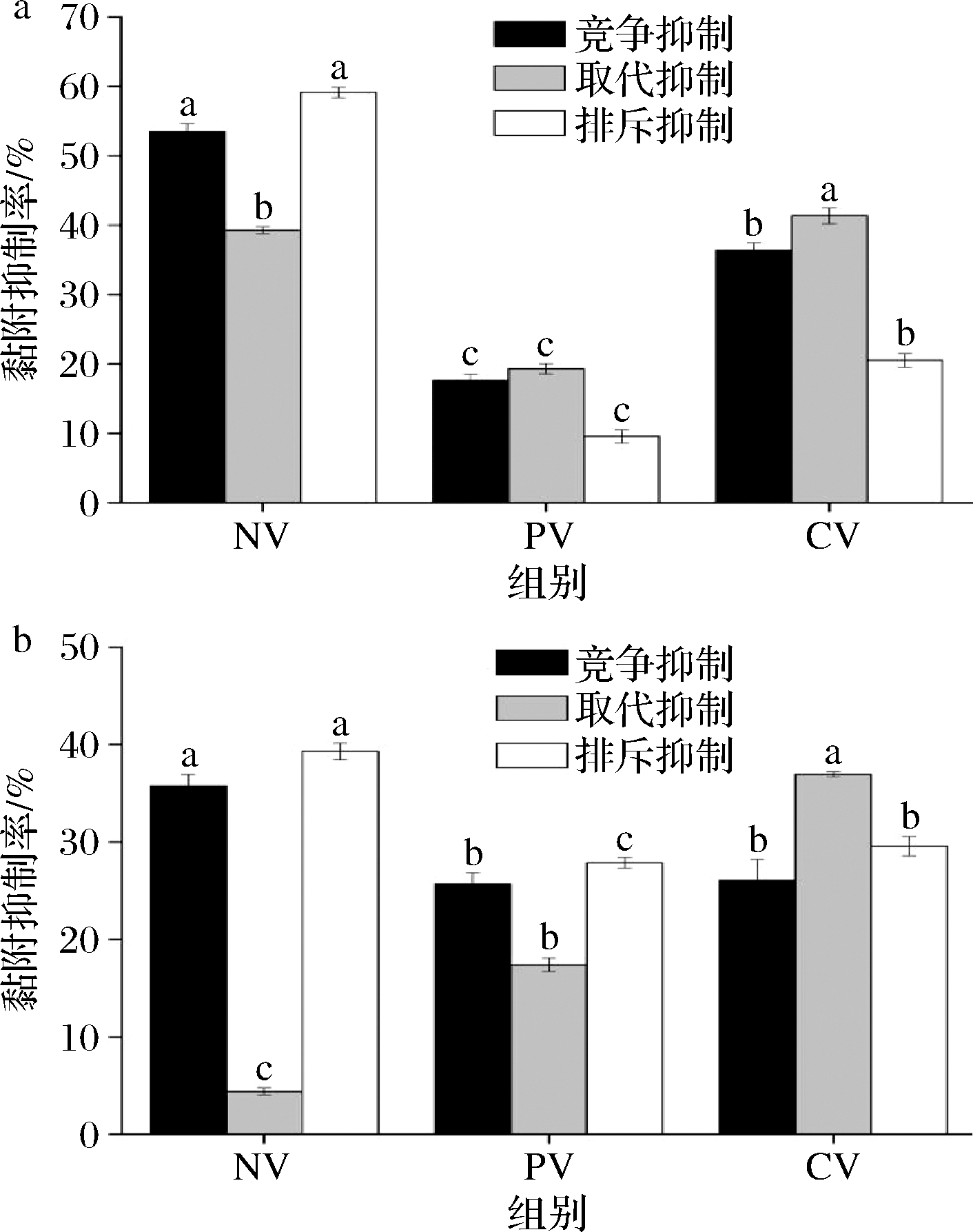
a-金黄色葡萄球菌;b-大肠杆菌
图5 复合保护剂对植物乳杆菌67抑制肠道致病菌黏附Caco-2细胞的影响(n=3)
Fig.5 Effect of compound protective agent on inhibition of intestinal pathogenic bacteria adhesion to Caco-2 cells by L.plantarum 67 (n=3)
注:同一种抑制方式的不同字母表示差异显著(P<0.05)
由图5-a可知,在PBS中冻干的菌株67通过竞争、取代和排斥对金黄色葡萄球菌黏附Caco-2细胞的抑制率分别为17.60%、19.28%和9.53%,均显著低于未冻干的菌株(P<0.05);在添加优化的复合保护剂后,菌株67通过竞争、取代和排斥对金黄色葡萄球菌的黏附抑制率分别为36.37%、41.37%和20.49%,显著高于在PBS中冻干的菌株(P<0.05)。
图5-b还发现,在PBS中冻干的菌株67通过竞争和排斥对大肠杆菌黏附Caco-2细胞的抑制率分别为25.69%和27.88%,显著低于未冻干的菌株(P<0.05);在添加优化的复合保护剂后,菌株67通过取代和排斥对大肠杆菌的黏附抑制率分别为36.94%和29.56%,显著高于在PBS中冻干的菌株(P<0.05)。表明冻干降低了菌株67抑制金黄色葡萄球菌和大肠杆菌黏附Caco-2细胞的能力,优化的复合保护剂则起到较好的恢复作用。
3 讨论
乳酸菌的表面蛋白、磷壁酸以及肽聚糖等是其发挥黏附作用的物质基础,细胞质中的兼职功能蛋白分泌到细胞表面也会进一步提高其黏附能力[22]。冻干过程中的失水不仅会破坏乳酸菌的表面蛋白等黏附素与水分子、细胞膜之间的相互作用力,导致黏附素功能的丧失[23];还会引起DNA的糖苷键断裂,影响菌株转运兼职功能蛋白的活力,抑制兼职功能蛋白运输至胞外,进而降低乳酸菌的黏附能力[24];此外,冻干导致的细胞膜磷脂双分子层的损伤降低了乳酸菌的疏水性,也会导致乳酸菌黏附能力的下降[25]。而在PBS中冻干后的植物乳杆菌67对Caco-2细胞的黏附率显著下降(P<0.05),并呈松散状黏附于Caco-2细胞上,可能是冻干破坏了菌株的表面黏附素及其疏水性所致。
SEM观察发现,冻干使得菌株67的菌体变短,这可能与菌株的自我保护机制有关;菌体通过改变自身的长短减少与外界不良环境的接触面积,降低对有害物质的吸收,进而维持细胞的生命活动[26];冻干过程中的细胞脱水导致的菌体胞内酶外流,容易造成细胞自身活力的下降,且随着脱水程度的加重,甚至会出现细胞塌陷破裂的情况[27]。因此,冻干后菌株67的菌体形态变短,并发生了破裂和坍塌现象。
当分别去除复合保护剂中的脱脂乳、菊粉、蔗糖、谷氨酸钠及海藻糖后,菌株67的黏附能力显著下降(P<0.05),表明脱脂乳、菊粉、蔗糖、谷氨酸钠及海藻糖对菌株67的黏附能力影响较大。脱脂乳作为乳酸菌的优良载体,被广泛用作乳酸菌的冻干保护剂,不仅可以在冻干过程中形成多孔结构有利于其复水,含有的乳清蛋白还能够包裹在菌体表面形成一层蛋白膜保护层,稳定细胞表面蛋白等活性物质及细胞膜,进而阻止并减少细胞与冰晶和氧气的接触,抵抗冻干对菌体的损伤[28];同时,脱脂乳中的Ca2+能够激活其介导的信号通路,促进菌体与Caco-2细胞表面受体间的特异性结合,增强菌株对Caco-2细胞的黏附能力[29];作为蛋白类保护剂,脱脂乳还对植物乳杆菌的疏水性具有良好的保护作用,有利于冻干后菌株黏附能力的恢复[30]。海藻糖和蔗糖含有的多羟基能够代替失去的水分,与菌体细胞膜中的磷酸基团及蛋白极性基团形成氢键,以“水化膜”的形式包裹在蛋白表面,从而保护菌体细胞膜和蛋白结构与功能的完整性[31-32];同时,在菌体表面形成一个玻璃状的层包裹着菌体的生物结构,限制其蛋白分子内流动性,维持和保护菌体表面蛋白的功能[33]。谷氨酸钠在冻干过程中也能够与菌体表面蛋白的极性基团形成氢键,保护菌体表面蛋白的结构和功能的完整性[34],其氨基与菌体蛋白的羧基相互作用使其更加稳定[35]。菊粉则能够有效地维持冻干后菌体细胞膜脂肪酸的组成和氨基酸代谢[18],有助于提高乳酸菌的存活力及其对Caco-2细胞的黏附能力;而甘油作为渗透型保护剂,具有很强的亲水性,不仅可以在冻干过程中维持菌体细胞膜和蛋白质的结构和功能,防止细胞在干燥脱水时的损伤,还可以防止菌体细胞膜结构在复水时受到伤害[19]。
试验发现,表面蛋白是菌株67的主要黏附素,且优化的复合保护剂使得菌株在Caco-2细胞表面的聚集程度要高于PBS;因此,相较于PBS而言,优化后含有脱脂乳、菊粉、蔗糖、谷氨酸钠及海藻糖的复合保护剂可能通过保护菌株的表面蛋白等黏附素及其疏水性来显著提高菌株67对Caco-2细胞的黏附率(P<0.05),从而延长了菌株在Caco-2细胞上的停留时间,并通过排斥的方式显著抑制金黄色葡萄球菌和大肠杆菌的黏附(P<0.05);优化的复合保护剂还显著提高了菌株67通过竞争和取代的方式显著抑制了金黄色葡萄球菌的黏附(P<0.05),表明优化的复合保护剂可能通过增强冻干后菌株产抑制金黄色葡萄球菌的物质及同其竞争共同黏附受体的能力[36],从而恢复菌株67抑制金黄色葡萄球菌的抑制能力。
单一保护剂添加后,菌株67对Caco-2细胞的黏附率均低于10.96%,表明单一保护剂虽然可以对菌株的黏附能力起到保护作用,但保护作用较差,可能是单一的保护机制影响了其保护效果;而多种单一保护剂的复合在发挥着各自保护作用的同时,还可以通过相互作用来增强其保护效果[10]。但不同比例的单一保护剂复合对菌株黏附Caco-2细胞的保护效果差异较大,当海藻糖的浓度过高时会导致其玻璃化结构过强,破坏菌体自身的结构[20],影响其存活和黏附;而过高浓度的菊粉则会干扰Caco-2细胞的结构,破坏菌株对其黏附[37];还有研究表明,不同浓度的蔗糖能够通过影响菌株的自聚合能力和疏水性,使其对Caco-2细胞的黏附能力具有差异性[38-39];因此,复合保护剂中单一保护剂的不同比例对菌株67黏附Caco-2细胞能力的影响不同。
优化的复合保护剂使得冻干后菌株67的菌体形态变化较小,细胞完整、无塌缩、破裂现象,且存活率要显著高于单一保护剂(P<0.05),表明优化的复合保护剂能更好地将菌体包裹,降低了菌株细胞膜的通透性及冰晶的形成速率,改善了细胞内外电解质浓缩导致的离子强度变化,避免了菌体细胞膜和细胞壁的塌陷等问题[40];同时,还显著提高了菌株67的LDH、Na+-K+ ATP等酶的活力(P<0.05),进而增加细胞膜不饱和脂肪酸的含量,增强了其在冻干过程中的抗性,保护了菌株67的活力[41];而Na+-K+ ATP酶活力的提高和电解质强度的改善能够较好地恢复菌体胞内的pH[42-43],从而保护菌株67黏附Caco-2细胞的能力[44]。
试验还发现,存活率高的菌株对Caco-2细胞黏附率不一定高,表明保护剂并不是通过提高菌株67的存活率来提高其黏附能力。延伸因子-Tu、延伸因子-P和延伸因子-G等细胞质蛋白是乳酸菌的重要兼职功能蛋白,能够作为黏附蛋白分泌到胞外促进乳酸菌黏附于肠上皮细胞[22,45];乳酸菌在糖酵解过程中的烯醇化酶可以与肠上皮细胞及肠道黏液结合来发挥其黏附作用[46];热休克蛋白DnaK是乳酸菌在应对不良环境时的重要应激蛋白,能够通过结合纤溶酶原来提高其黏附能力[47];冻干容易导致乳酸菌细胞中的这些蛋白和酶的失活[9],而优化的复合保护剂是否通过调控相关通路中这些蛋白的表达来改善菌株67的黏附能力,还需要在后期从蛋白组学的角度进行进一步研究。
4 结论
真空冷冻干燥显著降低了植物乳杆菌67的黏附率、存活率及酶活力;脱脂乳、菊粉、蔗糖、谷氨酸钠及海藻糖等单一保护剂对冻干后菌株67的黏附率具有较大的影响,而含有160 g/L脱脂乳、100 g/L菊粉、40 g/L蔗糖、70 g/L谷氨酸钠及120 g/L海藻糖的复合保护剂能够通过保护菌株的表面黏附素、疏水性及细胞膜等方式来改善菌株67的黏附能力、存活及酶活力,并较好地恢复了菌株67抑制金黄色葡萄球菌和大肠杆菌黏附Caco-2细胞的能力。
[1] TUO Y F, YU H L, AI L Z, et al.Aggregation and adhesion properties of 22 Lactobacillus strains[J].Journal of Dairy Science, 2013, 96(7):4 252-4 257.
[2] ALP D, KULEA AN H.Adhesion mechanisms of lactic acid bacteria:Conventional and novel approaches for testing[J].World Journal of Microbiology &Biotechnology, 2019, 35(10):156.
AN H.Adhesion mechanisms of lactic acid bacteria:Conventional and novel approaches for testing[J].World Journal of Microbiology &Biotechnology, 2019, 35(10):156.
[3] GAO X, WANG Z X, LI X, et al.A new Lactobacillus gasseri strain HMV18 inhibits the growth of pathogenic bacteria[J].Food Science and Human Wellness, 2022, 11(2):247-254.
[4] AYYASH M M, ABDALLA A K, ALKALBANI N S, et al.Invited review: Characterization of new probiotics from dairy and nondairy products—Insights into acid tolerance, bile metabolism and tolerance, and adhesion capability[J].Journal of Dairy Science, 2021, 104(8):8 363-8 379.
[5] WU H Q, XIE S, MIAO J F, et al.Lactobacillus reuteri maintains intestinal epithelial regeneration and repairs damaged intestinal mucosa[J].Gut Microbes, 2020, 11(4):997-1 014.
[6] RAO V B, FEISS M.The bacteriophage DNA packaging motor[J].Annual Review of Genetics, 2008, 42:647-681.
[7] VAN DE GUCHTE M, SERROR P, CHERVAUX C, et al.Stress responses in lactic acid bacteria[J].Antonie Van Leeuwenhoek, 2002, 82(1-4):187-216.
[8] KANDIL S, EL SODA M.Influence of freezing and freeze drying on intracellular enzymatic activity and autolytic properties of some lactic acid bacterial strains[J].Advances in Microbiology, 2015, 5(6):371-382.
[9] Z RATE G, NADER-MACIAS M E.Viability and biological properties of probiotic vaginal lactobacilli after lyophilization and refrigerated storage into gelatin capsules[J].Process Biochemistry, 2006, 41(8):1 779-1 785.
RATE G, NADER-MACIAS M E.Viability and biological properties of probiotic vaginal lactobacilli after lyophilization and refrigerated storage into gelatin capsules[J].Process Biochemistry, 2006, 41(8):1 779-1 785.
[10] CHENG Z Y, YAN X, WU J Y, et al.Effects of freeze drying in complex lyoprotectants on the survival, and membrane fatty acid composition of Lactobacillus plantarum L1 and Lactobacillus fermentum L2[J].Cryobiology, 2022, 105:1-9.
[11] OLUWATOSIN S O, TAI S L, FAGAN-ENDRES M A.Sucrose, maltodextrin and inulin efficacy as cryoprotectant, preservative and prebiotic-towards a freeze dried Lactobacillus plantarum topical probiotic[J].Biotechnology Reports, 2022, 33:e00696.
[12] 黄玉军, 姚瑶, 周帆, 等.益生菌干预频次及周期对高脂血症大鼠血清抗氧化能力的影响[J].现代食品科技, 2020, 36(1):1-7.
HUANG Y J, YAO Y, ZHOU F, et al.Effect of probiotic intervention frequency and cycle on serum antioxidant capacity in rats with hyperlipidemi[J].Modern Food Science and Technology, 2020, 36(1):1-7.
[13] 陈春萌. 消化应激对乳酸菌黏附能力的影响[D].扬州:扬州大学, 2021.
CHEN C M.Effect of oro-gastrointestinal stress on adhesion of lactic acid bacteria[D].Yangzhou:Yangzhou University, 2021.
[14] 陈大卫, 程月, 任晨瑜, 等.乳杆菌耐消化应激能力及消化应激对其肠道黏附能力的影响[J].食品科学, 2022, 43(14):143-150.
CHEN D W, CHENG Y, REN C Y, et al.Capability of Lactobacillus to tolerate digestive stress and effect of digestive stress on its intestinal adhesion capacity[J].Food Science, 2022, 43(14):143-150.
[15] 于平, 胡淳玉, 黄星星, 等.产肌醇的植物乳杆菌ZJ2868菌粉制备工艺[J].中国食品学报, 2021, 21(9):142-149.
YU P, HU C Y, HUANG X X, et al.Preparation process of inositol-producing Lactobacillus plantarum ZJ2868 powder[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):142-149.
[16] DIANAWATI D, MISHRA V, SHAH N P.Survival of microencapsulated probiotic bacteria after processing and during storage:A review[J].Critical Reviews in Food Science and Nutrition, 2016, 56(10):1 685-1 716.
[17] 李大鹏, 高玉荣.益生菌植物乳杆菌G1-28复合冻干发酵剂制备及保藏条件研究[J].食品工业科技, 2021, 42(10):100-104.
LI D P, GAO Y R.Preparation and preservation technology of probiotic Lactobacillus plantarum G1-28 composite lyophilized starter[J].Science and Technology of Food Industry, 2021, 42(10):100-104.
[18] 赵延胜, 肖香, 周兴华, 等.冻干保护剂影响植物乳杆菌代谢途径的研究[J].现代食品科技, 2016, 32(8):103-108;147.
ZHAO Y S, XIAO X, ZHOU X H, et al.Influence of cryoprotectants on the metabolic pathways of Lactobacillus plantarum[J].Modern Food Science and Technology, 2016, 32(8):103-108;147.
[19] BROECKX G, VANDENHEUVEL D, CLAES I J J, et al.Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J].International Journal of Pharmaceutics, 2016, 505(1-2):303-318.
[20] CAPELA P, HAY T K C, SHAH N P.Effect of cryoprotectants, prebiotics and microencapsulation on survival of probiotic organisms in yoghurt and freeze-dried yoghurt[J].Food Research International, 2006, 39(2):203-211.
[21] LU W J, FU N, WOO M W, et al.Exploring the interactions between Lactobacillus rhamnosus GG and whey protein isolate for preservation of the viability of bacteria through spray drying[J].Food &Function, 2021, 12(7):2 995-3 008.
[22] JEFFERY C J.Intracellular/surface moonlighting proteins that aid in the attachment of gut microbiota to the host[J].AIMS Microbiology, 2019, 5(1):77-86.
[23] FU N, CHEN X D.Towards a maximal cell survival in convective thermal drying processes[J].Food Research International, 2011, 44(5):1 127-1 149.
[24] CASTRO H P, TEIXEIRA P M, KIRBY R.Evidence of membrane damage in Lactobacillus bulgaricus following freeze drying[J].Journal of Applied Microbiology, 1997, 82(1):87-94.
[25] DIANAWATI D, SHAH N P.Survival, acid and bile tolerance, and surface hydrophobicity of microencapsulated B.animalis ssp.lactis Bb12 during storage at room temperature[J].Journal of Food Science, 2011, 76(9):M592-M599.
[26] 袁峥, 赵瑞香, 牛生洋, 等.酸胁迫下嗜酸乳杆菌菌体形态的扫描电镜观察[J].食品工业科技, 2012, 33(24):199-201.
YUAN Z, ZHAO R X, NIU S Y, et al.Observation of the mycelia morphology of Lactobacillus acidophilus with scanning electron microscope under acid stress[J].Science and Technology of Food Industry, 2012, 33(24):199-201.
[27] PEIGHAMBARDOUST S H, GOLSHAN TAFTI A, HESARI J.Application of spray drying for preservation of lactic acid starter cultures:A review[J].Trends in Food Science &Technology, 2011, 22(5):215-224.
[28] CARVALHO A S, SILVA J, HO P, et al.Relevant factors for the preparation of freeze-dried lactic acid bacteria[J].International Dairy Journal, 2004, 14(10):835-847.
[29] ADACHI T, KAKUTA S, AIHARA Y, et al.Visualization of probiotic-mediated Ca2+ signaling in intestinal epithelial cells in vivo[J].Frontiers in Immunology, 2016, 7:601.
[30] SAVEDBOWORN W, TEAWSOMBOONKIT K, SURICHAY S, et al.Impact of protectants on the storage stability of freeze-dried probiotic Lactobacillus plantarum[J].Food Science and Biotechnology, 2019, 28(3):795-805.
[31] YUSTE A, AROSEMENA E L, CALVO M  .Study of the probiotic potential and evaluation of the survival rate of Lactiplantibacillus plantarum lyophilized as a function of cryoprotectant[J].Scientific Reports, 2021, 11(1):19078.
.Study of the probiotic potential and evaluation of the survival rate of Lactiplantibacillus plantarum lyophilized as a function of cryoprotectant[J].Scientific Reports, 2021, 11(1):19078.
[32] ROMANO N, MARRO M, MARSAL M, et al.Fructose derived oligosaccharides prevent lipid membrane destabilization and DNA conformational alterations during vacuum-drying of Lactobacillus delbrueckii subsp.bulgaricus[J].Food Research International, 2021, 143:110235.
[33] POLOMSKA X, WOJTATOWICZ M, ZAROWSKA B, et al.Freeze-drying preservation of yeast adjunct cultures for cheese production[J].Polish Journal of Food and Nutrition Sciences, 2012, 62(3):143-150.
[34] AMINE K M, CHAMPAGNE C P, SALMIERI S, et al.Effect of palmitoylated alginate microencapsulation on viability of Bifidobacterium longum during freeze-drying[J].LWT - Food Science and Technology, 2014, 56(1):111-117.
[35] CARVALHO A S, SILVA J, HO P, et al.Protective effect of sorbitol and monosodium glutamate during storage of freeze-dried lactic acid bacteria[J].Le Lait, 2003, 83(3):203-210.
[36] LIÉVIN V, PEIFFER I, HUDAULT S, et al.Bifidobacterium strains from resident infant human gastrointestinal microflora exert antimicrobial activity[J].Gut, 2000, 47(5):646-652.
[37] IRAPORDA C, RUBEL I A, MANRIQUE G D, et al.Influence of inulin rich carbohydrates from Jerusalem artichoke (Helianthus tuberosus L.) tubers on probiotic properties of Lactobacillus strains[J].LWT, 2019, 101:738-746.
[38] PATIL A, MUNOT N, PATWEKAR M, et al.Encapsulation of lactic acid bacteria by lyophilisation with its effects on viability and adhesion properties[J].Evidence-Based Complementary and Alternative Medicine:ECAM, 2022, 2022:4651194.
[39] TYMCZYSZYN E E, DEL ROSARIO D AZ M, G
AZ M, G MEZ-ZAVAGLIA A, et al.Volume recovery, surface properties and membrane integrity of Lactobacillus delbrueckii subsp.bulgaricus dehydrated in the presence of trehalose or sucrose[J].Journal of Applied Microbiology, 2007, 103(6):2 410-2 419.
MEZ-ZAVAGLIA A, et al.Volume recovery, surface properties and membrane integrity of Lactobacillus delbrueckii subsp.bulgaricus dehydrated in the presence of trehalose or sucrose[J].Journal of Applied Microbiology, 2007, 103(6):2 410-2 419.
[40] JAWAN R, ABBASILIASI S, TAN J S, et al.Influence of type and concentration of lyoprotectants, storage temperature and storage duration on cell viability and antibacterial activity of freeze-dried lactic acid bacterium, Lactococcus lactis Gh1[J].Drying Technology, 2022, 40(9):1 774-1 790.
[41] VELLY H, BOUIX M, PASSOT S, et al.Cyclopropanation of unsaturated fatty acids and membrane rigidification improve the freeze-drying resistance of Lactococcus lactis subsp.lactis TOMSC161[J].Applied Microbiology and Biotechnology, 2015, 99(2):907-918.
[42] WANG J F, JIANG S M, HUANG J Q, et al.Optimization of initial cation concentrations for L-lactic acid production from fructose by Lactobacillus pentosus cells[J].Applied Biochemistry and Biotechnology, 2021, 193(5):1 496-1 512.
[43] PAPADIMITRIOU K, ALEGR A
A  , BRON P A, et al.Stress physiology of lactic acid bacteria[J].Microbiology and Molecular Biology Reviews:MMBR, 2016, 80(3):837-890.
, BRON P A, et al.Stress physiology of lactic acid bacteria[J].Microbiology and Molecular Biology Reviews:MMBR, 2016, 80(3):837-890.
[44] YADAV A K, TYAGI A, KAUSHIK J K, et al.Role of surface layer collagen binding protein from indigenous Lactobacillus plantarum 91 in adhesion and its anti-adhesion potential against gut pathogen[J].Microbiological Research, 2013, 168(10):639-645.
[45] JEFFERY C.Intracellular proteins moonlighting as bacterial adhesion factors[J].AIMS Microbiology, 2018, 4(2):362-376.
[46] CASTALDO C, VASTANO V, SICILIANO R A, et al.Surface displaced Alfa-enolase of Lactobacillus plantarum is a fibronectin binding protein[J].Microbial Cell Factories, 2009, 8:14.
[47] CANDELA M, BERGMANN S, VICI M, et al.Binding of human plasminogen to Bifidobacterium[J].Journal of Bacteriology, 2007, 189(16):5 929-5 936.