敌敌畏是有机磷农药的一种,由于具有广谱、高效、残效期短等优点在农业生产过程中被广泛使用[1-2]。调查显示从2005年开始我国每年敌敌畏生产力就已突破3万t/年且每年平均保持着10%以上的增长需求[3-5]。研究发现敌敌畏可通过呼吸道、皮肤接触等进入体内,当敌敌畏进入人体后可以与人体内的乙酰胆碱酯酶结合使其失活,引起神经传递障碍,使人产生抽搐、呕吐等症状,严重者甚至产生生命危险[6-8]。因此研究一种方便快捷的检测方法对果蔬中的敌敌畏进行快速检测分析具有重要意义。
目前,关于敌敌畏的检测方法主要有HPLC、酶联免疫法以及电化学分析法等[9]。HPLC、酶联免疫法等传统方法虽然具有检出限低、灵敏度高等优点,但设备操作复杂且携带不便,因此不适合快速检测的需求[10]。电化学酶传感器法由于具有检出限低、设备体积小、操作简单等优势,在敌敌畏快速定量分析方面具有较大的潜力[11-13]。酶分子是蛋白质大分子本身阻抗较大,因此在酶传感器的制备中往往引入纳米材料来提高传感器的灵敏度,常见的纳米材料有石墨烯、碳纳米管、纳米金等。
炭气凝胶(carbon aerogels,CAs)是一种以纳米粒子或高聚物分子为骨架组成具有低密度、高孔隙率、良好吸附性、催化性等优良特性的新型碳基质纳米材料,在电池、环境保护、储能以及色谱分离等方面被广泛应用[14-15]。近些年随着电化学传感器在快速定量分析方面的研究不断深入,CAs也越来越收到广大学者的关注,CAs不仅能够有效提高电化学传感器的灵敏度而且还可以为电化学反应提供稳定的电化学环境,催化电化学反应的进行,但同时也存在着分散性差的弊端[16-17]。研究发现,在碳基质纳米材料的制备过程中引入氮元素或复合其他纳米粒子可以有效缓解CAs分散性差的现状。金纳米棒具有生物相容性好、活性表面多以及优异的催化性和导电性等特性,成为CAs复合的理想粒子[18]。
此外,由于1-(4-磺酸)丁基-3-甲基咪唑硫酸氢盐离子液体(1-(4-sulfonic acid) butyl-3-methylimidazole bisulfate ionic liquid,[BSMIM]HSO4)具有化学和热稳定性好、电化学窗口宽、生物相容性、协同性好可以为酶分子提供稳定的反应环境,在酶传感器制备方面具有较大的应用潜力[19]。硼掺杂金刚石薄膜电极(boron-doped diamond,BDD)作为一种新型的电化学传感器制备电极,与玻碳电极、碳糊电极等其他常规电极相比具有电化学势窗宽、背景电流低、表面不易被污染以及可重复使用等优点,是制备有机磷酶传感器的理想电极[20]。因此,本文在CAs的制备中引入氮元素改善CAs的分散性同时复合金纳米棒,制备一种新型的氮掺杂炭气凝胶@金纳米棒纳米复合材料(nitrogen doped carbon aerogel@gold nanorods,N-CA@Au)并负载[BSMIM]HSO4以BDD为工作电极,制备一种具有更低检出限和灵敏度的新型N-CA@Au-[BSMIM]HSO4/BDD传感器对果蔬中的有机磷农药进行快速定量分析。
1 材料与方法
1.1 主要材料与试剂
间苯二酚,天津市凯通化学试剂有限公司;甲醛、乙醇,辽宁嘉诚精细化学品有限公司;三聚氰胺,天津渤化化学试剂有限公司;Na2CO3,成都釜山化学试剂有限公司;NaH2PO4、Na2HPO4,天津市化工三厂有限公司;硼氢化钠,天津市致远化学试剂有限公司;氯金酸,上海展云化工有限公司;C3389乙酰胆碱酯酶(acetylcholinesterase,AChE)、氯化乙酰胆碱(acetylcholine chloride, ATCl), 美国Sigma-Aldrich公司;羧甲基壳聚糖,广东翁江化学试剂有限公司;以上试剂均为分析纯。 敌敌畏(优级纯), 中国食品药品检定研究所。紫叶生菜,市售。
1.2 实验仪器
JSM-7001F热场发射扫描电子显微镜、JEM-2100高分辨透射电镜,日本电子株式会社;CHI-660E电化学工作站,上海辰华仪器有限公司;MFLGKDF205-12型马弗炉,杭州三永德仪器仪表有限公司;CJJ78-1磁力加热搅拌器,常州梅香仪器有限公司;PS-10A超声波清洗机,深圳市德康科技有限公司;硼掺杂金刚石薄膜电极,上海晶安生物科技有限公司。
1.3 实验方法
1.3.1 [BSMIM]HSO4-N-CA@Au的制备
N-CA的制备:准确量取13.5 mL的甲醛、5.51 g的间苯二酚于250 mL锥形瓶中然后加入100 mL的超纯水搅拌均匀,然后加入Na2CO3调节pH为8.0,将混合溶液磁力搅拌1 h,混合均匀标记为溶液A,备用。准确称取12.62 g的三聚氰胺、13.5 mL的甲醛于250 mL锥形瓶中然后加入100 mL的超纯水搅拌均匀,然后加入Na2CO3调节pH为8.0,将混合溶液于70 ℃条件下磁力搅拌30 min,混合均匀标记为溶液B,备用。将溶液A缓慢加入到溶液B中,磁力搅拌20 min使其完全反应形成水凝胶,然后将水凝胶转移至干燥箱中40 ℃保持24 h,70 ℃保持120 h使其完全凝胶化和老化,将老化后的水凝胶进行TiO2超临界干燥,收集干燥产物,备用。将干燥产物转移至马弗炉中于750 ℃(升温速度2 ℃/min)N2保护条件下保持120 min进行高温炭化处理,最后将高温炭化后的产物冷却至室温分别用无水乙醇、超纯水洗涤、干燥即得N-CA纳米材料[21-22]。
N-CA@Au的制备:称取100 mg制备好的N-CA于25 mL锥形瓶中,然后加入10 mL超纯水,超声分散20 min使其完全溶解。然后向其中加入200 μL质量浓度为2 mg/mL的KAuCl4,搅拌均匀,在磁力搅拌条件下加入1.0 mL质量浓度为2.5 mg/mL新鲜配制的硼氢化钠溶液,反复滴加3次,然后继续磁力搅拌30 min,最后将混合液于8 000 r/min离心,收集黑色产物,用超纯水将黑色产物反复洗涤3次后于60 ℃真空干燥即得N-CA@Au纳米复合材料[23]。
N-CA@Au-[BSMIM]HSO4的制备:离子液体[BSMIM]HSO4根据文献[24]合成。用移液枪准确吸取200 μL的[BSMIM]HSO4滴加到30 mL质量浓度为1.0 mg/mL的N-CA@Au的分散液中,超声分散20 min使其混合均匀,即得[BSMIM]HSO4-N-CA@Au,备用。
1.3.2 AChE/N-CA@Au-[BSMIM]HSO4/BDD的制备
将BDD置于王水中浸泡30 min去除表面灰尘异物,然后用无水乙醇和超纯水分别超声波清洗3 min常温干燥后备用。准确吸取5 μL质量浓度为1.0 mg/mL的[BSMIM]HSO4-N-CA@Au均匀滴加于BDD的表面,室温下自然干燥,得N-CA@Au-[BSMIM]HSO4/BDD,备用。以羧甲基壳聚糖为交联剂,准确吸取2.0 μL 3 g/L的羧甲基壳聚糖,3.0 μL的AChE (0.1 U/μL)和2.0 μL 10.0 g/L的牛血清白蛋白溶液 (防止酶分子聚集)于50 μL离心管中,超声波分散1 min混合均匀,用移液枪准确吸取3.5 μL的混合液均匀滴加在N-CA@Au-[BSMIM]HSO4/BDD的表面,4 ℃环境下干燥,即得AChE/N-CA@Au-[BSMIM]HSO4/BDD,4 ℃保存备用。
1.4 样品处理
以紫叶生菜为样品进行加标回收率试验,样品处理参考文献[25]的方法,分别制备1.0×10-8、5.0×10-8、1.0×10-7 g/L的加标待检样,备用。
2 结果与讨论
2.1 N-CA和N-CA@Au的形貌表征
分别用扫描电子显微镜(scanning electron microscope,SEM)和透射电子显微镜(transmission electron microscope, TEM)对N-CA和N-CA@Au进行形貌表征,结果如图1所示。

a-N-CA;b-N-CA@Au
图1 N-CA的SEM图和N-CA@Au的TEM图
Fig.1 SEM image of N-CA and TEM image of N-CA@Au
从图1分析可知,制备好的N-CA为簇状结构,表面有褶皱性纹理,这可以有效提高N-CA的表面积,制备好的Au为棒状纳米结构,均匀地附着于N-CA的表面纹理间隙中,其粒径约为10 nm,长度约为50 nm,这可以有效地提高N-CA表面电子的转移速率,提高N-CA的导电性。
2.2 不同传感器的交流阻抗表征
分别将制备好的BDD、N-CA/BDD、N-CA@Au/BDD、N-CA@Au-[BSMIM]HSO4/BDD和AChE/N-CA@Au-[BSMIM]HSO4/BDD置于10 mmol/L的铁氰化钾为电解质溶液中分别对其进行交流阻抗(electrochemical impedance spectroscopy, EIS)扫描,结果如图2所示。

图2 不同传感器的EIS曲线
Fig.2 EIS curve of different sensors
注:a-BDD;b-N-CA/BDD;c-AChE/N-CA@Au-[BSMIM]HSO4/BDD;d-N-CA@Au/BDD;e-N-CA@Au-[BSMIM]HSO4/BDD
从图2可知,BDD的阻抗为379.5 Ω,修饰N-CA后阻抗为293.35 Ω,与BDD相比,阻抗降低了22.70%,这是因为N-CA高比表面积和吸附特性可以为电化学反应提供更多的活性电位,加快电极表面电子转移数,进而有效降低电极阻抗。N-CA@Au/BDD的阻抗为183.76 Ω、N-CA@Au-[BSMIM]HSO4/BDD为67.21 Ω,与N-CA/BDD相比N-CA/BDD的阻抗降低了37.31%,这主要是因为Au具有良好的导电性,当其均匀附着在N-CA的表面时可以很好地降低N-CA的阻抗;N-CA@Au-[BSMIM]HSO4/BDD与N-CA@Au/BDD相比阻抗降低了63.43%这主要得益于[BSMIM]HSO4具有良好的稳定性好、生物相容性以及协同作用,可以为电化学反应提供稳定的环境,进而降低电极阻抗。AChE/N-CA@Au-[BSMIM]HSO4/BDD的阻抗为230.38 Ω,与N-CA@Au-[BSMIM]HSO4/BDD相比2.43倍,这是因为AChE为生物大分子,本身阻抗较大,故当其修饰在N-CA@Au-[BSMIM]HSO4/BDD表面时阻抗增加,这说明AChE已经有效地固定在了传感器表面[26]。
2.3 不同传感器的差分脉冲曲线
以pH 7.5的PBS为电解质溶液, 分别用AChE/BDD和AChE/N-CA@Au-[BSMIM]HSO4/BDD对1.0 mmol/L的ATCl进行差分脉冲(differential pulse voltammetry, DPV)扫描,记录氧化峰电流(oxidation peak current,Ip);然后向ATCl溶液中加入敌敌畏使其质量浓度为1.0×10-7 g/L,将AChE/N-CA@Au-[BSMIM]HSO4/BDD插入其中对其进行抑制6 min后再对其进行DPV扫描,记录Ip其结果见图3。

图3 不同传感器的DPV曲线
Fig.3 DPV curve of different sensors
注:a:AChE/BDD (1.0 mmol/L-ATCl);b:AChE/N-CA@Au-[BSMIM]HSO4/BDD (1.0 mmol/L-ATCl);c:AChE/N-CA@Au-[BSMIM]HSO4/BDD(1.0 mmol/L-ATCl +1.0×10-7 g/L-敌敌畏)
从图3可知,AChE/BDD在1.0 mmol/L的ATCl中测得的Ip为1.254 μA,AChE/N-CA@Au-[BSMIM]HSO4/BDD在1.0 mmol/L的ATCl中测得的Ip为2.586 μA与AChE/BDD相比Ip提高了1.06倍,这说明N-CA@Au-[BSMIM]HSO4能够有效地促进电极表面电化学反应的进行,提高电极表面电子的转移速率,为电化学反应提供稳定的反应体系,有效提高电极的灵敏度。当AChE/N-CA@Au-[BSMIM]HSO4/BDD被敌敌畏抑制6 min后AChE/N-CA@Au-[BSMIM]HSO4/BDD对1.0 mmol/L的ATCl测得的Ip为1.494 μA与抑制前相比Ip降低了42.23%,这是因为敌敌畏可以抑制AChE的活性,减弱催化反应的进行,进而导致Ip降低,其敌敌畏对AChE的抑制率和敌敌畏浓度存在一定的关系,据此可对敌敌畏进行定量分析。
2.4 AChE/N-CA@Au-[BSMIM]HSO4/BDD制备条件的优化
分别吸取150(1∶200)、200(1∶150)、250(1∶120)、300(1∶100)和350(7∶600) μL的[BSMIM]HSO4/BDD滴加入30 mL质量浓度为1.0 mg/mL的N-CA@Au的分散液中制备N-CA@Au-[BSMIM]HSO4并构建AChE/N-CA@Au-[BSMIM]HSO4/BDD然后对1.0 mmol/L的ATCl进行DPV扫描来研究[BSMIM]HSO4/BDD与N-CA@Au不同比对AChE/N-CA@Au-[BSMIM]HSO4/BDD的影响。分别采用1.0(0.1 U)、1.5(0.15 U)、2.0(0.2 U)、2.5(0.25 U)和3.0(0.3 U) μL的AChE (0.1 U/μL)制备AChE/N-CA@Au-[BSMIM]HSO4/BDD对1.0 mmol/L的ATCl进行DPV扫描来研究AChE对AChE/N-CA@Au-[BSMIM]HSO4/BDD影响,结果如图4所示。
从图4可知N-CA@Au-[BSMIM]HSO4和AChE对传感器均有较大的影响,彼此都呈现先增大后减小的趋势。当[BSMIM]HSO4/BDD与N-CA@Au的比为1∶150时Ip最大,这是因为[BSMIM]HSO4/BDD虽然能够使修饰材料、AChE和BDD发挥良好地协同作用为电化学反应提供稳定的环境,但同时也发现当[BSMIM]HSO4比重过大时其影响电极表面的成膜效果,进而导致电极阻抗增大电流降低。AChE虽然能够ATCl水解,但AChE也为生物蛋白大分子本身阻抗较大,当AChE达到一定量时对底物ATCl的催化效果达到极限,过多使用反而会增加电极本身阻抗降低电流响应。因此,综上所述选取[BSMIM]HSO4/BDD与N-CA@Au的比为1∶150,AChE的固载量为0.15 U。
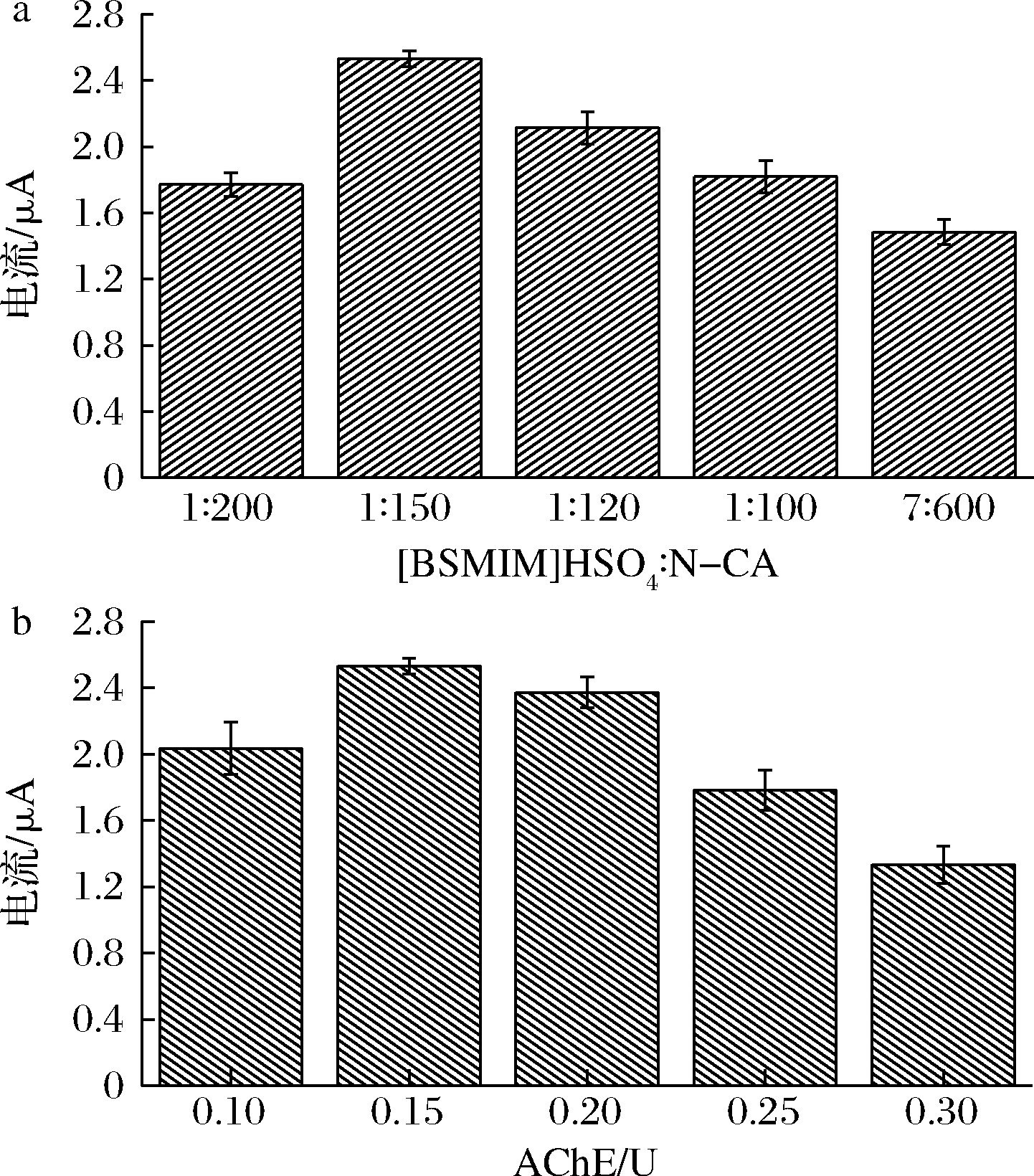
a-N-CA@Au-[BSMIM]HSO4对传感器的影响;b-AChE对传感器的影响
图4 N-CA@Au-[BSMIM]HSO4和AChE对传感器的影响(n=3)
Fig.4 Effect of N-CA@Au-[BSMIM]HSO4 and AChE on sensor(n=3)
2.5 抑制时间对敌敌畏对传感器抑制率的影响
在最佳试验条件下采用AChE/N-CA@Au-[BSMIM]HSO4/BDD对1.0 mmol/L的ATCl进行DPV扫描记录Ip0,然后向其中加入敌敌畏使其质量浓度为1.0×10-7 g/L然后每隔2 min对其进行DPV扫描一次并分别记录Ip2、Ip4……Ipn根据抑制率=(Ip0- Ipn)/Ip0分别计算不同抑制时间下的抑制率,其结果如图5。

图5 抑制时间对抑制率的影响(n=3)
Fig.5 Effect of inhibition time on inhibition rate(n=3)
从图5可知,随着抑制时间的增加,敌敌畏对传感器的抑制率也逐渐增加,但抑制率的增加速率逐渐降低且当6 min后其抑制率逐渐趋于稳定,这是因为CA具有多孔结构和吸附特性可以使敌敌畏与AChE很快结合达到抑制效果,这可以有效地缩短对敌敌畏的检测时间,进一步达到快速检测的目的。因此综上所述,抑制时间选取6 min。
2.6 标准曲线的绘制
在最佳试验条件下采用AChE/N-CA@Au-[BSMIM]HSO4/BDD分别对1.0×10-11~1.0×10-4 g/L敌敌畏进行抑制测定,其结果如图6所示。
从图6可知,敌敌畏浓度与其对AChE/N-CA@Au-[BSMIM]HSO4/BDD抑制率的负对数在0.5×10-10~1.0×10-5 g/L范围内呈线性关系,线性方程Y=-8.454 5X+100.514 7,R2=0.997 4检出限为(按抑制率10%计算)1.967 4×10-11 g/L,线性范围较宽,检出限较低明显优于同类型的其他传感器,见表1。

图6 敌敌畏浓度与抑制率间的关系曲线(n=3)
Fig.6 Relationship curve between the concentration of dichlorvosand inhibition rate(n=3)
表1 不同传感器的检测效果
Table 1 Detection effect of different sensors

2.7 实际样品检测
以紫叶生菜为实际样品,采用制备好的AChE/N-CA@Au-[BSMIM]HSO4/BDD分别对不同质量浓度的敌敌畏进行加标回收率试验,并与HPLC进行比对,结果见表2。
表2 敌敌畏检测结果
Table 2 Results of detecting dichlorvos
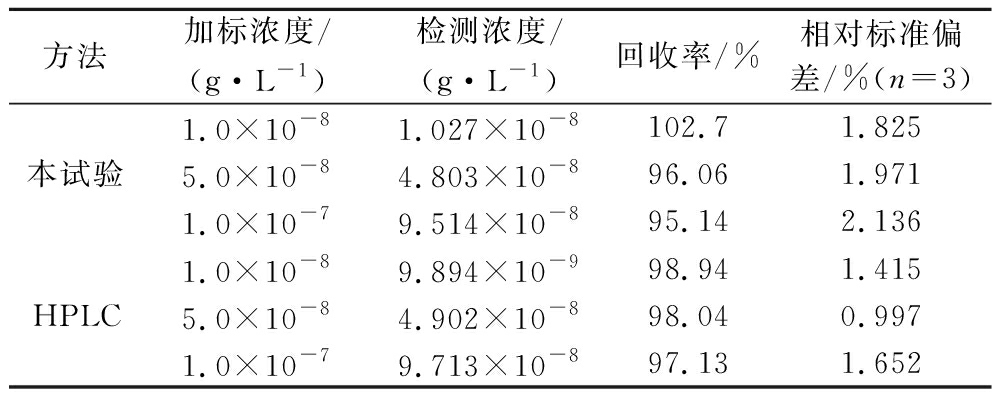
方法加标浓度/(g·L-1)检测浓度/(g·L-1)回收率/%相对标准偏差/%(n=3)本试验1.0×10-81.027×10-8102.71.8255.0×10-84.803×10-896.061.9711.0×10-79.514×10-895.142.136HPLC1.0×10-89.894×10-998.941.4155.0×10-84.902×10-898.040.9971.0×10-79.713×10-897.131.652
从表2可知,AChE/N-CA@Au-[BSMIM]HSO4/BDD对敌敌畏的加标回收率在95.14%~102.72%之间,检测结果与HPLC一致,精密度较高,可用于实际样品的定量分析。
2.8 抗干扰性研究
由于在敌敌畏的使用过程中往往还会有重金属离子如Pb2+、Cd2+和Hg2+等重金属离子以及西维因、灭多威等氨基甲酸之类农药残留的存在,因此在1.0×10-7 g/L中分别加入50倍的上述干扰物,采用AChE/N-CA@Au-[BSMIM]HSO4/BDD对1.0 mmol/L的ATCl进行DPV扫描对传感器的抗干扰能力进行研究,其结果如图7所示。
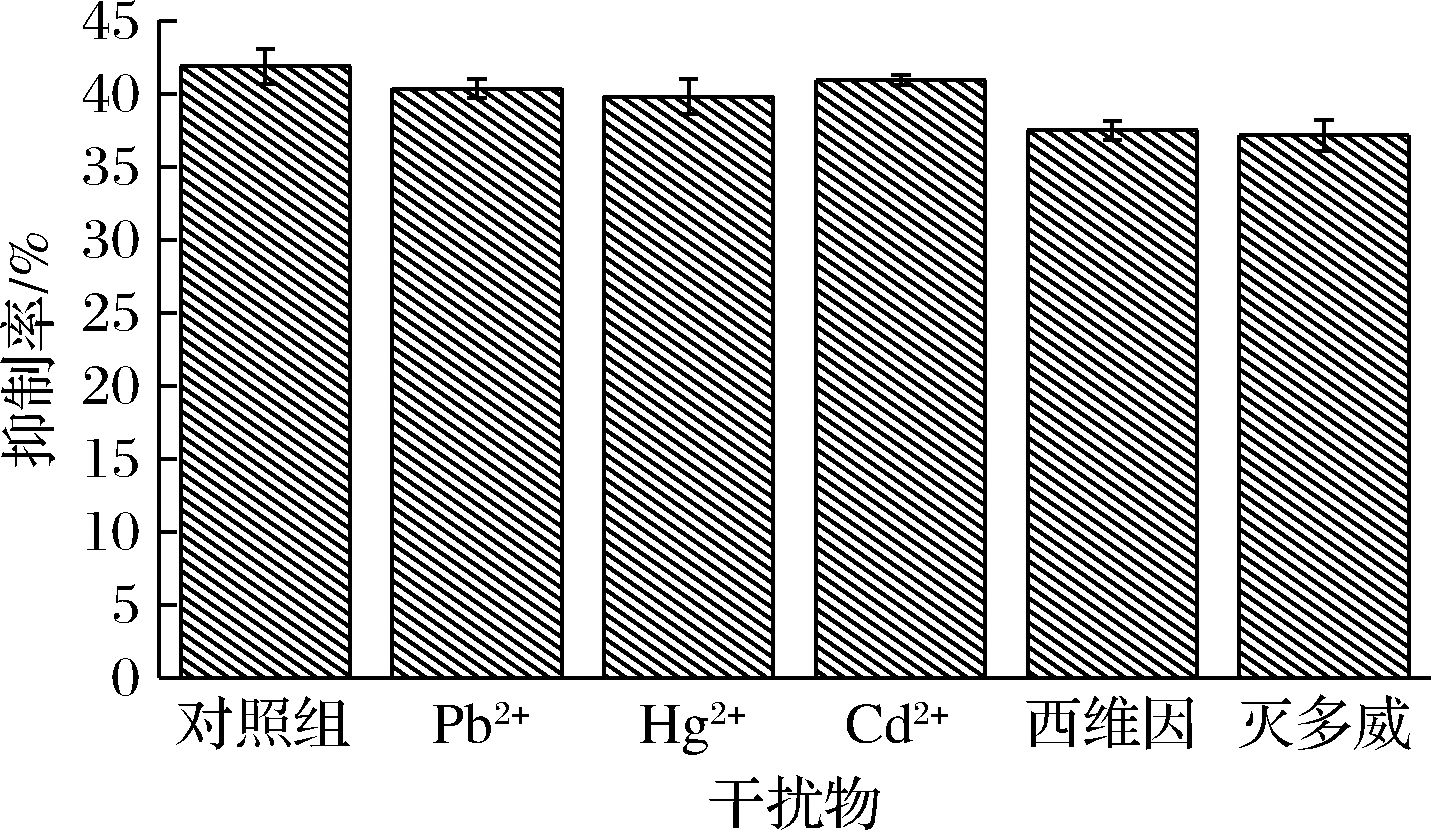
图7 干扰物对传感器的影响(n=3)
Fig.7 Effect of interferents on sensors(n=3)
从图7可知,当没干扰物存在时敌敌畏对传感器的抑制率为41.89%,当有重金属离子存在时,敌敌畏对传感器的抑制率在39.12%~40.95%,是对照组的95.06%~97.75%,偏差均小于5%,说明制备的传感器对常见的重金属离子有较好的抗干扰能力[32],当加入西维因和灭多威后敌敌畏对传感器的抑制率分别为37.52%和37.16%,分别为对照组的89.57%和88.71%,这说明制备的传感器对氨基甲酸之类农药西维因和灭多威抗干扰能力相对较弱。
2.9 稳定性和再生性研究
将制备好的AChE/N-CA@Au-[BSMIM]HSO4/BDD置于4 ℃环境中每隔5 d对1.0 mmol/L的ATCl进行DPV扫描一次对其稳定性进行研究;采用AChE/N-CA@Au-[BSMIM]HSO4/BDD对1.0 mmol/L的ATCl进行DPV扫描并记录Ip作为对照,然后用1.0×10-7 g/L的敌敌畏抑制6 min后将其浸泡在10 mmol/L的碘解磷定溶液中[24],每隔2 min对1.0 mmol/L的ATCl进行DPV扫描一次并记录Ip对其再生性进行研究,其结果如图8所示。

a-稳定性;b-再生性
图8 传感器的稳定性和再生性柱状图(n=3)
Fig.8 histogram of sensor stability and reproducibility(n=3)
从图8-a可知,AChE/N-CA@Au-[BSMIM]HSO4/BDD在4 ℃保存35 d后其对1.0 mmol/L的ATCl催化效果仍可达到最初的94.01%,说明其稳定性较好。由图8-b可知,将AChE/N-CA@Au-[BSMIM]HSO4/BDD用碘解磷定浸泡8 min后其对1.0 mmol/L的ATCl的检测结果可恢复至对照组的93.62%,说明AChE/N-CA@Au-[BSMIM]HSO4/BDD的再生性较好,可重复使用。
3 结论
研究制备了一种新型的N-CA@Au纳米材料并复合[BSMIM]HSO4构建了一种新的AChE型传感器对敌敌畏进行定量分析。N-CA的多孔隙结构和吸附特性可以为AChE、底物ATCl以及敌敌畏提供良好的反应环境,同时[BSMIM]HSO4的引入使AChE、N-CA@Au、BDD间发挥了良好的协同作用,有效地提高了传感器的灵敏度。和其他传感器相比AChE/N-CA@Au-[BSMIM]HSO4/BDD具有更高的检出限和灵敏度且稳定性和再生性较好,为敌敌畏等有机磷农药的快速检测分析提供了一种新的方案。
[1] TANG J, MA X H, YANG J, et al.Recent advances in metal-organic frameworks for pesticide detection and adsorption[J].Dalton Transactions (Cambridge, England:2003), 2020, 49(41):14 361-14 372.
[2] KARIMI-MALEH H, YOLA M L, ATAR N, et al.A novel detection method for organophosphorus insecticide fenamiphos:Molecularly imprinted electrochemical sensor based on core-shell Co3O4@MOF-74 nanocomposite[J].Journal of Colloid and Interface Science, 2021, 592:174-185.
[3] XU L P, LI J B, ZHANG J J, et al.A disposable molecularly imprinted electrochemical sensor for the ultra-trace detection of the organophosphorus insecticide phosalone employing monodisperse Pt-doped UiO-66 for signal amplification[J].The Analyst, 2020, 145(9):3 245-3 256.
[4] ZHAI R Q, CHEN G, LIU G Y, et al.Enzyme inhibition methods based on Au nanomaterials for rapid detection of organophosphorus pesticides in agricultural and environmental samples:A review[J].Journal of Advanced Research, 2022, 37:61-74.
[5] HU H Y, YANG L Q.Development of enzymatic electrochemical biosensors for organophosphorus pesticide detection[J].Journal of Environmental Science and Health.Part.B, Pesticides, Food Contaminants, and Agricultural Wastes, 2021, 56(2):168-180.
[6] LUO R P, FENG Z J, SHEN G N, et al.Acetylcholinesterase biosensor based on mesoporous hollow carbon spheres/core-shell magnetic nanoparticles-modified electrode for the detection of organophosphorus pesticides[J].Sensors (Basel, Switzerland), 2018, 18(12):4429.
[7] GAO N, TAN R N, CAI Z W, et al.A novel electrochemical sensor via Zr-based metal organic framework-graphene for pesticide detection[J].Journal of Materials Science, 2021, 56(34):19 060-19 074.
[8] TADELE K T, FEYISA T Y.Nanocomposite based enzyme-less electrochemical sensors for carbamate and organophosphorus pesticides detection[J].Current Nanomaterials, 2022, 7(2):93-109.
[9] SUN Q, DU J Y, TIAN L, et al.Detection of organophosphorus pesticides:Exploring oxime as a probe with improved sensitivity by CeO2-modified electrode[J].Analytical Methods:Advancing Methods and Applications, 2021, 13(39):4 634-4 641.
[10] MA L, HE Y, WANG Y R, et al.Nanocomposites of Pt nanoparticles anchored on UiO66-NH2 as carriers to construct acetylcholinesterase biosensors for organophosphorus pesticide detection[J].Electrochimica Acta, 2019, 318:525-533.
[11] 王静静, 卫敏, 郭红艳.基于碳球的乙酰胆碱酯酶传感器用于对硫磷的检测研究[J].分析试验室, 2015, 34(3):318-321.
WANG J J, WEI M, GUO H Y.Preparation of acetylcholinesterase biosensor based on carbon spheres for parathion detection[J].Chinese Journal of Analysis Laboratory, 2015, 34(3):318-321.
[12] TAO H, LIU F, JI C, et al.A novel electrochemical sensing platform based on the esterase extracted from kidney bean for high-sensitivity determination of organophosphorus pesticides[J].RSC Advances, 2022, 12(9):5 265-5 274.
[13] 王静静, 赵凤娟, 卫敏.基于新型乙酰胆碱酯酶传感器的有机磷农药检测[J].粮油食品科技, 2015, 23(5):77-81.
WANG J J, ZHAO F J, WEI M.Detection of organophosphorus pesticide based on novel acetylcholinesterase biosensor[J].Science and Technology of Cereals, Oils and Foods, 2015, 23(5):77-81.
[14] 闫昊. 炭气凝胶及其复合材料的制备与电化学性能的研究[D].北京:北京化工大学, 2020.
YAN H.Preparation and electrochemical properties of carbon aerogels and their composite materials[D].Beijing:Beijing University of Chemical Technology, 2020.
[15] 董佳伟. 多孔聚苯乙烯基气凝胶及其衍生炭气凝胶的制备及性能研究[D].合肥:合肥工业大学, 2021.
DONG J W.Study on the fabrication and performance of the porous polystyrene-based aerogels &derived carbon aerogels[D].Hefei:Hefei University of Technology, 2021.
[16] LI F, XIE L J, SUN G H, et al.Resorcinol-formaldehyde based carbon aerogel:Preparation, structure and applications in energy storage devices[J].Microporous and Mesoporous Materials, 2019, 279:293-315.
[17] WANG C H, KIM J, TANG J, et al.Large-scale synthesis of MOF-derived superporous carbon aerogels with extraordinary adsorption capacity for organic solvents[J].Angewandte Chemie (International Ed.in English), 2020, 59(5):2 066-2 070.
[18] 金华丽, 姜海洋.基于氮掺杂碳球生长金的酶传感器检测蔬菜中的克百威[J].食品科学, 2017, 38(24):296-301.
JIN H L, JIANG H Y.Development of acetylcholinesterase biosensor for detection of carbofuran in vegetables based on nitrogen-doped carbon sphere-gold nanoparticles composite modified electrode[J].Food Science, 2017, 38(24):296-301.
[19] 王静静. 基于碳基复合材料的酶传感器用于有机磷农药的检测方法研究[D].郑州:河南工业大学, 2016.
WANG J J.Enzyme biosensor based on carbon materials for rapid detection of organophosphate pesticides[D].Zhengzhou:Henan University of Technology, 2016.
[20] WEI M, WANG J J, GUO J X, et al.Nanoparticles-polyaniline-multiwalled carbon nanotubes for determination of organophosphate pesticides[J].Asian Journal of Chemistry, 2014, 26(15):4 679-4 683.
[21] RASINES G, LAVELA P, MAC AS C, et al.N-doped monolithic carbon aerogel electrodes with optimized features for the electrosorption of ions[J].Carbon, 2015, 83:262-274.
AS C, et al.N-doped monolithic carbon aerogel electrodes with optimized features for the electrosorption of ions[J].Carbon, 2015, 83:262-274.
[23] LI Y, HE J L, CHEN J, et al.A dual-type responsive electrochemical immunosensor for quantitative detection of PCSK9 based on n-C60-PdPt/N-GNRs and Pt-poly (methylene blue) nanocomposites[J].Biosensors and Bioelectronics, 2018, 101:7-13.
[24] WEI M, WANG J J.A novel acetylcholinesterase biosensor based on ionic liquids-AuNPs-porous carbon composite matrix for detection of organophosphate pesticides[J].Sensors and Actuators B:Chemical, 2015, 211:290-296.
[25] 王静静, 居仪焰.基于纳米金/铜有机骨架的酶传感器检测蔬菜中敌敌畏[J].食品安全质量检测学报, 2022, 13(8):2 513-2 519.
WANG J J, JU Y Y.Detection of dichlorvos in vegetables based on gold nanoparticles/copper-origin frameworks enzyme sensor[J].Journal of Food Safety &Quality, 2022, 13(8):2 513-2 519.
[26] HOU W J, ZHANG Q Q, DONG H W, et al.Acetylcholinesterase biosensor modified with ATO/OMC for detecting organophosphorus pesticides[J].New Journal of Chemistry, 2019, 43(2):946-952.
[27] DHULL V.A Nafion/AChE-cSWCNT/MWCNT/Au-based amperometric biosensor for the determination of organophosphorous compounds[J].Environmental Technology, 2020, 41(5):566-576.
[28] MAHMOUDI E, FAKHRI H.High-performance electrochemical enzyme sensor for organophosphate pesticide detection using modified metal-organic framework sensing platforms[J].Bioelectrochemistry, 2019, 130:1-10.
[29] ZHAO G Z, ZOU B H, WANG X W, et al.Detection of organophosphorus pesticides by nanogold/mercaptomethamidophos multi-residue electrochemical biosensor[J]. Food Chemistry, 2021, 354:1-7.
[30] WANG B, LI Y R, HU H Y, et al.Acetylcholinesterase electrochemical biosensors with graphene-transition metal carbides nanocomposites modified for detection of organophosphate pesticides[J].PLoS One, 2020, 15(4):e0231981.
[31] ZHAO Y S, ZUO X, LU X, et al.Hierarchical porous hollow N-doped Cu-based MOF derivatives as highly sensitive electrochemical sensing platform for pesticides detection[J].Sensors and Actuators B:Chemical, 2022, 362:1 749-1 762.
[32] THANGARASU R, DHAYABARAN V V, ALAGUMUTHU M.MnO2/PANI/rGO-A modified carbon electrode based electrochemical sensor to detect organophosphate pesticide in real food samples[J].Analytical Bioanalytical Electrochemistry, 2019, 11(4):427-447.