低聚肽一般指由2~4个氨基酸组成,分子质量小于1 000 u的肽。已有大量研究表明,低聚肽分子质量小,特异性强,具有抗氧化[1]、调节血糖[2]、增强免疫力[3]、调解血脂[4]、降血压[5]等多种生理功能。小麦低聚肽是以小麦蛋白为原料,经过酶解、喷雾干燥等手段制备的小分子肽混合物,其溶解性好,易于消化吸收[6-7]。研究表明,小麦低聚肽具有抗氧化、调节免疫、降血压、调节血液胆固醇、抗过敏、抗癌等生理功能[8-10]。铁是一种人体必需的微量元素,在体内影响组织呼吸,推动氧化还原酶反应系统,机体铁缺乏会造成贫血,还会影响消化系统[11]。因此,铁的摄入和吸收显得尤为重要。
目前,人体对于铁元素的摄入主要包括以动物性食物为来源的血红素铁和以植物性食物为来源的非血红素铁。植物性食物中植酸、草酸、多酚等物质影响铁的吸收,而动物性食物过量摄入会引起高血压、高血脂、高血糖等并发症。有研究指出,以海洋鱼皮低聚肽、酪蛋白肽以及乳清蛋白肽为主要原料制备低聚肽螯合铁,能够作为新型食源性铁补充剂[11],这拓展了铁元素的摄入来源。但目前以植物低聚肽为原料制备铁螯合物的研究较少。本研究以食源性小麦低聚肽与FeCl2进行螯合制备小麦低聚肽螯合铁,并对其结构进行表征,以期为食源性肽铁补充剂的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
小麦低聚肽,北京中食海氏生物技术有限公司;FeCl2、三乙醇胺、NH4Cl、MgSO4、NaOH、铬黑T、氨水、盐酸、硝酸、无水乙醇、三氟乙酸(均为分析纯)、乙腈(色谱纯),北京化学试剂公司;KBr(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
HH数显恒温水浴锅,金坛区富华仪器有限公司;FA 2004 N电子天平、LRH-99-250恒温箱,上海一恒科技有限公司;CD4-2离心机,北京医用离心机厂;SJ-3F型pH计,上海精密仪器有限公司;SHZ-3循环水多用真空泵,郑州朋来仪器有限公司;Pl403天平,梅特勒-托利多仪器公司;Nicolet 6700傅里叶变换红外光谱(Fourier transform infrared,FT-IR)仪,Perkin Elmer。
1.3 小麦低聚肽螯合铁样品的制备
小麦低聚肽螯合铁样品的制备流程为:
小麦低聚肽粉→溶解→加入抗氧化剂→调节pH→加入FeCl2→恒温水浴振荡螯合→浓缩→醇沉→抽滤、洗涤→干燥制得成品
1.4 样品螯合效果的测定
1.4.1 铁含量的测定
采用EDTA络合滴定法,按公式(1)(2)计算铁含量:
铁质量=c×V×10-3×56
(1)
式中:c,EDTA标定后的浓度,mol/L;V,EDTA滴定过程中需要的体积,mL;56,铁元素的相对分子质量。
铁含量![]()
(2)
式中:m1,多肽铁螯合物中铁的含量,g;m0,小麦低聚肽螯合铁的质量,g。
1.4.2 小麦低聚肽螯合铁得率的测定
计算如公式(3)所示:
小麦低聚肽螯合铁得率![]()
(3)
式中:m0,小麦低聚肽螯合铁的质量,g;m,小麦低聚肽和FeCl2的总质量,g。
1.4.3 铁螯合率的测定
1.4.3.1 螯合反应前体系中铁含量测定
取15 mL氨-氯化铵缓冲液(pH 11)于100 mL锥形瓶中,分别添加MgSO4 2滴、铬黑T指示剂2滴,充分摇匀,用0.05 mol/L的EDTA溶液进行滴定,溶液颜色由酒红色完全转变为蓝色即为滴定终点。
取反应前的溶液5 mL加入100 mL锥形瓶内,迅速加入三乙醇胺5滴、蒸馏水20 mL,混合均匀,滴加缓冲溶液后,利用EDTA溶液进行滴定,滴定过程中消耗的EDTA含量记为V1。
1.4.3.2 小麦低聚肽螯合铁中铁含量测定
缓冲液滴定方法同1.4.3.1,取5 mL反应后的溶液于100 mL锥形瓶中,加入20 mL无水乙醇,静置5 min后离心,取沉淀烘干处理。用盐酸湿法处理后加入20 mL蒸馏水和5滴三乙醇胺,混合均匀。加入缓冲液,使用EDTA溶液进行下一步的滴定,溶液完全变蓝即为滴定终点,EDTA消耗的体积记为V2。螯合率计算如公式(4)所示:
螯合率![]()
(4)
式中:V1,EDTA滴定前铁的体积,mL;V2,小麦低聚肽螯合铁滴定过程消耗的EDTA体积,mL。
1.5 小麦低聚肽螯合铁制备工艺单因素试验设计
设计单因素试验具体参数为:FeCl2 1 g,pH 6,温度65 ℃,分别在肽盐质量比为2∶1,4∶1,6∶1,8∶1,10∶1,12∶1的条件下反应45 min,研究肽盐质量比对螯合物得率和螯合率的影响。
FeCl2 1 g,肽盐质量比为8∶1,pH 6,螯合温度65 ℃的条件下,分别反应35、45、55、65、75、85 min,研究反应时间对螯合物得率和螯合率的影响。
FeCl2 1 g,肽盐质量比为8∶1,螯合温度65 ℃,分别在螯合pH 3、4、5、6、7、8的条件下反应45 min,研究pH对螯合物得率和螯合率的影响。
FeCl2 1 g,肽盐质量比为8∶1,pH 6,分别在螯合温度为35、45、55、65、75、85 ℃的条件下反应45 min,研究螯合温度对螯合物得率和螯合率的影响。
1.6 小麦低聚肽螯合铁制备工艺响应面设计
在单因素试验的基础上按照Box-Behnken中心组合设计原理,以回归方程作为函数估算的工具,进行4因素3水平响应曲面设计,确定影响试验指标的各因素及其交互作用,准确表述因素和响应值之间的关系,确定最佳工艺条件,中心组合试验水平见表1。
表1 中心组合试验水平表
Table 1 Central combination test level table
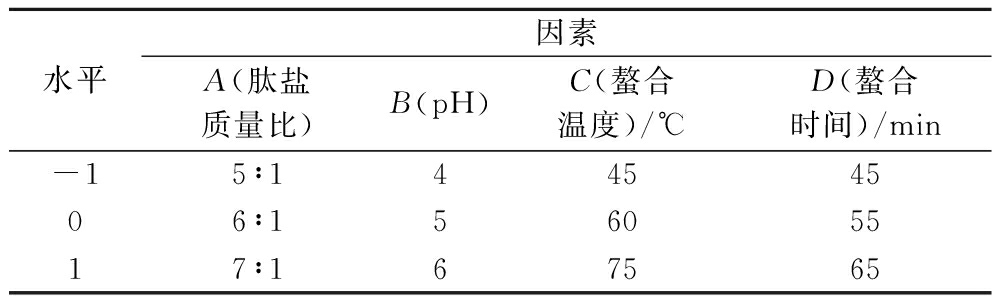
水平因素A(肽盐质量比)B(pH)C(螯合温度)/℃D(螯合时间)/min-15∶14454506∶15605517∶167565
1.7 小麦低聚肽螯合铁的结构表征
利用FT-IR对小麦低聚肽螯合铁进行结构表征。称取初步纯化后的小麦低聚肽螯合铁5 mg,放入玛瑙研钵中,在其中加入500 mg KBr,打开红外灯,在干燥环境下研磨并混合均匀。将均匀粉末放置于模具中压片处理,获得透明样品后采用FT-IR仪扫描,设置参数分辨率为4 cm-1、扫描范围为4 000~500 cm-1、扫描次数为32次。
1.8 数据处理
使用Excel 2010、SPSS 20和Design Expert 8.0.6软件对数据进行处理,并用Origin 2019软件绘图。
2 结果与分析
2.1 小麦低聚肽螯合铁单因素试验
2.1.1 肽铁的质量比对螯合效果的影响
肽盐质量比是影响螯合反应效果的重要因素,选取6组不同肽盐质量比探究其对螯合效果的影响,结果如图1所示。随着肽盐质量比的增加,螯合率呈现总体持续上升趋势,得率呈现总体先增加后降低的趋势。肽盐质量比过小,即FeCl2添加过量,小麦低聚肽无足够多的基团和Fe2+螯合,螯合率较低,则所得螯合物不稳定;肽盐质量比过大,即FeCl2添加量小,小麦低聚肽大量基团未螯合,反应不完全,会造成小麦低聚肽的浪费,成本提高[12],综合以上分析,为得到较好螯合率和得率,本实验初步得出小麦低聚肽和FeCl2质量比为6∶1。
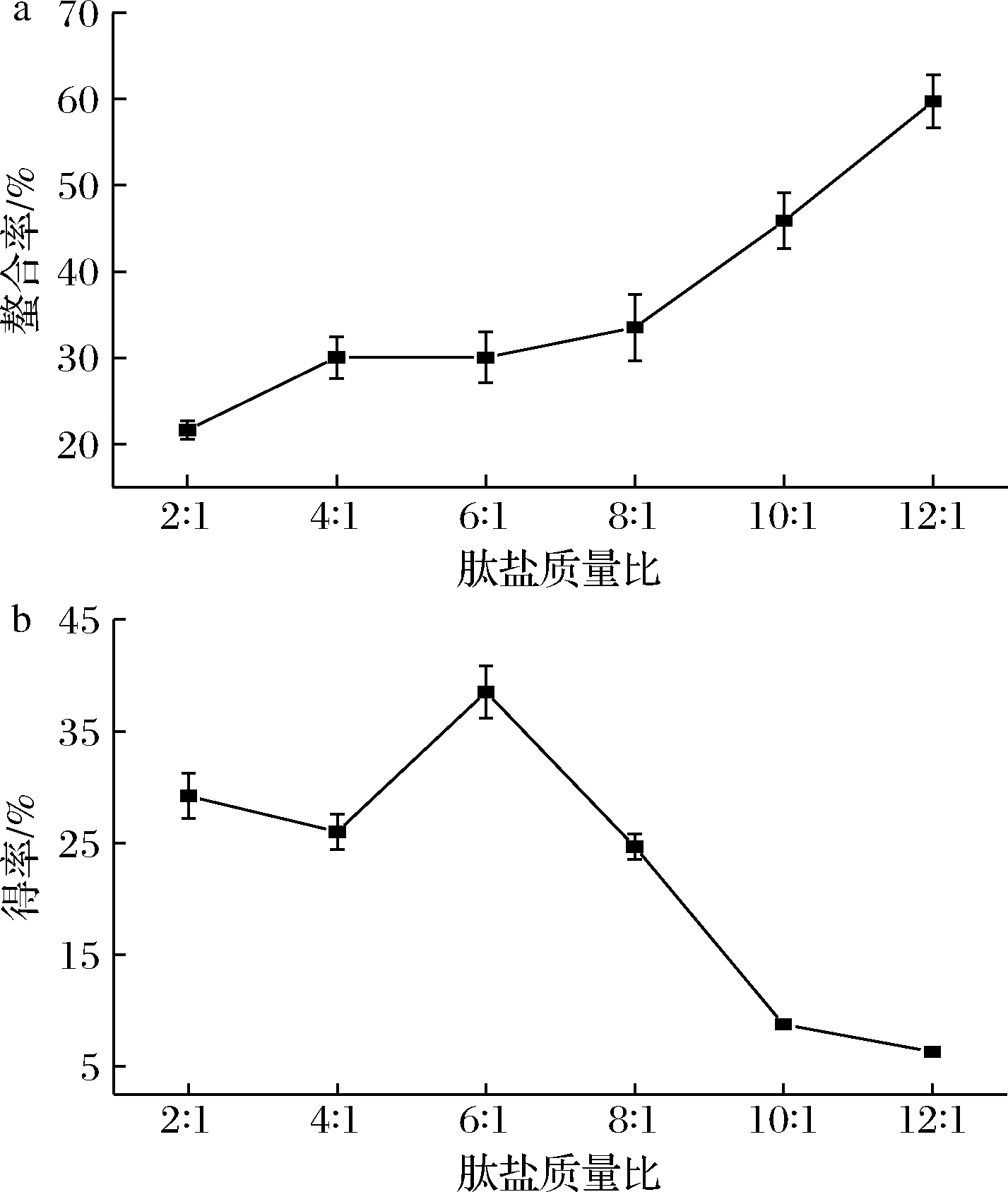
a-螯合率;b-得率
图1 肽盐质量比对螯合效果的影响
Fig.1 Effect of mass ratio of peptide salt on chelating effect
2.1.2 螯合时间对螯合效果的影响
选用螯合时间为35~85 min来探究螯合时间对螯合效果的影响,结果如图2所示。

a-螯合率;b-得率
图2 螯合时间对螯合效果的影响
Fig.2 Effect of chelating time on chelating effect
随着反应时间的延长,小麦低聚肽螯合铁的螯合率和得率先增加后降低,在65 min达到最大值。这是由于反应时间过短,小麦低聚肽和铁的螯合反应不彻底,产物中含有大量游离的Fe2+和配体,原料利用率低下。而反应时间过长则导致螯合物发生解离作用,且可能产生副反应,影响螯合反应效果。因此,初步确定螯合反应时间为65 min。
2.1.3 pH对螯合效果的影响
反应过程中,pH值影响螯合反应的得率和螯合率,设置pH值为3.0~8.0来探究其对螯合效果的影响,结果如图3所示。在酸性环境中,溶液中会存在大量的H+,H+与金属离子竞相争夺供电子基团,阻碍了多肽铁螯合物的形成;在碱性环境下,溶液中过多的OH-与供电子基团争夺金属离子,形成氢氧化物沉淀,也阻碍了螯合物的形成[13]。由实验结果可知,当pH值为5.0时,得率和螯合率均处于较大值,这说明此时H+和OH-对配体的影响较小,可能是由于此时有较多酸性及碱性的多肽物质处于等电点附近,受H+和OH-影响较小,供电子基团可以充分与铁通过配位键形成螯合物[14-15],因此,综合得率和螯合率,确定螯合反应的pH为5.0。
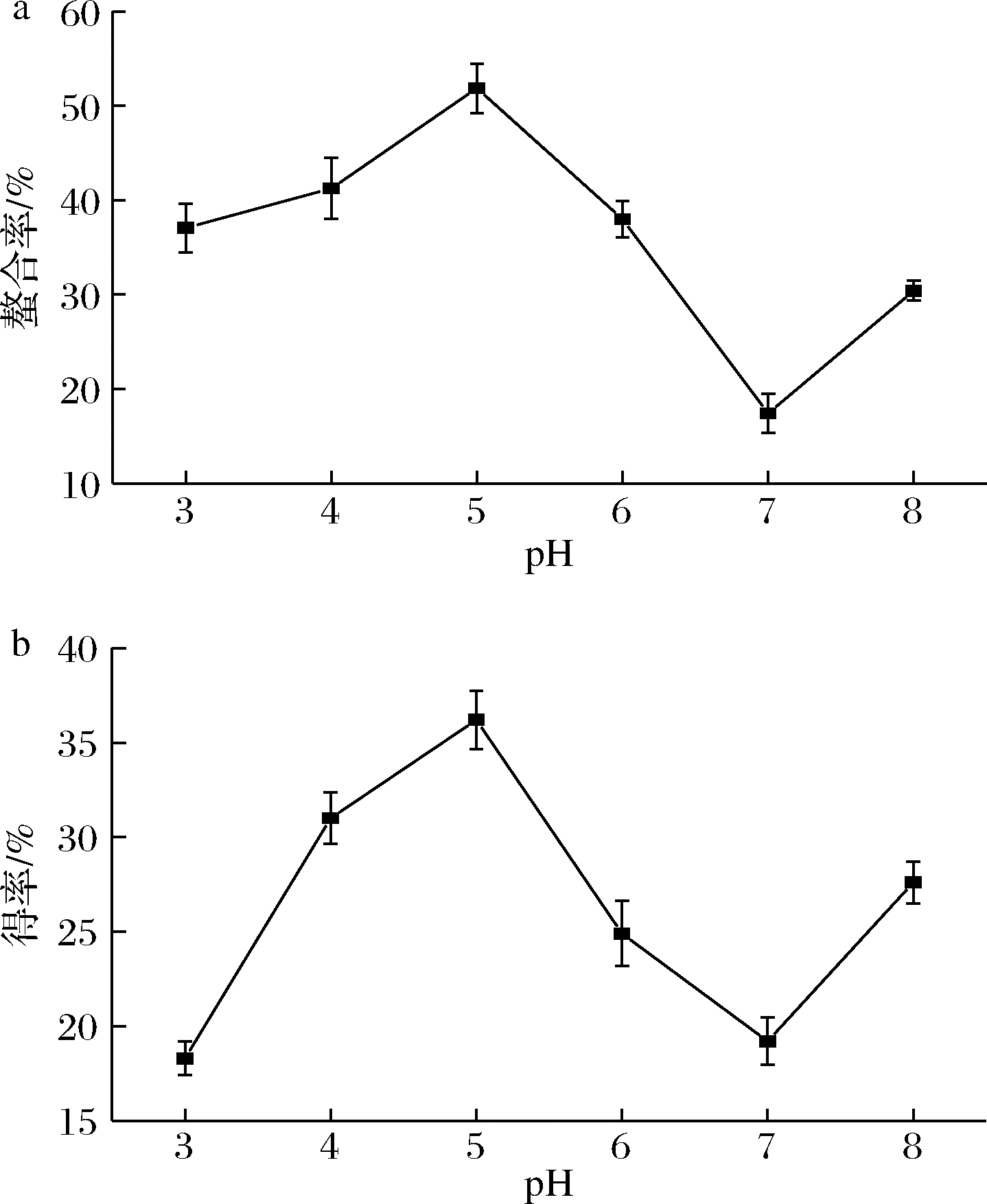
a-螯合率;b-得率
图3 pH对螯合效果的影响
Fig.3 Effect of pH on chelating effect
2.1.4 反应温度对螯合效果的影响
反应温度也是影响多肽和微量元素螯合反应的主要因素之一,设置螯合温度为35~85 ℃来探究反应温度对螯合效果的影响。由图4可知,反应温度对螯合率及得率影响均先总体升高后总体下降,由于螯合反应是吸热反应,在一定范围内,随着反应温度的升高,肽的溶解度逐渐增强,肽与铁的接触面积增大,螯合反应的得率和螯合率提高。且分子间的运动加剧,碰撞几率增大有利于螯合反应的进行。而超过一定范围,温度继续升高,螯合物不稳定易分解,氨基酸或小肽发生羰氨反应,与Fe2+形成竞争,使螯合率降低[16-18]。当反应温度在55 ℃时螯合效果最佳,因此确定反应温度为55 ℃。

a-螯合率;b-得率
图4 螯合温度对螯合效果的影响
Fig.4 Effect of chelating temperature on chelating effect
2.2 响应面设计试验结果及分析
根据单因素实验的结果,设计肽盐比、pH、螯合温度和螯合时间4因素3水平正交试验探究各影响因素对螯合效果的交互影响,所得结果如表2所示。采用Design Expert 8.0.6软件拟合回归多项参数,得到小麦低聚肽螯合铁得率和螯合率对(A)肽盐比、(B)pH、(C)螯合温度、(D)螯合时间的二次多项回归模型方程分别如公式(5)(6)所示:
f(x)=47.37-0.68A+1.15B-1.16C-0.89D-1.63AB+2.21AC+3.42AD-2BC-0.071BD+1.36CD-7.12A2-11.26B2-12.79C2-8.65D2
(5)
g(x)=62.54+1.26A+2.49B+1.55C-1.1D-3.24AB-3.17AC+1.65AD+3.68BC-0.47BD+1.07CD-16.86A2-10.3B2-17.26C2-12.17D2
(6)
对回归模型进行方差分析,结果如表3和表4所示。模型极显著(P<0.01)且失拟项均为不显著(P>0.05),模拟决定系数R2=97.91%,表明此响应面中心组合试验结果合理。表3结果中,二次项B2、C2、D2均对小麦低聚肽螯合铁得率有极显著性(P<0.01),而二次项A2对小麦低聚肽螯合铁得率有显著影响(P<0.05),其他项对得率无显著影响。由F值和P值得出各影响因素的主次顺序为C(螯合温度)>B(pH)>D(螯合时间)>A(肽盐比)。表4结果表示,二次项A2、B2、C2、D2均对小麦低聚肽螯合铁螯合率有极显著性(P<0.01),而一次项B对小麦低聚肽螯合铁螯合率有显著影响(P<0.05),其他项对小麦低聚肽螯合率无显著影响。由F值和P值得出各影响因素的主次顺序为B(pH)>C(螯合温度)>A(肽盐比)>D(螯合时间)。
根据实验结果和回归模型,得到小麦低聚肽螯合铁的最佳工艺条件为:肽盐比6∶1,pH 5,螯合温度为60 ℃,螯合时间为55 min,此条件下小麦低聚肽螯合铁的得率为47.49%,螯合率为62.68%。
表2 中心组合试验设计及结果
Table 2 Central combination test design and results

试验序号肽盐比pH温度/℃时间/min得率/%螯合率/%15∶14605527.0030.2527∶14605526.5032.1735∶16605531.0029.5247∶16605524.0044.4056∶15454525.7133.1966∶15754522.0031.1176∶15456523.4330.3686∶15756525.1432.5695∶15604542.8630.98107∶15604532.7529.45115∶15606526.6733.19127∶15606530.2538.25136∶14455524.8634.40146∶16455527.7128.75156∶14755526.0032.75166∶16755520.8641.83175∶15455525.6726.64187∶15455533.0030.36195∶15755527.0036.50207∶15755525.5027.56216∶14604522.2936.84226∶16604529.7145.23236∶14606526.0039.55246∶16606533.1446.05256∶15605545.7163.29266∶15605553.1461.00276∶15605550.8662.56286∶15605542.8660.88296∶15605544.2964.95
表3 中心组合试验设计方差分析表(得率)
Table 3 Analysis of variance of central combined test design (yield)

方差来源平方和自由度均方和FP显著性模型1 943.3814138.813.80 0.000 5**A-肽盐比5.5915.590.270.608 8B-pH15.84115.840.780.393 2C-温度16.06116.060.790.390 0D-时间9.5219.520.470.505 6AB10.56110.560.520.483 6AC19.51119.510.960.344 7AD46.86146.862.300.151 9BC16.00116.000.780.390 8BD0.02010.0209.995E-0040.975 2CD7.3717.370.360.557 5A2329.031329.0316.130.001 3*B2822.711822.7140.33<0.000 1**C21 060.4111 060.4151.98<0.000 1**D2485.561485.5623.800.000 2**残差285.621420.40失拟项207.561020.751.060.520 8纯误差78.11419.53总和2 229.0028
注:**P<0.01为极显著;*P<0.05为显著(下同)
表4 中心组合试验设计方差分析表(螯合率)
Table 4 Analysis of variance of central combined test design (chelating rate)

方差来源平方和自由度均方和FP显著性模型3 887.6414277.6922.96<0.000 1**A-肽盐比19.06119.061.580.229 9B-pH74.12174.126.130.026 7*C-温度28.84128.842.380.144 8D-时间14.46114.461.200.292 6AB41.99141.993.470.083 5AC40.09140.093.310.090 1AD10.88110.880.900.359 0BC54.19154.194.480.052 7BD0.8810.880.0730.790 9CD4.5914.590.380.547 9A21 843.0511 843.05152.40<0.000 1**B2687.521687.5256.85<0.000 1**C21 932.9511 932.95159.83<0.000 1**D2960.761960.7679.44<0.000 1**残差169.311412.09失拟项157.811015.785.490.057 6纯误差11.5042.88总和4 056.9528
2.3 工艺验证
通过响应面的回归模型得到小麦低聚肽螯合铁的最佳工艺条件为:肽盐比6∶1,pH 5,螯合温度为60 ℃,螯合时间为55 min,此条件下小麦低聚肽螯合铁的得率为47.49%,螯合率为62.68%。通过实验验证,平行组为6组,在此条件下小麦低聚肽螯合铁的得率为(51.13±1.16)%,螯合率为(62.61±0.84)%,与理论值接近,该模型得到的优化参数准确性较高。
2.4 小麦低聚肽螯合铁的结构鉴定
通过FT-IR对小麦低聚肽螯合铁的结构进行表征,结果如图5所示。

图5 小麦低聚肽及小麦低聚肽螯合铁傅里叶变换红外光谱图
Fig.5 FT-IR of wheat oligopeptides and iron-chelating wheat oligopeptides
由图5可知,小麦低聚肽在3 278 cm-1处出现N—H伸缩振动,即—NH2的伸缩振动,3 025、1 523 cm-1处出现了COO—的对称振动,2 939、1 646 cm-1出现了酰胺I带的C![]() O伸缩振动,1 036 cm-1处出现了单键的伸缩振动和变形振动。而在小麦低聚肽螯合铁的FT-IR谱图中,在3 260 cm-1处出现N—H伸缩振动,发生了蓝移,这是由于—NH2与铁发生了反应,生成了铵盐;2 936、1 610 cm-1出现了C
O伸缩振动,1 036 cm-1处出现了单键的伸缩振动和变形振动。而在小麦低聚肽螯合铁的FT-IR谱图中,在3 260 cm-1处出现N—H伸缩振动,发生了蓝移,这是由于—NH2与铁发生了反应,生成了铵盐;2 936、1 610 cm-1出现了C![]() O伸缩振动,且发生了蓝移,这是因为小麦低聚肽的COO—和铁发生了螯合反应导致,根据FT-IR结果分析可知,铁螯合在了小麦低聚肽的COO—和—NH2部分[19]。宋莎莎等[20]以乌鸡低聚肽和FeCl2为原料制备乌鸡肽铁螯合物,通过FT-IR对乌鸡肽铁进行结构分析,发现螯合物在3 030 cm-1的铵峰消失,而在1 046 cm-1处出现了吸收峰,3 385 cm-1处有宽吸收峰(—OH与—NH伸缩振动频率重叠)和924 cm-1处有吸收峰,说明含有游离—COOH,但在乌鸡肽铁螯合物中—COOH的吸收峰不存在,说明铁与乌鸡肽的螯合反应发生在乌鸡肽的COO—和—NH2部分。周名洋等[21]利用鹅骨胶原蛋白与钙螯合制备鹅骨胶原蛋白钙螯合肽,并通过FT-IR对螯合物进行结构鉴定,发现与鹅骨胶原肽相比,鹅骨胶原肽钙螯合物的酰胺I带和酰胺II带发生红移,峰值变小,由1 655.59、1 547.59 cm-1和1 667.16、1 541.82 cm-1变为1 638.23、1 544.70 cm-1和1 638.23、1 617.98 cm-1,说明氨基酸残基上的羧基参与钙螯合,且Ca2+的加入影响了鹅骨胶原肽的N—H键[22],这与本实验的结果一致。研究发现,羧基和氨基是蛋白质、多肽螯合的重要活性位点,可与多种金属离子,包括Ca2+、Cu2+和Mn2+等结合[23-24],形成多肽螯合物。综上可得,小麦低聚肽与铁发生了螯合反应,且反应发生在小麦低聚肽的COO—和—NH2部分。
O伸缩振动,且发生了蓝移,这是因为小麦低聚肽的COO—和铁发生了螯合反应导致,根据FT-IR结果分析可知,铁螯合在了小麦低聚肽的COO—和—NH2部分[19]。宋莎莎等[20]以乌鸡低聚肽和FeCl2为原料制备乌鸡肽铁螯合物,通过FT-IR对乌鸡肽铁进行结构分析,发现螯合物在3 030 cm-1的铵峰消失,而在1 046 cm-1处出现了吸收峰,3 385 cm-1处有宽吸收峰(—OH与—NH伸缩振动频率重叠)和924 cm-1处有吸收峰,说明含有游离—COOH,但在乌鸡肽铁螯合物中—COOH的吸收峰不存在,说明铁与乌鸡肽的螯合反应发生在乌鸡肽的COO—和—NH2部分。周名洋等[21]利用鹅骨胶原蛋白与钙螯合制备鹅骨胶原蛋白钙螯合肽,并通过FT-IR对螯合物进行结构鉴定,发现与鹅骨胶原肽相比,鹅骨胶原肽钙螯合物的酰胺I带和酰胺II带发生红移,峰值变小,由1 655.59、1 547.59 cm-1和1 667.16、1 541.82 cm-1变为1 638.23、1 544.70 cm-1和1 638.23、1 617.98 cm-1,说明氨基酸残基上的羧基参与钙螯合,且Ca2+的加入影响了鹅骨胶原肽的N—H键[22],这与本实验的结果一致。研究发现,羧基和氨基是蛋白质、多肽螯合的重要活性位点,可与多种金属离子,包括Ca2+、Cu2+和Mn2+等结合[23-24],形成多肽螯合物。综上可得,小麦低聚肽与铁发生了螯合反应,且反应发生在小麦低聚肽的COO—和—NH2部分。
3 结论与讨论
本研究通过单因素试验分析了肽铁质量比、时间、温度、pH值对小麦低聚肽和铁离子螯合作用的影响,并以4个因素进行响应面优化试验,得到的最佳螯合条件是:肽盐比6∶1,pH 5.0,螯合温度60.0 ℃,螯合时间55.0 min。在此条件下得率为(51.13±1.16)%,螯合率为(62.61±0.84)%,与预测值接近,响应面优化的最佳工艺条件可靠,可用于实践。通过FT-IR分析小麦低聚肽螯合铁微观结构,发现小麦低聚肽螯合铁的吸收值发生了位移,小麦低聚肽的氨基和羧基与铁发生了螯合反应,这也证明了小麦低聚肽和铁生成了小麦低聚肽螯合铁。综上,小麦低聚肽螯合铁是一种新型含铁的螯合物。本实验制备了小麦低聚肽螯合铁,拓展了铁补充剂的来源,为其应用于食品、医药行业奠定了理论基础。
[1] GUO H, KOUZUMA Y, YONEKURA M.Structures and properties of antioxidative peptides derived from royal jelly protein[J].Food Chemistry, 2009, 113(1):238-245.
[2] WEI Y, ZHANG R X, FANG L, et al.Hypoglycemic effects and biochemical mechanisms of pea oligopeptide on high-fat diet and streptozotocin-induced diabetic mice[J].Journal of Food Biochemistry, 2019, 43(12):e13055.
[3] AGYEI D, DANQUAH M K.Rethinking food-derived bioactive peptides for antimicrobial and immunomodulatory activities[J].Trends in Food Science &Technology, 2012, 23(2):62-69.
[4] CHO S J, JUILLERAT M A, LEE C H.Cholesterol lowering mechanism of soybean protein hydrolysate[J].Journal of Agricultural and Food Chemistry, 2007, 55(26):10 599-10 604.
[5] DEL MAR CONTRERAS M, CARR N R, MONTERO M J, et al.Novel casein-derived peptides with antihypertensive activity[J].International Dairy Journal, 2009, 19(10):566-573.
N R, MONTERO M J, et al.Novel casein-derived peptides with antihypertensive activity[J].International Dairy Journal, 2009, 19(10):566-573.
[6] 郑志强, 刘晋, 魏晓娟, 等.加工条件及模拟胃肠消化对小麦肽抗氧化稳定性的影响[J].农业机械学报, 2017, 48(9):330-336.
ZHENG Z Q, LIU J, WEI X J, et al.Effects of processing conditions and simulated gastrointestinal digestion on antioxidative stability of wheat peptide[J].Transactions of the Chinese Society for Agricultural Machinery, 2017, 48(9):330-336.
[7] 刘文颖, 冯晓文, 程青丽, 等.小麦低聚肽的结构特征及其体外抗氧化活性[J].现代食品科技, 2021, 37(12):72-79.
LIU W Y, FENG X W, CHENG Q L, et al.Structural characteristics and in vitro antioxidative activity of wheat oligopeptides[J].Modern Food Science and Technology, 2021, 37(12):72-79.
[8] 郑志强, 郝利民, 刘晋, 等.小麦蛋白双酶酶解制备高抗氧化性小麦肽研究[J].中国食品学报, 2019, 19(8):78-88.
ZHENG Z Q, HAO L M, LIU J, et al.Preparation of wheat peptide with high antioxidant activity by double enzymes hydrolysis of wheat gluten[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(8):78-88.
[9] 邵剑钢, 钱平, 刘晋, 等.小麦低聚肽的功能作用研究进展及应用前景展望[J].中国食物与营养, 2016, 22(10):72-74.
SHAO J G, QIAN P, LIU J, et al.Research advancement and application prospect of function properties of wheat oligopeptides[J].Food and Nutrition in China, 2016, 22(10):72-74.
[10] 刘艳, 张海欣, 魏颖, 等.小麦低聚肽对H2O2所致HepG2细胞氧化损伤的保护作用[J].食品与生物技术学报, 2015, 34(6):599-604.
LIU Y, ZHANG H X, WEI Y, et al.Protective effect of wheat oligopeptides on hydrogen peroxide-induced HepG2 cell injury[J].Journal of Food Science and Biotechnology, 2015, 34(6):599-604.
[11] 王梦莹. 食源性低聚肽铁改善大鼠缺铁性贫血的效果研究[D].杭州:浙江大学, 2020.
WANG M Y.Effects of food-derived oligopeptide iron chelates supplementation on iron deficiency anemic rats[D].Hangzhou:Zhejiang University, 2020.
[12] 郭芮, 申亮, 毕诗杰, 等.红鳍东方鲀鱼皮胶原低聚肽螯合钙工艺优化[J].食品工业科技, 2019, 40(3):147-152.
GUO R, SHEN L, BI S J, et al.Optimization of process of collagen oligopeptide calcium-chelating of Takifugu rubripes skin[J].Science and Technology of Food Industry, 2019, 40(3):147-152.
[13] 肖珊. 乳清蛋白肽螯合钙的制备及其微胶囊化的研究[D].广州:华南理工大学, 2014.
XIAO S.The study on preparation of whey protein peptide chelating calcium and its microencapsulation[D].Guangzhou:South China University of Technology, 2014.
[14] 丁媛媛, 王莉, 张新霞, 等.麦胚多肽-钙螯合物制备工艺优化及其结构表征[J].食品科学, 2017, 38(10):215-221.
DING Y Y, WANG L, ZHANG X X, et al.Optimized preparation and structural characterization of calcium-chelating polypeptides from wheat germ protein hydrolysate[J].Food Science, 2017, 38(10):215-221.
[15] 胡荣, 郭守立, 马宇熙, 等.鸡蛋壳超微粉粉体性质及其对谷氨酸螯合钙制备的影响[J].食品科学, 2017, 38(10):251-257.
HU R, GUO S L, MA Y X, et al.Properties of ultra-fine eggshell powder and optimization of preparation of calcium-chelating glutamate from it[J].Food Science, 2017, 38(10):251-257.
[16] 张蕾, 程润青, 孙媛媛, 等.河蚬多肽螯合钙的制备和抗氧化活性分析[J].食品工业, 2017, 38(3):94-98.
ZHANG L, CHENG R Q, SUN Y Y, et al.Study on the preparation of peptides from Corbicula fluminea meat chelated calcium and its antioxidation activity evaluation[J].The Food Industry, 2017, 38(3):94-98.
[17] 原洪, 柴丽琴, 王立霞, 等.花椒籽肽-铁螯合物的制备及其理化性质[J].食品与发酵工业, 2018, 44(6):164-171.
YUAN H, CHAI L Q, WANG L X, et al.Preparation of iron-chelating peptides of Zanthoxylum bungeanum seed and its physicochemical properties[J].Food and Fermentation Industries, 2018, 44(6):164-171.
[18] 洪惠, 罗永康, 吕元萌, 等.酶法制备鱼骨胶原多肽螯合钙的研究[J].中国农业大学学报, 2012, 17(1):149-155.
HONG H, LUO Y K, LYU Y M, et al.Preparation of collagen polypeptide chelated calcium by enzymatic method[J].Journal of China Agricultural University, 2012, 17(1):149-155.
[19] 王洋, 郭耀华, 樊晓盼, 等.鲶鱼骨肉泥酶解多肽螯合钙的结构表征[J].食品工业科技, 2018, 39(13):36-40.
WANG Y, GUO Y H, FAN X P, et al.Structure characterization of peptide chelating calcium derived from enzymatic hydrolysis of catfish flesh and bone paste[J].Science and Technology of Food Industry, 2018, 39(13):36-40.
[20] 宋莎莎, 高菲, 任迪峰, 等.乌鸡肽铁(Ⅱ)螯合物的制备及红外光谱鉴定[J].食品与发酵工业, 2013, 39(6):13-17.
SONG S S, GAO F, REN D F, et al.Preparation and infrared spectrum identification of black-bone silky fowl oligopeptide-iron(Ⅱ) chelates[J].Food and Fermentation Industries, 2013, 39(6):13-17.
[21] 周名洋, 何雨欣, 孙杨赢, 等.鹅骨胶原蛋白钙螯合肽的分离纯化及结构鉴定[J].食品科学, 2020, 41(22):8-14.
ZHOU M Y, HE Y X, SUN Y Y, et al.Isolation, purification and structural identification of calcium-chelating peptides from goose bone collagen hydrolysate[J].Food Science, 2020, 41(22):8-14.
[22] WANG X, GAO A, CHEN Y, et al.Preparation of cucumber seed peptide-calcium chelate by liquid state fermentation and its characterization[J].Food Chemistry, 2017, 229:487-494.
[23] ZHU C H, SUN Y, WANG Y Y, et al.The preparation and characterization of novel human-like collagen metal chelates[J].Materials Science and Engineering:C, 2013, 33(5):2 611-2 619.
[24] 申勇涛, 原恺, 霍乃蕊, 等.高钙含量肽钙螯合物的制备与表征分析[J].山西农业大学学报(自然科学版), 2018, 38(5):50-56.
SHEN Y T, YUAN K, HUO N R, et al.Preparation and characterization analysis of peptide-calcium chelation with high calcium content[J].Journal of Shanxi Agricultural University (Natural Science Edition), 2018, 38(5):50-56.