灵芝孢子(Ganoderma lucidum spores, GLS)为灵芝的生殖细胞,具有灵芝全部的遗传活性物质,具有抑制肿瘤、提高免疫力、清除自由基、降血糖、抗氧化、提高机体耐缺氧能力、保护神经系统及心肌细胞等功能[1],其中主要生理活性物质为灵芝孢子油、灵芝多糖和灵芝三萜。灵芝孢子细胞壁主要由纤维素、木质素、葡聚糖、几丁质等物质构成,其中还混合有钙、磷等元素,这些成分使灵芝孢子粉细胞壁坚硬,对细胞壁内物质起到了很好的保护作用[2],然而这在一定程度上也阻碍了人体消化系统对灵芝孢子粉营养成分的吸收。CAI等[3]对比了破壁灵芝孢子粉与未破壁灵芝孢子粉多糖的体外消化情况,发现破壁的灵芝孢子粉比未破壁的具有更好的多糖吸收效率。
在临床应用中,灵芝孢子粉制剂药物有复方灵芝孢子精油软胶囊、复方灵芝降糖胶囊、破壁灵芝孢子粉胶囊、灵芝孢子粉咀嚼片等[4]。然而含三萜类化合物的灵芝孢子油味苦且易被氧化[5-6],导致灵芝破壁孢子粉及其产品具有贮藏条件严苛、贮藏期短和口感较差等弊端[7]。因此,建立有效的微胶囊包埋方法对破壁灵芝孢子粉的有效成分的抗氧化、延长保质期等具有重要意义。
复凝聚法制备微胶囊是食品工业中发展迅速的一种技术[8]。其原理是采用带有2种相反电荷的高分子材料,以离子间相互作用相互交联,沉积囊芯周围制得微胶囊[9]。有学者采用复凝聚法成功制备微胶囊[10-12]。目前有关灵芝孢子粉的微胶囊制备主要集中在灵芝孢子油微胶囊。ZHOU等[7]利用阿拉伯胶与麦芽糊精包埋了灵芝孢子油以提高其抗氧化性。李芳等[13]以灵芝孢子油为芯材,明胶和阿拉伯胶为囊材,通过复凝聚法制备灵芝孢子油微囊。
银耳(Tremella fuciformis)是一种具有良好风味及药用价值的食用菌[14],其主要活性成分为银耳多糖[15]。银耳原胶是含有Ca2+、Mg2+、K+等多种阳离子,以及多糖和蛋白质等物质的弱酸性混合物[16]。本文利用银耳原胶替代传统的阿拉伯胶,用复相凝聚法制备灵芝破壁孢子粉微胶囊,可以同时提高微胶囊中的活性多糖含量。有望为破壁灵芝孢子粉全粉的品质保持及应用范围拓广提供数据支持,同时也提供了银耳原胶-明胶作为复凝聚法制备微胶囊壁材的可能性参考。
1 材料与方法
1.1 材料与仪器
破壁灵芝孢子粉、银耳,浙江科达生物科技有限公司;明胶(分析纯级),上海泰坦科技股份有限公司;冰乙酸、石油醚、KI、三氯甲烷、盐酸、酚酞、硫代硫酸钠、可溶性淀粉、重铬酸钾、95%乙醇,杭州邦易化工有限公司;谷氨酰胺转氨酶(glutamine transaminase,TG酶) 20 000 U/g,上海麦克林生化科技有限公司。
JM-L50型胶体磨,温州昊星机械设备制造有限公司;L19-P132型破壁机,九阳股份有限公司;高速冷冻离心机,日本Hitachi公司;BTP-3XL型真空冷冻干燥机,美国Virtis公司;GY-XXGZJ喷雾干燥仪,上海韭跃仪器有限公司;S-4700型场发射扫描电子显微镜,日本日立公司。
1.2 实验方法
1.2.1 银耳原胶的制备工艺
干燥银耳子实体按料液比1∶100(g∶mL)加水用破壁机热提30 min后用胶体磨粉碎(间隙0.22 mm,15 min),经高速离心(8 000 r/min, 10 min)后取上清液冷冻干燥备用。
1.2.2 灵芝孢子粉微胶囊制备
在前期实验的基础上,将4 g灵芝孢子粉与一定比例明胶溶液充分剪切混合。在40 ℃下缓慢滴入一定比例的银耳原胶溶液,用体积分数10%冰乙酸调节至一定pH并充分搅拌。按0.025 g/g明胶加入TG酶并降温至10 ℃,充分反应6 h,喷雾干燥后得灵芝孢子粉微胶囊粉末。
1.2.3 灵芝孢子粉微胶囊包埋率测定
灵芝孢子粉中主要有效成分为灵芝三萜类,而灵芝三萜类主要为脂溶性成分[17],故采用表面脂溶性物质即表面油含量测定来作为评价微胶囊包埋率的指标,能间接反映出产品活性物质的包埋率。
表面油测定:准确称取微胶囊于锥形瓶,加入20 mL石油醚,摇匀3 min,过滤,用石油醚洗涤锥形瓶和滤纸3次,收集滤液于恒重圆底烧瓶(m1),旋转蒸发溶剂,干燥至恒重(m2)。总油质量(m)测定采用GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》索氏抽提法。包埋率计算如公式(1)所示:
(1)
式中:ω,微胶囊表面油百分比,%;m2,灵芝孢子油与圆底烧瓶总质量,g;m1,圆底烧瓶质量,g;m,总油质量,g。
1.2.4 响应面法优化灵芝孢子粉微胶囊试验
在考察了壁材比例、芯壁比、pH、料液比、反应时间、反应温度等条件后,通过Box-Behnken Design试验设计法[18],选择壁材比例、芯壁比、pH 3个条件作为目标变量,建立3因素3水平响应面模型。试验因素及水平如表1所示。
表1 试验因素与水平
Table 1 Factors and levels for the trial

水平A(壁材比例)B(芯壁比)C(pH)10.80.23.921.00.44.031.20.64.1
1.2.5 场发射扫描电子显微镜(scanning electron microscope, SEM)表征
通过SEM对灵芝孢子粉微胶囊和灵芝孢子粉的微观形貌表征。将样品用导电胶带固定于样品台上,经喷金处理后,装入扫描电镜观察室,在低电压下观察拍照[19]。
1.2.6 灵芝孢子粉微胶囊加速氧化试验
将优化后制成的灵芝孢子粉微胶囊与等量未包埋的灵芝孢子粉置于60 ℃培养箱内加速氧化。定期取样根据国标法测定其油脂的过氧化值(GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》)和酸价(GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》)。
指标测定前需分离出灵芝孢子粉和灵芝孢子粉微胶囊中的油脂,具体操作如下:各称取约10 g粉末加入25 mL石油醚,400 W超声波提取10 min,离心取上清液,沉淀复提3次,合并上清液于已称重圆底烧瓶中,30 ℃减压旋蒸去除石油醚至恒重。
1.3 数据处理
每组实验重复3次,结果以平均值表示。采用Graphpad Prism 8.0.2 和Design Expert 10对数据进行作图和分析。
2 结果与讨论
2.1 响应面实验
2.1.1 模型建立及方差分析
根据Box-Behnken Design试验设计原理,选取17个试验点,其中12组为析因试验,5组为中心试验,用以估计整个试验的纯试验误差[20]。以包埋率为响应曲面设计方法(response surface methodology, RSM)响应值得到如下结果。
采用Design Expert 8软件对表2的数据进行多元回归分析,得到如下二次多项式回归方程:
包埋率/%=85.84+1.77A-0.83B-4.22C+2.17AB-1.68AC-2.63BC+1.82A2+0.004 2B2-5.71C2
进一步对该回归方程进行显著性分析,响应曲面数据的方差分析结果见表3。回归方程因变量与自变量之间的线性关系明显,灵芝孢子粉微胶囊试验模型回归显著(P<0.01),信噪比为9.782,远大于临界值4,说明该模型与实际情况拟合良好。失拟项P值为0.551 4>0.05,表明该模型失拟不显著,说明其他因素对模型的干扰程度低,试验结果与回归模型拟合程度良好[21]。
表2 响应面设计及结果
Table 2 Design and results of RSM experiment

实验编号A(壁材比例)B(芯壁比)C(pH)包埋率/%11-1087.32-1-1088.1301172.9401-184.25-10176.4600084.5710-190.8810176.79-10-183.91000085.41100090.31200085.21311091.5140-1181.3150-1-182.11600083.917-11083.7
表3 回归方程系数显著性检验
Table 3 Test for significance of regression coefficients
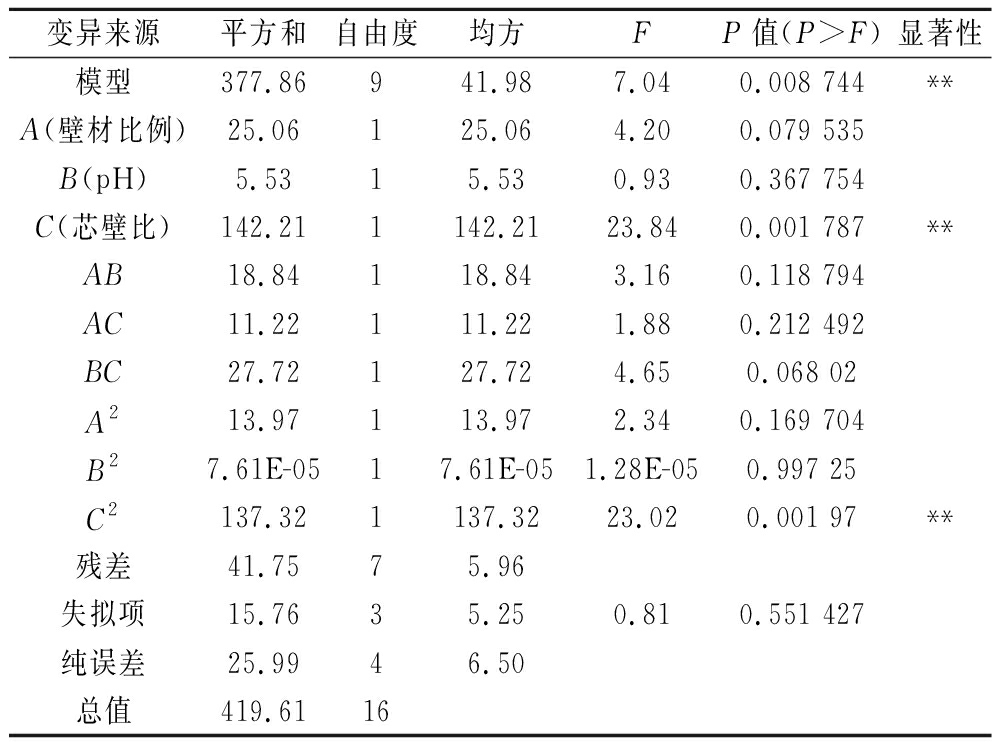
变异来源平方和自由度均方FP值(P>F)显著性模型377.86941.987.040.008 744**A(壁材比例)25.06125.064.200.079 535B(pH)5.5315.530.930.367 754C(芯壁比)142.211142.2123.840.001 787**AB18.84118.843.160.118 794AC11.22111.221.880.212 492BC27.72127.724.650.068 02A213.97113.972.340.169 704B27.61E-0517.61E-051.28E-050.997 25C2137.321137.3223.020.001 97**残差41.7575.96失拟项15.7635.250.810.551 427纯误差25.9946.50总值419.6116
注:**表示差异极显著 (P<0.01);*表示差异显著 (P<0.05)。
影响灵芝孢子粉微胶囊包埋率的主次因子顺序依次为芯壁比、壁材比例、pH;C2(P=0.001 97<0.05)说明芯壁比对灵芝孢子粉微胶囊包埋率不是简单的线性关系,曲面效应显著;由A值、B2值、AB值、AC值、BC值(P>0.05)可知,3个试验因子的交互作用不显著。
2.1.2 响应面的分析与优化
利用Design Expert10软件对表3数据进行拟合得到响应面及其等高线见图1,通过该图可以评价试验因素对各个响应值的交互作用大小,以确定最佳的水平范围[22]。

图1 芯壁比、壁材比例、pH对灵芝孢子粉微胶囊包埋率的响应面图和等高线图
Fig.1 Response surface diagram and contour diagram of core wall ratio, wall material ratio and pH on microcapsule embedding rate of GLS
由图1可知芯壁比、壁材比例对响应值影响较大,而pH对响应值影响较小。从本次试验数据得出灵芝孢子粉包埋微胶囊的最优条件为:壁材比例1.2、芯壁比0.3、pH 4.1。在此条件下灵芝孢子粉微胶囊包埋率预测值为94.0%,验证实验测量值为91.8%。
2.2 场发射SEM表征
从图2-a中可以发现,破壁灵芝孢子粉为无定形颗粒结构,图2-b、图2-c则证明以银耳原胶-明胶为壁材的灵芝孢子粉微胶囊成功包埋,且在干燥情况下呈现不规则皱缩球状结构,表面无破损穿孔。

a-灵芝孢子粉;b-灵芝孢子粉微胶囊(10 000×);c-灵芝孢子粉微胶囊(25 000×)
图2 灵芝孢子粉和灵芝孢子粉微胶囊SEM形态
Fig.2 SEM morphology of GLS and GLS microcapsule
2.3 氧化稳定性分析
每隔4 d取样,分别提取灵芝孢子粉和灵芝孢子粉微胶囊中油脂成分,通过油脂过氧化值和酸价监测孢子粉氧化程度并进行比较,结果如图3所示。

a-过氧化值;b-酸价
图3 灵芝孢子粉及灵芝孢子粉微胶囊中油脂过氧化值和酸价比较
Fig.3 Comparison of peroxide value and acid value of oil in GLS and GLS microcapsules
过氧化值用于测定脂质氧化早期含有氧化物和过氧化氢初级产物的浓度[23]。由图3-a可知,随着加速氧化时间增加,灵芝孢子粉和灵芝孢子粉微胶囊中油脂的过氧化值均升高,但相比较下对照组灵芝孢子粉中过氧化值明显高于灵芝孢子粉微胶囊。
酸价指示油脂中游离脂肪酸含量是油脂和含油食品最重要的质量指标和安全指标之一[24]。由图3-b可知,对照组中酸价随加速氧化时间增加显著增加,而灵芝孢子粉微胶囊油脂酸价增加幅度平缓。
过氧化值与酸价试验中,微囊化过程使灵芝孢子粉的过氧化值与酸价略高于纯灵芝孢子粉。而在加速氧化过程中,微囊化后灵芝孢子油的变性均慢于对照组,表明微囊化可有效减缓灵芝孢子油的氧化。
3 结论
采用复凝聚法制备破壁灵芝孢子粉微胶囊的结果表明,芯壁比、壁材比例条件对微胶囊包埋率影响较明显。当包埋条件为灵芝孢子粉质量分数33.1%、银耳原胶36.5%、明胶30.4%、包埋pH 4.1,此时的灵芝孢子粉微胶囊理论包埋率可达94.0%。此外,经过加速氧化试验证明,微囊化后灵芝孢子粉的体外氧化速率明显减缓。综上,以银耳原胶-明胶制备破壁灵芝孢子粉微胶囊对灵芝孢子粉的贮藏及抗氧化性都有增益,此法具有工业化应用潜力。
[1] SHI Y J, ZHENG H X, HONG Z P, et al.Antitumor effects of different Ganoderma lucidum spore powder in cell- and zebrafish-based bioassays[J].Journal of Integrative Medicine, 2021, 19(2):177-184.
[2] 刘洋, 覃媚媚, 罗印斌, 等.灵芝孢子主要活性成分及其功能研究进展[J].北方园艺, 2020(5):138-146.
LIU Y, QIN M M, LUO Y B, et al.Research progress on component and function of Ganoderma lucidium spore[J].Northern Horticulture, 2020(5):138-146.
[3] CAI M, MU H, XING H Y, et al.In vitro gastrointestinal digestion and fermentation properties of Ganoderma lucidum spore powders and their extracts[J].LWT, 2021, 135:110235.
[4] 杨晓青, 王旭.灵芝孢子粉最新应用研究概况[J].江苏中医药, 2018, 50(4):87-89.
YANG X Q, WANG X.The latest application and research survey of Ganoderma spores powder[J].Jiangsu Journal of Traditional Chinese Medicine, 2018, 50(4):87-89.
[5] 陈慧, 王晓玲, 刘高强.灵芝子实体中三萜酸的提取及其稳定性[J].食用菌学报, 2015, 22(4):58-64.
CHEN H, WANG X L, LIU G Q.Optimization of triterpenoid acid extraction from Ganoderma lingzhi fruit bodies and stability under different temperature-time regimes[J].Acta Edulis Fungi, 2015, 22(4):58-64.
[6] LIANG C Y, TIAN D N, LIU Y Z, et al.Review of the molecular mechanisms of Ganoderma lucidum triterpenoids:Ganoderic acids A, C2, D, F, DM, X and Y[J].European Journal of Medicinal Chemistry, 2019, 174:130-141.
[7] ZHOU D, ZHOU F X, MA J F, et al.Microcapsulation of Ganoderma lucidum spores oil:Evaluation of its fatty acids composition and enhancement of oxidative stability[J].Industrial Crops and Products, 2019, 131:1-7.
[8] LI F F, WANG H F, MEI X H.Preparation and characterization of phytosterol-loaded microcapsules based on the complex coacervation[J].Journal of Food Engineering, 2021, 311:110728.
[9] 黎晨晨, 马永强, 井弘书, 等.新型纳米递送系统研究动态及在食品中的应用进展[J].中国食品添加剂, 2021, 32(5):126-131.
LI C C, MA Y Q, JING H S, et al.Research trends on application and development of new nanodelivery systems in food industry[J].China Food Additives, 2021, 32(5):126-131.
[10] 胡佳慧, 刘贵珍, 郝丽, 等.复凝聚法制备槐米芦丁微胶囊工艺优化[J].食品科技, 2021, 46(12):237-244.
HU J H, LIU G Z, HAO L, et al.Optimization of preparation technology of microcapsulation of rutin from Sophora japonicum by complex coacervation[J].Food Science and Technology, 2021, 46(12):237-244.
[11] ZHOU D, PAN Y, YE J, et al.Preparation of walnut oil microcapsules employing soybean protein isolate and maltodextrin with enhanced oxidation stability of walnut oil[J].LWT-Food Science and Technology, 2017, 83:292-297.
[12] 孙雪, 张蕊, 范方宇, 等.复凝聚法制备西番莲果皮花色苷微胶囊及其性质分析[J].食品工业科技, 2021, 42(17):187-193.
SUN X, ZHANG R, FAN F Y, et al.Preparation and properties of anthocyanin microcapsules from Passiflora edulis rind by complex coacervation[J].Science and Technology of Food Industry, 2021, 42(17):187-193.
[13] 李芳, 陈艳君, 高雷雷, 等.灵芝孢子油微囊的制备工艺研究[J].广州化工, 2021, 49(15):104-107.
LI F, CHEN Y J, GAO L L, et al.Study on preparation process of Ganoderma lucidum spore oil microcapsules[J].Guangzhou Chemical Industry, 2021, 49(15):104-107.
[14] NIU B, FENG S M, XUAN S Q, et al.Moisture and caking resistant Tremella fuciformis polysaccharides microcapsules with hypoglycemic activity[J].Food Research International, 2021, 146:110420.
[15] 陈婵, 黄靖, 陈晓波, 等.超声波提取银耳蒂头粗多糖工艺的优化研究[J].农产品加工, 2019(24):43-46.
CHEN C, HUANG J, CHEN X B, et al.Study on ultrasonicly extracting technology of polysaccharide from Tremella stalk[J].Farm Products Processing, 2019(24):43-46.
[16] 吴琴, 陶瑞霄, 迟原龙, 等.银耳粗多糖的理化特性研究[J].食品科技, 2016, 41(12):149-153.
WU Q, TAO R X, CHI Y L, et al.Physicochemical properties of crude polysaccharides from Tremella fucitormis[J].Food Science and Technology, 2016, 41(12):149-153.
[17] 刘维, 虎虓真, 朱莉, 等.灵芝三萜的研究与应用进展[J].食品科学, 2019, 40(5):309-315.
LIU W, HU X Z, ZHU L, et al.Recent progress in research and application of Ganoderma lucidum triterpenoids[J].Food Science, 2019, 40(5):309-315.
[18] 张汉辉, 程杏安, 李俊杰, 等.荔枝多酚微胶囊的制备工艺优化及其特性分析[J].食品工业科技, 2021, 42(23):201-208.
ZHANG H H, CHEN X A, LI J J, et al.Optimization of preparation process of lichi polyphenols microcapsules and its characteristic analysis[J].Science and Technology of Food Industry, 2021, 42(23):201-208.
[19] BILGIC A, CIMEN A, BASTUG E, et al.Fluorescent sporopollenin microcapsule modified by BODIPY for sensitive&selective recognition and efficient removal of Cu (II) from aqueous solution[J].Chemical Engineering Research and Design, 2022, 178:61-72.
[20] 杨颖, 潘兆平, 李绮丽, 等.响应面法优化赣南脐橙全果果酱微波制作工艺[J].中国食品学报, 2020, 20(12):167-175.
YANG Y, PAN Z P, LI Q L, et al.Optimization of microwave production process of Gannan navel orange whole fruit jam by response surface methodology[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(12):167-175.
[21] 刘青梅, 高娟, 姜敏芳, 等.响应面法优化杨梅渣中花色苷提取工艺[J].中国食品学报, 2014, 14(6):90-96.
LIU Q M, GAO J, JIANG M F, et al.Optimization of extraction technique of anthocyanins from red bayberry by response surface methodology[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(6):90-96.
[22] 王民申, 李勇, 冯进, 等.响应面法优化黄浆水絮凝工艺及其代谢组学分析[J].食品工业科技, 2022, 43(1):244-252.
WANG M S, LI Y, FENG J, et al.Optimization of flocculation process of yellow serofluid by response surface methodology and its metabolomics analysis[J].Science and Technology of Food Industry, 2022, 43(1):244-252.
[23] CUI N N, WANG G X, MA Q H, et al.Evolution of lipid characteristics and minor compounds in hazelnut oil based on partial least squares regression during accelerated oxidation process[J].LWT, 2021, 150:112025.
[24] 曹文明, 薛斌, 屠炳芳.酸价的特异性检测方法:铜皂络合比色技术的研究进展[J].中国油脂, 2022, 47(3):110-116.
CAO W M, XUE B, TU B F.Progress on cupric acetate-pyridine colorimetric method for specific quantitative determination of acid value[J].China Oils and Fats, 2022, 47(3):110-116.