随着经济的发展和国民健康意识的提升,种类繁多且营养价值高的水产品为人们提供了饮食上的优质选择。罗非鱼(Oreochromis mossambicus)在最具国际市场潜力的养殖水产品中位居第三,中国已经成为全球最大的罗非鱼生产国和贸易国[1],环境适应性强且价格稳定是其在水产市场上的显著优势。
淡水养殖鱼类普遍存在腥味较重的问题,是降低消费者接受度的关键因素。生活于复杂水体环境中的淡水鱼因生理活动使体表黏附各种异味物质,包括水中生物分泌的有机物以及带有土腥臭味的淤泥,因此鱼体表现出浑浊的泥土味、苔藓味、脂肪味等[2];腥味还与贮藏、加工期间的鱼肉品质变化有关[3-4],微生物和酶[5]的作用以及鱼体自身不饱和脂肪酸的自动氧化[4]是加重鱼腥味的又一因素。
目前,物理、化学、生物及复合法是脱腥研究中的常用方法。其中,生物法操作繁琐且部分方法机理未明确,复合法脱腥效果不够稳定,而应用较广的是物理法和化学法。物理方法中的吸附法,依赖于吸附材料孔隙率高、比表面积大的优势,只需简单操作便可吸附异味。陈海燕等[6]的波纹巴非蛤酶解产物脱色脱腥研究表明,树脂LX-32借助动态吸附实现良好脱色脱腥。此外,化学脱腥法中的抗氧化剂法也是研究热点,人们对来自植物中的纯天然抗氧化成分颇具好感,HAM等[7]发现,利用碱性溶液提取的板栗内壳的酚类化合物,除臭活性高于用乙醇溶液提取。
近些年国内居民在饮品选择上具有很大变化,咖啡销售市场逐渐扩大,但大量废弃咖啡渣的丢弃给环境造成了严重负担。咖啡渣具有极强的吸附特性[8],同时,研究者从废弃咖啡中提取出大量的强抗氧化性的物质[9-10],例如酚类化合物,预示着其具有用于抗氧化及风味改良研究的可能性。
水产品脱腥的大部分研究对象是鱼糜或酶解产物,对淡水鱼体表或鱼片的研究较少。本研究旨在以废弃咖啡渣为原料,将罗非鱼脱腥作为研究方向,首先通过气相色谱-质谱联用技术结合扫描电镜分析咖啡渣粉末处理对罗非鱼体表脱腥处理的效果及方式;再结合感官评定及GC-MS分析咖啡渣提取液对冷藏罗非鱼肉腥味的抑制效果,并通过HPLC、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值和脂肪氧化酶活性探讨咖啡提取液影响罗非鱼肉风味的作用方式。以此来挖掘废弃咖啡渣的潜在价值,为开发简便高效且低成本的淡水鱼脱腥方法提供科学参考。
1 材料与方法
1.1 材料与试剂
罗非鱼,上海浦东新区临港古棕路水产市场;咖啡豆,辛鹿咖啡;绿原酸(chlorogenic acid,CGA)、脂肪氧化酶(lipoxygenase, LOX),上海源叶生物科技有限公司;C7~C40正构烷烃混标,美国o2si公司;2,4,6-三甲基吡啶(three methyl pyridine, TMP),上海麦克林生化科技有限公司;总抗氧化能力(DPPH法)试剂盒,苏州科铭生物技术有限公司。
1.2 仪器与设备
KQ-400KDE型高功率数控超声波清洗器,昆山市超声仪器有限公司;5977A超声气相色谱-质谱联用仪,美国安捷伦公司;固相微萃取(solid-phase microextraction,SPME)手动进样手柄、二乙烯基苯/Carboxen/聚二甲基硅氧烷(DVB/CAR/PDMS)固相微萃取萃取头,美国Supelco公司;日立SU5000热场发射扫描电镜,日本日立公司;福斯FOSS Soxtec 2050全自动索氏抽提仪,丹麦福斯公司。
1.3 实验方法
1.3.1 罗非鱼的处理方法
罗非鱼预处理:新鲜罗非鱼重击致死,去除鳞片、腮、内脏,洗净血水及黑色腹腔膜,用吸水纸将表层水分吸干,待用。
罗非鱼体表处理:将3%(按鱼体质量计)咖啡渣粉末均匀涂抹于鱼体表,放入密封袋中,静置10 min后,蒸馏水冲洗干净。
罗非鱼鱼肉处理:取罗非鱼背脊肉(4 cm×7 cm×0.5 cm),去除鱼皮,将鱼肉完全浸没于咖啡渣提取液中(固液比约为1∶3,g∶mL),4 ℃下保持1 h,再用蒸馏水冲洗表面残余液体,并用密封袋保存于4 ℃,冷藏5 d。以蒸馏水浸没处理作为对照,具体操作同上。
用于实验的废弃咖啡渣是模拟咖啡饮用冲泡后回收的废弃部分。咖啡渣烘干后过60目筛,即为咖啡渣粉末;将20 g咖啡渣粉末加入1 000 mL蒸馏水,80 ℃下超声15 min,过滤,即为咖啡渣提取液。
1.3.2 顶空固相微萃取-气质联用法(headspace-solid phase micro extraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)测定挥发性风味及数据处理
1.3.2.1 挥发性风味的分析
样品制备:鱼皮/鱼肉样品在绞肉机搅碎后随机取样;处理后的咖啡渣粉末于体表处理结束后收集;罗非鱼体表物质用药勺从预处理后的鱼体表刮取。
顶空固相微萃取:取2.00 g样品于20 mL顶空瓶内,加入0.18 g/mL NaCl溶液3 mL及0.1 μL /mL TMP溶液(以分析级甲醇为溶剂) 10 μL,放入微型搅拌子,60 ℃水浴萃取60 min,搅拌速度1 200 r/min,萃取结束后立刻将萃取头插入进样口,10 min后取出。
色谱条件:HP-5MS 弹性毛细管柱(30 m×250 μm×0.25 μm);程序升温:柱初温30 ℃,保持2 min,以5 ℃/min升至60 ℃,继续以5 ℃/min升至250 ℃,保持5 min;载气(He)流量1.4 mL/min;进样口温度250 ℃;解吸温度250 ℃;不分流模式进样。质谱条件:传输线温度280 ℃;离子源温度230 ℃;四极杆温度150 ℃;电子能量70 eV;质量扫描范围(m/z)40~400。
1.3.2.2 GC-MS数据处理
借助NIST 17数据库分析挥发性化合物,结合正反匹配度和保留指数确认定性。通过计算待测挥发性物质与TMP峰面积之比,求得该组分的绝对浓度(假定各挥发物的绝对校正因子为1.0)。计算如公式(1)所示:
挥发性化合物含量![]()
(1)
式中:Ai,挥发性物质i的峰面积;ATMP,内标物的峰面积;mTMP,被测样品加入的内标物质的量,μg;m,被测样品质量,g。
气味活性值(odor activity value, OAV)≥1的化合物可被定义为气味活性成分,OAV计算如公式(2)所示:
(2)
式中:ωi,成分i在样品中的质量分数,ng/g;ωOTi,组分i在参考文献中查得的嗅觉阈值,ng/g。
文中特征气味OAV为对该特征气味具有贡献的所有挥发性化合物OAV之和。
1.3.3 感官评定
评定组由经过专业感官训练的10人组成,5男5女,参考文献[11]依照表1对冷藏罗非鱼肉进行感官评定,给出每个指标的具体评分,并计算总分。
表1 感官评分标准表
Table 1 Sensory scoring standard table

指标好较好一般略差差色泽(20)色泽饱满,肉色呈半透明,肌肉切面光泽明亮(17~20)色泽饱满,肌肉切面有光泽(13~16)色泽微暗淡,肌肉切面略有光泽(9~12)色泽暗淡,肌肉切面无光泽(5~8)色泽暗淡无光,肌肉切面完全没有光泽(0~4)气味(40)鱼肉香味浓郁,略带清香或咖啡香气(33~40)有鱼肉香味,有不悦的咖啡味(25~32)无鱼肉香味,有淡淡腥臭味(19~24)腥臭味明显(9~18)有腥臭味和腐臭味(0~8)组织状态(20)组织紧密完整,纹理清晰(17~20)组织紧密,纹理较清晰(13~16)组织不够紧密,纹理清晰度弱(9~12)组织部分松散(5~8)组织松散(0~4)肌肉弹性(20)鱼肉紧实,指压后立即恢复(17~20)鱼肉较坚实,指压恢复速度缓慢(13~16)鱼肉中度柔软,压痕不易恢复(9~12)鱼肉柔软,指压后不能恢复(5~8)鱼肉柔软,指压后呈凹陷状,略黏手(0~4)
1.3.4 TBARS的测定
参考SANTOS等[12]和顾赛麒等[13]的方法,并稍作修改。将10 g鱼糜加入50 mL 7.5%三氯乙酸溶液中均质,静置1 h后离心取5 mL上清液与0.02 mol/L TBA溶液等量混合,加热显色,恢复至室温后取上清液在OD532和OD600下测定吸光度值,TBARS值(mg/100 g)计算如公式(3)所示:
(3)
1.3.5 扫描电镜(scanning electron microscope,SEM)
将待观察的咖啡渣粉末烘干,少量固定于铁片上,喷金后在300倍和2 500倍下观察。
1.3.6 HPLC测定绿原酸含量
参考李莎莎等[14]的方法并稍作修改。用绿原酸标准品配制300 μg/mL母液,依次稀释为150、80、40、16、8、3.2 μg/mL的标准溶液,以绿原酸含量为横坐标,峰面积为纵坐标制作标准曲线,计算待测溶液中的绿原酸含量。液相色谱条件:C18色谱柱(4.6 mm×100 mm, 3.5 μm),柱温35 ℃,流速0.3 mL/min,检测波长323 nm,进样量10 μL,流动相A:0.5 %甲酸水溶液,B:甲醇,梯度洗脱。
1.3.7 脂肪氧化酶活性测定
参考JIN等[15]的方法并作了适当修改。亚油酸底物制备:140 mg亚油酸溶解于含有180 μL吐温20的5 mL蒸馏水,加入2滴2 mol/L NaOH溶液使溶液体系澄清,稀释至50 mL,4 ℃保存备用。分别在9 mL蒸馏水、9 mL 400 μg/mL 绿原酸标准品溶液、9 mL咖啡渣提取液中加入1 mL 5 000 U/mL脂肪氧化酶标准溶液,构建反应体系,4 ℃反应1 h。准备3个10 mL 离心管,各加入2.47 mL 酶缓冲液和0.5 mL 亚油酸底物,混匀后,取各反应体系0.03 mL 加入酶缓冲液与亚油酸底物的混合液体,每个离心管中混合溶液总体积为3 mL,以2.5 mL 酶缓冲液和0.5 mL 亚油酸底物混合液作为对照。测定温度为室温,以溶液在234 nm下,1 min吸光度值的增加量来测定脂肪氧化酶活性。
酶缓冲液制备:将87 mL 0.2 mol/L Na2HPO4溶液与13 mL 0.2 mol/L Na2HPO4溶液混合。
1.3.8 粗脂肪测定
参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法。
1.3.9 数据处理与分析
采用Excel软件对数据进行整理统计,结果表示为平均值±标准差。采用SPSS 20.0软件进行显著性分析。采用Origin 2021软件作图。
2 结果与分析
2.1 咖啡粉末对罗非鱼体表的脱腥效果
通过GC-MS分析新鲜罗非鱼皮中的挥发性化合物发现,从新鲜罗非鱼皮中共检出40种挥发性化合物,其中有12种化合物的OAV>1且与鱼类腥味有关。研究中将OAV>1的化合物称为气味活性成分,对水产品风味有显著影响[16]。参照特征气味描述对这12种气味活性成分进行分类[17-18],如表2所示。
表2 化合物的特征气味描述
Table 2 Characteristic odor description and related substances

特征气味气味化合物土腥味1-辛烯-3-醇鱼腥味己醛、庚醛、辛醛、(2E)-2-辛烯醛、(Z)-4-癸烯醛脂肪味癸醛、正庚醇、壬醛、(E,E)-2,4-庚二烯醛、2-庚烯醛、(Z)-4-庚烯醛
按预实验结果,使用鱼体质量3%的咖啡渣对罗非鱼体进行脱腥处理,可保证完全覆盖鱼体又不造成浪费。通过GC-MS分析罗非鱼皮的挥发性化合物成分发现,咖啡渣粉末处理前后,12种气味活性成分的含量由1 007.70 ng/g下降至261.10 ng/g,减少74.09%,腥味脱除明显,如图1-a所示。醛类是水产品异味的主要来源[19],鱼体表的12种气味活性成分中,己醛和壬醛含量较高,咖啡渣粉末处理使己醛含量由338.90 ng/g降到70.69 ng/g,降低79.14%,壬醛从101.99 ng/g降至26.92 ng/g,下降幅度为73.61%。己醛表现出鱼腥味和青草味,壬醛表现出脂肪气息,它们的减少使体表鱼腥味和脂肪味减弱(图1-b)。研究证实,2,4-庚二烯醛是形成海藻腥臭味的主要原因之一[20]。处理后的罗非鱼皮中未检出(E,E)-2,4-庚二烯醛、2-庚烯醛、(Z)-4-庚烯醛、(Z)-4-癸烯醛和正庚醇这5种对鱼体腥味有较大影响的挥发性化合物。此外,1-辛烯-3-醇对罗非鱼体表土腥味具有主导作用[21],1-辛烯-3-醇的含量在处理后减少59.79%,由307.45 ng/g下降到123.63 ng/g,可见,鱼体表的土腥味强度也大大减弱。

a-12种气味活性成分的质量分数变化;b-特征气味OAV变化
图1 咖啡渣粉末处理前后罗非鱼皮气味活性成分及特征气味变化
Fig.1 Changes of active ingredients and characteristic odor of tilapia skin before and after powdered spent coffee grounds treatment
注:不同小写字母表示同种化合物在体表处理前后存在显著差异(P<0.05)
2.2 咖啡渣提取液对冷藏罗非鱼肉的脱腥效果
植物提取液在水产加工方面应用广泛,PARVATHY等[22]发现咖啡提取物在鲭鱼肉中作为天然抗氧化剂是有效的,因此尝试将废弃咖啡渣提取液作用于罗非鱼肉。在新鲜罗非鱼肉中共检出23种挥发性化合物,筛选出整个冷藏期内OAV>1且与腥味增强有关的化合物有如下5种:己醛、庚醛、辛醛、壬醛、1-辛烯-3醇。环境中的腥味物质先接触鱼体表,再进入鱼体内,同时,鱼皮中微生物和酶的数量远高于鱼肉,它们能够促进碱性氨基酸等物质的分解,产生带有腥味的短链分子,因此相较于鱼皮,鱼肉中含有的腥味物质较少[23]。上述5种化合物也是罗非鱼体表的气味活性成分,可同样按照表2进行分类。
研究表明,多不饱和脂肪酸在脂肪氧化酶的作用下,可以生成不饱和醇和短链挥发性碳基,同时饱和醛增加会产生油脂酸败味[24]。冷藏鱼肉中的己醛被认为与腐臭味和霉味有关。蒸馏水处理组在冷藏第3天时,鱼肉中己醛含量为51.15 ng/g,第5天升至311.66 ng/g,增加了5倍,如图2-a。蒸馏水处理组鱼肉中的壬醛含量在冷藏第5天出现显著变化(P<0.05),含量是冷藏第1天的2.75倍。低浓度的壬醛具有脂肪香,高浓度呈现为厚重油腻的油脂气息[25],随着壬醛含量的增加,蒸馏水处理组在冷藏第4天和第5天的油脂味比咖啡渣提取液处理组更强烈,如图2-b。而咖啡渣提取液处理组中的己醛和壬醛,在整个冷藏期间未表现出增加趋势(图2-a),说明咖啡渣提取液处理能够较好地维持新鲜鱼肉风味。
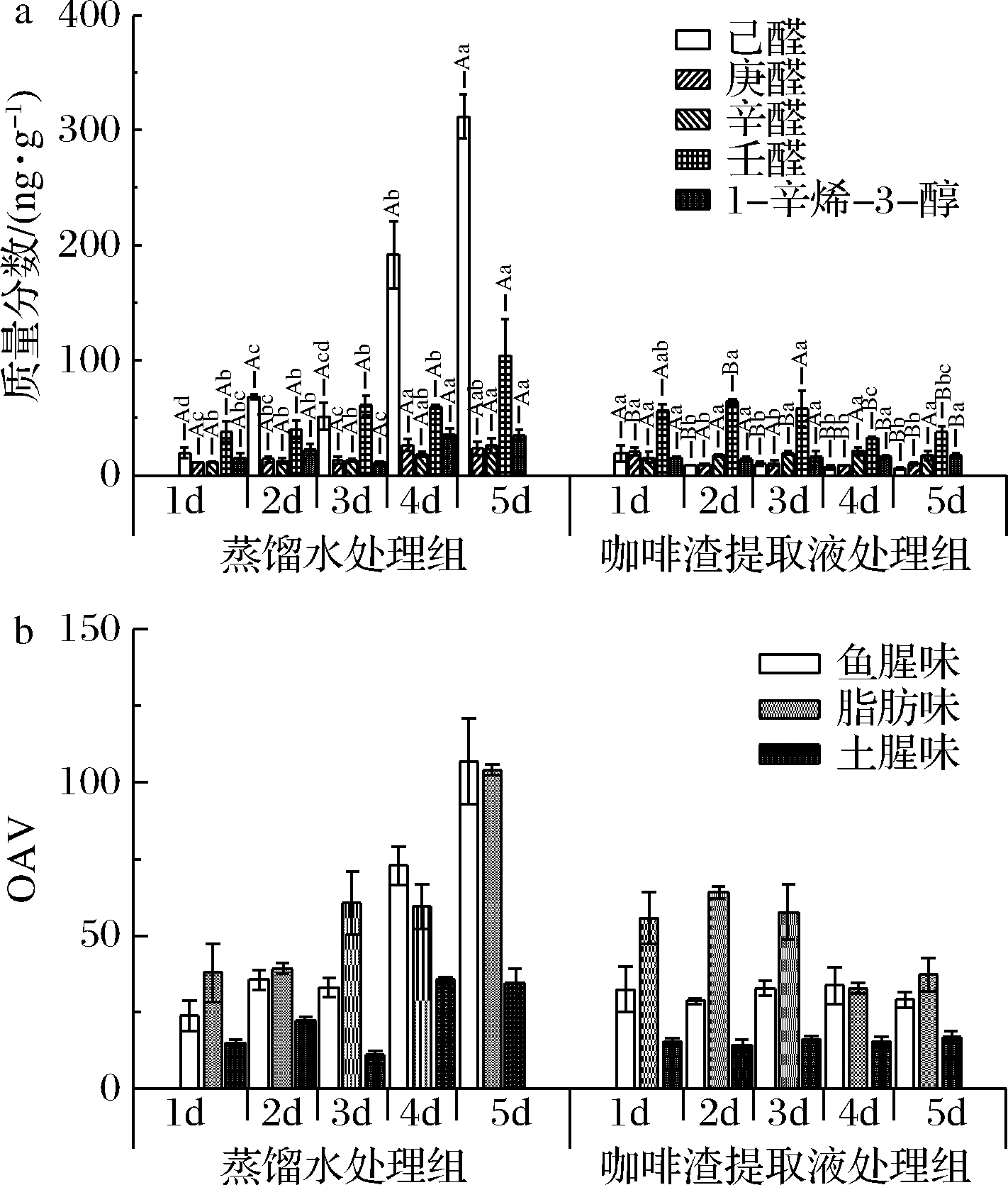
a-气味活性成分质量分数变化;b-特征气味OAV变化
图2 咖啡渣提取液处理对冷藏罗非鱼气味活性成分及特征气味的影响
Fig.2 Effect of spent coffee grounds extract treatment on odor active components and characteristic odor of refrigerated tilapia
注:不同大写字母表示同种化合物在不同处理下的同一冷藏时间存在显著差异,不同小写字母表示同种处理下同一化合物在不同冷藏时间存在显著差异(P<0.05)
蒸馏水处理组中1-辛烯-3-醇的含量在整个冷藏期增加了1.33倍,而咖啡渣提取液处理组中,其含量在冷藏第1天和第5天分别为15.2和16.73 ng/g,变化较小,意味着该组鱼肉的土腥味在冷藏期间得到有效控制。研究表明,挥发性化合物与蛋白的结合受多种因素影响[26-27],咖啡渣提取液处理组的挥发性化合物在pH影响下,可能较蒸馏水处理更容易被萃取到顶空环境中,表现为冷藏第1天鱼腥味和脂肪味高于蒸馏水处理组。
上述挥发性化合物的变化表明,咖啡渣提取液对延缓冷藏罗非鱼肉的腥味加重具有积极作用。同时,GC-MS分析显示,咖啡渣提取液处理组中出现了少数咖啡特征风味物质,比如2,5-二甲基吡嗪,这些化合物对鱼肉整体风味的影响还需结合感官综合分析。
由图3-b可知,两组样品的感官评定总分均随冷藏时间的延长而下降。冷藏5 d内,咖啡渣提取液处理组的气味评分均高于蒸馏水处理组,冷藏第1天符合“鱼肉香味浓郁,略带清香或咖啡香”标准,说明评定人员认为咖啡清香是令人愉悦的,且不会影响鱼肉本身香味。

a-冷藏罗非鱼片照片;b-感官评分
图3 冷藏罗非鱼片照片和感官评分
Fig.3 The photos and sensory scores of refrigerated tilapia
图3-a显示,咖啡渣提取液处理后鱼肉色泽加深,导致色泽评分较低,这与超声萃取造成咖啡渣中的色素析出有关。两组鱼肉冷藏5 d内的组织状态和肌肉弹性评分,变化并不显著(P>0.05)。感官结果表示,咖啡渣提取液对冷藏罗非鱼肉风味具有积极影响,而对色泽的影响可通过改进咖啡渣提取方法来消除。
2.3 咖啡渣粉末及其提取液对罗非鱼的脱腥作用分析
2.3.1 咖啡渣粉末对罗非鱼体表的脱腥作用分析
罗非鱼体表腥味在咖啡渣粉末处理后减轻,而处理后的咖啡渣粉末中检出了更多的腥味化合物,如表3所示。咖啡渣粉末中己醛的含量在处理前是(5.90±3.26) ng/g,处理后增加到(180.30±23.67) ng/g,壬醛的含量在处理前是(17.51±5.07) ng/g,处理后增加到(366.35±101.34) ng/g,含量明显增加,此外,还新增了庚醛、2-庚烯醛、(2E)-2-辛烯醛、1-辛烯-3-醇这4种腥味化合物。咖啡渣粉末中增加的腥味化合物,也在罗非鱼体表物质中被检出。
表3 咖啡渣粉末处理前后及罗非鱼体表物质的12种气味活性成分质量分数 单位:ng/g
Table 3 Mass fraction of 12 odor active components in tilapia body surface substances and powdered spent coffee grounds before and after treatment

挥发性化合物挥发性化合物的质量分数咖啡渣粉末(处理前)咖啡渣粉末(处理后)罗非鱼体表物质己醛5.90±3.26180.30±23.67183.50±29.48(Z)-4-庚烯醛---庚醛-41.02±5.3430.28±5.232-庚烯醛-21.01±4.2324.61±3.15辛醛--41.09±8.20(E,E)-2,4-庚二烯醛---(2E)-2-辛烯醛-188.81±30.66151.15±7.73壬醛17.51±5.07366.35±101.34123.06±16.17(Z)-4-癸烯醛--7.45±0.51癸醛--4.20±0.02正庚醇---1-辛烯-3-醇-283.73±36.441 037.71±116.99
注:“-”表示未检出;罗非鱼体表物质是在处理前由鱼体表刮取获得。
借助扫描电镜观察处理前后咖啡渣粉末的微观结构。图4-a是处理前的咖啡渣粉末,放大后能更清晰地观察到深入的孔隙结构。图4-b是处理后的咖啡渣粉末,放大后发现孔隙中填满了某些物质,与处理前差别明显。同时,处理后的咖啡渣粉末腥味化合物增加,罗非鱼皮腥味化合物减少,与咖啡渣粉末微观结构变化结合分析,表明咖啡渣粉末借助吸附作用减轻了罗非鱼体表腥味。

a-处理前(左图300倍,右图2.5k倍,右图为左图中白色矩形框的放大观察);b-处理后(左图300倍,右图2.5k倍,右图为左图中白色矩形框的放大观察)
图4 咖啡渣粉末SEM图
Fig.4 The SEM images of powdered spent coffee grounds
由此可见,咖啡渣粉末对罗非鱼体表的处理能够显著降低体表腥味,并且这一变化归因于咖啡渣粉末的吸附作用。钱攀等[28]研究活性炭对美国鲢鱼的脱腥效果,发现活性炭在鱼肉中难以除净,易造成食用风险。而将可食用的咖啡渣用作鱼类体表脱腥,不仅效果显著,而且鱼体表面光滑易清洗,不用担心食品安全问题。
2.3.2 咖啡渣提取液对冷藏罗非鱼肉的脱腥作用分析
咖啡渣提取液处理组中,与脂质氧化有关的挥发性醛类的含量显著低于蒸馏水处理组,可能是脂质氧化反应受到了抑制。脂肪测定结果显示,未处理的罗非鱼肉脂肪含量为(3.03±0.23) g/100 g,蒸馏水处理后脂肪含量为(2.70±0.16) g/100 g,咖啡渣提取液处理后含量为(2.72±0.13) g/100 g,3组数据间不存在显著差异(P>0.05),说明咖啡渣提取液处理未造成鱼肉脂肪的溶解。TBARS值可作为鱼肉氧化程度的有效评价指标[29],图5显示,蒸馏水处理组的TBARS值在冷藏第5天超过0.6 mg MDA eq/kg,而咖啡渣提取液处理组冷藏第5天低于0.2 mg MDA eq/kg,表明咖啡渣提取液处理能够减缓鱼肉脂肪氧化速度,与PARVATHY等[23]的研究结论一致。
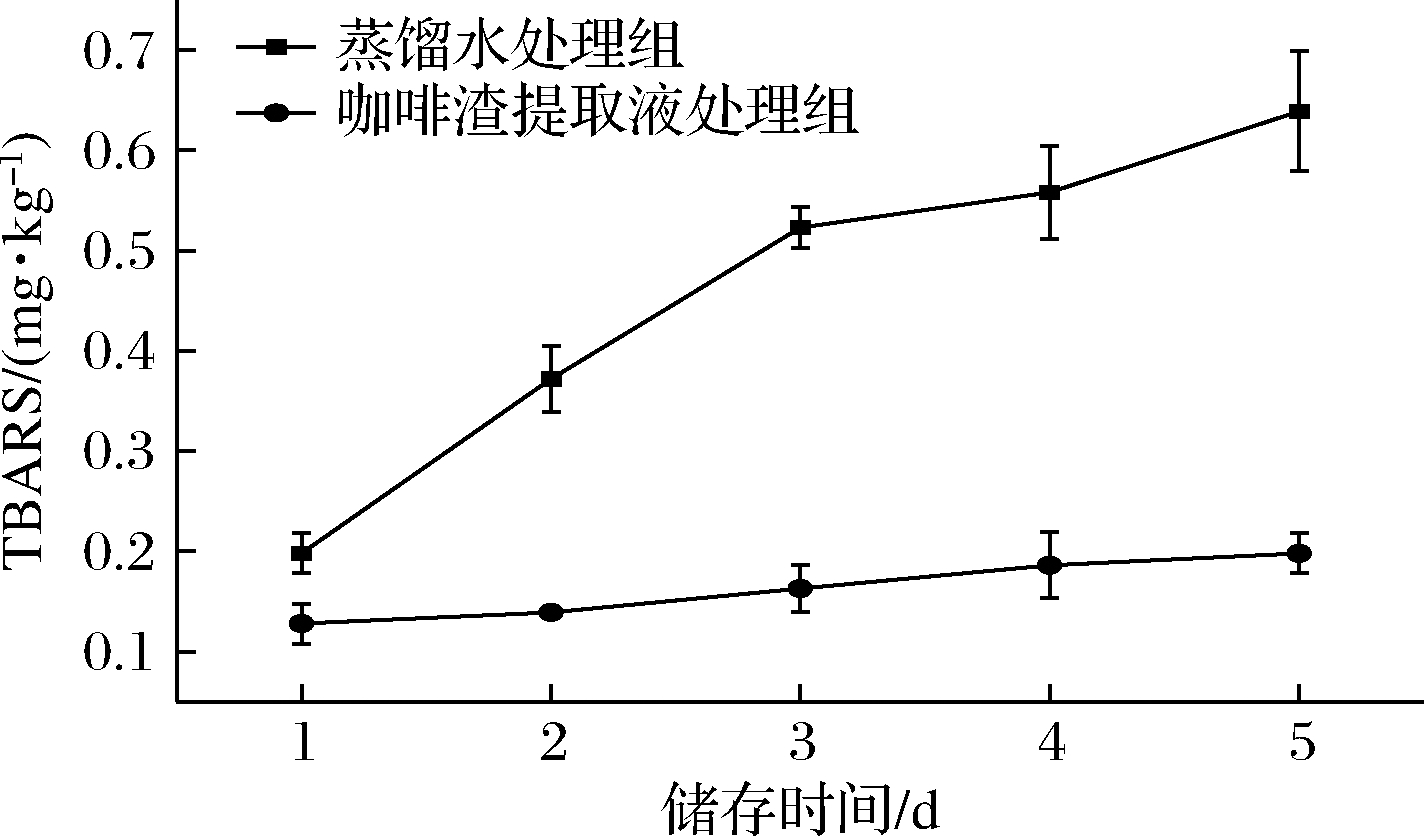
图5 不同处理条件下冷藏罗非鱼肉TBARS变化
Fig.5 The changes of TBARS of refrigerated tilapia meat under different treatment
HPLC分析发现,咖啡渣提取液中的绿原酸含量丰富(400 μg/mL)。蒸馏水处理的脂肪氧化酶活性为(19.3±0.02) U/min,咖啡渣提取液处理后脂肪氧化酶活性为(9.2±0.60) U/min,400 μg/mL绿原酸标准溶液处理后酶活为(9.60±0.03) U/min,说明咖啡渣提取液能够有效抑制脂肪氧化酶活性,推测绿原酸起主要作用。
上述结果表明,咖啡渣提取液中的绿原酸通过抑制脂肪氧化酶活性进而延缓脂肪氧化进程,充分发挥了自身的强抗氧化性[30],有利于改善罗非鱼肉冷藏期间因脂肪氧化造成的风味劣变。LI等[31]研究发现红辣椒叶提取物能够提高盐银鱼加工过程中的脂质稳定性,与本研究中咖啡渣提取液的作用效果一致。
3 结论
本研究以废弃咖啡渣为原料,通过GC-MS和感官评定分别探究咖啡渣粉末及其提取液对罗非鱼体表及鱼肉的脱腥效果。结果表明,经咖啡渣粉末处理后,罗非鱼体表与腥味有关的气味活性成分的含量下降74.09%,而处理过程造成咖啡渣粉末中腥味化合物增加,结合扫描电镜结果认为咖啡渣粉末对罗非鱼体表腥味具有吸附作用,实现脱腥。此外,咖啡渣提取液处理后,鱼肉腥味化合物的累积速度慢于蒸馏水处理组,TBARS值增速减缓;HPLC分析发现咖啡渣提取液中绿原酸丰富,脂肪氧化酶活性在咖啡渣提取液处理后下降,表明冷藏罗非鱼肉的风味改良主要在于,咖啡渣提取液阻止了脂肪氧化酶对脂肪氧化的促进作用。咖啡渣在罗非鱼脱腥方面的应用是对生物废弃物的二次利用,成分天然易被消费者接受,不存在食用隐患,且成本较低,操作简便,耗时较短。但咖啡色素对鱼肉的影响,还需通过改进提取方法来消除。本研究为开发简便高效、低成本的淡水鱼脱腥方法提供科学参考,也为开拓废弃咖啡渣的应用提供了新思路。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会编制.中国渔业统计年鉴-2020[M].北京:中国农业出版社, 2020.
Department of Agriculture and Rural Fisheries Fishery Administration,National Aquatic Technology Promotion Station,China Society of Fisheries.2020 China Fishery Statistical Yearbook[M].Beijing:China Agriculture Press,2020.
[2] MAHMOUD M A A, BUETTNER A.Characterisation of aroma-active and off-odour compounds in German rainbow trout (Oncorhynchus mykiss).Part II:Case of fish meat and skin from earthen-ponds farming[J].Food Chemistry, 2016, 232:841-849.
[3] HOWGATE P.Tainting of farmed fish by geosmin and 2-methyl-iso-borneol:A review of sensory aspects and of uptake/depuration[J].Aquaculture, 2004, 234(1-4):155-181.
[4] KANNER J.Oxidative processes in meat and meat products:Quality implications[J].Meat Science, 1994, 36(1-2):169-189.
[5] TOYOMIZU M, HANAOKA K, YAMAGUCHI K.Effect of release of free fatty acids by enzymatic hydrolysis of phospholipids on lipid oxidation during storage of fish muscle at-5.DEG.C[J].Nippon Suisan Gakkaishi, 1981, 47(5):615-620.
[6] 陈海燕,郑惠娜,曹文红,等.波纹巴非蛤酶解产物脱色脱腥及其分子量分布研究[J].广东农业科学, 2016, 43(9):132-139.
CHEN H Y, ZHENG H N, CAO W H, et al.Study on decolorization, deodorization and molecular weight distribution of enzymatic hydrolysis prepared from Paphia undulta[J].Guangdong Agricultural Sciences,2016,43(9):132-139.
[7] HAM J S, KIM H Y, LIM S T.Antioxidant and deodorizing activities of phenolic components in chestnut inner shell extracts[J].Industrial Crops and Products, 2015, 73:99-105.
[8] 庄圣炜, 孙水裕.咖啡渣制备活性炭及其在环境污染治理应用进展[J].广东化工, 2018, 45(11):110-113.
ZHUANG S W, SUN S Y.Preparation of activated carbon made from coffer grounds and its application in the environmental pollution control:A review[J].Guangdong Chemical Industry, 2018, 45(11):110-113.
[9] LEE C S, HAN I.Physiological activities of water and 80% ethanol extracts of various coffee bean residues[J].Korean Journal of Food and Cookery Science, 2019, 35(6):591-600.
[10] RHI J W, SHIN H S.Physicochemical properties of antioxidant fractions extracted from freeze-dried coffee by various solvents[J].Korean Journal of Food Science and Technology, 1996, 28(1):109-116.
[11] 何其, 王晶, 曹雪涛, 等.基于质构变化的罗非鱼片冻藏保质期预测[J].食品科学, 2014, 35(10):241-245.
HE Q, WANG J, CAO X T, et al.Prediction of the shelf-life of frozen Tilapia based on changes in texture parameters[J].Food Science, 2014, 35(10):241-245.
[12] SANTOS M D, MATOS G, CASAL S, et al.Quality evolution of raw meat under hyperbaric storage:Fatty acids, volatile organic compounds and lipid oxidation profiles[J].Food Bioscience, 2021, 42:101108.
[13] 顾赛麒, 周洪鑫, 郑皓铭, 等.干制方式对腌腊草鱼脂肪氧化和挥发性风味成分的影响[J].食品科学, 2018, 39(21):1-10.
GU S Q, ZHOU H X, ZHENG H M, et al.Effects of different drying methods on lipid oxidation and volatile flavor components of cured grass carp[J].Food Science, 2018, 39(21):1-10.
[14] 李莎莎, 于娟, 谭淑瑜, 等.HPLC法测定不同产地咖啡中咖啡因、咖啡酸及绿原酸的含量[J].江西中医药大学学报, 2017, 29(1):90-93.
LI S S, YU J, TAN S Y, et al.Determination of caffeine, caffeic acid and chlorogenic acid in coffee beans from different origins by RP-HPLC[J].Journal of Jiangxi University of Traditional Chinese Medicine, 2017, 29(1):90-93.
[15] JIN G F, ZHANG J H, YU X, et al.Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J].Food Chemistry, 2010, 123(2):465-471.
[16] XU Y X, JIANG Z D, DU X P, et al.The identification of biotransformation pathways for removing fishy malodor from Bangia fuscopurpurea using fermentation with Saccharomyces cerevisiae[J].Food Chemistry, 2022, 380:132103.
[17] 雷乙, 陈竟豪, 涂金金, 等.鱼肉加工过程特征气味物质变化研究进展[J].食品研究与开发, 2020, 41(15):201-210.
LEI Y, CHEN J H, TU J J, et al.Research progress on changes of characteristic odor substances in fish processing[J].Food Research and Development, 2020, 41(15):201-210.
[18] 吴薇,陶宁萍,顾赛麒.鱼肉特征性气味物质研究进展[J].食品科学, 2013, 34(11):381-385.
WU W, TAO N P, GU S Q.Research progress in characteristic odor compounds of fish meats[J].Food Science, 2013, 34(11):381-385.
[19] ROSS C F, SMITH D M.Use of volatiles as indicators of lipid oxidation in muscle foods [J].Comprehensive Reviews in Food Science and Food Safety, 2006, 5(1):.18-25.
[20] LIU T T, YU J W, SU M, et al.Production and fate of fishy odorants produced by two freshwater chrysophyte species under different temperature and light conditions[J].Water Research, 2019, 157:529-534.
[21] YARNPAKDEE S, BENJAKUL S, KRISTINSSON H G.Lipid oxidation and fishy odour in protein hydrolysate derived from Nile tilapia (Oreochromis niloticus) protein isolate as influenced by haemoglobin[J].Journal of the Science of Food and Agriculture, 2014, 94(2):219-226.
[22] PARVATHY U, SIVARAMAN G K, MURTHY L N,et al.Green coffee extract as a natural antioxidant in chill stored Indian mackerel (Rastrelliger kanagurta) mince[J].Indian Journal of Fisheries,2018.DOI:10.21077/ijf.2018.65.1.73739-14.
[23] PERCIVAL S, DRABSCH P, GLENCROSS B.Determining factors affecting muddy-flavour taint in farmed barramundi, Lates calcarifer[J].Aquaculture, 2008, 284(1-4):136-143.
[24] DUFLOS G, COIN V M, CORNU M, et al.Determination of volatile compounds to characterize fish spoilage using headspace/mass spectrometry and solid-phase microextraction/gas chromatography/mass spectrometry[J].Journal of the Science of Food and Agriculture, 2006, 86(4):600-611.
[25] SELLI S, CAYHAN G G.Analysis of volatile compounds of wild gilthead sea bream (Sparus aurata) by simultaneous distillation-extraction (SDE) and GC-MS [J].Microchemical Journal, 2009, 93(2):232-235.
[26] GÖRGÉNYI M, DEWULF J, VAN LANGENHOVE H, et al.Aqueous salting-out effect of inorganic cations and anions on non-electrolytes[J].Chemosphere, 2006, 65(5):802-810.
[27] GU S Q, DAI W L, CHONG Y Q,et al.The binding of key fishy off-flavor compounds to silver carp proteins:A thermodynamic analysis[J].RSC Advances, 2020, 10(19):11 292-11 299.
[28] 钱攀, 马旭婷, 许刚, 等.美国鲢鱼挥发性成分和脱腥方法研究[J].中国食品学报, 2016, 16(12):169-176.
QIAN P, MA X T, XU G, et al.Study on volatile components and deodorization of silver carp[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(12):169-176.
[29] SUN X Y, GUO X B, JI M Y, et al.Preservative effects of fish gelatin coating enriched with CUR/βCD emulsion on grass carp (Ctenopharyngodon idellus) fillets during storage at 4 ℃[J].Food Chemistry, 2019, 272:643-652.
[30] 张晓霞. 绿咖啡豆中绿原酸的提取纯化及其提取物抗氧化活性的研究[D].南宁:广西大学, 2014.
ZHANG X X.Separation of chlorogenic acid from green coffee beans and the extract antioxidant activity in vitro[D].Nanning:Guangxi University, 2014.
[31] LI J K, HUI T, WANG F L, et al.Chinese red pepper (Zanthoxylum bungeanum Maxim.) leaf extract as natural antioxidants in salted silver carp (Hypophthalmichthys molitrix) in dorsal and ventral muscles during processing[J].Food Control, 2015, 56:9-17.