小黄鱼(Larimichthys polyactis),又名小黄花鱼,广泛分布于我国黄海、东海和渤海以及朝鲜半岛西海岸,为暖温性底层结群洄游性鱼[1]。小黄鱼是我国近海重要的优势种类和渔业经济种类,与带鱼、大黄鱼共称为我国三大海产鱼[2-3]。由于其营养丰富、肉质鲜美、价格低廉、产量丰盛等优势,深受消费者青睐。小黄鱼等水产品主要利用冷藏、微冻、冻藏等低温贮藏方式延长其货架期。
冻藏对微生物的生长、繁殖有抑制作用,且可促使内源酶活力下降,虽处于低温条件下,但某些生化反应在鱼肉中仍以较慢速度发生,比如内源酶从溶酶体中释放出来,通过酶解作用破坏肌肉组织以及持水力,导致鱼体发生劣变[4]。水产品体内含有很多种蛋白酶,当鱼体死后会从僵直期逐渐进入自溶期,主要有组织蛋白酶、氨肽酶、丝氨酸蛋白酶等酶类促使肌肉蛋白降解以及氨基酸积累[5]。其中,参与肌肉劣变的主要蛋白酶是组织蛋白酶B、H、L,可引起肌原纤维和结缔组织的降解[6-7]。此外,α-葡萄糖苷酶(α-glucosidase,AG)和β-乙酰基氨基葡萄糖苷酶(β-acetylglucosaminidase,NAG)与细胞完整性相关[8]。阙婷婷[9]研究低温条件下的乌鳢随着贮藏时间的延长,肌肉离心液中的AG和NAG活性均呈上升趋势,表明肌肉组织结构受到破坏。我国小黄鱼的产出速率逐年增加,消费区域不断扩大,但是,小黄鱼在不同低温冻藏过程中与蛋白质密切相关的蛋白酶活力变化尚未有相关报道。
本文通过研究低温冻藏(-18、-25 ℃)对小黄鱼的硬度、咀嚼性、弹性等质构特性和内源酶(组织蛋白酶B、H、L和AG、NAG)以及水分迁移的影响,与超低温冻藏(-45 ℃)环境下小黄鱼品质指标进行比较,研究在超低温冻藏过程中小黄鱼肉中的AG、NAG和组织蛋白酶活性在冻藏过程中的变化规律以及水分迁移情况,旨在从内源性蛋白酶的角度揭示小黄鱼肉在长期冻藏过程中鲜度变化的机理,为小黄鱼的保鲜贮藏提供理论参考。
1 材料与方法
1.1 材料与设备
小黄鱼,浙江省舟山市批发市场,挑选个体均一(120~140 g),背部金黄色,腹部偏白的新鲜个体,冰藏条件下运回实验室处理。
UV-3100紫外-可见分光光度计,上海美普达仪器有限公司;BS223 S电子天平,北京赛多利斯仪器系统有限公司;LG10-2.4A高速离心机,北京医用离心机厂;PT-2100组织捣碎机,瑞士Kinematica公司;TA.XT plus食品质构仪,超技仪器有限公司;MK3微孔板酶标仪,美国Thermo Labsystems公司;ZO-85恒温培养箱,常州市国旺仪器制造有限公司;MesoMR23-060H-I低场核磁共振分析仪,上海纽迈电子科技有限公司。
1.2 实验方法
1.2.1 样品处理
新鲜小黄鱼经冰水清洗除去表皮黏液,蒸馏水清洗沥干后随机分为3组,再用聚乙烯保鲜袋每3条一袋分装,分别贮藏于-18、-25、-45 ℃。测量时,随机取出一袋,去头、内脏、鱼皮和鱼骨,取肉,搅碎,待测。
1.2.2 质构测定
参照ZHU等[10]的方法。取鱼背部肉,将鱼肉切成20 mm×20 mm×15 mm的立方体,将其置于质构仪上测定鱼肉的硬度、弹性、咀嚼性。测量模式选择TPA,测定探头为TPA P/6圆柱形,测试前后速度均为1 mm/s,测试间隔时间为5 s,鱼肉的变形率为30%,压力为10 N,每组样品3个平行,每个平行重复测定2次。
1.2.3 组织蛋白酶活性测定
采用ELISA检测试剂盒法测定鱼组织蛋白酶B、H、L。
1.2.4 AG和NAG活性测定
参考BENJAKUL等[11]的方法,并进行适当修改。称取25 g鱼肉,绞碎,8 000 r/min离心30 min,得到鱼肉渗出液。
AG活性:用蒸馏水将鱼肉渗出液定容至25 mL,取2 mL样液于试管中,向试管中加入0.6 mL 0.1 mol/L pH 4.0的柠檬酸钠缓冲液和0.4 mL 1.0 mol/L的NaCl溶液,充分混匀后放于37 ℃水浴锅中,预热10 min,之后向试管中加入2 mL 4.2 mmol/L对硝基苯-α-吡喃葡萄糖苷(p-nitrophenyl-α-glucopyranoside),反应开始。混匀后放于37 ℃水浴锅中,反应60 min后,加入2 mL 0.3 mol/L的KOH溶液使反应终止。每组3个平行,在加入开始反应试剂之前加反应终止剂作为阴性对照,以2 mL蒸馏水代替2 mL样液参与反应即为空白对照。反应结束后,在波长405 nm下用分光光度计测吸光度。
NAG活性:样品稀释液制备方法同上。取0.6 mL样液于试管中,向试管中加入0.9 mL 0.1 mol/L pH 4.5的柠檬酸钠缓冲液和0.6 mL 0.6 mol/L的KCl溶液,再加入0.6 mL 1 mmol/L对硝基苯-β-D-乙酰氨基葡萄糖(p-nitrophenyl-N-acetyl-β-D-glucopyranoside)表示反应开始,混匀后放于37 ℃水浴锅中反应10 min,最后加入3 mL 0.3 mol/L KOH溶液来终止反应。每组3个平行,阴性对照和空白对照操作方法同上。反应结束后,在波长405 nm下用分光光度计测吸光度。
1.2.5 低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)及核磁成像分析
取1 cm×1 cm×1 cm的小黄鱼块,用保鲜膜包装,放入核磁检测管中,线圈温度为32 ℃,质子共振频率为12 MHz,使用CPMG序列测定样品,各参数设定为:采样频率SW=125 kHz,模拟增益RG1=1,P1=5.80 μs,P2=9.60 μs,数字增益DRG1=2,TD=150 004,PRG=3,回波个数NECH=6 000,重复次数NS=4,重复采样间隔时间TW=2 500,回波时间TE=0.20 ms。用分析软件进行迭代反演得到横向弛豫时间T2以及各自所对应的峰面积百分比。不同状态水分相对含量以其对应峰面积比例表示,并使用磁共振成像(magnetic resonance imaging,MRI)软件进行成像,并将图像进行伪彩处理。
1.2.6 持水力测定
参照JIANG等[12]的方法,略有改动。称取鱼肉3 g(精确到0.000 1 g),用滤纸擦去表面的黏液,称质量,包裹滤纸装入离心管中,3 000 r/min离心10 min,称量鱼肉,重复测量3次,取平均值。持水力按公式(1)计算:
持水力![]()
(1)
式中:m1,离心前鱼肉质量,g;m2,离心后鱼肉质量,g。
1.2.7 数据处理与分析
采用SPSS 26.0对数据进行相关性及单因素方差分析,Origin 9.1数据进行分析处理。
2 结果与分析
2.1 质构变化
如表1所示,小黄鱼在不同低温冻藏条件下的硬度、咀嚼性和弹性随着贮藏时间的延长均呈下降趋势,这是由于冻藏期间小黄鱼肌肉中的自身酶解作用以及外部的微生物的作用降解蛋白质,分解纤维,影响质地[13],使质构中各指标值显著下降(P<0.05)。小黄鱼硬度、弹性和咀嚼性的初始值分别为(95.14±1.45) g、(2.34±0.05) mm和(112.48±1.30) mJ,冻藏200 d后-45 ℃组样品的硬度、弹性和咀嚼性值分别下降至(78.37±2.19) g、(1.04±0.06) mm、(50.68±2.20) mJ。与-18、-25 ℃组样品相比,其下降幅度相对较小,且整个冻藏期间其质构各指标值均高于其他2组,说明-45 ℃组可较好地维持小黄鱼肉质地,这与柴智等[14]的研究结果相一致。WANG等[15]也得到了类似的结果,他们发现相比于-18 ℃温度,-30 ℃温度下更能有效地保存鱼片的硬度,细胞外大冰晶的形成和收缩会导致组织变形,导致硬度下降。
表1 不同冻藏温度条件下小黄鱼鱼肉质构特性变化情况
Table 1 Muscle texture characteristics of Larimichthys polyactis at different frozen temperatures

时间/d硬度/g弹性/mm咀嚼性/mJ-18 ℃-25 ℃-45 ℃-18 ℃-25 ℃-45 ℃-18 ℃-25 ℃-45 ℃095.14±1.45a95.14±1.45a95.14±1.45a2.34±0.05a2.34±0.05a2.34±0.05a112.48±1.30a112.48±1.30a112.48±1.30a2590.45±1.96a92.15±1.70ab94.14±3.15ab2.12±0.04b2.27±0.09ab2.30±0.1a97.22±1.93b99.37±1.26b104.24±2.17b5085.95±0.95b89.44±2.18bc93.85±2.14ab2.11±0.09b2.20±0.11b2.24±0.06a80.43±2.19c89.75±1.31c95.85±1.26c7579.28±2.12c85.94±1.79c91.57±1.94ab1.75±0.05c1.80±0.06c1.94±0.04b74.45±1.65d79.59±2.16d86.22±2.37d10072.12±2.22d78.96±1.40d90.50±2.49bc1.66±0.03c1.72±0.04c1.72±0.09c60.85±1.26e65.75±1.27e78.68±2.21e12569.67±1.47de77.48±2.02d86.43±4.14cd1.31±0.11d1.41±0.08d1.58±0.08d48.93±1.37f53.31±1.32f62.44±2.96f15066.99±1.56ef72.87±1.45e84.33±2.11d0.99±0.03e1.02±0.05e1.25±0.06e48.41±2.27f51.25±2.01fg56.12±1.32g17565.52±1.86fg70.37±1.82ef79.84±3.14e0.98±0.04e1.01±0.03e1.20±0.04e47.48±2.32fg49.19±2.99g51.76±2.36h20061.95±1.61g67.63±2.16f78.37±2.19e0.97±0.02e1.00±0.07e1.04±0.06f44.05±1.61g48.92±1.14g50.68±2.20h
注:表中数据为平均值±标准偏差,同一列数据不同上标字母代表有显著差异(P<0.05)
2.2 组织蛋白酶B、H、L活性变化
在冻藏过程中,酶的作用对小黄鱼肉的品质有着直接的影响。如图1所示,随着冻藏时间的延长组织蛋白酶的活性均先减小后增加,在-45 ℃冻藏0~75 d,组织蛋白酶B和L活性均显著下降(P<0.05);冻藏0~50 d,组织蛋白酶H也下降了18.43%。在-18和-25 ℃条件下有相同趋势,可能因为低温冻藏对组织蛋白酶的活性有抑制作用。组织蛋白酶B和L在第75 d后和组织蛋白酶H在50 d后,酶活性皆随时间延长显著增加(P<0.05),因此75 d是组织蛋白酶B和L的冻藏温度的分界点,而50 d是组织蛋白酶H的分界点。后期呈上升趋势,可能是由于当贮藏时间不断增加,低温已不能起到主要抑制酶活性的作用,肌肉中的生成的冰晶数目和面积增加以及自由基会攻击细胞膜,破坏细胞膜[16-17]。此外,-45 ℃组的组织蛋白酶的活性在贮藏期间始终是低于-18和-25 ℃组,推测在-45 ℃比-18和-25 ℃下储存的小黄鱼肉中形成了更小的冰晶,从而导致鱼肉解冻时细胞和溶酶体膜的破裂相对较小,导致更少的组织蛋白酶从溶酶体释放出来,肌肉组织破坏[18]。同样地,在HU等[19]发现更低温度液氮(-80 ℃)条件下对带鱼组织蛋白酶活性的抑制程度最高,且温度越低,抑制作用越强,肌原纤维蛋白降解速度越慢。LU等[20]研究冷冻贮藏对鳙鱼鱼片理化特性的影响中发现,在-12和-28 ℃冻藏的样品肌原纤维中,组织蛋白酶B和B+L的活性在0~1周下降,在第8~16周,组织蛋白酶B和B+L活性显著升高(P<0.05),表明在冷冻后期肌肉发生降解反应。
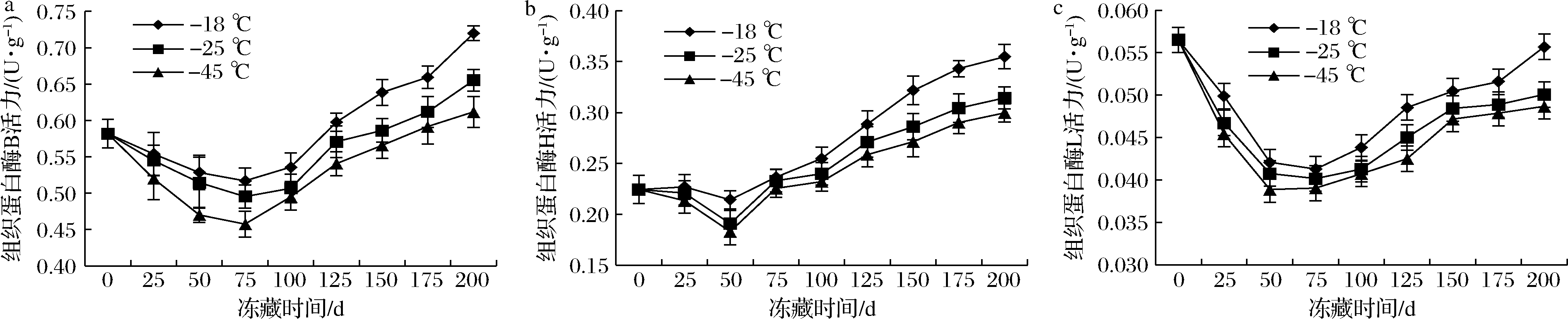
a-组织蛋白酶B;b-组织蛋白酶H;c-组织蛋白酶L
图1 不同温度贮藏条件下小黄鱼的组织蛋白酶活性随贮藏时间的变化
Fig.1 Cathepsin activity of L.polyactis at different storage temperatures
2.3 AG和NAG活性变化
AG和NAG活性可作为细胞和组织完整性的标志物,活性越高表明细胞破坏越严重[21]。如图2所示,随着冻藏时间的延长,冰晶形成和增加破坏了细胞,未冻相中盐浓度的增加改变了细胞的渗透性,导致AG和NAG的渗漏,所以-18、-25、-45 ℃冻藏条件下小黄鱼肉中AG和NAG活性呈现增加趋势。KINGWASCHARAPONG等[22]发现太平洋白虾形成的渗出液中AG和NAG活性随着冻融循环的增加而增加。在冻藏后期,AG、NAG活性依然持续上升,表明随着贮藏时间增加,低温对酶活性抑制作用减小,肌肉组织仍在恶化,而低温不能决定后期冷冻贮藏中酶的活性。
从图2-a可知,-18和-25 ℃下的小黄鱼肉AG活性在冻藏0~125 d呈缓慢增加,没有显著性(P>0.05),可能是冻藏前期低温对AG活性有抑制作用;而冻藏125~200 d显著增加(P<0.05),从(0.90±0.03)、(0.82±0.04) U/g分别增加到(1.66±0.03)、(1.34±0.08) U/g。超低温-45 ℃下的小黄鱼肉AG在冻藏后期其AG活性显著低于-18和-25 ℃下,说明超低温可以抑制酶活性,可能是因为超低温下的冰晶小且均匀,对细胞组织破坏小,更好地保持鱼的品质。
从图2-b看出,-18 ℃下的小黄鱼肉NAG活性在冻藏0~125 d显著上升(P<0.05),125~175 d缓慢上升,可能是酶自身在此期间有降解的原因,后期175~200 d又显著增加。冻藏200 d,-18、-25和-45 ℃组的NAG活性从初始值(1.02±0.09) U/g分别上升到(3.53±0.12)、(2.98±0.14)和(2.74±0.07) U/g。-25和-45 ℃下NAG活性在贮藏后期显著低于-18 ℃,且-45 ℃组NAG活性最低,说明温度越低,NAG活性越小,对蛋白氧化、细胞组织破坏越小。

a-AG;b-NAG
图2 不同温度贮藏条件下小黄鱼的AG和NAG活性变化
Fig.2 Changes of AG and NAG activities of L. polyactis at different storage temperatures
注:不同大写字母表示相同冻藏时间不同温度组间存在显著差异(P<0.05),不同小写字母表示相同温度不同贮藏时间组间存在显著差异(P<0.05)(下同)
2.4 水分变化
2.4.1 LF-NMR分析
使用LF-NMR技术可以分析出小黄鱼肉中不同状态下水的含量、分布情况和迁移过程[23]。T21(0.1~10 ms)表示结合水的横向弛豫时间;T22(10~100 ms)表示不易流动水横向弛豫时间;T23(100~1000 ms)表示自由水横向弛豫时间。在水分LF-NMR图中有3~4个峰,这和其他人的分析结果一致[24-25]。

a-A;b-A21;c-A22;d-A23
图3 不同温度下小黄鱼各横向弛豫时间峰面积的变化
Fig.3 Peak areas of transverse relaxation times of L.polyactis at different storage temperatures
从图3-a看出,3种温度下的小黄鱼肉总体峰面积A随着冻藏时间的增加不断降低,0~250 d,-18、-25和-45 ℃组从初始值5 096.58分别下降到2 493.65、2 383.92和3 170.32。在整个冻藏期间-45 ℃组总峰面积下降最缓慢,表示此温度下的小黄鱼肉持水力最强,而-18和-25 ℃组冻藏前期总峰面积显著下降,可能是长期冻藏使得冰晶升华,温度越高鱼肉干耗越严重,水分损失越多。
如图3-b所示,结合水峰面积A21随着时间延长而减小,-18 ℃组50 d时下降到初始值的55.88%,显著下降(P<0.05)说明此温度下的鱼肉的品质发生劣变更迅速,结构破坏较严重。在前150 d,-25和-45 ℃组鱼肉结合水差异不显著,到250 d时,-45 ℃组结合水含量显著高于其他2组,水分迁移运动缓慢,A21的下降速度最慢,所以低温有利于长期贮藏。
据图3-c可知,冻藏250 d时,-45 ℃组的A22最高。不同温度组鱼肉A22含量随时间增加呈下降趋势,可能因为低温破坏细胞组织,酶和一些功能键开始相互作用,纤维膜网状结构的破坏,降低了膜内疏水能力,持水力降低[26]。
由图3-d可知,不同温度组组间的自由水A23差异增大,冻藏200 d时,其随温度增大而增加,即-45 ℃组<-25 ℃组<-18 ℃组。随着冻藏时间延长A23呈上升趋势,推测可能由于蛋白质降解,肌纤维持水力下降,使得膜内水向外层流动,100 d后A23急速增大,这与张楠楠等[27]研究结果相似。且-45 ℃组A23显著低于其他两组,说明温度越低自由水含量越少。
2.4.2 MRI成像分析
图4为MRI成像分析结果,颜色越鲜红表示H质子密度越大,水分含量高;颜色越深表示H质子密度越小,含水量低[28]。如图4所示,新鲜样品颜色中间鲜红部分占据更大比例,说明含水量较高,从横列来看,随着冻藏时间的延长,图片中的艳红部分逐渐减少,可以直观地表现出小黄鱼的水分迁移和水分含量减少情况;从纵列来看,随着冻藏温度的降低,鲜红色区域是增多的,表明温度越低表现出更高的持水力。-18 ℃组在100 d时红色部分几近消失,蓝绿色占据全部,说明水分含量损失严重,这与图3中总峰面积变化相一致。250 d时,3种温度的图片颜色皆为蓝色,不易流动水大多转变成自由水,解冻时流出鱼肉,持水力降低。因此,表明超低温(-45 ℃)条件下小黄鱼肉持水力较高,迁移水分较少,保鲜效果更好。
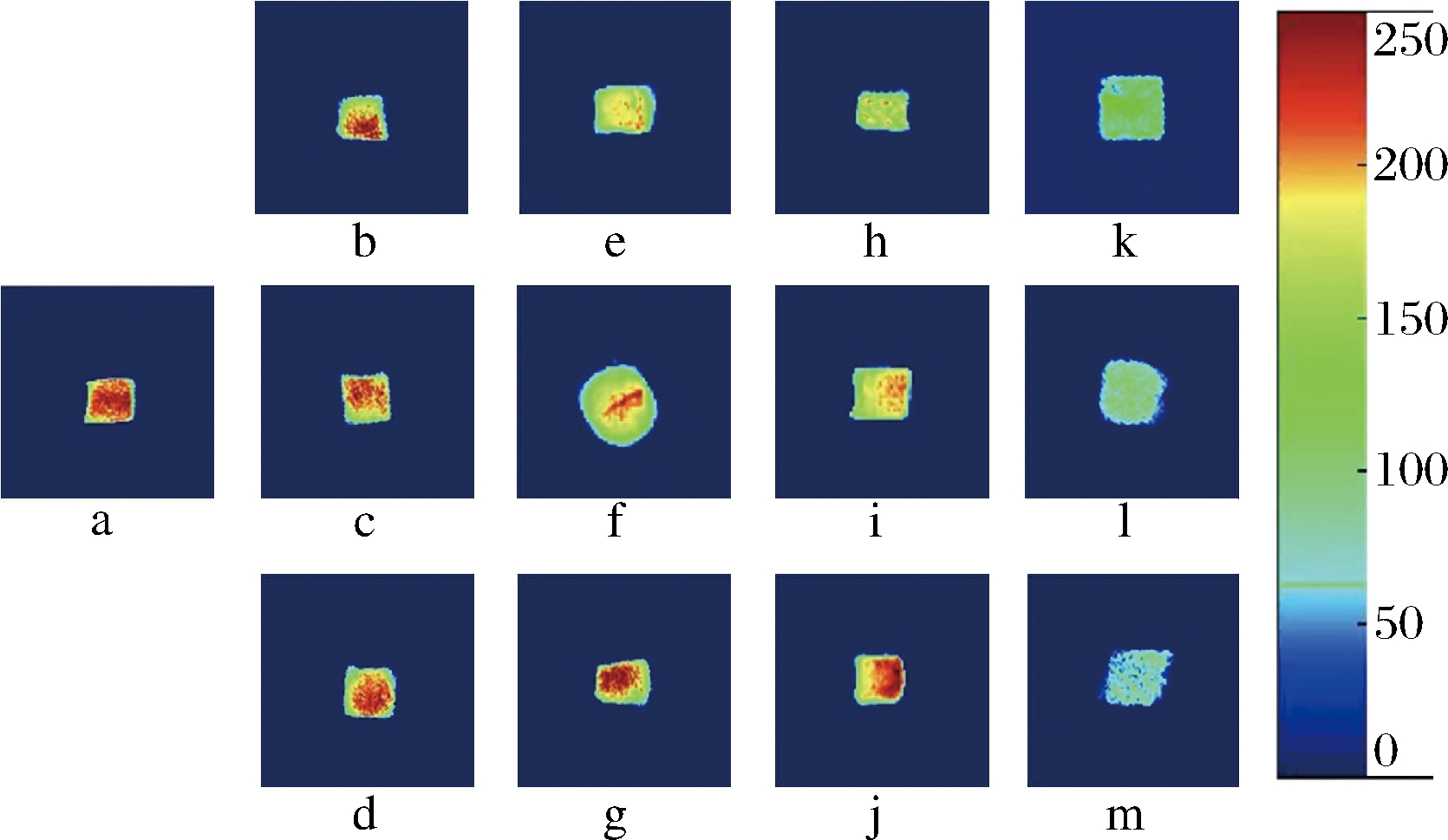
a-新鲜小黄鱼;b-18 ℃-50 d;c-25 ℃-50 d;d-45 ℃-50 d;e-18 ℃-100 d;f-25 ℃-100 d;g-45 ℃-100 d;h-18 ℃-150 d;i-25 ℃-150 d;j-45 ℃-150 d;k-18 ℃-250 d;l-25 ℃-250 d;m-45 ℃-250 d
图4 不同温度下小黄鱼MRI成像图
Fig.4 Magnetic resonance imaging of L. polyactis at different storage temperatures
2.4.3 持水力
由图5可知,随着冻藏时间延长,3种温度下的小黄鱼的持水力均下降,这与总峰面积下降结果相一致,由于冻藏过程中冰晶形成,破环肌肉组织结构,汁液流失增大,此结果与阙婷婷等[29]研究自然解冻乌鳢情况相一致。冻藏200 d时,-18、-25、-45 ℃组小黄鱼肌肉的持水力从初始值79.11%,分别下降到68.65%、73.48%和74.62%,超低温(-45 ℃)条件下小黄鱼持水力显著高于其他2组(P<0.05)。且0~200 d期间,-45 ℃组最慢,可能是由于超低温冻结速率快,形成冰晶小,对组织破环较小。周果等[30]研究贮藏温度对鲐鱼肉品质的影响,结果表明贮藏温度越低,鱼肉持水力越好,这与本研究结果一致。超低温(-45 ℃)组极大地增大了小黄鱼肉持水力,提高了小黄鱼的品质。

图5 不同温度条件下小黄鱼的持水力的变化
Fig.5 Retention ability in L.polyactis at different storage temperatures
3 结论与讨论
随着冻藏时间延长,-18、-25、-45 ℃组小黄鱼的硬度、弹性和咀嚼性均呈下降趋势。组织蛋白酶在贮藏过程中均先下降后上升,且75 d是组织蛋白酶B和L的冻藏温度的分界点,50 d是组织蛋白酶H的冻藏温度的分界点,-45 ℃组的组织蛋白酶活性始终低于-18和-25 ℃组;AG和NAG活性随时间增加而增加,冻藏后期-45 ℃组酶活性显著低于其他两组;同时由低压核磁共振结果分析可知,小黄鱼肉总水分含量下降,不易流动水向自由水转移,自由水含量增加,而-45 ℃组不易流动水转移最少;200 d时,-45 ℃条件下小黄鱼持水力显著高于其他2组。因此,小黄鱼在长期冻藏过程中,超低温(-45 ℃)可以更有效地抑制酶活性,减缓水分转移,保持鱼肉品质。目前超低温技术应用十分广泛,但从经济效益、能源消耗方面考虑,仍存在局限性,若可以与高压、气调以及天然化学防腐剂等多技术结合使用,则更有利于小黄鱼在长期贮藏仍能保持新鲜度。
[1] 谭鲁玉, 王玉堃, 唐学玺, 等.黄海小黄鱼不同组织中δ15N的分布特征及其生态学意义[J].渔业科学进展, 2018, 39(3):30-35.
TAN L Y, WANG Y K, TANG X X, et al.Distribution characteristics of the stable nitrogen isotope in different tissues of small yellow croaker and the ecological significance in the Yellow Sea[J].Progress in Fishery Sciences, 2018, 39(3):30-35.
[2] 董开成. 不同低温预处理对小黄鱼贮藏过程中品质的影响[D].杭州:浙江大学, 2015.
DONG K C.Effect of different pre-frozen methods on the quality of small yellow croaker[D].Hangzhou:Zhejiang University, 2015.
[3] 李建生, 林龙山, 程家骅.东海北部秋季小黄鱼分布特征及其与底层温度和盐度的关系[J].中国水产科学, 2009, 16(3):348-356.
LI J S, LIN L S, CHENG J H.Distribution characteristic of small yellow croaker(Larimichthys polyactis Bleeker) and its relationship with bottom water temperature and salinity in the northern East China Sea in autumn[J].Journal of Fishery Sciences of China, 2009, 16(3):348-356.
[4] 王慧平,张欢, 陈倩, 等.鱼肉内源性蛋白酶对其贮藏期品质影响的研究进展[J].食品工业科技, 2021, 42(19):429-435.
WANG H P, ZHANG H, CHEN Q, et al.Research progress on effects of endogenous protease on quality of fish during storage[J].Science and Technology of Food Industry, 2021, 42(19):429-435.
[5] 章超桦, 薛长湖.水产食品学[M].北京:中国农业出版社, 2018, 3:33.
ZHANG C H, XIU C H.Aquatic Food Microbiology[M].Beijing:China Agriculture Press, 2018, 3:33.
[6] 崔珺. 速冻方式和贮藏温度对带鱼品质影响的研究[D].舟山:浙江海洋大学, 2011.
CUI J.Study on quality changes of Trichiurus haumela subjected to different frozen methods and storage temperature[D].Zhoushan:Zhejiang Ocean University, 2011.
[7] KIM Y H B, BØDKER S, ROSENVOLD K.Influence of lamb age and high-oxygen modified atmosphere packaging on protein polymerization of long-term aged lamb loins[J].Food Chemistry, 2012, 135(1):122-126.
[8] ALBERIO G R A, BARBAGALLO R N, TODARO A, et al.Effect of freezing/thawing process in different sizes of blue fish in the Mediterranean through lysosomal enzymatic tests[J].Food Chemistry, 2014, 148:47-53.
[9] 阙婷婷. 不同低温保鲜方法对乌鳢鱼肉理化性质以及组织结构的影响[D].杭州:浙江大学, 2014.
QUE T T.Effect of different low-temperature preservation methods on the physicochemical properties and microstructures of snakehead fillets[D].Hangzhou:Zhejiang University, 2014.
[10] ZHU S C, LUO Y K, HONG H, et al.Correlation between electrical conductivity of the gutted fish body and the quality of bighead carp (Aristichthys nobilis) heads stored at 0 and 3 ℃[J].Food and Bioprocess Technology, 2013, 6(11):3 068-3 075.
[11] BENJAKUL S, BAUER F.Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J].Journal of the Science of Food and Agriculture, 2000, 80(8):1 143-1 150.
[12] JIANG Q Q, JIA R, NAKAZAWA N, et al.Changes in protein properties and tissue histology of tuna meat as affected by salting and subsequent freezing[J].Food Chemistry, 2019, 271:550-560.
[13] HAFEZPARAST M N, HAMDAMI N, DALVI I M, et al.Effects of radiofrequency assisted freezing on microstructure and quality of rainbow trout (Oncorhynchus mykiss) fillet[J].Innovative Food Science &Emerging Technologies, 2018, 47(6):81-87.
[14] 柴智, 黄琼, 冯进, 等.不同冻藏温度对鳜鱼鱼肉品质变化的影响[J].江苏农业科学, 2020, 48(13):228-235.
CHAI Z, HUANG Q, FENG J, et al.Effects of different frozen storage temperatures on quality of mandarin fish (Siniperca chuatsi)[J].Jiangsu Agricultural Sciences, 2020, 48(13), 228-235.
[15] WANG Y Q, ZHANG T, CHEN Q, et al.Effects of immersion freezing with coolant on the quality of grouper (female Epinephelus fuscoguttatus×male Epinephelus lanceolatus) during frozen storage[J].CYTA-JOURNAL OF FOOD, 2021, 19(1):634-644.
[16] HAMILTON D N, ELLIS M, HEMANN M D, et al.The impact of longissimus glycolytic potential and short-term feeding of magnesium sulfate heptahydrate prior to slaughter on carcass characteristics and pork quality[J].Journal of Animal Science, 2002, 80(6):1 586-1 592.
[17] 李志鹏, 周晓娇, 水珊珊, 等.低温贮藏中华管鞭虾肌肉品质及组织蛋白酶H活性变化[J].食品工业科技, 2021, 42(22):306-313.
LI Z P, ZHOU X J, SHUI S S, et al.Influence of cold storage on the quality of muscle and the activity of cathepsin H in red shrimp (Solenocera crassicornis)[J].Science and Technology of Food Industry, 2021, 42(22):306-313.
[18] GE L H, XU Y S, XIA W S, et al.Synergistic action of cathepsin B, L, D and calpain in disassembly and degradation of myofibrillar protein of grass carp[J].Food Research International (Ottawa, Ont.), 2018, 109:481-488.
[19] HU L P, YING Y B, ZHANG H W, et al.Advantages of liquid nitrogen freezing in long-term frozen preservation of hairtail (Trichiurus haumela):Enzyme activity, protein structure, and tissue structure[J].Food Process Engineering, 2021, 44(9):e13789.
[20] LU H, ZHANG L T, SHI J, et al.Effects of frozen storage on physicochemical characteristics of bighead carp (Aristichthys nobilis) fillets[J].Food Processing and Preservation, 2019, 43(10):e14141.
[21] YANG F, JING D T, DIAO Y D, et al.Effect of immersion freezing with edible solution on freezing efficiency and physical properties of obscure pufferfish (Takifugu obscurus) fillets[J].LWT - Food Science and Technology, 2020, 118:108762.
[22] KINGWASCHARAPONG P, BENJAKUL S.Effect of phosphate and bicarbonate replacers on quality changes of raw and cooked Pacific white shrimp as influenced by the repeated freeze-thawing[J].International Journal of Refrigeration, 2016, 67:345-354.
[23] WANG H H, WANG R Y, SONG Y K, et al.A fast and non-destructive LF-NMR and MRI method to discriminate adulterated shrimp[J].Journal of Food Measurement and Characterization, 2018, 12(2):1 340-1 349.
[24] GUDJ NSD
NSD TTIR M, LAUZON H L, MAGN
TTIR M, LAUZON H L, MAGN SSON H, et al.Low field nuclear magnetic resonance on the effect of salt and modified atmosphere packaging on cod (Gadus morhua) during super chilled storage[J].Food Research International, 2011, 44(1):241-249.
SSON H, et al.Low field nuclear magnetic resonance on the effect of salt and modified atmosphere packaging on cod (Gadus morhua) during super chilled storage[J].Food Research International, 2011, 44(1):241-249.
[25] BERTRAM H C, ANDERSEN H J, KARLSSON A H.Comparative study of low-field NMR relaxation measurements and two traditional methods in the determination of water holding capacity of pork[J].Meat Science, 2001, 57(2):125-132.
[26] STOCK P, UTZIG T, VALTINER M.Direct and quantitative AFM measurements of the concentration and temperature dependence of the hydrophobic force law at nanoscopic contacts[J].Journal of Colloid and Interface Science, 2015, 446:244-251.
[27] 张楠楠, 蓝蔚青, 黄夏, 等.迷迭香复配液对大黄鱼冰藏品质及水分迁移的影响[J].食品科学, 2019, 40(7):247-253.
ZHANG N N, LAN W Q, HUANG X, et al.Effect of rosemary extract and ε-polylysine blend on the quality and moisture migration of large yellow croaker during ice storage[J].Food Science, 2019, 40(7):247-253.
[28] 胡斐斐, 钱书意, 李侠, 等.低压静电场辅助冷藏对牛肉品质的影响[J].食品科学, 2021, 42(1):132-138.
HU F F, QIAN S Y, LI X, et al.Effect of low voltage electrostatic field-assisted chilling storage on quality of beef[J].Food Science, 2021, 42(1):132-138.
[29] 阙婷婷, 郑家闻, 陈士国, 等.微冻保鲜与冻藏保鲜对乌鳢品质的影响[J].中国食品学报, 2015, 15(6):136-147.
QUE T T, ZHENG J W, CHEN S G, et al.Effect of super-chilling and frozen on the meat quality of snakehead[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(6):136-147.
[30] 周果, 崔燕, 杨文鸽, 等.冰温贮藏对梭子蟹品质影响及其货架期模型的建立[J].核农学报, 2017, 31(4):719-727.
ZHOU G, CUI Y, YANG W G, et al.Impact of controlled freezing-point storage on the Portunus trituberculatus quality and model construction of its shelf-life[J].Journal of Nuclear Agricultural Sciences, 2017, 31(4):719-727.