芦笋(Asparagus officinalis L.)学名石刁柏,又名龙须菜、文山竹、细白叶等,属天门冬属雌雄异株草本植物,距今已有2 000多年的栽培历史,原产地位于地中海沿岸和小亚细亚一带,20世纪由欧洲传入中国,现今我国已成为世界上最大的芦笋种植国[1]。芦笋是一种质地优良、营养健康的保健型蔬菜,富含膳食纤维、维生素、矿物质及酚类物质,其中所含有的槲皮素、芦丁、黄酮等生物活性成分具有抗氧化、抗肿瘤、调节免疫力及改善睡眠等多种生理功能,在国际上享有“蔬菜之王”的美称,深受消费者的青睐[2]。KOBUS-CISOWSKA等[3]研究表明,芦笋中所含的酚类物质可有效清除人体中DPPH自由基、·OH、ABTS阳离子自由基及·O2-,是优质的天然抗氧化剂来源。MAKRIS等[4]研究表明,芦笋可有效阻止肿瘤的增殖,对子宫癌、肝癌等疾病具有特殊疗效,抗癌率可达到32.4%。
鲜芦笋虽营养美味,但其在储藏过程中容易发生失水和木质化甚至腐烂。传统的加工方式通常将绿芦笋加工成罐头或速冻食品,而对绿芦笋进行干燥加工工艺的研究仅有少数[5]。为进一步推动芦笋干燥产品的研发,前人从不同角度对芦笋进行干燥产品工艺优化的研究。周驰[6]研究表明,真空冷冻干燥对芦笋粉功能成分及色泽品质影响最小,但其大批量生产的耗费成本较高。YU [7]研究表明,微波和热风联合干燥有利于芦笋皂苷中的原薯蓣皂苷和薯蓣皂苷发生脱糖基作用,可增强抗酪氨酸酶的能力。李文香 [8]研究发现,芦笋粉的添加可提高面条的色泽品质和营养价值,其富含的膳食纤维可改善面条持水性、吸水膨胀性等加工性能。由此可见,干燥处理不仅能延长芦笋的货架期,同时还能赋予其加工形式的多样化。但是芦笋在加工过程中容易发生酶促褐变或氧化反应而导致组织褐变或褪色[9],因此常添加抗坏血酸、半胱氨酸等护色剂,护色剂可通过自身氧化消耗氧气或抑制氧化酶的活性而终止褐变反应的发生。但由于护色剂种类、护色方式的不同,所达到的护色效果也不尽相同。因此,为提高芦笋干燥产品的品质,本研究采用不同的护色剂及浸泡、喷涂2种护色方式对芦笋进行处理,以改善芦笋粉在干燥过程中出现的褐变问题。
鲜芦笋(绿色品种),森林鲜语生鲜专营店。使用3种护色剂对鲜芦笋进行喷涂、浸泡处理,以未护色处理为对照。护色处理:鲜芦笋斜切成1 cm厚的薄片,将护色剂均匀喷涂至其表面(喷涂)或将其于护色剂浸泡30 min(浸泡),沥干水分于45 ℃烘箱中干燥至水分含量8%以下,粉碎过60目筛,于4 ℃下储藏备用。为保证食品安全,故对护色剂3浸泡、喷洒处理的芦笋粉的苯甲酸钠残留量进行测定,结果表明由护色剂3浸泡、喷涂处理的芦笋粉苯甲酸钠残留量分别为0.02、0.03 g/kg,符合GB 2760—2014《食品安全国家标准 食品添加剂使用标准》规定使用量(0.2~1.0 g/kg)。
护色剂1:将Na2CO3溶解至去离子水中,至最终含量为10 g/L;护色剂2:将抗坏血酸、半胱氨酸、柠檬酸溶解至去离子水中,至最终含量分别为3、1.5和1 g/L。护色剂3:将苯甲酸钠、抗坏血酸、Na2SO3溶解至去离子水中,至最终含量分别为1、5和1 g/L。
硫酸、盐酸、无水乙醇、二硝基水杨酸、NaOH、Na2CO3、2,4,6-三(2-吡啶基)三嗪[2,4,6-tri(2-pyridyl)-s-triazine, TPTZ]、水溶性维生素E(Trolox)等,均为分析纯;芦丁、甲醇、乙腈、乙酸, 均为色谱纯,国药集团化学试剂有限公司。
TE214S 电子分析天平,赛多利斯科学仪器(北京)有限公司;TGL-24MC 台式高速冷冻离心机,长沙平凡仪器仪表有限公司;SHB-III循环水式真空泵,郑州长城仪器有限公司;K9840自动凯氏定氮仪,海能仪器有限公司;SX2-4-10 NP箱式电阻炉,上海一恒科学仪器有限公司;GZX-9240 MBE电热鼓风干燥箱,上海博迅实业有限公司医疗设备厂;F30400209 磁力搅拌振荡箱,VELP试剂有限公司;722 N可见分光光度计,上海仪电仪器有限公司;e2695 高效液相色谱仪,沃特世科技有限公司。
1.3.1 基本成分测定
不可溶性膳食纤维(insoluble dietary fiber,IDF)、可溶性膳食纤维(soluble dietary fiber,SDF)参照国标方法GB 5009.88—2014《食品安全国家标准 食品中膳食纤维的测定》测定。
1.3.2 化学成分测定
1.3.2.1 总酚含量测定
采用Folin-Ciocalteu法测定[10]。以没食子酸为标准品,制作标准曲线:y=0.009 6x+0.024,R2=0.999 0。式中y为吸光度光度值,x为没食子酸质量浓度(mg/L)。称取1 g样品与25 mL体积分数60%乙醇于50 mL离心管中充分混匀,于50 ℃下超声波(45 kHz)提取1 h,提取液于 8 000 r/min下离心10 min,得上清液。取1 mL上清液,加入5 mL体积分数10%的福林酚试剂,静置反应5 min,再加入4 mL 75 g/L Na2CO3溶液,充分混匀,于室温下避光反应30 min,于760 nm处测定吸光度,再依据标准曲线计算得总酚含量(mg GAE/g DW)。
1.3.2.2 黄酮含量测定
采用硝酸铝显色法测定[11]。以芦丁作为标准品,制作标准曲线:y=4.577 6x-0.003 3,R2=0.999 2。式中,y为吸光度光度值,x为芦丁质量浓度(mg/L)。称取1 g样品与25 mL体积分数60%乙醇于50 mL离心管中充分混匀,于50 ℃下超声波(45 kHz)提取1 h,提取液于8 000 r/min下离心10 min,得上清液。取1 mL上清液于25 mL刻度试管中,加入6 mL 50 g/L NaNO2溶液,摇匀静置6 min,再加入1 mL 100 g/L Al(NO3)3溶液,摇匀静置6 min,加入4 mL 1 mol/L NaOH溶液,后以去离子水稀释至刻度线,静置15 min后于510 nm处测定吸光度。根据芦丁标准曲线换算出总黄酮含量 (mg RE/100 g DW)。
1.3.2.3 芦丁含量测定
采用HPLC测定[12]。以芦丁为标准品,制作标准曲线:y=1.774 8x-0.046 7,R2=0.998 8。式中,y为吸光度光度值,x为芦丁质量浓度(mg/L)。称取1 g样品与15 mL的4 ℃酸化甲醇溶液(体积分数95%甲醇∶1 mol/L HCl=85∶15,体积比)混匀,4 ℃振荡提取10 min,10 000 r/min离心10 min,取上清液,重复提取3次,合并上清液氮吹至无水状态。以10 mL体积分数80%甲醇溶液溶解,采用0.22 μm有机滤膜过滤后装入棕色样品瓶中,-20 ℃储藏备用。
HPLC标准品制备:将芦丁标准品溶于体积分数80%甲醇,配制质量浓度1 mg/mL的标准品母液,基于母液分别配制0.1、0.2、0.4、0.6、0.8、1 mg/mL的工作液。按照HPLC检测条件测定不同浓度条件下标准品滞留时间、色谱峰及吸光度,构建芦丁浓度与吸光度的标准曲线。
HPLC检测条件:色谱柱:WAT054275 SB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相A(体积分数0.2%乙酸)和流动相B(乙腈),梯度洗脱条件:0~30 min(A:体积分数95%~75%),30~50 min(A:体积分数60%),50~60 min(A:体积分数95%),后运行5 min,流速1 mL/min,柱温30 ℃;进样量10 μL;检测波长:280和360 nm。重复3次。
1.3.3 物化特性测定
1.3.3.1 持水性测定
称取一定量样品,按料液比1∶20(g∶mL)加入去离子水,室温条件下搅拌30 min后,2 500 r/min离心10 min,弃上清液,沉淀称质量[13],持水性按公式(1)计算:
持水性![]()
(1)
式中:m1,吸水前样品质量,g;m2,吸水后样品质量,g。
1.3.3.2 持油性测定
称取一定量样品,按料液比1∶10(g∶mL)加入大豆油,充分混匀,室温条件下放置1 h,1 500 r/min离心10 min,残渣称质量[13],持油性按公式(2)计算:
持油性![]()
(2)
式中:m1,吸油前样品质量,g;m2,吸油后样品质量,g。
1.3.3.3 吸水膨胀性测定
称取一定量样品,置于带刻度试管中,按料液比1∶10(g∶mL)加入去离子水,充分混匀后于4 ℃下放置24 h,记录体积[13],吸水膨胀性按公式(3)计算:
吸水膨胀性![]()
(3)
式中:V1,吸水膨胀前的体积,mL;V2,吸水膨胀后的体积,mL;m1,样品质量,g。
1.3.3.4 胆固醇吸附能力测定
参照蔡沙等[13]的方法测定。以胆固醇为标准品,制作标准曲线:y=0.106x-0.115 9,R2=0.999 0。式中,y为吸光度光度值,x为胆固醇质量浓度(mg/L)。取市售鲜鸡蛋蛋黄,加入9倍体积去离子水充分搅打成乳液,测定并记录乳液中的胆固醇含量。称取一定量样品,以料液比1∶20(g∶mL)加入乳液搅拌均匀,调节pH值至7.0,室温振荡2 h,3 000 r/min离心20 min,取上清液稀释10倍,测定并记录上清液的胆固醇含量,样品胆固醇吸附能力按公式(4)计算:
胆固醇吸附能力![]()
(4)
式中:P1,乳液中的胆固醇含量,mg;P2,上清液中的胆固醇含量,mg;m1,样品质量,g。
1.3.3.5 葡萄糖吸附能力测定
参照王艳丽等[14]的方法,并稍作改进。称取0.5 g样品置于100 mL三角瓶中,加入25 mL 0.4 mol/L的葡萄糖溶液,37 ℃下振荡搅拌2 h,再以10 000 r/min离心20 min,取上清液,稀释一定倍数,以DNS法测定并记录上清液中的葡萄糖含量,记为实验组上清液的葡萄糖含量N1。以水溶液代替葡萄糖溶液作为空白组,同样条件下搅拌、离心,取上清液稀释一定倍数,测定并记录该上清液中的葡萄糖含量,记为空白组上清液葡萄糖含量N2。葡萄糖吸附能力按公式(5)、公式(6)计算:
校正后上清液葡萄糖含量/mmol=N1-N2
(5)
葡萄糖吸附能力![]()
(6)
式中:m1,样品质量,g;N1,实验组上清液的葡萄糖含量,mmol;N2,空白组上清液葡萄糖含量,mmol;n2,葡萄糖溶液中的葡萄糖含量,mmol;n3,校准后上清液的葡萄糖含量,mmol。
1.3.4 抗氧化能力测定
1.3.4.1 DPPH自由基清除率测定
参照陈蓬凤等[15]的方法测定。称取2 mL样品提取液于10 mL比色管中,加入2 mL DPPH乙醇溶液(0.2 mmol/L,避光4 ℃保存,现用现配)混匀,室温避光静置30 min,以乙醇为空白调零,517 nm波长处测定吸光度A1,同时测定2 mL样品提取液与2 mL无水乙醇混合液的吸光度A2,2 mL DPPH乙醇溶液的吸光度A0,以维生素C(VC)作为抗氧化能力参考标准,根据样品清除率代入VC标准曲线换算出DPPH自由基清除能力,表示为VC当量(mg VC/100g DW)。DPPH自由基清除率按照公式(7)计算:
清除率/%=[1-(A1-A2)/A0]×100
(7)
1.3.4.2 总还原能力的测定
参考TI等[16]的方法测定,并稍作修改。FRAP试剂由25 mL 300 mmol/L醋酸缓冲液(pH 3.6)、2.5 mL 20 mmol/L FeCl3·6H2O 溶液和2.5 mL TPTZ溶液(10 mmol/L TPTZ 溶解于40 mmol/L HCl溶液中)组成,37 ℃预热后使用。将0.09 mL适当稀释后的提取物或标准品与2.0 mL FRAP 试剂混匀,室温下避光30 min,在515 nm处测定吸光度,甲醇溶液作为空白对照,用Trolox绘制标准曲线。结果以每100 g干重样品(mg Trolox/100 g DW)所对应的Trolox当量表示。
1.3.4.3 ·OH清除能力测定
参照陈蓬凤等[15]的方法测定。取10 mL比色管,依次加入1 mL 10 mmol/L的FeSO4、1 mL 10 mmol/L水杨酸,再加入1 mL样品提取液,最后加入1 mL 8.8 mmol/L的H2O2,37 ℃下水浴反应30 min,以去离子水作参比,在波长510 nm处测定吸光度,并同时做不加显色剂的样品空白;以同样的方法测定维生素C的·OH清除能力,表示为维生素C当量(mg VC/g DW)。·OH清除率按公式(8)计算:
清除率/%=[1-(Ai-Aj)/A0]×100
(8)
式中:A0,蒸馏水代替样品的空白对照吸光度;Ai,样品溶液反应后的吸光度值;Aj,不加H2O2的样品溶液与无水乙醇混合后的吸光度值。
1.3.4.4 ·O2-清除率
参照陈蓬凤等[15]的方法测定。取10 mL比色管,依次加入4.5 mL 50 mmol/L Tris-HCl溶液(pH 8.2)、0.2 mL 5 mmol/L邻苯三酚溶液、1 mL 样品提取液、2.5 mL去离子水,迅速摇匀,每隔30 s在325 nm处测定一次吸光度,测得5 min内的吸光度,计算v样。以Tris-HCl溶液调零,去离子水代替样品作做空白对照,测得5 min内的吸光度,计算![]() 清除率按公式(9)计算:
清除率按公式(9)计算:
清除率/%=(v0-v样)/v0×100
(9)
式中:v0,邻苯三酚自身氧化30 s的吸光度值拟合直线取其斜率所得自身氧化速率;v样,邻苯三酚与样品溶液混合反应液每30 s的吸光值拟合直线取其斜率所得的氧化速率。
1.3.5 α-淀粉酶活性抑制率测定
参照汤陈鹏等[1]的方法测定,稍作修改。取0.5 mL样品溶液,以PBS(pH 6.8)定容至1 mL,加0.5 mL α-淀粉酶溶液,摇匀后37 ℃水浴10 min,再加0.25 mL 5 g/L可溶性淀粉溶液,37 ℃下水浴10 min,加入2 mL DNS溶液,置于沸水浴5 min,待冷却后于540 nm下测得吸光值。以不加淀粉酶作空白调零,PBS代替样品对照。
1.3.6 色度值测定
利用色差仪测定样品的3个色值。L*为色彩的明度,L*=0为黑色,L*=50为灰色,L*=100为白色。a*和b*为色彩的颜色值,a*表示红绿(a*=0为灰色),正值越大表示越偏红,负值绝对值越大表示越偏绿;b*表示表示黄蓝(b*=0为灰色),正值越大表示越偏黄,负值绝对值越大表示越偏蓝[18]。
采用WPS office对数据进行整理,SPSS 25进行差异性分析,Origin 9.1绘图,结果以平均值±标准差表示,小写字母不同表示样品间存在显著性差异(P<0.05)。
从表1可知,芦笋粉的总酚、黄酮、芦丁、IDF及SDF分别介于6.08~6.43 mg GAE/g DW、249.53~297.14 mg RE/100 g DW、39.03~134.28 mg RE/100 g DW、62.35~63.85 g/100 g及11.93~12.82 g/100 g之间。结果显示,浸泡的护色效果优于喷涂,而喷涂优于不护色。其中,经护色剂3浸泡芦笋粉的总酚、黄酮含量最高,分别为6.43 mg GAE/g DW、297.14 mg RE/100 g DW,经护色剂2浸泡芦笋粉的芦丁含量最高,为134.28 mg RE/100 g DW,而未经护色的芦笋粉的总酚、黄酮及芦丁含量最低,分别为6.08 mg GAE/g DW、249.53 mg RE/100 g DW及39.03 mg RE/100 g DW。尹培培[19]研究表明,以绿芦笋粉的总酚、黄酮含量分别达6.76 mg、2.31 mg RE/g DW。姚红娟[20]研究表明,经甲醇提取法所测得的芦笋白秸秆粉末的芦丁含量达2.49 mg RE/g DW,并表明芦笋秸秆中的膳食纤维组成,以IDF为主。
表1 芦笋粉成分分析(干重)
Table 1 Composition analysis of asparagus powder(dry weight)

组别总酚(mg GAE/g DW)黄酮(mg RE/100 g DW) 芦丁(mg RE/100 g DW)IDF(g/100 g)SDF(g/100 g)对照6.08±0.03g249.53±0.04d39.03±0.18g62.70±0.05e12.52±0.09c护色剂1-浸泡6.13±0.04c268.76±0.16b83.98±0.38e63.13±0.56c12.49±0.54d护色剂1-喷涂6.10±0.03f263.27±0.0559.34±0.27f62.35±0.71g12.82±0.71a护色剂2-浸泡6.21±0.04b295.31±0.00c134.28±0.61a62.73±0.26d12.80±0.89b护色剂2-喷涂6.17±0.01d271.50±0.13f128.66±0.58b62.57±0.38f11.96±0.54e护色剂3-浸泡6.43±0.00a297.14±0.05a113.29±0.51c63.77±0.07b12.52±0.61c护色剂3-喷涂6.22±0.00e279.74±0.12e100.68±0.45d 63.85±0.08a11.93±0.10f
注:同一列内不同字母差异性显著(P<0.05)
从表2可以看出,芦笋粉的持水性、持油性、吸水膨胀性、葡萄糖吸附能力及胆固醇吸附能力分别介于4.07~4.53 g/g、2.32~2.50 g/g、4.29~4.55 mL/g、0.44~0.65 mmol/g及10.30~11.26 mg/g。其中,经护色剂3喷涂芦笋粉的持水性、持油性及吸水膨胀性含量最高,分别为4.53 g/g、2.50 g/g、4.55 mL/g。蔡沙等[13]研究马铃薯膳食纤维物化特性时指出,持水性、持油性及吸水膨胀性是评价不溶性膳食纤维的重要指标,而成分分析也表明经护色剂3浸泡的芦笋粉IDF含量最高。芦笋粉的葡萄糖吸附能力及胆固醇吸附能力之间相差不大,其中经护色剂1喷涂与护色剂3浸泡芦笋粉的葡萄糖吸附能力最佳,均为0.65 mmol/g,经护色剂2-喷涂处理芦笋粉的胆固醇吸附能力最佳,为11.26 mg/g,而未经护色的芦笋粉胆固醇吸附能力最差。刘静娜等[21]研究表明,SDF较IDF的胆固醇吸附能力好,其中SDF的胆固醇吸附能力为19.80 mg/g,而IDF的胆固醇吸附能力为12.70 mg/g。
表2 芦笋粉物化特性分析
Table 2 Analysis of physicochemical characteristics of asparagus powder
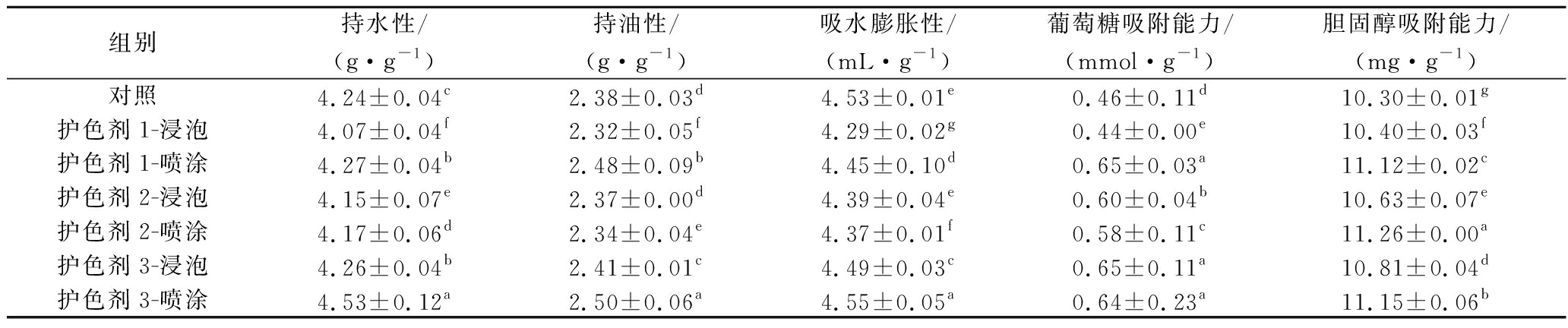
组别持水性/(g·g-1)持油性/(g·g-1)吸水膨胀性/(mL·g-1)葡萄糖吸附能力/(mmol·g-1)胆固醇吸附能力/(mg·g-1)对照4.24±0.04c2.38±0.03d4.53±0.01e0.46±0.11d10.30±0.01g护色剂1-浸泡4.07±0.04f2.32±0.05f4.29±0.02g0.44±0.00e10.40±0.03f护色剂1-喷涂4.27±0.04b2.48±0.09b4.45±0.10d0.65±0.03a11.12±0.02c护色剂2-浸泡4.15±0.07e2.37±0.00d4.39±0.04e0.60±0.04b10.63±0.07e护色剂2-喷涂4.17±0.06d2.34±0.04e4.37±0.01f0.58±0.11c11.26±0.00a护色剂3-浸泡4.26±0.04b2.41±0.01c4.49±0.03c0.65±0.11a10.81±0.04d护色剂3-喷涂4.53±0.12a2.50±0.06a4.55±0.05a0.64±0.23a11.15±0.06b
2.3.1 芦笋粉DPPH自由基清除能力分析
从图1可以看出,芦笋粉的DPPH自由基清除能力介于52.31~85.24 mg VC/100 g DW。陈月[22]研究发现,酚类物质的含量与其抗氧化活性存在正相关,良好的抗氧化活性可在一定时间内延缓食品褐变的速率,而护色剂可通过耗氧或抑制氧化酶活性的方式而达到护色的效果,结果也呈现了相同的趋势,经护色处理的芦笋粉相较于未护色处理的抗氧化活性更好。其中,经护色剂3浸泡芦笋粉的DPPH自由基清除能力最佳,达85.24 mg VC/100 g DW,而未经护色的芦笋粉清除能力最低,为52.31 mg VC/100 g DW。此外,同一种护色剂的DPPH自由基清除能力可随着护色方式的不同而发生改变,其中经护色剂浸泡的芦笋粉DPPH自由基清除能力优于喷涂及不护色。

图1 芦笋粉DPPH自由基清除能力
Fig.1 DPPH scavenging capacity of asparagus powder
注:不同小写字母代表差异显著(P<0.05)(下同)
2.3.2 芦笋粉总还原能力分析
从图2可以看出,芦笋粉的总还原能力介于150.61~189.87 mg Trolox/100 g DW。其中,经护色剂1、护色剂2及护色剂3浸泡芦笋粉的总还原力分别为183.50、185.42、189.87 mg Trolox/100 g DW,经喷涂芦笋粉的总还原力分别为180.26、181.12、181.63 mg Trolox/100 g DW,而未经护色芦笋粉的总还原力为156.61 mg Trolox/100 g DW。结果显示最佳的护色方式依次为浸泡>喷涂>不护色,而最佳的护色剂依次为护色剂3>护色剂2>护色剂1。杨晓宽等[23]研究表明,芦笋老茎秸秆粉末的总还原能力达到91.56%,具有抑制炎症、抗衰老、抗癌等潜力,有利于在高营养食品中得到广泛的应用。

图2 芦笋粉总还原能力
Fig.2 Total reducing capacity of asparagus powder
2.3.3 芦笋粉·OH清除能力分析
从图3可以看出,芦笋粉的·OH清除能力介于0.08~0.20 mg VC/g DW。其中,经护色剂1、护色剂2及护色剂3浸泡芦笋粉的·OH清除能力分别为0.16、0.18、0.20 mg VC/g DW,经喷涂芦笋粉的·OH清除能力分别为0.09、0.11、0.14 mg VC/g DW,而未经护色芦笋粉的·OH清除能力为0.08 mg VC/g DW。结果显示最佳的护色方式依次为浸泡>喷涂>不护色,而最佳的护色剂依次为护色剂3>护色剂2>护色剂1。ZHANG等[24]研究表明,芦笋的·OH清除能力随芦笋黄酮浓度升高而增强,当芦笋黄酮质量浓度达到100 μg/mL时,·OH清除率可达到48.06%。
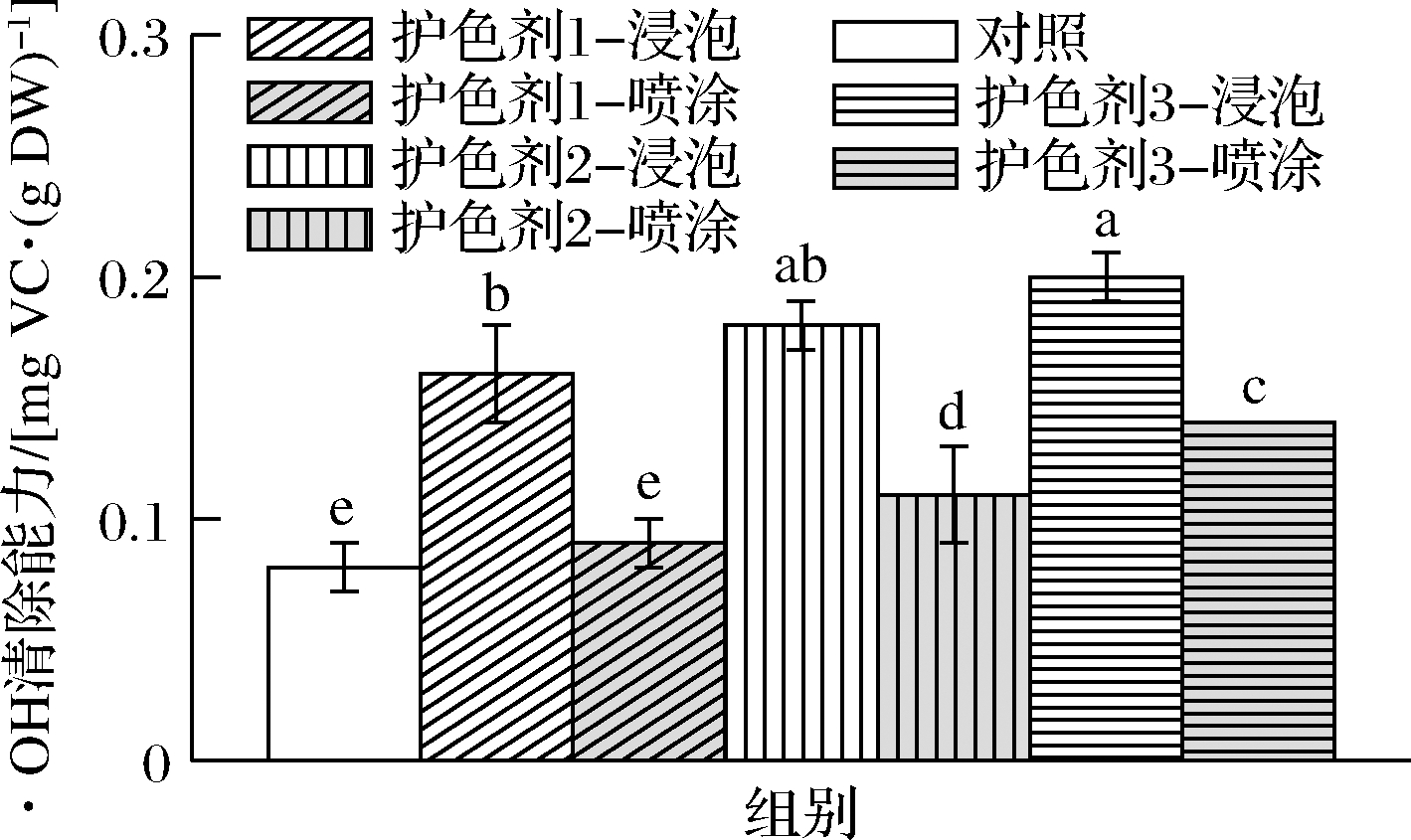
图3 芦笋粉·OH清除能力
Fig.3 ·OH scavenging capacity of asparagus powder
2.3.4 芦笋粉·O2-清除率分析
由图4可知,不同护色处理条件下的芦笋粉·O2-清除率分别介于72.77%~87.28%。其中,经护色剂1、护色剂2及护色剂3浸泡芦笋粉的·O2-清除率分别为82.02%、84.65%及87.28%,经喷涂芦笋粉的·O2-清除率分别为76.75%、77.66%及79.39%,而未经护色芦笋粉的·O2-清除率为72.77%。结果显示最佳的护色方式依次为浸泡>喷涂>不护色,而最佳的护色剂依次为护色剂3>护色剂2>护色剂1。贾毅伟等[1]研究表明,芦笋中的黄酮类化合物在低质量浓度范围内,对·O2-的清除能力远优于维生素C,当二者质量浓度均为0.08 mg/mL时,芦笋黄酮的·O2-清除能力可达到99.27%,而维生素C清除率为66.00%。

图4 芦笋粉·O2-清除率
Fig.4 Superoxide radical scavenging rate of asparagus powder
从图5可以看出,当芦笋粉中酚类物质提取物质量浓度为0.02 ~0.10 mg/mL时,α-淀粉酶活性抑制率介于6.24%~46.62%。不同护色处理条件下芦笋粉α-淀粉酶活性抑制率最高的护色剂依次为护色剂3>护色剂2>护色剂1,所采用的护色方式均为浸泡,α-淀粉酶活性抑制率分别为46.62%、41.67%及40.6%,而在不进行护色情况下α-淀粉酶活性抑制率最低,仅有38.87%。秦昱等[25]研究表明,酚类物质中的没食子酸对α-淀粉酶活性具有抑制作用,抑制率随着添加量的加大而增大,其对α-淀粉酶的IC50值为3.01 mg/mL。

图5 芦笋粉α-淀粉酶活性抑制率
Fig.5 α-inhibition rate of asparagus powder on amylase activity
从表3可以看出,不同护色处理条件下芦笋粉的L*值、a*值及b*值分别介于82.34~84.46、3.10~3.95及18.38~20.35。其中,对照组的L*值最高,a*值和b*值最低,分别为84.46、3.10、18.38,而经护色剂3浸泡的芦笋粉L*亮度最低,a*值和b*最高,分别为82.34、3.95、20.35,表明经过护色的芦笋粉颜色更深,但明亮度有所降低。刘娟汝等[26]研究表明,色泽的L*值与a*值、b*值呈负相关,当色泽颜色加深,明亮度也会随之降低。
表3 芦笋粉色度值
Table 3 Color indexes of asparagus powder

组别L*a*b*对照84.46±0.11b3.10±0.03g18.38±0.35f护色剂1-浸泡83.24±0.28f3.85±0.06c19.31±0.18c护色剂1-喷涂84.48±0.16a3.83±0.05c17.94±0.07h护色剂2-浸泡83.38±0.16e3.84±0.05c19.77±0.07b护色剂2-喷涂84.39±0.29c3.93±0.04b18.44±0.20e护色剂3-浸泡82.34±0.21g3.95±0.04a20.35±0.10a护色剂3-喷涂84.34±0.35d3.62±0.04e18.83±0.08d
注:同一列内不同字母差异性显著(P<0.05)
WANG等[27]研究表明,食物中的酚类物质与抗氧化活性及色泽度具有密切的关系,DPPH自由基清除能力和还原能力的变化趋势与色泽颜色参数相似,并且总多酚、总黄酮与抗氧化活性之间显现出极显著的正相关性,表明护色处理不仅可以提高芦笋粉的色泽品质,对芦笋生物活性成分也具有较好的保留效果。
为改善芦笋粉在热风干燥过程中出现的褐变问题,进一步推动芦笋干燥产品的研发,本文以不同护色剂对芦笋进行浸泡、喷涂护色处理。结果表明,最佳的护色剂依次为护色剂3>护色剂2>护色剂1,最佳的护色方式依次为浸泡>喷涂>不护色。与未经护色的芦笋粉相比,经过护色的芦笋粉酚类物质含量及抗氧化活性更高,色泽品质也更佳。不同护色方式条件下芦笋粉的总酚、黄酮、芦丁、IDF及SDF含量分别介于6.08~6.43 mg GAE/g DW、249.53~297.14 mg RE/100 g DW、39.02~134.28 mg RE/100 g DW、62.35~63.85 g/100 g及11.93~12.82 g/100 g。芦笋粉酚类提取物的总还原力及其对DPPH自由基、·OH自由基、·O2-、α-淀粉酶活性剂的清除抑制能力分别介于150.61~189.87 mg Trolox/100 g DW、52.31~85.24 mg VC/100 g DW、0.08~0.20 mg VC/g DW、72.77%~87.28%、6.24%~46.62%。其中经护色剂3浸泡处理的芦笋粉总酚、黄酮含量最高,分别为6.43 mg GAE/g DW、297.14 mg RE/100 g DW,且具有良好的抗氧化能力。芦笋粉持水性、持油性、吸水膨胀性、葡萄糖吸附能力及胆固醇吸附能力分别介于4.07~4.53 mg/g、2.32~2.50 g/g、4.29~4.55 ml/g、0.44~0.65 mmol/g及10.30~11.26 mg/g,加工性能良好。
[1] 贾毅伟, 张家荣, 陈果, 等. 芦笋老茎中总黄酮的提取及其抗氧化性能[J]. 南昌大学学报(工科版), 2020, 42(2):144-148; 193.
JIA Y W, ZHANG J R, CHEN G, et al. Extraction and anti-oxidation property of total flavonoids from old stems of asparagus[J]. Journal of Nanchang University (Engineering &Technology), 2020, 42(2):144-148; 193.
[2] 董孝元, 方冬芬, 杨梅, 等. 纤维素酶辅助提取芦笋黄酮及其抗氧化活性分析[J]. 食品科学, 2014, 35(6):17-23.
DONG X Y, FANG D F, YANG M, et al. Extraction and antioxidant activity of Asparagus flavonoids[J]. Food Science, 2014, 35(6):17-23.
[3] KOBUS-CISOWSKA J, SZYMANOWSKA D, SZCZEPANIAK O M, et al. Composition of polyphenols of asparagus spears (Asparagus officinalis) and their antioxidant potential[J]. Ciência Rural, 2019, 49(4): 1-13.
[4] MAKRIS D P, ROSSITER J T. Domestic processing of onion bulbs (Allium cepa) and asparagus spears (Asparagus officinalis): Effect on flavonol content and antioxidant status[J]. Journal of Agricultural and Food Chemistry, 2001, 49(7):3 216-3 222.
[5] 朱蕴兰, 陈宏伟, 陈安徽, 等. 不同干燥方式对芦笋营养与品质特性的影响[J]. 北方园艺, 2018(1):129-134.
ZHU Y L, CHEN H W, CHEN A H, et al. Effects of different drying methods on nutrition and physical properties of Asparagus officinalis[J]. Northern Horticulture, 2018(1):129-134.
[6] 周驰. 芦笋粉加工关键技术及应用研究[D]. 泰安: 山东农业大学, 2015.
ZHOU C. Key processing technology and application of asparagus powder[D]. Tai’an: Shandong Agricultural University, 2015.
[7] YU Q, DUAN J J, YU N, et al. Enhancing the antityrosinase activity of saponins and polyphenols from asparagus by hot air coupled with microwave treatments[J]. LWT, 2020, 124:109174.
[8] 李文香, 王丽娇, 刘锦涛, 等. 一种高膳食纤维绿芦笋超微全粉面包及其制作方法: CN103229795A[P]. 2013-08-07.
LI W X, WANG L J, LIU J T, et al. The invention relates to a high dietary fiber green asparagus superfine whole powder bread and a preparation method thereof: CN103229795A[P]. 2013-08-07.
[9] 杨强. 芦笋中多酚氧化酶(PPO)酶学特性研究[J]. 科技创新与应用, 2013(23):51.
YANG Q. Study on enzymatic characteristics of polyphenol oxidase (PPO) in asparagus[J]. Technology Innovation and Application, 2013(23):51.
[10] 杜俊娜, 陈书霞, 程智慧, 等. 响应曲面法优化大蒜中总酚提取工艺及其抗氧化活性测定[J]. 食品科学, 2012, 33(10):72-77.
DU J N, CHEN S X, CHENG Z H, et al. Response surface methodology for optimization of extraction conditions of total phenolic compounds from garlic and determination of antioxidant activity[J]. Food Science, 2012, 33(10):72-77.
[11] 杨永涛. 罗布麻总黄酮的提取、分离纯化及其抗氧化性能研究[D]. 广州: 华南理工大学, 2018.
YANG Y T. Study on extraction, purification and antioxidant activity of total flavonoids from Apocynum venetum[D]. Guangzhou: South China University of Technology, 2018.
[12] 殷丛培,吴盟,王志博,等.高粱籽粒中9种黄酮类化合物的积累特性分析[J].中国粮油学报, 2022, 37(12):76-83.
YIN C P, WU M, WANG Z B, et al. Analysis on accumulation characteristics of nine flavonoids in sorghum grains [J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(12):76-83.
[13] 蔡沙, 隋勇, 施建斌, 等. 马铃薯膳食纤维物化特性分析及其对马铃薯热干面品质的影响[J]. 食品科学, 2019, 40(4):87-94.
CAI S, SUI Y, SHI J B, et al. Physicochemical properties of potato dietary fiber and its influence on the quality of hot dry noodles made from potato starch[J]. Food Science, 2019, 40(4):87-94.
[14] 王艳丽, 刘凌, 孙慧, 等. 膳食纤维的微观结构及功能特性研究[J]. 中国食品添加剂, 2014(2):98-103.
WANG Y L, LIU L, SUN H, et al. The study on microstructure and functional property of diet fiber[J]. China Food Additives, 2014(2):98-103.
[15] 陈蓬凤, 梅新, 黄师荣, 等. 不同品种薯尖的总酚、总黄酮含量及抗氧化活性比较[J]. 现代食品科技, 2021, 37(3):132-138; 15.
CHEN P F, MEI X, HUANG S R, et al. Comparison of the total phenolics, total flavonoids and antioxidant activities in potato tips of different varieties[J]. Modern Food Science and Technology, 2021, 37(3):132-138; 15.
[16] TI H H, LI Q, ZHANG R F, et al. Free and bound phenolic profiles and antioxidant activity of milled fractions of different indica rice varieties cultivated in Southern China[J]. Food Chemistry, 2014, 159:166-174.
[17] 汤陈鹏, 吕峰, 王蓉琳. 孔石莼多糖锌结构表征与体外降血糖活性[J]. 食品科学, 2020, 41(7):52-58.
TANG C P, LYU F, WANG R L. Structural characterization and hypoglycemic activity in vitro of Ulva pertusa polysaccharides-zinc complex[J]. Food Science, 2020, 41(7):52-58.
[18] 张毅, TAWANDA MUZHINGI, 岳瑞雪, 等. 东非不同肉色甘薯的营养品质分析与综合评价[J]. 江苏师范大学学报(自然科学版), 2020, 38(2):42-47.
ZHANG Y, MUZHINGI T, YUE R X, et al. Nutritive quality analysis and comprehensive evaluation of sweetpotato with different flesh colors in East Africa[J]. Journal of Jiangsu Normal University (Natural Science Edition), 2020, 38(2):42-47.
[19] 尹培培, 刘昌衡, 赵鲁豫, 等. 芦笋膳食纤维及酚类物质的抗氧化活性[J]. 食品工业, 2019, 40(7):190-194.
YIN P P, LIU C H, ZHAO L Y, et al. Antioxidant activity of dietary fibers and phenolic compounds in asparagus[J]. The Food Industry, 2019, 40(7):190-194.
[20] 姚红娟. 芦笋茎秆中膳食纤维素及微晶纤维素提取工艺的研究[D]. 济南: 齐鲁工业大学, 2017.
YAO H J. The study on preparation process of dietary fiber and microcrystalline cellulose from asparagus stems[D]. Jinan: Qilu University of Technology, 2017.
[21] 刘静娜, 黄志娜, 吴丽萍. 芦笋膳食纤维的提取及其在面包中的应用[J]. 食品科技, 2010, 35(11):178-181; 185.
LIU J N, HUANG Z N, WU L P. Extraction of dietary fiber from asparagus and its appliance in the bread[J]. Food Science and Technology, 2010, 35(11):178-181; 185.
[22] 陈月. 体外模拟消化对苦荞酚类化合物生物利用率的影响[D].贵阳:贵州大学, 2021.
CHEN Y. Effect of simulated digestion in vitro on the bioavailability of tartary buckwheat phenols [D]. Guiyang: Guizhou University, 2021.
[23] 杨晓宽, 李汉臣, 张建才, 等. 芦笋膳食纤维品质分析及抗氧化性研究[J]. 中国食品学报, 2013, 13(10):205-212.
YANG X K, LI H C, ZHANG J C, et al. Quality analysis and antioxidant research of dietary fiber from asparagus[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(10):205-212.
[24] ZHANG H X, BIRCH J, PEI J J, et al. Phytochemical compounds and biological activity in Asparagus roots: A review[J]. International Journal of Food Science &Technology, 2019, 54(4):966-977.
[25] 秦昱, 邵元元, 熊硕, 等. 没食子酸对猪胰α-淀粉酶和蛋白酶的抑制作用[J]. 食品科学, 2015, 36(3):41-45.
QIN Y, SHAO Y Y, XIONG S, et al. Inhibitory effect of Gallic acid on pancreatic α-amylase and trypsin[J]. Food Science, 2015, 36(3):41-45.
[26] 刘娟汝,刘晓梅,刘雨诗,等. 基于色度分析原理的青黛有效成分含量与其色度值的相关性分析[J]. 中国实验方剂学杂志, 2019, 25(23):165-170.
LIU J R, LIU X M, LIU Y S, et al. Correlation analysis between the content of active ingredients of Indigo Naturalis and its chromaticity value based on the principle of chromaticity analysis [J]. Chinese Journal of Experimental Prescriptions, 2019, 25 (23): 165-170.
[27] WANG L L, QIN Y C, WANG Y B, et al. A pair of homoisoflavonoid analogues (6-aldehydo-isoophiopogonanone A/6-aldehydo-isoophiopogonanone B) from Ophiopogon japonicus as a tyrosinase inhibitor: Inhibitory activity, conformational change and mechanism[J]. European Food Research and Technology, 2022, 248(2):553-565.