甲醛是一种无色刺激性气体,通常易溶于水且有较高毒性,一般用作消毒剂和防腐剂[1]。甲醛属于Ⅰ类致癌物[2],长期接触可能会造成皮肤及消化系统疾病,严重的可能会引发休克、死亡。食品中不得使用甲醛作为添加剂,食品生产过程中也不得使用甲醛作为加工助剂[3]。GB 2757—2012《食品安全国家标准 蒸馏酒及其配制酒》中规定了啤酒中甲醛的最大残留限量为2.0 mg/L。除了啤酒,市场上常见的其他酒类如白酒、葡萄酒以及黄酒等在酿造以及生产过程中都可能产生甲醛[4-5]。但是,目前国标中对于葡萄酒、黄酒及白酒中甲醛的限量均未做要求,其中白酒属于蒸馏酒,酒精度数较高,目前没有这类产品中甲醛含量检测的国家标准。
甲醛含量测定主要采用光谱法[6-8]和色谱法[9-11]。国标中使用分光光度计测定啤酒中甲醛含量,其测定结果容易受到样品中其他物质(如SO2)的干扰,而且该方法灵敏度低,对于含量较低的样品定量分析可能不准确,造成结果偏差[12-13]。此外,该方法的使用范围主要为酒精含量较低的发酵酒和配制酒。白酒属于蒸馏酒且酒精含量较高,在加水降度过程中会出现白色浑浊,即失光现象,如果参考啤酒采用分光光度计进行甲醛检测,很可能造成检测结果不准确。色谱法虽定量较准确,但是样品基质干扰较大,需要保证色谱峰的分离度和纯度,一般分析时间较长,且对于痕量分析不够灵敏[10,14]。本研究以不同工艺且酒精含量不同的酒类作为检测目标,选取白酒、啤酒、葡萄酒以及黄酒为样本,以2,4-二硝基苯肼作衍生剂,在酸性条件下衍生样品中的甲醛生成稳定的衍生物后直接用超高效液相色谱质谱联用(ultra-performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)检测,外标法定量。通过优化前处理和检测条件,建立UPLC-MS/MS测定酒类中甲醛含量的方法,为相关部门对酒类中甲醛含量的检测提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
甲醛标准溶液(100 μg/mL),美国Accustandard公司。乙腈(色谱纯)、甲酸(优级纯),德国Merck有限公司。2, 4-二硝基苯肼、NaCl、乙酸钠、冰乙酸,均为分析纯,国药集团化学试剂有限公司。
样本:市售不同品牌啤酒10批(2批低酒精度2.2%vol~2.5%vol;8批中酒精度3.3%vol~4.5%vol);白酒10批(4批浓香型45%vol~53%vol;4批清香型42%vol~56%vol;2批老白干香型42%vol~67%vol);葡萄酒10批(8批红葡萄酒11%vol~13%vol,2批白葡萄酒11%vol~12%vol);黄酒5批(半干型8%vol~15%vol)。
1.2 仪器与设备
6460液相色谱-质谱联用仪、1290高效液相色谱仪,美国安捷伦科技有限公司;ME-204天平,瑞士梅特勒-托利多有限公司;移液器(量程:20~200 μL;50~1 000 μL)、5810R高速离心机,德国艾本德仪器有限公司;Vortex2涡旋混匀仪、KS4000i控温摇床,德国艾卡仪器设备有限公司。
1.3 实验方法
1.3.1 溶液配制
2,4-二硝基苯肼溶液配制:称取2,4-二硝基苯肼400 mg,用乙腈溶解定容至500 mL,避光保存,现配现用。
缓冲溶液配制:称取2.64 g乙酸钠,以适量超纯水溶解,加入1.0 mL冰乙酸,用水定容至500 mL。
1.3.2 样品制备
准确移取样品1.00 mL至50 mL离心管中,加入10 mL 2, 4-二硝基苯肼溶液和10 mL乙酸钠溶液,涡旋混匀。将其置于摇床60 ℃振摇40 min,摇床转速100 r/min。取出降至室温后转移至25 mL容量瓶中用乙腈定容,溶液经0.22 μm有机滤膜过滤后上机。其中啤酒样品取样前需超声去除泡沫,滤纸过滤,去除CO2。
1.3.3 标准溶液配制
甲醛使用液:将甲醛标准溶液用超纯水稀释至10 mg/L后转移至棕色瓶密封,0~5 ℃保存。
甲醛标准系列浓度溶液配制:准确移取质量浓度为10 mg/L的甲醛使用液0.00、0.10、0.20、0.30、0.40、0.50 mL于50 mL离心管中,再按照1.3.2操作步骤配制成质量浓度0、0.04、0.08、0.12、0.16、0.20 mg/L的标准系列溶液。
1.3.4 仪器检测条件
1.3.4.1 液相色谱条件
色谱柱:ACQUITY UPLC BEH C18 (2.1 mm×100 mm, 1.7 μm);流动相:A为0.1%的甲酸-乙腈,B为超纯水。等度洗脱:A(70%)-B(30%);流速0.3 mL/min;进样量1 μL;采集时间5 min。
1.3.4.2 质谱检测条件
采用电喷雾电离源(electrospray ionization, ESI)在负离子模式下进行多反应监测(multiple reaction monitoring, MRM)。质谱仪离子源条件参数见表1,目标化合物测定参数见表2。
表1 质谱仪离子源条件参数
Table 1 Condition parameters of ion source for mass spectrometer

仪器条件毛细管电压/kV干燥气温度/℃载气流速/(L·min-1)雾化压力/psi碰撞气流速/(mL·min-1)设定值33001115 0.15
表2 目标化合物质谱测定参数
Table 2 Determination parameters of target compound by mass spectrometer

化合物名称保留时间/min母离子(m/z)子离子(m/z)碎裂电压/V碰撞能量/eV甲醛-2,4-二硝基苯腙1.35520946*/76/12013520/10/20
1.4 计算公式
样品中甲醛含量计算如公式(1)所示:
(1)
式中:ρ,试样中甲醛的含量,mg/L;ρ′,由标准曲线得出试样中甲醛的含量,mg/L;V,定容体积,mL;v,取样量,mL。
1.5 数据处理
采用质谱仪数据处理软件MassHunter进行定性定量分析,使用Excel 2016软件、OriginPro 2016和SPSS软件对数据进行统计和分析。
2 结果与分析
2.1 前处理条件优化
2.1.1 溶剂选择
本实验使用2,4-二硝基苯肼为衍生试剂,其微溶于水和乙醇,因此采用乙腈作为溶剂配制衍生液。此外,乙腈黏度低、相对于醇类和酯类有较低的紫外吸收,色谱的基线背景低,可以减少对液相色谱分析的干扰,提高检测灵敏度。
2.1.2 衍生条件优化
样品中的甲醛与2,4-二硝基苯肼在酸性条件下会反应生成稳定的衍生物甲醛-2,4-二硝基苯腙,其衍生温度与衍生时间对生成的甲醛-2,4-二硝基苯腙含量影响较大。因此,需设计单因素试验以选取适宜温度和反应时间。衍生温度的选择:设定衍生时间为60 min,衍生温度从20 ℃间隔10 ℃递增至80 ℃,比较不同衍生温度下衍生物的峰面积,结果如图1-a所示。随着衍生温度的升高,目标物峰面积在60 ℃时到达峰值,其后衍生物峰面积逐渐减小,说明温度较低时衍生不充分,温度较高时衍生物可能会分解,则最适衍生温度选择60 ℃。衍生时间的选择:设定衍生温度为60 ℃,衍生时间从20 min间隔10 min递增至80 min,比较在不同衍生时间下测得衍生物的峰面积,结果如图1-b所示。在60 ℃衍生温度条件下,衍生物的峰面积随着在40 min时达到峰值,当衍生时间超过40 min时,衍生产物的峰面积逐渐下降,说明反应已经充分,最佳衍生时间为40 min。
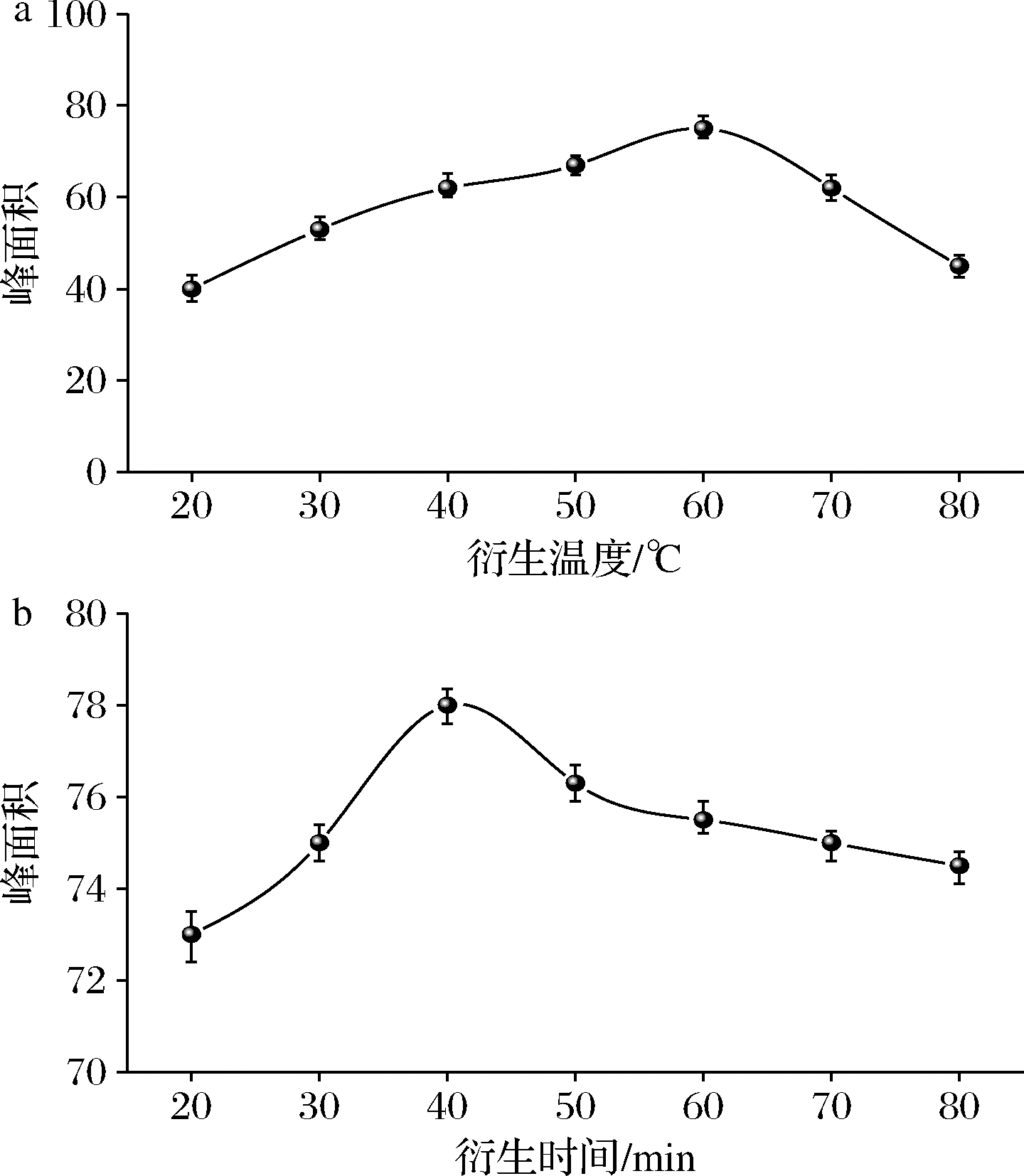
a-衍生温度;b-衍生时间
图1 不同衍生温度与衍生时间下样品中甲醛响应值
Fig.1 Formaldehyde response values at different derivatization temperatures and derivatization times
2.1.3 色谱条件优化
配制0.05 mg/L甲醛溶液,分别采用梯度洗脱和恒比例洗脱,流动相A为含0.1%甲酸的乙腈,流动相B为超纯水,梯度洗脱程序0~6 min,40%~80%A;6~6.5 min,80%~40%A;6.5~8 min,40%A。恒比例洗脱:70%A-30%B。分析比较色谱图,见图2和图3。可见恒比例洗脱时目标物的分离、保留和灵敏度较理想,而且恒比例洗脱系统稳定性较好,进样前不需要再对系统进行平衡,可以缩短分析时间,提高检测效率。因此选择采用恒比例洗脱:70%A-30%B。
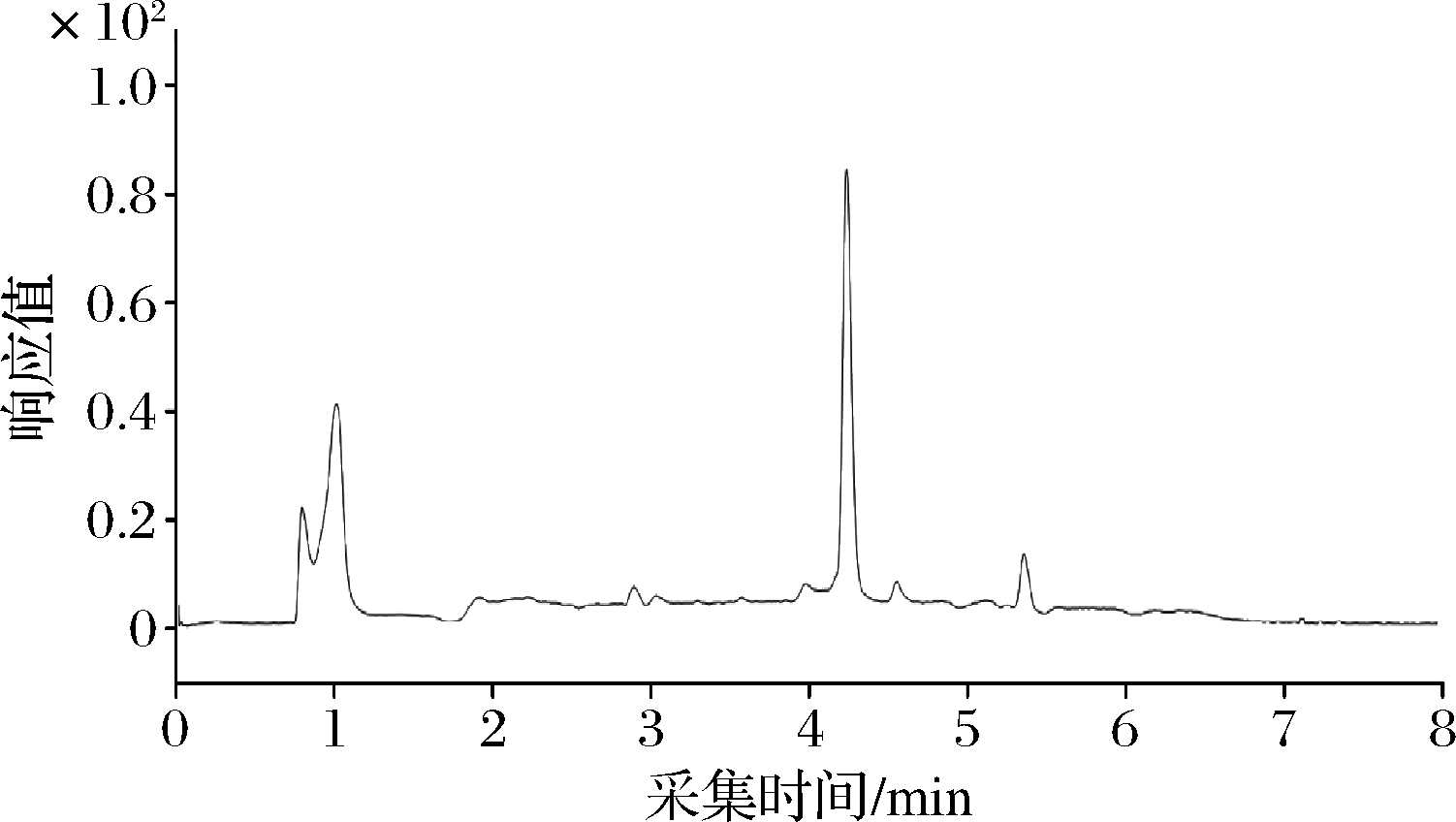
图2 梯度洗脱色谱图
Fig.2 Gradient elution chromatogram of target compound

图3 恒比例洗脱色谱图
Fig.3 Constant ratio elution chromatogram of target compound
2.1.4 质谱条件优化
在正负离子模式下进行一级扫描[15-16],目标物甲醛-2,4-二硝基苯腙在负离子模式下稳定性和响应度较好,选用[M-H]-离子(209 m/z)作为监测母离子,通过二级质谱扫描,比较并选取响应较强的3组离子作为子离子。在MRM模式下,对碰撞能等参数进行优化,参数见表2。优化后选取46 m/z、76 m/z、120 m/z作为子离子,3组子离子的响应强度见图4,其中46 m/z响应较高可作为定量离子,其他2组离子作为定性离子。

图4 三组子离子响应强度
Fig.4 The response intensity of three groups of product ions
2.2 方法学验证
2.2.1 线性范围
分别配制2套不同质量浓度范围的甲醛标准溶液。衍生后按照上述条件测定,以质量浓度对相应的响应值进行线性回归,得甲醛标准溶液的标准曲线、检测范围及相关系数(图5)。由图5可知,本方法测定甲醛在0~0.05 mg/L、0~0.2 mg/L范围内线性均良好,相关系数R2>0.999,说明在低浓度范围和高浓度范围都能够准确定量分析。
2.2.2 精密度试验
在离心管中添加125 μL甲醛标准使用液(10 mg/L),后按1.3.2制备样品。分别进样6次,计算精密度,结果见表3。实验结果表明,峰面积相对标准偏差(relative standard deviation,RSD)<2%,重现性较好,精密度能达到实验要求。

a-1号;b-2号
图5 1号和2号甲醛溶液标准曲线
Fig.5 Standard curves of No.1 and No.2 formaldehyde solution
表3 精密度实验结果
Table 3 Precision test results of target compound
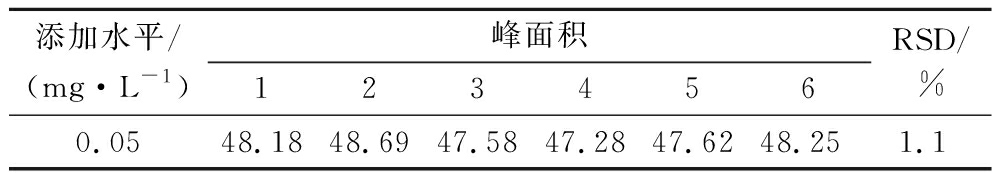
添加水平/(mg·L-1)峰面积123456RSD/%0.0548.1848.6947.5847.2847.6248.251.1
2.2.3 检出限和定量限试验
将0.05 mg/L甲醛衍生液逐步稀释,当稀释至质量浓度为0.002 mg/L时,峰高为基线噪声的3倍。将0.002 mg/L作为方法检出限,以3倍检出限作为定量限,则该方法的定量限为0.006 mg/L。该检出限明显低于色谱方法检出限[17],说明该方法检测灵敏度较高,适用于痕量分析。
2.2.4 回收率和精密度
取啤酒、白酒、葡萄酒和黄酒样品分别进行回收率试验,设定3组加标浓度,每个浓度水平重复3次,同时对空白样品进行测定,结果见表4。
表4 不同酒类中甲醛回收率试验结果
Table 4 Test results of recovery rate of formaldehyde in different alcohols

酒类甲醛含量/(mg·L-1)样品加入测得1次2次3次回收率/%1次2次3次回收率均值/%样品处理前后甲醛含量相关系数r(显著性)RSD/%啤酒0.230.1250.3590.3580.360103.10102.50103.800.6250.8370.8430.84297.0498.1297.981.2501.3801.3681.38192.0291.0192.0697.50.981(P<0.001)4.98白酒0.610.1250.7300.7280.72995.8094.5095.100.6251.2091.2131.22395.7896.4698.041.2501.7351.7521.75390.0291.3691.4494.30.999(P<0.001)2.71葡萄酒0.110.1250.2340.2350.23699.50100.30101.000.6250.7220.7130.72397.9296.5098.041.2501.2231.2401.24989.0290.3691.1296.00.999(P<0.001)4.58黄酒0.420.1250.5430.5420.54198.4097.5096.800.6251.0151.0221.02795.1296.2497.041.2501.5201.5001.51388.0286.3687.4493.70.998(P<0.001)4.89
由表4可知,4组样品平均回收率分别为97.5%、94.3%、96.0%、93.7%,回收率结果RSD为2.71%~4.98%,回收率较高且稳定,准确度符合测定要求。此外,对4组加标样品处理前后甲醛含量进行配对样本T检验,相关系数均大于0.9,且P值均小于0.001,呈现显著正相关。
2.3 样品测定
用优化后的检测方法对样品进行测定,检测结果见表5。
表5 市售酒类中甲醛检测结果
Table 5 Formaldehyde detection results of commercial alcohols
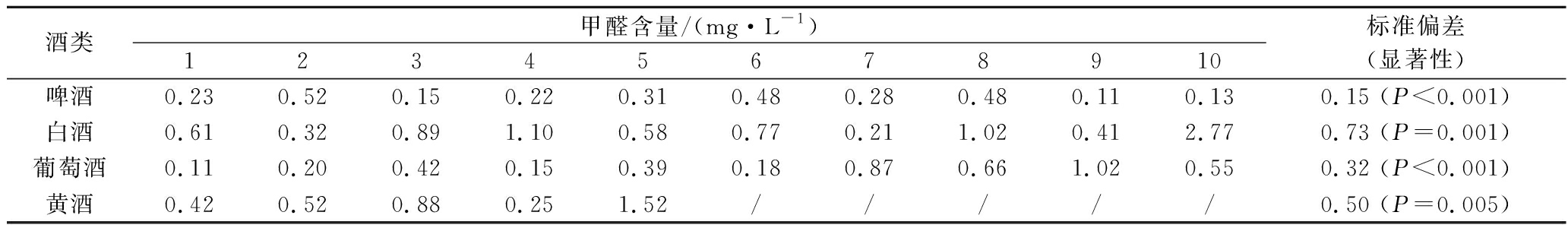
酒类甲醛含量/(mg·L-1)12345678910标准偏差(显著性)啤酒0.230.520.150.220.310.480.280.480.110.130.15 (P<0.001)白酒0.610.320.891.100.580.770.211.020.412.770.73 (P=0.001)葡萄酒0.110.200.420.150.390.180.870.661.020.550.32 (P<0.001)黄酒0.420.520.880.251.52/////0.50 (P=0.005)
由表5可知,不同品牌市售酒类中均含有甲醛。参考国家标准中啤酒甲醛残留量的限量值2.0 mg/L,35批样品中1批次白酒含量超过限值,色谱图见图6,样本整体与限量值比较差异性显著。
由于甲醛易溶于水和醇,广泛存在于酒精饮品中,但一般含量很低。甲醛的来源一是由发酵原材料带入,如一些水果、薯类、米麦和谷糠麸皮的内表皮含有丰富果胶质,其在发酵过程中易形成甲醇,而甲醇会在非酶氧化作用下生成甲醛[18-19]。二是酿造工艺也会影响甲醛含量,如“掐头去尾”可有效减少甲醛含量,但是一些生产厂家的生产过程不够标准化,可能会造成酒中甲醛含量较高[20]。目前对于白酒中甲醛的产生机制及来源途径研究相对较少,本方法也旨在为该方面的研究提供技术支持。

图6 某白酒阳性样品色谱图
Fig.6 Chromatogram of a positive sample of Baijiu
3 结论
本文以2,4-二硝基苯肼作衍生剂,通过优化样品前处理和仪器条件,建立了高效液相色谱质谱联用测定酒类(啤酒、白酒、葡萄酒和黄酒)中甲醛含量的方法。实验结果显示,该方法测定甲醛在0~0.2 mg/L范围内线性良好,相关系数R2>0.999,回收率较高(93.7%~97.5%)且稳定,可满足不同工艺和酒精含量的酒类样品的检测。与光谱法和色谱法相比,该方法操作简便、分析快速、检出限低,不易受样品基质干扰,适用于市场上常见酒类中甲醛的分析定量。目前该方法仅针对甲醛这一化合物的检测,后期可在该方法的研究基础上建立酒类中易挥发的多种醛类的分析检测方法,为相关部门对酒类安全检测分析提供一定的参考依据。
[1] PENG W X, YUE X C, CHEN H L, et al.A review of plants formaldehyde metabolism:Implications for hazardous emissions and phytoremediation[J].Journal of Hazardous Materials, 2022, 436:129304.
[2] LIU Y, YUAN Y, LEI X Y, et al.Purification and characterisation of two enzymes related to endogenous formaldehyde in Lentinula edodes[J].Food Chemistry, 2013, 138(4):2 174-2 179.
[3] REINGRUBER H, PONTEL L B.Formaldehyde metabolism and its impact on human health[J].Current Opinion in Toxicology, 2018, 9:28-34.
[4] 汪咏曾, 祝胡仙, 朱教胜.酒类产品中甲醛检测方法(紫外分光法)研究与改进[J].农产品加工, 2022(10):79-81.
WANG Y Z, ZHU H X, ZHU J S.Research and improvement of detection method of formaldehyde in alcohol products(UV spectrophotometry)[J].Farm Products Processing, 2022(10):79-81.
[5] NOWSHAD F, ISLAM M N, KHAN M S.Concentration and formation behavior of naturally occurring formaldehyde in foods[J].Agriculture &Food Security, 2018, 7(1):17.
[6] 崔娜, 张曼玲, 田艳玲.乙酰丙酮法测定啤酒中甲醛含量的研究[J].食品安全质量检测学报, 2016, 7(3):906-910.
CUI N, ZHANG M L, TIAN Y L.Determination of the formaldehyde content in beer by acetyl acetone method[J].Journal of Food Safety &Quality, 2016, 7(3):906-910.
[7] 丁怀宇, 张静文.分光光度计法测定啤酒中甲醛含量[J].长春工业大学学报(自然科学版), 2008, 29(6):657-660.
DING H Y, ZHANG J W.Test of formaldehyde content in beer with spectrophotometer[J].Journal of Changchun University of Technology (Natural Science Edition), 2008, 29(6):657-660.
[8] DENG Z F, HU K, ZHANG Y M, et al.On-cartridge derivatisation using a calixarene solid-phase extraction sorbent for facile, sensitive and fast determination of formaldehyde in beer[J].Food Chemistry, 2016, 211(15):314-319.
[9] 袁彩霞, 钱滢文, 柴宗龙, 等.气相色谱法同时测定啤酒中的甲醛和乙醇[J].酿酒科技, 2018(5):117-121.
YUAN C X, QIAN Y W, CHAI Z L, et al.Simultaneous determination of formaldehyde and ethanol in beer by gas chromatography[J].Liquor-Making Science &Technology, 2018(5):117-121.
[10] 曾文祥, 李珍妮, 曾川, 等.高效液相色谱柱后衍生法测定啤酒中甲醛含量[J].食品安全导刊, 2021(34):75-78.
ZENG W X, LI Z N, ZENG C, et al.Determination of formaldehyde in beer by HPLC with post-column derivatization[J].China Food Safety Magazine, 2021(34):75-78.
[11] PENG Z F, LUO Y K, SONG C C, et al.A novel methodology and strategy to detect low molecular aldehydes in beer based on charged microdroplet driving online derivatization and high resolution mass spectrometry[J].Food Chemistry, 2022, 383:132380.
[12] KISHIKAWA N, EL-MAGHRABEY M H, KURODA N.Chromatographic methods and sample pretreatment techniques for aldehydes determination in biological, food, and environmental samples[J].Journal of Pharmaceutical and Biomedical Analysis, 2019, 175:112782.
[13] 赵云鹏, 徐晓飞, 刘星汶, 等.食品中甲醛含量的检测方法研究进展[J].中国食品添加剂, 2020, 31(12):112-116.
ZHAO Y P, XU X F, LIU X W, et al.Research progress in detection methods for formaldehyde[J].China Food Additives, 2020, 31(12):112-116.
[14] LIPSKEROV F A, SHESHUKOVA E V, KOMAROVA T V.Approaches to formaldehyde measurement:From liquid biological samples to cells and organisms[J].International Journal of Molecular Sciences, 2022, 23(12):6642.
[15] 刘建强. LC-MS/MS法测定啤酒中的微量甲醛和乙醛[J].中国酿造, 2008, 27(11):87-90.
LIU J Q.Determination of trace formaldehyde and acetaldehyde in beer by LC-MS/MS[J].China Brewing, 2008, 27(11):87-90.
[16] 顾亚萍, 乔方, 方长发, 等.液相色谱串联质谱法测定白菜中的甲醛含量[J].食品与发酵工业, 2017, 43(12):214-217.
GU Y P, QIAO F, FANG C F, et al.Determination of formaldehyde in Chinese cabbage by high performance liquid chromatography tandem mass spectrometry[J].Food and Fermentation Industries, 2017, 43(12):214-217.
[17] 李俊, 刘永翔, 王辉, 等.高效液相色谱法定量测定果蔬中甲醛含量[J].食品科学, 2016, 37(22):198-204.
LI J, LIU Y X, WANG H, et al.Determination of formaldehyde in fruits and vegetables by HPLC[J].Food Science, 2016, 37(22):198-204.
[18] 朱梦旭, 范文来, 徐岩.我国白酒蒸馏过程以及不同年份产原酒和成品酒中甲醛的研究[J].食品与发酵工业, 2015, 41(9):153-158.
ZHU M X, FAN W L, XU Y.Characterization of formaldehyde from distillation cut, raw liquor of different vintage, and finished Chinese liquor[J].Food and Fermentation Industries, 2015, 41(9):153-158.
[19] 于欣禾, 李明慧, 孙珍.LC-MS/MS分析结合优化提取工艺探究啤酒中麸质蛋白[J].质谱学报, 2022, 43(2):242-251.
YU X H, LI M H, SUN Z.Analysis of the gluten map in beers by LC-MS/MS combined with optimized extraction protocol[J].Journal of Chinese Mass Spectrometry Society, 2022, 43(2):242-251.
[20] VARTIAINEN E, BLOMBERG P, ILMÉN M, et al.Evaluation of synthetic formaldehyde and methanol assimilation pathways in Yarrowia lipolytica[J].Fungal Biology and Biotechnology, 2019, 6:27.