玉米在生长、收获、贮藏过程中都可能产生不同类型的生物毒素[1-5]。黄曲霉毒素B1(aflatoxin B1,AFB1)、黄曲霉毒素B2(aflatoxin B2,AFB2)、玉米赤霉烯酮(zearalenone,ZEN)、伏马毒素B1(fumonisin B1,FB1)、伏马毒素B2(fumonisin B2,FB2)、伏马毒素B3(fumonisin B3,FB3)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)及其乙酰化衍生物(3A-DON、15- DON)、T-2毒素(T-2 mycotoxin,T-2)、赭曲霉毒素A(ochratoxin A,OTA)等生物毒素广泛存在于玉米产品中,是其质量安全方面的主要问题[6-8]。生物毒素具有很强的致病性,对贮藏、销售及食用产生极大影响,严重威胁人类和牲畜的健康和生命[9-10]。
目前,生物毒素检测方法有薄层色谱法、液相色谱法、气相色谱法和酶联免疫吸附法等[11-16]。这些方法只能单纯对某种特定或某类结构相近的生物毒素进行检测,检测参数通量小,且在定性、定量能力方面有待改善。玉米产品中往往是多种毒素同时存在[17],因此,亟需建立多种生物毒素同时定性定量的高效的检测方法。
超高效液相色谱-串联质谱(ultra performance liquid chromatography-tandem mass spectrometry, UPLC-MS/MS)法具有更高的灵敏度和选择性,并且可同时提供目标物的分子结构信息和保留时间,适用于多组分同时测定分析等特点,成为同时检测大批量多种生物毒素方法的趋势。有学者用高效液相色谱-串联质谱法测定了腐乳、生姜、花生中特征生物毒素,取得了良好的效果[18-20]。但目前未见玉米及其产品中特征生物毒素同时测定方法的报道。本试验以不同类型玉米产品为研究对象,以准确度和精密度为考核指标,通过考察不同前处理方法,利用UPLC-MS/MS技术,建立玉米产品中AFB1、AFB2、ZEN、FB1、FB2、FB3等11种生物毒素同时检测的方法,为玉米产品品质综合评价、质量安全及调控提供标准依据。
1 材料与方法
1.1 材料与试剂
玉米样品来自于宁夏不同生态区(银川、吴忠和固原)不同贮藏条件下的籽粒玉米。
AFB1(CAS号1162-65-8,纯度≥99.0%)、AFB2(CAS号7220-81-7,纯度≥99.0%)、FB1(CAS号116355-83-0,纯度≥98.0%)、FB2(CAS号116355-84-1,纯度≥97.9%)、FB3(CAS号136379-59-4,纯度≥98.5%)、DON(CAS号51481-10-8,纯度≥99.38%)、3A-DON(CAS号50722-38-8,纯度≥99.0%)、15A-DON(CAS号88337-96-6,纯度≥99.8%)、ZEN(CAS号17924-92-4,纯度≥99.7%),美国Romer公司;T-2(CAS号21259-20-1,纯度≥96.55%),青岛普瑞邦生物工程有限公司;OTA(CAS号303-47-9,纯度≥99.0%),上海甄准生物科技有限公司;乙腈、甲醇,均为色谱纯,美国Sigma公司;NaCl(分析纯,≥99.5%),国药集团化学试剂有限公司;MgSO4(分析纯,≥99.0%),天津市光复精细化工研究所;柠檬酸钠(分析纯,纯度≥99.0%),天津市大茂化学试剂厂;水为实验室一级用水。
1.2 仪器与设备
Ddionex ultimate 3000超高效液相色谱-QTRAP 5500三重四极杆质谱联用仪,分别来自于美国Thermo公司和美国AB SCIEX公司;TDL-40C型离心机,上海安亭科学仪器厂;THZ-82A振荡器,金坛荣华仪器公司;MS3 digital型涡旋混合器,德国IKA艾卡公司;PL202-L型电子天平,瑞士梅特勒-托利多仪器有限公司;SMT-Y09型组织捣碎机,深圳斯玛特智能电器发展有限公司;N-Evaptm 112氮吹仪,美国Organomation公司;Milli-Q超纯水机,美国Millipore公司。
1.3 试验方法
1.3.1 样品的制备
玉米样品于-18 ℃冷冻冰箱中保存。试验时将玉米样品取出,用高速万能粉碎机(可加少量的液氮)粉碎,分别置于样品袋中,-18 ℃冷冻备用。
1.3.2 样品的提取
称取玉米样品2.00 g于50 mL离心管,加入20 mL体积分数80%乙腈溶液,振荡提取40 min,加入混合净化材料(1.5 g NaCl+3.5 g MgSO4+1.0 g柠檬酸钠),振摇约1 min,4 000 r/min离心5 min,吸取3 mL上清液,经N2吹干后,用体积分数50%乙腈溶液定容至1.5 mL,涡旋净化后过0.22 μm滤膜,待测。
1.3.3 仪器分析条件
色谱条件:色谱柱为HSS T3柱(2.1 mm×100 mm,1.8 μm);柱温40 ℃;进样量2 μL;流速0.4 mL/min,流动相0.1%甲酸甲醇-5 mmol/L乙酸铵0.1%甲酸水,洗脱方式为梯度洗脱。
质谱条件:离子源,电喷雾离子源;扫描方式:正、负离子模式;离子源喷雾电压:正离子模式5 500 V、负离子模式4 500 V;离子源温度550 ℃;喷雾气流速50 L/h;气帘气流速50 L/h;碰撞气流速200~600 L/h;外标法定量。扫描模式,多反应监测模式。
1.3.4 标准溶液配制
将11种毒素标准品配制成相应浓度的标准溶液,再用乙腈稀释配制质量浓度为0.001~1.0 mg/L的标准溶液,在上述仪器条件下测定,以标准溶液质量浓度为横坐标,定量离子对峰面积为纵坐标绘制标准曲线。
1.4 数据分析
采用 Excel进行数据整理与统计分析,采用Origin 9.1进行作图。
2 结果与分析
2.1 色谱条件的确定
首先筛选并确定合适的色谱分析方法,然后确定最优的色谱条件。寻找合适的母离子、子离子、优化碰撞能量、喷撞气等离子源参数;选择色谱柱、柱温、流动相体系及配比、流速,确定仪器优化条件。
分别选择Symmetry C18(3.5 μm,2.1 mm×100 mm)、BEH C18(1.7 μm,2.1 mm×100 mm)、HSS T3柱(1.8 μm,2.1 mm×100 mm)色谱柱进行研究。结果表明,Symmetry C18色谱柱及BEH C18色谱柱均在较短时间内集中出峰,通过调节流动相梯度依然不能很好地分离各目标峰,只有HSS T3色谱柱可将11种目标峰较好分离,且峰型尖锐,分离效果好。因此,试验确定色谱柱为HSS T3柱。
再进一步对流动相体系进行优化,分别选用乙腈-5 mmol/L乙酸铵体积分数0.1%甲酸水、甲醇-5 mmol/L乙酸铵体积分数0.1%甲酸水、0.1%甲酸甲醇-5 mmol/L乙酸铵0.1%甲酸水3种流动相体系对11种生物毒素进行梯度洗脱试验。结果表明,以0.1%甲酸甲醇-5 mmol/L乙酸铵0.1%甲酸水为流动相时,11种生物毒素的分离度均较好,且保留时间合适。最终确定以0.1%甲酸甲醇-5 mmol/L乙酸铵0.1%甲酸水的梯度洗脱。洗脱条件见表1。
表1 流动相梯度洗脱条件
Table 1 Gradient elution conditions of mobile phase
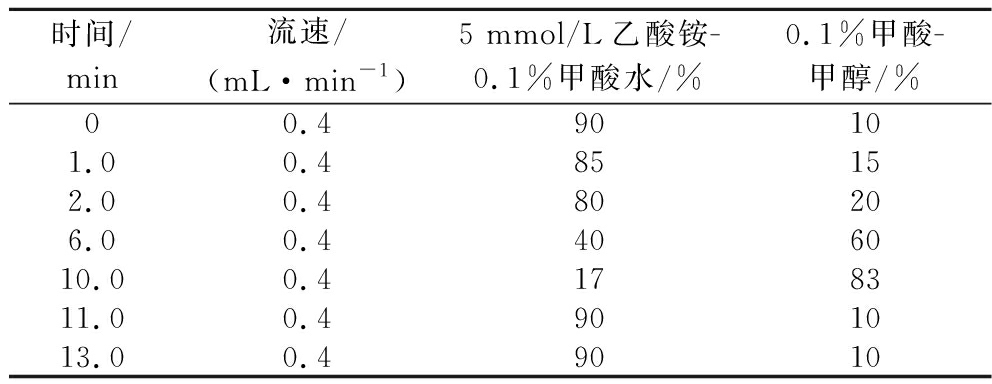
时间/min流速/(mL·min-1)5 mmol/L乙酸铵-0.1%甲酸水/%0.1%甲酸-甲醇/%00.490101.00.485152.00.480206.00.4406010.00.4178311.00.4901013.00.49010
2.2 质谱条件的确定
将FB1、FB2、FB3、DON、3A-DON、15A-DON、ZEN、T-2和OTA 9种生物毒素分别配制成1.0 mg/L的标准工作液,AFB1和AFB2分别配制成0.5 mg/L的标准工作液,通过针泵进样,分别在正、负离子模式下进行母离子全扫描,得到11种生物毒素的母离子信息。对上述母离子施加不同的碰撞能量,对产生的子离子进行全扫描,得到相对丰度较高的子离子信息及最适的碰撞能量。具体质谱图见图1、检测参数见表2。
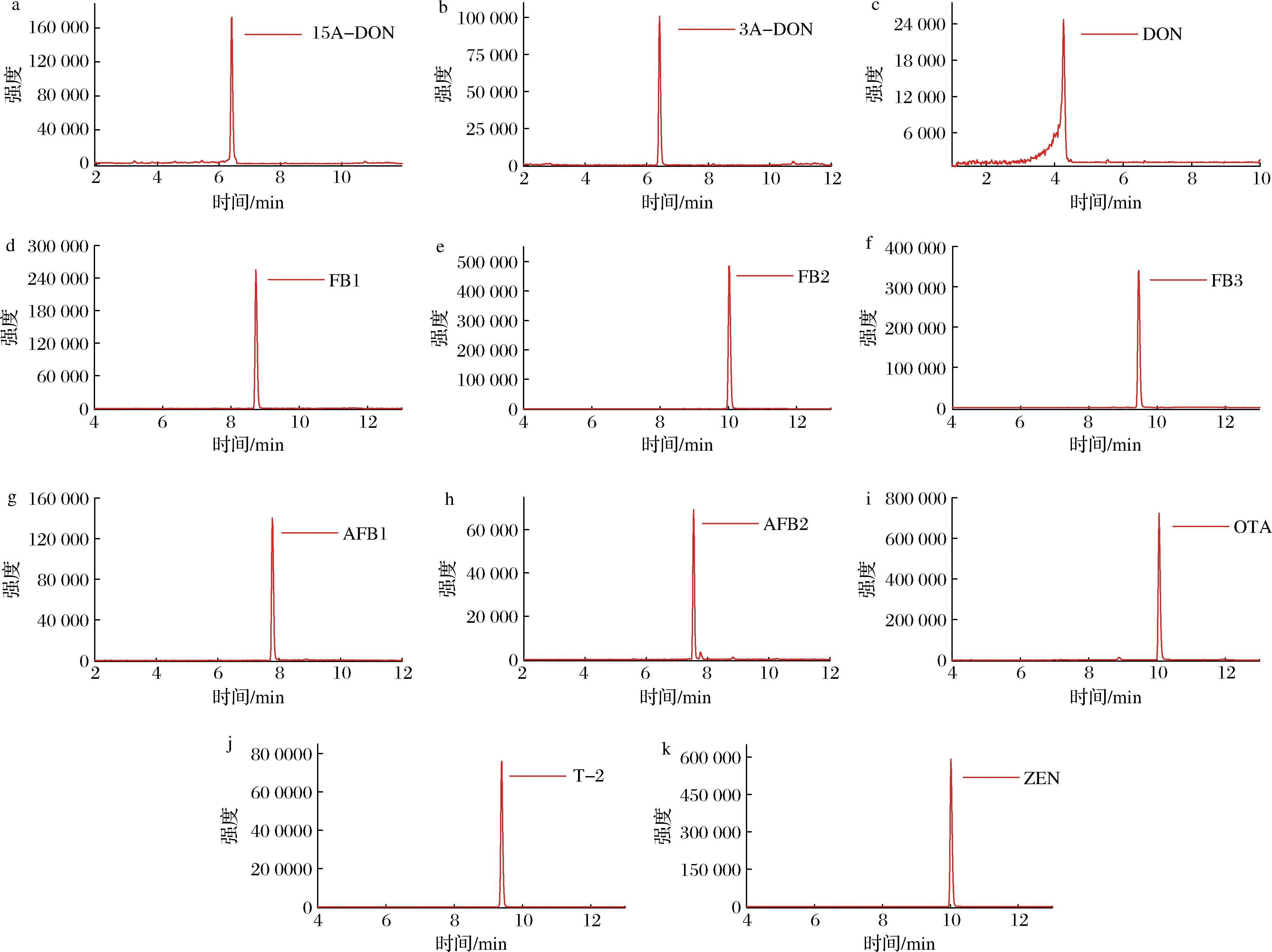
a-15A-DON;b-3A-DON;c-DON;d-FB1;e-FB2;f-FB3;g-AFB1;h-AFB2;i-OTA;j-T-2;k-ZEN
图1 十一种生物毒素标准溶液LC-MS/MS的多反应监测(MRM)色谱图
Fig.1 Multiple reaction monitoring (MRM) chromatograms of lC-MS /MS standard solutions for 11 mycotoxins
表2 多反应监测模式(MRM)分析参数
Table 2 Analysis parameters of multiple response monitoring mode (MRM)

毒素扫描方式保留时间/min定性离子对(m/z)定量离子对(m/z)碰撞能量/eV毒素扫描方式保留时间/min定性离子对(m/z)定量离子对(m/z)碰撞能量/eVFB1正离子8.73722.4/334.4722.4/352.4722.4/334.45450FB2正离子10.03706.4/336.51706.4/318.61706.4/336.515054FB3正离子9.46706.4/336.50706.4/318.60706.4/336.505050DON正离子4.26297.1/249.1297.1/203.2297.1/249.116213A-DON正离子6.42339.2/203.2339.2/231.1339.2/203.2211815A-DON正离子6.41339.3/321.2339.3/137.1339.3/321.21219AFB1正离子7.74313.1/285.1313.1/241.1313.1/285.13350AFB2正离子7.50315.1/287.1315.1/259.1315.1/287.13540T-2毒素正离子9.39484.2/305.1484.2/245.1484.2/305.11919ZEN负离子10.02317.1/175.0317.1/273.0317.1/175.0-32-27OTA负离子10.06402.2/358.2402.2/211.0402.2/358.2-28-38
2.3 提取溶剂的确定
提取溶剂的选择应该是与残留分析的化合物有良好的溶解性和稳定性,适于样品制备和色谱分析,不仅要求目标物被提取充分,而且提取的杂质干扰越少越好。查阅相关文献,分别选择乙腈(提前加水浸泡)、80%乙腈溶液、50%乙腈溶液3种提取试剂对试样进行提取。
在提取溶剂研究中,对比了3种提取溶剂对玉米样品中11种生物毒素的提取效果,结果见图2。

图2 不同提取试剂提取效果的分析
Fig.2 Analysis of extraction effects of different extraction reagents
通过在不同溶剂中的提取率实验及色谱扫描峰面积与相对标准偏差(relative standard deviation,RSD)的比较,结果可知,用乙腈(提前加水浸泡)和50%乙腈溶液同时提取玉米样品中的11种生物毒素时,回收率均不能达到分析检测的要求,而采用80%乙腈溶液提取时,11种生物毒素的回收率均为76%~95%,RSD为3.7%~12.8%,完全能满足分析检测要求。因此,确定80%乙腈溶液作为测定玉米样品中11种生物毒素的提取溶剂。
2.4 标准溶液配制及标准工作曲线绘制
将11种毒素标准品配制成相应质量浓度的标准溶液,再用乙腈稀释配制在0.001~1.0 mg/L的标准溶液,在上述仪器条件下测定,以标准溶液浓度为横坐标,定量离子对峰面积为纵坐标绘制标准曲线。如表3所示,FB1、FB2、FB3在0.005、0.02、0.1、0.5、1.0 mg/L质量浓度范围内均具有良好的线性关系,相关系数r值均大于0.999 5。DON、3A-DON、15A-DON在0.02、0.2、0.5、1.0、2.0 mg/L质量浓度范围内均具有良好的线性关系,相关系数r值均大于0.999 5。AFB1、AFB2在0.001、0.005、0.01、0.05、0.1 mg/L质量浓度范围内均具有良好的线性关系,相关系数r值均大于0.999 5。ZEN、T-2、OTA在0.005、0.01、0.05、0.1、0.5 mg/L质量浓度范围内均具有良好的线性关系,相关系数r值均大于0.999 5。
表3 十一种生物毒素的线性方程、相关系数及定量限
Table 3 Linear equations, correlation coefficients and limits of quantification of 11 mycotoxins
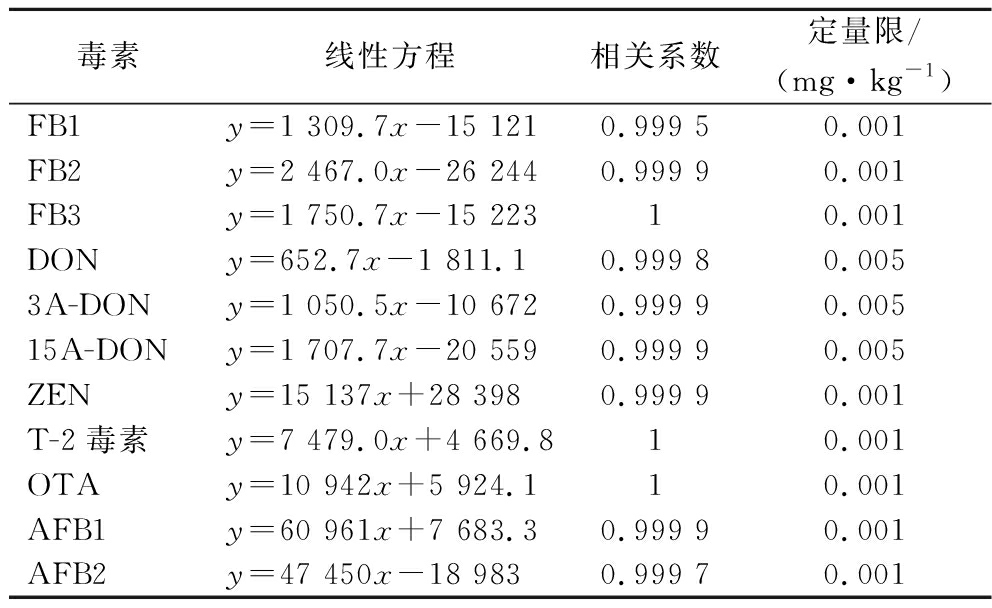
毒素线性方程相关系数定量限/(mg·kg-1)FB1y=1 309.7x-15 1210.999 50.001FB2y=2 467.0x-26 2440.999 90.001FB3y=1 750.7x-15 22310.001DONy=652.7x-1 811.10.999 80.0053A-DONy=1 050.5x-10 6720.999 90.00515A-DONy=1 707.7x-20 5590.999 90.005ZENy=15 137x+28 3980.999 90.001T-2毒素y=7 479.0x+4 669.810.001OTAy=10 942x+5 924.110.001AFB1y=60 961x+7 683.30.999 90.001AFB2y=47 450x-18 9830.999 70.001
2.5 准确度和精确度
11种生物毒素分别为0.001~2.0 mg/kg,每种毒素做3个添加水平,每个水平做5个重复,玉米空白试样同时进行测定,如表4所示。
表4 玉米样品中11种生物毒素的添加回收率及相对标准偏差(n=5)
Table 4 Recovery rates and relative standard deviations of 11 mycotoxins in corn samples (n=5)
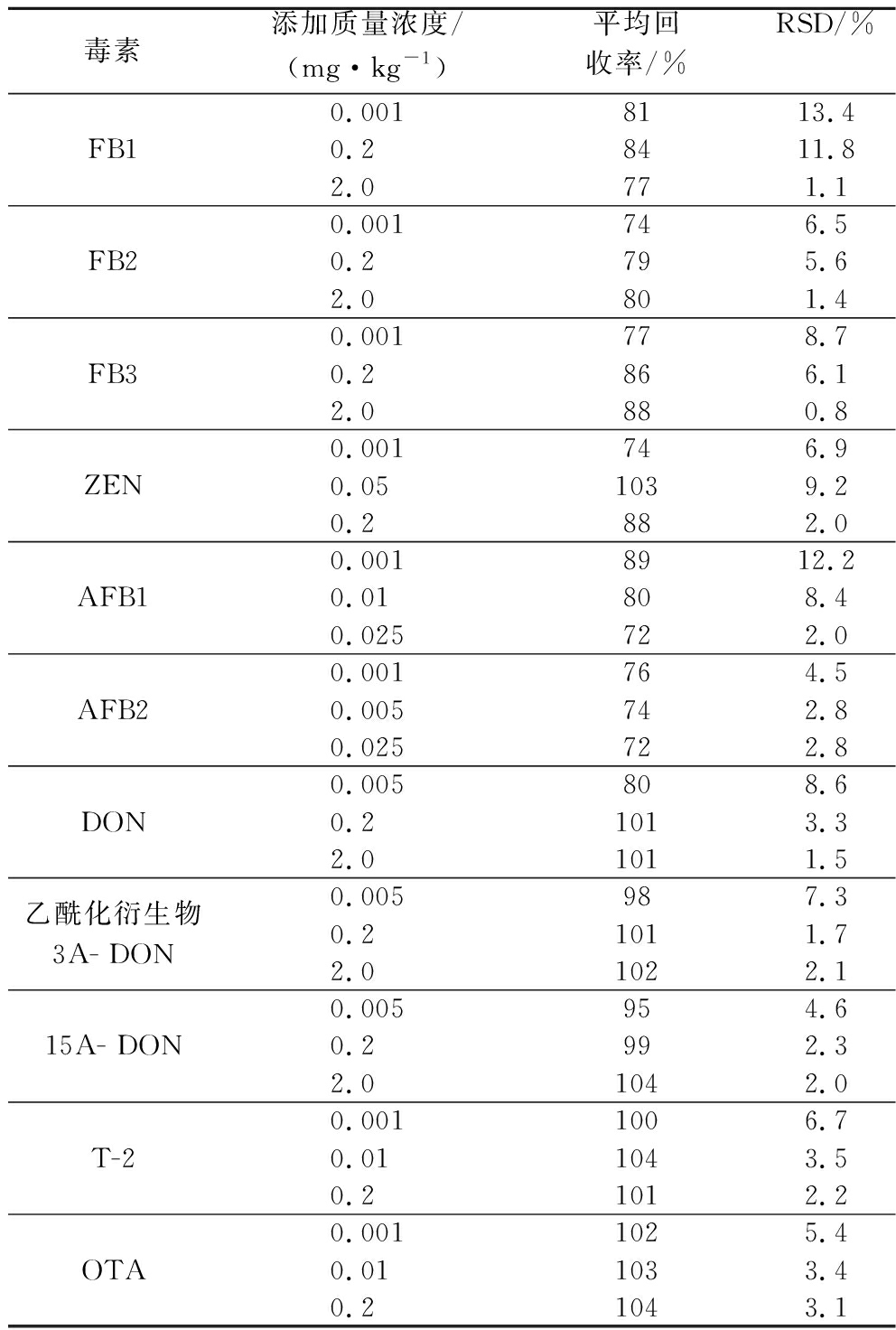
毒素添加质量浓度/(mg·kg-1)平均回收率/%RSD/%FB10.0018113.40.28411.82.0771.1FB20.001746.50.2795.62.0801.4FB30.001778.70.2866.12.0880.8ZEN0.001746.90.051039.20.2882.0AFB10.0018912.20.01808.40.025722.0AFB20.001764.50.005742.80.025722.8DON0.005808.60.21013.32.01011.5乙酰化衍生物3A- DON0.005987.30.21011.72.01022.115A- DON0.005954.60.2992.32.01042.0T-20.0011006.70.011043.50.21012.2OTA0.0011025.40.011033.40.21043.1
玉米样品中FB1、FB2、FB3中的平均回收率为74%~88%, RSD为0.8%~13.4%;玉米样品在DON、3A-DON、15A-DON中的平均回收率为80%~104%,RSD为1.5%~8.6%;玉米样品在AFB1、AFB2中的平均回收率为72%~89%,RSD为2.0%~12.2%;玉米样品在ZEN、T-2、OTA中的平均回收率为74%~104%,RSD为2.0%~9.2%。回收率和RSD均符合检测分析的要求,方法高效、快速、准确,具备较强实用性。添加回收总离子流图见图3。
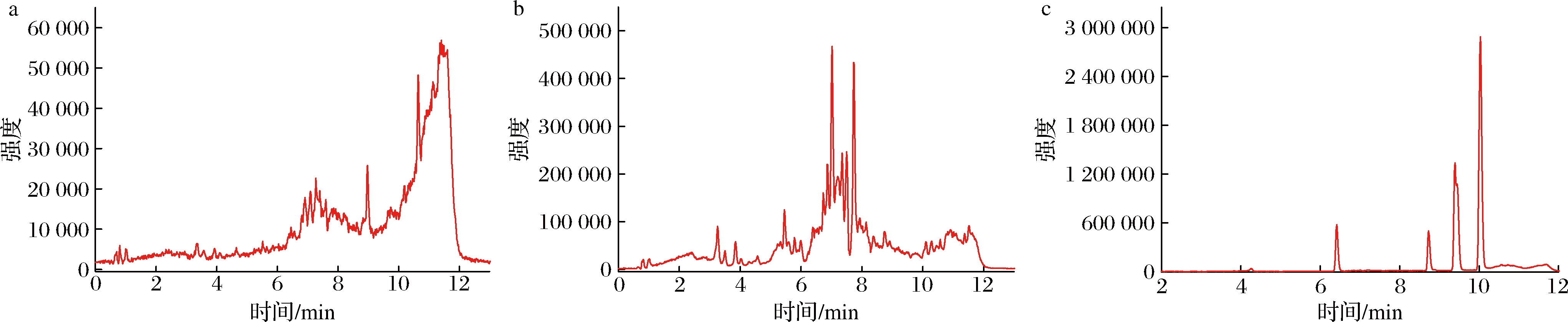
a-空白样品;b-添加AFB1、AFB2;c-添加(0.025 mg/L);FB1、FB2、FB3、DON、3A-DON、15A-DON、ZEN、T-2和OTA(0.2 mg/L)
图3 玉米样品的总离子流图
Fig.3 Total ion flow diagram of corn samples
2.6 样品测定
应用上述方法分别对2020年和2021年的宁夏地区不同储藏阶级和不同储藏方式下的玉米籽粒中的AFB1、AFB2、ZEN、FB1、FB2、FB3、DON、3A-DON、15A-DON、T-2和OTA 11种生物毒素进行监测分析。结果显示,11种生物毒素均有检出,其中检出率最高的是伏马毒素,检出率为89.7%,其次是玉米赤霉烯酮,检出率为39.5%,再次是脱氧雪腐镰刀菌烯醇,检出率为13.2%;黄曲霉毒素的检出率为17.9%,赭曲霉毒素A检出率为6.6%,T-2毒素的检出率不到1%。
3 结论
本实验采用超高效液相色谱-三重四极杆质谱联用技术,优化确定了色谱、质谱条件,提取试剂和方法,方法的添加回收率和精密度已达到分析要求,建立的玉米及其产品中11种生物毒素含量的测定液相色谱-质谱/质谱法定型定量准确,快速高效,适用于玉米产品中多种生物毒素的测定。
[1] 兰静,赵琳,孙向东,等.我国玉米生物毒素污染现状及预防措施[J].安徽农业科学,2019,47(19):183-185;189.
LAN J, ZHAO L, SUN X D, et al.Current situation and preventive measures of mycotoxin contamination of maize in China [J].Journal of Anhui Agricultural Sciences, 2019,47(19):183-185;189.
[2] CHILAKA C A,DE KOCK S,PHOKU J Z,et al.Fungal and mycotoxin contamination of South African commercial maize[J].Journal of Food Agriculture &Environment, 2012,10(2):296-303.
[3] AYERST G.The effects of moisture and temperature on growth and spore germination in some fungi [J].Journal of Stored Products Research,1969,5(2):127-141.
[4] 赫丹,徐剑宏,仇剑波,等.伏马毒素的理化性质、检测方法及在我国玉米和玉米制品中的污染现状综述[J].江苏农业科学,2021,49(21):33-39.
HE D, XU J H, QIU J B, et al.Physical and chemical properties, detection methods and pollution status of fumonisins in corn and its products in China:A review[J].Jiangsu Agricultural Sciences, 2021,49(21):33-39.
[5] 孟繁磊,范宏,谭莉,等.吉林省玉米真菌毒素污染状况及其膳食风险评估研究[J].玉米科学,2021,29(5):88-94.
MENG F L, FAN H, TAN L, et al.Contamination status and dietary risk assessment of corn mycotoxins in Jilin province[J].Journal of Maize Sciences,2021,29(5):88-94.
[6] 刘玉兰,郑婷婷,马宇翔,等.臭氧熏蒸对玉米胚中真菌毒素的降解消除作用[J].食品科学,2022,43(3):77-82.
LIU Y L, ZHENG T T, MA Y X, et al.Effect of ozone fumigation on the removal of mycotoxins in corn germ[J].Food Science, 2022,43(3):77-82.
[7] LIU J, SUN L H, ZHANG J C, et al.Aflatoxin B1, Zearalenone and deoxynivalenol in feed ingredients and complete feed from central China[J].Food Additives &Contaminants.Part B, Surveillance, 2016, 9(2):91-97.
[8] LICHTWARDT R W,TIFFANY L H.Mold flora associated with shelled corn in Iowa[J].Iowa State College Journal of Science, 1958,33:1-11.
[9] ANTONISSEN G, DEVREESE M, DE BAERE S, et al. Impact of Fusarium mycotoxins on hepatic and intestinal mRNA expression of cytochrome P450 enzymes and drug transporters, and on the pharmacokinetics of oral enrofloxacin in broiler chickens[J].Food and Chemical Toxicology,2017, 101:75-83.
[10] GRUBER-DORNINGER C, NOVAK B, NAGL V, et al.Emerging mycotoxins:Beyond traditionally determined food contaminants[J].Journal of Agricultural and Food Chemistry, 2017, 65(33):7 052-7 070.
[11] 刘涛, 王向红, 常彧, 等.直接竞争酶联免疫法检测大麦中玉米赤霉烯酮[J].食品与机械, 2008, 24(2):97-99;117.
LIU T, WANG X H, CHANG Y, et al.Direct competitive enzyme-linked Immunosorbent assay for the detection of Zearalenone in barley[J].Food &Machinery, 2008, 24(2):97-99;117.
[12] 朱孟丽. 高效液相色谱法对饲料中赭曲霉毒素的测定[J].中国饲料,2005(20):25-26.
ZHU M L.Determination of ochratoxin in feed by high performance liquid chromatography[J].China Feed,2005(20):25-26.
[13] 孙月,赵晋铭,贾雯晴,等.固相萃取-高效液相色谱串联质谱法检测粮食中赭曲霉毒素A[J].江苏农业学报,2016,32(6):1 416-1 420.
SUN Y, ZHAO J M, JIA W Q, et al.Application of solid-phase extraction to determination of ochratoxin A in grains by high performance liquid chromatography-tandem mass spectrometry.[J].Jiangsu Journal of Agricultural Sciences, 2016,32(6):1 416-1 420.
[14] 曹冬梅,许杨,涂追,等.基于纳米抗体-碱性磷酸酶融合蛋白的一步酶联免疫吸附分析法检测黄曲霉毒素B1 [J].分析化学,2016, 44(7):1 085-1 091.
CAO D M, XU Y, TU Z, et al.One-step enzyme linked immunosorbent assay for detection of aflatoxin B1 using a nanobody-alkaline phosphatase fusion protein[J].Chinese Journal of Analytical Chemistry, 2016, 44(7):1 085-1 091.
[15] 陈芳芳. 高效液相色谱法同时检测花生中6种真菌毒素的方法及应用研究[D].济南:山东大学, 2017.
CHEN F F.Simultaneous determination of six mycotoxins in peanut by high-performance liquid chromatography with fluorescence detector and its application[D].Jinan:Shandong University, 2017.
[16] 符金华, 杨琳芬, 董泽民, 等.同位素稀释技术结合超高效液相色谱-四极杆/线性离子阱质谱快速精准测定饲料及原料中16种霉菌毒素[J].中国饲料, 2019(1):72-79.
FU J H, YANG L F, DONG Z M, et al.Determination of 16 mycotoxins in feed and feedstuff by UPLC-Quadrupole/Qtrap Mass Spectrometry and stable isotope dilution technique[J].China Feed, 2019(1):72-79.
[17] 张大伟, 杨海麟, 华宇, 等.玉米中隐蔽性毒素和新型毒素污染情况分析:基于2020年中国玉米主产区采样情况[J].粮油食品科技, 2021, 29(6):119-130;30.
ZHANG D W, YANG H L, HUA Y, et al.Analysis on the mask-mycotoxins and emerging-mycotoxins in maize:Samples from the maize cultivated region in 2020, China[J].Science and Technology of Cereals, Oils and Foods, 2021, 29(6):119-130;30.
[18] 赵亚荣,刘香香,赵晓丽,等.生姜及其制品中常见真菌毒素污染与检测方法研究进展[J].农产品质量与安全,2020(4):49-54.
ZHAO Y R, LIU X X, ZHAO X L, et al.Progress in mycotoxins contamination and detection in ginger and their processed products[J].Quality and Safety of Agro-Products, 2020(4):49-54.
[19] 陈宁周,颜玉婷,王海波,等.高效液相色谱-串联质谱法测定腐乳中16种真菌毒素[J].食品安全质量检测学报, 2019,10(15):5 169-5 179.
CHEN N Z, YAN Y T, WANG H B, et al.Determination of 16 mycotoxins in sufu by high performance liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety &Quality, 2019, 10(15):5 169-5 179.
[20] 黄仁堂, 刘洪美, 关凯仪, 等.LC-MS/MS同时检测中药中多种真菌毒素的研究进展[J/OL].中华中医药学刊, 2022:1-13.(2022-06-24).https://kns.cnki.net/kcms/detail/21.1546.R.20220623.1132.002.html.
HUANG R T, LIU H M, GUAN K Y, et al.Research advance in simultaneous determination of multi-mycotoxins in traditional Chinese medicine by LC-MS/MS[J/OL].Chinese Archives of Traditional Chinese Medicine, 2022:1-13.(2022-06-24).https://kns.cnki.net/kcms/detail/21.1546.R.20220623.1132.002.html.