青藏高原是世界上海拔最高的高原,气温偏低,但是因为日照强,形成了大片的天然草场,利于畜牧业的发展。正因如此,长久以来青藏高原上的藏族牧民形成了饲养牦牛,食用牦牛肉和牦牛乳的生活习惯[1]。牦牛乳含有丰富的蛋白质和矿物质元素等有益物质,藏族牧民除了直饮牦牛乳外,还会将牦牛乳通过自然发酵制成牦牛酸乳。藏族牧民独特的自然发酵工艺以及高原地区特殊的地理环境,这些因素使牦牛酸乳含有丰富的微生物和特殊的风味[2]。研究显示,从自然发酵牦牛酸乳中发现的微生物已应用到食品产业中,表现出包括肠道调节、减肥和预防体内多种炎症疾病的生物活性作用[3]。青藏高原的自然发酵牦牛乳中含有的微生物多样性,具有很好的开发利用价值,是发现益生菌资源的潜在来源[4]。
狼疮性肾炎是系统性红斑狼疮累及到肾脏而出现的一种疾病,发病后会导致肾小球滤过功能下降和肾小管功能减退[5]。狼疮性肾炎会引起免疫力下降、淋巴结增生和肾小球肾炎等病变,肾脏组织会发生肾小球硬化或弥漫性增生,造成患者的代谢和排毒功能严重受损,最终导致慢性肾功能衰竭,严重时可危及生命[6]。大多数狼疮性肾炎发病后会过度激活B细胞和T细胞,T细胞分化为辅助性T细胞,在免疫反应中仅能起到中间过程的角色作用,但是益生菌存在的情况下可以使更多的T细胞发育为可以缓解炎症的调节性T细胞,直接干预肾炎[7]。益生菌的自身结构成分还可以直接以抗原的方式刺激和激活免疫系统,起到排出体内毒性物质,减轻炎症的作用[8]。降植烷是一种能够引起炎症和加强免疫反应,使T细胞出现高度活化和使B细胞的反应性大幅度增高的化合物,基于降植烷能促使动物产生多种自身抗体的性质,可以用降植烷诱导实验动物引发狼疮性肾炎,此动物模型现已常被用于检验药物和保健食品对狼疮性肾炎干预效果[9]。植物乳杆菌HFY09是本研究团队从四川红原采集到的藏族牧民家庭自制自然发酵酸乳中分离鉴定的一株乳酸菌,本研究将通过检测小鼠血清中相关指标和炎症相关细胞因子水平证实植物乳杆菌HFY09对狼疮性肾炎的效果,并进一步采用病理学观察、组织mRNA和蛋白表达检测深入研究植物乳杆菌HFY09的作用机理。
1 材料与方法
1.1 材料与试剂
植物乳杆菌HFY09分离于四川省阿坝藏族羌族自治州红原县的自然发酵牦牛酸乳,菌种保藏于中国微生物菌种保藏管理委员会普通微生物中心,专利保藏号为CGMCC No.16633。
SPF级6周龄的雌性C57BL/6J小鼠,体质量为(23±2)g,购于重庆医科大学实验动物中心,生产许可证号为SCXK(渝)2018-0003。本研究中的动物实验经重庆市功能性食品协同创新中心动物实验伦理委员会批准,批准号为2021050007B。
降植烷,上海麦克林生化科技有限公司;总蛋白(total protein,TP)、血清肌酐(serum creatinine,SCr)、尿素氮(blood urea nitrogen,BUN)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、白蛋白(albumin,ALB)测定试剂盒,南京建成生物工程研究所;辣根过氧化物酶,美国Sigma公司;白介素6(interleukin-6,IL-6)、IL-12、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)和干扰素γ(interferon γ,IFN-γ)检测试剂盒,上海酶联生物科技有限公司;TRIzol试剂,美国Invitrogen公司;SYBR Green PCR Master Mix、qPCR引物、SDS-PAGE预制胶、一抗、二抗,美国Thermo Fisher Scientific公司;蛋白浓度测定试剂盒,美国Bio-Rad公司;其余试剂均为国产分析纯。
1.2 仪器与设备
BX43显微镜,日本奥林巴斯公司;Varioskan LUX多功能酶标仪、StoponePlus定量PCR仪、iBright成像系统,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 动物实验
C57BL/6J小鼠饲养在温度为(20±1)℃和湿度为30%~40%的环境下,实验小鼠可自由采食和饮水,小鼠适应性喂养7 d后正式开始进行实验。50只小鼠随机分为5组,每组10只,分别为正常组、模型组、药物阳性对照组、LP-HFY09低浓度处理(LP-HFY09-L)组和LP-HFY09高浓度处理(LP-HFY09-H)组。实验正式开始后第1天正常组小鼠一次性腹腔注射生理盐水溶液,其余各组小鼠一次性腹腔注射0.5 mL降植烷[10]。药物阳性对照组小鼠每日按剂量10 mg/kg灌胃泼尼松溶液,LP-HFY09-L组和LP-HFY09-H组小鼠每日按108和109 CFU/kg的剂量灌胃LP-HFY09,泼尼松和LP-HFY09的灌胃持续12周。12周后对小鼠实施眼眶静脉丛采血后断颈椎脱臼处死,解剖取小鼠心脏待测。
1.3.2 尿蛋白检验
实验开始后,每2周将小鼠饲养在代谢笼中1日并收集小鼠的排尿,采用总蛋白试剂盒(考马斯亮蓝法)测定24 h内小鼠尿液中的蛋白量。
1.3.3 血清和组织炎症细胞因子测定
采取心脏取血收集小鼠全血后在3 000 r/min、4 ℃下离心10 min,取上层血清进行实验。另外称取0.1 g肾脏组织,在肾脏组织中加入0.9 mL生理盐水,然后在4 ℃下对肾脏组织进行均质,4 000 r/min、10 min离心后取上清液进行实验。最后按检测试剂盒方法测定血清和组织中的IL-6、IL-12、TNF-α和IFN-γ炎症细胞因子水平[11]。
1.3.4 血清SCr、BUN、TC、TG、TP和ALB水平测定
采取1.3.3方法收集小鼠血清,按检测试剂盒方法测定小鼠血清的SCr、BUN、TC、TG、TP和ALB水平。
1.3.5 抗双链DNA(double-stranded DNA,dsDNA)抗体测定
实验开始后每2周采用内眦静脉取血收集小鼠血液,然后按1.3.3方法制备小鼠血清后使用微滴度板和间接免疫荧光实验测定抗dsDNA抗体[12]。
1.3.6 组织切片观察
解剖小鼠后,取小鼠的肾脏组织用体积分数10%的甲醇水溶液固定。脱水48 h后,用石蜡包埋组织样品,再进行切片,最后用苏木精-伊红(hematoxylin-eosin staining,H&E)染料进行染色后采用光学显微镜观察组织病理变化。
1.3.7 qPCR实验
在0.1 g的小鼠肾脏组织中加入0.9 mL的生理盐水,然后对组织混合液进行匀浆。然后再使用RNAzol(1.0 mL)提取小鼠肾脏组织中的RNA。在260和280 nm处测定RNA的吸光度值,计算RNA纯度和浓度,并将RNA浓度调整为1 μg/μL。进行反转录生成cDNA后,将1 μL cDNA、10 μL SYBR Green PCR Master Mix、7 μL无菌蒸馏水和各1 μL的上下游引物溶液混合配制成反应体系溶液。接着在95 ℃持续60 s;95 ℃持续15 s,进行40个循环;55 ℃持续30 s;72 ℃持续35 s;95 ℃持续30 s;55 ℃持续35 s的条件下进行反应,并使用2-ΔΔCt法对其相关基因进行定量分析,实验中使用GAPDH作为内参(表1)[13]。
表1 本实验中使用的引物序列
Table 1 The primer sequences used in this experiment
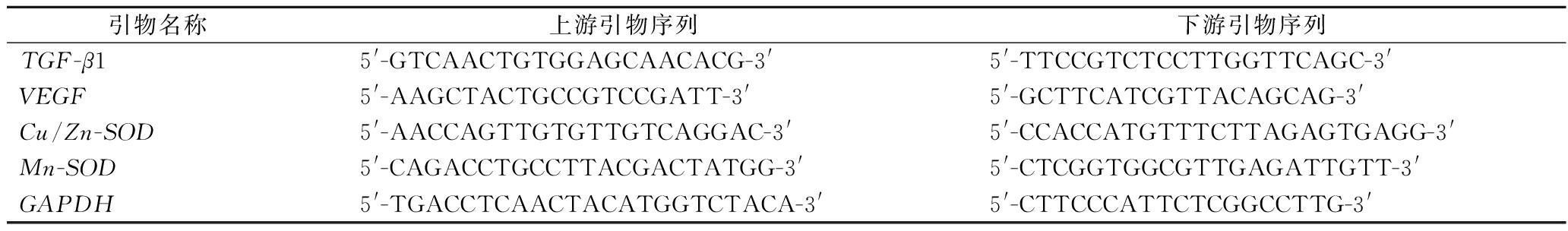
引物名称上游引物序列下游引物序列TGF-β15'-GTCAACTGTGGAGCAACACG-3'5'-TTCCGTCTCCTTGGTTCAGC-3'VEGF5'-AAGCTACTGCCGTCCGATT-3'5'-GCTTCATCGTTACAGCAG-3'Cu/Zn-SOD5'-AACCAGTTGTGTTGTCAGGAC-3'5'-CCACCATGTTTCTTAGAGTGAGG-3'Mn-SOD5'-CAGACCTGCCTTACGACTATGG-3'5'-CTCGGTGGCGTTGAGATTGTT-3'GAPDH5'-TGACCTCAACTACATGGTCTACA-3'5'-CTTCCCATTCTCGGCCTTG-3'
1.3.8 Western blot
称取0.5 g小鼠的肾脏组织,用1 mL放射免疫沉淀法(radio immuno precipitation assay,RIPA)裂解液和10 μL 苯甲基磺酰氟(phenyl methane sulfonyl fluoride,PMSF)裂解,然后4 ℃,12 000 r/min离心4 min,去除中间蛋白层溶液,并使用BCA蛋白定量试剂盒进行蛋白定量。将各组提取到的蛋白稀释至50 μg/mL,将稀释后的蛋白质与样品缓冲液按4∶1的比例混合,并在100 ℃下加热5 min,然后倒入预制胶中,进行50 min的垂直凝胶电泳,然后进行聚偏二氟乙烯(polyvinylidene fluoride,PVDF)转膜。接着用含有TBST溶液的质量分数5%脱脂牛乳封闭PVDF膜1 h,完成后用TBST对PVDF膜进行清洗。然后在25 ℃下以1∶500的稀释一抗后孵育2 h,二抗在25 ℃下孵育1 h。最后,使用Supersignal West Pico PLUS填充PVDF膜,并将其放置在成像系统中进行观察[13]。
1.4 统计学分析
动物实验结束后对所有指标进行3次平行测定,测定得到的结果以平均值表示,同时标注出标准偏差(平均值±标准偏差)。然后采用单因素方差分析得到各组指标值在P<0.05上是否具有显著差异。
2 结果与分析
2.1 小鼠尿液中蛋白量
在实验过程中,正常组小鼠的尿液中蛋白量没有明显变化,但其他组小鼠的尿蛋白随着时间的延长而增加。2周后,在LP-HFY09-L、LP-HFY09-H和泼尼松组中,分别有7、5和3只小鼠出现蛋白尿,模型组小鼠均出现蛋白尿。12周后,狼疮性肾炎小鼠(模型组)的尿蛋白含量显著(P<0.05)高于LP-HFY09和泼尼松处理小鼠和正常组小鼠(表2)。用高浓度LP-HFY09和泼尼松处理的小鼠的尿蛋白输出量与正常小鼠最接近,但显著高于正常小鼠(P<0.05),LP-HFY09-H小组小鼠的尿蛋白略高于泼尼松组小鼠(P<0.05)。
2.2 小鼠血清和肾脏组织中IL-6、IL-12、TNF-α和IFN-γ细胞因子水平
由表3和表4所示,正常组小鼠血清和肾组织的IL-6、IL-12、TNF-α和IFN-γ细胞因子水平显著低于其他各组(P<0.05)。相对模型组小鼠,LP-HFY09和泼尼松作用后,狼疮性肾炎小鼠(模型组)的IL-6、IL-12、TNF-α和IFN-γ细胞因子水平显著下调(P<0.05),且高浓度LP-HFY09和泼尼松下调这些细胞因子水平的能力更强。
表2 实验过程中各组小鼠尿蛋白含量 单位:g/L
Table 2 The urine protein content of mice in each group during the experiment
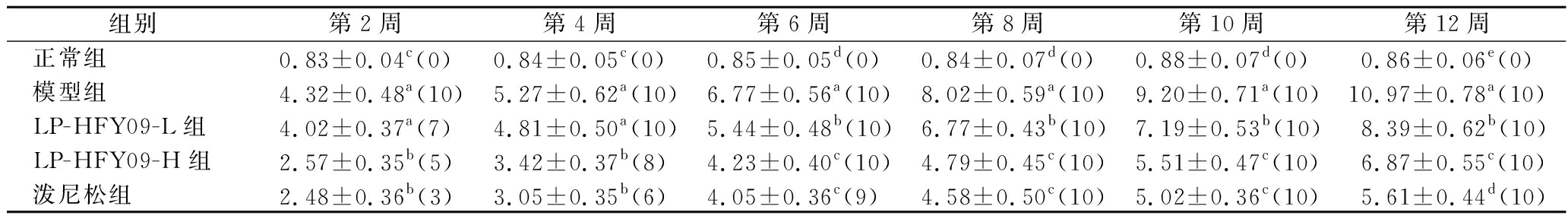
组别第2周 第4周第6周第8周第10周第12周正常组0.83±0.04c (0)0.84±0.05c(0)0.85±0.05d(0)0.84±0.07d(0)0.88±0.07d(0)0.86±0.06e(0)模型组4.32±0.48a(10)5.27±0.62a(10)6.77±0.56a(10)8.02±0.59a(10)9.20±0.71a(10)10.97±0.78a(10)LP-HFY09-L组4.02±0.37a(7)4.81±0.50a(10)5.44±0.48b(10)6.77±0.43b(10)7.19±0.53b(10)8.39±0.62b(10)LP-HFY09-H组2.57±0.35b(5)3.42±0.37b(8)4.23±0.40c(10)4.79±0.45c(10)5.51±0.47c(10)6.87±0.55c(10)泼尼松组2.48±0.36b(3)3.05±0.35b(6)4.05±0.36c(9)4.58±0.50c(10)5.02±0.36c(10)5.61±0.44d(10)
注:括号中的数字表示蛋白尿小鼠数量;不同字母表示各组之间在P<0.05水平上具有显著差异,相同字母表示无显著差异(下同)
表3 小鼠血清IL-6、IL-12、TNF-α和IFN-γ水平
Table 3 The serum IL-6, IL-12, TNF-α, and IFN-γ levels in mice

表4 小鼠肾脏组织IL-6、IL-12、TNF-α和IFN-γ水平
Table 4 The IL-6, IL-12, TNF-α, and IFN-γ in renal tissue of mice

2.3 小鼠血清SCr、BUN、TC、TG、TP和ALB水平
由表5可知,模型组小鼠的血清SCr、BUN、TC和TG水平均显著高于其他组(P<0.05),而正常小鼠的血清SCr、BUN、TC和TG水平最低(P<0.05)。与模型组小鼠相比,经LP-HFY09和泼尼松处理小鼠的SCr、BUN、TC和TG水平也有所降低,但还是显著高于正常小鼠(P<0.05)。LP-HFY09可使肾炎小鼠的SCr、BUN、TC和TG水平接近正常水平。另外,TP和ALB血清水平呈相反趋势,各组水平由高到低依次为正常组、泼尼松组、LP-HFY09-H组、LP-HFY09-L组和对照组,各组间均有显著差异(P<0.05)。
表5 小鼠血清SCr、BUN、TC、TG、TP和ALB水平
Table 5 The serum SCr, BUN, TC, TG, TP, and ALB levels in mice

组别c(SCr)/(μmol·L-1)c(BUN)/(mmol·L-1) c(TC)/(mmol·L-1)c(TG)/(mmol·L-1)ρ(TP)/(g·L-1)ρ(ALB)/(g·L-1)正常组57.33±4.15d1.18±0.23e2.11±0.48e1.28±0.34e71.08±4.36a40.83±3.67a模型组153.05±23.08a17.51±2.10a20.32±1.97a16.30±1.12a22.89±2.41e10.62±1.79eLP-HFY09-L组112.03±16.37b13.02±2.21b14.68±1.66b12.08±1.07b40.68±3.41d16.77±2.01dLP-HFY09-H组89.12±15.32c6.62±1.76c7.56±0.67c6.55±0.63c56.03±3.18c28.42±2.63c泼尼松组80.36±16.03c4.33±0.72d5.12±0.70d4.08±0.52d61.28±3.22b33.08±1.63b
2.4 dsDNA阳性率
在治疗后第2、4、6、7、10和12周,通过间接免疫荧光法检测自身抗体dsDNA。结果表明,从第6周末开始,模型组所有小鼠均呈阳性,狼疮性肾炎诱导均成功。LP-HFY09-L组小鼠在第8周末检测为阳性,LP-HFY09-H组和泼尼松组小鼠均在第10周末检测为阳性,这意味着LP-HFY09和泼尼松减慢了小鼠患上狼疮性肾炎的速度,且LP-HFY09和泼尼松的效果接近(表6)。
表6 各组狼疮性肾炎小鼠的dsDNA阳性率 单位:%
Table 6 The dsDNA positive rate of lupus nephritis mice in each group
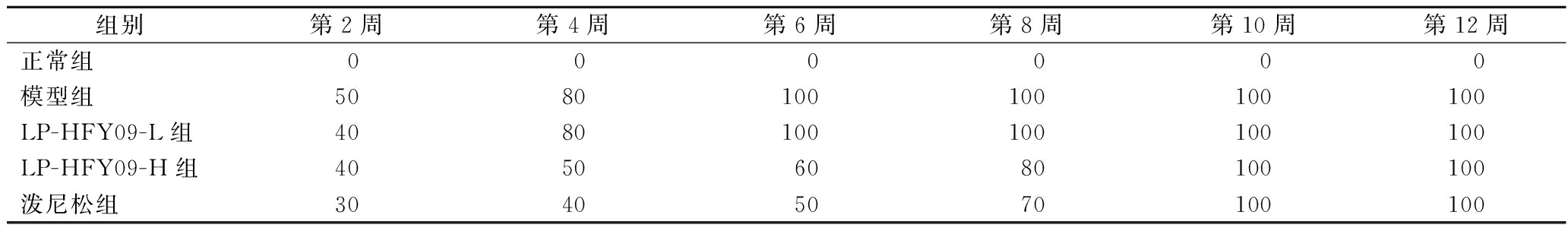
组别第2周第4周第6周第8周第10周第12周正常组00 0 0 0 0模型组5080100100100100LP-HFY09-L组4080100100100100LP-HFY09-H组40506080100100泼尼松组30405070100100
2.5 肾脏组织病理学观察
由图1所示,模型组小鼠肾脏组织出现较为严重的病变,大量的肾小球显示出形态不规则,部分肾小球出现破裂现象,组织间出现严重的炎症细胞浸润现象。正常组小鼠肾小球和细胞结构完整,LP-HFY09和泼尼松都能减轻狼疮性肾炎导致的肾组织病变,减轻肾脏组织损伤。同时,高浓度的LP-HFY09和泼尼松的作用效果较好,都能够促进肾脏的组织形态接近正常组。

a-正常组;b-模型组;c-LP-HFY09-L组;d-LP-HFY09-H组;e-泼尼松组
图1 小鼠肾脏组织的H&E染色切片(200×)
Fig.1 The H&E stained sections of mice kidney tissue (200×)
2.6 小鼠肾组织的mRNA和蛋白表达
如图2所示,模型组小鼠肾组织转化生长因子-β1(transforming growth factor-β1,TGF-β1)和血管内皮生长因子(vascular endothelial growth factor,VEGF)的mRNA和蛋白表达最强,而铜锌超氧化物歧化酶(copper/zinc superoxide dismutase,Cu/Zn-SOD)和锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD)表达最弱(P<0.05)。正常组小鼠的肾组织呈现出相反的趋势,TGF-β1和VEGF的表达最弱,Cu/Zn-SOD和Mn-SOD表达最强(P<0.05)。相比模型组,LP-HFY09和泼尼松能够显著上调狼疮性肾炎小鼠肾组织的Cu/Zn-SOD、Mn-SOD表达和下调TGF-β1、VEGF表达(P<0.05),且高浓度的LP-HFY09和泼尼松的效果显著强于低浓度的LP-HFY09(P<0.05)。

a-mRNA表达;b-蛋白表达
图2 小鼠肾组织中的mRNA和蛋白表达
Fig.2 The mRNA and protein expression in mice kidney tissue
3 讨论
尿蛋白在肾脏病的发生和发展中表现出重要的作用,复杂的综合型肾病中大量蛋白尿是主要病症之一,狼疮性肾炎的主要临床表现就是出现蛋白尿[14]。本研究中建模成功的狼疮性肾炎小鼠也表现出蛋白尿,而LP-HFY09和泼尼松均能够降低狼疮性肾炎小鼠尿液中的蛋白量,起到缓解狼疮性肾炎的作用,且随着LP-HFY09浓度的升高,LP-HFY09的效果也随之增加。SCr和BUN是含氮有机化合物,是蛋白质代谢的最终产物。当肾功能正常时,这些小分子从肾小球滤过。当肾脏受损时,肾小球的滤过能力降低,SCr和BUN含量增加,因此SCr和BUN水平的升高可作为临床诊断肾损伤的指标[15]。过多的胆固醇和甘油三酯是导致高脂血症的原因,当肾病恶化到一定程度时,高钾血症的特征将并存。因此,胆固醇和甘油三酯也可被视为肾功能减退和肾损害的指标[16]。肾病综合征患者因为长期蛋白尿的原因导致血清中的总蛋白显著降低。白蛋白是血清中最常见的蛋白质,白蛋白常用于治疗严重疾病,包括在临床上用于治疗肾病引起的水肿,肾功能不良的情况下总蛋白和白蛋白含量的降低。由此可见,保持血清总蛋白和白蛋白含量的稳定是维持肾功能正常的重要途径[17]。本研究中LP-HFY09和泼尼松也体现出抑制狼疮性肾炎导致的SCr、BUN、胆固醇、甘油三酯升高和总蛋白、白蛋白降低的能力,通过调节这些肾病相关指标起到保护肾脏的作用。
IL-12在狼疮性肾炎自身免疫反应中起重要作用,狼疮性肾炎发病期IL-12水平升高。狼疮性肾炎的特征之一是出现大量自身抗体,IL-12可以促进细胞直接产生自身抗体,IL-12水平的提高进一步导致自身抗体的大量产生,加重病症[18]。IFN-γ作为一种炎症介质,参与了肾炎的整个免疫炎症过程,临床上显示肾小球肾炎患者的IFN-γ水平显著高于正常人群[19]。肾炎发生后,与炎症相关的细胞因子发生变化,血液中与炎症相关的细胞因子,如IL-6、IL-12、TNF-α和IFN-γ的含量也会明显增加[20]。本研究中狼疮性肾炎小鼠的炎症细胞因子IL-6、IL-12、TNF-α和IFN-γ水平较正常小鼠均大幅度上升,而LP-HFY09和泼尼松能够显著抑制这种变化。
狼疮性肾炎中自身反应性抗体的必要过程是通过突变和类别转换为免疫球蛋白G(immunoglobulin G,IgG)。血浆中IgG 抗 dsDNA抗体和免疫复合物等物质在肾小球中的大量沉积导致肾脏损伤,进而引起炎症造成炎症细胞的侵润。另外,高浓度的dsDNA抗体被发现几乎只出现于狼疮性肾炎中,dsDNA抗体对狼疮性肾炎显示出特异性,因此可以作为诊断系统性狼疮性肾炎的指标。临床上狼疮性肾炎患者的肾脏组织多出现肾小球细胞增殖改变和肾小球中性粒细胞浸润等现象[21]。本研究的实验性指标也印证了这些表现,LP-HFY09和泼尼松均能标志性地抑制dsDNA抗体的出现和保护肾脏组织的病理变化。
TGF-β1是机体中最要的促纤维化因子且与包括肾脏在内的脏器纤维化有关,在肾脏疾病中TGF-β1常发生异常表达。肾脏中的TGF-β1是由足细胞和肾小球系膜细胞(glomerular mesangial cells,GMCs)分泌产生的,足细胞通过与内皮细胞之前的相关作用分泌TGF-β1,而GMCs则是在免疫球蛋白A(immunoglobulin A,IgA)的刺激下分泌TGF-β1[22]。在肾脏出现损害后肾小球内皮细胞能够通过VEGF的刺激进行TGF-β1的分泌。TGF-β1和VEGF的表达出现异常是狼疮性肾炎发病后的典型表现,因此调节这2个因子的表达可以有效地控制狼疮性肾炎,对IL-6、IL-12、TNF-α和IFN-γ等炎症细胞因子起到抑制作用[23]。肾炎造成的肾小球炎症与机体自由基的失衡有密切关系。肾脏内产生的氧自由基通过血液进入肾脏的炎性细胞,在吞噬异物或被免疫复合物激活时,氧自由基会大量出现。临床上的炎症性疾病中SOD均能参与调节TGF-β1和VEGF表达[24]。哺乳动物体内SOD是以Cu/Zn-SOD和Mn-SOD的形式发挥作用,调节这2种SOD能够起到控制炎症的作用[25]。LP-HFY09和泼尼松显示出对TGF-β1、VEGF、Cu/Zn-SOD和Mn-SOD表达的调控作用,从而起到干预狼疮性肾炎的作用,且LP-HFY09的效果与其作用浓度呈现正相关。
本研究观察了一株从自然发酵牦牛酸乳中新发现的植物乳杆菌LP-HFY09,通过动物模型验证了LP-HFY09对狼疮性肾炎的干预作用。实验结果显示,LP-HFY09能够缓解狼疮性肾炎造成的小鼠血清和组织炎症病变,特别是LP-HFY09能够调节狼疮性肾炎的标志性表达因子TGF-β1。现在临床上使用的狼疮性肾炎治疗药物普遍有一定的副作用,本研究中泼尼松作为一种副作用小的药物被作为药物阳性对照,通过对比也发现LP-HFY09的作用能够接近泼尼松,可以更健康地干预狼疮性肾炎。由此可见,LP-HFY09具有作为益生菌起到干预狼疮性肾炎的作用,有待进一步通过人体试验进行深入研究和推广。
[1] GAN Y, TONG J, ZHOU X R, et al.Hepatoprotective effect of Lactobacillus plantarum HFY09 on ethanol-induced liver injury in mice[J].Frontiers in Nutrition, 2021, 8:684588.
[2] LI C, FAN Y, LI S, et al.Antioxidant effect of soymilk fermented by Lactobacillus plantarum HFY01 on D-galactose-induced premature aging mouse model[J].Frontiers in Nutrition, 2021, 8:667643.
[3] LI F, LU D Y, ZHONG Q, et al.Lactobacillus fermentum HFY06 reduced CCl4-induced hepatic damage in Kunming mice[J].RSC Advances, 2019, 10(1):1-9.
[4] YI R K, TAN F, LIAO W, et al.Isolation and identification of Lactobacillus plantarum HFY05 from natural fermented yak yogurt and its effect on alcoholic liver injury in mice[J].Microorganisms, 2019, 7(11):530.
[5] GAO Y, ZENG Y, XUE W Y, et al.Anti-IL-12/23 p40 antibody attenuates chronic graft-versus-host disease with lupus nephritis via inhibiting Tfh cell in mice[J].Biomedicine &Pharmacotherapy, 2020, 129:110396.
[6] ZHANG L H, XIAO B, ZHONG M, et al.LncRNA NEAT1 accelerates renal mesangial cell injury via modulating the miR-146b/TRAF6/NF-κB axis in lupus nephritis[J].Cell and Tissue Research, 2020, 382(3):627-638.
[7] SFIKAKIS P P, BOLETIS J N, LIONAKI S, et al.Remission of proliferative lupus nephritis following B cell depletion therapy is preceded by down-regulation of the T cell costimulatory molecule CD40 ligand:An open-label trial[J].Arthritis and Rheumatism, 2005, 52(2):501-513.
[8] LOMAX A R, CALDER P C.Probiotics, immune function, infection and inflammation:A review of the evidence from studies conducted in humans[J].Current Pharmaceutical Design, 2009, 15(13):1 428-1 518.
[9] FU D D, SENOUTHAI S, WANG J J, et al.Vasoactive intestinal peptide ameliorates renal injury in a pristane-induced lupus mouse model by modulating Th17/Treg balance[J].BMC Nephrology, 2019, 20(1):350.
[10] 沈辉, 朱玉强, 孔永, 等.B7-1人-鼠嵌合抗体对小鼠狼疮样肾炎模型的免疫干预效应[J].中国免疫学杂志, 2015, 31(9):1 200-1 205.
SHEN H, ZHU Y Q, KONG Y, et al.Immune intervention effect of human-mouse chimeric antibody B7-1 against murine lupus nephritis model[J].Chinese Journal of Immunology, 2015, 31(9):1 200-1 205.
[11] WANG R R, ZENG X F, LIU B H, et al.Prophylactic effect of Lactobacillus plantarum KSFY06 on HCl/ethanol-induced gastric injury in mice[J].Food &Function, 2020, 11(3):2 679-2 692.
[12] 张宗玮, 陈铖, 王惠明, 等.血清β2微球蛋白水平与系统性红斑狼疮疾病活动度及狼疮性肾损害程度的相关性研究[J].中国全科医学, 2019, 22(17):2 058-2 063.
ZHANG Z W, CHEN C, WANG H M, et al.Correlation of serum β2-microglobulin level with disease activity of systemic lupus erythematosus and degree of lupus nephritis[J].Chinese General Practice, 2019, 22(17):2 058-2 063.
[13] LONG X Y, SUN F J, WANG Z Y, et al.Lactobacillus fermentum CQPC08 protects rats from lead-induced oxidative damage by regulating the Keap1/Nrf2/ARE pathway[J].Food &Function, 2021, 12(13):6 029-6 044.
[14] HAMILTON P, MYERS J, GILLHAM J, et al.Urinary protein selectivity in nephrotic syndrome and pregnancy:Resurrection of a biomarker when renal biopsy is contraindicated[J].Clinical Kidney Journal, 2014, 7(6):595-598.
[15] 李向阳, 孔凡运, 张海清, 等.小鼠抗GBM肾炎模型的复制与鉴定[J].徐州医学院学报, 2011, 31(8):527-530.
LI X Y, KONG F Y, ZHANG H Q, et al.The duplication and identification of anti-glomerular basement membrane (GBM) nephritis model in mice[J].Journal of Jiangxi University of Chinese Medicine, 2011, 31(8):527-530.
[16] 丑安, 周玖瑶, 周园, 等.真武汤对C-BSA渗透泵肾小球肾炎大鼠的治疗作用[J].中药新药与临床药理, 2012, 23(6):626-630.
CHOU A, ZHOU J Y, ZHOU Y, et al.Therapeutic effect of Zhenwu Decoction on chronic glomerulonephritis rat model induced by cationization bovine serum albumin osmotic pump[J].Traditional Chinese Drug Research and Clinical Pharmacology, 2012, 23(6):626-630.
[17] ZHOU T B, LIN S J, YANG S, et al.Efficacy and safety of tacrolimus in induction therapy of patients with lupus nephritis[J].Drug Design, Development and Therapy, 2019, 13:857-869.
[18] 李志坚, 李幼姬, 杨琼琼, 等.IL-12和IgG在狼疮肾炎患者中表达的意义[J].新医学, 2002, 33(1):19-20.
LI Z J, LI Y J, YANG Q Q, et al.Significance of levels of IL-12 and IgG in patients with lupus nephritis[J].New Chinese Medicine, 2002, 33(1):19-20.
[19] 向莉, 高小夏, 潘家荣.慢性肾小球肾炎患者血清IFN-γ、IL-10的变化及意义[J].中国临床医学, 2006, 13(2):269-270;272.
XIANG L, GAO X X, PAN J R.Serum levels of interferon-gamma and interleukin-10 in patients with chronic glomerulonephritis and their clinical significance[J].Chinese Journal of Clinical Medicine, 2006, 13(2):269-270;272.
[20] C RDOVA C, LOPES-E-SILVA F Jr, PIRES A S, et al.Long-term resistance training is associated with reduced circulating levels of IL-6, IFN-γ and TNF-α in elderly women[J].Neuroimmunomodulation, 2011, 18(3):165-170.
RDOVA C, LOPES-E-SILVA F Jr, PIRES A S, et al.Long-term resistance training is associated with reduced circulating levels of IL-6, IFN-γ and TNF-α in elderly women[J].Neuroimmunomodulation, 2011, 18(3):165-170.
[21] YANG S R, HUA K F, CHU L J, et al.Xenon blunts NF-κB/NLRP3 inflammasome activation and improves acute onset of accelerated and severe lupus nephritis in mice[J].Kidney International, 2020, 98(2):378-390.
[22] RAVINAL R C, COSTA R S, COIMBRA T M, et al.Mast cells, TGF-beta1 and myofibroblasts expression in lupus nephritis outcome[J].Lupus, 2005, 14(10):814-821.
[23] ENDREFFY E, T RI S, L
RI S, L SZIK Z, et al.The effects of vitamin E on tissue oxidation in nephrotoxic (anti-glomerular basement membrane) nephritis[J].Pediatric Nephrology, 1991, 5(3):312-317.
SZIK Z, et al.The effects of vitamin E on tissue oxidation in nephrotoxic (anti-glomerular basement membrane) nephritis[J].Pediatric Nephrology, 1991, 5(3):312-317.
[24] LIU Y N, ZHA W J, MA Y, et al.Galangin attenuates airway remodelling by inhibiting TGF-β1-mediated ROS generation and MAPK/Akt phosphorylation in asthma[J].Scientific Reports, 2015, 5(1):11758.
[25] RUI T, CEPINSKAS G, FENG Q P, et al.Delayed preconditioning in cardiac myocytes with respect to development of a proinflammatory phenotype:Role of SOD and NOS[J].Cardiovascular Research, 2003, 59(4):901-911.