发酵香肠是指在自然或人工控制条件下,利用微生物发酵剂使原料肉中蛋白质、脂质及碳水化合物发生一系列生化及物理变化生成小分子物质,形成具有典型风味、色泽和质地,延长保质期的一类肉制品[1]。发酵香肠因发酵和成熟过程形成不同质地、外观和风味,成为深受广大消费者喜好的肉制品之一。因制作方式不同,发酵香肠具有较为明显的地理特征[2],如意大利萨拉米发酵香肠、西班牙干发酵香肠、黎巴嫩大发酵香肠、塞尔维拉特发酵香肠、欧洲干发酵香肠、中国广式香肠等。发酵香肠种类繁多,目前各个国家对发酵香肠分类仍无统一的标准,常见分类主要是按发酵程度和脱水程度划分[3]:(1)发酵程度。以发酵结束后符合世界卫生组织(World Health Organization, WHO)对发酵香肠pH的食用安全要求[4],可分为高酸度发酵香肠(pH>5.3)和低酸度发酵香肠(pH<5.3);(2)脱水程度。按水分含量散失程度可将发酵香肠分为干发酵香肠(水分含量<40%)、半干发酵香肠(水分含量>40%)。低pH和水分含量对于发酵香肠贮藏、缩短发酵周期具有重要作用。发酵香肠独特的风味和质地与微生物发酵剂的活动密切相关。发酵香肠工业化生产过程常接种商业发酵剂,如乳酸菌和葡萄球菌等。乳酸菌属在发酵过程中产生乳酸和乙酸以降低发酵香肠pH,pH降至蛋白等电点以下时蛋白发生胶凝化利于水分渗出,低pH和低水分活度有利于缩短发酵香肠发酵成熟周期;同时乳酸菌代谢产物细菌素(Nisin)可抑制发酵香肠中腐败菌及致病菌生长繁殖,提高发酵香肠安全性[5];葡萄球菌属能够促进亚硝酸盐与肌红蛋白结合,形成亚硝肌红蛋白从而提髙发酵香肠红度值[6];酵母菌分解脂肪、蛋白质和碳水化合物,促进挥发性化合物的产生[7];霉菌水解蛋白质为氨基酸和降解脂肪为脂肪酸,通过延缓酸败和影响其他微生物生理活动等来改善香肠风味[8]。
发酵剂能够改善发酵香肠风味,特别是肉基质中氨基酸的降解会导致挥发性化合物的产生,这些化合物对产品的典型风味具有重要贡献[9]。以支链氨基酸、不饱和脂肪酸为前体物质,分解成低阈值、丰度较高和优良风味的挥发性化合物对于改善发酵香肠的风味具有重要意义。发酵香肠中成熟后气味活性值(odor activity value, OAV)最高的挥发性化合物是2-/3-甲基丁醛、壬醛、己醛和3-甲基丁酸乙酯等,这些物质对风味感官贡献最大[10]。
由于发酵香肠中风味物质含量高且来源广泛,除香辛料带来的风味外,广泛报道的是蛋白质对风味的作用[11],由蛋白水解产生的支链氨基酸在微生物作用下衍生的风味物质——支链醛,其中以3-甲基丁醛带来的麦芽味/异味或坚果味/巧克力味对产品的风味贡献最大。但3-甲基丁醛的来源尚无明确的界定,其产量、产生途径因酶促生物合成途径或温度依赖亮氨酸Strecker降解不同,不同菌株生物合成途径也存在显著差异。本文总结了发酵香肠中3-甲基丁醛对发酵香肠的贡献、合成途径及影响因素。
1 发酵香肠风味物质及其来源
风味是衡量发酵香肠品质的重要指标之一,其风味来源除香辛料外,主要源于蛋白质水解与氧化、脂质水解与氧化,碳水化合物发酵等作用[12],这些生理生化变化都离不开微生物的生理活动。发酵香肠的风味所用的香辛料多为洋葱、胡椒和蒜粉[13]。来自于脂质氧化的风味化合物占比第二,特别是脂质氧化形成C6-C12的中链醛类是所有熟肉肉制品中重要风味物质,庚醛、壬醛和己酸是发酵肉制品中含量最高的3种醛类,其分别是由亚油酸分解产生的具有青草味的己醛、亚麻酸分解产生的具有油脂香味的庚醛和正壬醛[14]。碳水化合物来源于发酵香肠制作过程中添加的葡萄糖、蔗糖等,以提供微生物生长所需要的碳源,以乳酸菌为主的发酵剂利用碳水化合物产生乳酸和乙酸,赋予发酵香肠良好滋味,同时也为形成酯类风味物质奠定了基础[15]。
发酵香肠在发酵和成熟过程中,风味物质种类组成复杂,形成途径多样。但由于发酵香肠加工温度较低,香肠中风味物质主要来源于蛋白质及脂质的降解。尽管来自脂质产生的风味物质含量较高,如己醛、壬醛等,但微生物中的脂酶作用较小,只有30%左右的脂肪水解来自微生物[16]。而微生物参与蛋白质、氨基酸的分解代谢程度较高,肌肉蛋白酶和微生物酶作用下分解蛋白质产生多肽,其自身含量降低20%~40%,经肽酶和氨肽酶水解形成小肽和游离氨基酸[17],其中必需氨基酸(essential amino acids, EAAs)的含量增加2~12倍,其中缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸和蛋氨酸含量明显增多[16]。蛋白水解产生的支链氨基酸(branched-chain amino acid, BCAAs)(亮氨酸、异亮氨酸、缬氨酸)占总游离氨基酸的20%~30%。BCAAs作为前体可分解为3-甲基丁醛/醇/酸、2-甲基丁醛/醇/酸、2-甲基丙醛/醇/酸,这些风味物质对香肠的巧克力/麦芽/坚果风味具有重要贡献,表1所示为支链氨基酸分解产生的支链醛/醇/酸的风味描述及阈值。
表1 BCAAs衍生的挥发性物质的风味描述及其阈值
Table 1 Flavor description and threshold of volatile substances derived from BCAAs

物质名称来源阈值/(μg·kg-1)风味描述3-甲基丁醛3-甲基丁醇3-甲基丁酸亮氨酸0.06麦芽味/水果味/坚果味[16, 18]4.75水果味[16]0.07汗味/奶酪味[16]2-甲基丁醛2-甲基丁醇2-甲基丁酸异亮氨酸0.13麦芽味/水果味/坚果味[16, 18]5.50汗味/奶酪味[16, 19]3.2汗味/奶酪味[16, 20]2-甲基丙醛2-甲基丙醇2-甲基丙酸缬氨酸0.18香蕉味、麦芽味、巧克力味[16, 18]5.25醇味[21]5.3腐臭、汗味[20]
3-甲基丁醛作为发酵香肠中最重要的风味成分,其理想的质量分数范围为73~210 μg/kg,但当3-甲基丁醛的含量超过理想浓度范围时就会造成发酵香肠异味[22]。3-甲基丁醛来源于亮氨酸,亮氨酸生成产物3-甲基丁醛涉及一系列反应,亮氨酸在微生物支链氨基酸转氨酶(branched-chain amino acid aminotransferase, BCAT)、α-酮酸脱羧酶(α-ketoacid decarboxylase, KADC)或α-酮酸脱氢酶(α-ketoacid dehydrogenase, KADH)等的作用下降解产生3-甲基丁醛,产量因酶含量及活力在不同菌株间不同;也受同一菌株间酶活性影响,导致不同条件下途径的重新分配,导致产生3-甲基丁醛的量不同。
2 3-甲基丁醛对发酵香肠的风味贡献
由乳酸菌、葡萄球菌等具有转氨酶活力的发酵剂分解支链氨基酸产生的2-,3-甲基丁醛和2-甲基丙醛,3种支链醛赋予发酵香肠独特风味。其中以3-甲基丁醛最具代表性,原因是3-甲基丁醛较2-甲基丁醛和2-甲基丙醛具有更低的阈值或更高的相对丰度[22]。表2所示是不同菌株分解亮氨酸产3-甲基丁醛含量及其风味作用。
相关BCAAs降解产生挥发性风味物质的报道显示,产生挥发性风味物质的种类取决于作为起始发酵剂的菌株,不同菌株代谢亮氨酸、异亮氨酸和缬氨酸产生的挥发性化合物的含量存在显著差异。一般来说,葡萄球菌代谢BCAAs的能力高于乳酸菌,而葡萄球菌属内菌种之间代谢能力也有差异[16]。以上结果进一步证实了葡萄球菌对发酵香肠中产生挥发性化合物具有重要作用。
表2 菌株相关酶产3-甲基丁醛对产品风味的贡献
Table 2 Contribution of 3-methylbutanal produced by strain related enzymes to product flavor

风味贡献菌株相关酶及其贡献麦芽味、水果味Staphylococcus simulans S52模拟葡萄球菌S52存在代谢亮氨酸的转氨酶;代谢BCAA生成相应的支链醛、醇、酸[16]果香味Lactobacillus sakei, Staphylococcus xylose清酒乳杆菌与木糖葡萄球菌复合菌株经转氨和α-酮酸脱羧酶途径代谢亮氨酸生成3-甲基丁醛[23]麦芽/巧克力Carnobacterium maltaromaticum LMA 28麦芽肉杆菌LMA 28通过α-酮酸脱羧酶途径和α-酮酸脱氢酶途径产生3-甲基丁醛,且KADC强于KADH活性[24]坚果风味Lactococcus lactis ssp.lactis F9乳酸乳球菌亚种 F9具有分解亮氨酸能力,α-酮酸脱氢酶活力高于α-酮酸脱羧活力[25]麦芽味/异味或坚果味/巧克力味Lactobacillus fermentum YZU-06发酵乳杆菌YZU-06和BCAAs复配组产生的甲基支链醇醛、酸的含量显著高于未接菌组和单一接菌[26]可可、杏仁Staphylococcus spp.优势菌株(肠杆菌和葡萄球菌)能够产生BCAT,肠杆菌产生少量BCAT,BCAT特异性分解Leu[27]面包味Staphylococcus xylosus 16, Staphylococcus carnosus 833木糖葡萄球菌16和肉质葡萄球菌833在发酵香肠模型里具有蛋白水解活性、减少硝酸盐以及产3-甲基丁醛能力[28]奶酪味Propionibacterium freudenreichii费氏丙酸杆菌分解氨基酸(支链、芳香族和含硫氨基酸)产生风味化合物,揭示相关代谢途径[29]醛和羧酸风味Staphylococcus xylosus DD-34木糖葡萄球菌DD-34在氧化条件利于降解亮氨酸为3-甲基丁酸且添加NaCl会影响发酵香肠中BCAAs挥发性化合物的比例[30]干香肠风味Staphylococcus xylosus DD-34木糖葡萄球菌DD-34对甲基支链氨基酸表现出高亲和力,分解α-酮异己酸脱羧成3-甲基丁醛,然后迅速氧化成相应的酸[31]酱香Lactiplantibacillus plantarum LM34∶Staphylococcus carnosus SAB18∶Wickerha-momyces anomalus YE3为2∶1∶1复合发酵剂的产物3-甲基丁醛能够产生良好风味,有助于提高牛肉口感,可以使肉制品产生良好的酱香[32]
3 3-甲基丁醛形成的限速酶
3-甲基丁醛的形成始于支链氨基酸转氨酶降解支链氨基酸(BCAAs)生成α-酮异己酸。支链氨基酸氨基转移酶(branched-chain amino acid aminotransferase, BCATs),广泛存在于微生物中[33],属于转氨酶类(amino acid aminotransferase, ATs)中的第Ⅳ类转氨酶,能可逆地催化BCAAs与α-酮戊二酸生成相应的酮酸和谷氨酸,是所有有机体中BCAAs代谢的关键酶[34]。支链氨基酸转氨酶作为亮氨酸降解产生3-甲基丁醛的第一个限速步骤酶,几项研究表明,转氨酶的基因型的存在及表现型在细菌种类和菌株之间差异很大,敲除乳酸乳球菌支链氨基转氨酶基因导致大约90%的亮氨酸转氨减少,其余10%可能来源于芳香族氨基酸或甲硫氨酸的非特异性转氨酶作用[35]。
因发酵香肠中肉蛋白内源酶的数量有限,并且在发酵和干燥期间酶的活性容易受到抑制,为了规范生产过程,接种发酵剂成为缩短发酵时间、增强风味和提高发酵香肠品质的重要途径[36]。在发酵香肠制作时加入发酵剂,对蛋白质、脂质分解产生风味具有重要作用。目前用作肉类发酵剂的主要细菌属有微球菌、乳酸杆菌和片球菌等。微球菌具有其硝酸盐还原能力和过氧化氢酶活性;乳酸杆菌和片球菌具有较强产酸和产细菌素能力。将这些选定的微生物发酵剂添加到肉制品中,可以更好地确保产品的安全性、缩短发酵时间,并延长货架期。微生物发酵剂是可用于确保产品符合要求的加工工序之一[4]。
目前国内外关于BCAAs的研究主要集中在高转氨酶活力菌株的筛选,BCAT作为分解BCAAs产生3-甲基丁醛的第一个限速步骤,了解转氨酶的酶学性质是研究菌株发挥作用的重要前提。BCAT作为亮氨酸向α-酮异己酸转化的中间连接酶,学者往往以转氨酶活力衡量菌株生成3-甲基丁醛的潜力。王晶[37]从土壤中分离到1株具有支链氨基酸转氨酶活性的Bacillus cereus WJ44,亮氨酸转氨酶活性达45.787U/mL;杜楠[38]和陆辰燕[26]优化电化学检测体系测定转氨酶方法,筛选出高转氨酶的Lactobacillus casei L14和Lactobacillus fermentum YZU-06(酶活力为65 U/L)。这些研究表明,具有转氨酶活力的菌株是有产3-甲基丁醛应用潜力的发酵剂。
4 3-甲基丁醛的产生途径
原料肉中肌浆蛋白在肌肉蛋白酶(组织蛋白酶)作用下水解为短链肽或游离氨基酸,小肽经氨肽酶作用生成游离氨基酸,后者经微生物转运蛋白运输到微生物细胞内,在微生物胞内酶的作用下生成产物由自由扩散作用下排出体外,在微生物酶的参与反应过程被称为生物合成途径;非酶参与、较高温度下亮氨酸降解为3-甲基丁醛被称为Strecker化学降解。3-甲基丁醛的产生途径可分为生物合成和化学降解途径,关于发酵香肠中3-甲基丁醛的产生是生物合成途径或化学降解途径,或是两种途径同时在发酵香肠中发挥作用,目前研究报道较少。
4.1 3-甲基丁醛生物合成途径
3-甲基丁醛的生物合成途径始于BCAT降解亮氨酸为α-酮异己酸,经转氨酶和5′-磷酸吡哆醛依赖性酶的作用将氨基转移给α-酮戊二酸(α-ketoglutarate, α-KG),具有谷氨酸脱氢酶(glutamate dehydrogenase, GDH)活性的菌株能够实现α-酮戊二酸(α-ketoglutarate, α-KG)和谷氨酸(glutamate, Glu)的循环并产生α-酮异己酸(α-ketoisocaproic acid, KIC),α-酮戊二酸作为氨基受体,可使NAD+转化为NADH[39]。α-酮异己酸可分解为各种风味物质,例如3-甲基丁酸(汗味/奶酪味)、3-甲基丁醛(麦芽味/水果味/坚果味)、3-甲基丁醇(水果味)以及非芳香化合物(α-羟基异己酸)(图1),α-羟基异己酸没有任何风味,也不作为风味化合物的前体[35]。这些产物经微生物酶的作用排出体外发挥风味作用。如图1所示,理想状况下外源添加α-酮戊二酸可增强亮氨酸向3-甲基丁醛的转变,提高α-酮戊二酸的可用性导致亮氨酸转化率增加,向凝乳中添加α-酮戊二酸时,氨基酸转化率的增加证实了这一点[40-41]。上述研究证明只有在氨基受体α-酮戊二酸存在的情况下亮氨酸才能被降解[29]。
目前香肠中氨基酸分解代谢的研究大部分针对支链氨基酸,因为它们在香气发展中起着关键作用。将氨基酸转化为风味化合物的主要途径有两种:由氨基酸裂解酶催化的消除反应和由氨基酸氨基转移酶引发的途径[42]。这些化合物的产生主要取决于菌株的酶含量,例如,一些菌株因高α-酮酸脱羧酶活性而产生醛类和醇类,而其他一些菌株经α-酮酸脱氢酶或α-羟基酸脱氢酶产生羧酸或羟基酸[43]。代谢物的产生也受到环境因素的影响,如pH值和NaCl浓度等影响酶活性的因素[44]。α-酮异己酸作为亮氨酸分解的中间体,分解途径可能通过非氧化脱羧的直接途径(α-ketoacid decarboxylase,KADC)和氧化脱氢的间接途径(α-ketoacid dehydrogenase,KADH)或者两种途径同时存在且产生3-甲基丁醛,其途径高度依赖于菌株和物种[25]。比如乳酸菌主要是由α-酮酸脱羧酶的作用产生的醛,然后被氧化成酸或还原为醇。相反,在瑞士乳杆菌和嗜热链球菌中参与α-酮酸转化为酸的酶是一种α-酮酸脱氢酶,可产生酰基-CoA[45]。
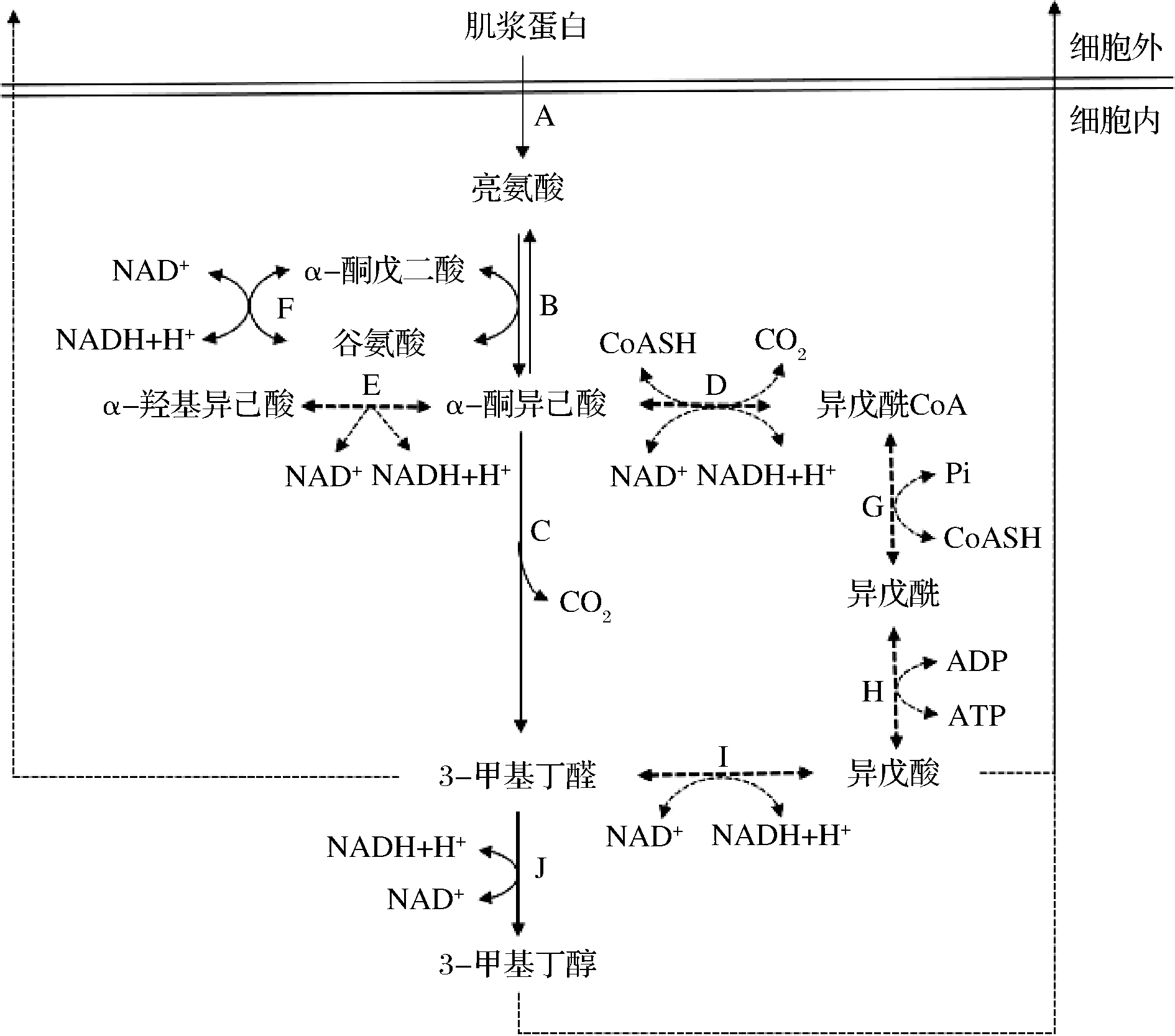
实线箭头(→)表示直接途径,虚线箭头(→)表示间接途径
A-蛋白酶;B-转氨酶;C-α-酮酸脱羧酶;D-α-酮酸脱氢酶;E-α-羟基脱氢酶;F-谷氨酸脱氢酶;G-酰基激酶;H-磷酸转移酶;I-醛脱氢酶;J-醇脱氢酶
图1 发酵香肠中亮氨酸分解3-甲基丁醛生物合成途径
Fig.1 Biosynthetic pathway of leucine decomposing 3-methylbutanal in fermented sausage
关于不同菌株产3-甲基丁醛的直接/间接代谢途径,近年多采用标记亮氨酸体外分解实验以判定菌株代谢途径[46],以L-[4,5-3H]-亮氨酸或氚代亮氨酸检测亮氨酸的降解情况,通过LC-MS监测中间代谢产物及终产物的含量分布情况来判定,对于表征菌株分解亮氨酸产3-甲基丁醛代谢途径具有潜在应用价值[46-47]。
4.1.1 α-酮酸脱羧途径(KADC)
α-酮酸脱羧酶是一种典型的硫胺素焦磷酸酶,以硫胺素二磷酸(维生素B1辅酶)和Mg2+作为辅助因子,进行α-酮异己酸原位脱羧。KADC作为α-酮异己酸的直接途径向3-甲基丁醛脱羧限速步骤酶,文献记载α-酮酸脱羧酶仅存在于少数菌株中[43]。α-酮异己酸经α-酮酸脱羧酶非氧化脱羧为3-甲基丁醛(如图2所示),脱羧反应进程中,质子被消耗,产物从细胞中输出,导致细胞内pH值升高[48]。醛被醛脱氢酶氧化为酸或经醇脱氢酶还原为醇[45],且pH值降低至4.5会增加醇和醛的产量,而不影响酸的产生[9]。除醛脱氢酶和醇脱氢酶的氧化还原作用外,之所以醛相对容易地还原成相应的醇或氧化成相应的酸取决于醛基基团自身的性质(氢原子键合的碳原子和氧原子双键合的碳原子组成,称为醛基,O![]() CH—)。带负电的氧原子引起的醛基中略带正电的碳原子易受到亲核试剂的攻击,使得醛具有相对的反应性,所以检测到的醛浓度通常较低[49]。
CH—)。带负电的氧原子引起的醛基中略带正电的碳原子易受到亲核试剂的攻击,使得醛具有相对的反应性,所以检测到的醛浓度通常较低[49]。

图2 3-甲基丁醛KADC生物合成途径
Fig.2 3-methylbutanal KADC biosynthesis pathway
由于3-甲基丁醛/醇/酸的不同比例,且醇与酸的气味阈值高于醛,相对含量通常高于醛,以期提高3-甲基丁醛含量,使发酵香肠中风味更加协调。在乳酸乳球菌中,氧化条件有利于通过KADC活性将α-酮异己酸转化为3-甲基丁醛,可解释为氧化条件或α-酮异己酸的积累对酶活性的直接刺激而提高酶活力,从而减少向α-羟基异己酸的转化,减少α-酮异己酸向α-羟基异己酸的转化以增强前者积累而提高3-甲基丁醛含量往往是产3-甲基丁醛所期待的[50]。这也证实了3-甲基丁醛的产生可能会受到氧气的影响,即细胞外氧化还原电位(Eh)。这种氧化还原电势导致直接和间接途径之间的重新分配。这两种途径的转变可能是不同食品中的各种氧化还原条件下分解代谢BCAA的优势。
脱羧酶表征表明,该酶在奶酪成熟条件下具有活性,最高的活性是在碳链长度为4~6个碳原子的支链和直链α-酮酸上起作用,但甲硫氨酸、苯丙氨酸和色氨酸的中间产物也可被转化,尽管转化率相对较低,表明脱羧酶可能特异性分解亮氨酸产物的α-酮异己酸[44]。
4.1.2 α-酮酸脱氢酶途径(KADH)
α-酮异己酸形成3-甲基丁醛的非氧化脱氢被称为间接途径,涉及一系列酶及中间代谢产物,其中KADH是含有α-酮酸脱氢酶(亚基E1-α和E1-β)、二氢硫辛酰转酰基酶(E2)和二氢硫辛酰脱氢酶(E3)作为催化成分的多酶复合物(E1-α、E1-β、E2和E3四种多肽组成)。E1使用焦磷酸硫胺素(thiamine pyrophosphate, TPP)和Mg2+作为辅因子,催化α-酮酸的脱羧和酰基氧化转移到E2的脂酰部分,E2催化酰基转移至二氢硫辛酰胺,最后,生成的二氢硫辛酰胺被E3组分氧化回二硫化物形式,NAD+作为辅因子会导致酰基-CoA的形成及NAD+还原为NADH[24]。然后通过ptb基因产物(phosphotransferase, PTA)生成异戊酰和buk基因产物(acylkinase, ACK)的酰基-CoA水解酶联合作用以及伴随的ADP磷酸化转化为异戊酸[51],异戊酸一部分在醛脱氢酶作用下还原为3-甲基丁醛(如图3)。研究表明,木糖链球菌中3-甲基丁酸的产生是在稳定生长期开始时并开始积累,而直接途径的直接前体3-甲基丁醛,被证明在指数生长期仅短暂存在[30]。

图3 3-甲基丁醛KADH生物合成途径
Fig.3 3-methylbutanal KADH biosynthesis pathway
亚砷酸钠(NaAsO2)是一种特异性抑制剂[24],NaAsO2抑制KADH实验表明,NaAsO2与硫辛酰胺的SH基团结合,使KADH酶复合物不稳定,导致α-酮异己酸向3-甲基丁酸的转化路径被掐断,使得异戊酸含量急剧减少,因此被用作判定3-甲基丁醛生物合成的直接途径和间接途径的抑制剂。
KADH是α-酮异己酸的氧化脱氢向3-甲基丁醛转化的另一控速步骤。同时存在直接途径和间接途径的微生物中,α-酮酸脱醛产生的酸也受细胞内的还原环境影响。氧化还原电势对直接和间接途径之间的重新分配导致3-甲基丁醛/醇/酸的比例,氧化电势利于α-酮酸脱羧途径的进行而提高醛的含量,还原电势利于α-酮酸脱氢途径提高醇含量。然后,这两种途径的不同功能可能是一个优势,以便在不同食品中的各种氧化还原条件下分解代谢BCAAs[50]。
经筛选,在发酵香肠中介导亮氨酸产3-甲基丁醛的菌株并不多,兼具KADC酶和KADH酶的菌株更少,截至目前的研究报道,仅LUO等[25]筛选得到1株麦芽肉杆菌LMA 28和AFZAL等[24]筛选得到1株乳酸乳球菌亚种F9均兼具有KADC酶和KADH酶。不同菌株分解亮氨酸产3-甲基丁醛的途径(KADC酶和KADH复合酶系)由编码基因决定。然而,3-甲基丁醛的产生与编码代谢途径的基因之间的关系尚未明确[52],决定KADC和KADH途径的走向取决于相关基因的表达模式。然而,不同基因表达模式与高/低产3-甲基丁醛菌株的对应关系;支链氨基酸转氨酶(branched-chain amino acid aminotransferase, BCAT)、α-羟基脱氢酶(α-hydroxyacid dehydrogenase, α-HADH)、酰基激酶(acylkinase, ACK)、磷酸转移酶(phosphotransferase, PTA)、醛脱氢酶(alcohol dehydrogenase, AlcDH)、醇脱氢酶(aldehyde dehydrogenase, AldDH)等参与3-甲基丁醛和生物合成途径的酶,其表达式模式和基因型的对应关系有待进一步探究。后期针对不同菌株产3-甲基丁醛的产量结合基因组学、系统发育树、基因背景研究亮氨酸形成风味化合物的关键酶的功能注释。分析参与支链氨基酸代谢相关酶,总结风味化合物的前体降解产生3-甲基丁醛的相关机制,对各种菌株的比较分析得出了其风味形成能力差异的总体观点。
4.2 3-甲基丁醛化学降解途径
亮氨酸产生3-甲基丁醛的非酶反应来源于Strecker降解,Strecker降解对产品形成棕色色泽和良好风味极为重要[49]。Strecker降解作为美拉德的中间步骤,如果美拉德反应可以看作是氨基化合物催化的糖降解,则Strecker降解可以看作是由反应性羰基物质(reactive carbonyl substances, RCS)引发的氨基酸降解。美拉德反应开始于氨基与还原糖的缩合形成席夫碱,然后环化为N-取代的醛糖胺,通过Amadori重排形成氨基-脱氧醛糖或酮糖,由于其重排产物结构不稳定又形成二羰基化合物。这种二羰基与氨基酸的反应产生具有香味活性的醛类,称为Strecker降解[53]。亮氨酸通过Strecker降解生成二氧化碳和比亮氨酸少1个碳原子的3-甲基丁醛以及羟基胺,反应涉及氧化脱氨作用、脱羧、脱水等过程[12, 54]。反应途径如图4所示。
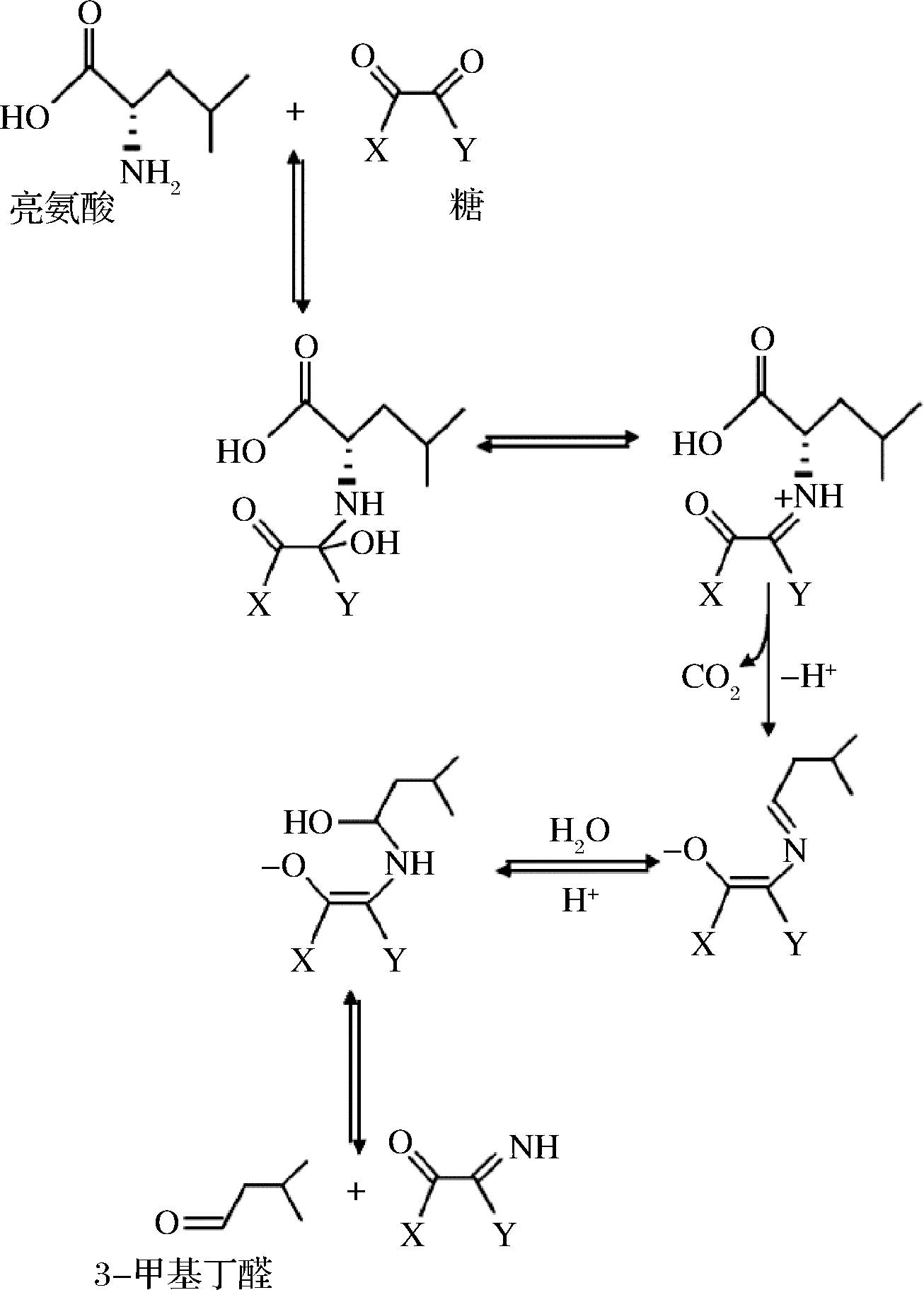
图4 亮氨酸的Strecker降解途径
Fig.4 Strecker degradation pathway of leucine
高尧来等[55]总结Strecker反应是形成大多数风味化合物的主要途径,二羰基化合物通过Strecker反应降解氨基酸形成挥发性含硫化合物,产生类似肉的风味。Strecker降解的产物3-甲基丁醛散发辛辣味、可可味、苹果味、奶酪味、麦芽味香气,风味生成反应通常伴随较高的温度,比如煮熟的绿豆中鉴定出来源于亮氨酸的3-甲基丁醛,它的主要形成途径似乎是通过高温催化下Strecker降解的氧化脱氨-脱羧反应[56];RAINER等[57]提出温度依赖性Strecker降解氨基酸产生支链醛。这些研究都表明Strecker降解亮氨酸产生醛需要较高温度的共性。
为减少发酵香肠发酵成熟过程中腐败菌和致病菌的生长繁殖,香肠发酵温度一般是15~30 ℃[58],导致发酵香肠中Strecker降解亮氨酸产生醛的过程进行地极为缓慢。但是考虑发酵香肠烹调食用时要经过某种热处理,由于发酵香肠存在蛋白质和碳水化合物,有利于形成支链醛的生成条件。除了化学形成之外,在许多食物的发酵过程中也会形成支链醛,发酵和热处理相结合有利于形成最佳风味[49]。推测发酵香肠中发酵成熟期间3-甲基丁醛的产生以生物合成途径为主,可能在烹调时以Strecker途径为主。
5 影响3-甲基丁醛产生的因素
发酵香肠中亮氨酸分解成3-甲基丁醛的代谢途径取决于加工中所选用发酵剂的物种特异性,如常见肉制品发酵剂:乳酸菌、葡萄球菌、酵母菌、霉菌[8]。因其菌株生成3-甲基丁醛的不同途径、菌株体内不同氧化还原电势对直接途径和间接途径的重排导致不同生物合成途径,除此之外还受加工温度对亮氨酸Strecker降解影响。已有文献报道关于增加3-甲基丁醛含量策略,包括外源添加底物或微生物连接酶;外源添加亮氨酸或不同比例支链氨基酸,添加α-酮异己酸经α-酮酸脱羧酶一步生成3-甲基丁醛;筛选高效分解亮氨酸产3-甲基丁醛菌株;或者基因敲除α-羟基酸脱氢酶基因以减少α-酮异己酸向α-羟基异己酸的转变而积累3-甲基丁醛。以上代谢途径中有关积累3-甲基丁醛含量的调控策略已有综述报道[22, 59]。
发酵香肠菌株多样,如将单一菌株作为发酵剂,或将不同菌属复配菌株作为发酵剂以满足商业发酵香肠特殊化需求,有助于产品形成良好的风味。添加外源发酵剂对发酵香肠风味生成起着关键作用。乳酸菌主要起到酸化作用,而凝固酶阴性的葡萄球菌则可以代谢氨基酸和脂质对香味起到重要作用,研究表明葡萄球菌可生成挥发性化合物中一些甲基化支链醛、醇类、酸类。挥发性化合物3-甲基丁醇主要来源于像木糖葡萄球菌和肉葡萄球菌等降解亮氨酸生成。这些香味物质也可由清酒乳杆菌、植物乳杆菌等生成,但生成数量较少。除此之外,发酵香肠发酵环境条件,如温度、pH值、盐添加量等对发酵肉制品风味组成及其物质含量也具有重要影响[50, 60-61]。温度对木糖葡萄球菌或肉葡萄球菌产生的3-甲基丁醛有影响,较高温度会引起美拉德反应,生成较多熟肉香味的挥发性香味物质。pH影响菌株的生长繁殖,过高或过低的pH都不适宜菌株的生长,从而影响菌株风味相关酶的活性。盐含量对发酵香肠脂质氧化和风味形成具有较大的影响,盐自身具有呈味作用,含量大小会影响脂肪氧合酶、蛋白质水解酶等活性,进而影响着肉制品的风味。低含量盐降低产品口感、多汁性及香味而影响产品品质等。结果表明腌制盐用量与总醛类含量呈正相关,与醇、酮、烷烃等风味化合物呈显著负相关。随着盐含量增加,3-甲基丁醛积累呈现増加的变化。表明适当的盐使用量有助于提高肉制品风味含量组成和感官品质。细胞外氧化还原电势可以改变菌株的代谢通量,氧化或还原剂添加到培养基中仅略微改变了分解代谢亮氨酸产物3-甲基丁醛/醇/酸的总百分比[50]。
6 小结
目前3-甲基丁醛是许多食品中重要的风味化合物,包括发酵和非发酵(热处理)食品。加强对这些风味化合物生成途径的了解对于调控醛的形成和含量尤为重要。支链氨基酸代谢对于风味贡献具有重要作用,3-甲基丁醛对发酵香肠和奶酪等发酵食品中风味贡献显著。目前关于发酵剂介导亮氨酸产3-甲基丁醛的研究多集中于亮氨酸体系或者肌原纤维蛋白体系,但实际上,发酵香肠的风味来源远比这些途径复杂,风味物质来源的界限不是那样清晰,比如,醋酸或醇,主要来自碳水化合物的发酵,但也可来源于脂肪或氨基酸代谢。表明风味物质的来源并不如理论上揭示的那样简单,可能来源于发酵香肠基质复杂的网络交叉,因此对发酵香肠风味的研究仍需要更深的挖掘。而且氨基酸形成风味取决于复杂的反应网络过程,微生物发酵剂的转氨酶既能分解支链氨基酸、芳香氨基酸和甲硫氨基酸,或者非特异性芳香族支链氨基酸转氨酶也能分解BCAAs产生3-甲基丁醛,以及热反应引起Strecker降解亮氨酸所带来的风味,这些因素可能同时影响亮氨酸产生3-甲基丁醛的含量,有助于风味化合物的平衡。所以,在发酵香肠模型里风味来源的界定仍需投入很大的精力。相信,风味作为发酵香肠吸引消费者的重要品质属性之一,这方面的研究仍将是今后发酵香肠的热点,这对于指导发酵香肠生产及发酵香肠产生风味物质具有重要意义。
[1] CASABURI A, ARISTOY M C, CAVELLA S, et al.Biochemical and sensory characteristics of traditional fermented sausages of Vallo di Diano (Southern Italy) as affected by the use of starter cultures[J].Meat Science, 2007, 76(2):295-307.
[2] SUZZI G, GARDINI F.Biogenic amines in dry fermented sausages:A review[J].International Journal of Food Microbiology, 2003, 88(1):41-54.
[3] 刘英丽, 杨梓妍, 万真, 等.发酵剂对发酵香肠挥发性风味物质形成的作用及影响机制研究进展[J].食品科学, 2021, 42(11):284-296.
LIU Y L, YANG Z Y, WAN Z, et al.Progress in understanding the effect and mechanism of starter cultures on the formation of volatile flavor compounds in fermented sausage[J].Food Science, 2021, 42(11):284-296.
[4] ROCA M, INCZE K.Fermented sausages[J].Food Reviews International, 1990, 6(1):91-118.
[5] FRAQUEZA M J.Antibiotic resistance of lactic acid bacteria isolated from dry-fermented sausages[J].International Journal of Food Microbiology, 2015, 212:76-88.
[6] ROSENSTEIN R, NERZ C, BISWAS L, et al.Genome analysis of the meat starter culture bacterium Staphylococcus carnosus TM300[J].Applied and Environmental Microbiology, 2009, 75(3):811-822.
[7] LIU Y L, WAN Z, YOHANNES K W, et al.Functional characteristics of Lactobacillus and yeast single starter cultures in the ripening process of dry fermented sausage[J].Frontiers in Microbiology, 2020, 11:611260.
[8] LEROY F, VERLUYTEN J, DE VUYST L.Functional meat starter cultures for improved sausage fermentation[J].International Journal of Food Microbiology, 2006, 106(3):270-285.
[9] DUR M A, FLORES M, TOLDR
M A, FLORES M, TOLDR F.Effect of growth phase and dry-cured sausage processing conditions on Debaryomyces spp.generation of volatile compounds from branched-chain amino acids[J].Food Chemistry, 2004, 86(3):391-399.
F.Effect of growth phase and dry-cured sausage processing conditions on Debaryomyces spp.generation of volatile compounds from branched-chain amino acids[J].Food Chemistry, 2004, 86(3):391-399.
[10] OLIVARES A, NAVARRO J L, FLORES M.Establishment of the contribution of volatile compounds to the aroma of fermented sausages at different stages of processing and storage[J].Food Chemistry, 2009, 115(4):1 464-1 472.
[11] ZHANG J, KANG D C, ZHANG W G, et al.Recent advantage of interactions of protein-flavor in foods:Perspective of theoretical models, protein properties and extrinsic factors[J].Trends in Food Science &Technology, 2021, 111:405-425.
[12] SHI Y N, LI X, HUANG A X.A metabolomics-based approach investigates volatile flavor formation and characteristic compounds of the Dahe black pig dry-cured ham[J].Meat Science, 2019, 158:107904.
[13] 刘静, 吴晓彤.发酵肉制品的风味物质来源及其研究进展[J].内蒙古科技与经济, 2016(15):95-96.
LIU J, WU X T.Source and research progress of flavor substances in fermented meat products[J].Inner Mongolia Science Technology &Economy, 2016(15):95-96.
[14] NIETO G, BA
 N S, DOLORES GARRIDO M.Effect of supplementing ewes’ diet with thyme (Thymus zygis ssp.gracilis) leaves on the lipid oxidation of cooked lamb meat[J].Food Chemistry, 2011, 125(4):1 147-1 152.
N S, DOLORES GARRIDO M.Effect of supplementing ewes’ diet with thyme (Thymus zygis ssp.gracilis) leaves on the lipid oxidation of cooked lamb meat[J].Food Chemistry, 2011, 125(4):1 147-1 152.
[15] 刘战丽, 罗欣.发酵肠的风味物质及其来源[J].中国调味品, 2002, 27(10):32-35.
LIU Z L, LUO X.Flavour components and its origins in fermented sausage[J].Chinese Condiment, 2002, 27(10):32-35.
[16] 王海燕. 湖南腊肉源产香葡萄球菌的筛选、鉴定及其产香机理研究[D].北京:中国农业大学, 2005.
WANG H Y.Identification of Staphylococcus spp.isolated from Hunan bacon and its mechanism of aroma-production[D].Beijing:China Agricultural University, 2005.
[17] YU D, FENG M Q, SUN J, et al.Protein degradation and peptide formation with antioxidant activity in pork protein extracts inoculated with Lactobacillus plantarum and Staphylococcus simulans[J].Meat Science, 2020, 160:107958.
[18] MUGULA J K, NNKO S A M, NARVHUS J A, et al.Microbiological and fermentation characteristics of Togwa, a Tanzanian fermented food[J].International Journal of Food Microbiology, 2003, 80(3):187-199.
[19] MONTEL M C, MASSON F, TALON R.Bacterial role in flavour development[J].Meat Science, 1998, 49:S111-S123.
[20] BRENNAND C P, HA J K, LINDSAY R C.Aroma properties and thresholds of some branched-chain and other minor volatile fatty acids occurring in milkfat and meat lipids[J].Journal of Sensory Studies, 1989, 4(2):105-120.
[21] SHELDON R M, LINDSAY R C, LIBBEY L M, et al.Chemical nature of malty flavor and aroma produced by Streptococcus lactis var.maltigenes[J].Applied Microbiology, 1971, 22(3):263-266.
[22] AFZAL M I, ARICEAGA C C, BOULAHYA K A, et al.Biosynthesis and role of 3-methylbutanal in cheese by lactic acid bacteria:Major metabolic pathways, enzymes involved, and strategies for control[J].Critical Reviews in Food Science and Nutrition, 2017, 57(2):399-406.
[23] 王德宝. 混合发酵剂对发酵羊肉香肠理化品质及生物胺的影响[D].呼和浩特:内蒙古农业大学, 2015.
WANG D B.Effects of combined fermentation agents on the physicochemical quality and biogenic amines[D].Hohhot:Inner Mongolia Agricultural University, 2015.
[24] AFZAL M I, DELAUNAY S, PARIS C, et al.Identification of metabolic pathways involved in the biosynthesis of flavor compound 3-methylbutanal from leucine catabolism by Carnobacterium maltaromaticum LMA 28[J].International Journal of Food Microbiology, 2012, 157(3):332-339.
[25] LUO J, JIANG C B, ZHAO L, et al.Keto acid decarboxylase and keto acid dehydrogenase activity detected during the biosynthesis of flavor compound 3-methylbutanal by the nondairy adjunct culture Lactococcus lactis ssp.lactis F9[J].Journal of Dairy Science, 2018, 101(11):9 725-9 735.
[26] 陆辰燕. BCAT菌株和蛋白酶菌株复配及对发酵香肠风味的作用研究[D].扬州:扬州大学, 2021.
LU C Y.Study on the mixed starter of BCAT active strain and protease active strain and the effect of the mixed starter on the flavor of fermented sausage[D].Yangzhou:Yangzhou University, 2021.
[27] YANG J, WU S L, MAI R J, et al.Formation of amino acid-derived volatile compounds in dry-cured mackerel (Scomberomorus niphonius):Metabolic pathways involving microorganisms, precursors, and intermediates[J].Food Chemistry, 2021, 364:130163.
[28] VERGNAIS L, MASSON F, MONTEL M C, et al.Evaluation of solid-phase microextraction for analysis of volatile metabolites produced by staphylococci[J].Journal of Agricultural and Food Chemistry, 1998, 46(1):228-234.
[29] THIERRY A, MAILLARD M B.Production of cheese flavour compounds derived from amino acid catabolism by Propionibacterium freudenreichii[J].Le Lait, 2002, 82(1):17-32.
[30] BECK H C, HANSEN A M, LAURITSEN F R.Catabolism of leucine to branched-chain fatty acids in Staphylococcus xylosus[J].Journal of Applied Microbiology, 2004, 96(5):1 185-1 193.
[31] BECK H C, HANSEN A M, LAURITSEN F R.Metabolite production and kinetics of branched-chain aldehyde oxidation in Staphylococcus xylosus[J].Enzyme and Microbial Technology, 2002, 31(1-2):94-101.
[32] 杨晓钢, 赵鑫锐, 堵国成.低酸牛肉发酵剂的筛选、工艺优化及品质特性研究[J].食品与发酵工业, 2022, 48(19):185-195.
YANG X G, ZHAO X R, DU G C.Screening, fermentation condition optimization and quality evaluation of commercial low acidity fermented beef starter[J].Food and Fermentation Industries, 2022, 48(19):185-195.
[33] SMIT G, SMIT B A, ENGELS W J M.Flavour formation by lactic acid bacteria and biochemical flavour profiling of cheese products[J].FEMS Microbiology Reviews, 2005, 29(3):591-610.
[34] 郑欣欣. 一种假单胞菌来源的支链氨基酸氨基转移酶的酶学性质研究及晶体结构解析[D].乌鲁木齐:新疆大学, 2019.
ZHENG X X.Enzymatic properties and crystal structure analysis of branched-chain amino acid aminotransferase from Pseudomonas sp.[D].Urumqi:Xinjiang University, 2019.
[35] LIU M J, NAUTA A, FRANCKE C, et al.Comparative genomics of enzymes in flavor-forming pathways from amino acids in lactic acid bacteria[J].Applied and Environmental Microbiology, 2008, 74(15):4 590-4 600.
[36] WANG H, XU J H, LIU Q, et al.Effect of the protease from Staphylococcus carnosus on the proteolysis, quality characteristics, and flavor development of Harbin dry sausage[J].Meat Science, 2022, 189:108827.
[37] 王晶. 支链氨基酸转氨酶产生菌的筛选及其发酵条件的优化[D].无锡:江南大学, 2008.
WANG J.Screening and fermentation optimization of branched-chain amino acid aminotransferase-producing strain[D].Wuxi:Jiangnan University, 2008.
[38] 杜楠. 高产BCAT菌株筛选及其电化学检测体系的建立与应用[D].扬州:扬州大学, 2017.
DU N.Screening of BCAT-producing strain and establishment and application of electrochemical detection system[D].Yangzhou:Yangzhou University, 2017.
[39] DE ANGELIS M, CALASSO M, DI CAGNO R, et al.NADP-glutamate dehydrogenase activity in nonstarter lactic acid bacteria:Effects of temperature, pH and NaCl on enzyme activity and expression[J].Journal of Applied Microbiology, 2010, 109(5):1 763-1 774.
[40] BANKS J M, YVON M, GRIPON J C, et al.Enhancement of amino acid catabolism in Cheddar cheese using α-ketoglutarate:Amino acid degradation in relation to volatile compounds and aroma character[J].International Dairy Journal, 2001, 11(4-7):235-243.
[41] YVON M, BERTHELOT S, GRIPON J C.Adding α-ketoglutarate to semi-hard cheese curd highly enhances the conversion of amino acids to aroma compounds[J].International Dairy Journal, 1998, 8(10-11):889-898.
[42] STEELE J, BROADBENT J, KOK J.Perspectives on the contribution of lactic acid bacteria to cheese flavor development[J].Current Opinion in Biotechnology, 2013, 24(2):135-141.
[43] SMIT B A, ENGELS W M, WOUTERS J M, et al.Diversity of L-leucine catabolism in various microorganisms involved in dairy fermentations, and identification of the rate-controlling step in the formation of the potent flavour component 3-methylbutanal[J].Applied Microbiology and Biotechnology, 2004, 64(3):396-402.
[44] DE LA PLAZA M, FERN NDEZ DE PALENCIA P, PEL
NDEZ DE PALENCIA P, PEL EZ C, et al.Biochemical and molecular characterization of α-ketoisovalerate decarboxylase, an enzyme involved in the formation of aldehydes from amino acids by Lactococcus lactis[J].FEMS Microbiology Letters, 2004, 238(2):367-374.
EZ C, et al.Biochemical and molecular characterization of α-ketoisovalerate decarboxylase, an enzyme involved in the formation of aldehydes from amino acids by Lactococcus lactis[J].FEMS Microbiology Letters, 2004, 238(2):367-374.
[45] HELINCK S, LE BARS D, MOREAU D, et al.Ability of thermophilic lactic acid bacteria to produce aroma compounds from amino acids[J].Applied and Environmental Microbiology, 2004, 70(7):3 855-3 861.
[46] RIJNEN L, COURTIN P, GRIPON J C, et al.Expression of a heterologous glutamate dehydrogenase gene in Lactococcus lactis highly improves the conversion of amino acids to aroma compounds[J].Applied and Environmental Microbiology, 2000, 66(4):1 354-1 359.
[47] YVON M, CHAMBELLON E, BOLOTIN A, et al.Characterization and role of the branched-chain aminotransferase (BcaT) isolated from Lactococcus lactis subsp.cremoris NCDO 763[J].Applied and Environmental Microbiology, 2000, 66(2):571-577.
[48] ALBERTO ZULJAN F, MORTERA P, ALARC N S H, et al.Lactic acid bacteria decarboxylation reactions in cheese[J].International Dairy Journal, 2016, 62:53-62.
N S H, et al.Lactic acid bacteria decarboxylation reactions in cheese[J].International Dairy Journal, 2016, 62:53-62.
[49] SMIT B A, ENGELS W J M, SMIT G.Branched chain aldehydes:Production and breakdown pathways and relevance for flavour in foods[J].Applied Microbiology and Biotechnology, 2009, 81(6):987-999.
[50] KIERONCZYK A, CACHON R, FERON G, et al.Addition of oxidizing or reducing agents to the reaction medium influences amino acid conversion to aroma compounds by Lactococcus lactis[J].Journal of Applied Microbiology, 2006, 101(5):1 114-1 122.
[51] WARD D E, ROSS R P, VAN DER WEIJDEN C C, et al.Catabolism of branched-chain α-keto acids in Enterococcus faecalis:The bkd gene cluster, enzymes, and metabolic route[J].Journal of Bacteriology, 1999, 181(17):5 433-5 442.
[52] CHEN C, YUAN J J, YU H Y, et al.Characterization of metabolic pathways for biosynthesis of the flavor compound 3-methylbutanal by Lactococcus lactis[J].Journal of Dairy Science, 2022, 105(1):97-108.
[53] RIZZI G P.The strecker degradation and its contribution to food flavor[M].Flavor Chemistry.Boston, MA:Springer US, 1999:335-343.
[54] L PEZ-PEDROUSO M, PÉREZ-SANTAESCOL
PEZ-PEDROUSO M, PÉREZ-SANTAESCOL STICA C, FRANCO D, et al.Molecular insight into taste and aroma of sliced dry-cured ham induced by protein degradation undergone high-pressure conditions[J].Food Research International, 2019, 122:635-642.
STICA C, FRANCO D, et al.Molecular insight into taste and aroma of sliced dry-cured ham induced by protein degradation undergone high-pressure conditions[J].Food Research International, 2019, 122:635-642.
[55] 高尧来, 朱晶莹.美拉德反应与肉的风味[J].广州食品工业科技, 2004, 20(1):91-94.
GAO Y L, ZHU J Y.Maillard reaction and flavor of meat[J].Guangzhou Food Science and Technology, 2004, 20(1):91-94.
[56] SANCHES-SILVA A, LOPEZ-HERN NDEZ J, PASEIRO-LOSADA P.Profiling flavor compounds of potato crisps during storage using solid-phase microextraction[J].Journal of Chromatography A, 2005, 1 064(2):239-245.
NDEZ J, PASEIRO-LOSADA P.Profiling flavor compounds of potato crisps during storage using solid-phase microextraction[J].Journal of Chromatography A, 2005, 1 064(2):239-245.
[57] RAINER CREMER D, EICHNER K.The reaction kinetics for the formation of Strecker aldehydes in low moisture model systems and in plant powders[J].Food Chemistry, 2000, 71(1):37-43.
[58] GONZ LEZ-MOHINO A, PÉREZ-PALACIOS T, ANTEQUERA T, et al.Monitoring the processing of dry fermented sausages with a portable NIRS device[J].Foods (Basel, Switzerland), 2020, 9(9):1294.
LEZ-MOHINO A, PÉREZ-PALACIOS T, ANTEQUERA T, et al.Monitoring the processing of dry fermented sausages with a portable NIRS device[J].Foods (Basel, Switzerland), 2020, 9(9):1294.
[59] 陈臣, 周文雅, 袁佳杰, 等.3-甲基丁醛对奶酪坚果风味的贡献及其生物合成的研究进展[J].食品科学, 2020, 41(7):228-233.
CHEN C, ZHOU W Y, YUAN J J, et al.Recent progress in biosynthesis of 3-methylbutanal and its contribution to nutty flavor in cheese[J].Food Science, 2020, 41(7):228-233.
[60] CURTIN A C, DE ANGELIS M, CIPRIANI M, et al.Amino acid catabolism in cheese-related bacteria:Selection and study of the effects of pH, temperature and NaCl by quadratic response surface methodology[J].Journal of Applied Microbiology, 2001, 91(2):312-321.
[61] WEIMER B, DIAS B, UMMADI M, et al.Influence of NaCl and pH on intracellular enzymes that influence Cheddar cheese ripening[J].Le Lait, 1997, 77(3):383-398.