食源性致病菌主要指以食品为传播载体的致病性细菌,这些致病性细菌能够存活在食物或水源中,致病性细菌污染的水源或食物被人食用后可能会引发肠道疾病或者食物中毒,严重可导致死亡[1]。常见食源性致病菌主要有沙门氏菌、空肠弯曲杆菌、单增李斯特菌、志贺氏菌以及大肠杆菌O157∶H7,这些食源性致病菌检测是应对食品安全问题中非常重要的环节[2]。报告显示,美国食品工业中因食源性致病菌污染而损失的食品数量高达25%,在一些发达国家有35%的人群感染食源性疾病,甚至在全世界每年有几百万人因食源性疾病而丧生[3]。目前传统的食源性致病菌检测方法耗时过长且不能快速判断菌种亚型,传统的免疫学检测方法在操作不当时还会产生假阳性的结果,严重影响了食源性致病菌的防控,因此亟需快速且专一的食源性致病菌检测方法。
随着研究不断深入,在传统检测方法的基础上开发了很多现代快速食源性致病菌检测新方法,例如,现代免疫法、分子生物法、仪器分析法、生物传感器等[4]。这些新检测方法有效提高了检测效率,在检测限、特异性和检测时间等众多方面不断取得了新突破,但是仍然存在一些问题待解决,例如:免疫法中的生物制剂易失活,分子生物法中无法区分活细胞和死细胞,仪器分析法检测成本过高、仪器设备昂贵、样品制作繁杂。噬菌体生产成本较低,对样品环境的适应性较强,能够有效进行活细胞和死细胞鉴别,因此成为了研究过程中抗体等生物活性物质的理想替代对象[5]。
1 噬菌体简介
噬菌体是指能够侵袭真菌、藻类、放线菌以及细菌等微生物的病毒。有数据显示,地球上约有1031个噬菌体。噬菌体广泛存在于各种环境中,细菌存在的地方就有噬菌体存在[6]。因为噬菌体表面天然存在特异性识别蛋白,使得噬菌体具有极高特异性,只能作用于一种或者某一类微生物,对其他非靶标微生物或者人类无任何毒害作用,因此噬菌体在研发应用时具有很高安全性。目前噬菌体根据不同理化性质被分为多种类型,例如:根据核酸不同,分为单链RNA噬菌体、双链RNA噬菌体、单链DNA噬菌体、双链DNA噬菌体,根据侵染细菌时生殖方式的不同,分为溶原性噬菌体、裂解性噬菌体以及温和噬菌体[7]。噬菌体内部组成较为简单,主要由遗传物质核酸和蛋白质外壳组成,种类繁多的噬菌体在长度上也有很大差别,目前发现的噬菌体长度区间是24 ~200 nm,T4噬菌体是已知最大噬菌体[8]。噬菌体增殖主要包括吸附、侵入、生物合成、装配和释放这5个阶段,首先特异性吸附和侵入宿主菌,接着利用宿主菌内遗传物质完成自身生物合成和装配,最后裂解宿主菌释放到环境中[9]。
因为噬菌体具有结构简单、价格低廉以及特异性强等众多优点,所以非常容易与其他检测方法相结合,被广大学者作为研究对象应用于食源性致病菌快速检测[10]。美国食品药品监督管理局(Food and Drug Administration, FDA)早在2007年就已经宣布支持将一些噬菌体作为检测方法应用到食源性致病菌检测中,另外随着科学技术不断发展,已经具备了商业化生产噬菌体对产品进行检测,目前噬菌体已经用于检测结核杆菌、沙门氏菌、李斯特菌、大肠杆菌、绿脓假单胞菌和弯曲杆菌等多种病原菌[11],众多研究成果表明,噬菌体在食源性致病菌检测方面应用前景广阔,越来越多基于噬菌体的食源性致病菌检测方法被应用在工业生产和日常生活中。
2 噬菌体检测食源性致病菌的不同方法及应用
已经建立的基于噬菌体检测食源性致病菌的方法多种多样,如图1所示,噬菌体可以用来感染目标细菌。在细胞裂解的情况下,可以检测到后代噬菌体或细胞内溶物。一些噬菌体可以将外源基因导入细菌,用荧光、比色或光学标记宿主。噬菌体也可以用来在生物传感器中创建感应层。附着在微米或纳米颗粒上的噬菌体可以在不同检测方法中作为捕获元件[12]。这些检测方法的原理涉及噬菌体增殖过程与细菌相互作用各个阶段,运用不同生物技术与噬菌体增殖过程中某一阶段相互结合从而达到精确检测的目的。下面本文将依据新型检测方法中不同生物技术进行分类综述。
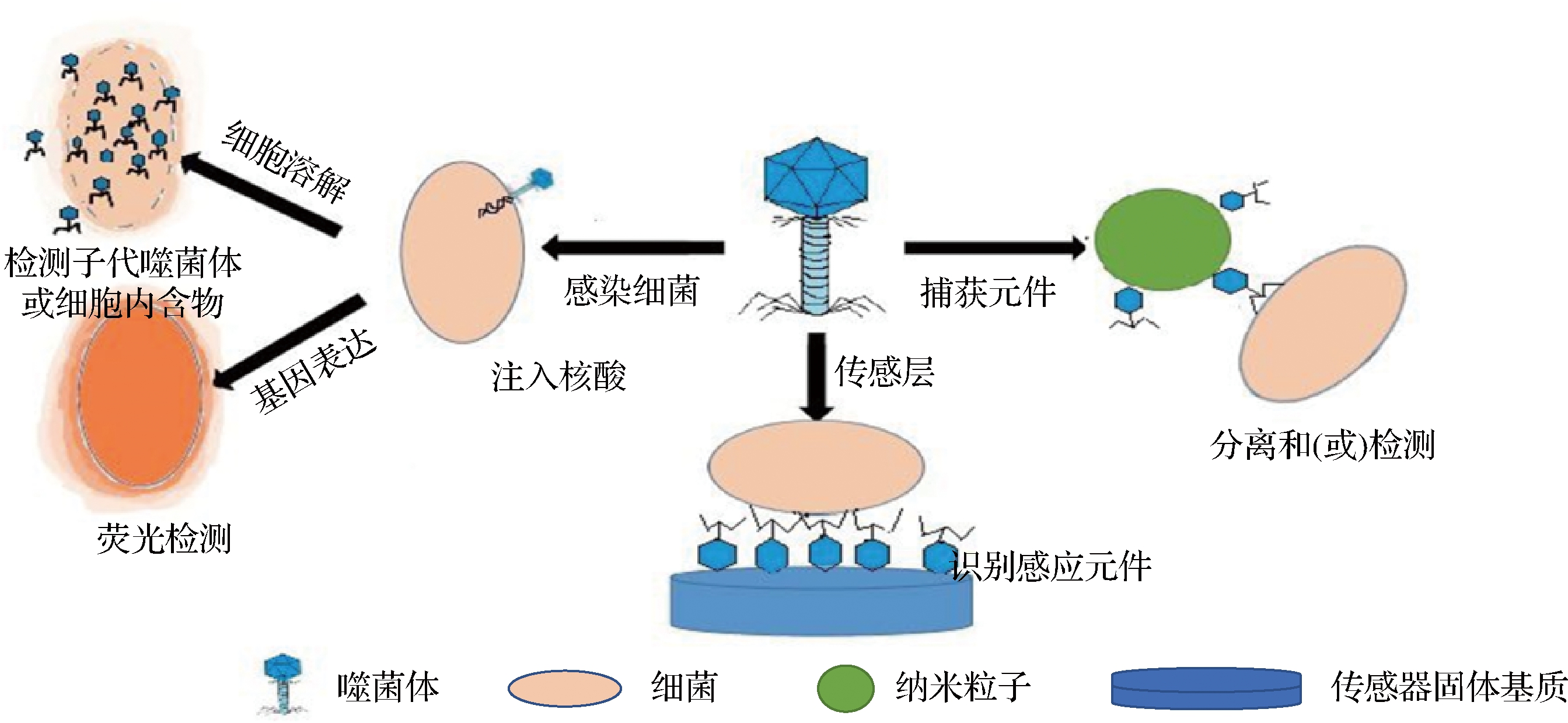
图1 基于噬菌体的细菌检测[12]
Fig.1 Phage-based bacterial detection[12]
2.1 基于噬菌体的微生物学检测
随着微生物与微生物之间不断进化,噬菌体表面形成特异性蛋白能够专一识别宿主菌,噬菌体这种高特异性识别能力在微生物检测中可用于判断致病菌的有无、致病菌是否为活细胞。
通过噬菌体判断是否含有致病菌的检测方法被称为噬菌体扩增法,其原理是烈性噬菌体能够在短时间感染并裂解宿主细菌,导致在宿主细胞内大量扩增的噬菌体被释放到样品溶液中,通过检测样品溶液中的噬菌体间接检测出致病菌的存在。例如GARRIDO-MAESTU等[13]研究建立了一种基于沙门氏菌噬菌体扩增与实时定量PCR(real-time quantitative PCR, qPCR)相结合快速检测鸡肉样品中肠炎沙门氏菌的新方法,此方法首先需经过较短的细菌回收步骤,之后在样品中加入噬菌体进行噬菌体扩增,可检测到0.22 fg/μL纯病毒DNA和103 PFU/mL病毒颗粒,整个方法包括DNA提取和QPCR分析时间在10 h内就可以检测到8 CFU/g细菌,另外性能参数评价指出该方法可快速检测肠炎沙门氏菌。
研究表明,有60种常见食源性致病菌,在物理、化学或者生物等外部环境诱导下,可能会进入活的非可培养(viable but non-culture, VBNC)状态,比如影响较大的大肠杆菌、沙门氏菌等[14]。处于VBNC状态的致病菌,其自身仍然具有代谢活动和致病能力,在适宜环境下VBNC状态的致病菌就会恢复活性,然而传统检测方法并不能检测出VBNC状态下的致病菌,近年来发展的免疫学、分子生物学等检测方法也无法精准检测出VBNC状态下的细菌,这对于食品安全来说是极大威胁[15]。噬菌体需要与活细菌表面蛋白进行特异性识别,因此能够区分致病菌生存状态,有效提升检测结果的准确性。有研究人员曾做过相关实验,取不同样品混合有不同比例VBNC状态细胞,利用抗体检测不同生理状态下的致病菌造成了许多假阳性现象,在使用噬菌体检测时,可有效识别不同状态下的致病菌[9]。MIDO等[16]提出了一种“概念证明”噬菌体扩增偶联试验作为检测样本中细菌的替代方法,该检测方法需要检测由细菌内感染产生的子代噬菌体,由于噬菌体需要活宿主细胞来感染和复制,因此该检测方法具有区分活细胞和死亡细胞的能力,该方法原理如图2所示,噬菌体识别感染宿主细菌并在细菌内生长繁殖,最终导致宿主细胞裂解和大量子代噬菌体释放,接着偶联在磁珠表面的抗体捕获子代噬菌体;加入抗体与链霉亲和素-藻红蛋白结合物(streptavidin-phycoerythrin,SAPE)孵育。最终络合物发出荧光在仪器中被测量并报告出相对荧光单位。结果表明该检测方法具有活细胞鉴别能力,培养3 h后,大肠杆菌检测限为1×102 CFU/mL。这些研究表明,基于噬菌体的微生物学检测完善了传统微生物培养不能检测活细胞的不足,检测限降低的同时检测培养时间也缩短,有效提升了食源性致病菌检测的准确性。

图2 噬菌体扩增偶联免疫测定法检测细菌原理图[16]
Fig.2 Phage amplification coupled immunoassay for detection of bacteria[16]
2.2 基于噬菌体的免疫学检测
免疫学检测是根据抗原与抗体特异性识别来进行检测的方法,常用抗体因为生产批次不稳定、保存不当易失活等众多因素,使得结果不够准确且成本较高,严重限制了免疫学检测方法的发展。然而噬菌体结构中含有特异识别的尾丝蛋白(tail fiber protein, TFP),研究表明TFP与宿主具有很高亲和能力,可以有效解决以上抗体所产生的问题,准确性提升的同时极大控制了检测成本[17]。例如:HE等[18]在大肠杆菌中表达了重组铜绿假单胞菌噬菌体尾部纤维蛋白P069(a recombinant tail fiber protein)用于特异性检测铜绿假单胞菌,结果显示P069包涵体成功转化为水溶性蛋白,有效保留了对铜绿假单胞菌识别能力,使用P069作为生物识别元件与生物发光法相结合检测铜绿假单胞菌的检测限为6.7×102 CFU/mL,另外将P069与荧光法相结合检测铜绿假单胞菌,检测限可降低至1.7×102 CFU/mL。
噬菌体的细胞壁结合区域(cell wall binding domain, CBD)在酶联免疫检测中也具有较大应用价值,研究表明,一个细胞表面CBD结合位点可以达到107[19],最近很多研究人员将CBD与免疫磁珠相结合用于致病菌检测过程中分离、富集等步骤,因为CBD具有较高特异性和亲和性,并且相较于抗体具有较小体积,在免疫检测中成为了抗体的理想替代品[20]。LIU等[21]使用噬菌体模拟表位CBD代替化学合成抗原,用于免疫检测玉米中致病菌,检测在40 min即可完成,并且结果稳定可靠。另外近些年,研究人员开始将不同颜色的荧光蛋白对噬菌体CBD进行标记,研发出噬菌体CBD鸡尾酒检测方法,该方法可以同时检测出样品中多种致病菌。WANG等[22]建立了以重组CBD蛋白为识别剂的流式细胞术检测耐甲氧西林金黄色葡萄球菌,检测范围为1.5×102~1.5×106 CFU/mL。以上研究表明,利用噬菌体的特异性可以开展多种免疫检测新方法,这些新方法攻克传统技术难题的同时特异性更强,有效拓宽了免疫学检测法在食源性致病菌检测中的应用。
2.3 基于噬菌体的分子生物学检测
基于噬菌体的分子生物学检测方法也被称为报告噬菌体检测法。报告噬菌体是指经过基因工程方法改造能够编码荧光发色基因或特异性编码可被检测基因的噬菌体。目前常用基因有绿色荧光蛋白基因(gfp)、碱性磷酸酶基因、荧光素酶基因(lux和luc)、β-半乳糖苷酶基因(lacZ)[23]。
绿色荧光蛋白基因(gfp)是一种自身催化形成的荧光蛋白,该荧光基团从蓝光到紫外线激发下都能显示出绿色荧光,gfp基因最大优势是自身就可完成荧光检测不需要另外添加辅助物,并且gfp基因较为简单容易操作,因此gfp基因目前应用面非常广泛。通过基因工程方法使噬菌体含有碱性磷酸酶基因,噬菌体在宿主体内表达产生碱性磷酸酶,在裂解宿主菌后通过检测样品中是否有碱性磷酸酶基因,就可以间接检测出宿主菌[24]。
噬菌体自身无法合成激发荧光所需的酶、底物和能量,但是当噬菌体侵入宿主细胞之后,将自身携带的发光基因表达,利用宿主合成荧光所需物质,使得噬菌体能够在宿主之内发光[25]。研究表明lux基因操纵子中包括luxCDE和luxAB,luxCDE可以编码脂肪酸还原酶体系进而促进反应底物脂肪醇合成,luxAB负责编码荧光素酶α和β亚基,2个亚基与合成底物一起用于发光反应。研究过程如果单独使用luxAB则需要添加其他辅助物,如果使用luxCDE和luxAB两种操纵子,则无需添加其他辅助物[26]。luc基因编码真核生物荧光素酶,该酶可以催化D-荧光素氧化成氧化荧光素,氧化同时会产生生物荧光,在波长560 nm处能检测到荧光[27]。lacZ基因能够编码β-半乳糖苷酶,编码产生该酶后会促进β-半乳糖苷发生水解反应,研究过程中常将反应产物与荧光素酶连用,或者作为化学发光的底物[28]。
表1总结了近几年报告噬菌体研究进展,随着基因工程技术不断发展,成功研发出的报告噬菌体也越来越多,更加丰富了报告噬菌体可检测的食源性致病菌种类,使得报告噬菌体在食源性致病菌检测的过程中发挥更大的作用。
表1 报告噬菌体最新研究进展
Table 1 Reports the latest research progress of phages

生物受体细菌方法LOD/(CFU·mL-1)检测时间/min注释参考文献工程噬菌体phiV10lux大肠杆菌O157∶H7生物发光法约为140将细菌荧光素酶基因(luxCDABE)操纵子引入到phiV10基因组中[29]NRGp6报告噬菌体大肠杆菌光谱检测5×102120 将纳米Luc荧光素酶表达盒插入到T7噬菌体[30]NRGp5报告噬菌体大肠杆菌膜过滤和选择性富集相结合20300含有NanoLuc酶基因的报告噬菌体NRGp5[31]T7-ALP基因工程噬菌体大肠杆菌荧光成像和图像分析100300表达碱性磷酸酶基因并使用荧光沉淀底物ELF-97作为碱性磷酸酶活性的底物[32]工程噬菌体T7大肠杆菌荧光检测10420含有编码β-半乳糖苷酶(β-GAL)的LacZ操纵子并且以4-甲基伞形花环糖苷(MUG)为底物[33]
2.4 基于噬菌体的光学检测
利用噬菌体进行发光检测依据原理可分为生物发光和化学发光两种类型。生物发光原理是细胞自身合成的某些物质在与特定酶相互作用后发出荧光,根据荧光强度推测出待测致病菌含量[34]。化学发光原理是化学发光试剂通过化学或物理方法结合到细胞特定基团上,使得细胞具有了发光效果,最终通过是否有光来判定致病菌含量[35]。
生物发光目前有ATP生物发光法和NADH生物发光法两种。研究表明,ATP能够与荧光素酶相互作用进而产生荧光,反应机理如下:
D-荧光素酶![]() 氧化荧光素+AMP+PPi+H2O
氧化荧光素+AMP+PPi+H2O
检测时利用噬菌体去裂解宿主菌使得细胞内ATP释放出来,然后加入荧光素酶与ATP相互反应,产生荧光强度与样品中ATP含量成正比,进而检测出致病菌含量[36]。例如唐倩倩等[37]曾将ATP生物发光法与纳米免疫磁技术相结合用于检测食源性致病菌O157∶H7,纳米免疫磁珠能够高效捕获环境中的致病菌,检测灵敏度提升的同时准确性也更高。研究人员曾采用平板计数法和ATP生物发光法建立了7种食源性病原菌群浓度与其相对发光强度之间的数学模型,并且利用SAS软件分析了7种不同菌株之间ATP含量变化,结果显示ATP浓度与发光强度呈线性关系,生物发光法对菌落计数具有较高可靠性。该研究为ATP生物发光法在食品检测中的应用提供了强有力的理论支撑[38]。
微生物细胞在生长过程中会产生NADH,并且在特定生长代谢时期细胞内NADH含量相对稳定,NADH作为一种胞内产物,其含量和致病菌数量成正比,研究人员利用烈性噬菌体感染宿主致病菌使宿主致病菌裂解死亡,释放出胞内NADH,然后加入氧化还原酶和荧光素酶,三者相互作用产生荧光,通过荧光强度就可以计算出致病菌总数[39]。生物发光法具有高灵敏度、易操作等优点,已经被研发用于食品生产过程中致病菌的检测,目前市面上已经有商品化的基于噬菌体与荧光素酶相结合的检测系统,具有较好的检测灵敏度[40]。
利用噬菌体进行化学发光检测的方法也被称作荧光标记噬菌体法,目前常用的商业化化学发光试剂有YOYO-1、SYBR、SYTO等,随着科技不断进步,新核酸染料表现出与核酸较高亲和性,逐渐取代了传统核酸染料[41]。例如:用荧光核酸染料SYBR 标记PNJ1809-36噬菌体用于检测含K1荚膜的大肠杆菌,结果表明荧光标记的噬菌体在4 ℃避光条件下较稳定,能稳定保存4个月,并且在15 min内能特异性、方便直观地检测到K1荚膜的大肠杆菌[42]。
2.5 基于噬菌体的传感器检测
生物传感器是一种对生物物质较为敏感且能够将其浓度转化为数码读数的检测器,该检测器核心是将固定的生物感应成分作为识别元件,常用生物感应成分有抗体、抗原、酶、核酸等生物活性物质[43],这些生物感应成分对应用环境和储存条件要求较高,不适合的环境极易造成失活或者假阳性的结果,噬菌体对环境适应度高并且专一性强,因此使用噬菌体替代这些生物活性成分,能够有效解决以上问题。基于噬菌体检测食源性致病菌的生物传感器研究目前主要分为电化学传感和磁传感两种,两者差别主要体现在理化换能装置的转换原理。
电化学传感器原理是将检测样品与生物活性物质反应产生的信号通过换能装置转化为电信号,最后经仪表放大显示出来,计算出检测物含量[44]。电化学传感器设计主要依据噬菌体增殖过程与宿主菌相互作用引起环境中阻抗变化进行检测,例如:噬菌体在吸附、侵入宿主细胞时,会使得细胞表面正负离子发生变化,会产生微小电压波动[45]。噬菌体在宿主体内生物合成、装配的过程中会将宿主细胞内蛋白质等惰性物质转化为乳糖等小分子物质,使得样品环境中阻抗发生变化[46]。噬菌体最终裂解释放后,会使得宿主细胞内溶物释放到环境中,可以在样品中外加反应物质与释放内溶物相互作用产生电流。例如:XU等[47]开发了一种基于野生型T4噬菌体的微电化学传感器,用于对大肠杆菌B的特异性和敏感性检测,20 min内检测完成,检测限低至(14±5) CFU/mL。FAROOQ等[48]构建了一个表面固定化噬菌体的电化学传感器,该检测方法原理如图3所示,首先在细菌纤维素薄膜(bacterial cellulose, BC)中掺入羧基化多碳纳米管(carboxylated multiwalled carbon nanotubes, C-MWCNTs)使得材料具有导电性能,然后在表面加上聚乙烯亚胺(polyethyleneimine, PEI)方便后续噬菌体的共价结合,在检测时固定的噬菌体会与金黄色葡萄球菌相互作用产生电阻变化,通过检测电流变化就可推测出致病菌含量,研究结果表明传感器在磷酸盐缓冲溶液和牛奶中检测限分别为3和5 CFU/mL,该传感器能够稳定维持6周以上,并且具有鉴别活/死细胞的能力,在30 min内即可完成检测。
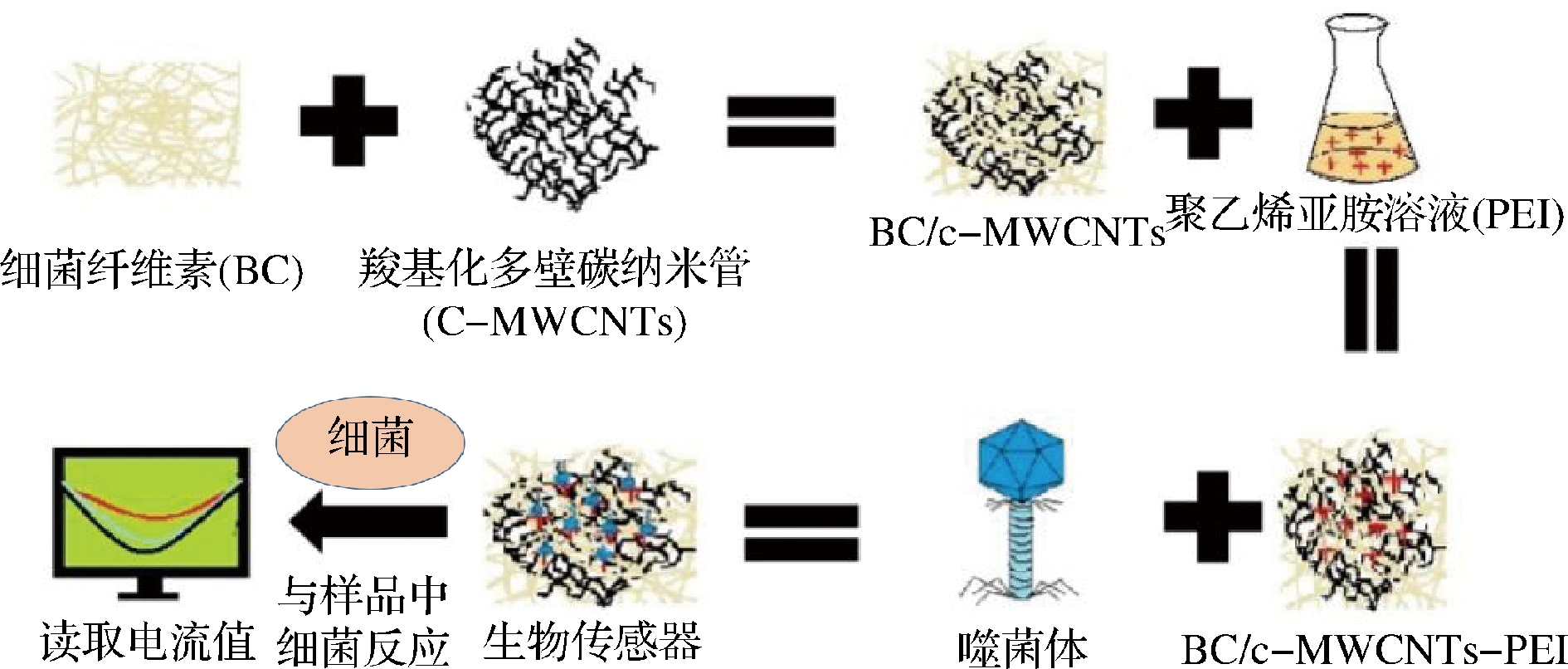
图3 表面固定化噬菌体的电化学传感器检测原理图[48]
Fig.3 The principle of electrochemical sensor for detection of immobilized phage on the surface[48]
随着纳米技术不断发展,新型纳米材料与噬菌体具有高度亲和性[49],纳米磁传感器是通过纳米磁珠亲和噬菌体,利用噬菌体特异性识别致病菌进行富集,然后去除没有结合的纳米磁颗粒,通过检测磁场共振频率变化进行致病菌含量检测[50]。MACK等[51]研发出噬菌体磁弹性生物传感器用于快速检测生菜中鼠伤寒沙门氏菌,该传感器在30 min内完成检测,检测限为5×102 CFU/mL。HIREMATH等[52]通过将噬菌体与磁弹性生物传感器相结合用于检测耐甲氧西林金黄色葡萄球菌,实验表明该传感器能够在不同细菌培养基中特异性识别耐甲氧西林金黄色葡萄球菌,并且耐甲氧西林金黄色葡萄球菌的浓度与共振频率有正比关系。KRETZER等[53]设计了一种超灵敏诊断单增李斯特菌的方法,该方法结合了噬菌体检测的2种策略:(1)利用李斯特菌噬菌体内溶素的细胞壁结合域,通过磁分离特异性捕获和浓缩靶细胞;(2)使用 A511∷luxAB 生物发光报告噬菌体测定法以微孔板形式进行高灵敏度检测。该方法检测步骤如图4所示,首先对食品样品进行预处理,接着进行16 h选择性富集,随后是细胞壁结合域的磁分离和A511∷LuxAB噬菌体感染和生物发光信号产生,该检测方法在不到22 h总检测时间内,能够稳定地检测到极低数量(0.1~1.0 CFU/g) 单增李斯特菌活菌。
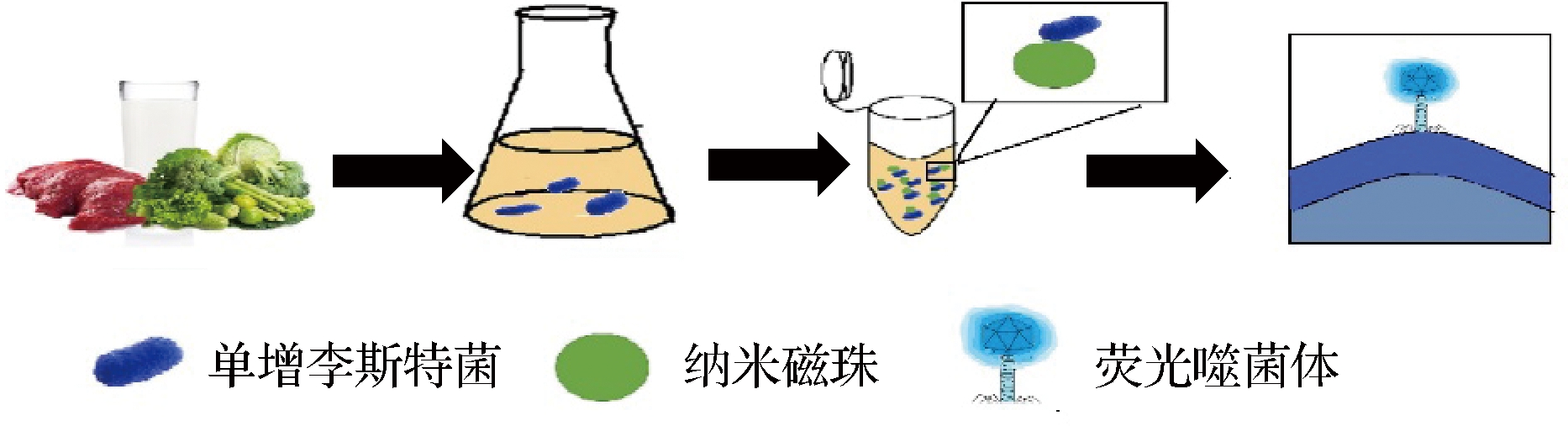
图4 CBD-MS/A511∷LuxAB联合检测工作流程示意图[53]
Fig.4 CBD-MS/A511∷LuxAB joint detection workflow diagram[53]
综合以上实例可以看出,噬菌体结合最新科学技术研发出的生物传感器具有检测限低,效率高等显著优点,然而传感器检测方法目前还处在实验室研发阶段,需要较为精密的仪器辅助检测,如果能够将检测方法更加简化突破仪器限制,基于噬菌体的生物传感器将成为食源性致病菌检测的主要方法。
3 结语
本文阐述了食源性致病菌检测的现状、目前使用的检测方法中存在的不足以及噬菌体在食源性致病菌检测中的优势。分析了目前噬菌体在食源性致病菌检测应用时的不同方法,根据生物技术的不同原理进行分类阐述和详细解读,重点列举了很多新型检测方法实例。
随着仪器设备和科学理论的不断发展,噬菌体的潜在价值也被逐渐发掘,噬菌体特异性高、适应性强、制取方便等众多优势合理地被应用在食源性致病菌检测和防控的过程中。此外噬菌体检测技术不再是单一技术的应用,科研工作者更倾向于将噬菌体与分子生物学、微生物学、材料科学以及光电子学等学科进行跨学科领域的合作,从而研发出更加高效变携的检测新技术。未来在推广应用基于噬菌体的新型检测方法时不要求高标准的实验室环境和专业的技术人员进行操作,新型检测方法定会和大众化需求相结合,将检测方法简化到日常生活中可以随时随地进行检测,在没有精密仪器和专业人员的情况下也能够完成。通过对噬菌体进行更加深入的研究,基于噬菌体的检测技术定会取得新的突破,成功运用到日常生活中,在食品安全防控方面发挥重大作用。
[1] QI W Z, ZHENG L Y, HOU Y, et al.A finger-actuated microfluidic biosensor for colorimetric detection of foodborne pathogens[J].Food Chemistry, 2022, 381:131801.
[2] RIPOLLES-AVILA C, MART NEZ-GARCIA M, CAPELLAS M, et al.From hazard analysis to risk control using rapid methods in microbiology:A practical approach for the food industry[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):1 877-1 907.
NEZ-GARCIA M, CAPELLAS M, et al.From hazard analysis to risk control using rapid methods in microbiology:A practical approach for the food industry[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4):1 877-1 907.
[3] SARHAN W A, AZZAZY H M.Phage approved in food, why not as a therapeutic?[J].Expert Review of Anti-Infective Therapy, 2015, 13(1):91-101.
[4] 姚帮本, 闫超, 姚丽, 等.食源性致病菌快速检测方法研究进展[J].分析测试学报, 2021, 40(5):617-627.
YAO B B, YAN C, YAO L, et al.Advance on rapid detection of foodborne pathogenic bacteria[J].Journal of Instrumental Analysis, 2021, 40(5):617-627.
[5] YANG J Y, LIU S Z, SUI Z W, et al.Establishing novel bacteriophage detection method based on imagining flow cytometry[J].IOP Conference Series:Earth and Environmental Science, 2019, 252:042116.
[6] SHAREEFDEEN H, HYNES A P.Does over a century of aerobic phage work provide a solid framework for the study of phages in the gut?[J].Anaerobe, 2021, 68:102319.
[7] 邹秀月, 蔡德周.噬菌体治疗细菌性疾病的研究进展及发展方向[J].中国感染控制杂志, 2019, 18(9):888-892.
ZOU X Y, CAI D Z.Research progress and development direction of bacteriophage therapy for bacterial infection[J].Chinese Journal of Infection Control, 2019, 18(9):888-892.
[8] SHARMA S, CHATTERJEE S, DATTA S, et al.Bacteriophages and its applications:An overview[J].Folia Microbiologica, 2017, 62(1):17-55.
[9] 于堃, 曹中赞, 万明, 等.噬菌体在防治畜禽沙门氏菌感染中的应用[J].动物医学进展, 2021, 42(4):115-119.
YU K, CAO Z Z, WAN M, et al.Application of bacteriophages in prevention and treatment of Salmonella infections in livestock and poultry[J].Progress in Veterinary Medicine, 2021, 42(4):115-119.
[10] ABRAHA H B, KIM K P, SBHATU D B.Bacteriophages for detection and control of foodborne bacterial pathogens:The case of Bacillus cereusand their phages[J].Journal of Food Safety, 2021:41(3):1-10.
[11] ANANY H, BROVKO L, EL DOUGDOUG N K, et al.Print to detect:A rapid and ultrasensitive phage-based dipstick assay for foodborne pathogens[J].Analytical and Bioanalytical Chemistry, 2018, 410(4):1 217-1 230.
[12] RICHTER  , JANCZUK-RICHTER M, NIEDZI
, JANCZUK-RICHTER M, NIEDZI
 KA-JÖNSSON J, et al.Recent advances in bacteriophage-based methods for bacteria detection[J].Drug Discovery Today, 2018, 23(2):448-455.
KA-JÖNSSON J, et al.Recent advances in bacteriophage-based methods for bacteria detection[J].Drug Discovery Today, 2018, 23(2):448-455.
[13] GARRIDO-MAESTU A, FUCI OS P, AZINHEIRO S, et al.Specific detection of viable Salmonella Enteritidis by phage amplification combined with qPCR (PAA-qPCR) in spiked chicken meat samples[J].Food Control, 2019, 99:79-83.
OS P, AZINHEIRO S, et al.Specific detection of viable Salmonella Enteritidis by phage amplification combined with qPCR (PAA-qPCR) in spiked chicken meat samples[J].Food Control, 2019, 99:79-83.
[14] 徐璐宁. 污染物胁迫下微生物VBNC状态的形成及Rpf复苏环境功能菌种的研究[D].金华:浙江师范大学, 2020.
XU L N.Study on the formation of microbial VBNC state under pollutants stess and resuscitation of functional bacteria by rpf[D].Jinhua:Zhejiang Normal University, 2020.
[15] 聂新颖, 张蕊蕊, 蒋丽芬, 等.食源性微生物VBNC状态检测与分离方法的研究进展[J].现代食品科技, 2017, 33(9):283-292.
NIE X Y, ZHANG R R, JIANG L F, et al.Research progress of detection and separation methods for foodborne microorganisms at VBNC state[J].Modern Food Science and Technology, 2017, 33(9):283-292.
[16] MIDO T, SCHAFFER E M, DORSEY R W, et al.Sensitive detection of live Escherichia coli by bacteriophage amplification-coupled immunoassay on the Luminex® MAGPIX instrument[J].Journal of Microbiological Methods, 2018, 152:143-147.
[17] 邓贺文. 沙门菌噬菌体YSP2尾丝蛋白鉴定及功能研究[D].长春:吉林大学, 2020.
DENG H W.Identification and functional study of Salmonella bacteriophage YSP2 tail fiber protein[D].Changchun:Jilin University, 2020.
[18] HE Y, SHI Y L, LIU M L, et al.Nonlytic recombinant phage tail fiber protein for specific recognition of Pseudomonas aeruginosa[J].Analytical Chemistry, 2018, 90(24):14 462-14 468.
[19] YU J P, ZHANG Y, ZHANG Y, et al.Sensitive and rapid detection of staphylococcus aureus in milk via cell binding domain of lysin[J].Biosensors and Bioelectronics, 2016, 77:366-371.
[20] BAI J, KIM Y T, RYU S, et al.Biocontrol and rapid detection of food-borne pathogens using bacteriophages and endolysins[J].Frontiers in Microbiology, 2016, 7:474.
[21] LIU R X, SHI R R, ZOU W T, et al.Highly sensitive phage-magnetic-chemiluminescent enzyme immunoassay for determination of Zearalenone[J].Food Chemistry, 2020, 325:126905.
[22] WANG Y R, HE Y, BHATTACHARYYA S, et al.Recombinant bacteriophage cell-binding domain proteins for broad-spectrum recognition of methicillin-resistant Staphylococcus aureus strains[J].Analytical Chemistry, 2020, 92(4):3 340-3 345.
[23] 秦秀娟, 雍彬, 马沁沁.噬菌体在食品工业中的应用与危害防控[J].微生物学通报, 2021, 48(9):3 368-3 379.
QIN X J, YONG B, MA Q Q.The application and control of bacteriophage in food industry[J].Microbiology China, 2021, 48(9):3 368-3 379.
[24] HONG S J, PAN Q H, CHEN S Y, et al.Identification and characterization of alkaline phosphatase gene phoX in Microcystis aeruginosa PCC7806[J].3 Biotech, 2021, 11(5):218.
[25] HINKLEY T C, GARING S, SINGH S, et al.Reporter bacteriophage T7 NLC utilizes a novel NanoLuc::CBM fusion for the ultrasensitive detection of Escherichia coli in water[J].Analyst, 2018, 143(17):4 074-4 082.
[26] ABILEV S K, KOTOVA V Y, SMIRNOVA S V, et al.Specific lux biosensors of Escherichia coli containing pRecA::Lux, pColD::Lux, and pDinI::Lux plasmids for detection of genotoxic agents[J].Russian Journal of Genetics, 2020, 56(6):666-673.
[27] CHEN X K, LIU X J, GAO Y H, et al.Application of firefly luciferase (luc) as a reporter gene for the chemoautotrophic and acidophilic Acidithiobacillus spp.[J].Current Microbiology, 2020, 77(11):3 724-3 730.
[28] KR MER M S, FEIL R, SCHMIDT H.Analysis of gene expression using lacZ reporter mouse lines[J].Methods in Molecular Biology (Clifton, N.J.), 2021, 2224:29-45.
MER M S, FEIL R, SCHMIDT H.Analysis of gene expression using lacZ reporter mouse lines[J].Methods in Molecular Biology (Clifton, N.J.), 2021, 2224:29-45.
[29] KIM J, KIM M, KIM S, et al.Sensitive detection of viable Escherichia coli O157:H7 from foods using a luciferase-reporter phage phiV10lux[J].International Journal of Food Microbiology, 2017, 254:11-17.
[30] PULKKINEN E M, HINKLEY T C, NUGEN S R.Utilizing in vitro DNA assembly to engineer a synthetic T7 Nanoluc reporter phage for Escherichia coli detection[J].Integrative Biology, 2019, 11(3):63-68.
[31] HINKLEY T C, GARING S, JAIN P, et al.A syringe-based biosensor to rapidly detect low levels of Escherichia coli (ECOR13) in drinking water using engineered bacteriophages[J].Sensors (Basel, Switzerland), 2020, 20(7):1953.
[32] WISUTHIPHAET N, YANG X, YOUNG G M, et al.Rapid detection of Escherichia coli in beverages using genetically engineered bacteriophage T7[J].AMB Express, 2019, 9(1):55.
[33] CHEN A Q, WANG D H, NUGEN S R, et al.An engineered reporter phage for the fluorometric detection of Escherichia coli in ground beef[J].Microorganisms, 2021, 9(2):436.
[34] SYED A J, ANDERSON J C.Applications of bioluminescence in biotechnology and beyond[J].Chemical Society Reviews, 2021, 50(9):5 668-5 705.
[35] FU A C, MAO Y J, WANG H B, et al.An activatable chemiluminescence probe based on phenoxy-dioxetane scaffold for biothiol imaging in living systems[J].Journal of Pharmaceutical and Biomedical Analysis, 2021, 204:114266.
[36] LI Z.Study on the detection of total colony in medical and health environment based on ATP bioluminescence[J].Journal of Commercial Biotechnology, 2018, 24(2):40-45.
[37] 唐倩倩. 基于ATP生物发光法与免疫磁分离技术检测大肠杆菌O157:H7的研究[D].杭州:浙江大学, 2008.
TANG Q Q.Detection of Escherichia coli O157:H7 based on ATP bioluminescence and immunomagnetic separation technology[D].Hangzhou:Zhejiang University, 2008.
[38] 李海月. ATP荧光技术快速检测8种常见食源性致病菌研究[D].郑州:河南工业大学, 2017.
LI H Y.Study on rapid detection of eight kinds of food-borne pathogen by ATP bioluminescence method[D].Zhengzhou:Henan University of Technology, 2017.
[39] 张亚超. 基于纳米多孔金的病原微生物电化学检测方法研究[D].济南:山东大学, 2021.
ZHANG Y C.Research on electrochemical detection method for pathogenic microorganims based on nanoporus gold[D].Jinan:Shandong University, 2021.
[40] CAPPILLINO M, SHIVERS R P, BROWNELL D R, et al.Sample6 DETECT/L:An In-plant, In-shift, enrichment-free Listeria environmental assay[J].Journal of AOAC INTERNATIONAL, 2015, 98(2):436-444.
[41] KIM E, KIM D, YANG S M, et al.Multiplex SYBR Green real-time PCR for Lactobacillus acidophilus group species targeting biomarker genes revealed by a pangenome approach[J].Microbiological Research, 2022, 259:127013.
[42] OLDAK L, LUKASZEWSKI Z, GORODKIEWICZ E.Studies of interactions between fibronectin and a specific antibody against fibronectin using SPRi and QCM[J].Journal of Pharmaceutical and Biomedical Analysis, 2022, 212:114640.
[43] DORLEDO DE FARIA R A, DOUAUD A, SOARES R B, et al.Electrochemical behavior of screen-printed carbon electrodes as transducers in biosensors[J].Corrosion, 2020, 76(6):553-561.
[44] PATEL D, ZHOU Y, RAMASAMY R P.A bacteriophage-based electrochemical biosensor for detection of methicillin-resistant Staphylococcus aureus[J].Journal of the Electrochemical Society, 2021, 168(5):057523.
[45] YANG Q L, DENG S S, XU J J, et al.Poly(indole-5-carboxylic acid)/reduced graphene oxide/gold nanoparticles/phage-based electrochemical biosensor for highly specific detection of Yersinia pseudotuberculosis[J].Microchimica Acta, 2021, 188(4):107.
[46] XU J T, CHAU Y, LEE Y K.Phage-based electrochemical sensors:A review[J].Micromachines, 2019, 10(12):855.
[47] XU J T, ZHAO C, CHAU Y, et al.The synergy of chemical immobilization and electrical orientation of T4 bacteriophage on a micro electrochemical sensor for low-level viable bacteria detection via Differential Pulse Voltammetry[J].Biosensors and Bioelectronics, 2020, 151:111914.
[48] FAROOQ U, ULLAH M W, YANG Q L, et al.High-density phage particles immobilization in surface-modified bacterial cellulose for ultra-sensitive and selective electrochemical detection of Staphylococcus aureus[J].Biosensors and Bioelectronics, 2020, 157:112163.
[49] KUBRAKOVA I V, PRYAZHNIKOV D V.Microwave-assisted synthesis of nanosized magnetic Sorbents[J].Journal of Analytical Chemistry, 2021, 76(1):15-25.
[50] LIU P, WANG Y B, HAN L, et al.Colorimetric assay of bacterial pathogens based on Co3O4 magnetic nanozymes conjugated with specific fusion phage proteins and magnetophoretic chromatography[J].ACS Applied Materials &Interfaces, 2020, 12(8):9 090-9 097.
[51] MACK J D, YEHUALAESHET T, PARK M K, et al.Phage-based biosensor and optimization of surface blocking agents to detect Salmonella typhimurium on romaine lettuce[J].Journal of Food Safety, 2017, 37(2):12299.
[52] HIREMATH N, CHIN B A, PARK M K.Effect of competing foodborne pathogens on the selectivity and binding kinetics of a lytic phage for methicillin-ResistantStaphylococcus aureus Detection[J].Journal of the Electrochemical Society, 2017, 164(4):B142-B146.
[53] KRETZER J W, SCHMELCHER M, LOESSNER M J.Ultrasensitive and fast diagnostics of viable Listeria cells by CBD magnetic separation combined with A511∷luxAB detection[J].Viruses, 2018, 10(11):626.