单增李斯特菌(Listeria monocytogenes)是一种革兰氏阳性兼性厌氧的无芽孢短杆菌,可引发严重的人畜共患疾病[1],多存在于食品工厂的加工器械等食品接触表面,由于L.monocytogenes具有较强的生物被膜黏附能力和传播性,因此难以被彻底清除。目前,由于抗生素对细菌耐药性的诱导作用以及化学消毒剂的残留问题,食品行业中针对L.monocytogenes的防治越来越多地集中于对细菌素和表面活性剂的研究[2]。枯草芽孢杆菌(Bacillus subtilis)作为一种好氧嗜热、革兰氏阳性产芽孢的杆状益生菌,可以产生具有抗菌作用的次级代谢物,如细菌素、脂肪类抗生素、挥发性化合物和多酮类化合物以及少量的有机酸,并可作为天然抑菌物质的良好来源[3]。然而目前对其防控致病菌生物被膜形成的相关研究较少,且食品领域内关于枯草芽孢杆菌代谢物抑制L.monocytogenes及其生物被膜的应用仍然匮乏,其中的生物被膜抑制机制也有待进一步阐明。
本研究选用枯草芽孢杆菌无细胞上清液(cell free supernatant,CFS)作为抑菌剂,探究枯草芽孢杆菌的CFS对L.monocytogenes生物被膜的抑制作用。研究选取实验室自主分离保存的具有强成膜能力的L.monocytogenes 118号野生菌株(以下简称为No.118)为实验目标菌株[4],通过测定CFS处理后No.118的自聚集能力、表面疏水性、生物被膜代谢活性、鞭毛泳动能力和胞外聚合物(extracellular polymeric substances,EPS),探究枯草芽孢杆菌CFS对No.118生物被膜形成的抑制机理。
1 材料与方法
1.1 材料
1.1.1 菌种选择与培养
Bacillus subtilis CMCC 63501,中国医学细菌保藏中心(center for medical culture collections,CMCC)。L.monocytogenes菌株选取肉牛屠宰工厂来源的No.118(野生菌株)[4]。菌株均保存在含25%(体积分数)甘油的脑心浸液肉汤培养液(brain heart infusion broth,BHI)中,并在-80 ℃冰箱中保藏备用。菌株活化条件:接菌量按0.1%接入无菌BHI中,37 ℃下200 r/min振荡培养18 h,使用前活化2次。
1.1.2 实验试剂
BHI、脑心浸液琼脂(brain heart infusion agar,BHIA)、蛋白胨、葡萄糖,北京陆桥有限公司;NaCl、无水乙醇、95%乙醇、二甲苯、5%苯酚溶液,天津凯通化学试剂有限公司;结晶紫染料,国药集团有限公司;CCK-8试剂(cell counting kit-8,CCK-8),北京索莱宝有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS),武汉塞维尔有限公司;浓硫酸,红星实验仪器有限公司;96孔、48孔、24孔和6孔板细胞培养板,美国康宁有限公司;BCA蛋白定量试剂盒,北京康为世纪有限公司;LIVE/DEAD荧光染料,赛默飞世尔有限公司。
1.1.3 仪器与设备
G154DWS蒸汽压力灭菌锅,厦门致微;SPX40生化培养箱,宁波江南仪器厂;DK-52水浴锅,上海精鸿;THZ-C恒温摇床,苏州培英;FD-304真空冷冻干燥机,济南骏德仪器有限公司;LSM880Ariyscan超高分辨激光共聚焦显微镜(confocal laser scanning microscope, CLSM),德国蔡司公司;Epoch2酶标仪,美国博腾仪器;1300SERIES A2生物安全柜,美国赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 冻干枯草芽孢杆菌CFS制备
1.2.1.1 提取和冻干枯草芽孢杆菌CFS
将B. subtilis CMCC 63501按1.1.1节的方法活化后,6 000 r/min离心15 min得到枯草芽孢杆菌上清液,将收集的上清液经0.22 μm水系聚醚砜滤膜过滤后得到枯草芽孢杆菌CFS,于-80 ℃保存备用[5]。将过滤得到的枯草芽孢杆菌CFS分别转移至100 mL无菌离心管中,每管储存约20 mL后于-80 ℃冻藏,48 h后,于真空冷冻干燥机中冻干3 d,之后研磨成分布均匀的固体粉末,于4 ℃冰箱备用。
1.2.2 最小抑菌浓度(minimum inhibitory concentration,MIC)
参考YU等[6]的方法,用96孔板肉汤稀释法测定MIC,用BHI无菌培养液溶解枯草芽孢杆菌CFS,调整其质量浓度为200 mg/mL,随后将200 μL的枯草芽孢杆菌CFS加入到96孔板并依次取100 μL用BHI进行对半稀释,使其终质量浓度分别为200、100、50、25、12.5、6.25、3.125、1.562 5、0.781 25和0.390 625 mg/mL,随后将100 μL No.118加入到稀释好的96孔板中,使其终浓度为5×105 CFU/mL。其中纯BHI与菌液混合液作为阳性对照;阴性对照为用BHI复溶的无菌液的200 mg/mL的枯草芽孢杆菌CFS。将培养板于37 ℃培养24 h后,于酶标仪620 nm波长下读取吸光度值,MIC为读数与阴性对照平均值无显著差异的处理组,实验独立重复3次。
1.2.3 生物被膜形成
将冻干枯草芽孢杆菌CFS用BHI无菌培养液按照MIC为100 mg/mL的质量浓度复溶,分别调整孔内浓度为MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、1/64 MIC的抑制液处理No.118(使其终浓度为105 CFU/mL),用96孔板结晶紫染色法[7]对其生物被膜进行抑制实验。于25 ℃培养3 d后,使用PBS冲洗培养板3次,去除浮游菌后于室温下自然风干30 min,每孔加入200 μL结晶紫染液,避光染色30 min,用PBS冲洗培养板3次,洗去多余染液,室温下自然风干30 min,加入体积分数为95%的乙醇溶液,洗脱结合的生物被膜染料30 min,最后使用酶标仪于570 nm测定吸光度。记对照组OD570nm为OD0,处理组OD570nm为OD1,实验重复3次,生物膜抑制率的计算如公式(1)所示:
生物被膜抑制率/%=(OD0-OD1)/OD0×100
(1)
1.2.3.1 细胞代谢活力
参照尹清干等[8]的方法,调配枯草芽孢杆菌CFS抑制液的浓度为:MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、1/64 MIC,在96孔板中加入90 μL BHI和90 μL各梯度枯草芽孢杆菌CFS以及对照组180 μL BHI,接种20 μL No.118菌液(使其最终浓度为106 CFU/mL)于25 ℃培养3 d后,用PBS缓冲液冲洗96孔板3次,室温自然风干30 min,加入100 μL PBS和10 μL CCK-8试剂于37 ℃培养4 h,实验重复3次,测定OD450nm值。记对照组OD450nm为OD0,处理组OD450nm为OD1,代谢活性抑制率的计算如公式(2)所示:
代谢活性抑制率/%=(OD0-OD1)/OD0×100
(2)
1.2.3.2 自聚集能力和表面疏水性
参照KIM等[9]的方法,调配枯草芽孢杆菌CFS抑制液浓度分别为MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、1/64 MIC,将No.118菌株接种于上述不同BHI中37 ℃培养24 h后,每管加入6 mL菌液,使其初始OD600nm值在1.0左右,10 000×g离心5 min,收集沉淀,用PBS冲洗沉淀2次后,对照组加入2 mL PBS重悬菌液,处理组分别加入2 mL枯草芽孢杆菌CFS重悬菌液,测定初始OD600nm,记为A0,于37 ℃孵育6 h,随后取上清液200 μL加入96孔板中,测定最终OD600nm,记为A1,实验重复3次,自聚集率的计算如公式(3)所示:
自聚集率/%=(A0-A1)/A0×100
(3)
同理,测得A0后,每根离心管再加入2 mL二甲苯,涡旋5 min,静置40 min,取水相上清液200 μL,测水相OD600 nm,记为A1,实验重复3次,表面疏水性的计算如公式(4)所示:
表面疏水性/%=(A0-A1)/A0×100
(4)
1.2.3.3 鞭毛泳动能力
菌株泳动能力分为单一泳动和群集泳动,单一泳动平板的配方为:10 g/L胰蛋白胨,5 g/L NaCl,2.5 g/L葡萄糖,3 g/L琼脂粉;群集泳动平板的配方为:25 g/L LB,0.5 g/L葡萄糖,5 g/L琼脂粉。参照WANG等[10]的方法,按照10∶1的比例将泳动琼脂平板与MIC、1/2 MIC、1/4 MIC、1/8 MIC的枯草芽孢杆菌CFS混合均匀,阴性对照为BHIA平板,取3 μL OD600nm为1.0的No.118菌株悬浮液接种至2种平板的中心位置,在室温下放置20 min,使菌液充分吸收。单一泳动平板和群集泳动平板37 ℃培养48 h后测定菌株扩散菌圈的直径(mm),每种处理重复3次。
1.2.3.4 EPS
参照YANG等[11]的方法,将2次活化的No.118菌液分别加入终浓度为MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC、1/64 MIC的枯草芽孢杆菌CFS抑制液的24孔板中,每孔总体积为1 mL,菌液最终浓度为5×106 CFU/mL。每孔对照组为BHI,于25 ℃培养72 h后,用无菌生理盐水冲洗3次,4个复孔汇聚为1个平行,实验重复3次,富集后分别转入到无菌离心管中,在1 mL生物被膜样品中加入0.4 mL 1 mol/L NaOH,150 r/min、4 ℃振荡3 h,加入0.6 mL 8.5 g/L NaCl溶液,6 000×g 4 ℃离心20 min,0.45 μm滤膜过滤上清液,用苯酚-硫酸法测胞外多糖含量,BCA蛋白质定量试剂盒测蛋白含量,每个实验重复3次。
1.2.3.5 CLSM观察枯草芽孢杆菌CFS对No.118生物被膜的影响
参照KARYGIANNI等[12]的方法,将No.118接种至含有不同浓度枯草芽孢杆菌CFS(MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC)的聚苯乙烯细菌培养皿中(35 mm×10 mm)中,使菌液的最终浓度为5×105 CFU/mL,其中对照组为不含枯草芽孢杆菌CFS的BHI培养基。25 ℃培养72 h后,用无菌生理盐水洗涤3次,室温下风干45 min,然后用ViaGramTM Red+ Bacterial Gram Stain and Viability Kit试剂盒在黑暗中染色1 h。对生物被膜使用CLSM的20×物镜和63×油镜与488 nm氩激光器成像,在340~380 nm发射波长内收集4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)荧光和450~490 nm发射波长内收集SYTOX发射荧光,3D影像用ZEN Blue lite 2-3软件的z-stacks投影功能。
1.3 数据处理和统计分析
采用SAS 9.0分析枯草芽孢杆菌CFS对No.118的生物被膜抑制率、自聚集能力、表面疏水性、细胞代谢活性、鞭毛泳动能力、胞外聚合物的分泌等影响,采用Pearson相关系数法进行各因素间对No.118生物被膜抑制的相关性分析,差异显著水平为P<0.05,数据结果用平均值±标准偏差表示,使用Origin 2021软件作图。
2 结果与分析
2.1 枯草芽孢杆菌CFS抑制No.118的MIC
参照ZHANG等[13]的方法,制备含有抑菌物质的CFS作为抑菌剂。100 mg/mL的枯草芽孢杆菌CFS处理下的OD值为与阴性对照无明显差异的最低浓度,因此确定100 mg/mL为枯草芽孢杆菌CFS抑制No.118的MIC。
2.2 枯草芽孢杆菌CFS抑制No.118生物被膜形成相关特性的研究
2.2.1 枯草芽孢杆菌CFS对No.118生物被膜抑制作用
由图1可知,枯草芽孢杆菌CFS对No.118生物被膜具有显著的抑制作用,MIC下生物被膜抑制率可达69%,并且在亚抑菌浓度下,枯草芽孢杆菌CFS对No.118仍有50%~65%左右的抑制作用,随着CFS稀释倍数的增加,在浓度为1/16 MIC~1/64 MIC之间的抑制率趋于稳定,并保持47%左右。
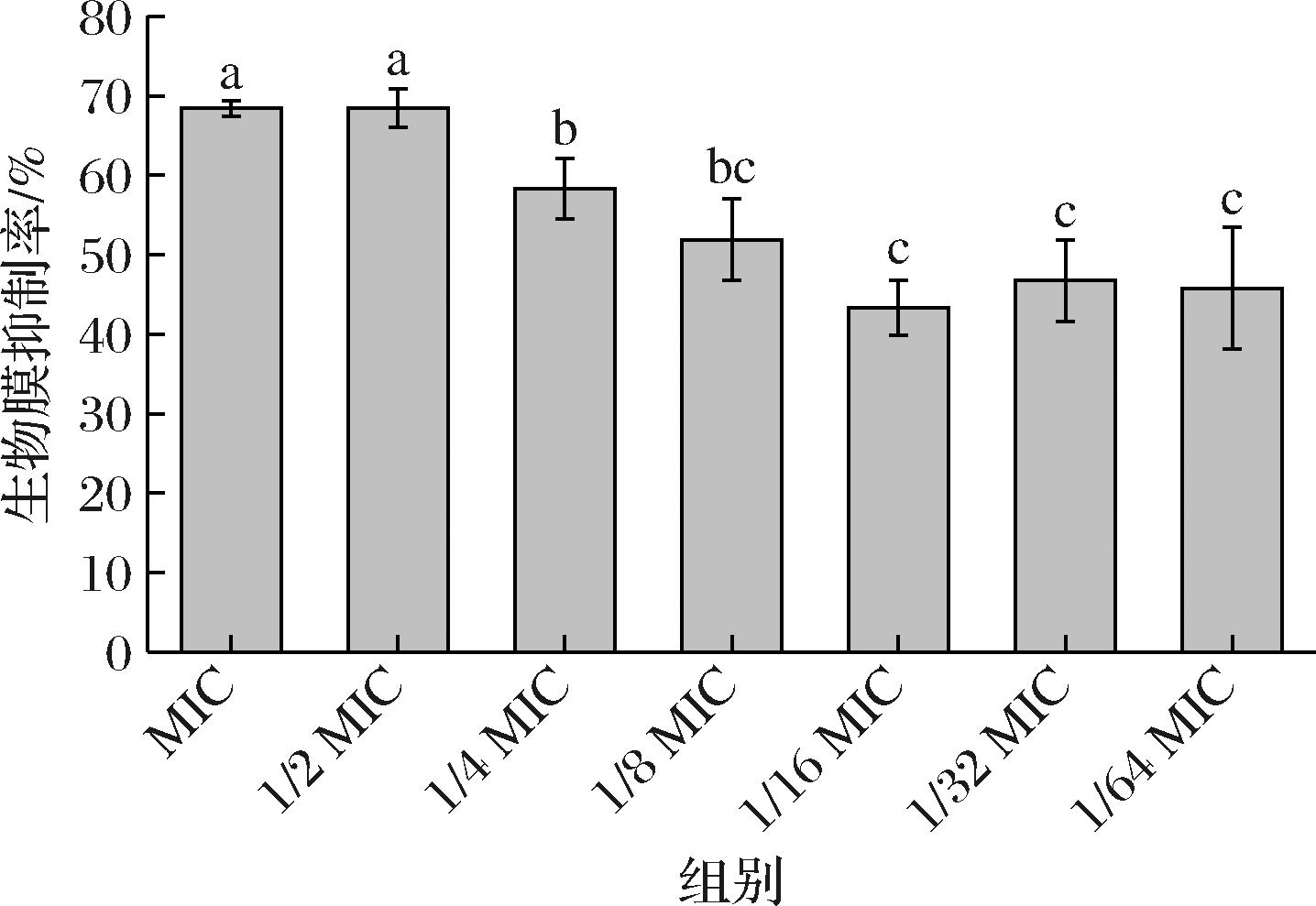
图1 不同浓度上清液对单增李斯特菌生物被膜的抑制率
Fig.1 Inhibition rate of L.monocytogenes biofilm with different concentration of CFS
注:不同字母表示组间差异显著(P<0.05)(下同)。
相似的,MELIAN等[14]的研究同样发现亚抑菌浓度下的弯曲乳杆菌细菌素(20 AU/mL)对L.monocytogenes生物被膜抑制率高达73%。广泛的对于Ⅱ类细菌素研究表明,其可以通过增加目标菌株的细胞膜通透性,从而引发K+外流,以及干扰胞内DNA、RNA、蛋白质和多糖等大分子的生物合成等行为影响细菌正常代谢生长[13]。这与本实验结果大致契合,为接下来讨论亚抑菌浓度下枯草芽孢杆菌CFS抑制No.118生物被膜形成的机制奠定了基础。
2.2.2 枯草芽孢杆菌CFS对No.118代谢活性抑制率的影响
生物被膜的形成与细胞代谢活性有关[15],细胞生长期间可以进行线粒体呼吸,细胞代谢活性越强,越利于形成生物被膜。如图2所示,枯草芽孢杆菌CFS对No.118生物被膜中细胞代谢活性具有显著的抑制作用,MIC下抑制率最高为35%,随着稀释倍数的增加,抑菌浓度降低,抑制作用也显著降低(P<0.05),且在1/64 MIC时,CFS仅有14%的代谢活性抑制率。这与图1中枯草芽孢杆菌CFS对No.118的生物被膜抑制率趋势相一致,因此,枯草芽孢杆菌CFS极有可能通过抑制L.monocytogenes生物被膜细胞代谢活性从而抑制其生物被膜形成。WANG等[16]在研究植物乳杆菌CFS抑制噬水气单胞菌ST3的过程中发现,植物乳杆菌CFS会影响病原菌代谢通路相关基因的表达,这通路途径涉及氨基酸代谢、碳水化合物代谢、核苷酸代谢等。其中氨基酸代谢中对于组氨酸的利用与病原菌生物被膜形成有关,且氨基酸代谢和核苷酸代谢还会影响病原菌细胞壁的修复和合成活性[17]。因此,枯草芽孢杆菌CFS对No.118生物被膜氨基酸代谢的影响机制可能成为后续抑制L.monocytogenes生物被膜形成的研究方向之一。
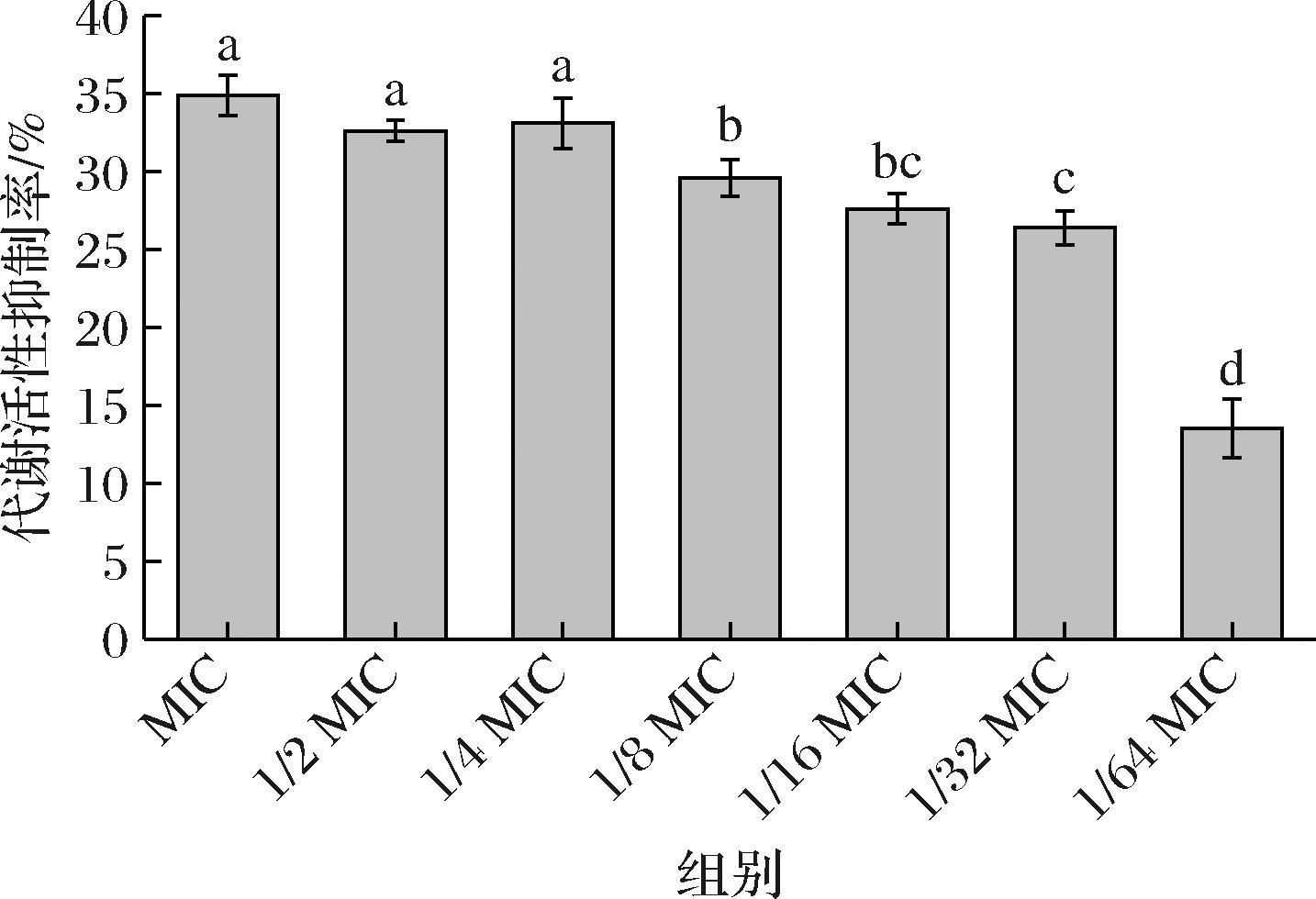
图2 不同浓度上清液对单增李斯特菌生物被膜细胞代谢活性抑制率的影响
Fig.2 Effects of CFS concentration on inhibitory rate of metabolic activity of L.monocytogenes biofilm cells
2.2.3 枯草芽孢杆菌CFS对No.118自聚集率影响
细菌的自聚集能力是细菌在非生物表面沉积和微菌落形成的重要机制,与菌体初始黏附和EPS分泌有关[18],影响生物被膜的形成。图3表明,枯草芽孢杆菌CFS对No.118的细胞自聚集具有显著抑制作用,最高可在65%左右,在亚抑菌浓度1/2 MIC~1/4 MIC处仍有50%以上的抑制作用,之后随抑制浓度的降低,抑制率随之降低,且不同质量浓度之间差异显著(P<0.05)。
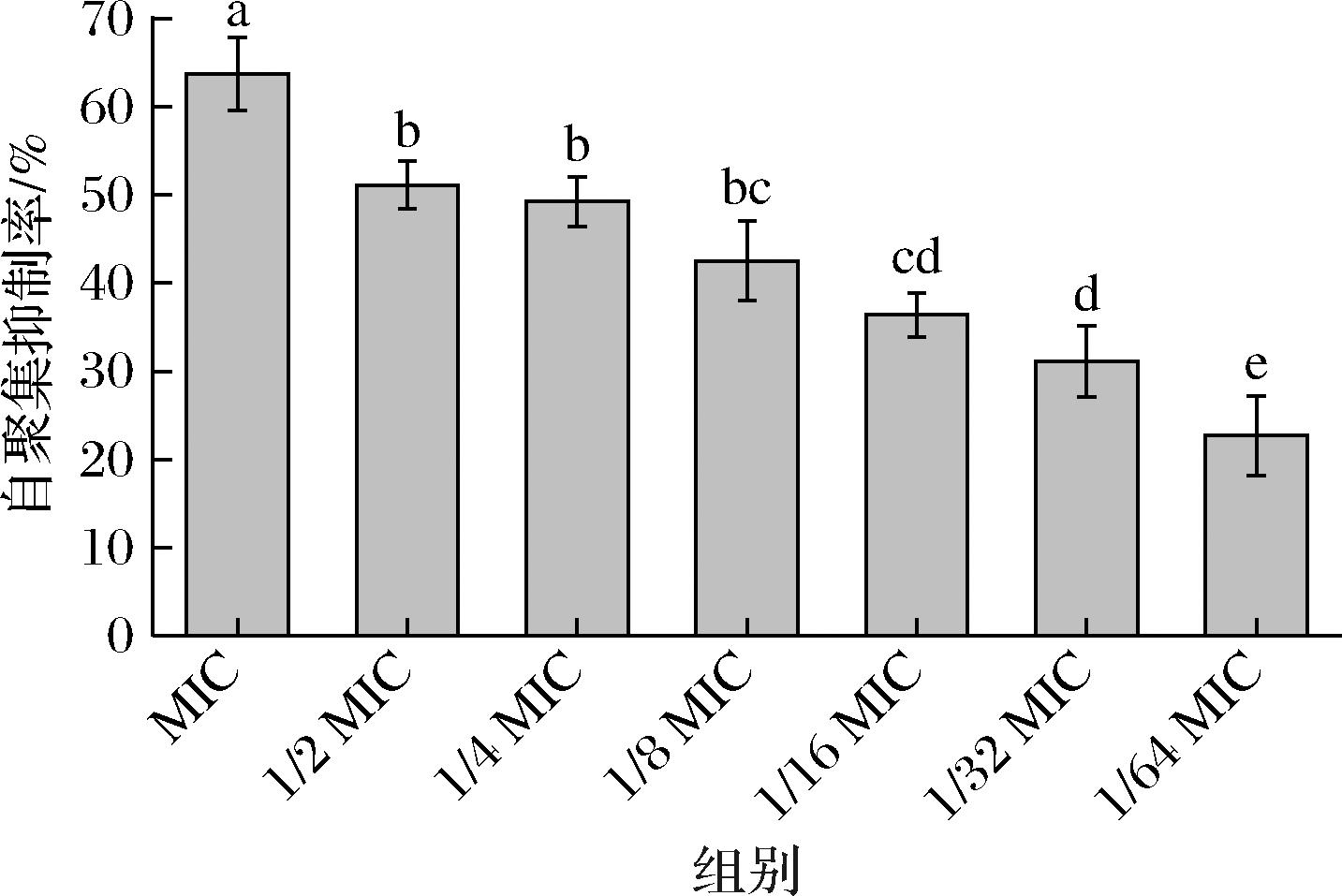
图3 不同浓度上清液对单增李斯特菌自聚集抑制率的影响
Fig.3 Effects of different concentrations of CFS on inhibitory rate of self-aggregation of L.monocytogenes cells
在1/64 MIC时,枯草芽孢杆菌CFS对No.118的自聚集抑制率仅在22%。KIM等[9]在研究酿酒酵母CFS对L.monocytogenes的抑制中发现,酿酒酵母CFS通过降低L.monocytogenes自聚集来抑制初始黏附性,同时下调了细胞表面蛋白基因actA、运动基因flaA等。ActA可以刺激肌动蛋白的局部聚合,有助于L.monocytogenes的自身运动和传播,TRAVIER等[19]还指出actA与L.monocytogenes细胞自聚集能力有重要联系,因此在枯草芽孢杆菌CFS对L.monocytogenes生物被膜抑制过程中,actA可能是一个潜在的控制靶点,从而影响细胞自聚集能力。这还说明,枯草芽孢杆菌CFS可能中含有靶向作用于actA的物质或基团,具体结构和作用机理尚有待进一步考据。
2.2.4 枯草芽孢杆菌CFS对No.118表面疏水性影响
细菌表面疏水性能力也与菌体对环境的附着力有关,因此可能会影响菌株的初始黏附和生物被膜形成[18]。由图4可知,枯草芽孢杆菌CFS对No.118具有很强的表面疏水抑制作用,其中枯草芽孢杆菌CFS抑制浓度在MIC~1/64 MIC之间时,枯草芽孢杆菌CFS对No.118的抑制率维持在75%以上。这说明枯草芽孢杆菌CFS对No.118的疏水性具有显著抑制作用,且在较低浓度下仍具较强的抑制效果。有研究指出,细菌表面的疏水性是引发菌体初始黏附的重要因素,并与细菌的细胞膜中存在的疏水化合物(蛋白质、脂肪酸等)的疏水基团有关[20]。因此推测本研究中枯草芽孢杆菌CFS代谢物中含有的肽类抑菌物质的疏水基团可能会与No.118细胞膜上的疏水基团相结合,降低了No.118的表面疏水性,使得细胞膜渗透性增强,导致No.118产生增溶效应[2]。
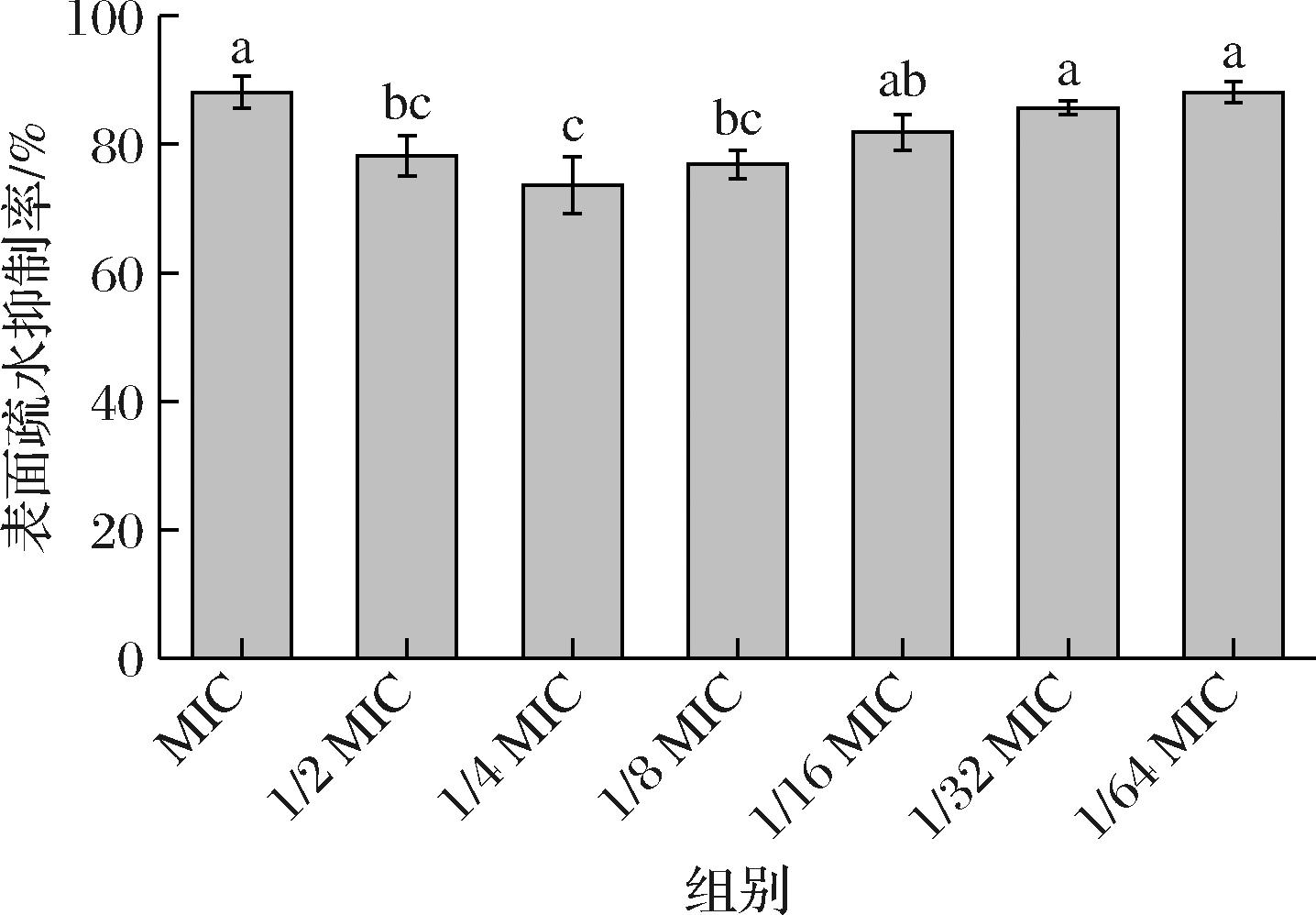
图4 不同浓度上清液对单增李斯特菌表面疏水抑制率的影响
Fig.4 Effects of CFS concentration on inhibitory rate of surface hydrophobicity of L. monocytogenes
联系WEI等[21]研究中提及的枯草杆菌JS-4细菌素可以通过在L.monocytogenes细胞膜上形成“孔道”,增加其细胞膜的通透性,造成细胞自溶等结果,这与本研究中表面疏水性的结果类似。SATPUTEA等[22]也在文章中也指出,酿酒酵母CFS中含有的生物表面活性剂也可以通过降低L.monocytogenes表面疏水性,从而降低其微生物附着在物体表面的能力。由此推测,枯草芽孢杆菌CFS通过抑制No.118的表面疏水性增加细胞膜渗透作用,导致细胞结构被破坏,从而抑制了No.118生物被膜形成的初始黏附阶段。
2.2.5 枯草芽孢杆菌CFS对No.118泳动能力影响
细菌的泳动能力主要依靠鞭毛进行,分为单一泳动能力和群集泳动能力,他们组成聚集细胞团在基质表面运动,有助于EPS的分泌附着,利于生物被膜的形成[23]。由表1可知,枯草芽孢杆菌CFS对No.118的单一泳动能力具有轻微的促进作用,不表现为显著抑制作用,而在群集泳动能力的上表现出浓度依赖的抑制差异(P<0.05)。由此可推断,枯草芽孢杆菌CFS更多表现为对No.118群集泳动能力的抑制,从而影响生物被膜的形成。这说明,No.118生物被膜的形成与群集泳动能力呈现正相关,由此推测枯草芽孢杆菌CFS极有可能抑制了No.118的群体感应,进而影响了细胞间信号传递,从而抑制细胞自聚集能力和群集泳动,进而影响生物被膜的形成。
表1 不同浓度上清液对单增李斯特菌鞭毛泳动能力的影响
Table 1 Effects of different concentrations of CFS on flagellum swimming capacity of L. monocytogenes

泳动能力指标组别CG1/8 MIC1/4 MIC1/2 MICMIC单一泳动菌株扩散圈直径/mm6.00±0.2c6.25±0.25bc6.43±0.11a6.33±0.15bc6.76±0.25a群集泳动菌株扩散圈直径/mm6.93±0.4a7.00±0.2a6.33±0.15b6.23±0.05b6.40±0.17b
注:不同字母表示同一菌株不同浓度之间差异显著(P<0.05);CG表示对照组。
2.2.6 枯草芽孢杆菌CFS对No.118 EPS分泌影响
No.118分泌的EPS是一种主要成分为多糖和蛋白质的有机高分子物质,它们主要黏附在周围环境中,以此保证生物被膜功能及完整,是生物被膜难以去除的主要原因。由图5-a和图5-b的对照组中可以看出,在亚抑菌浓度枯草芽孢杆菌CFS处理下,No.118 EPS中的蛋白含量为0.009 μg/mL,多糖含量为0.006 mg/mL,而对照组EPS中的蛋白含量为0.11 μg/mL,多糖含量为0.173 mg/mL,这说明枯草芽孢杆菌CFS显著抑制了No.118 EPS的分泌,且随抑制浓度的降低,枯草芽孢杆菌CFS对EPS的抑制作用显著下降(P<0.05)。SOUSA等[24]指出,EPS是生物被膜走向成熟的标志,对生物被膜的结构和被膜量以及细胞间的相互作用具有重要影响。因此,枯草芽孢杆菌CFS可能抑制了No.118生物被膜的成熟阶段从而影响生物被膜形成。
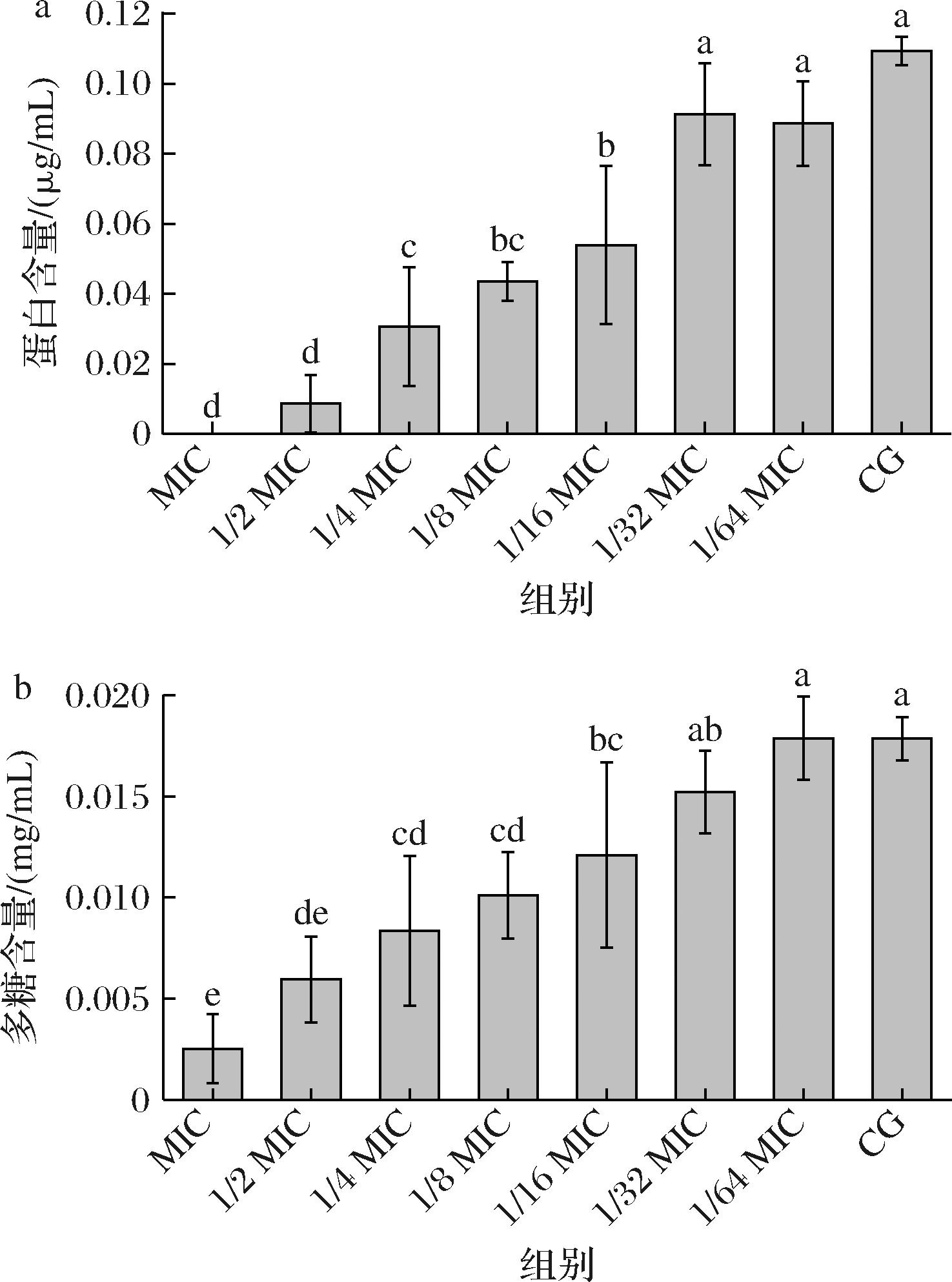
a-蛋白含量;b-多糖含量
图5 不同浓度上清液对单增李斯特菌胞外聚合物分泌的影响
Fig.5 Effects of different concentrations of CFS on EPS secretion of L. monocytogenes
注:CG表示对照组。
2.3 枯草芽孢杆菌CFS对No.118生物被膜细胞分布结构的影响
CLSM可以观察生物被膜的细胞分布和结构状态,由图6可以看出,与对照组“A1、a1”相比,经CFS处理的No.118生物被膜细胞大量受损,SYTOX荧光染料大量穿透受损的细胞膜并在图中广泛显示呈绿色,并且具有完整细胞膜结构的生物被膜细胞(蓝色荧光)数量明显低于对照组。此外,在不同抑制浓度(MIC~1/16 MIC)的枯草芽孢杆菌CFS作用下,激光共聚焦显微镜下No.118生物被膜细胞呈现趋势性变化,即蓝色荧光强度逐渐增加,绿色荧光相对减弱。该结果验证了图1生物被膜抑制率结果的同时,更加直观的观测了No.118在不同浓度枯草芽孢杆菌CFS处理下生物被膜的结构特点。
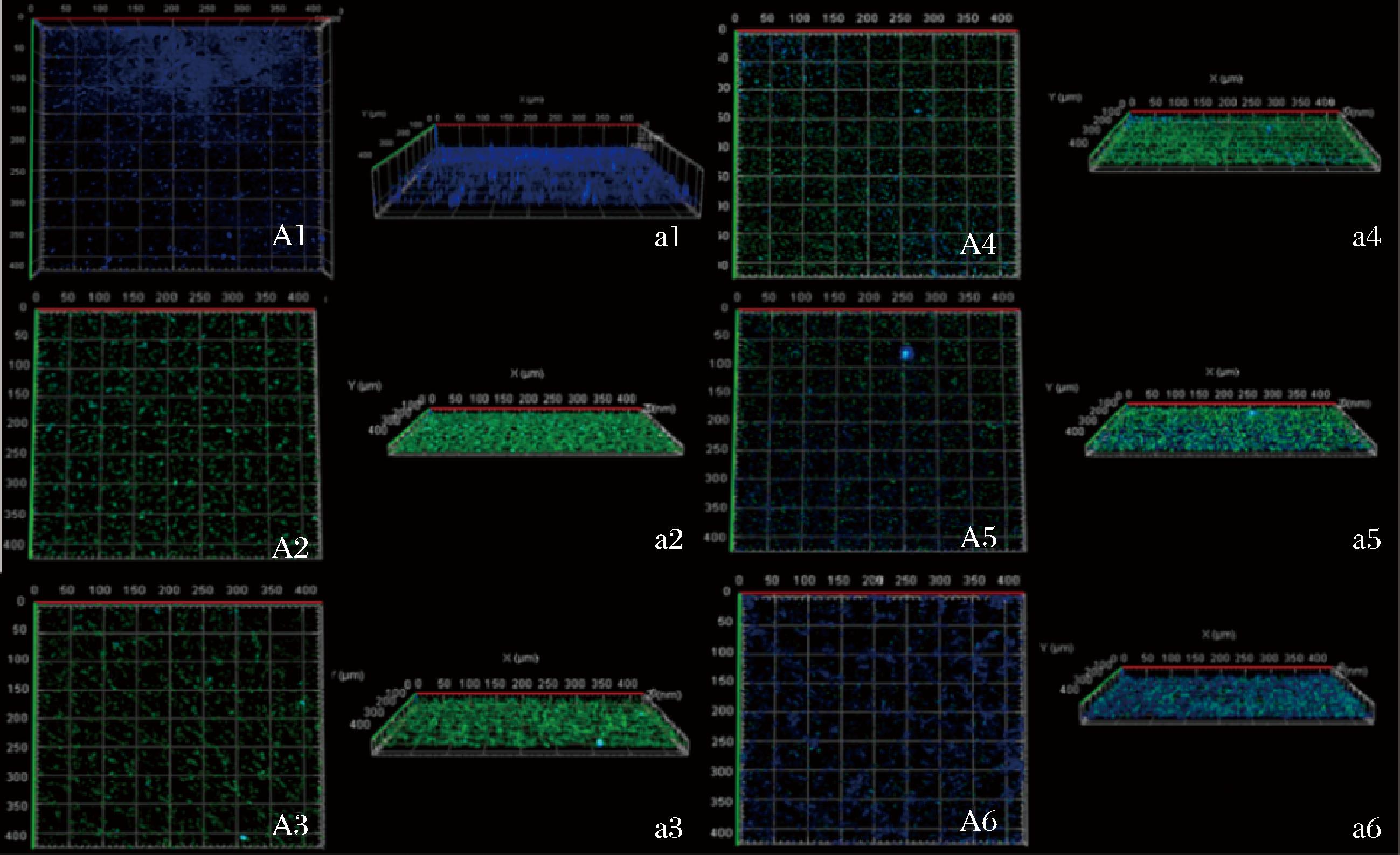
图6 CFS对No.118生物被膜结构的影响
Fig.6 Effect of CFS on the structure of No.118 biofilm
注:A、a分别为CLSM下观察No.118的2D和3D结构图;1为对照组; 2、3、4、5、6分别为MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC浓度CFS处理下No.118生物被膜结构图。
2.4 枯草芽孢杆菌CFS对No.118生物被膜抑制的各因素间的相关性分析
由表2相关性分析可得,枯草芽孢杆菌CFS可通过抑制No.118细胞代谢活性、自聚集能力、鞭毛群集泳动及EPS分泌影响L.monocytogenes成膜。其中自聚集抑制率、群集泳动能力、代谢活性抑制率、多糖含量和蛋白含量之间具有显著的相关性,而各因素与表面疏水抑制率之间均没有显著的相关性。由此推测枯草芽孢杆菌CFS可能是通过2种途径抑制No.118生物被膜的形成:基于对No.118细胞代谢活性的影响从而抑制成膜,涉及的相关表征现象包括No.118的自聚集能力、群集泳动能力和EPS分泌均被显著降低;通过影响No.118细胞膜成分的疏水性基团,从而降低细胞表面疏水性,增加细胞膜渗透作用,破坏细胞结构,从而抑制生物被膜形成。
表2 各因素间对No.118生物被膜抑制的相关性
Table 2 Correlation of factors to inhibition of No.118 biofilm

生物被膜抑制率自聚集抑制率代谢活性抑制率表面疏水性抑制率群集泳动多糖含量自聚集抑制率0.773**代谢活性抑制率0.643**0.869**表面疏水性抑制率-0.091-0.251-0.443*群集泳动-0.649**-0.598*-0.703**0.014多糖含量-0.823**-0.831**-0.782**0.2080.330蛋白含量-0.808**-0.850**-0.767**0.2790.4940.953**
注:*代表P<0.05;**代表P<0.01。
3 结论与讨论
基于上述研究内容,本研究发现枯草芽孢杆菌CFS可作为一种天然抑菌剂抑制L.monocytogenes生物被膜形成。枯草芽孢杆菌CFS显著降低了生物被膜内的细胞代谢活性,这很可能影响了No.118的生物被膜形成相关代谢通路,使得细菌对营养物质的分解效率减慢,降低了细胞的初始黏附能力,并最终影响生物被膜的形成。而细胞的表面疏水能力与细胞膜上的疏水基团有关[25]。由此推测,枯草芽孢杆菌CFS中含有的肽类抑菌物质的疏水基团与No.118细胞膜成分中的疏水基团相互作用,使其极性降低,表现出疏水抑制。此外,细胞的自聚集能力与鞭毛的群集泳动能力有关,属于生物被膜形成初始阶段的细胞互作。本研究中的抑制机制可能涉及相关的群体感应调控[26],细胞的单一泳动没有被抑制也证明了这一点。并且,类似的研究也表明,细菌素可作为一种群体感应抑制剂,通过下调群体感应基因以及干扰信号分子交流来控制L.monocytogenes生物被膜的形成[27]。因此,本研究中枯草芽孢杆菌CFS是否基于对L.monocytogenes生物被膜群体感应信号分子的作用机制可作为进一步研究的重点。
[1] LIU Y T, SUN W X, SUN T M, et al.The prevalence of Listeria monocytogenes in meat products in China:A systematic literature review and novel meta-analysis approach[J].International Journal of Food Microbiology, 2020, 312:108358.
[2] ADETUNJI C O, OLANIYAN O T, ANANI O A, et al.Role of biosurfactant in the destruction of pores and destabilization of the biological membrane of pathogenic microorganisms[M]//Green Sustainable Process for Chemical and Environmental Engineering and Science.Amsterdam:Elsevier, 2022:175-188.
[3] KASPAR F, NEUBAUER P, GIMPEL M.Bioactive secondary metabolites from Bacillus subtilis:A comprehensive review[J].Journal of Natural Products, 2019, 82(7):2038-2053.
[4] LIU Y G, DONG P C, ZHU L X, et al.Effect of four kinds of natural antimicrobial compounds on the biofilm formation ability of Listeria monocytogenes isolated from beef processing plants in China[J].LWT, 2020, 133:110020.
[5] VERMA P, ANAND S.Antimicrobial activity as a potential factor influencing the predominance of Bacillus subtilis within the constitutive microflora of a whey reverse osmosis membrane biofilm[J].Journal of Dairy Science, 2020, 103(11):9992-10000.
[6] YU X X, LI J Y, MU D S, et al.Green synthesis and characterizations of silver nanoparticles with enhanced antibacterial properties by secondary metabolites of Bacillus subtilis (SDUM301120)[J].Green Chemistry Letters and Reviews, 2021, 14(2):190-203.
[7] MELO T A, DOS SANTOS T F, DE ALMEIDA M E, et al.Inhibition of Staphylococcus aureus biofilm by Lactobacillus isolated from fine cocoa[J].BMC Microbiology, 2016, 16(1):250.
[8] 尹清干, 程俊茗, 刘腾飞, 等.环境因子对鳗弧菌生物膜形成的影响[J].微生物学通报, 2018, 45(1):138-145.YIN Q G, CHENG J M, LIU T F, et al.Characteristics of biofilm formation of pathogenic Vibrio anguillarum[J].Microbiology China, 2018, 45(1):138-145.
[9] KIM Y J, YU H H, SONG Y J, et al.Anti-biofilm effect of the cell-free supernatant of probiotic Saccharomyces cerevisiae against Listeria monocytogenes[J].Food Control, 2021, 121:107667.[10] WANG H H, CAI L L, LI Y H, et al.Biofilm formation by meat-borne Pseudomonas fluorescens on stainless steel and its resistance to disinfectants[J].Food Control, 2018, 91:397-403.
[11] YANG X, PEI Z J, HU R J, et al.Study on the inhibitory activity and possible mechanism of myriocin on clinically relevant drug-resistant Candida albicans and its biofilms[J].Biological &Pharmaceutical Bulletin, 2021, 44(3):305-315.
[12] KARYGIANNI L, ATTIN T, THURNHEER T.Combined DNase and proteinase treatment interferes with composition and structural integrity of multispecies oral biofilms[J].Journal of Clinical Medicine, 2020, 9(4):983.
[13] ZHANG J, GU S B, ZHANG T R, et al.Characterization and antibacterial modes of action of bacteriocins from Bacillus coagulans CGMCC 9951 against Listeria monocytogenes[J].LWT, 2022, 160:113272.
[14] MELIAN C, BENTENCOURT E, CASTELLANO P, et al.Biofilm genes expression of Listeria monocytogenes exposed to Latilactobacillus curvatus bacteriocins at 10 ℃[J].International Journal of Food Microbiology, 2022, 370:109648.
[15] CHIANG W C, PAMP S J, NILSSON M, et al.The metabolically active subpopulation in Pseudomonas aeruginosa biofilms survives exposure to membrane-targeting antimicrobials via distinct molecular mechanisms[J].FEMS Immunology and Medical Microbiology, 2012, 65(2):245-256.
[16] WANG D, LIU Y F, LI X P, et al.Unraveling the antibacterial mechanism of Lactiplantibacillus plantarum MY2 cell-free supernatants against Aeromonas hydrophila ST3 and potential application in raw tuna[J].Food Control, 2023, 145:109512.
[17] ZHOU Y H, XU C G, YANG Y B, et al.Histidine metabolism and IGPD play a key role in cefquinome inhibiting biofilm formation of Staphylococcus xylosus[J].Frontiers in Microbiology, 2018, 9:665.
[18] YANG S J, LEE J E, LIM S M, et al.Antioxidant and immune-enhancing effects of probiotic Lactobacillus plantarum 200655 isolated from kimchi[J].Food Science and Biotechnology, 2018, 28(2):491-499.
[19] TRAVIER L, GUADAGNINI S, GOUIN E, et al.ActA promotes Listeria monocytogenes aggregation, intestinal colonization and carriage[J].PLoS Pathogens, 2013, 9(1):e1003131.
[20] ALIZADEH BEHBAHANI B, NOSHAD M, FALAH F.Inhibition of Escherichia coli adhesion to human intestinal Caco-2 cells by probiotic candidate Lactobacillus plantarum strain L15[J].Microbial Pathogenesis, 2019, 136:103677.
[21] WEI Z H, SHAN C J, ZHANG L X, et al.A novel subtilin-like lantibiotics subtilin JS-4 produced by Bacillus subtilis JS-4, and its antibacterial mechanism against Listeria monocytogenes[J].LWT, 2021, 142:110993.
[22] SATPUTEA S K, BANPURKAR A G, BANAT I M, et al.Multiple roles of biosurfactants in biofilms[J].Current Pharmaceutical Design, 2016, 22(11):1429-1448.
[23] RUHAL R, KATARIA R.Biofilm patterns in gram-positive and gram-negative bacteria[J].Microbiological Research, 2021, 251:126829.
[24] SOUSA C, TEIXEIRA P, OLIVEIRA R.The role of extracellular polymers on Staphylococcus epidermidis biofilm biomass and metabolic activity[J].Journal of Basic Microbiology, 2009, 49(4):363-370.
[25] RODRIGUES L R, TEIXEIRA J A, VAN DER MEI H C, et al.Isolation and partial characterization of a biosurfactant produced by Streptococcus thermophilus A[J].Colloids and Surfaces.B, Biointerfaces, 2006, 53(1):105-112.
[26] CHANDLER J R, DUERKOP B A, HINZ A, et al.Mutational analysis of Burkholderia thailandensis quorum sensing and self-aggregation[J].Journal of Bacteriology, 2009, 191(19):5901-5909.
[27] MELIAN C, SEGLI F, GONZALEZ R, et al.Lactocin AL705 as quorum sensing inhibitor to control Listeria monocytogenes biofilm formation[J].Journal of Applied Microbiology, 2019, 127(3):911-920.