乳清分离蛋白(whey protein isolate, WPI)是一种由β-乳球蛋白、α-乳白蛋白、牛血清白蛋白、免疫球蛋白和糖巨肽等组成的高质量蛋白质,具有极高的营养价值(如容易消化和吸收,低脂肪和乳糖,以及多种必需氨基酸)和各种功能特性,包括乳化、凝胶性、发泡和增稠性[1]。其中凝胶特性是研究最为广泛的性质之一,可用于生产奶酪、酸奶和冰淇淋等产品。大量研究发现,WPI能与多糖、蛋白质、氨基酸、脂类和盐类等物质通过热、冷、酸、碱、酶、高压及高剪切等诱导方式制备复合凝胶,以改善WPI凝胶的理化性质。然而,WPI是在高浓度(>12%)下才能形成凝胶且WPI凝胶易受不同外部环境(温度、pH值和离子强度)的影响。其中蛋白质与多糖同时存在于许多食品体系中,因此WPI与多糖制备复合凝胶的研究较为广泛,例如玉米淀粉[2]、纳米纤维素[3]、黄原胶[4]、魔芋葡甘露聚糖(konjac glucomannan, KGM)[5]等的添加均能提高WPI凝胶性能及稳定性。但这些多糖的添加量均较低(≤1%)且易发生相分离。此外,还需要在一定离子浓度下才能提高凝胶的稳定性。由此看来,提高WPI凝胶的凝胶性质及稳定性并扩大其在食品领域中的应用是必不可少的。
KGM是一种大分子多糖,具有高吸水性、成膜性和增稠性。研究表明,低添加量的KGM(0%~0.5%)在WPI内形成了大的不规则形状的魔芋包裹体,从而提高了WPI凝胶的热固性凝胶性能[5]。然而,WPI的成胶浓度相对较高(11%)。此外,由于KGM的高黏度及高吸水性,其添加量非常小(<0.5%),并且KGM和WPI大分子之间容易发生相分离。氧化魔芋葡甘露聚糖(oxidized konjac glucomannan, OKGM)是由KGM通过高碘酸钠、臭氧微波协同等方法氧化改性后得到的一种相对低黏度、低分子质量的多糖,具有良好的生物相容性。目前,OKGM多与明胶、壳聚糖、羧甲基壳聚糖和氧化石墨烯等材料制备复合水凝胶,研究发现OKGM能增强胶原蛋白肽/羧甲基壳聚糖复合水凝胶的性能、缩短凝胶时间并促进凝胶网络的形成[6];研究OKGM对齐口裂腹鱼生长情况及免疫功能发现,添加日粮为8 000 mg/kg的OKGM能促进裂腹鱼生长并改善免疫功能[7],说明一定剂量的OKGM能促进生长发育;除此之外,OKGM还是一种优质的膳食纤维,具有促进肠道蠕动,降脂减糖、抗氧化等功能特性。由此看来,OKGM是一种优质的多糖,有望改善乳清分离蛋白凝胶的性能及稳定性并提供一定的营养特性。但是,OKGM加入后对WPI凝胶形成、质构、流变特性及稳定性的影响目前尚未研究。
因此,本文以WPI、OKGM为原料制备复合凝胶,研究不同添加量的OKGM对复合凝胶的持水性、质构、流变特性、热稳定性的影响,并从表面疏水性、游离巯基含量和微观结构等方面初步分析凝胶形成机理,为扩大乳清分离蛋白凝胶食品及功能特性的应用提供参考。
1 材料与方法
1.1 实验材料
魔芋精粉(纯度≥86%),湖北十堰花仙子魔芋制品有限公司;乳清分离蛋白(蛋白质含量为89%,脂肪含量为1.3%,乳糖含量为0.6%),美国希尔玛有限公司;其他化学试剂均为分析纯。
1.2 仪器与设备
FL-815Y臭氧消毒机,深圳飞立电器科技有限公司;LGJ-10型的冷冻干燥机,松源华兴科技有限公司;HCJ-4E磁力搅拌水浴锅,常州朗越仪器制造有限公司;AXTG16G离心机,盐城安信实验仪器有限公司;TA-XT plus质构仪,英国Stable Micro Systems公司;DHR-1流变仪、TGA550热重分析仪,美国TA公司;Phenom Pro扫描电镜,荷兰Phenom World公司;SYNERGY H1酶标仪,美国Biotek公司。
1.3 实验方法
1.3.1 OKGM的制备
参考实验室现有的方法[8]并稍作修改。准确称取4.0 g KGM粉末于400 mL蒸馏水中,在50 ℃水浴中溶胀1 h,采用臭氧微波协同方法(臭氧15 g/h,微波600 W,65 ℃)氧化KGM,氧化1 h后得到悬浮液,将其醇沉后冷冻干燥12 h得到OKGM粉末。经实验室前期测得的KGM、OKGM的分子质量分别为1.78×106和2.60×104[9]。
1.3.2 OKGM-WPI复合凝胶的制备
参考XIAO等[3]的方法制备复合凝胶并稍作修改。将WPI粉末(10%)溶解在试管中,在(26±1) ℃下搅拌2 h,然后在4 ℃下保存12 h以保证完全水合。将OKGM粉末(1%、1.5%、2%、2.5%和3%)加入到WPI分散液中,在40 ℃的磁力搅拌水浴锅中搅拌1 h,调节pH值至8.0±0.1。所有复合凝胶在90 ℃下加热30 min并成胶,然后立即冷却并在4 ℃的冰箱中储藏20 h以待分析。
1.3.3 持水性
复合凝胶的持水性参考XU等[10]的方法进行修改。准确称取凝胶样品3.0 g于15 mL离心管中,在8 000 r/min条件下离心25 min,离心后排出上清液的水并用滤纸吸干凝胶表面的水分。持水性的计算如公式(1)所示:
持水性/%=(W1/W2)×100
(1)
式中:W1,离心后的样品质量,g;W2,离心后的样品质量,g。
1.3.4 质构
参考PU等[11]的方法测定凝胶质构。所有凝胶样品在室温中平衡2 h后使用探针(P/0.5)进行TPA测试。测前速度为1.5 mm/s,测中、测后速度均为1.0 mm/s,触发力4.0 g,压缩比40%。
1.3.5 流变学特性
复合凝胶的流变学特性参考CAO等[12]和ZHAO等[13]的方法并稍作修改。测试前样品在25 ℃下放置2 h,选择PP 25平行板进行实验,平板间隙1 mm,将二甲基硅油覆盖于平板边缘以防止实验过程中水分的散失,25 ℃平衡120 s。
稳态扫描:在0.1~100 s-1的剪切速率下进行扫描,测试温度为25 ℃,观察复合凝胶的表观黏度随剪切速率的变化。
频率扫描:在0.1~100 rad/s的角频率下测定样品的动态黏弹性,应变0.5%。
温度扫描:测试温度范围是25~95 ℃,升温速率为5 ℃/min,观察样品的储能模量(G′)和损耗模量(G″)随温度变化的情况。
1.3.6 热稳定性分析
将冷冻干燥后的样品(3~5 mg)放入热重分析仪以确定凝胶的热稳定性。采用流速为20 mL/min的N2作为冷却介质,测试范围为30~600 ℃,升温速率为20 ℃/min。
1.3.7 扫描电镜分析
凝胶样品被冻干后切成薄片,固定在载样台上,喷金后进行观察,记录下255X的扫描电镜图像。
1.3.8 表面疏水性测定
复合凝胶的表面疏水性采用JIANG等[14]的方法并稍作修改。准确称取0.5 g凝胶溶于25 mL磷酸盐缓冲液(pH=7.0,0.01 mol/L)中,离心后取上清液稀释至质量浓度为4、8、12、16、20 mg/mL。取稀释样品溶液4 mL与20 μL 8 mmol/L 8-苯胺-1-萘磺酸盐混合(ANS溶于磷酸盐缓冲液中)。该混合物在室温黑暗条件下反应15 min,在379 nm激发光和479 nm发射光下测量荧光强度,用斜率表明表面疏水性指数H0。
1.3.9 游离巯基
游离巯基含量的测定参考ZHANG等[15]的方法。称取0.5 g凝胶样品于5 mL Tris-Gly缓冲液(pH=8.0)中溶解,在室温下搅拌2 h,离心稀释后取3 mL与30 μL 4 mg/mL Ellman试剂(DTNB溶于Tris-Gly缓冲液中)混合,将混合物置于室温下反应20 min,随后在412 nm下测定吸光度。游离巯基含量的计算如公式(2)所示:
SH/(μmol/g)=(73.53×A412 nm×D)/C
(2)
式中:A,412 nm处的吸光度;C,样品蛋白质的浓度,mg/mL;D,稀释倍数。
1.4 数据处理与分析
所有实验均重复3次,结果用平均值±标准差来表示。采用SPSS 23.0对数据进行方差分析,显著性水平为P<0.05。Origin 2018作图。
2 结果与分析
2.1 持水性
持水性是蛋白凝胶制品的一个重要指标。如图1所示,纯乳清分离蛋白凝胶的持水性为53.58%,添加OKGM后复合凝胶持水性均显著增加,其中OKGM添加1%时最高(93.42%),这是因为OKGM与WPI之间形成了交联体,使网络结构更加密集,保留了更多的水分,从而提高了乳清分离蛋白凝胶的持水性[16]。当OKGM添加量超过2%时,复合凝胶的持水性有所下降,这可能是由于高添加量的OKGM与WPI之间形成了大的生物聚合物,存在不相容性,从而降低了凝胶网络保留水分的能力[10]。
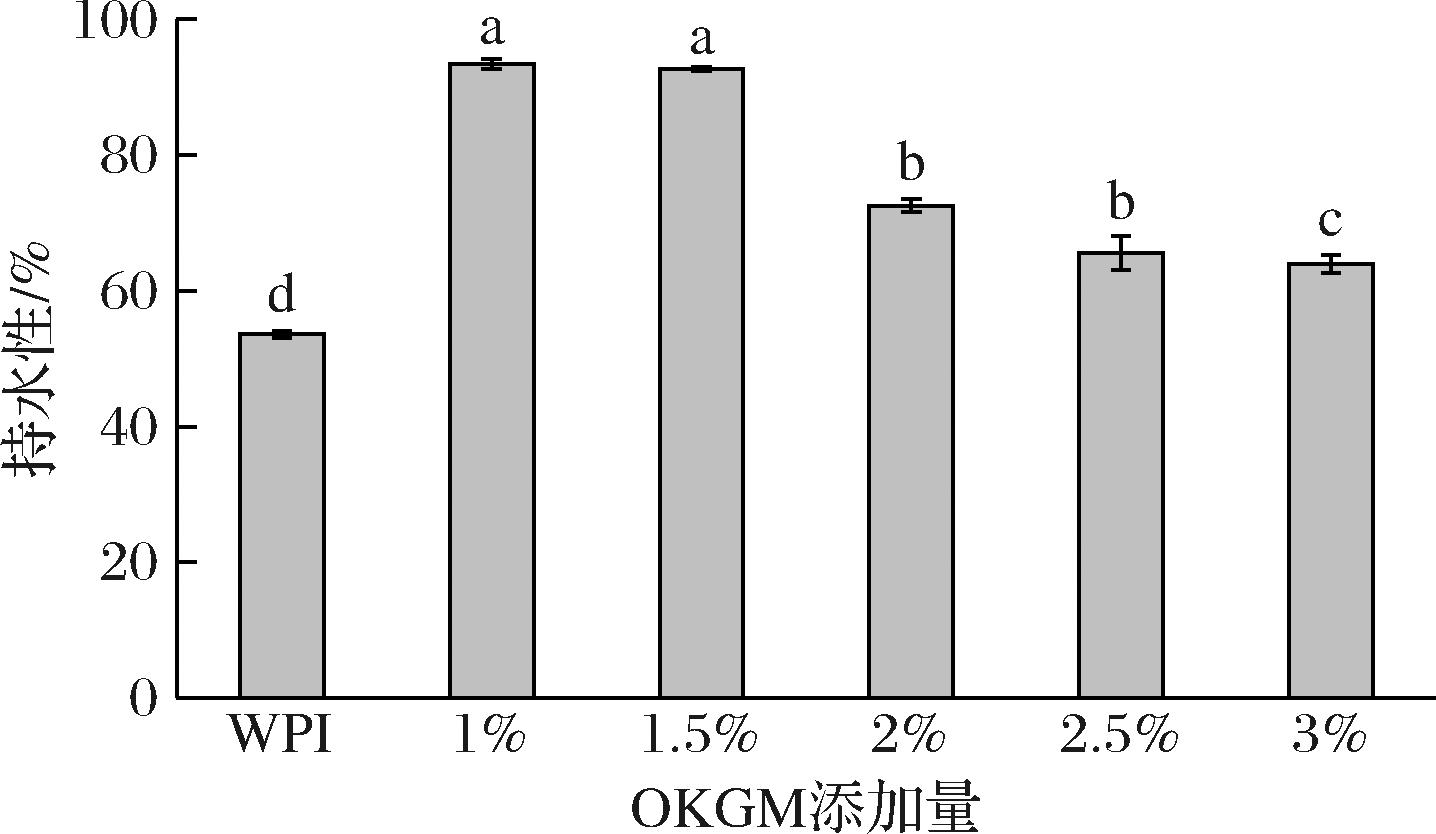
图1 OKGM添加量对OKGM-WPI复合凝胶持水性的影响
Fig.1 Effect of OKGM addition amounts on water holding capacity of OKGM-WPI composite gels
2.2 质构特性
质构特性是影响凝胶食品感官评价的重要特征之一。硬度是指压缩样品所需力的大小,胶着性是指将样品破裂成吞咽状态所需的能量,咀嚼性表示复合凝胶对咀嚼的抵抗所需的能量[17]。如表1所示,复合凝胶的硬度、胶着性、咀嚼性均随OKGM添加量的增加先升高后降低,当添加量达到2%时,其硬度、胶着性、咀嚼性值最大,分别为193.71 g、120.23 N和163.71 N,并与其他凝胶组存在显著差异。这可能是由于OKGM(≤2%)促进了分子间的交联和絮凝,提高了复合凝胶的硬度、胶着性、咀嚼性,但随着添加量的增加(2.5%和3%),OKGM的溶胀性和吸水性下降,导致凝胶网络结构变得松散,从而硬度等随之降低,这与代曜伊等[18]对竹笋-大豆蛋白复合凝胶质构的研究结果相似,竹笋纤维添加量过高时,其凝胶的硬度也会下降。弹性表示物体受外力压缩后发生形变并恢复原状的能力。复合凝胶的弹性(0.97~1.42)均高于纯乳清分离蛋白凝胶的弹性(0.94),说明OKGM的添加可以增强复合凝胶的弹性。综上,说明可以通过调节OKGM的添加量来改善乳清分离蛋白凝胶的硬度、咀嚼性和胶着性等质构特性,为开发硬度、黏弹性适宜的凝胶食品提供参考数据。
表1 OKGM添加量对OKGM-WPI复合凝胶质构特性的影响
Table 1 Effect of OKGM addition amounts on the textural properties of OKGM-WPI composite gels

凝胶组别硬度/g弹性胶着性/N咀嚼性/N回复性WPI14.78±2.95f0.94±0.05c11.84±1.75f11.26±1.93d0.40±0.06a1%45.94±1.06e1.42±0.07a25.87±3.84e36.89±6.26cd0.26±0.11ab1.5%88.32±4.50d1.08±0.13bc49.11±1.49d53.41±6.21bc0.16±0.08bc2%193.71±6.68a1.35±0.31ab120.23±10.97a163.71±47.36a0.27±0.07ab2.5%175.62±14.20b0.98±0.01c91.34±5.95b90.04±6.85b0.20±0.02bc3%146.47±3.22c0.97±0.00c78.40±1.61c76.50±1.48bc0.11±0.00c
2.3 流变特性
2.3.1 稳态剪切扫描
不同凝胶样品的表观黏度剪切分析如图2所示。随着剪切速率的增加,复合凝胶的表观黏度不断下降,并有剪切变薄行为,是一种典型的假塑性流体,这是由于较高的剪切速率(>10-1)破坏了分子间的网络和排列[19]。复合凝胶的表观黏度均高于纯乳清分离蛋白凝胶(45.09 Pa·s)并随着OKGM添加量的增加而增加,OKGM添加3%时达到最大值(1 447.31 Pa·s),这可能是高添加量的OKGM其复合溶液本身黏度也较高,从而增加了复合凝胶的表观黏度。
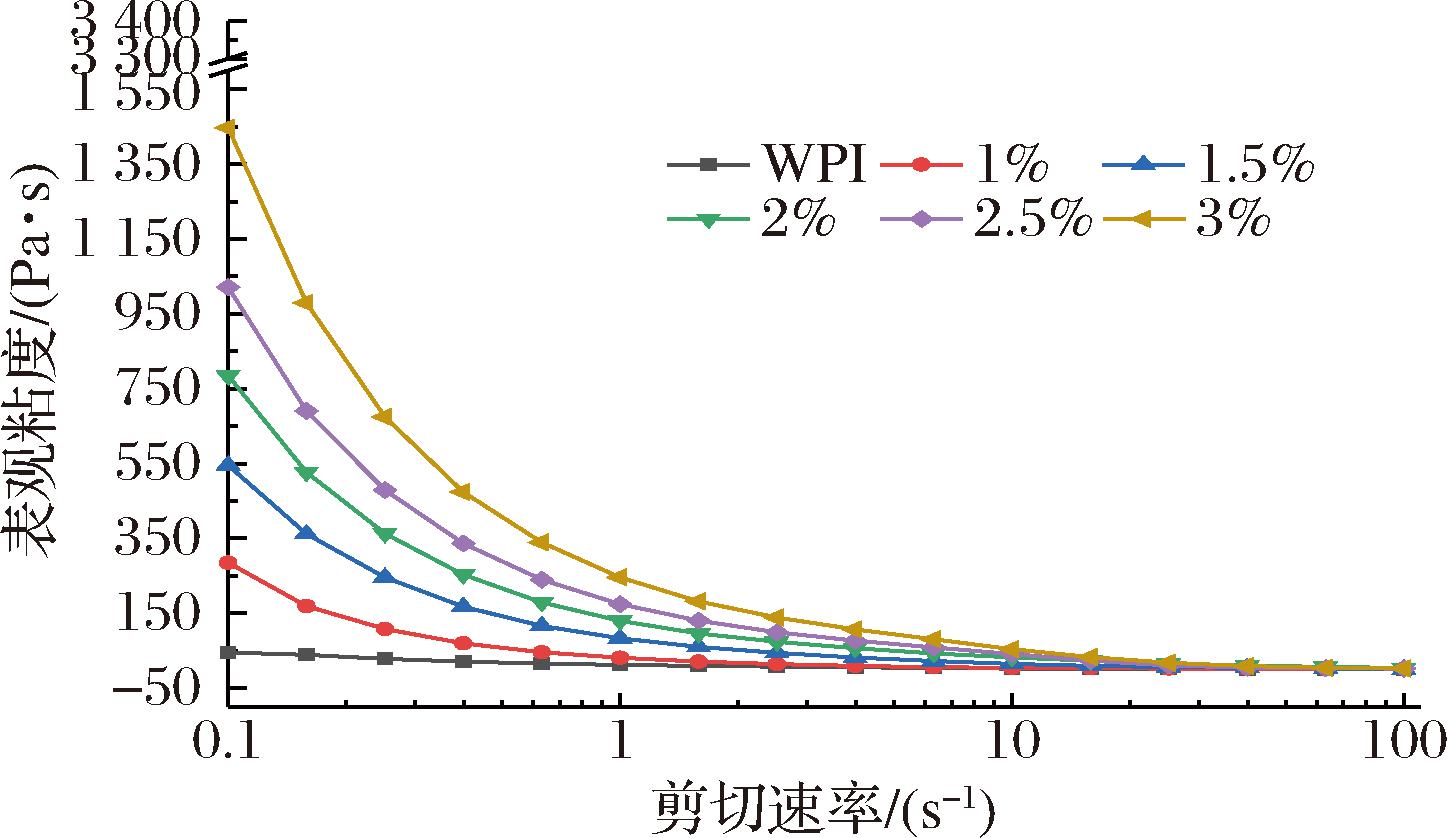
图2 OKGM-WPI复合凝胶的表观黏度曲线
Fig.2 The apparent viscosity curve of OKGM-WPI composite gels
2.3.2 动态频率扫描
储能模量(G′)和损耗模量(G″)是影响凝胶黏弹性能的关键指标,它反映了流体在变形过程中的能量储存和损失,分别代表弹性和黏性模量[20]。图3-a和图3-b表示所有凝胶样品的动态频率扫描曲线。随着角频率的提高,凝胶的G′和G″均增强,说明该复合凝胶具有更高的频率依赖性且G′总是大于G″,说明该凝胶具有高度结构化的弹性流变行为。复合凝胶的G′和G″随着OKGM添加量的增加而增加,说明体系的弹性和黏性随OKGM添加量的增加而增加,这可能是由于OKGM/WPI复合体系通过二硫键、氢键和其他非共价相互作用的交联和聚集,提高了样品的G′和G″及体系的稳定性[21]。
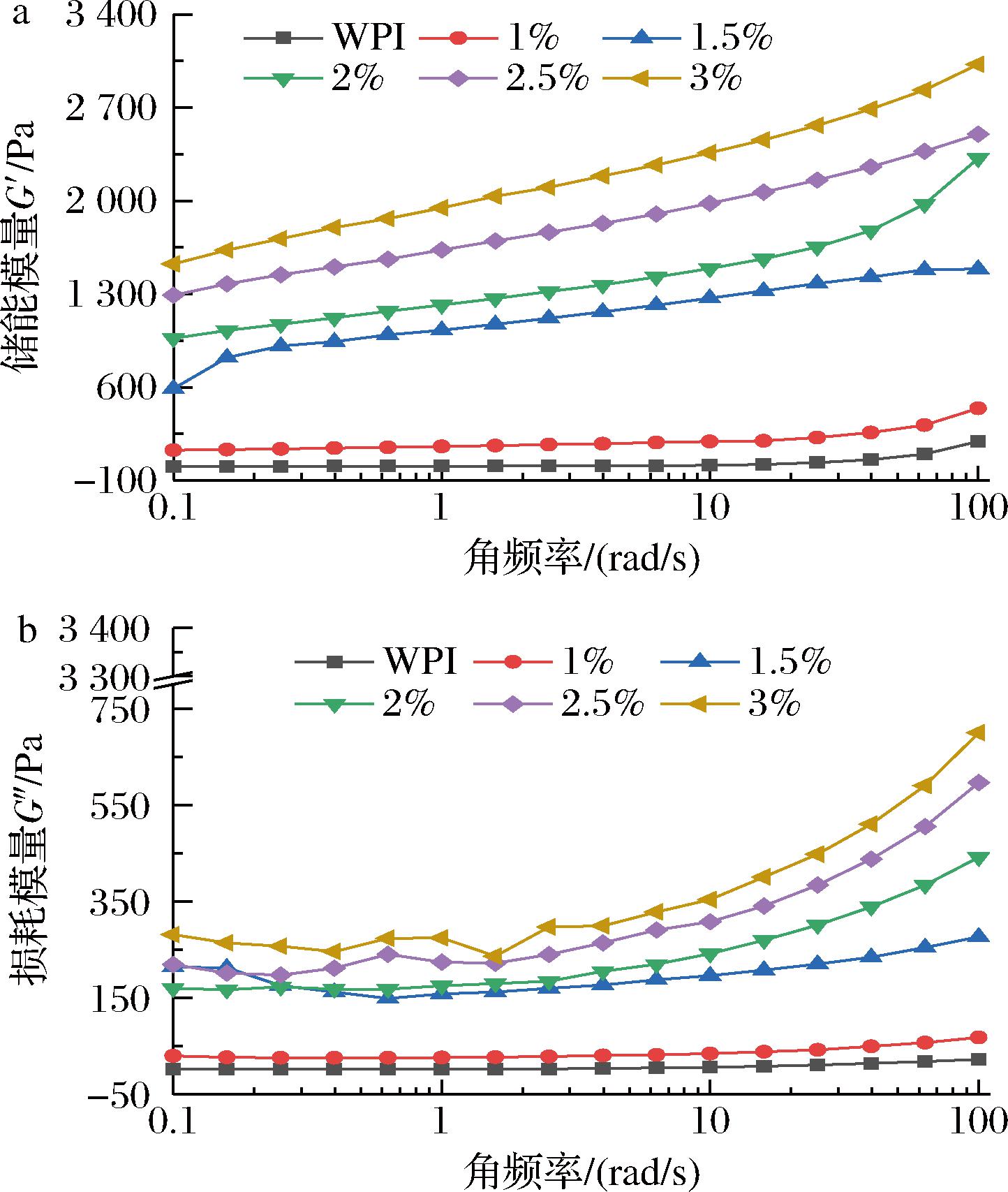
a-储能模量;b-损耗模量
图3 OKGM-WPI复合凝胶的动态频率扫描曲线
Fig.3 The dynamic frequency scan curve of OKGM-WPI composite gels
2.3.3 温度扫描分析
在25~95 ℃内对复合凝胶样品进行温度扫描测试,如图4-a和图4-b所示,所有样品的G′和G″随着温度的升高先逐渐下降后趋于平稳,这可能是因为离子键、氢键等非共价相互作用的下降以及蛋白质聚集物的解离导致复合体系的黏弹性下降[22]。在同一温度下,添加OKGM后,复合凝胶的G′和G″均高于纯乳清分离蛋白凝胶(9.60、5.34 Pa),OKGM添加量为3%达到时最大值(2 375.39、368.46 Pa),说明OKGM与WPI形成了复杂的网络结构和更多的分子内缠结,这与动态频率扫描结果一致(图3-a和图3-b)。
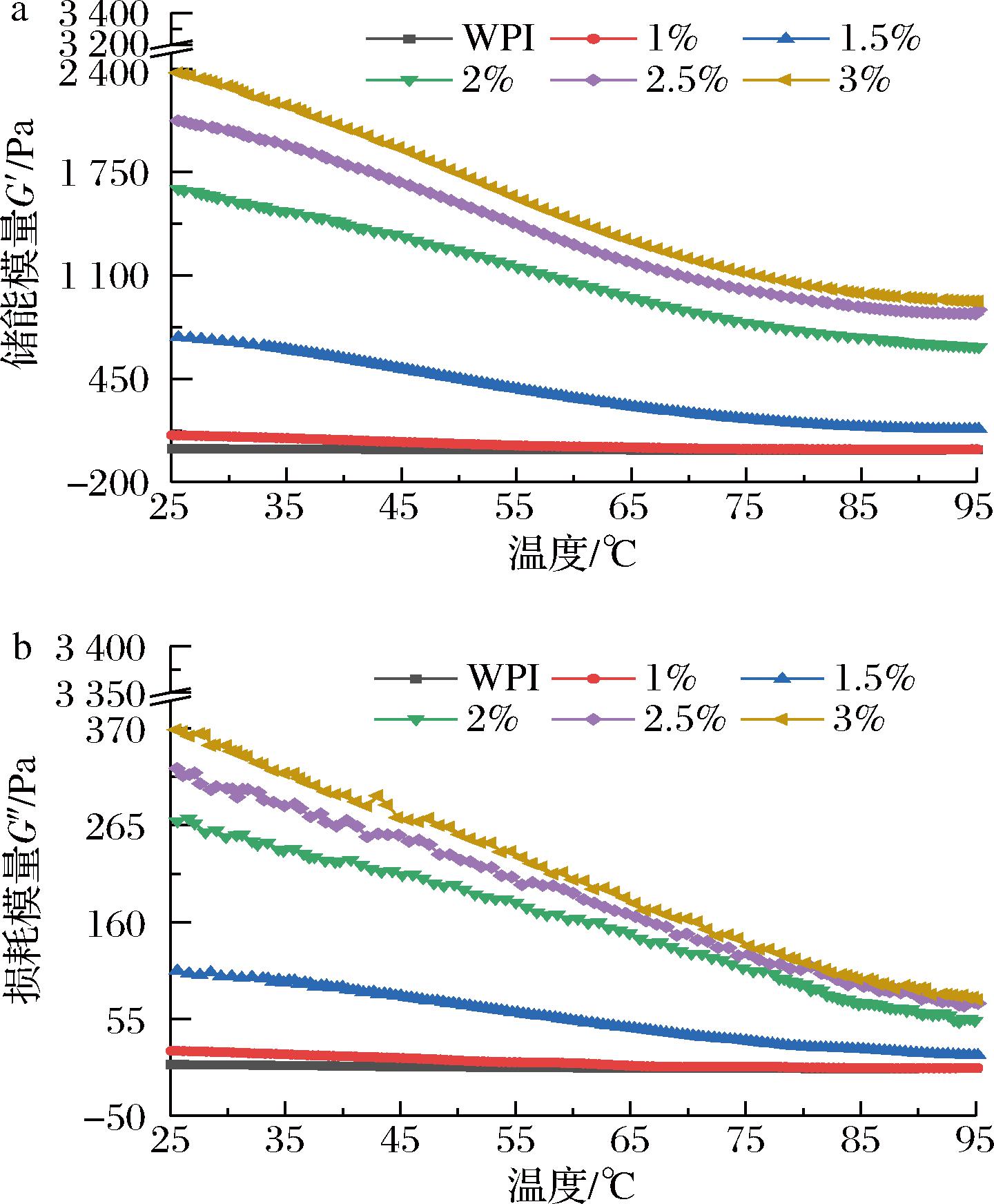
a-储能模量;b-损耗模量
图4 OKGM-WPI复合凝胶的温度扫描曲线
Fig.4 The temperature scan curve of OKGM-WPI composite gels
2.4 热稳定性分析
热重分析研究了OKGM的添加对WPI凝胶热稳定性的影响。图5-a和图5-b显示了所有样品的热重曲线。在30~600 ℃的温度范围内观察到凝胶降解的3个阶段,第一阶段在100 ℃左右,主要是由于水分的散失,第二阶段发生在150~190 ℃范围内,对应于蛋白质主链和碳水化合物的解聚,第三阶段主要发生在310 ℃左右,这一阶段的降解主要是因为解聚碎片的进一步破裂[23]。如图5-b所示,乳清分离蛋白在308.4 ℃发生热分解反应,OKGM添加量为1%和1.5%时,复合凝胶分别在311.3、311.4 ℃发生降解反应,说明OKGM(≤1.5%)能提高乳清分离蛋白凝胶的热稳定性,添加量为2%和2.5%时,复合凝胶的热分解温度为308.2、309.6 ℃,表明较高添加量的OKGM对凝胶的热稳定性无显著影响;当OKGM添加量为3%时,热分解反应下降到307.2 ℃,这可能是由于大分子聚合物存在热力学不相容性,导致其热稳定性下降。
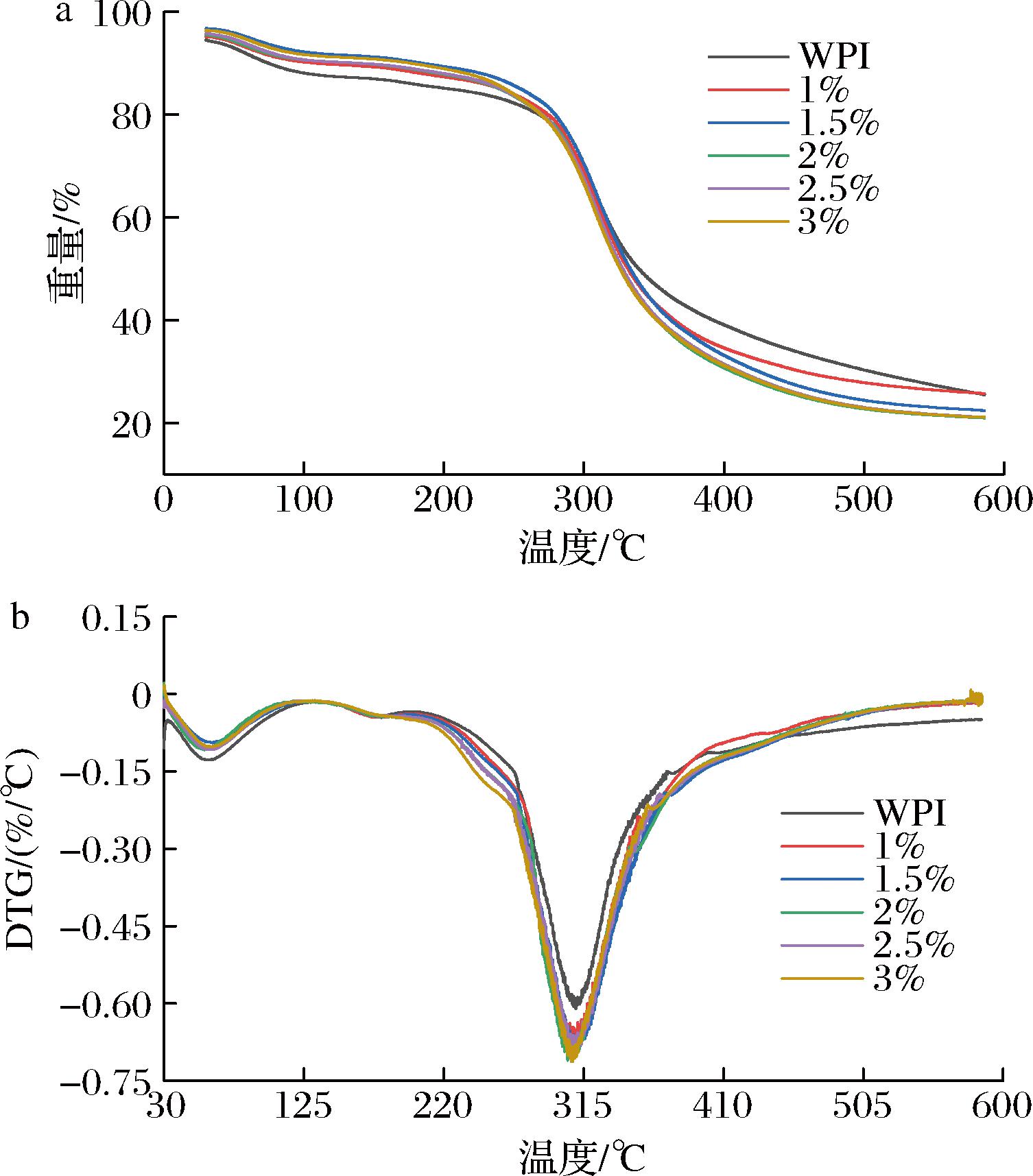
a-TGA;b-DTG
图5 OKGM添加量对OKGM-WPI复合凝胶热稳定性的影响
Fig.5 Effect of OKGM addition amounts on the thermal stability of OKGM-WPI composite gels
2.5 微观结构分析
凝胶的微观结构反映了相应的持水性和质构特性,图6展示了OKGM的添加量对乳清分离蛋白凝胶网络结构的影响。

a-WPI;b-1%;c-1.5%;d-2%;e-2.5%;f-3%
图6 OKGM-WPI复合凝胶的扫描电镜图
Fig.6 Scan electron micrograph of OKGM-WPI composite gels
纯乳清分离蛋白凝胶为不规则、粗糙、松散的三维片状结构。添加OKGM后(1%~3%),复合凝胶转变为更加规则、孔洞更有序的三维网状结构,说明OKGM的存在可减弱分子间或分子内的空间位阻效应,与WPI发生交联和聚集使凝胶结构更为有序、稳定。研究发现含有聚集体的凝胶具有更均匀和密集的结构[24],这种凝胶网络结构可能有助于提高持水性和质构特性(图1和表1)。综上,可以通过调节OKGM的添加量改善乳清分离蛋白凝胶性能。
2.6 表面疏水性分析
蛋白质表面疏水性反应了蛋白质空间结构及分子构象的变化,可用于衡量蛋白质变性程度和聚集情况[25]。ANS荧光探针方法测定疏水性的原理是ANS通过静电作用与蛋白质的疏水区结合,结合后荧光强度增加。如图7所示,复合凝胶的表面疏水性均低于纯蛋白凝胶的表面疏水性且具有显著性差异,随着OKGM的添加量从1%增加到3%时,凝胶的表面疏水性不断降低,这可能是由于OKGM的存在使复合体系发生了聚集,抑制了蛋白质的解折叠和分子中疏水基团的暴露,降低了ANS相关位点的数量,从而降低了其表面疏水性[14]。研究发现,凝胶的疏水性可能与其稳定性、构象和功能特性有关,较低的疏水性值可能使凝胶构象更稳定[26]。当OKGM添加量>2%时,复合凝胶的表面疏水性基本不变,说明添加量过高时,其蛋白质内部的疏水位点已被完全结合。

图7 OKGM添加量对OKGM-WPI复合凝胶表面疏水性的影响
Fig.7 Effect of OKGM addition amounts on the surface hydrophobicity of OKGM-WPI composite gels
2.7 游离巯基测定
游离巯基含量是影响蛋白质理化性质、功能特性和结构的重要指标之一,游离巯基可以形成二硫键,稳定蛋白质的结构。如图8所示,复合凝胶的游离巯基含量显著低于纯蛋白凝胶的巯基含量(4.32 μmol/g),且随着OKGM添加量的提高,游离巯基含量逐渐降低,这是因为OKGM的加入产生了大量的蛋白质聚集体或者形成了二硫键交联的寡聚体,改变了乳清分离蛋白的结构,导致游离巯基含量的消耗与减少[27]。当OKGM添加量>2%时,游离巯基含量基本不变,这可能是由于高添加量的OKGM与蛋白质的聚集和交联达到了饱和,致使二硫键含量基本不变。
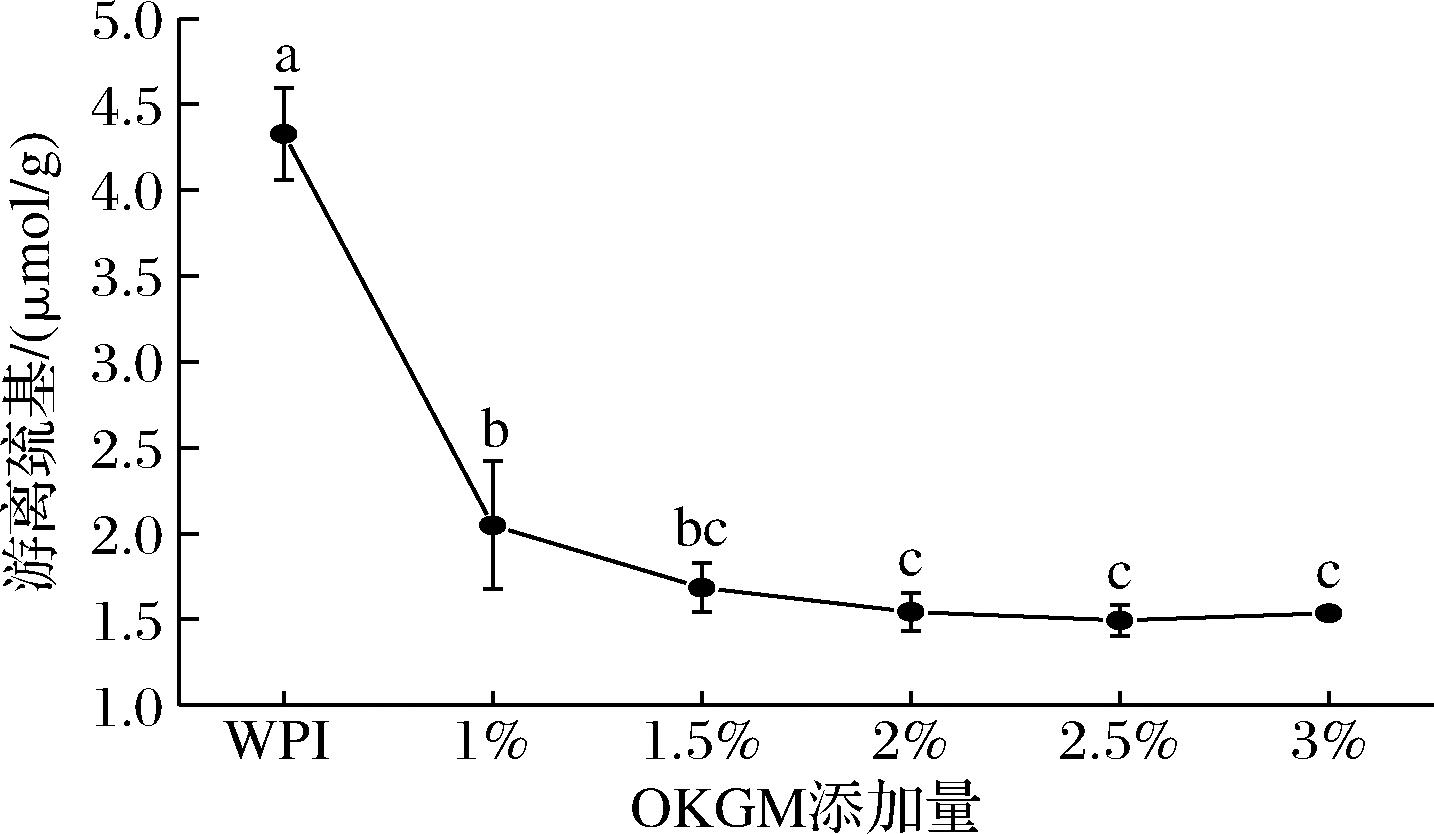
图8 OKGM添加量对OKGM-WPI复合凝胶游离巯基含量的影响
Fig.8 Effect of OKGM addition amounts on the free sulfhydryl content of OKGM-WPI composite gels
综上所述,OKGM可有效提高WPI凝胶的理化性质和稳定性(WPI成胶浓度降低到10%,OKGM添加量明显提高至3%;而在其他复合凝胶研究中WPI浓度≥11%,玉米淀粉、纳米纤维素、黄原胶和KGM等多糖添加量≤1%[2-5]),这主要是由于以下2个方面:(1)OKGM改变了WPI的结构。OKGM降低了蛋白质的疏水位点,从而稳定了蛋白质的构象(图8);OKGM的加入使原来暴露的巯基被埋在蛋白内,导致游离巯基含量降低,从而使WPI二硫键含量增加,增强分子间的相互作用,并诱导形成稳定的凝胶[14](图6)。(2)OKGM与WPI形成了复合物。OKGM-WPI在加热后变性聚集形成复合大分子,这些复合大分子交联形成多孔、致密的三维网络结构[28](图6)。
3 结论
本研究探讨了不同添加量的OKGM对乳清分离蛋白凝胶持水性、质构、流变特性、热稳定性的影响,并对凝胶形成机理进行了研究。结果发现,添加一定量的OKGM能提高凝胶的持水性、质构,添加量为2%时凝胶的硬度、弹性、咀嚼性最大;流变分析表明,复合凝胶对高频率、高温具有更低的依赖性;说明OKGM的添加能改善WPI凝胶的性质;OKGM通过与WPI的交联和聚集,降低了表面疏水性和游离巯基含量,提高二硫键的形成,并提高了复合凝胶的稳定性;微观结构分析发现OKGM的存在使凝胶结构更致密、有序。综上所述,可以通过调节OKGM添加量获得不同凝胶性能的产品以满足生产需要。但在实际生产中,还需要获得经济实用的OKGM工业化生产技术,同时解决OKGM安全性认证,获批为食品添加剂或食品新原料。后续将继续研究OKGM与WPI复合物在蛋白凝胶食品生产过程中的储藏稳定性问题。
[1] ZHAO R N, FU W T, CHEN Y J, et al.Structural modification of whey protein isolate by cinnamaldehyde and stabilization effect on β-carotene-loaded emulsions and emulsion gels[J].Food Chemistry, 2022, 366:130602.
[2] ESPINOSA-DZIB A, RAM REZ-GILLY M, TECANTE A.Viscoelastic behavior and microstructure of aqueous mixtures of cross-linked waxy maize starch, whey protein isolate and κ-carrageenan[J].Food Hydrocolloids, 2012, 28(2):248-257.
REZ-GILLY M, TECANTE A.Viscoelastic behavior and microstructure of aqueous mixtures of cross-linked waxy maize starch, whey protein isolate and κ-carrageenan[J].Food Hydrocolloids, 2012, 28(2):248-257.
[3] XIAO Y Q, LIU Y N, WANG Y, et al.Heat-induced whey protein isolate gels improved by cellulose nanocrystals:Gelling properties and microstructure[J].Carbohydrate Polymers, 2020, 231:115749.
[4] BRYANT C M, MCCLEMENTS D J.Influence of xanthan gum on physical characteristics of heat-denatured whey protein solutions and gels[J].Food Hydrocolloids, 2000, 14(4):383-390.
[5] TOBIN J T, FITZSIMONS S M, CHAURIN V, et al.Thermodynamic incompatibility between denatured whey protein and konjac glucomannan[J].Food Hydrocolloids, 2012, 27(1):201-207.
[6] FAN L H, YI J Y, TONG J, et al.Preparation and characterization of oxidized konjac glucomannan/carboxymethyl chitosan/graphene oxide hydrogel[J].International Journal of Biological Macromolecules, 2016, 91:358-367.
[7] ZHANG L, WU Y L, WANG L, et al.Effects of oxidized konjac glucomannan (OKGM) on growth and immune function of Schizothorax prenanti[J].Fish &Shellfish Immunology, 2013, 35(4):1105-1110.
[8] LI Y, LIU H B, XIE Y, et al.Preparation, characterization and physicochemical properties of konjac glucomannan depolymerized by ozone assisted with microwave treatment[J].Food Hydrocolloids, 2021, 119:106878.
[9] 范天琴, 覃小丽, 谢勇, 等.氧化魔芋葡甘露聚糖对脱乙酰魔芋葡甘露聚糖凝胶特性的影响[J].食品与发酵工业, 2023, 49(22):251-257.FAN T Q, QIN X L, XIE Y, et al.Effect of oxidized konjac glucomannan on gel properties of deacetylated konjac glucomannan[J].Food and Fermentation Industries, 2023, 49(22):251-257.[10] XU Q Q, QI B K, HAN L, et al.Study on the gel properties, interactions, and pH stability of pea protein isolate emulsion gels as influenced by inulin[J].LWT, 2021, 137:110421.
[11] PU X L, ZHANG M Y, LIN X D, et al.Development and characterization of acid-induced whey protein concentrate and egg white protein composite gel[J].LWT, 2022, 164:113624.
[12] CAO C N, LI X, YIN Y C, et al.Effects of sodium chloride on the physical and oxidative stability of filled hydrogel particles fabricated with phase separation behavior[J].Foods, 2021, 10(5):1027.
[13] ZHAO H B, WANG Y S, LI W W, et al.Effects of oligosaccharides and soy soluble polysaccharide on the rheological and textural properties of calcium sulfate-induced soy protein gels[J].Food and Bioprocess Technology, 2017, 10(3):556-567.
[14] JIANG L, ZHANG J H, REN Y M, et al.Acid/alkali shifting of Mesona chinensis polysaccharide-whey protein isolate gels:Characterization and formation mechanism[J].Food Chemistry, 2021, 355:129650.
[15] ZHANG M Q, LI J H, SU Y J, et al.Preparation and characterization of hen egg proteins-soybean protein isolate composite gels[J].Food Hydrocolloids, 2019, 97:105191.
[16] 姜鹏飞, 于文静, 朱凯悦, 等.多糖对罗非鱼鱼糜凝胶化行为的影响[J].中国食品学报, 2023, 23(1):87-99.JIANG P F, YU W J, ZHU K Y, et al.Effect of polysaccharides on gelation behavior of tilapia surimi[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(1):87-99.
[17] 杨悦, 任元元, 邓利玲, 等.基于碱性电解水形成的魔芋热不可逆凝胶性质研究[J].食品与发酵工业, 2022, 48(18):149-154.YANG Y, REN Y Y, DENG L L, et al.Study on properties of thermal irreversible konjac gel formed by alkaline electrolyzed water[J].Food and Fermentation Industries, 2022, 48(18):149-154.
[18] 代曜伊, 毕家钰, 田巧玲, 等.竹笋不溶性膳食纤维对大豆蛋白凝胶性质的影响[J].食品与发酵工业, 2017, 43(6):104-108.DAI Y Y, BI J Y, TIAN Q L, et al.Effect of bamboo shoots insoluble dietary fiber on the gel properties of soy protein[J].Food and Fermentation Industries, 2017, 43(6):104-108.
[19] ZHANG X Y, ZHANG S, ZHONG M M, et al.Soy and whey protein isolate mixture/calcium chloride thermally induced emulsion gels:Rheological properties and digestive characteristics[J].Food Chemistry, 2022, 380:132212.
[20] MU Y Y, SUN J, OBADI M, et al.Effects of saccharides on the rheological and gelling properties and water mobility of egg white protein[J].Food Hydrocolloids, 2020, 108:106038.
[21] 张佳璇, 韦翠萍, 童彩玲, 等.甘蓝提取物对魔芋葡甘聚糖凝胶流变特性的影响[J].食品研究与开发, 2023, 44(9):8-14.ZHANG J X, WEI C P, TONG C L, et al.Effect of red cabbage extract on rheological properties of konjac glucomannan gel[J].Food Research and Development, 2023, 44(9):8-14.
[22] TARHAN O, SPOTTI M J, SCHAFFTER S, et al.Rheological and structural characterization of whey protein gelation induced by enzymatic hydrolysis[J].Food Hydrocolloids, 2016, 61:211-220.
[23] BORA A F M, KOUAME K J E P, LI X D, et al.Development, characterization and probiotic encapsulating ability of novel Momordica charantia bioactive polysaccharides/whey protein isolate composite gels[J].International Journal of Biological Macromolecules, 2023, 225:454-466.
[24] WANG Y R, YANG Q, LI-SHA Y J, et al.Effects of thermal aggregation treatment on the structural, gelation properties and microstructure of phosphorylated rice glutelin gel[J].Journal of Cereal Science, 2021, 100:103252.
[25] 李颖畅, 宋素珍, 杨钟燕, 等.甲醛对鱿鱼肌原纤维蛋白凝胶特性的影响[J].中国食品学报, 2019, 19(8):60-69.LI Y C, SONG S Z, YANG Z Y, et al.Effects of formaldehyde on the myofibrillar protein gel properties of Peru squid[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(8):60-69.
[26] LIU J B, CHAI J L, YUAN Y X, et al.Dextran sulfate facilitates egg white protein to form transparent hydrogel at neutral pH:Structural, functional, and degradation properties[J].Food Hydrocolloids, 2022, 122:107094.
[27] SHI R J, LI T, LI M, et al.Consequences of dynamic high-pressure homogenization pretreatment on the physicochemical and functional characteristics of citric acid-treated whey protein isolate[J].LWT, 2021, 136:110303.
[28] MI H B, LI Y, WANG C, et al.The interaction of starch-gums and their effect on gel properties and protein conformation of silver carp surimi[J].Food Hydrocolloids, 2021, 112:106290.