牛乳含有有益的常量和微量营养素,对维持机体的营养平衡起着重要作用[1]。此外,牛乳含有潜在的生物活性成分,有助于维持人体新陈代谢[2]。牛乳中的蛋白质含有所有必需氨基酸,称为全蛋白[3]。乳糖是乳和乳制品中重要的碳水化合物来源,它主要由小肠中的乳糖酶分解,其分解产物主要有葡萄糖半乳糖[4]。如果乳糖酶活性低,未消化的乳糖可能会诱发乳糖不耐受症,其症状主要表现为胃痛、腹胀、肠胃胀气、恶心和腹泻等[5]。有研究报道,全球约有65%的人会出现乳糖不耐受症,其发生率也与地区和年龄有关[6-7]。因此,为满足乳糖不耐受人群对乳制品的需求,食品工业需要生产乳糖含量低或零乳糖的乳制品。
牛乳中乳糖的去除方法主要包括乳糖酶水解、膜分离等[8]。QUEIROZ等[9]将山羊乳在(7±2) ℃下使用乳糖酶水解24 h除去乳糖,然后进行喷雾干燥制备无乳糖山羊乳粉。ZHANG等[10]采用超滤、电渗析、纳滤3种膜技术方法制备低乳糖乳粉,超滤膜阻断了牛乳中的蛋白质和脂肪,乳糖和小分子物质被允许通过,然后进行电渗析脱盐,最后通过纳滤膜完全分离出乳糖。乳糖酶水解技术成本相对较低、操作简单、可实现性强,是工业化生产的首选。但乳糖水解为低分子质量的葡萄糖和半乳糖后,玻璃化转变温度降低,易发生褐变,对产品风味和色泽产生影响[11]。膜过滤技术避免了乳糖水解,直接去除乳糖。但容易结垢会引起膜污染问题或降低其性能缩短使用寿命,其净化处理工艺也会导致运行成本增高。且纳滤需要在更高的压力下进行,工序多、能耗高、操作周期长、经济效益不高,相比之下乳糖酶水解技术更易实现[9-11]。
现有研究多侧重于乳糖酶水解条件优化及其工艺流程,但对低乳糖牛乳粉蛋白特性的研究还比较有限。因此,本研究探究了不同乳糖酶水解乳糖后制备的低乳糖牛乳粉品质及蛋白特性,筛选出品质优良的低乳糖牛乳粉,为低乳糖牛乳粉的生产提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜牛乳样品采集于西安市郊区奶牛养殖场,放入冰袋中运输到实验室;乳糖酶A、B、C(食品级),分别来自公司1、2、3;NaOH、尿素、KBr(分析纯),天津市天力化学试剂有限公司;溴酚蓝、甘氨酸(分析纯),美国Sigma试剂公司;5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid), DTNB],美国Thermo Fisher Scientific公司。
1.2 仪器与设备
NS800手持色差仪,深圳三恩驰科技有限公司;HD-5型智能水分活度测量仪,无锡华科仪器仪表有限公司;BI-90Plus激光粒度Zeta电位仪,美国Brookhaven公司;TM3030型台式扫描电子显微镜,日本日立公司;Nicolet iS10型傅里叶红外光谱分析仪,美国Thermo Fisher Scientific公司;TGL-16 gR离心机,上海安亭科学仪器厂;YC-015喷雾干燥机,上海雅程仪器设备有限公司;UV-1200紫外可见分光光度计,上海美析仪器有限公司。
1.3 实验方法
1.3.1 低乳糖牛乳粉制备
低乳糖牛乳粉生产流程如图1所示,在第三步酶解时加入A、B、C 3种不同的乳糖酶,水解参数如下:温度40 ℃、时间3 h、酶添加量1%;对照组无酶解步骤,其余一致。

图1 低乳糖牛乳粉生产流程
Fig.1 Production process of low lactose milk powder

a-OMP;b-LLMP-EA;c-LLMP-EB;d-LLMP-EC;e-CLLMP
图2 低乳糖牛乳粉感官图
Fig.2 Sensory image of low lactose milk powder
1.3.2 色泽测定
使用手持色差仪测定样品的色泽,色差仪开机后依次进行黑板校正、白板校正(各5次),校正完成后测量样品的L*、a*、b*值。每个样品重复测3次,取平均值。
1.3.3 理化指标测定
1.3.3.1 水分含量
根据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》测定低乳糖牛乳粉的水分含量,称取5.0 g样品于称量瓶,置于101~105 ℃烘箱中,重复干燥至前后2次质量差不超过2 mg,干燥前后样品质量差值即为水分含量。
1.3.3.2 水分活度
根据GB 5009.238—2016《食品安全国家标准 食品中水分活度的测定》测定低乳糖牛乳粉的水分活度,称取1.0 g样品迅速放入样品仓,封闭后开始测量,测定时间5 min。
1.3.3.3 乳糖水解率
根据GB 5009.8—2023《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》测定低乳糖牛乳粉的水解率,称取5.0 g样品,温水溶解后分别加入乙酸锌和亚铁氰化钾溶液沉淀蛋白质,用干燥滤纸过滤,弃去初滤液,后续滤液用0.45 μm微孔滤膜过滤至样品瓶,进行液相色谱分析。
1.3.4 粒径和Zeta电位测定
参考陈舒桐等[12]的方法,并稍作修改。将低乳糖牛乳粉1∶10复原并进行稀释,测定粒径样品质量浓度在mg/mL级别,肉眼观测澄清透明。
1.3.5 微观形态观测
使用台式扫描电子显微镜(scanning electron microscope, SEM)观察分析乳粉表面形态,参考杨翦秋等[13]的方法,并稍作改进。取少量样品均匀附着在导电胶表面,贴于样品台中间位置,喷金后进行观察。
1.3.6 游离巯基含量测定
参考许英一等[14]的方法,并稍作修改。将蛋白样品溶于Tris-甘氨酸缓冲液中,配制质量浓度为2 mg/mL的蛋白溶液。取6 mL蛋白溶液加入20 μL Ellman试剂(0.2 g DTNB溶于50 mL缓冲液中)。于室温避光反应15 min后在3 000 r/min离心10 min,测定上清液在412 nm处的吸光度,空白组不加试样。其计算如公式(1)所示:
(1)
式中:A412,样品上清液在412 nm处的OD值;D,稀释倍数;ρ,蛋白溶液质量浓度,mg/mL。
1.3.7 表面疏水性测定
参考贾娜等[15]的方法并稍作修改。将蛋白样品溶于磷酸盐缓冲溶液(pH 7.0)中,配制质量浓度为5 mg/mL的蛋白溶液。取1 mL蛋白溶液加入200 μL溴酚蓝溶液(5 mg溴酚蓝溶于5 mL去离子水中),混匀置于摇床反应10 min后在6 000 r/min离心15 min,上清液稀释10倍后测定其在595 nm处的吸光度,以PBS缓冲溶液为对照组。其计算如公式(2)所示:
溴酚蓝结合量![]()
(2)
1.3.8 傅里叶红外光谱(Fourier transform infrared spectrometer, FTIR)测定
参考ULRICHS等[16]的方法,将乳粉样品与干燥的KBr(1∶100)混匀研磨充分并进行压片,压片均匀透明即可进行扫描。
1.4 数据处理
使用Excel进行数据汇总处理,用SPSS 22.0进行数据分析,组间两两比较采用ANOVA方差分析法。用Origin 2018进行绘图,结果表示为平均值±标准偏差。
2 结果与分析
2.1 低乳糖牛乳粉色泽
如表1所示,低乳糖牛乳粉-乳糖酶A(low lactose milk powder-enzyme A, LLMP-EA)、低乳糖牛乳粉-乳糖酶B(low lactose milk powder-enzyme B, LLMP-EB)和低乳糖牛乳粉-乳糖酶C(low lactose milk powder-enzyme C, LLMP-EC)的L*值分别显著高于普通牛乳粉(ordinary milk powder, OMP)3.50%、3.82%和2.30%(P<0.05),LLMP-EA、LLMP-EB和LLMP-EC的L*值分别显著高于商品低乳糖牛乳粉(commodity low lactose milk powder, CLLMP)5.70%、6.03%和4.47%(P<0.05);LLMP-EA、LLMP-EB、LLMP-EC和CLLMP的a*值均显著高于OMP(P<0.05),说明乳糖水解后的乳粉的色泽偏红;LLMP-EA、LLMP-EB的b*值分别显著低于OMP 5.35%、1.37%(P<0.05),LLMP-EC的b*值显著高于OMP 1.00%(P<0.05),CLLMP的b*值最高。低乳糖牛乳粉感官图如图1所示,OMP与LLMP-EA、LLMP-EB和LLMP-EC外观及组织状态相近、色泽偏白,CLLMP色偏黄,与表1中b*值的结果一致。
表1 低乳糖牛乳粉色泽变化
Table 1 Color changes in low lactose milk powder

组号L*a*b*190.48±0.01d-0.27±0.02e8.04±0.03c293.65±0.01b0.03±0.01c7.61±0.01e393.94±0.01a0.23±0.00a7.93±0.00d492.56±0.01c0.13±0.00b8.12±0.01b588.60±0.01e-0.03±0.01d14.55±0.01a
注:同列不同字母表示差异显著(P<0.05),表中1-OMP;2-LLMP-EA;3-LLMP-EB;4-LLMP-EC;5-CLLMP;下表同。
2.2 低乳糖牛乳粉理化特性
如表2所示,LLMP-EA、LLMP-EB和LLMP-EC的水分活度分别比OMP高10.12%、17.51%和14.79%(P<0.05);LLMP-EA、LLMP-EB和LLMP-EC的水分含量分别比OMP高4.68%、11.51%和8.27%(P<0.05)。LLMP-EA水分活度分别比LLMP-EB、LLMP-EC和CLLMP低6.29%、4.07%和8.12%(P<0.05);LLMP-EA水分含量分别比LLMP-EB、LLMP-EC和CLLMP低6.13%、3.32%和11.82%(P<0.05)。其中水分活度值接近于0.3,水分含量各组值均≤5%,LLMP-EA、LLMP-EB和LLMP-EC的乳糖水解率在(75.10±1.83)%~(93.15±1.06)%,均符合国家标准。CLLMP水分活度和水分含量较高,这可能是生产条件不同导致的。
表2 低乳糖牛乳粉理化特性
Table 2 Physicochemical properties of low lactose milk powder

组号水分活度水分含量/(g/100 g)水解率/%10.257±0.005e2.78±0.02e0.00±0.00e20.283±0.005c2.91±0.01d75.10±1.83d30.302±0.004b3.10±0.03b93.15±1.06b40.295±0.005d3.01±0.04c79.33±1.35c50.308±0.006a3.30±0.02a100.00±0.00a
2.3 低乳糖牛乳粉粒径和Zeta电位
如图3所示,CLLMP的粒径分别显著高于LLMP-EA、LLMP-EB、LLMP-EC和OMP 72.21%、97.29%、73.81%和28.94%(P<0.05),LLMP-EA、LLMP-EB和LLMP-EC的粒径之间无显著性差异(P>0.05),粒径分布范围在256.95~294.38 nm;OMP和LLMP-EA的PDI值分别显著低于CLLMP 47.96%和46.51%(P<0.05)。低乳糖牛乳粉Zeta电位的变化如图4所示,5组样品的电位值无显著性差异(P>0.05),电位绝对值在59.58~69.46 mV,均大于50 mV,表明乳粉物理稳定性良好,该结果与粒径测定结果一致。综上可见,乳糖酶水解对牛乳粉Zeta电位的影响不大。
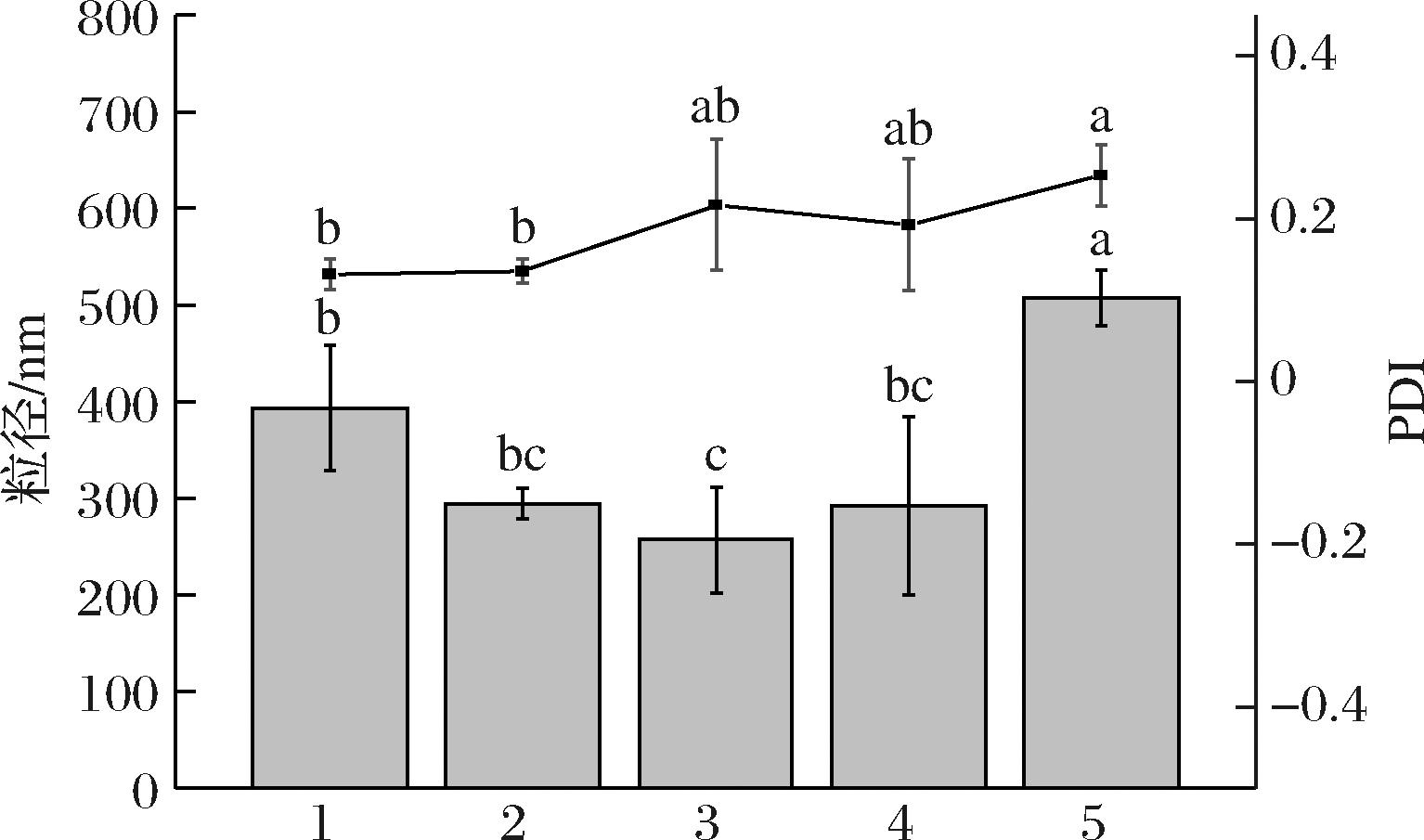
图3 低乳糖牛乳粉粒径和PDI
Fig.3 Low lactose milk powder particle size and PDI
注:1-OMP;2-LLMP-EA;3-LLMP-EB;4-LLMP-EC;5-CLLMP;下图同。

图4 低乳糖牛乳粉Zeta电位
Fig.4 Zeta potential of low lactose milk powder
2.4 低乳糖牛乳粉微观结构观察
如图5所示,OMP(图5-a)团聚程度相对较高,颗粒表面有轻微凹陷;LLMP-EA(图5-b)颗粒比较饱满,表面有轻微凹陷、颗粒聚集度较低与CLLMP(图5-e)形态接近;LLMP-EB(图5-c)、LLMP-EC(图5-d)团聚程度较低,表面凹陷较深;CLLMP有极少的团聚,表面相对光滑且基本无凹陷,颗粒较大,该结果与粒径结果一致(图3)。

a-OMP;b-LLMP-EA;c-LLMP-EB;d-LLMP-EC;e-CLLMP
图5 低乳糖牛乳粉微观结构
Fig.5 Micro structure of low lactose milk powder
2.5 低乳糖牛乳粉中游离巯基含量
如图6所示,OMP的游离巯基含量达到最小值(6.79±0.19) μmol/g,LLMP-EA与OMP的游离巯基含量无显著性差异(P>0.05),LLMP-EA的游离巯基含量显著低于LLMP-EB、LLMP-EC和CLLMP 19.90%、12.15%、42.94%(P<0.05),LLMP-EB和LLMP-EC之间游离巯基含量无显著性差异(P>0.05)。综上可见,乳糖水解后,牛乳粉游离巯基含量增加,蛋白稳定性相对降低,LLMP-EA的游离巯基含量相对最低。
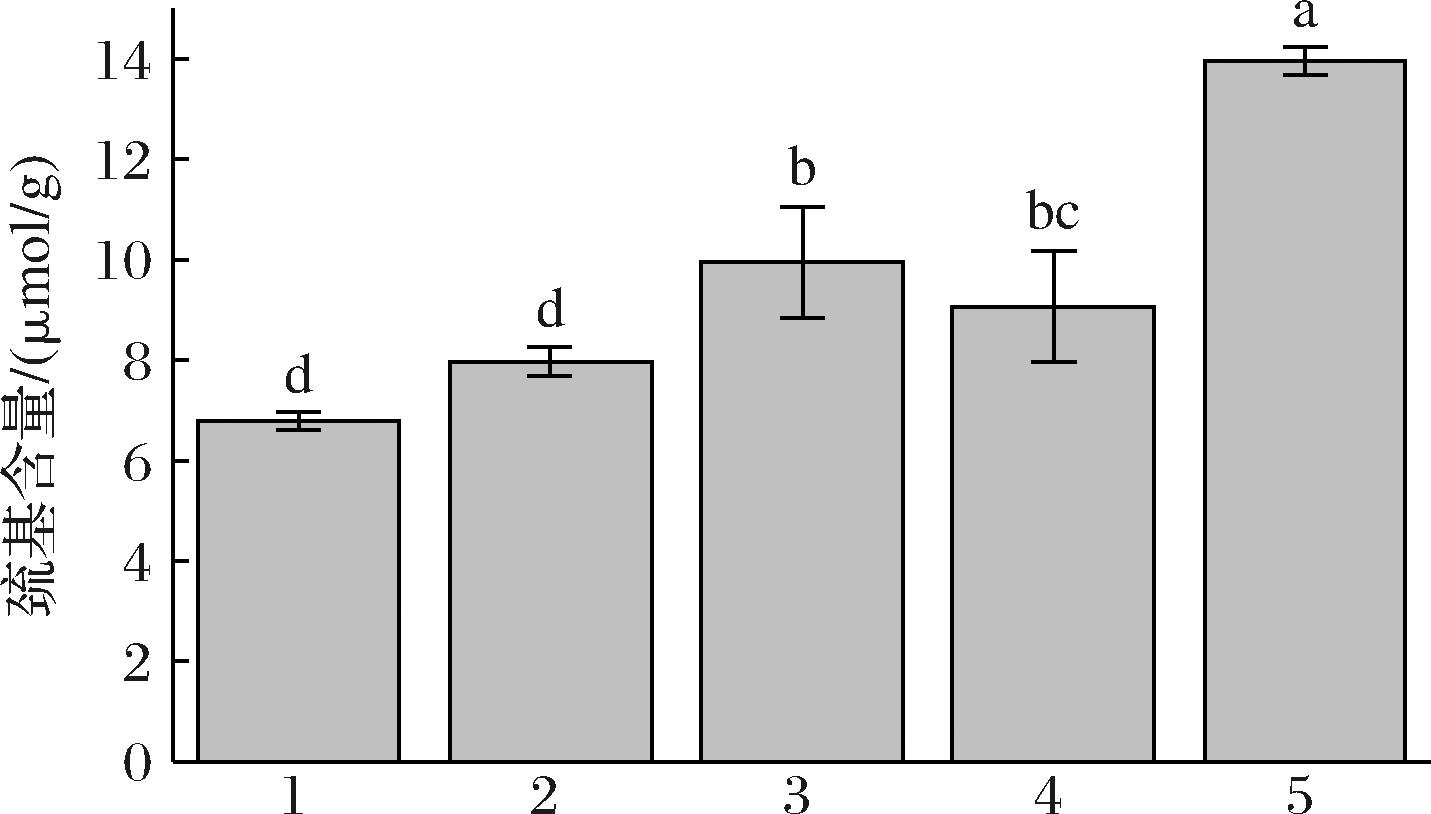
图6 低乳糖牛乳粉中游离巯基含量
Fig.6 Free sulfhydryl content in low lactose milk powder
2.6 低乳糖牛乳粉表面疏水性
如图7所示,OMP溴酚蓝结合量为40.15 μg,显著低于LLMP-EA、LLMP-EB、LLMP-EC和CLLMP 23.71%、33.09%、16.78%和33.46%(P<0.05),表明OMP蛋白质空间稳定性最强。LLMP-EA溴酚蓝结合量显著低于LLMP-EB、CLLMP 12.29%、12.78%(P<0.05),但显著高于LLMP-EC 9.09%(P<0.05)。综上可见,经过水解后,牛乳粉表面疏水性增强,稳定性下降,LLMP-EC表面疏水性最低,LLMP-EA次之。
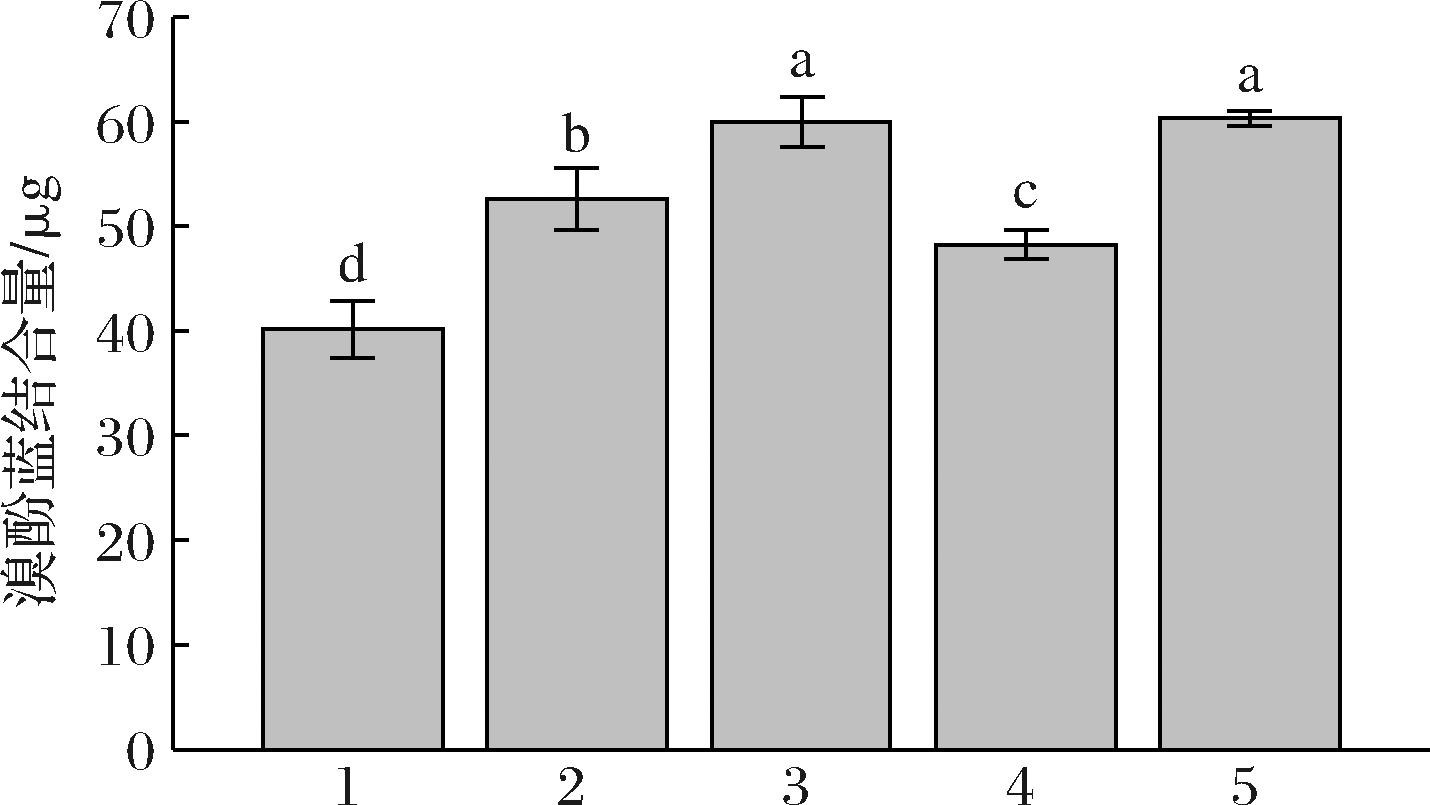
图7 低乳糖牛乳粉中蛋白表面疏水性差异
Fig.7 Differences in protein surface hydrophobicity in low lactose milk powder
2.7 低乳糖牛乳粉FTIR及蛋白二级结构
如图8-A所示,在酰胺Ⅰ带范围(1 600~1 700 cm-1),OMP蛋白特征峰在1 654.62 cm-1、LLMP-EA蛋白特征峰在1 653.48 cm-1、LLMP-EB蛋白特征峰在1 653.38 cm-1、LLMP-EC蛋白特征峰在1 653.14 cm-1、CLLMP蛋白特征峰在1 652.90 cm-1。与OMP相比,LLMP-EA、LLMP-EB、LLMP-EC和CLLMP的蛋白特征峰均出现红移。具体为LLMP-EA红移1.14 cm-1、LLMP-EB红移1.24 cm-1、LLMP-EC红移1.48 cm-1、CLLMP红移1.72 cm-1。将原谱图通过基线矫正和平滑等处理后得到酰胺Ⅰ带拟合图如图8-B所示。酰胺Ⅰ带广泛用于蛋白质二级结构的定量分析,波长在1 650~1 660 cm-1的吸收峰对应于α-螺旋、波长在1 610~1 640 cm-1的吸收峰对应于β-折叠、波长在1 660~1 700 cm-1的吸收峰对应于β-转角、波长在1 640~1 650 cm-1的吸收峰对应于无规则卷曲[17]。

a-OMP;b-LLMP-EA;c-LLMP-EB;d-LLMP-EC;e-CLLMP
A-傅里叶红外光谱图;B-酰胺Ⅰ带拟合图
图8 傅里叶红外光谱图和酰胺Ⅰ带拟合图
Fig.8 Fourier transform infrared spectroscopy and amide I band fitting diagram
低乳糖牛乳粉的二级结构变化如表3所示。OMP蛋白中α-螺旋含量为16.10%,比LLMP-EA、LLMP-EB、LLMP-EC和CLLMP分别高1.90%、3.27%、3.87%和6.06%(P<0.05),OMP蛋白中无规则卷曲含量为15.54%,比LLMP-EA、LLMP-EB、LLMP-EC和CLLMP分别低10.69%、10.48%、9.18%和5.59%(P<0.05)。LLMP-EA蛋白中α-螺旋含量比LLMP-EB、LLMP-EC和CLLMP分别高1.35%、1.94%、4.08%(P<0.05),β-折叠含量比LLMP-EC高2.47%(P<0.05),无规则卷曲含量比LLMP-EC低1.69%(P<0.05)。而α-螺旋中的肽键均参与形成氢键,是最稳定的二级结构。综上可见,乳糖水解后,牛乳粉蛋白质二级结构稳定性相对下降,LLMP-EA蛋白质二级结构稳定性相对最高。
表3 低乳糖牛乳粉二级结构含量
Table 3 Low lactose milk powder secondary structure percentage content

组号α-螺旋结构/%β-折叠结构/%β-转角结构/%无规则卷曲/%116.10±0.24a30.08±0.81e38.28±1.36a15.54±0.36e215.80±0.26b32.38±0.74c34.41±0.72d17.40±0.23a315.59±1.09c33.34±0.30a33.71±2.40e17.36±1.37b415.50±0.94d31.60±1.78d35.79±4.82b17.11±1.20c515.18±0.59e32.69±0.26b35.67±0.46c16.46±0.38d
3 讨论
本研究对不同乳糖酶水解所得低乳糖牛乳粉的品质及蛋白特性进行分析,并与OMP和CLLMP进行对比。在色泽方面,OMP、LLMP-EA、LLMP-EB和LLMP-EC的外观及组织状态相近、色泽偏白,CLLMP色泽偏黄,这可能是乳糖水解促进乳粉发生美拉德反应以及乳糖水解过程中生成的5-羟甲基糠醛所致[18-19]。5组样品水分活度在(0.257±0.005)~(0.308±0.006),水分活度对食品质量和稳定性起关键作用,较低的水分活度可抑制微生物的生长[20]。同时,水分含量的高低影响奶粉的贮藏期,若水分含量过高,将导致奶粉中的脂肪酸被分解成游离脂肪酸,影响奶粉的质量[21]。刘玲等[22]研究表明在贮存过程中,水分活度对全脂羊乳粉中游离脂肪酸的变化具有明显的作用,降低水分活度可以延缓全脂羊乳中游离脂肪酸的升高。
乳粉的粒径分布决定其外观、复溶性能、颗粒沉降速率、表面反应性和流动特性,粒径和PDI也是反映乳粉均一性和物理稳定性的重要指标。粒径和PDI的值越小,乳粉均匀性和分散性越好[23]。本试验LLMP-EA、LLMP-EB和LLMP-EC的粒径低于CLLMP,具有更高的稳定性;LLMP-EA的PDI低于CLLMP,这可能是由于粒径受原始牛奶特性和加工条件的影响[24]。综上,LLMP-EA粒度更均匀、分散性更好。Zeta电位是乳脂球和酪蛋白胶束电荷的指示剂,可反映出蛋白质静电相互作用倾向,对微粒分散系统的物理稳定性进行评估或预测,Zeta电位绝对值越高,粒子之间的静电斥力越大,粒子具有更好的物理稳定性[25-26]。本试验中,5组样品的Zeta电位无显著性差异,且均具有良好的物理稳定性,表明乳糖酶水解对Zeta电位的影响程度较小。
通过扫描电镜观察发现,乳粉颗粒表面呈现凹陷、皱纹和折叠,颗粒之间有不同程度的团聚,这与HO等[27]研究结果一致。CLLMP颗粒表面呈现出一些凹痕和褶皱,蛋白颗粒比OMP、LLMP-EA、LLMP-EB和LLMP-EC的尺寸大的多,这与本试验粒径结果一致;LLMP-EA蛋白颗粒较为饱满,表面有轻微凹陷、颗粒聚集程度较低,与CLLMP形态接近。表面凹陷是喷雾干燥乳粉普遍存在的形态学特点,这可能是由于雾化过程的高温处理使颗粒表面水分快速蒸发以及干燥温度的影响,干燥温度越高其颗粒更接近光滑和球形[28-30]。游离巯基是反映蛋白质结构稳定性的重要因素,游离巯基、二硫键之间可相互转换,二硫键断裂后转换为游离巯基,会使蛋白质空间结构被破坏,稳定性下降[31-33]。研究表明,游离巯基对蛋白的折叠与稳定有重要影响,还会影响蛋白质的界面和乳化特性[34]。LI等[35]研究表明二硫键的断裂会对分子的柔性产生一定的影响,同时还会对构象重排和疏水区的露出造成一定的阻碍,从而提高界面蛋白质的覆盖面积。本试验LLMP-EB、LLMP-EC和CLLMP中游离巯基含量比OMP高,这可能是因为乳糖被水解为葡萄糖、半乳糖,而单糖的美拉德反应更为强烈,从而破坏了蛋白的空间结构[36]。蛋白质的表面疏水性指暴露在蛋白质分子表面且可键合疏水键团的数量,它与蛋白质的理化性质、结构特征、加工方法以及条件都有关系。另外,蛋白降解程度也可以从其表面疏水性来判断[37]。在维持蛋白质三级结构的过程中,蛋白质的疏水作用力能够体现出蛋白质空间构象的稳定性、反映出分子间相互作用的强度,表面疏水性越强蛋白质空间稳定性越差。溴酚蓝结合量越多,表明乳粉蛋白表面疏水基团数目越多、表面疏水性越强,蛋白质空间结构越不稳定[38]。本试验4组低乳糖牛乳粉的溴酚蓝结合量高于OMP,这是因为牛乳通过水解后蛋白质空间结构逐渐展开,导致内部疏水基团逐渐暴露[39]。根据推测,蛋白质-蛋白质相互作用可能通过疏水残基的暴露而增强,导致未折叠蛋白质之间的重新结合或聚集[40]。
蛋白质二级结构指的是由多肽链以氢键连接盘旋而构成的结构,具体为α-螺旋、β-折叠、β-转角和无规则卷曲四种结构[41-42]。FTIR可用于预测蛋白质二级结构组成,其中酰胺Ⅰ带是对二级结构组成最敏感的光谱区域,它主要反映蛋白质分子结构中羰基的伸缩情况[43]。本研究中蛋白质的特征吸收峰出现在1 650 cm-1附近,与GUO等[44]研究一致。本试验中FTIR的峰值发生红移,可能是加热引起乳清蛋白变性,并降低其羰基电子云密度造成的[45]。α-螺旋中的肽键均参与氢键的形成,是最稳定的二级结构。4组低乳糖牛乳粉的α-螺旋含量比OMP减少,β-折叠和无规则卷曲含量比OMP增加。这可能是由于乳糖水解过程的热处理效应,乳清蛋白分子部分被破坏、氢键断裂,使α-螺旋向β-折叠和无规则卷曲转化[46]引起的。这种转化会使乳粉蛋白的热聚集作用增强,蛋白质分子间的氢键变弱,从而影响乳粉蛋白的贮藏稳定性[47-48]。
4 结论
LLMP-EA色泽白,水分含量和水分活度低于LLMP-EB、LLMP-EC,其理化性质较好。LLMP-EA粒度均匀、PDI<0.3、Zeta电位绝对值>50 mV,物理稳定性较好。LLMP-EA蛋白颗粒较饱满,表面有轻微凹陷、颗粒聚集度较低,与CLLMP形态接近;LLMP-EA游离巯基含量及表面疏水性均较低,其空间结构稳定性强、不易变质易于储存;LLMP-EA红移程度小且α-螺旋结构的比例高,二级结构稳定性强、贮藏稳定性强。因此,LLMP-EA所得低乳糖牛乳粉品质良好,可为低乳糖牛乳粉的工业化生产提供一定的理论依据。
[1] 卢璇, 张茜, 赵宇轩, 等.基于代谢组学技术结合智能感官探究临床乳房炎对牛乳风味和滋味物质的影响[J].食品科学, 2023,44(20):260-267.LU X, ZHANG Q, ZHAO Y X, et al.Effects of clinical mastitis on milk flavor and taste substances based on metabolomics investigation and intelligent senses[J].Food Science, 2023,44(20):260-267.
[2] 李文斐, 张磊, 宋宇轩, 等.绵羊、山羊和牛乳的营养成分比较分析[J].食品工业科技, 2020, 41(24):286-291.LI W F, ZHANG L, SONG Y X, et al.Comparative analysis of nutrients in sheep, goat and cow milk[J].Science and Technology of Food Industry, 2020, 41(24):286-291.
[3] 刘一璇, 鲁丁强, 刘丹阳, 等.牛乳蛋白生物脱敏技术研究进展[J].中国乳品工业, 2023, 51(2):40-48.LIU Y X, LU D Q, LIU D Y, et al.Research progress of desensitization technology and detection methods of milk protein based on biological method[J].China Dairy Industry, 2023, 51(2):40-48.
[4] 原卉卉, 杨孝成, 葛武鹏, 等.Fe3O4@海藻酸钠-壳聚糖固定化乳糖酶技术及其酶学性质研究[J].中国乳品工业, 2023, 51(2):4-9;20.YUAN H H, YANG X C, GE W P, et al.Fe3O4@ sodium alginate-chitosan immobilized lactase technology and its enzymatic properties[J].China Dairy Industry, 2023, 51(2):4-9;20.
[5] 李东丹, 闫洁, 杨艳玲.乳糖不耐受及饮食营养管理[J].中国实用儿科杂志, 2022, 37(10):758-763.LI D D, YAN J, YANG Y L.Lactose intolerance and dietary nutrition management[J].Chinese Journal of Practical Pediatrics, 2022, 37(10):758-763.
[6] LI A L, ZHENG J, HAN X T, et al.Health implication of lactose intolerance and updates on its dietary management[J].International Dairy Journal, 2023, 140:105608.
[7] STORHAUG C L, FOSSE S K, FADNES L T.Country, regional, and global estimates for lactose malabsorption in adults:A systematic review and meta-analysis[J].The Lancet.Gastroenterology &Hepatology, 2017, 2(10):738-746.
[8] RAZA A, IQBAL S, ULLAH A, et al.Enzymatic conversion of milk lactose to prebiotic galacto-oligosaccharides to produce low lactose yogurt[J].Journal of Food Processing and Preservation, 2018, 42(4):e13586.
[9] QUEIROZ E S, LOPES REZENDE A L, PERRONE  T, et al.Spray drying and characterization of lactose-free goat milk[J].LWT, 2021, 147:111516.[10] ZHANG H J, TAO Y Y, HE Y B, et al.Preparation of low-lactose milk powder by coupling membrane technology[J].ACS Omega, 2020, 5(15):8543-8550.
T, et al.Spray drying and characterization of lactose-free goat milk[J].LWT, 2021, 147:111516.[10] ZHANG H J, TAO Y Y, HE Y B, et al.Preparation of low-lactose milk powder by coupling membrane technology[J].ACS Omega, 2020, 5(15):8543-8550.
[11] MORELOS-GOMEZ A, TERASHIMA S, YAMANAKA A, et al.Graphene oxide membranes for lactose-free milk[J].Carbon, 2021, 181:118-129.
[12] 陈舒桐, 周庆玲, 杨睿宇, 等.两种马尾藻岩藻多糖的理化性质、结构表征及其增强免疫和降血糖活性[J].食品科学, 2024, 45(1):15-22.CHEN S T, ZHOU Q L, YANG R Y, et al.Physicochemical property, structural characterization of fucoidan extracts from two Sargassums and their immunoenhancement and hypoglycemic activities[J].Food Science, 2024, 45(1):15-22.
[13] 杨翦秋, 毕会敏, 范方宇.木薯纳米淀粉的制备及乳化性能研究[J].食品与发酵工业, 2024, 50(5):243-248.YANG J Q, BI H M, FAN F Y.Preparation and emulsification of cassava starch nanoparticles[J].Food and Fermentation Industries, 2024, 50(5):243-248.
[14] 许英一, 刘迪, 林巍, 等.热处理改性燕麦蛋白部分性质与表面疏水性的关系[J].食品工业, 2021, 42(8):176-179.XU Y Y, LIU D, LIN W, et al.Correlation between sectional properties and surface hydrophobicity of heat-treated modified oat protein[J].The Food Industry, 2021, 42(8):176-179.
[15] 贾娜, 林世文, 王乐田, 等.没食子酸诱导肌原纤维蛋白巯基含量和表面疏水性变化对蛋白凝胶特性的影响[J].食品科学, 2020, 41(22):1-7.JIA N, LIN S W, WANG L T, et al.Effects of changes in sulfhydryl content and surface hydrophobicity of myofibrillar protein induced by gallic acid on its gel properties[J].Food Science, 2020, 41(22):1-7.
[16] ULRICHS T, DROTLEFF A M, TERNES W.Determination of heat-induced changes in the protein secondary structure of reconstituted livetins (water-soluble proteins from hen’s egg yolk) by FTIR[J].Food Chemistry, 2015, 172:909-920.
[17] 安红周, 黄山, 郭益廷, 等.磷酸盐对高水分挤压组织化植物蛋白产品品质的影响[J].中国粮油学报, 2023, 38(9):115-124.AN H Z, HUANG S, GUO Y T, et al.Effects of phosphate on quality of high moisture extruded textured vegetable protein[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(9):115-124.
[18] DURMU S, EMIN M, MEHMET K.Powder flow behavior, functional characteristics and microstructure of whole milk powder produced from cow and buffalo milk mixtures[J].International Dairy Journal, 2022, 135:105474.
S, EMIN M, MEHMET K.Powder flow behavior, functional characteristics and microstructure of whole milk powder produced from cow and buffalo milk mixtures[J].International Dairy Journal, 2022, 135:105474.
[19] SINGH P, RAO P S, SHARMA V, et al.Physico-chemical aspects of lactose hydrolysed milk system along with detection and mitigation of Maillard reaction products[J].Trends in Food Science &Technology, 2021, 107:57-67.
[20] 乔春艳. 多重检测技术对市售羊奶粉品质结果的差异性分析研究[D].西安:陕西师范大学, 2021.QIAO C Y.Research on quality difference of goat milk powder with multiple testing technologies[D].Xi’an:Shaanxi Normal University, 2021.
[21] 谢爱英, 张富新, 陈颖.发酵香肠的pH值、水分含量与水分活度(Aw)的关系及其对制品贮藏性的影响[J].食品与发酵工业, 2004, 30(11):143-146.XIE A Y, ZHANG F X, CHEN Y.Quality of fermented sausage during storage:Relationship of pH, water content and water activity[J].Food and Fermentation Industries, 2004, 30(11):143-146.
[22] 刘玲, 张富新, 艾对, 等.贮藏条件对全脂羊奶粉游离脂肪酸的影响[J].农产品加工(学刊), 2014(9):9-12.LIU L, ZHANG F X, AI D, et al.Effect of storage conditions on the free fatty acids of whole goat milk powder[J].Academic Periodical of Farm Products Processing, 2014(9):9-12.
[23] CARTER B G, DRAKE M.Influence of oral movement, particle size, and zeta potential on astringency of whey protein[J].Journal of Sensory Studies, 2021, 36(3):e12652.
[24] MIAO W L, HE R, FENG L, et al.Study on processing stability and fermentation characteristics of donkey milk[J].LWT, 2020, 124:109151.
[25] BOUZID H, RABILLER-BAUDRY M, PAUGAM L, et al.Impact of zeta potential and size of caseins as precursors of fouling deposit on limiting and critical fluxes in spiral ultrafiltration of modified skim milks[J].Journal of Membrane Science, 2008, 314(1-2):67-75.
[26] QIAN C, DECKER E A, XIAO H, et al.Comparison of biopolymer emulsifier performance in formation and stabilization of orange oil-in-water emulsions[J].Journal of the American Oil Chemists’ Society, 2011, 88(1):47-55.
[27] HO T M, TON T T, GAIANI C, et al.Changes in surface chemical composition relating to rehydration properties of spray-dried camel milk powder during accelerated storage[J].Food Chemistry, 2021, 361:130136.
[28] KOSASIH L, BHANDARI B, PRAKASH S, et al.Effect of whole milk concentrate carbonation on functional, physicochemical and structural properties of the resultant spray dried powder during storage[J].Journal of Food Engineering, 2016, 179:68-77.
[29] CUI L Q, KIMMEL J, ZHOU L, et al.Improving the functionality of pea protein isolate through co-spray drying with emulsifying salt or disaccharide[J].Food Hydrocolloids, 2021, 113:106534.
[30] MURRIETA-PAZOS I, GAIANI C, GALET L, et al.Composition gradient from surface to core in dairy powders:Agglomeration effect[J].Food Hydrocolloids, 2012, 26(1):149-158.
[31] THAM T W Y, YEOH A T H, ZHOU W B.Characterisation of aged infant formulas and physicochemical changes[J].Food Chemistry, 2017, 219:117-125.
[32] 罗帷, 张宇娟, 侯江霞, 等.不同抗氧化剂对面筋蛋白结构功能特性的影响[J].食品科技, 2022, 47(12):135-140.LUO W, ZHANG Y J, HOU J X, et al.Effects of different antioxidants on structural and functional properties of gluten[J].Food Science and Technology, 2022, 47(12):135-140.
[33] 吴相佚, 刘泽朋, 高婧昕, 等.超高压处理对乳蛋白结构和致敏性的改善作用[J].中国食品学报, 2022, 22(7):142-148.WU X Y, LIU Z P, GAO J X, et al.Effect of ultra-high pressure treatment on structure and allergenicity of milk protein[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):142-148.
[34] YANG J, DUAN Y Q, ZHANG H H, et al.Ultrasound coupled with weak alkali cycling-induced exchange of free sulfhydryl-disulfide bond for remodeling interfacial flexibility of flaxseed protein isolates[J].Food Hydrocolloids, 2023, 140:108597.
[35] LI R N, XIONG Y L.Disulfide cleavage to improve interfacial behavior and emulsification properties of oat protein[J].Food Chemistry, 2023, 404(Pt A):134511.
[36] 李思宁, 唐善虎, 胡洋, 等.酶法水解乳糖与热处理偶联对牛乳Maillard反应的影响[J].食品科学, 2017, 38(7):122-128.LI S N, TANG S H, HU Y, et al.Effect of enzymatic hydrolysis of lactose combined with heat treatments on Maillard reaction of milk[J].Food Science, 2017, 38(7):122-128.
[37] 王佳蓉, 欧才智, 武玥, 等.挤压处理对薏米蛋白组分结构及功能性质的影响[J].中国食品学报, 2023, 23(3):111-120.WANG J R, OU C Z, WU Y, et al.Effect of extrusion treatment on the structural and functional properties of the adlay seed protein fractions[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(3):111-120.
[38] 蒋家睿, 樊祥埼, 郑学玲.小麦加工前中后路粉面筋蛋白特性差异性分析[J].食品与发酵工业, 2024, 50(4):240-245.JIANG J R, FAN X Q, ZHENG X L.Analysis of differences in gluten protein characteristics of anterior, middle, and posterior wheat flour[J].Food and Fermentation Industries, 2024, 50(4):240-245.
[39] CHENG J H, LI J L, SUN D W.Effects of dielectric barrier discharge cold plasma on structure, surface hydrophobicity and allergenic properties of shrimp tropomyosin[J].Food Chemistry, 2023, 409:135316.
[40] EKEZIE F G C, SUN D W, CHENG J H.Altering the IgE binding capacity of king prawn (Litopenaeus vannamei) tropomyosin through conformational changes induced by cold argon-plasma jet[J].Food Chemistry, 2019, 300:125143.
[41] 张永金, 胡艳红, 葛武鹏, 等.母乳、牛乳与主要小品种乳蛋白质组成及乳清蛋白二级结构比较[J].食品安全质量检测学报, 2022, 13(15):4779-4786.ZHANG Y J, HU Y H, GE W P, et al.Comparative study on the composition of protein and secondary structure of whey protein in human milk, milk and main small varieties of milk[J].Journal of Food Safety &Quality, 2022, 13(15):4779-4786.
[42] 刘锞琳, 何悦珊, 王钊, 等.傅里叶红外光谱法与拉曼光谱法测定蛋白质二级结构研究进展[J].食品与发酵工业, 2023, 49(10):293-298.LIU K L, HE Y S, WANG Z, et al.Progress in determination of protein secondary structure by Fourier infrared spectroscopy and Raman spectroscopy[J].Food and Fermentation Industries, 2023, 49(10):293-298.
[43] 崔航, 王冀菲, 杨建, 等.重金属铅对大麦苗粉蛋白质二级结构及氨基酸的影响[J].食品科学, 2023,44(12):67-73.CUI H, WNAG Y F, YNAG J, et al.Effects of heavy metal lead on protein secondary structure and amino acids of barley seedling powder[J].Food Science, 2023,44(12):67-73.
[44] GUO C F, ZHANG Z N, CHEN J J, et al.Effects of radio frequency heating treatment on structure changes of soy protein isolate for protein modification[J].Food and Bioprocess Technology, 2017, 10(8):1574-1583.
[45] YANG S N, ZHANG Q L, YANG H Y, et al.Progress in infrared spectroscopy as an efficient tool for predicting protein secondary structure[J].International Journal of Biological Macromolecules, 2022, 206:175-187.
[46] 孟岳成, 黃阮卿, 陈杰, 等.热处理对酸马奶中蛋白质稳定性的影响[J].中国食品学报, 2022, 22(12):174-180.MENG Y C, HUANG R Q, CHEN J, et al.Effects of thermal treatments on the protein stability of koumiss[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(12):174-180.
[47] GREWAL M K, HUPPERTZ T, VASILJEVIC T.FTIR fingerprinting of structural changes of milk proteins induced by heat treatment, deamidation and dephosphorylation[J].Food Hydrocolloids, 2018, 80:160-167.
[48] MINI D A P, MILIN
D A P, MILIN I
I D D, KOLA
D D, KOLA INAC S, et al.Goat milk proteins enriched with Agaricus blazei Murrill ss.Heinem extracts:Electrophoretic, FTIR, DLS and microstructure characterization[J].Food Chemistry, 2023, 402:134299.
INAC S, et al.Goat milk proteins enriched with Agaricus blazei Murrill ss.Heinem extracts:Electrophoretic, FTIR, DLS and microstructure characterization[J].Food Chemistry, 2023, 402:134299.