在全球范围内,每年有263.0亿吨肉类被浪费,其中大约50% 的肉类损失和浪费发生在收获后的储存阶段[1]。牛肉是一种高质量的食物来源,其富含优质蛋白质、B族维生素、矿物质、微量元素和其他生物活性化合物,可以满足身体的多种营养需求[2]。因此,牛肉的保质减损一直是肉类行业的难点和研究热点。冷冻是储存牛肉制品最常见和最有效的方法之一,它可以延缓微生物的生长并延长保质期[3]。然而,由于冷链技术的不完善以及储存、运输和零售店销售过程中的温度波动甚至在家庭厨房中都不可避免地造成牛肉反复冻融现象的发生[4]。一方面,由于冷冻过程中产生的冰晶会破坏肉的组织结构,导致水分损失、颜色变化、蛋白质变性、脂质氧化加重等负面作用[5]。此外,解冻过程也容易受到微生物污染[6],从而对牛肉产品的质量和消费者接受度产生负面影响。因此延长冷冻储存期牛肉的品质特性成为研究的重点。
研究发现添加冷冻保护剂是防止冷冻过程中蛋白质变性的有效方法。其中,糖类是最常用的一种冷冻保护剂,糖类冷冻保护剂可通过增加水的表面张力和结合水的数量,从而增加蛋白质分子的水合作用,达到稳定蛋白质的作用[7]。现有的研究报告证实了蔗糖、海藻糖、低聚木糖等冷冻保护剂的添加能有效提高食品的质量。海藻糖、蔗糖、卡拉胶可以在水溶液中形成螺旋结构,从而增加持水性能,此外它们具有良好的保湿性和抗冻性能[8]。YANG等[9]研究不同冷冻保护剂(蔗糖和山梨糖醇、低聚木糖和防冻蛋白)对不同冷冻温度下对大黄花鱼的冷冻保护效果,蔗糖、山梨糖醇和低聚木糖防冻效果相当。ZHANG等[10]研究发现海藻糖和低聚糖能够影响去皮虾冷冻贮藏过程中冰晶界面的结构,抑制冰晶生长。ZHANG等[11]研究发现在冻融循环下,低聚木糖和卡拉胶对蛋清蛋白的保护效果最好。这些冷冻保护剂可以通过非共价相互作用(如氢键、静电相互作用或疏水键的形成)取代蛋白质周围的水分子,从而在很大程度上抑制冷冻诱导的蛋白质变性[12]。尽管已经有不少关于蔗糖、海藻糖和卡拉胶作为冷冻保护剂在水产等方面的研究,但这些冷冻保护剂对牛肉冻融处理下的研究较少。因此开发经济、绿色、高效的冷冻保护剂并研究其对牛肉品质的影响具有重要的理论和工业价值。
本研究首次将海藻糖、蔗糖和卡拉胶应用于牛肉冻融过程中,并验证了其在冷冻保护效果方面的优势。研究冷冻保护剂(海藻糖、蔗糖和卡拉胶)对牛肉保水能力、脂质氧化和微观结构以及牛肉品质的影响。为牛肉在食品加工和贮藏中的应用提供了理论依据,也为其他肉类冷冻保护研究提供参考。
1 材料与方法
1.1 实验材料
牛背脊、蔗糖,市售;海藻糖、卡拉胶,绿新(福建)食品有限公司,三氯乙酸,阿拉丁试剂上海有限公司,戊二醛、硫代巴比妥酸,国药集团化学试剂有限公司。所有试剂均为分析纯试剂。
1.2 实验仪器
BCD-575 WDBI冰箱,青岛海尔股份有限公司;YT1004分析电子天平,昆山优科维特电子科技有限公司;TA.XTC-18质构仪,上海保圣实业发展有限公司;NMI20-23-015V-I核磁共振成像分析仪,纽迈电子科技有限公司;CS-422色差仪,杭州彩普科技有限公司;PHS-25雷磁pH计,上海仪电科学仪器股份有限公司;722S可见分光光度计,上海菁华科技仪器有限公司;80-2电动离心机,上海江星仪器有限公司;SU8010高分辨场发射扫描电镜,日本Hitachi公司。
1.3 实验方法
1.3.1 样品准备
新鲜牛背脊肉购买于当地生鲜超市,剔除可见结缔组织和脂肪组织后随机分成小块(2 cm×2 cm×2 cm),4 ℃下分别在0.9%生理盐水(质量分数,下同)(对照组)、3%海藻糖(质量分数,下同)+4%蔗糖(质量分数,下同)(TS);0.3%卡拉胶(质量分数,下同)+4%蔗糖(CS);0.3%卡拉胶+3%海藻糖(CT)中浸泡5 h。所有牛肉经滤纸沥干表面水分后,放入无菌包装袋中密封,-18 ℃冷冻2 d,4 ℃解冻1 d为1次冻融循环。分别于1、2、3、4和5次冻融循环后取样进行指标检测。
1.3.2 解冻损失
将牛肉样品在4 ℃解冻1 d后,用滤纸吸取表面的水分。将解冻前和解冻后的样品称重,分别记为m1和m2,平行测定3次。解冻损失按照公式(1)计算:
解冻损失![]()
(1)
1.3.3 蒸煮损失
参考吴梦迪等[13]的方法,并做稍微修改。将牛肉样品称重(m3),放入烧杯中,然后用95 ℃水浴锅水浴加热10 min,蒸煮结束后冷却至室温,立即擦干表面水分,称重(m4),平行测定3次。蒸煮损失按照公式(2)计算:
蒸煮损失![]()
(2)
1.3.4 颜色
测量前,用滤纸擦干解冻样品表面的水分。牛肉的颜色采用色差仪测定。采用白色标准板对仪器进行校准。记录牛肉的L*(亮度)、a*(红绿度)和b*(黄蓝度)。每个样品在牛肉中心位置测量,并平行测定3次。
1.3.5 pH值
将粉碎后的牛肉样品(3 g)与30 mL蒸馏水搅拌混合30 min,每5 min搅拌一次。将混合物过滤,用pH计测定滤液的pH值。平行测定3次。
1.3.6 水分分布
采用核磁共振成像分析仪对牛肉样品的水分分布进行测定。测定方法参考CAI等[14]的方法并稍作修改,将样品切成1.0 cm×1.0 cm×1.5 cm,放入核磁共振管中,核磁共振管插入核磁共振探针。采用CPMG脉冲序列测定横向弛豫时间(T2)。核磁共振测量在以下条件下进行:等待时间(TW)4 000 ms;回波时间(TE)3 ms;重复扫描次数(NS)8。每个梯度重复采样3次。
1.3.7 质构特性
牛肉的质构特性检测参考YANG等[9]的方法,将样品(2.0 cm×2.0 cm×2.0 cm)放在质构分析仪的平台上,并通过带有P 50(直径5 cm)的圆形探头进行两周期压缩。测试前速度2 mm/s,测试速度2 mm/s,测试后速度1 mm/s。压缩比75%,每组平行测定3个样品,每组样品重复测量3次。
1.3.8 微观结构
参考LAN等[15]的方法。采用扫描电镜观察牛肉微观结构,将经5次冻融后的牛肉样品在4 ℃的2.5%(质量分数)戊二醛溶液中浸泡24 h,然后切成5 mm×5 mm×5 mm的小块。接下来,用乙醇系列(30%、50%、70%、80%和90%乙醇,均为体积分数)对样品进行脱水;用无水乙醇脱水3次,每次20 min。临界点样品干燥后喷金,用扫描电镜观察牛肉样品的微观结构。
1.3.9 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
脂质氧化参考LIN等[16]的方法,由硫代巴比妥酸反应法测量,向5 g碎牛肉样品中加入10 mL 20%三氯乙酸(trichloroacetic acid, TCA)溶液(体积分数,下同),使用涡旋仪充分混合1 min,然后在5 000 r/min,离心15 min。取上清液5 mL,加入5 mL 0.02 mol/L 2-硫代巴比妥酸(2-thiobarbituric acid, TBA)溶液中,空白处理为5 mL 20% TCA溶液与5 mL TBA试剂混合。随后,将溶液在沸水浴中加热20 min。将所得溶液在自来水中冷却10 min后,用分光光度计测定在532 nm处的吸光值。TBARS值由以下公式(3)计算:
TBARS=(A532+0.002)×2.589
(3)
式中:A532,测定溶液的吸光度值。
1.4 数据处理
所有实验均重复3次,结果以平均值±标准差表示。样品间的显著性差异利用SPSS 23.0进行单因素方差分析,P<0.05表示平均值差异显著,不同小写字母(a~d)为同一冻融次数下不同处理方式的差异显著;不同大写字母(A~E)为相同处理方式不同冻融次数下的差异显著。数据作图采用Origin 9进行绘制。
2 结果与讨论
2.1 解冻损失
保水能力是牛肉的一项重要品质指标,它直接影响到牛肉在加工和储存过程中的变化。如图1所示,冷冻肉样品的解冻损失随着冻融次数的延长而持续增加。在5次冻融循环后,对照组样品的解冻损失从20.37%显著增加至36.22%,这主要是由于冷冻过程中肌肉纤维的结构会被冰晶破坏,导致组织发生变形,使水分从细胞中扩散出来[17],导致肉的水分流动性增加。在经过一次冻融后,冷冻保护剂处理后牛肉的解冻损失均小于对照组,TS组、CS组和CT组分别为10.8%、16.23%和17.14%,这是由于海藻糖、蔗糖、卡拉胶可以在水溶液中形成螺旋结构,从而增加持水性能[18]。3次冻融循环后,对照组、CS组和CT组处理的解冻损失无显著差异(P<0.05)。TS组处理的牛肉样品在5次冻融处理中,其解冻损失一直保持最小,可能是由于海藻糖和蔗糖保护剂的再结晶抑制作用,改变了冰晶的自发生长。
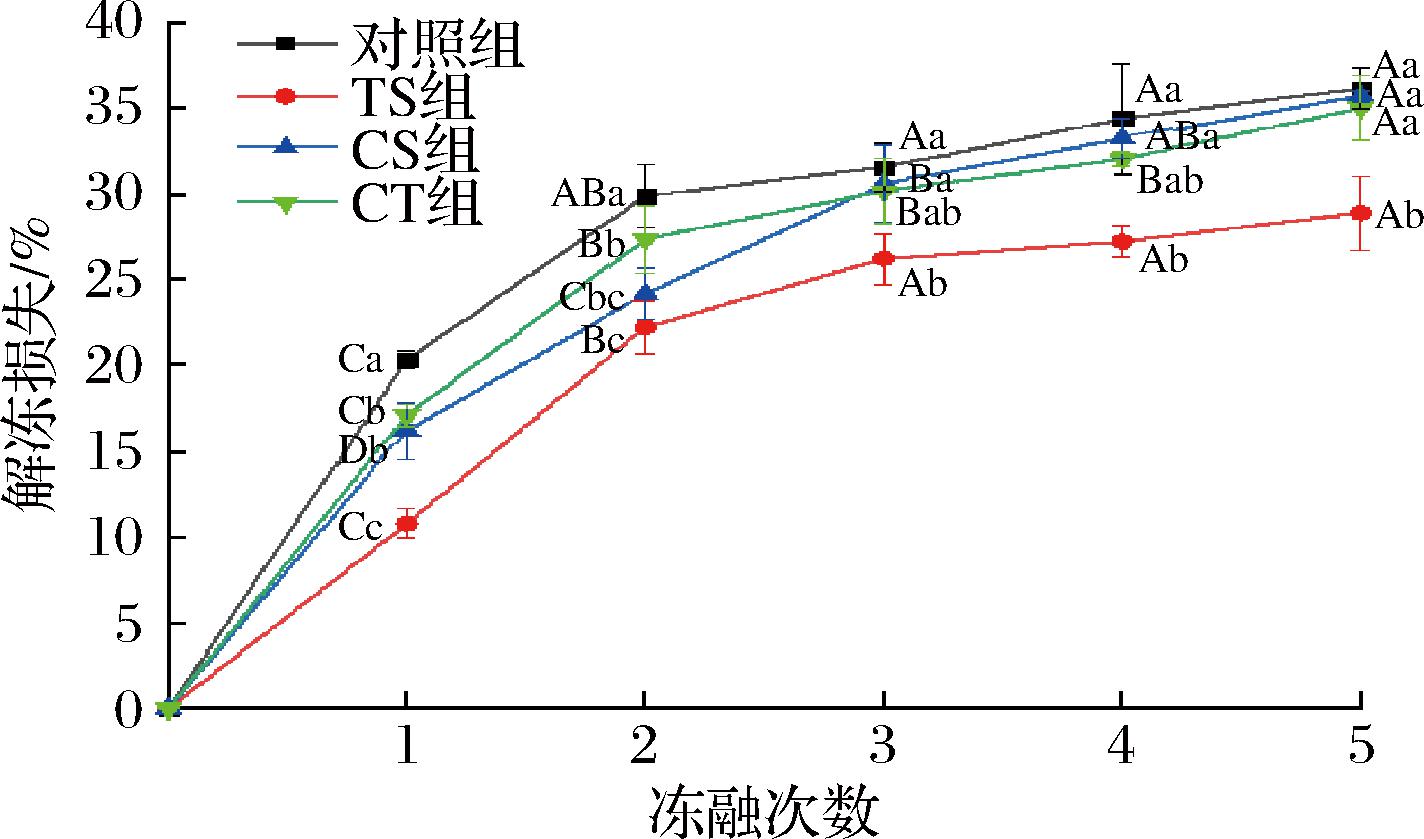
图1 不同冻融次数下冷冻保护剂对牛肉解冻损失影响
Fig.1 Effect of cryoprotectants on thawing loss of beef under different freeze-thaw times
注:不同字母表示差异显著(P<0.05)(下同)。
2.2 蒸煮损失
蒸煮损失是指冷冻牛肉蒸煮后的水分损失和可溶性营养素损失。如图2所示,随着冻融次数的增加,蒸煮损失逐渐增加,这与DU等[19]研究在冻融循环下对鲤鱼的蒸煮损失研究结果一致。经过1次冻融处理,CT组蒸煮损失最小(32.76%),对照组的蒸煮损失最大(39.01%)。与对照组相比,冷冻保护剂处理组减少了牛肉的蒸煮损失,对牛肉的烹饪损失有抑制作用,可能是冷冻保护剂能吸附在冰晶上,阻止冰晶的成核[20]。因此,冷冻保护剂对牛肉的持水能力有积极影响。而CT组在前4次冻融下表现出较少的蒸煮损失。此外,LI等[21]研究了死后老化对冷冻羊腰肉解冻品质的影响,得出蒸煮损失不受解冻损失的影响,与其无关的结论。本研究也得到了类似的结果,样品蒸煮损失变化不随解冻损失而变化。
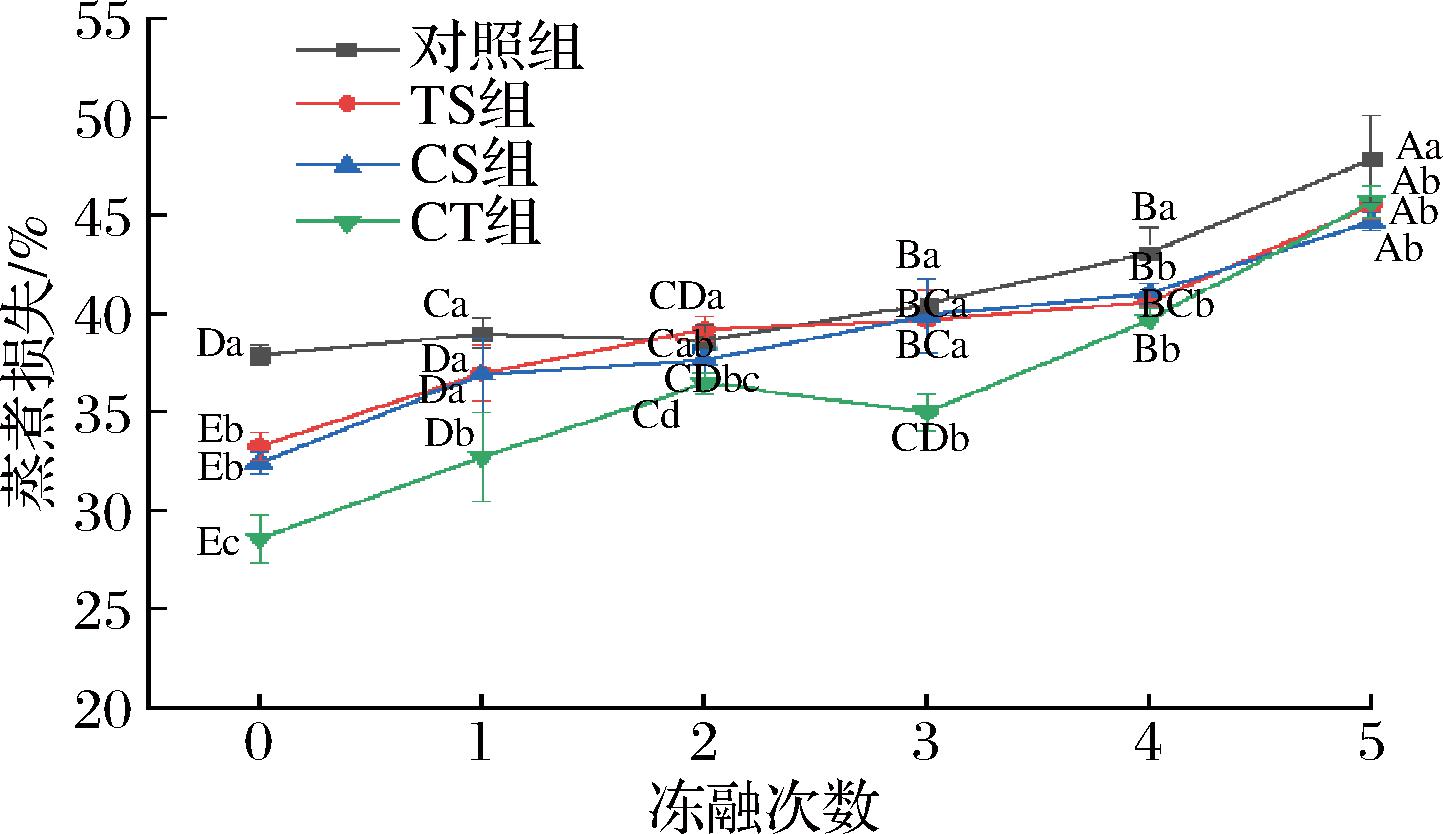
图2 不同冻融次数下冷冻保护剂对牛肉蒸煮损失影响
Fig.2 Effect of cryoprotectants on cooking loss of beef under different freeze-thaw times
2.3 pH值
pH值是评估冷冻和解冻牛肉质量特性的重要指标之一。牛肉经0~5次冻融处理后的pH值如图3所示,对照组的pH值变化在5.72~9.34范围内,冷冻保护剂处理组的pH值变化在5.52~6.58,对照组在5次冻融后pH值为9.34,TS组为6.58,CS组为6.23,CT组为5.94,与对照组相比加入冷冻保护剂处理组pH值降低。根据GB 5009.237—2016《食品安全国家标准 食品pH值的测定》,pH值在5.8~6.2为一级鲜肉、6.3~6.6为二级鲜肉、大于6.7为腐败(变质)肉[22]。因此,肉类的pH值应在5.8~6.6范围内。
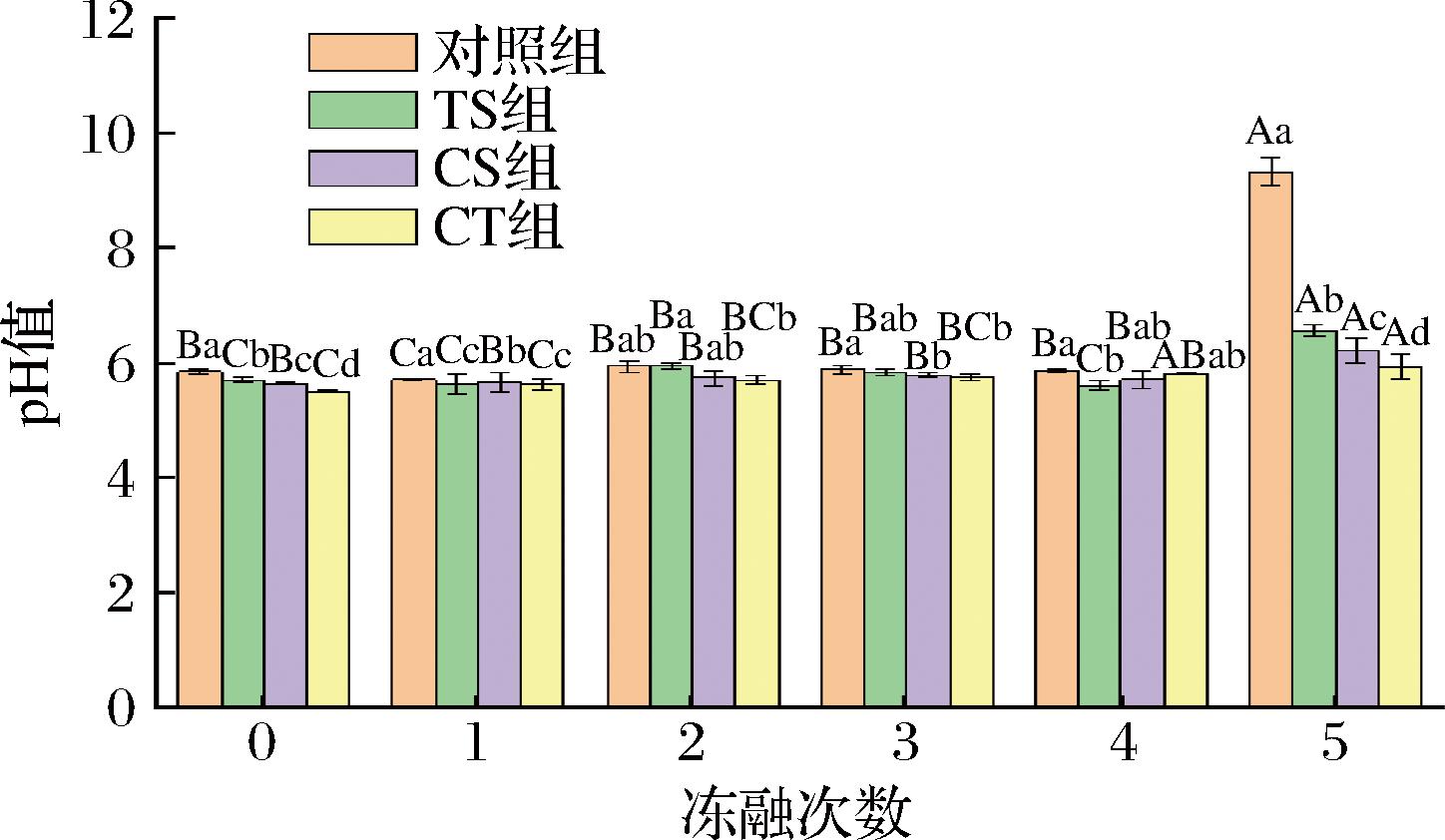
图3 不同冻融次数下冷冻保护剂对牛肉pH值影响
Fig.3 Effect of cryoprotectants on beef pH under different freeze-thaw times
随着冻融次数的增加,pH值逐渐升高,在5次冻融后,与其他3组相比对照组的pH值出现明显的升高,增加了63.29%,牛肉的pH值呈现碱性,可能是由于肉类腐败微生物通过内源性酶促蛋白质降解产生氨和其他碱性物质,从而使牛肉pH值升高进而发生变质[23]。而冷冻保护剂处理的TS、CS、CT三组pH值分别增加了16.46%、9.77%、5.51%,牛肉的pH值仍是弱酸性(<6.6),说明冷冻保护剂处理的牛肉都在合理的鲜肉pH范围内,CT组处理的牛肉pH值在一级鲜肉范围内,表明卡拉胶与蔗糖协同作用可以较大程度上减缓牛肉品质的恶化。以上结果表明冷冻保护剂可以更好地防止牛肉腐败,从而具有延长保质期的作用。
2.4 色差
颜色是消费者对肉制品最直观的感觉,肉制品颜色的变化会影响人们的购买意愿。不同冷冻保护剂处理的牛肉在不同冻融循环下的L*、a*、b*值变化如表1所示。随着冷冻循环的延长,亮度L*值降低,可能是由于牛肉在冷冻解冻过程中受到脂质氧化和色素的分解,导致表面颜色变暗。经1次冻融循环后,CT处理的样品L*值高于对照组,可能是由于冷冻保护剂能起到一定的氧化还原作用,延缓了牛肉氧化变质的速度。
表1 不同冻融次数下冷冻保护剂处理对牛肉颜色影响
Table 1 Effect of cryoprotectants on the color of beef under different freeze-thaw times

冻融次数样品L*a*b*0对照组23.40±1.45Ab5.87±0.19Ac4.51±0.33DcTS组24.47±1.56Aa6.55±0.57Ab5.40±0.67BaCS组22.78±1.49Ab6.69±0.27Ba4.71±0.23DbCT组23.56±1.38Aab6.72±0.81Aa3.76±0.34Ed1对照组20.60±0.63Bb5.77±0.29Ab5.81±0.24ABaTS组20.94±0.87Bb6.43±0.48Aab4.86±0.28BbCS组22.62±0.53Aa7.80±0.21Aa5.61±0.22CaCT组21.47±0.50BCb6.85±0.16Aa4.88±0.25Db2对照组15.55±0.94Cb4.57±0.23ABb6.48±0.35ABbTS组16.51±0.86Cb5.30±0.07Bc5.29±0.45BbCS组20.10±1.06Aa5.79±0.29Ca8.20±0.60BaCT组20.81±1.41BCa3.65±0.13Cc5.21±0.16Cb3对照组16.02±0.88Cb4.19±0.30Bb5.22±0.32CbTS组17.85±0.72Cb3.43±0.27Db4.89±0.44BbCS组18.66±1.65Bab4.51±0.30Db6.30±0.52CaCT组19.88±0.16Ca4.63±0.15Ba6.05±0.38Ba4对照组16.73±1.44Cb4.05±0.38Aa6.15±0.18ABbTS组19.41±1.35Bb4.15±0.28Ca7.79±0.68AbCS组20.31±0.57Ab3.81±0.71Eb8.44±0.52AaCT组22.12±1.41Aa4.00±0.27Ba6.28±0.39Bb5对照组17.11±0.32Cb3.54±0.04Bb8.54±0.65AaTS组21.75±0.75Ba4.30±0.13Cab7.71±0.54AabCS组20.91±1.18Aa4.53±0.31Da8.05±0.53BabCT组22.40±1.12ABa4.24±0.23Bab6.51±0.16Ab
注:不同字母表示差异显著(P<0.05)(下同)。
a*值的变化通常反映肌红蛋白的变化,相对较高的a*值(发红),消费者接受度越高。由表1可以看出,在冻融循环过程中的a*值总体呈下降的趋势。这可能是在冷冻过程中高铁肌红蛋白的数量增加。b*值的变化反映了脂肪组成的变化[24],一般来说,b*值的增加由于脂肪在冷冻过程中氧化。5次冻融处理后,对照组的b*值为8.54,而CT、TS和CS组的b*分别为6.51、7.71和8.05,显著高于其他各组,与第1次冻融相比,增加了46.98%。表明对照组在冻融过程中,脂肪氧化更严重。结合图4可知,0次冻融处理下各组的牛肉颜色均保持红色,随着冻融次数的增加牛肉颜色变暗。在5次冻融时对照组牛肉颜色明显暗沉呈现暗褐色,而TS和CT组的牛肉呈现微红色,与b*值的变化相对应。
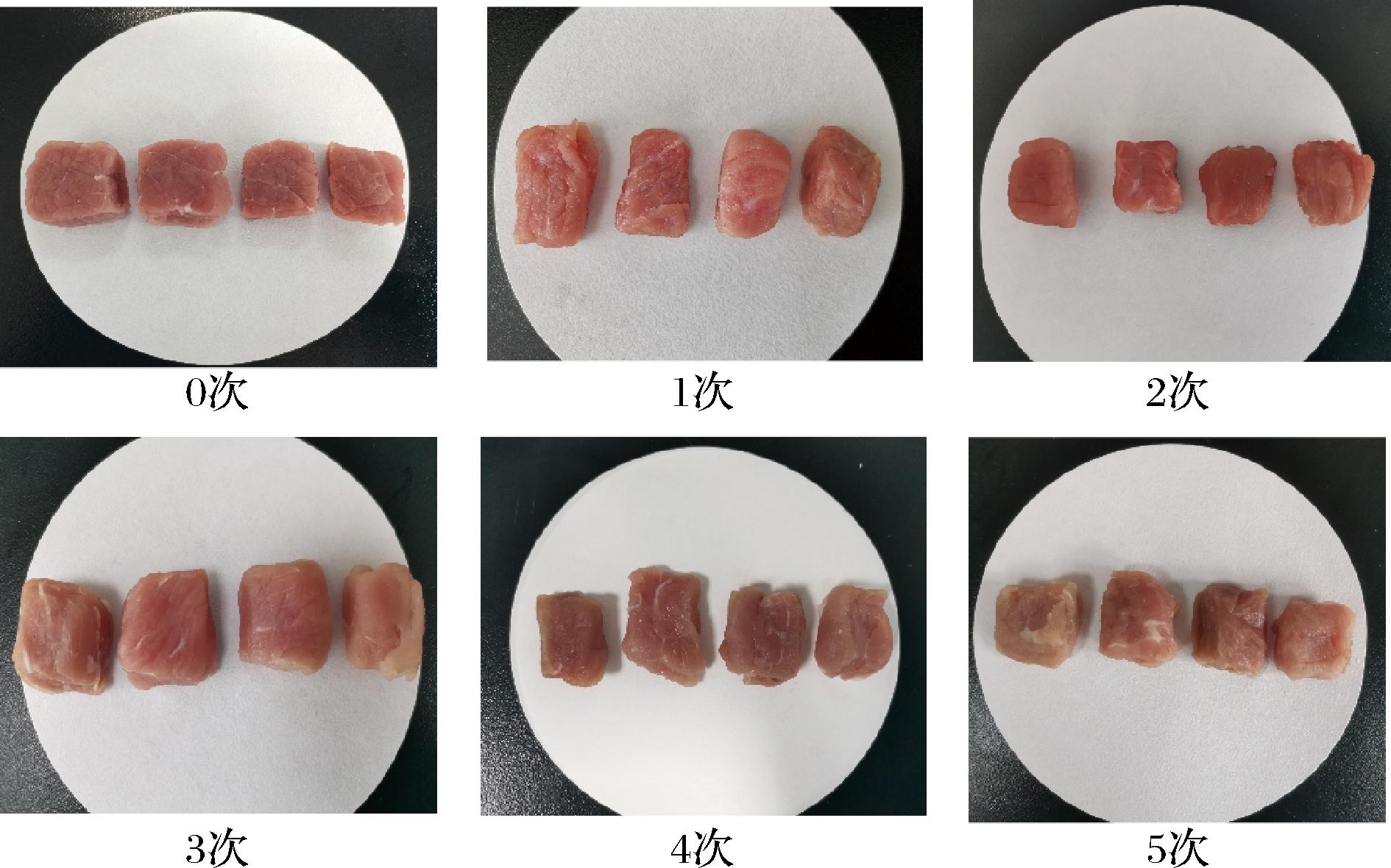
图4 不同冻融次数下冷冻保护剂处理牛肉外观图(样品从左至右分别为对照组、TS组、CS组、CT组)
Fig.4 Appearance of beef treated with cryoprotectant under different freeze-thaw times
2.5 水分分布
低场核磁共振技术是一种无损、无创的光谱技术,可以测量食品中的水分成分和流动性。T2弛豫时间可以表征肌肉组织中存在的3种水:T2b(1~10 ms)是指水与大分子上的亲水基团紧密结合的结合水;T21(10~100 ms)代表肌原纤维网络或肌球蛋白和肌动蛋白丝之间的空间中的固定水;T22(100~1 000 ms)对应肌肉束间隙中存在的自由水[25]。T2弛豫时间越短,体系越稳定,水分迁移率越低。从图5-a可知,经过反复冻融5次后,T2b水的弛豫时间和峰面积比率均无显著变化,这部分水很稳定。随着冻融循环的增加,对照组的T21随着冻融循环的增加而减小,表明固定水流动性在经过反复多次冻融后开始逐渐下降,固定水向自由水方向迁移,牛肉内的水分分布发生了变化。随着冻融次数的增加,TS组的T21峰面积变化不大,即牛肉中固定水变化不大,减少了固定水向自由水的转化,一定程度上减少了解冻损失,说明海藻糖和蔗糖协同具有很好的保水能力,这与牛肉解冻损失的结果一致(图1)。

a-T2;b-P2
图5 不同冻融次数下冷冻保护剂对牛肉的T2弛豫时间和P2(T2峰比)的影响
Fig.5 Effect of cryoprotectants on T2 relaxation time and P2 (T2 peak ratio) of beef under different freeze-thaw times
从图5-b中可以看出,不同区间对应的积分面积占总面积的百分比表示为P2b、P21、P22,可以反映牛肉中不同水组分的相对含量。添加冷冻保护剂组的固定水的P21比值波动较小,呈小范围增加趋势,表明冻结造成的损害已得到缓解。经过5次反复冻融后对照组P22自由水的峰面积比率逐渐增加(图5-b),这可能是因为反复冻融导致冰晶增长使水不断从细胞内转移到细胞外,导致自由水含量增加。
2.6 质构
对不同冷冻保护剂处理的牛肉样品进行质构参数测定和分析,能够验证冷冻保护剂对产品质量的影响。表2显示了不同冷冻保护剂浸泡处理的解冻牛肉样品的质构特性。
表2 不同冻融次数下冷冻保护剂对牛肉质构影响
Table 2 Effect of cryoprotectants on beef texture under different freeze-thaw times
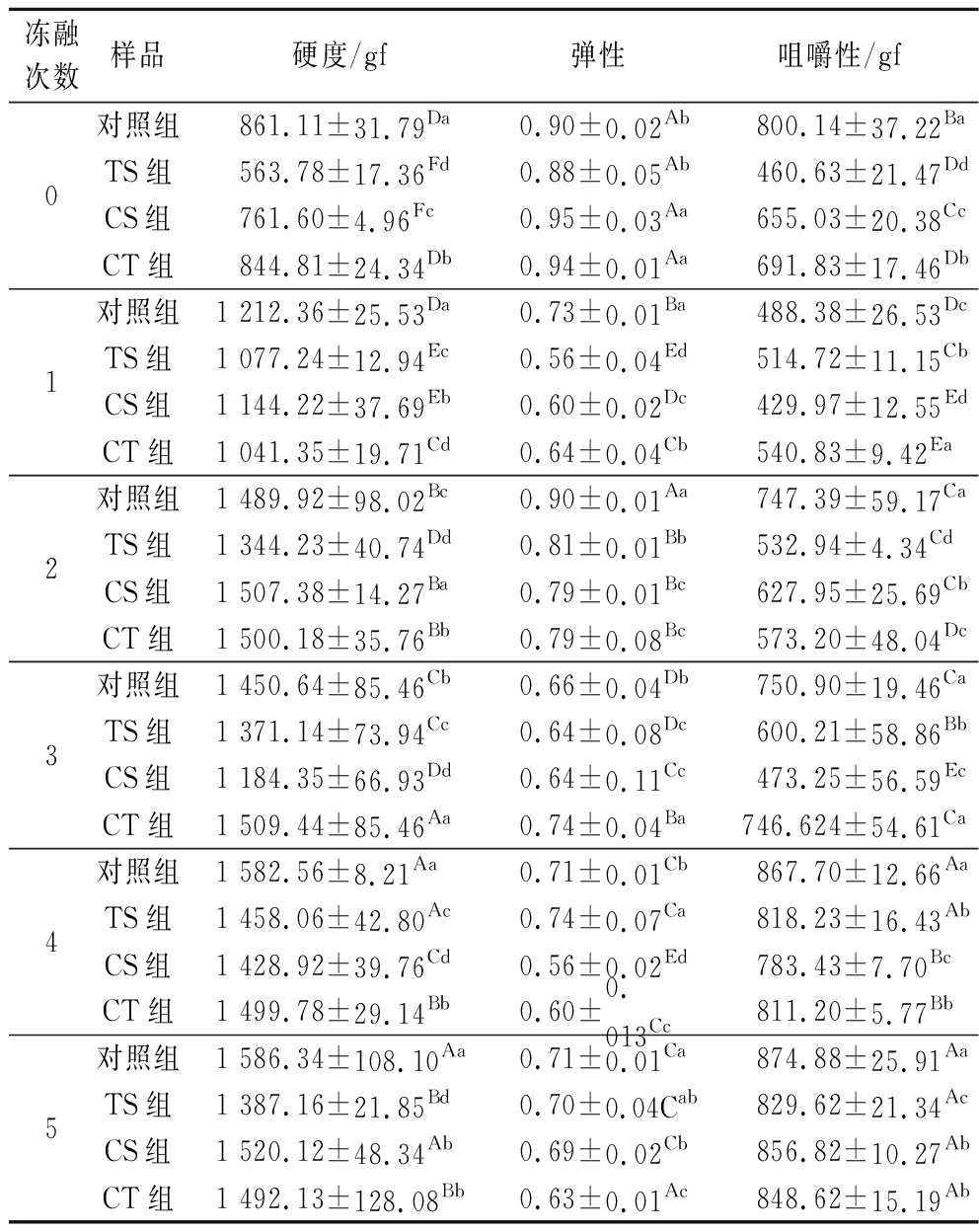
冻融次数样品硬度/gf弹性咀嚼性/gf0对照组861.11±31.79Da0.90±0.02Ab800.14±37.22BaTS组563.78±17.36Fd0.88±0.05Ab460.63±21.47DdCS组761.60±4.96Fc0.95±0.03Aa655.03±20.38CcCT组844.81±24.34Db0.94±0.01Aa691.83±17.46Db1对照组1 212.36±25.53Da0.73±0.01Ba488.38±26.53DcTS组1 077.24±12.94Ec0.56±0.04Ed514.72±11.15CbCS组1 144.22±37.69Eb0.60±0.02Dc429.97±12.55EdCT组1 041.35±19.71Cd0.64±0.04Cb540.83±9.42Ea2对照组1 489.92±98.02Bc0.90±0.01Aa747.39±59.17CaTS组1 344.23±40.74Dd0.81±0.01Bb532.94±4.34CdCS组1 507.38±14.27Ba0.79±0.01Bc627.95±25.69CbCT组1 500.18±35.76Bb0.79±0.08Bc573.20±48.04Dc3对照组1 450.64±85.46Cb0.66±0.04Db750.90±19.46CaTS组1 371.14±73.94Cc0.64±0.08Dc600.21±58.86BbCS组1 184.35±66.93Dd0.64±0.11Cc473.25±56.59EcCT组1 509.44±85.46Aa0.74±0.04Ba746.624±54.61Ca4对照组1 582.56±8.21Aa0.71±0.01Cb867.70±12.66AaTS组1 458.06±42.80Ac0.74±0.07Ca818.23±16.43AbCS组1 428.92±39.76Cd0.56±0.02Ed783.43±7.70BcCT组1 499.78±29.14Bb0.60±0.013Cc811.20±5.77Bb5对照组1 586.34±108.10Aa0.71±0.01Ca874.88±25.91AaTS组1 387.16±21.85Bd0.70±0.04Cab829.62±21.34AcCS组1 520.12±48.34Ab0.69±0.02Cb856.82±10.27AbCT组1 492.13±128.08Bb0.63±0.01Ac848.62±15.19Ab
质构是反映牛肉产品的适口性的重要感官参数,直接反映牛肉的组织状态和消费者接受度[26]。冷冻和冷冻储存会导致肌原纤维蛋白的化学变化和结构损伤,增加了肉的硬度[27]。与对照组相比,添加冷冻保护剂对牛肉样品的硬度和咀嚼性有明显改善。这表明使用冷冻保护剂进行预浸泡处理改善了牛肉质地特性。随着冻融次数的增加,牛肉硬度和咀嚼性呈现增加的趋势,经5次冻融处理,对照组硬度最高(1 586.34 gf),其次是CS组(1 520.12 gf),而TS组硬度最小(1 387.16 gf)。反复冻融会造成牛肉内水分的流失,使得牛肉硬度变大,咀嚼性变差;牛肉的弹性呈现缓慢减小,牛肉中水分流失,致使牛肉回弹性变差。
2.7 TBARS
如图6所示,脂质氧化是牛肉在加工和储存过程中质量恶化的重要原因。氧化食品的质量损失通常与营养物质损失、色泽裂变、风味变差以及有害物质形成有关。当食物在冷冻和冷藏温度下储存时,食物中的脂质被氧化,不饱和脂肪酸形成氢过氧化物,随后分解成二次产物,包括丙二醛和其他导致味道不好的羰基化合物[28]。经过2次和4次冻融处理,对照组和TS组的TBARS含量无显著性差异。在0次冻融下,对照组、TS组、CS组、CT组的TBARS值分别为0.16、0.09、0.12和0.12 mg/kg,而在5次冻融后,对照组、TS组、CS组、CT组的TBARS值分别为0.63、0.67、0.70和0.6 mg/kg,而加入了蔗糖处理的牛肉TBARS较高,牛肉的脂质氧化程度提高,可能是蔗糖提供了反应底物并促进牛肉中脂质氧化[29]。在本项研究中,卡拉胶和海藻糖可以用作保护材料,以防止冷藏期间的氧化。在冻融储存期间,与对照组相比,CT组处理的牛肉样品表现出较低的TBARS值。
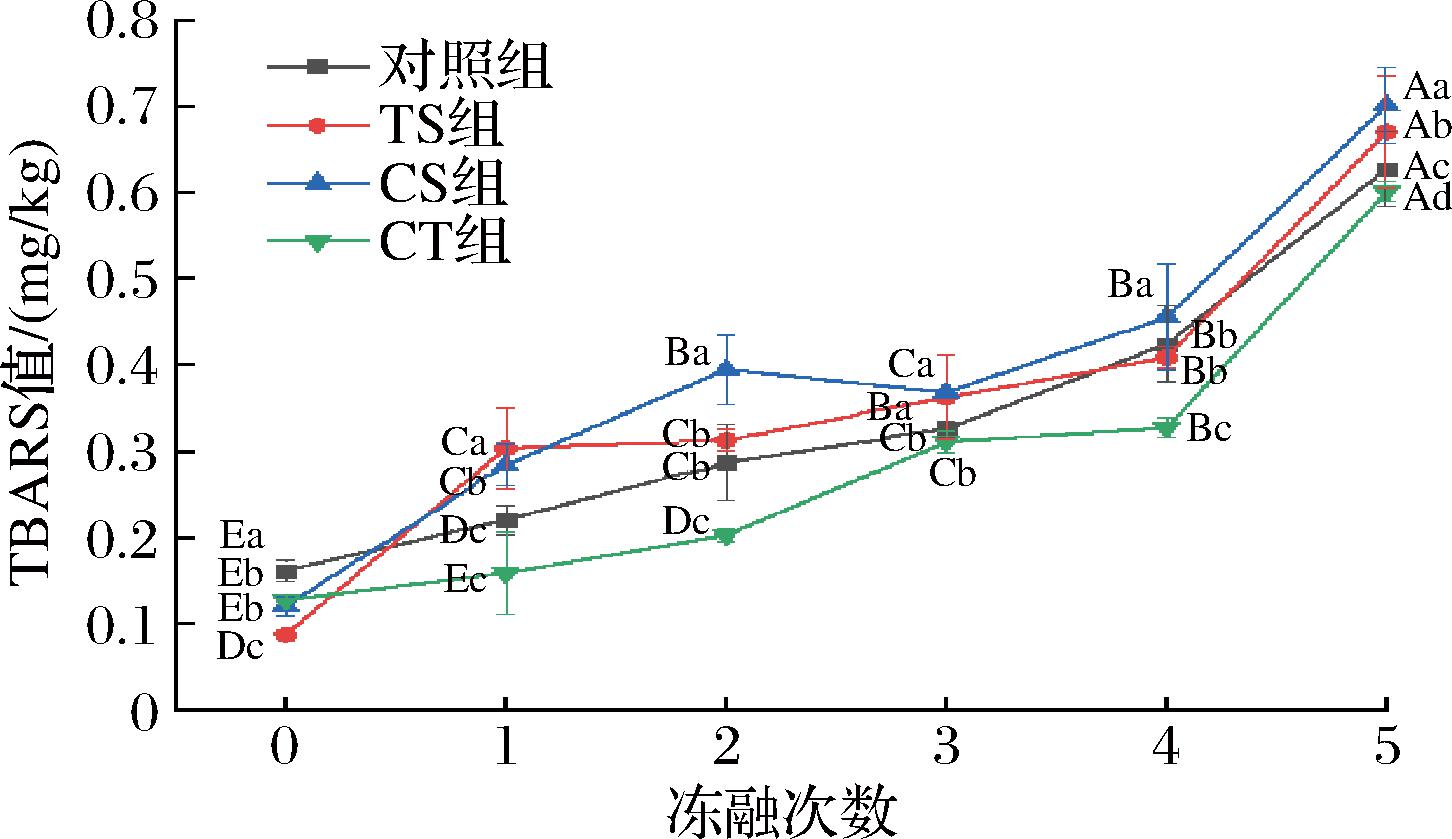
图6 不同冻融次数下冷冻保护剂对牛肉TBARS值影响
Fig.6 Effect of cryoprotectants on TBARS value of beef under different freeze-thaw times
2.8 微观结构
如图7所示,经5次冻融后,对照组肌原纤维之间的间隙明显较大,形状弯曲不规整,肌原纤维之间排列杂乱无章,这也使细胞内的物质释放到细胞间隙,同时这些被扩大的胞外间隙很可能是解冻汁液损失率增加的原因。肌原纤维的破坏程度加深会降低牛肉的水分保持能力,造成牛肉水分流失,这也进一步验证了水分损失和低场核磁水分分布的结果。刁华玉等[30]通过扫描电镜观察到南极磷虾肉冻融循环过程肌肉组织之间有较大的空隙,结构受损,与本研究结果一致。而冷冻保护剂TS、CS、CT组的牛肉组织纤维结合较紧密,其中TS和CS的牛肉肌原纤维排列更紧密,CT组肌原纤维之间间隙很小,呈规则的聚集结构。ZHANG等[31]发现添加卡拉胶和低聚木糖的虾肌原纤维组织结构更完整,肌纤维表面更光滑,持水性更好,这与本研究添加卡拉胶牛肉肌原纤维结构更完整聚集的结论一致。经5次冻融后,添加冷冻保护剂的牛肉,尤其是添加TS处理的牛肉结构更紧密,说明海藻糖和蔗糖对维持牛肉结构具有积极作用。

a-对照组;b-TS组;c-CS组;d-CT组
图7 冷冻保护剂对5次冻融处理下牛肉组织微观结构图(400×)
Fig.7 Microstructure of beef tissue under 5 freeze-thaw treatments with cryoprotectant (400×)
3 结论
本研究表明,在重复冻融循环后,由于牛肉中脂质氧化、冰晶形成和再结晶,导致牛肉的颜色变暗、肌原纤维结构完整性被破坏,品质变差。冷冻保护剂的加入,有效地抑制牛肉中的水分流失、维持色泽和肌原纤维结构来改善牛肉品质。TS组在冻融过程中对牛肉的保护作用高于其他2组。其中,海藻糖和蔗糖作为冷冻保护剂可以较好地降低牛肉解冻损失,减少了牛肉中固定水向自由水的转化,同时可以较好地保护肌原纤维结构,抑制pH的升高,降低硬度。通过这些研究,揭示了海藻糖、蔗糖和卡拉胶作为一种替代的冷冻保护剂,提高了在食品冷冻中的应用,解决商业蛋白类冷冻保护剂在冷冻肉制品中产生的经济成本高的问题。
[1] TAYENGWA T, CHIKWANHA O C, GOUWS P, et al.Dietary citrus pulp and grape pomace as potential natural preservatives for extending beef shelf life[J].Meat Science, 2020, 162:108029.
[2] NICKLAS T A, O’NEIL C E, ZANOVEC M, et al.Contribution of beef consumption to nutrient intake, diet quality, and food patterns in the diets of the US population[J].Meat Science, 2012, 90(1):152-158.
[3] LIU H, SAITO Y, AL RIZA D F, et al.Rapid evaluation of quality deterioration and freshness of beef during low temperature storage using three-dimensional fluorescence spectroscopy[J].Food Chemistry, 2019, 287:369-374.
[4] ALI S, ZHANG W G, RAJPUT N, et al.Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J].Food Chemistry, 2015, 173:808-814.
[5] CHENG H L, SONG S M, JUNG E Y, et al.Comparison of beef quality influenced by freeze-thawing among different beef cuts having different muscle fiber characteristics[J].Meat Science, 2020, 169:108206.
[6] LI B, SUN D W.Novel methods for rapid freezing and thawing of foods-a review[J].Journal of Food Engineering, 2002, 54(3):175-182.
[7] ZHANG B, WU H X, YANG H C, et al.Cryoprotective roles of trehalose and alginate oligosaccharides during frozen storage of peeled shrimp (Litopenaeus vannamei)[J].Food Chemistry, 2017, 228:257-264.
[8] BALCERZAK A K, MCCLYMONT K, BEN R N.140 The importance of hydrophobic moieties in ice recrystallization inhibitors[J].Cryobiology, 2013, 67(3):438.
[9] YANG Z K, YE G S, YANG D Z, et al.Observation on the ice crystal formation process of large yellow croaker (Pseudosciaena crocea) and the effect of multiple cryoprotectants pre-soaking treatments on frozen quality[J].Cryobiology, 2023, 113:104580.[10] ZHANG B, CAO H J, LIN H M, et al.Insights into ice-growth inhibition by trehalose and alginate oligosaccharides in peeled Pacific white shrimp (Litopenaeus vannamei) during frozen storage[J].Food Chemistry, 2019, 278:482-490.
[11] ZHANG G P, ZHU C Y, WALAYAT N, et al.Effect of cryoprotectants on physicochemical and structural changes in repeated freeze-thawed egg white protein[J].Food Bioscience, 2023, 55:102913.
[12] XIE Y, ZHOU K, CHEN B, et al.Synergism effect of low voltage electrostatic field and antifreeze agents on enhancing the qualities of frozen beef steak:Perspectives on water migration and protein aggregation[J].Innovative Food Science &Emerging Technologies, 2023, 84:103263.
[13] 吴梦迪, 马海乐, 刘会敏.不同模式超声波辅助低温腌制对牛肉品质的影响[J].食品与机械, 2023, 39(9):177-182;233.WU M D, MA H L, LIU H M.Effects of different modes of ultrasonic assisted lowtemperature curing on beef quality[J].Food &Machinery, 2023, 39(9):177-182;233.
[14] CAI L Y, ZHANG W D, CAO A L, et al.Effects of ultrasonics combined with far infrared or microwave thawing on protein denaturation and moisture migration of Sciaenops ocellatus (red drum)[J].Ultrasonics Sonochemistry, 2019, 55:96-104.
[15] LAN W Q, HU X Y, SUN X H, et al.Effect of the number of freeze-thaw cycles number on the quality of Pacific white shrimp (Litopenaeus vannamei):An emphasis on moisture migration and microstructure by LF-NMR and SEM[J].Aquaculture and Fisheries, 2020, 5(4):193-200.
[16] LIN H X, ZHAO S S, HAN X Y, et al.Effect of static magnetic field extended supercooling preservation on beef quality[J].Food Chemistry, 2022, 370:131264.
[17] JIANG Q Q, NAKAZAWA N, HU Y Q, et al.Changes in quality properties and tissue histology of lightly salted tuna meat subjected to multiple freeze-thaw cycles[J].Food Chemistry, 2019, 293:178-186.
[18] ZHANG B, ZHANG X L, SHEN C L, et al.Understanding the influence of carrageenan oligosaccharides and xylooligosaccharides on ice-crystal growth in peeled shrimp (Litopenaeus vannamei) during frozen storage[J].Food &Function, 2018, 9(8):4394-4403.
[19] DU X, CHANG P, TIAN J Y, et al.Effect of ice structuring protein on the quality, thermal stability and oxidation of mirror carp (Cyprinus carpio L.) induced by freeze-thaw cycles[J].LWT, 2020, 124:109140.
[20] KIM H W, MILLER D K, YAN F F, et al.Probiotic supplementation and fast freezing to improve quality attributes and oxidation stability of frozen chicken breast muscle[J].LWT, 2017, 75:34-41.
[21] LI G X, LI Z, LI X, et al.Postmortem ageing influences the thawed meat quality of frozen lamb loins[J].Food Chemistry, 2019, 275:105-112.
[22] CAO Y J, HAO R, GUO Z L, et al.Combined effects of superchilling and natural extracts on beef preservation quality[J].LWT, 2022, 153:112520.
[23] HE L, ZOU L K, YANG Q R, et al.Antimicrobial activities of nisin, tea polyphenols, and chitosan and their combinations in chilled mutton[J].Journal of Food Science, 2016, 81(6):M1466-M1471.
[24] CHEN J L, FAN Y Q, ZHANG X G, et al.Effect of antifreeze protein on the quality and microstructure of frozen chicken breasts[J].Food Chemistry, 2023, 404:134555.
[25] QIAN S Y, HU F F, MEHMOOD W, et al.The rise of thawing drip:Freezing rate effects on ice crystallization and myowater dynamics changes[J].Food Chemistry, 2022, 373:131461.
[26] 李玉梅, 司徒慧媛, 高加龙, 等.温度波动对大黄鱼冷链流通期间鲜度品质及水分迁移的影响[J].食品与发酵工业, 2024, 50(1):211-218.LI Y M, SITU H Y, GAO J L, et al.Effect of temperature fluctuation on quality and moisture migration of Pseudosciaena crocea during cold chain circulation[J].Food and Fermentation Industries, 2024, 50(1):211-218.
[27] LIU F, YANG N, ZHANG L T, et al.Effect of weak magnetic field on the water-holding properties, texture, and volatile compounds of pork and beef during frozen storage[J].Food Bioscience, 2023, 53:102667.
[28] GANH O R, ESTÉVEZ M, MORCUENDE D.Suitability of the TBA method for assessing lipid oxidation in a meat system with added phenolic-rich materials[J].Food Chemistry, 2011, 126(2):772-778.
O R, ESTÉVEZ M, MORCUENDE D.Suitability of the TBA method for assessing lipid oxidation in a meat system with added phenolic-rich materials[J].Food Chemistry, 2011, 126(2):772-778.
[29] SHI H N, QIN R K, WU R L, et al.Effect of cryoprotectants on the formation of advanced glycation end products and acrylamide in fried fish cakes[J].Food Bioscience, 2021, 44:101433.
[30] 刁华玉, 林松毅, 梁瑞, 等.南极磷虾肉冻融循环过程水分的迁移及微观结构变化[J].中国食品学报, 2022, 22(6):242-250.DIAO H Y, LIN S Y, LIANG R, et al.Moisture migration and microstructure changes of Antarctic krill meat during multiple freeze-thaw cycles[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(6):242-250.
[31] ZHANG B, CAO H J, WEI W Y, et al.Influence of temperature fluctuations on growth and recrystallization of ice crystals in frozen peeled shrimp (Litopenaeus vannamei) pre-soaked with carrageenan oligosaccharide and xylooligosaccharide[J].Food Chemistry, 2020, 306:125641.