低温无水保活技术就是通过梯度降温等方法,使水产品进入休眠状态,以降低水产品新陈代谢,减少机械损伤,延长水产品的保活时间,达到长途保活运输的目的。然而,鱼类是在水中生活的变温动物,水温是影响鱼类生殖生长的重要环境因子,当外界生存水环境的温度发生改变时体温也随之发生变化,如所处水环境的温度降低时,鱼体内会发生一系列生理、生化指标的变化[1-2],从而引发机体产生应激,严重时甚至会造成死亡。因此,探究如何缓解鱼类进入休眠期间低温诱发的胁迫反应,保持鱼类无水状态时的品质具有重要意义。
维生素E,是目前最主要的抗氧化剂之一。根据前期的研究工作发现,水体中添加维生素E对鲫鱼进行处理能够缓解降温胁迫带来的负面影响,其中100 mg/L的维生素E效果最好[3]。维生素E除了是脂溶性的生物组织抗氧化剂外,还是一种自由基清除剂,可清除自由基保护细胞膜,防止细胞氧化损伤,从而提高鱼类的抗氧化、抗应激的能力,提高鱼类免疫力以及繁殖能力[4]。机体存在2种抗氧化防御系统:酶抗氧化系统和非酶抗氧化系统,这2种防御系统的协调作用,使得机体免受氧化损伤,并与体内生成的活性氧形成一种平衡的状态,其中酶抗氧化系统主要包括超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等[5]。然而维持这种平衡状态并不是很牢固,极易受外界因素影响,如鱼类所处的水环境温度发生不好的变化时,这种平衡就会被破坏,就可能会导致鱼类受到氧化胁迫,从而导致细胞和机体的损伤[6]。此外,低温环境引起的细胞和组织的生理生化反应可能导致组织结构和功能的变化[7]。有研究表明,水体中添加维生素E对鲫鱼进行处理能够缓解冷应激下的氧化应激,减缓肝损伤[8]。然而,水体中添加维生素E对鲫鱼脑组织的作用尚未明确。因此,本研究以鲫鱼为研究对象,探究维生素E对鲫鱼降温胁迫下脑组织中抗氧化水平及肌肉组织学结构的影响,以期填补这方面的空缺,为水体中添加维生素E应用于缓解鱼类压力提供理论参考。
1 材料与方法
1.1 材料与试剂
鲫鱼购自济南市海鲜大市场,并运至山东省农产品贮运保鲜技术重点实验室。挑选个体初始体重(0.3±0.1)kg、体长(15.7±1.1)cm、体质健康、体表无损伤、鳞片完整、大小均匀的成鱼,暂养于山东省农产品贮运保鲜技术重点实验室水产品控温循环水过滤系统待用,暂养鲫鱼的水温参数设置为(20±1)℃,溶氧量参数设置为≥6 mg/L;暂养的时间参数设置为24 h。
H2O2、超氧阴离子(·O2-)、丙二醛(malondialdehyde,MDA)、总蛋白定量测定试剂盒(BCA试剂盒)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)试剂盒,南京建成生物工程研究所;通用组织固定液(4%多聚甲醛),北京索莱宝科技有限公司;二甲苯,国药集团化学试剂有限公司;磷酸盐缓冲盐水、HE染液、分化液、返蓝液,武汉赛维尔生物科技有限公司。
1.2 仪器与设备
T9S 紫外分光光度计,北京普析通用仪器有限责任公司;JPB-607A 型便携式溶解氧分析仪,上海雷磁仪电科学仪器股份有限公司;RM2125RTS徕卡切片机,北京悦昌行科技有限公司;水产养殖及循环水处理系统,青岛中科海水处理设备工程有限公司;鲜活水产品智能冷驯化/唤醒箱,山东省农产品贮运保鲜技术重点实验室自主研发(专利号ZL201310447777.8)。
1.3 试验方法
1.3.1 维生素E处理
试验组按维生素E∶无水乙醇=1∶5(g∶mL)的比例将维生素E溶入无水乙醇制成原液,并将原液加水调配成质量浓度为100 mg/L的维生素E水溶液,设为E3,以不添加维生素E(0 mg/L)处理的鲫鱼作为对照组E1,每组18尾鲫鱼。设置阴性对照组E2,E2为乙醇量与配制100 mg/L维生素E水溶液时所需乙醇量相同的无水乙醇与水配制而成的乙醇水溶液,每组18尾鲫鱼。将暂养后的鲫鱼分别转入E1、E2和E3处理组水溶液的冷驯化智能降温装置中进行药浴,时间为2 h。
1.3.2 冷驯化处理
冷驯化实验由自主研发的冷驯化智能降温装置完成。整个冷驯化实验由2部分组成:装置先以降温速率参数为10 ℃/h的速度将水的温度从20 ℃降至10 ℃,然后再切换成5 ℃/h的降温速率将水的温度由10 ℃降至5 ℃;分别在20、10、5 ℃的3个温度点随机取出6尾鲫鱼进行取样。
1.3.3 指标测定
鲫鱼从冷驯化智能降温装置中取出后,将鲫鱼放置在盛有冰块的托盘上进行解剖,取其脑组织,液氮处理后放入-80 ℃冰箱中保存待用。按照袁梦莹等[9]的方法,随机选取2尾鱼的适量肌肉组织,分别浸润在4%甲醛固定液中,以制备石蜡切片。
1.3.3.1 氧化应激指标测定
采用紫外分光光度计对脑组织中H2O2、·O2-和MDA的含量进行测定。脑组织中蛋白质含量用总蛋白定量测定试剂盒(BCA试剂盒)测定。
1.3.3.2 抗氧化指标测定
脑组织中SOD、GSH-Px和CAT的活性按试剂盒说明书进行测定。
1.3.3.3 组织结构观察
以E1组在20 ℃时的肌肉组织为空白对照组,观察E1、E2和E3组在5 ℃时的肝脏组织结构。用手术刀小心地将肝脏切成5~6 μm厚的切片,将4%甲醛固定液中肌肉组织用体积分数为50%、70%、85%、95%的乙醇和无水乙醇逐级脱水,每级脱水2 h;将样品用石蜡进行包埋,然后再对包埋的样品进行切片、染色、中性树胶封片等步骤的操作,最后在光学显微镜下观察组织学特征。
1.4 数据统计
数据由Excel表格和SPSS 22软件进行处理,采用单因素方差分析(one-way ANOVA)和Duncan检验法对数据进行显著性差异分析,显著性水平设P<0.05表示显著,结果由Origin2019软件绘制图表。
2 结果与分析
2.1 维生素E对降温胁迫下鲫鱼氧化应激指标的影响
MDA是一种多不饱和脂肪酸过氧化产物,其含量通常被用来评定是否发生脂质过氧化和氧化应激[10]。活性氧(reactive oxygenic species,ROS)的特征表现为具有氧且化学反应较之氧更为活跃,通常是氧直接或间接地转化而成的某些代谢产物及其衍生的含氧物质[11]。ROS主要包括:H2O2、·O2-、单重态氧(1O2)以及由芬顿反应产生的羟自由基(·OH)等[12]。在胁迫环境下,鱼体内的活性氧会被大量积累,如H2O2、·O2-等,若不及时有效地清理,会和体内的生物大分子发生反应,导致脂质过氧化,进而影响鱼类正常的生理活动[8,13-14]。如图1-a所示,在降温过程中,E1、E2处理组的MDA含量呈上升趋势,E3处理组的MDA含量呈先升后降的趋势。随着温度的降低,E1处理组的H2O2含量呈先升后降的趋势,E2、E3处理组则呈先降后升的趋势(图1-b)。如图1-c所示,E1、E3处理组的·O2-含量随着温度的降低呈先降后升的趋势,E2处理组则呈先升后降的趋势。蔡润佳等[15]研究发现,低温胁迫下,会导致军曹鱼幼鱼体内脂类过氧化加剧,MDA含量增加。有研究表明,在胁迫处理下,会导致斑马鱼机体发生氧化应激,H2O2和·O2-含量增加[16-17]。本研究中,降温后,鲫鱼脑组织中MDA、H2O2和·O2-含量整体升高,说明降温条件下鲫鱼脑组织脂质过氧化加剧,氧自由基增加,导致细胞膜氧化损伤、细胞凋亡,对脑组织造成一定程度的损伤,但E3处理组的MDA、H2O2和·O2-含量显著低于E1、E2处理组(P<0.05),说明胁迫前后,维生素E处理的鲫鱼能有效降低MDA、H2O2和·O2-含量,从而降低自由基的积累量,减缓脂质过氧化,故维生素E处理能够在一定程度上减缓温度引起的氧化应激,减轻脑损伤。
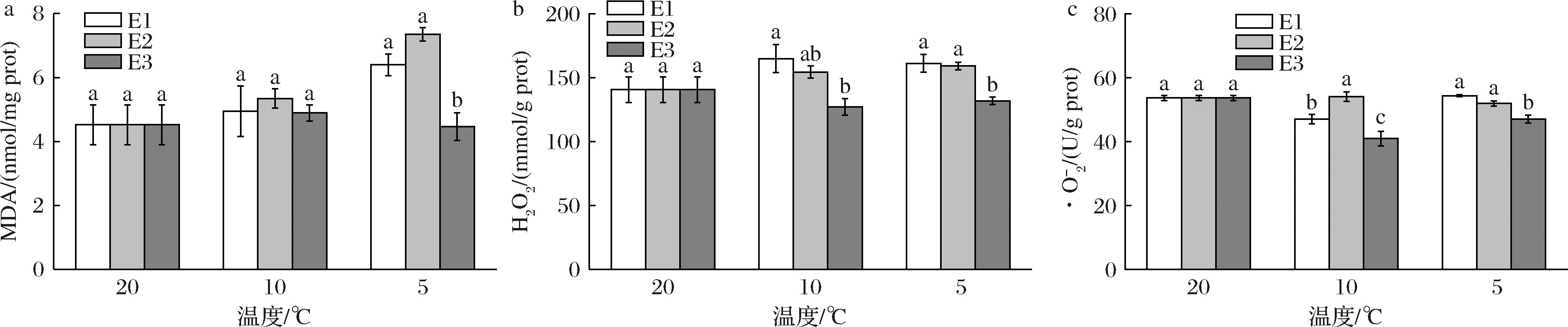
a-MDA;b-H2O2;c-·O2-
图1 维生素E对降温胁迫下鲫鱼脑组织MDA、H2O2和·O2-的影响
Fig.1 Effects of vitamin E on MDA, H2O2,and ·O2- in brain tissue of crucian carp under cooling stress
注:柱上方的不同小写字母表示有显著性差异(P<0.05),相同小写字母表示无显著性差异(P>0.05)(下同)。
2.2 维生素E对降温胁迫下鲫鱼抗氧化指标的影响
抗氧化酶如CAT、SOD和GSH-Px在维持人体正常代谢功能方面发挥着重要作用[18]。研究表明,在低温胁迫下,其抗氧化酶活性都会增加[19]。其中,SOD可以有效地清除机体内的活性自由基,将其转化为H2O2和H2O,随后CAT将H2O2分解为O2和H2O,将H2O2清除,从而维持机体内适当的阴离子浓度;此外 GSH-Px 具有还原性,在有毒的过氧化物和无毒的羟基化合物之间进行转化,从而减少细胞遭受的氧化物损伤[20-21]。如图2-a所示,E1、E2处理组的CAT活性随温度的降低呈上升的趋势,E3处理组的则呈先降后升的趋势。在降温过程中,E1、E2处理组的SOD活性随温度的降低而上升,E3处理组的则呈先升后降的趋势(图2-b)。随着温度的降低,E1、E2和E3处理组的GSH-Px活性呈先降后升的趋势(图2-c)。有研究表明,在胁迫处理下,黑鲷(Acanthopagrus schlegelii)[22]的CAT、SOD和GSH-Px活性急剧上升。本研究中,鲫鱼的脑CAT、SOD和GSH-Px活性在降温胁迫下均升高,说明降温胁迫会导致鱼体内自由基的大量堆积,为应对体内的自由基的变化,鲫鱼体内的抗氧化酶系统便随之做出相应的调整以帮助鱼体适应不利环境,从而减少自由基对脑组织的损伤。然而,E3处理组的CAT、SOD和GSH-Px活性显著低于E1、E2处理组(P<0.05)。CAT、SOD和GSH-Px的表达量大小是机体应对应激的主要方式,也反映出应激的程度[23],且结合MDA的研究结果表明维生素E处理能够在一定程度上缓解鲫鱼的应激,应激程度的降低,与之对应的抗氧化酶的活性也随之降低,进而减缓了鲫鱼脑组织的氧化损伤。

a-CAT;b-SOD;c-GSH-Px
图2 维生素E对降温胁迫下鲫鱼脑组织抗氧化指标的影响
Fig.2 Effects of vitamin E on antioxidant indexes of crucian carp brain tissue under cooling stress
2.3 维生素E对降温胁迫下鲫鱼肌肉组织结构的影响
肌肉是鱼类运动的主要参与者,而突然的低温胁迫使鱼类迅速运动, 不可避免地会对肌肉组织造成一定损伤。通过观察维生素E对降温胁迫下鲫鱼肌肉组织结构的变化(图3)可知,各个组的肌肉组织横切面显示数个边界清楚的肌纤维束,多数呈角状外观;与空白组对比,E1处理组的肌肉组织中少量肌束内的肌纤维出现排列疏松的现象(图3-b),E2处理组的肌肉组织中可见小灶性的肌纤维分界不清,呈均质状(图3-c),E3处理组的肌肉组织中的肌纤维排列紧密(图3-d)。
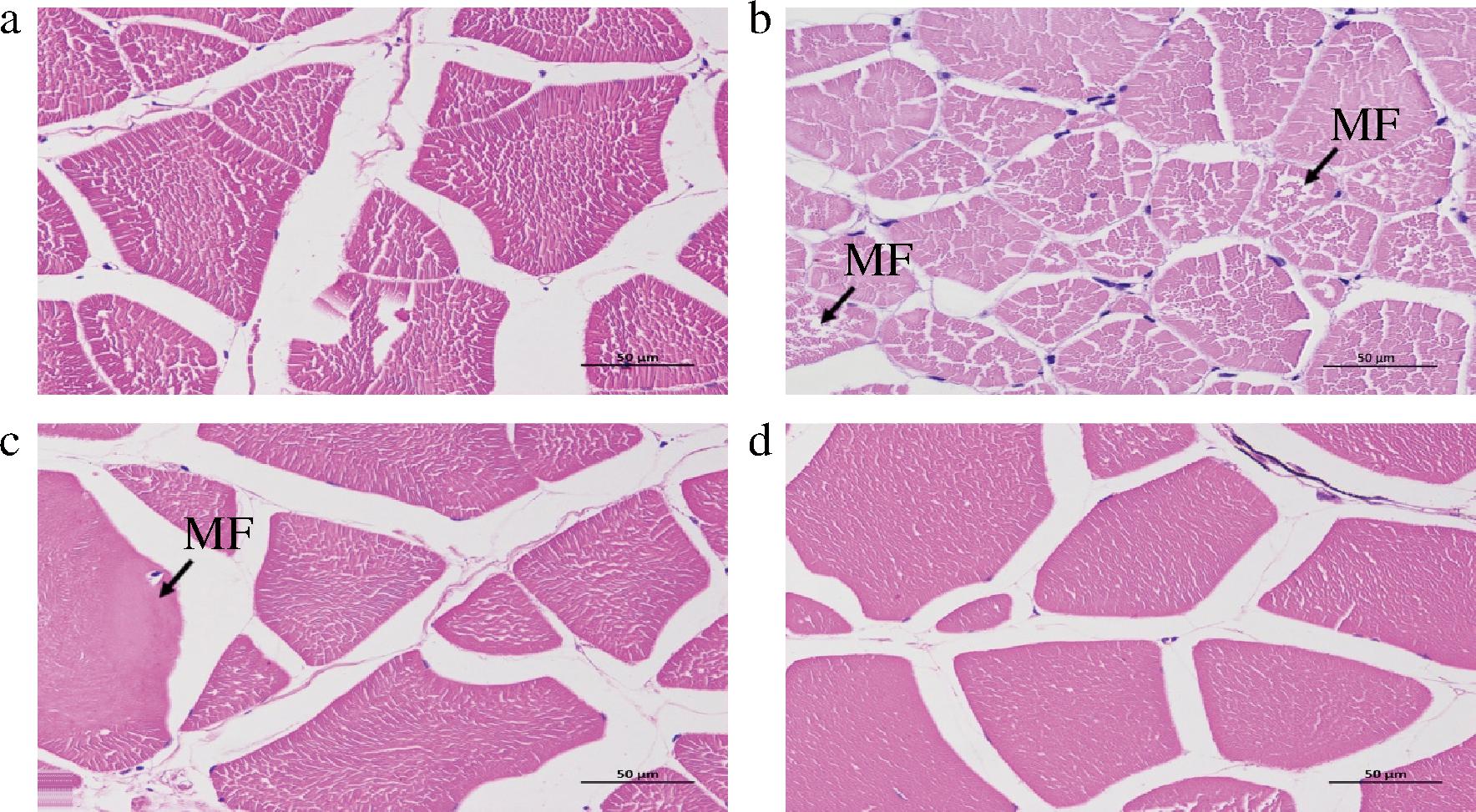
a-空白组;b- E1处理组;c-E2处理组;d-E3处理组
图3 5 ℃时维生素E对降温胁迫下鲫鱼肝脏组织结构的影响
Fig.3 Effect of vitamin E on the liver tissue structure of Carassius auratus under cooling stress
注:MF表示肌纤维。
研究表明,肌纤维的发育跟鱼类的营养水平、运动方式、环境因子等有着直接的影响[24-26]。如低温胁迫下,四指马鲅幼鱼肌肉出现结构显著变化,肌纤维之间的缝隙增大,严重部分甚至发生断裂[27]。SAXENA等[28]研究发现胁迫处理下能造成动物体肌纤维的氧化损伤。本研究中,未经维生素E处理(即E1、E2处理组)的鲫鱼肌肉组织出现肌纤维疏松、均质化等病变症状,而经过维生素E(即E3处理组)处理的鲫鱼肌肉组织则无明显病变现象。鱼类进化过程中,机体对内外界刺激具有一定的适应能力,轻度刺激对鱼类的生长和体质起到一个促进和改善的作用,但过于剧烈或长期的刺激不仅不具备积极作用,还会造成机体损伤、甚至死亡。根据四指马鲅[27]的研究结果推测,未经维生素E处理的鲫鱼出现病变症状可能是所受的胁迫强度已经超出了机体所能承受的适应范围,对肌肉造成不可逆的损伤,而维生素E处理的鲫鱼则无明显现象,说明维生素E处理能增强鱼体对外界刺激的适应能力,从而降低胁迫所引发的负面影响,减缓机体的氧化损伤。
3 结论
本实验以鲫鱼作为动物实验模型,研究水体中添加维生素E对鲫鱼降温胁迫下脑组织氧化应激指标、抗氧化指标及肌肉组织结构的影响。结果发现,水体中添加维生素E对鲫鱼进行处理可显著缓解降温胁迫下鲫鱼脑组织的氧化应激,减缓鲫鱼肌肉组织的氧化损伤,为进一步研究维生素E处理对鲫鱼降温胁迫下的缓解作用机制奠定基础。
[1] 李豫, 黄建盛, 陈有铭, 等.低温胁迫对军曹鱼幼鱼血清生化指标、肝脏抗氧化酶活性及凋亡相关基因表达量的影响[J].广东海洋大学学报, 2022, 42(5):18-26.LI Y, HUANG J S, CHEN Y M, et al.Effects of low-temperature stress on serum biochemical, antioxidant enzymes activities and apoptosis-related gene expression in liver of juvenile cobia(Rachycentron canadum)[J].Journal of Guangdong Ocean University, 2022, 42(5):18-26.
[2] 邵彦翔, 陈超, 李炎璐, 等.低温胁迫对云纹石斑鱼(♀)×鞍带石斑鱼(♂)杂交后代血清生化指标的影响[J].渔业科学进展, 2017, 38(2):70-76.SHAO Y X, CHEN C, LI Y L, et al.Effects of low temperature stress on serum biochemical indices of the juvenile hybrid of Epinephelus moara♀ × Epinephelus lanceolatus♂[J].Progress in Fishery Sciences, 2017, 38(2):70-76.
[3] 唐家铭, 蒋乐霞, 张长峰, 等.维生素E对鲫鱼生理生化、肌肉质构及风味的影响及其缓解降温胁迫作用研究[J].食品与发酵工业, 2023, 49(19):226-234.TANG J M, JIANG L X, ZHANG C F, et al.Effect of vitamin E on physiology and biochemistry, muscle texture, and flavor of crucian carp (Carassius auratus) and its effect on mitigation of cooling stress[J].Food and Fermentation Industries, 2023, 49(19):226-234.
[4] 王旭, 李娟.饲料中维生素E不同添加水平对香鱼仔稚鱼生长性能及抗氧化酶活力的影响[J].饲料工业, 2021, 42(12):49-53.WANG X, LI J.Effects of vitamin E level in feedstuff on growth performance and antioxidant enzyme activity in of sweetfish(Plecoglossus altivelis) larvae and juveniles[J].Feed Industry, 2021, 42(12):49-53.
[5] 亢玉静, 郎明远, 赵文.水生生物体内抗氧化酶及其影响因素研究进展[J].微生物学杂志, 2013, 33(3):75-80.KANG Y J, LANG M Y, ZHAO W.Advance in antioxidant enzymes and its effect factors in aquatic organisms[J].Journal of Microbiology, 2013, 33(3):75-80.
[6] 潘桂平, 刘本伟, 周文玉.低温胁迫对云纹石斑鱼幼鱼抗氧化和免疫指标的影响[J].上海海洋大学学报, 2016, 25(1):78-85.PAN G P, LIU B W, ZHOU W Y.The effects of cold stress on the antioxidant defense and immune parameters of juvenile Epinephelus moara[J].Journal of Shanghai Ocean University, 2016, 25(1):78-85.
[7] ELABD H, WANG H P, SHAHEEN A, et al.Anti-oxidative effects of some dietary supplements on Yellow perch (Perca flavescens) exposed to different physical stressors[J].Aquaculture Reports, 2017, 8:21-30.
[8] TANG J M, ZHANG C F, JIAMG L X, et al.Effects of vitamin E on immune response, antioxidant capacity, and liver tissue structure of Crucian carp under acute cold stress[J].Aquaculture Research, 2023.
[9] 袁梦莹, 王恒志, 米海峰, 等.不同来源菜籽粕对鲤鱼生长、消化生理、抗氧化能力和健康的影响[J].动物营养学报, 2023, 35(1):469-493.YUAN M Y, WANG H Z, MI H F, et al.Effects of rapeseed meal from different sources on growth, digestive physiology, antioxidant capacity and health of common carp[J].Chinese Journal of Animal Nutrition, 2023, 35(1):469-493.[10] 杜欢, 秦小明, 范秀萍, 等.CO2协同低温有水对卵形鲳鲹麻醉保活效果的影响[J].广东海洋大学学报, 2022, 42(1):35-43.DU H, QIN X M, FAN X P, et al.Synergistic effect of CO2 and low water temperature on the anesthesia and survival of Trachinotus ovatus[J].Journal of Guangdong Ocean University, 2022, 42(1):35-43.
[11] 徐德立. 低温胁迫对草鱼ZC—7901细胞系和淡水白鲳CBS细胞系某些细胞功能影响的研究[D].杭州:浙江大学, 2002.XU D L.The study of the effects of cold stress on some cell fuction of the Ctenopharyngodon idella cell line ZC-7901 and the Colossoma brachypomum cell line CBS[D].Hangzhou:Zhejiang University, 2002.
[12] 王婷. 温度调控球等鞭金藻3011DHA的积累及其作用机理[D].天津:天津商业大学, 2015.WANG T.Accumulation and mechanism of DHA in isochrysis globosa 3011DHA regulated by temperature[D].Tianjin:Tianjin University of Commerce, 2015.
[13] CAO L, HUANG W, LIU J H, et al.Accumulation and oxidative stress biomarkers in Japanese flounder larvae and juveniles under chronic cadmium exposure[J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology, 2010, 151(3):386-392.
[14] L PEZ E, ARCE C, OSET-GASQUE M J, et al.Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J].Free Radical Biology and Medicine, 2006, 40(6):940-951.
PEZ E, ARCE C, OSET-GASQUE M J, et al.Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J].Free Radical Biology and Medicine, 2006, 40(6):940-951.
[15] 蔡润佳, 张静, 黄建盛, 等.低温胁迫对军曹鱼幼鱼脂代谢相关生理生化的影响[J].广东海洋大学学报, 2021, 41(3):123-130.CAI R J, ZHANG J, HUANG J S, et al.Effects of low temperature stress on physiology and biochemistry of lipid metabolism of juvenile cobia, Rachycentron canadum[J].Journal of Guangdong Ocean University, 2021, 41(3):123-130.
[16] 朱小山. 几种人工纳米材料的生态毒理学研究[D].天津:南开大学, 2007.ZHU X S.Aquatic ecotoxicities of several manufactured nanomaterials[D].Tianjin:Nankai University, 2007.
[17] 谷亚齐. 甜菜碱通过Wnt/β-catenin通路调控斑马鱼ZF4细胞ROS的机制研究[D].淄博:山东理工大学, 2021.GU Y Q.The study on the mechanism that betaine regulates ROS through Wnt/β-catenin pathway in the ZF4 cells of zebrafish[D].Zibo:Shandong University of Technology, 2021.
[18] IGHODARO O M, AKINLOYE O A.First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX):Their fundamental role in the entire antioxidant defence grid[J].Alexandria Journal of Medicine, 2018, 54(4):287-293.
[19] 文鑫. 暗纹东方鲀(Takifugu fasciatus)应对低温胁迫的生理响应和分子机制研究[D].南京:南京师范大学, 2019.WEN X.Physiological response and molecular mechanism of Takifugu fasciatus to low temperature stress[D].Nanjing:Nanjing Normal University, 2019.
[20] WEN X, CHU P, XU J J, et al.Combined effects of low temperature and salinity on the immune response, antioxidant capacity and lipid metabolism in the pufferfish (Takifugu fasciatus)[J].Aquaculture, 2021, 531:735866.
[21] WANG M, WU F L, XIE S G, et al.Acute hypoxia and reoxygenation:Effect on oxidative stress and hypoxia signal transduction in the juvenile yellow catfish (Pelteobagrus fulvidraco)[J].Aquaculture, 2021, 531:735903.
[22] 陈自强, 张志勇, 祝斐, 等.急性低温对黑鲷抗氧化酶活性和热休克蛋白含量的影响[J].动物学杂志, 2020, 55(6):784-792.CHEN Z Q, ZHANG Z Y, ZHU F, et al.The effects of acute low temperature stress on activities of antioxidant enzymes and heat shock protein content in Acanthopagrus schlegelii[J].Chinese Journal of Zoology, 2020, 55(6):784-792.
[23] 郑翔. 低氧胁迫对瓦氏黄颡鱼肠道氧化应激、细胞凋亡及其微生物组成的影响[D].南京:南京师范大学, 2021.ZHENG X.Effects of hypoxia stress on intestinal oxidative stress, apoptosis and microbial composition of Pelteobagrus vachelli[D].Nanjing:Nanjing Normal University, 2021.
[24] 郭琼林, 卢全章.草鱼肾脏和脾脏血细胞发育过程的观察[J].水生生物学报, 1993, 17(1):40-45.GUO Q L, LU Q Z.Observation on the development of blood cells in kidney and spleen of grass carp[J].Acta Hydrobiologica Sinica, 1993, 17(1):40-45.
[25] JOHNSTON I A, ALDERSON R, SANDHAM C, et al.Muscle fibre density in relation to the colour and texture of smoked Atlantic salmon (Salmo salar L.)[J].Aquaculture, 2000, 189(3-4):335-349.
[26] JOHNSTON I A, MANTHRI S, ALDERSON R, et al.Freshwater environment affects growth rate and muscle fibre recruitment in seawater stages of Atlantic salmon (Salmo salar L.)[J].The Journal of Experimental Biology, 2003, 206(Pt 8):1337-1351.
[27] 刘奇奇, 温久福, 区又君, 等.急性离水操作胁迫对四指马鲅(Eleutheronema tetradactylum)幼鱼组织结构和氧化应激的影响[J].渔业科学进展, 2017, 38(6):48-55.LIU Q Q, WEN J F, OU Y J, et al.The effects of acute off-water handling stress on the tissue structure and oxidative stress of juvenile Eleutheronema tetradactylum[J].Progress in Fishery Sciences, 2017, 38(6):48-55.
[28] SAXENA S, SHUKLA D, SAXENA S, et al.Hypoxia preconditioning by cobalt chloride enhances endurance performance and protects skeletal muscles from exercise-induced oxidative damage in rats[J].Acta Physiologica, 2010, 200(3):249-263.