鲅鱼(Scomberomorus niphonius)学名蓝点马鲛,身体呈流线型,腹部银白色,背部颜色较深,通常有黑色斑点。主要分布于北太平洋西部,是我国北方海域的重要经济鱼种,仅2020年全国捕捞总产量就高达35.5万t[1]。鲅鱼含有丰富的蛋白质和不饱和脂肪酸[2],对人类具有很高的营养价值[3],在世界范围内被广泛食用。然而,鲅鱼在加工和储存过程中容易发生蛋白质氧化,影响产品质量。
在鲅鱼肌肉蛋白质中,肌浆蛋白(sarcoplasmic proteins,SP)作为除肌原纤维蛋白外的重要组分,SP约占总蛋白质组分的1/3[4],主要由肌红蛋白和糖酵解酶组成。尽管与肌原纤维蛋白相比,不能直接影响肌肉嫩度,但研究发现肌浆蛋白的变性对肌肉的品质(如色泽和持水能力)具有重要影响[5]。
氧化是水产品加工和储存过程中造成品质下降的主要原因之一。蛋白质氧化是由活性氧(reactive oxygen species,ROS)引起的直接反应或与氧化应激的副产物间接诱导的蛋白质共价修饰[6]。由于蛋白质与脂质在水产品系统中共存,除了蛋白质氧化,脂质也极容易受到氧化,且两种反应通常是相互依赖[7]。脂质的氢过氧化物是主要的初始氧化产物,氧化产物可以诱导过氧、羟和烷氧自由基的形成[8],而过氧自由基又极易触发蛋白质的氧化[9]。在过去的研究中,不饱和脂肪酸的氧化与蛋白质氧化在水产品品质变化中得到了广泛的关注,证实了不饱和脂肪酸和蛋白质之间的相互作用对蛋白质的氧化有很大影响[10]。
OA是鲅鱼中的一种单不饱和脂肪酸(monounsaturated fatty acid,MUFA),与其他脂肪酸一起以甘油酯的形式存在于脂质中,在脂肪酸中占比40%~50%[11]。脂肪酸被证实参与了肌肉中ROS的形成,进而诱导蛋白质的氧化[12],导致肉质的品质恶化。国内外学者已经研究了大量脂肪酸(亚油酸、二十碳五烯酸和二十二碳六烯酸等)对肌原纤维蛋白的氧化诱导作用[1,13-14],但是鲜见OA对肌浆的蛋白氧化诱导的相关报道。因此,本研究旨在探讨不同浓度OA诱导对鲅鱼SP结构和理化特性的影响,进一步探索脂质诱导蛋白质氧化在水产品中的意义,为深入理解水产品肌肉蛋白氧化提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜鲅鱼[体长(45.00±2.50) cm、体重(648.20±22.80) g],大连市新长兴市场,用泡沫箱覆冰运输到实验室。切除鱼头、内脏、鱼骨和鱼皮,取背部长条肌,切成均匀的小块(5 cm×3 cm×2 cm),用聚乙烯袋密封保存,置于冰箱(-20 ℃)中备用。
油酸(分析纯),上海阿拉丁生化科技股份有限公司;KBr(光谱纯),天津市光复精细化工研究所;2,4-二硝基苯肼 (2,4-dinitrophenylhydrazine, DNPH)(色谱纯),上海麦克林生化科技有限公司;5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid, DTNB](色谱纯),国药集团化学试剂有限公司;标准蛋白,Thermal公司(美国)。其他试剂均为国产分析纯。
1.2 仪器与设备
BS-224S电子分析天平,赛多利斯仪器系统有限公司(北京);HR/T20MM 立式高速冷冻离心机,湖南赫西仪器装备有限公司;FZ3000-SH数显高速分散均质机,上海标本制造厂;Mini-PROTEAN Tetra Cell电泳系统,美国Bio-Rad公司;Synergy HT多功能酶标仪,美国伯腾仪器有限公司;UV-16001紫外-可见分光光度计,日本岛津仪器有限公司;F-2700荧光分光光度计,日本Hitachi公司;NEXUS670傅里叶红外光谱仪(Fourier-transform infrared spectroscopy,FTIR),美国PerkinElmer公司。
1.3 实验方法
1.3.1 肌浆蛋白的制备
鲅鱼SP的提取采用CHEN等[15]的方法稍作修改。将绞碎鱼肉样品与磷酸盐缓冲液(20 mmol/L、pH 6.8)按照1∶5(g∶mL)的比例加入到50 mL的离心管中,高速均质(6 000 r/min、2 min)。均质后离心(8 000 r/min、4 ℃、30 min)。收集上清液,用滤纸过滤,滤液即为SP。采用Biuert法测定其蛋白质含量。
1.3.2 氧化复合物的制备
称取适量OA加入25 mL容量瓶中,加入吐温-20 (0.2 g),用磷酸盐缓冲液(20 mmol/L、pH 6.8)制备不同浓度(0、10、20、30、40 mmol/L)的OA乳液。将SP溶液(5 mg/mL、pH 6.8)与不同浓度OA按4∶1(体积比)混合。混合溶液使用涡旋混合器涡旋1 min,使鲅鱼SP与OA乳液充分接触。随后将样品置于4 ℃、避光环境中反应24 h。最后得到氧化的肌浆蛋白复合物。
1.3.3 肌浆蛋白羰基含量的测定
参考WANG等[16]的方法。取0.4 mL SP复合溶液,加入0.3 mL HCl溶液(2 mol/L,含有2 g/L DTNB),标记为测定组;同时设置对照组,取0.4 mL SP复合溶液,加入0.3 mL的2 mol/L HCl溶液。涡旋混匀,将测定组和对照组组样品在37 ℃、避光条件下反应1 h(10 min 振荡1次),加入0.4 mL 40 g/L的三氯乙酸静置5 min。接着离心(12 000 r/min、4 ℃、15 min),弃上清液,留沉淀。加入0.75 mL V(乙醇)∶V(乙酸乙酯)=1∶1,混匀洗涤沉淀,接着离心(12 000 r/min、4 ℃、10 min),弃上清液,留沉淀,重复洗涤3次,以除去残留的DNPH。加入1 mL的磷酸盐缓冲液(20 mmol/L、pH 6.5,含有6 mol/L盐酸胍溶解沉淀。涡旋混匀,37 ℃温育15 min,待沉淀全部溶解,离心(12 000 r/min、4 ℃、15 min),取上清液于370 nm波长处测定吸光度,用摩尔消光系数22 000 L·cm/mol来计算蛋白质羰基含量。
1.3.4 肌浆蛋白总巯基含量的测定
参考ELLMAN[17]的方法,分别取两份0.2 mL SP复合溶液,加入0.75 mL的磷酸盐缓冲液(50 mmol/L,pH 7.0)。在测定管中加入50 μL 0.1% DTNB,对照管中加入50 μL水,混匀后室温避光放置10 min,在412 nm波长处测定吸光度。通过测定还原性谷胱甘肽(glutathione,GSH)标准品含量,得到标准曲线,进而计算SP中总巯基含量。
1.3.5 SDS-PAGE
将SP复合溶液用磷酸盐缓冲液(20 mmol/L、pH 6.8)稀释至4 mg/mL。分别用含有质量分数5% β-巯基乙醇(β-mercaptoethanol,β-ME)和不含有β-ME的电泳上样液与稀释后的蛋白质溶液混匀,于100 ℃水浴5 min,冷却至室温备用。
SDS-PAGE参考MARCOS等[18]的方法,稍作修改。使用质量分数10%的分离胶和5%的浓缩胶,将8 μg蛋白质加入浓缩胶上样孔,在70 V电压下电泳30 min,然后120 V电压下电泳90 min。电泳结束后,凝胶用染色液(内含10%冰醋酸、10%甲醇和0.1%的考马斯亮蓝R-250)染色1 h,并用V(甲醇)∶V(醋酸)=2∶3,复合脱色液进行脱色12 h。
1.3.6 紫外吸收光谱测定
参照MA等[19]的方法进行测定。将SP复合溶液用磷酸盐缓冲液(20 mmol/L、pH 6.8)稀释至0.25 mg/mL。滤纸过滤后,用紫外-可见分光光度计扫描样品在200~400 nm处的紫外吸收光谱。
1.3.7 内源性荧光光谱测定
参考JIANG等[20]的方法,将SP复合溶液用磷酸盐缓冲液(20 mmol/L、pH 6.8)稀释至0.25 mg/mL,用荧光分光光度计在25 ℃、激发波长为280 nm条件下,扫描300~400 nm处的荧光强度光谱。
1.3.8 FTIR测定肌浆蛋白中蛋白质二级结构
参考KOBAYASHI等[21]方法分析SP中蛋白质二级结构的变化。将1.3.2节中的SP复合溶液真空冷冻干燥,称取1 mg经冻干处理后的SP粉末,加入100 mg无水KBr,用玛瑙研钵充分研磨,倒入模具放置在压片机中制成压片。送入FTIR仪进行检测鉴定,用纯KBr做扫描背景,扫描范围4 000~450 cm-1。酰胺Ⅰ带光谱曲线的拟合分析用Peak Fit软件进行运算,计算各吸收峰面积占比,观察SP中二级结构的变化。
1.3.9 蛋白质表面疏水性测定
参照JIANG等[22]的方法测定,将0.2 mL溴酚蓝溶液(1 mg/mL)与1 mL的SP复合溶液混合;同时设置对照组,0.2 mL的溴酚蓝溶液与1 mL磷酸盐缓冲液(20 mmol/L、pH 6.8)混合。将样品混匀后,在室温条件下反应30 min,离心(5 000 r/min、4 ℃、15 min),收集上清液,弃沉淀。用磷酸盐缓冲液与上清液按照9∶1(体积比)比例稀释,测定溶液在595 nm波长处的吸光度。以溴酚蓝结合量(μg)表示SP表面疏水性,按公式(1)计算:
溴酚蓝结合量![]()
(1)
式中:ODcontrol,对照组在595 nm波长处的吸光度;ODsample,样品在595 nm波长处的吸光度。
1.3.10 溶解度测定
根据WANG等[23]的方法稍作修改。取1.5 mL SP复合溶液。在4 ℃条件下离心(5 000 r/min、15 min)。蛋白溶解度根据离心后上清液蛋白质量浓度与离心前蛋白质量浓度的比值来表示,按公式(2)计算:
溶解度![]()
(2)
1.3.11 浊度测定
参考ZHANG等[24]的方法测定,取不同浓度OA氧化的SP溶液,以600 nm处蛋白质溶液的吸光度表示SP复合物的浊度。
1.4 统计分析
每组试验独立重复3次,实验数据釆用 Origin 2019b 进行处理,计算平均值和相对标准差。采用SPSS 25.0进行统计分析,采用Tukey HSD和单因素方差分析来确定样本间的差异。如果P<0.05,则被认为具有显著性差异。
2 结果与分析
2.1 OA对SP羰基含量的影响
如图1所示,对照组(0 mmol/L)羰基含量为2.35 nmol/mg,随着OA浓度的增加,SP羰基的含量显著增加(P<0.05), SP羰基含量在OA浓度40 mmol/L时最高(6.17 nmol/mg),这一结果与LI等[25]报道的鲤鱼肌肉中肌原纤维蛋白的羰基含量变化一致。蛋白质羰基的增加是蛋白质氧化过程中发生的关键生化变化之一。羰基可以在氧化过程中通过氧化肽链断裂产生[26],还可以与脂质氧化产物反应将一些氨基酸残基转化为羰基衍生物[27]。OA是不饱和脂肪酸,拥有不饱和双键和长链碳原子,可以为氨基酸残基提供连接位点,从而促进SP中羰基化合物的形成。
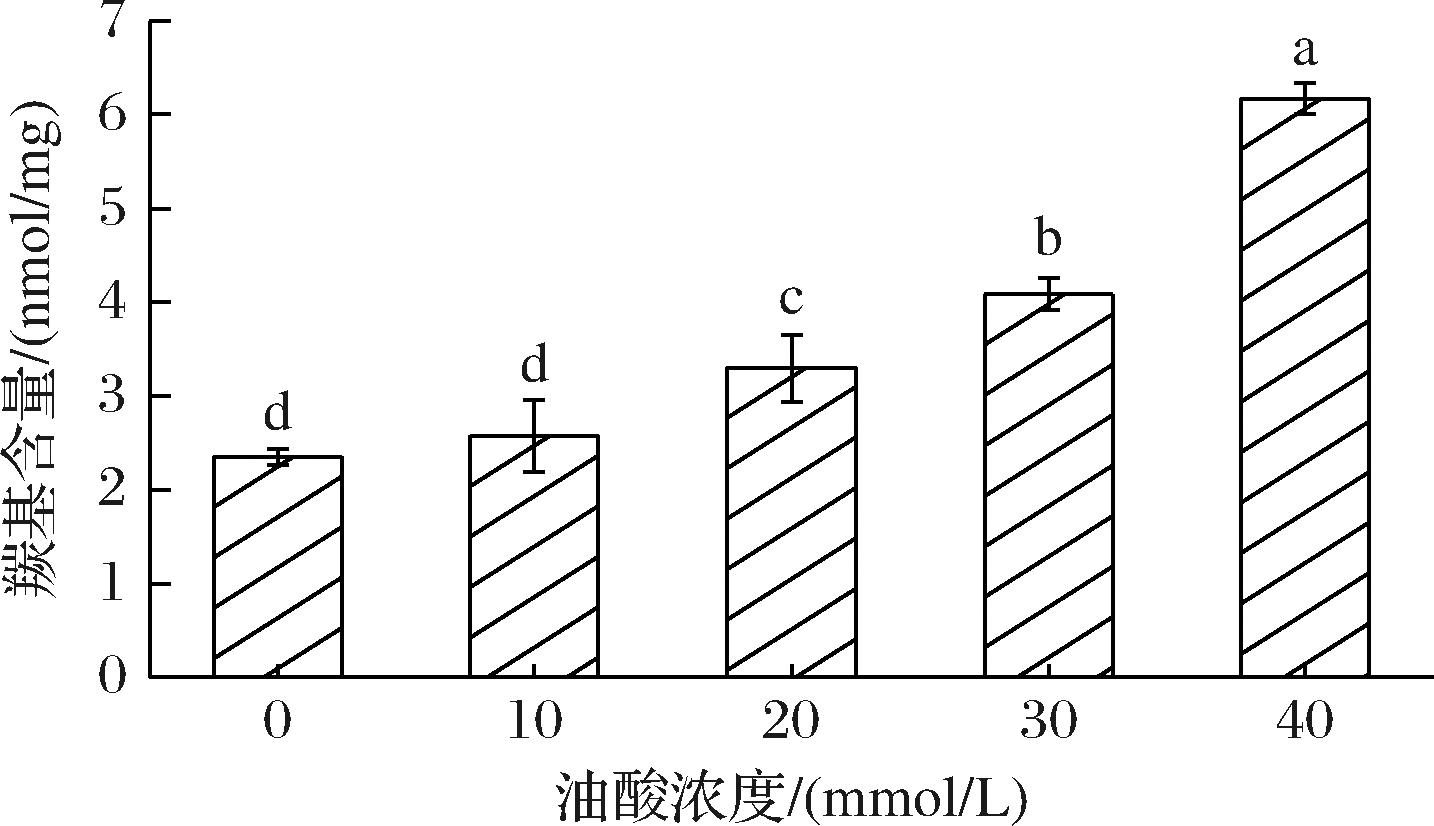
图1 不同浓度OA对鲅鱼肌浆蛋白中羰基含量的影响
Fig.1 Changes in carbonyl contents of sarcoplasmic proteins with different concentrations of OA
注:不同小写字母表示不同浓度之间具有差异显著(P<0.05)(下同)。
2.2 OA对SP总巯基含量的影响
如图2所示。对照组(0 mmol/L)中总巯基含量为59.53 nmol/mg, 随着OA浓度的增加,总巯基含量显著降低(P<0.05)。巯基作为蛋白质中非常重要的功能基团,在氧化条件下容易形成多种氧化产物[28],从而减少总巯基的含量。形成蛋白质聚合物一条重要途径,就是二硫键和非二硫键交联作用[29]。JIA等[30]发现巯基在肌原纤维蛋白中含量丰富,且易受氧化因子的攻击转化为分子内的二硫键,从而导致总巯基含量下降,与本文SP中的变化趋势一致。巯基含量的变化说明伴随着OA的加入,SP中的巯基基团被氧化,推测在共价键的交联作用下,促进蛋白聚合物的形成,加剧了鲅鱼蛋白质的氧化。
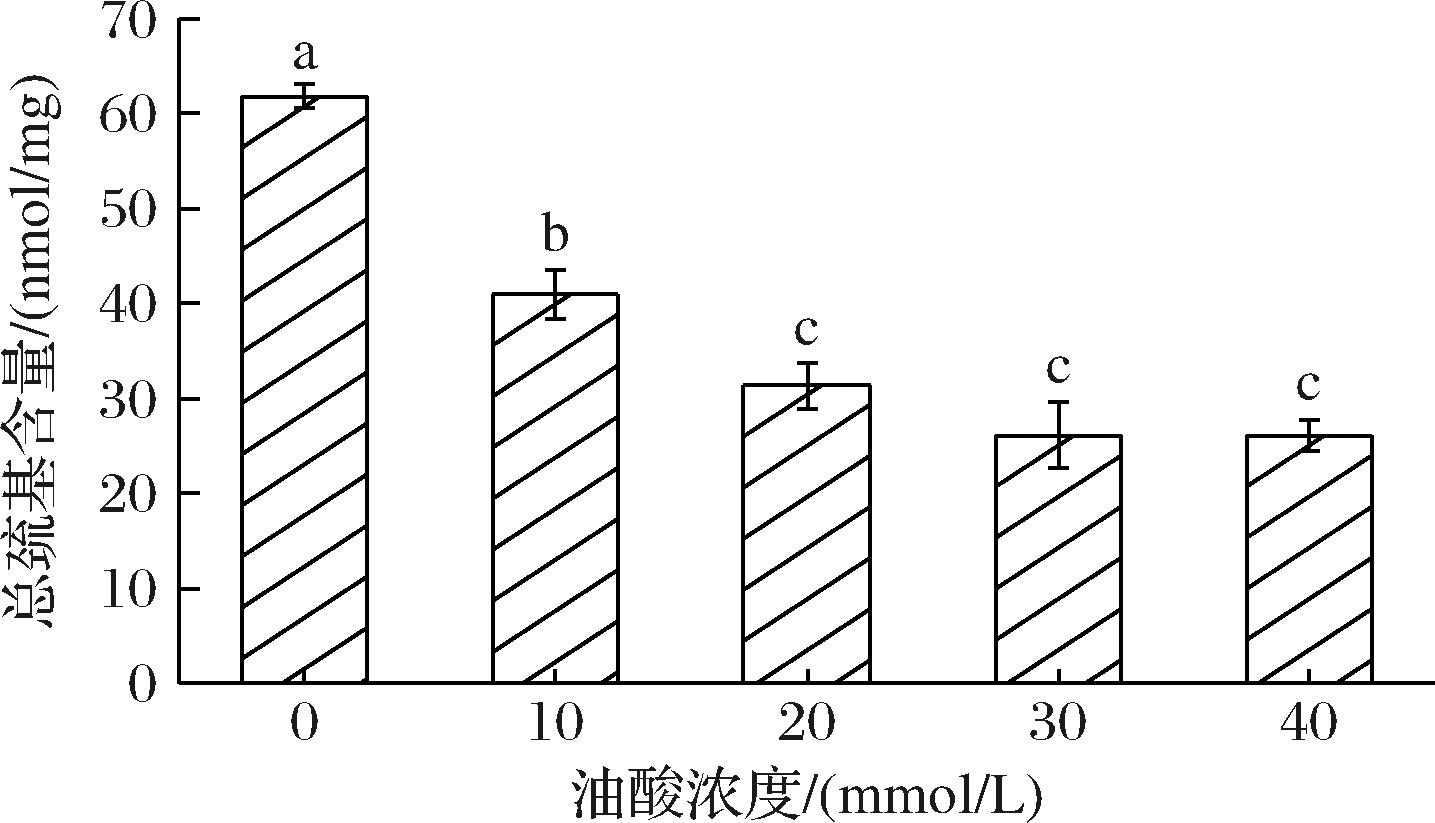
图2 不同浓度OA对鲅鱼肌浆蛋白中总巯基含量的影响
Fig.2 Changes in total sulfhydryl contents of sarcoplasmic proteins with different concentrations of OA
2.3 SDS-PAGE
如图3所示,在鲅鱼SP中含有不同的蛋白质,分子质量从17~97 kDa不等,主要包括糖原磷酸化酶b(97 kDa)、丙酮酸激酶(61 kDa)、肌酸激酶(52 kDa)、醛缩酶(41 kDa)、磷酸甘油醛脱氢酶(38 kDa)和肌红蛋白(24 kDa)等,这一结果TADPITCHAYANGKOON等[31]报道鲶鱼SP的SDS-PAGE结果一致。
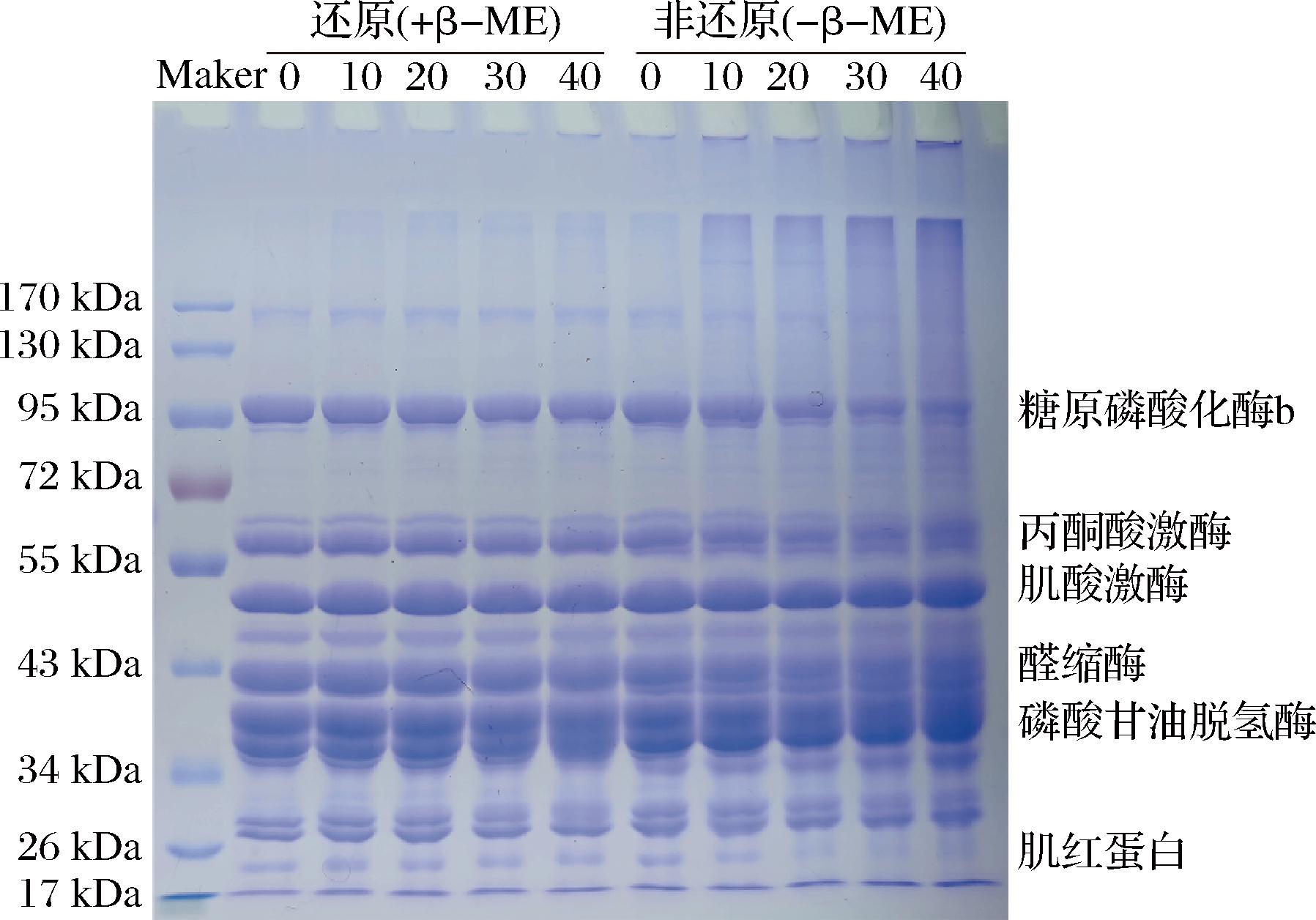
图3 不同浓度OA对鲅鱼肌浆蛋白在还原(+ β-ME)和非还原(- β-ME)条件下的SDS-PAGE图谱
Fig.3 SDS-PAGE patterns of OA on sarcoplasmic proteins under reducing (+ β-mercaptoethanol) and non-reducing (- β-mercaptoethanol) conditions
SP是肌肉中的水溶性蛋白[32],非还原(-β-ME)条件下,在浓缩胶顶部可以观察到聚集物条带,且条带强度与OA浓度呈正相关,而果糖-6-磷酸激酶、丙酮酸激酶、醛缩酶和肌红蛋白等条带强度与OA浓度呈负相关,OA浓度越高,条带颜色越浅。在还原(+ β-ME)条件下,浓缩胶顶部聚集物条带消失,未观察到非还原条件下条带减弱的现象。结果表明,鲅鱼SP中受到OA氧化修饰的影响,引起蛋白聚合物的形成,氧化过程中的蛋白质聚集可以通过二硫化物交联(与图2中巯基含量减少一致)或希夫碱加合物发生,或者通过不同蛋白质分子中碳原子中心自由基的相互作用形成C—C共价键[33],从而改变蛋白质的网络结构。
2.4 OA对SP紫外吸收光谱的影响
紫外可见吸收光谱可用于观察脂质-蛋白质复合物体系的结构变化和相互作用。如图4所示,鲅鱼SP的最大吸收波长在280 nm附近,表示蛋白质分子中存在色氨酸(Trp)、酪氨酸(Tyr)或苯丙氨酸(Phe)等芳香族氨基酸残基。随着OA浓度的增加,吸收峰强度也随之上升,说明OA诱导的氧化会引起SP构象的改变,鲅鱼SP的肽链与OA发生相互作用而展开。这与RABBANI等[34]研究结果一致,证实吸收峰强度的上升可以反应蛋白质三级结构的改变。ZHENG等[35]在用高浓度H2O2处理后河豚肌肉的肌原纤维蛋白中也出现了类似的上升趋势,推测是由于肌原纤维蛋白受到氧化,其空间结构展开,导致埋藏在蛋白质内部的芳香族氨基酸残基暴露。
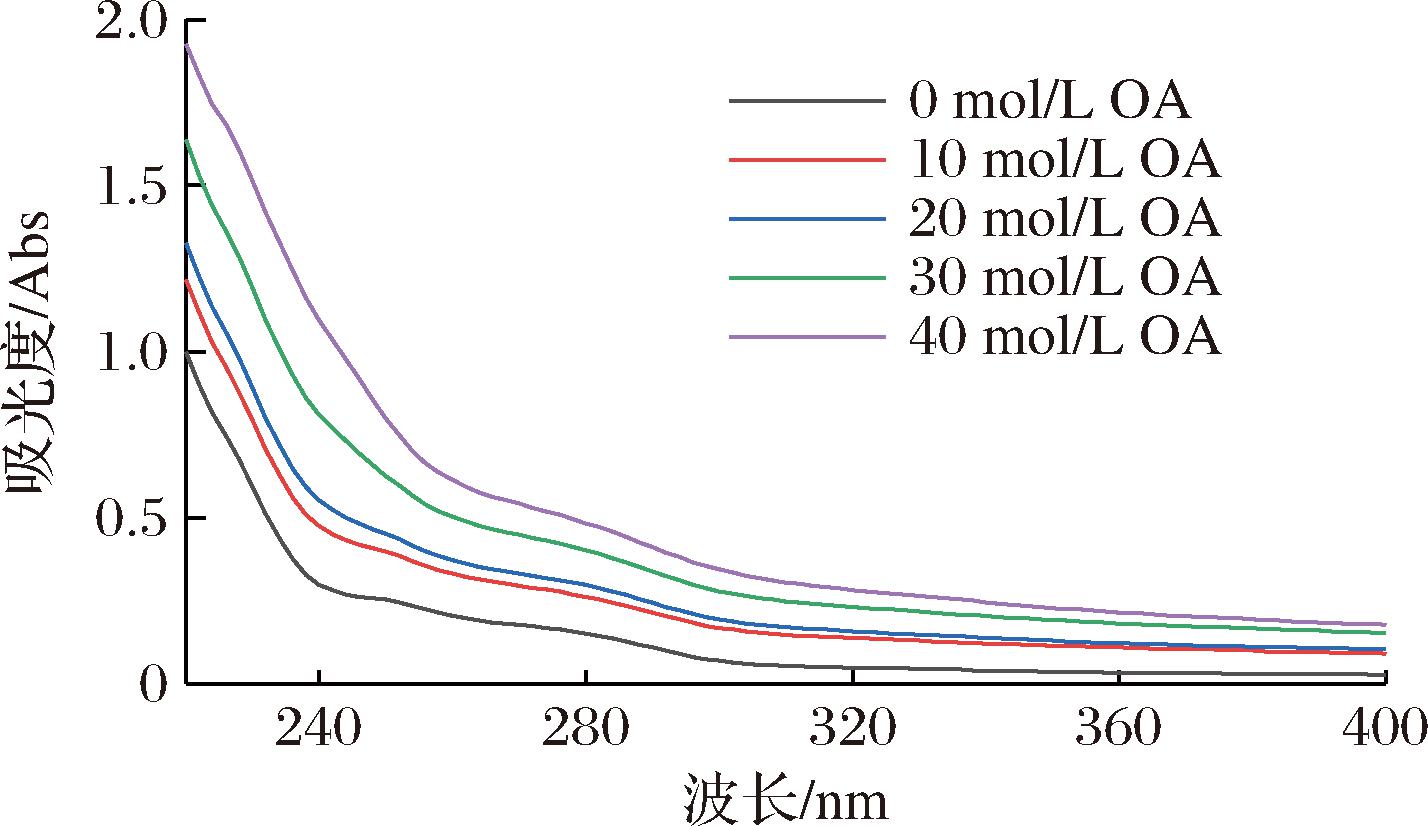
图4 不同浓度OA对鲅鱼肌浆蛋白紫外吸收光谱的影响
Fig.4 Changes in UV spectra of sarcoplasmic proteins with different concentrations of OA
2.5 OA对SP内源性荧光光谱的影响
荧光光谱是研究蛋白质与其他生物分子相互作用的重要方法[36],本质为一种探测荧光团局部环境变化的探测技术。不同浓度OA对鲅鱼肌浆蛋白荧光光谱的影响如图5所示。
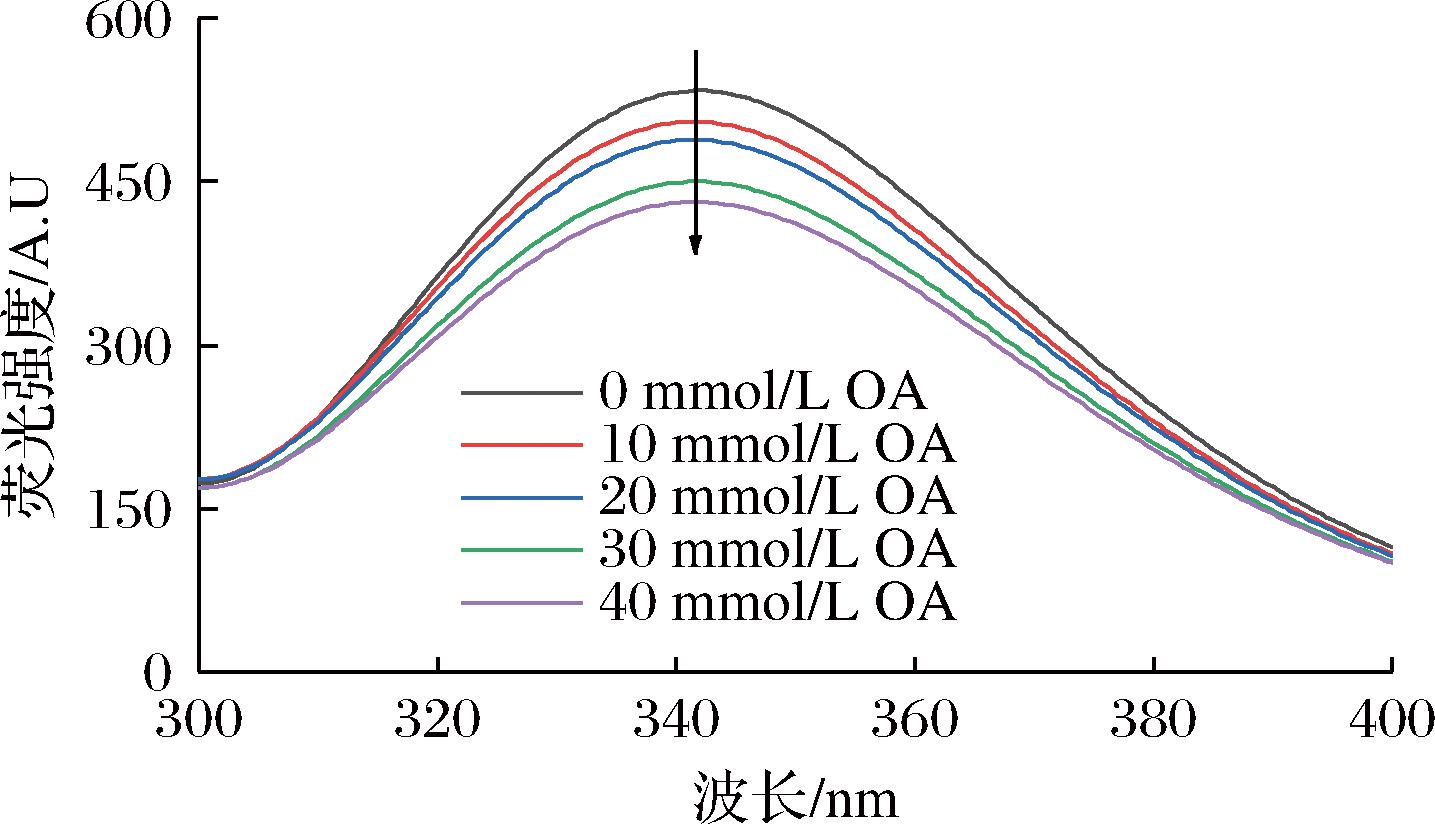
图5 不同浓度OA对鲅鱼肌浆蛋白荧光光谱的影响
Fig.5 Changes in Fluorescence spectra of sarcoplasmic proteins with different concentrations of OA
对照组SP在342 nm处具有最大荧光强度,随着OA浓度的逐渐增加,荧光强度发生明显的淬灭。一般来说,荧光淬灭是由荧光发色团与淬灭分子的各种分子相互作用诱导的荧光量子产率的降低[37]。发色氨基酸中,色氨酸在蛋白质氧化体系里最为敏感,更容易受到氧化产物的诱导。此外,自由基的氧化也会导致色氨酸残基的淬灭,脂肪酸氧化的氢过氧化物,如羟自由基(·OH)、过氧化氢(H2O2·)和脂质过氧自由基(ROO·),通过夺取色氨酸中氢原子产生蛋白质自由基[38],次级氧化产物(醛、酮、酸等),在酸性条件下可以与色氨酸残基反应。LI等[39]认为在氧化过程中色氨酸残基被蛋白质聚集物埋藏,色氨酸残基被迫转移到蛋白质内部的非极性微环境中,使得蛋白质最大荧光强度减弱。
2.6 OA对SP蛋白质二级结构的影响
由图6可知,鲅鱼SP在傅里叶红外光谱上具有多个特征吸收峰,红外光谱中吸收峰的出现可以反映出被测物质的分子结构特点,常用于确定物质的组成及官能团,吸收谱带的强度可以反映与之相关的基团数量。通过测定酰胺Ⅰ带(1 600~1 700 cm-1)和酰胺Ⅱ带(1 500~1 600 cm-1)来分析FTIR光谱中二级结构变化。与酰胺Ⅰ带相关的吸收峰主要来自C![]() O的伸缩振动,与酰胺Ⅱ带相关的吸收峰主要来自N—H弯曲振动。尽管酰胺I和酰胺II带都与蛋白质的二级结构有关,但酰胺II带并不能很好的用来预测蛋白质二级结构变化[40]。从能量的角度来看,蛋白质始终处于最小能量状态,以便在环境中保持相对稳定,当环境发生变化时,蛋白质就会发生折叠和展开并导致构象变化,以达到最低能量[41],维持相对稳定的状态。
O的伸缩振动,与酰胺Ⅱ带相关的吸收峰主要来自N—H弯曲振动。尽管酰胺I和酰胺II带都与蛋白质的二级结构有关,但酰胺II带并不能很好的用来预测蛋白质二级结构变化[40]。从能量的角度来看,蛋白质始终处于最小能量状态,以便在环境中保持相对稳定,当环境发生变化时,蛋白质就会发生折叠和展开并导致构象变化,以达到最低能量[41],维持相对稳定的状态。
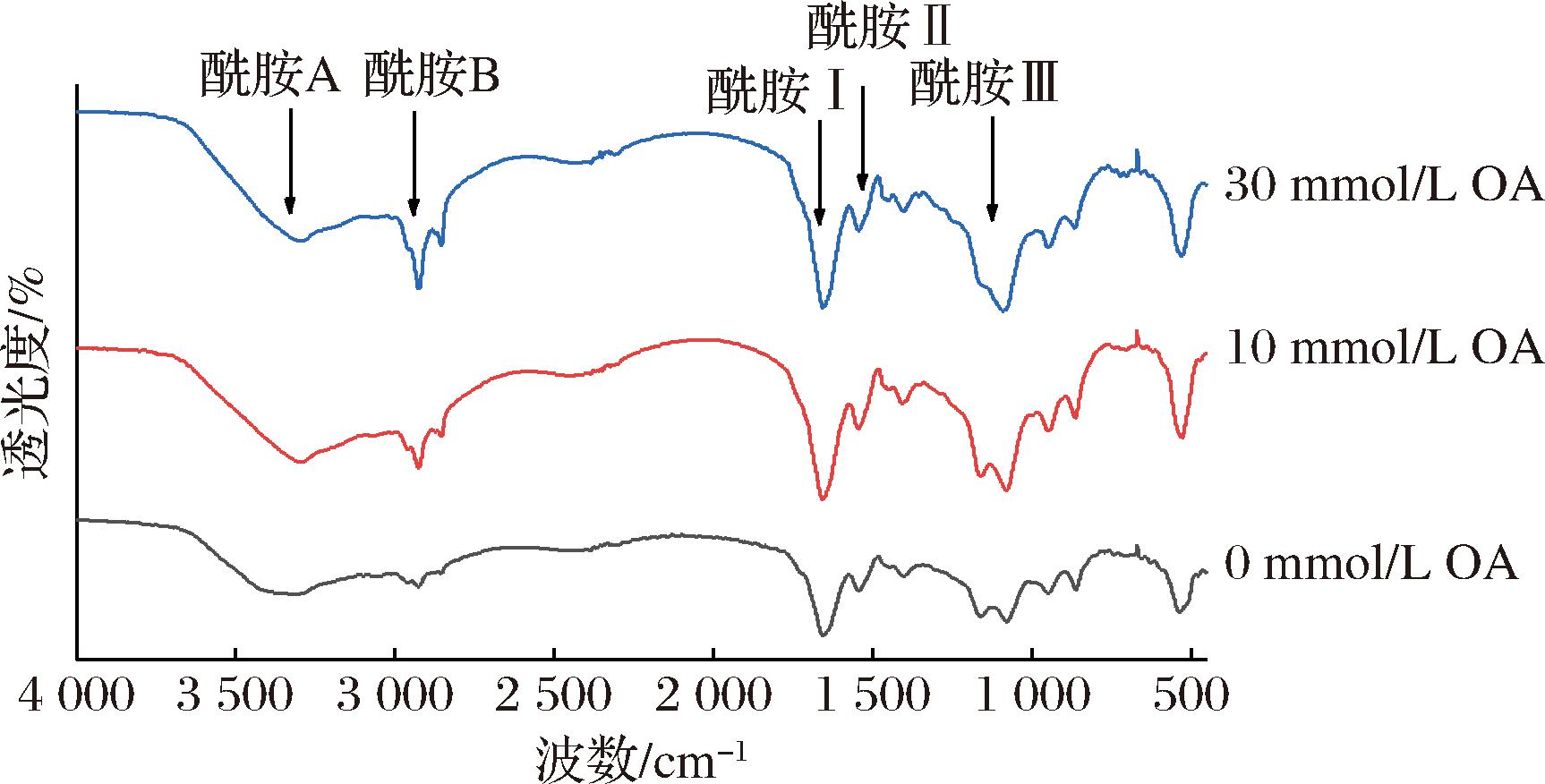
图6 鲅鱼肌浆蛋白的FTIR谱图
Fig.6 FTIR spectra of sarcoplasmic proteins
对酰胺Ⅰ带的特征吸收峰进行线性拟合分析。在基线校正和高斯平滑后,通过去卷积得到蛋白质二级结构的4个组分(α-螺旋、β-折叠、β-转角和无规则卷曲)。由表1所示,为了量化二级结构的变化,结果以相应面积占总酰胺I带总面积的相对含量来表示。β-转角和β-折叠是鲅鱼SP二级结构中的主要结构,其次是α-螺旋及无规则卷曲。随着OA浓度的增加,β-折叠相对含量随之降低(P<0.05)、β-转角相对含量降低,α-螺旋相对含量增加,无规则卷曲相对含量持续升高。蛋白质的二级结构相对含量变化表明OA通过与SP相互作用可能促进了蛋白质分子中去折叠,蛋白质中有序的空间结构转向混乱的无规则结构。
表1 OA对鲅鱼肌浆蛋白二级结构相对含量的影响
Table 1 Effect of sarcoplasmic proteins on secondary structure relative contents of OA

波数/cm-1OA浓度/(mmol/L)01030α-螺旋/%1 650~1 660 15.50±0.41c16.56±0.40b17.50±0.13aβ-折叠/%1 600~1 64031.48±0.46a30.62±0.05b30.47±0.26bβ-转角/%1 660~1 695 35.59±0.18a34.23±0.55a32.66±2.54a无规则卷曲/%1 640~1 65017.43±0.37a18.59±0.90a19.39±2.30a
2.7 OA对SP表面疏水性的影响
如图7所示,OA对鲅鱼SP表面疏水性的影响非常显著,与对照组相比,OA浓度升高,SP表面疏水性明显增强(P<0.05)。这与SHEN等[42]在低温真空加热条件下脂质氧化产物与鲟鱼肌原纤维蛋白的相互作用及结合机理中的研究结果一致。蛋白质表面疏水性反映了蛋白质的构象变化并表征了表面疏水性位点的暴露,溴酚蓝可以通过疏水作用与蛋白质发生结合,结合总量用于估算蛋白质疏水性[43]。氧化导致蛋白质的二级和三级结构的变化与表面疏水性的增加密切相关,空间结构的改变使非极性氨基酸处于疏水环境中而导致蛋白质分子的展开和重排[44],从而使得鲅鱼SP表面疏水性增大。
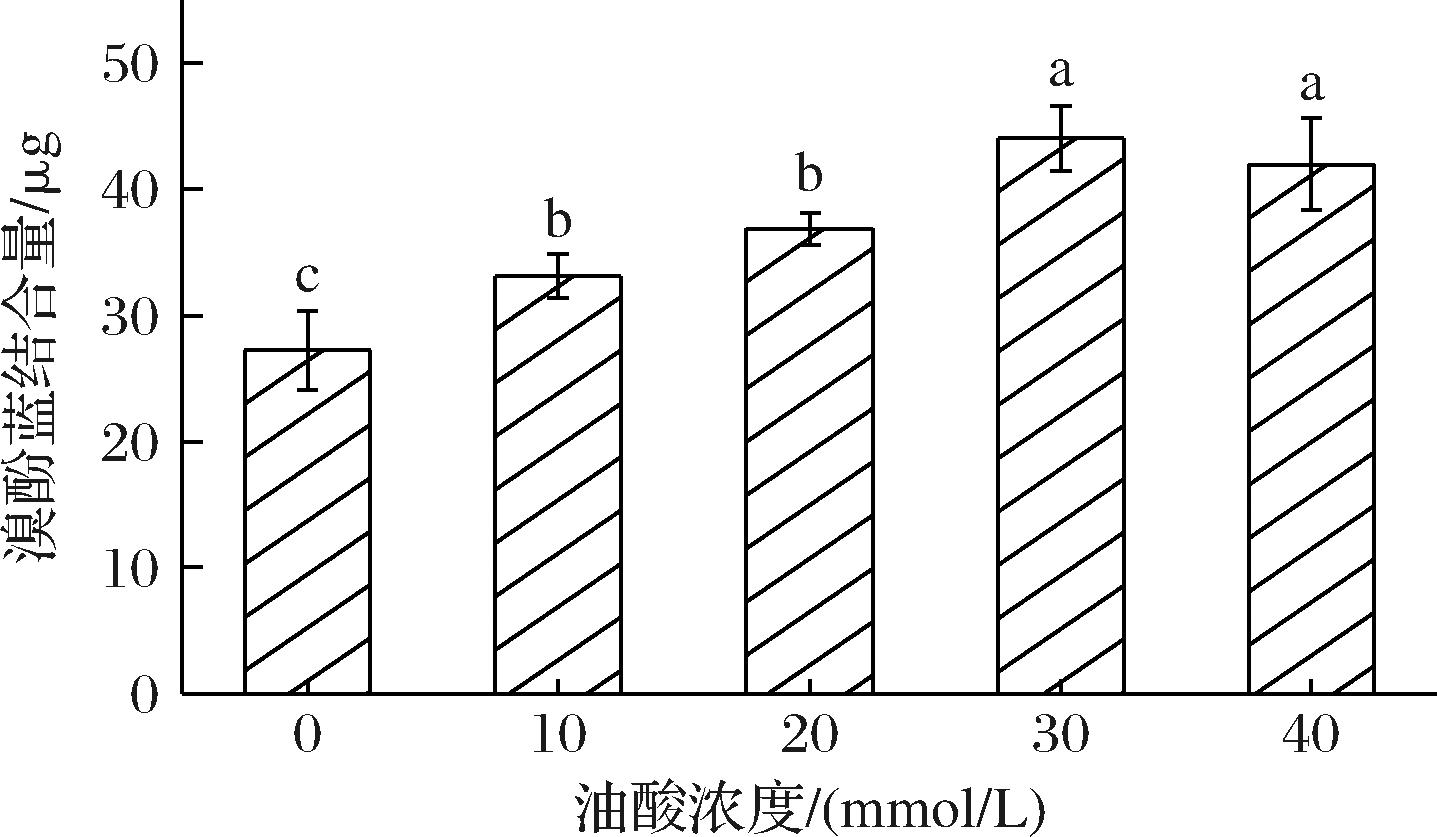
图7 不同浓度OA对鲅鱼肌浆蛋白表面疏水性的影响
Fig.7 Changes in surface hydrophobicity of sarcoplasmic proteins with different concentrations of OA
2.8 OA对SP溶解度的影响
如图8所示,不同浓度OA处理对鲅鱼SP溶解度变化具有显著性差异,当OA浓度为0~20 mmol/L时,SP溶解度随OA浓度增大显著减小(P<0.05),而当OA浓度为30~40 mmol/L时,SP溶解度变化趋于稳定(P>0.05)。蛋白质溶解度是蛋白质变性的一个重要指标。疏水基团、氢键、二硫键和离子相互作用的形成都会影响导致蛋白质的溶解度[45]。MOHAN等[46]对鲮鱼蛋白在冻藏过程中功能特性的研究中提出,SP溶解度下降与蛋白聚合物的形成具有密切关系。巯基含量的变化与蛋白溶解度的数据具有良好的相关性,总巯基含量的减少是由于通过巯基的氧化或二硫化物的互换形成二硫键,二硫键的形成导致了蛋白质的聚集,从而导致了蛋白质的溶解度降低[47]。此外,OA的氧化修饰促进SP表面疏水性的增大,增强了SP分子间疏水相互作用[46],在体系中形成蛋白质聚集体,也能降低鲅鱼SP溶解度。
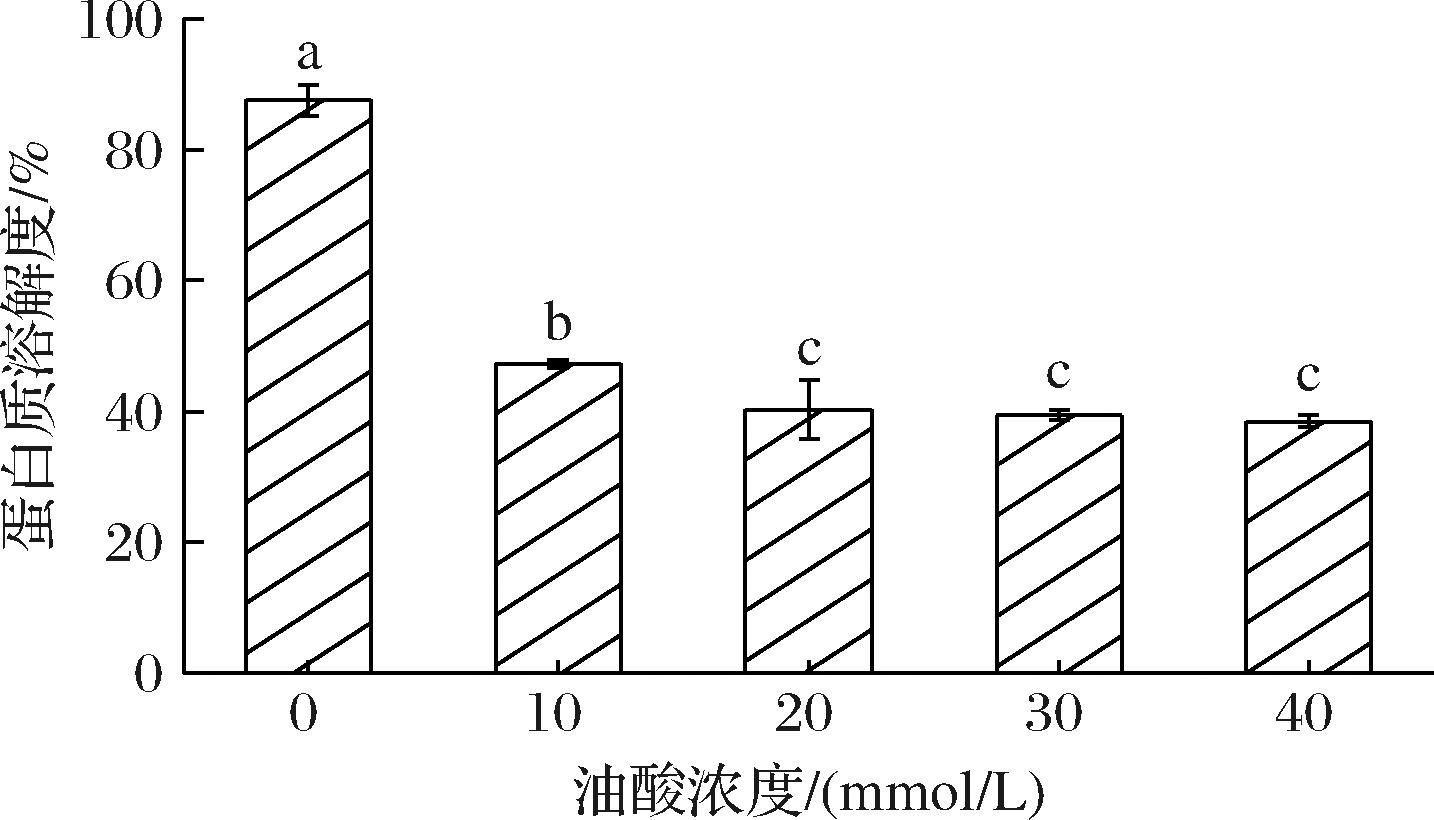
图8 不同浓度OA对鲅鱼肌浆蛋白溶解度的影响
Fig.8 Changes in solubility of sarcoplasmic proteins with different concentrations of OA
2.9 OA对SP浊度的影响
蛋白质浊度可以反应蛋白质的聚集程度。如图9所示,不同浓度OA处理对鲅鱼SP浊度变化具有显著性差异,随OA浓度升高,SP浊度也随之增加,吸光度从0.22增加到0.53(P<0.05), 这与CUI等[48]的研究结果一致。通过氧化可以破坏蛋白质空间结构,暴露疏水基团,影响蛋白质分子之间的静态平衡[49],促进蛋白质聚集。根据观察SDS-PAGE中条带变化结果可以发现,通过二硫键的共价作用,蛋白质聚合物的形成随着OA浓度的升高而逐渐显著。表明脂肪酸可以诱导鲅鱼SP氧化,促进蛋白质聚合物的形成,降低溶解度,浊度增加,脂肪酸的诱导是SP聚合物形成的主要原因。
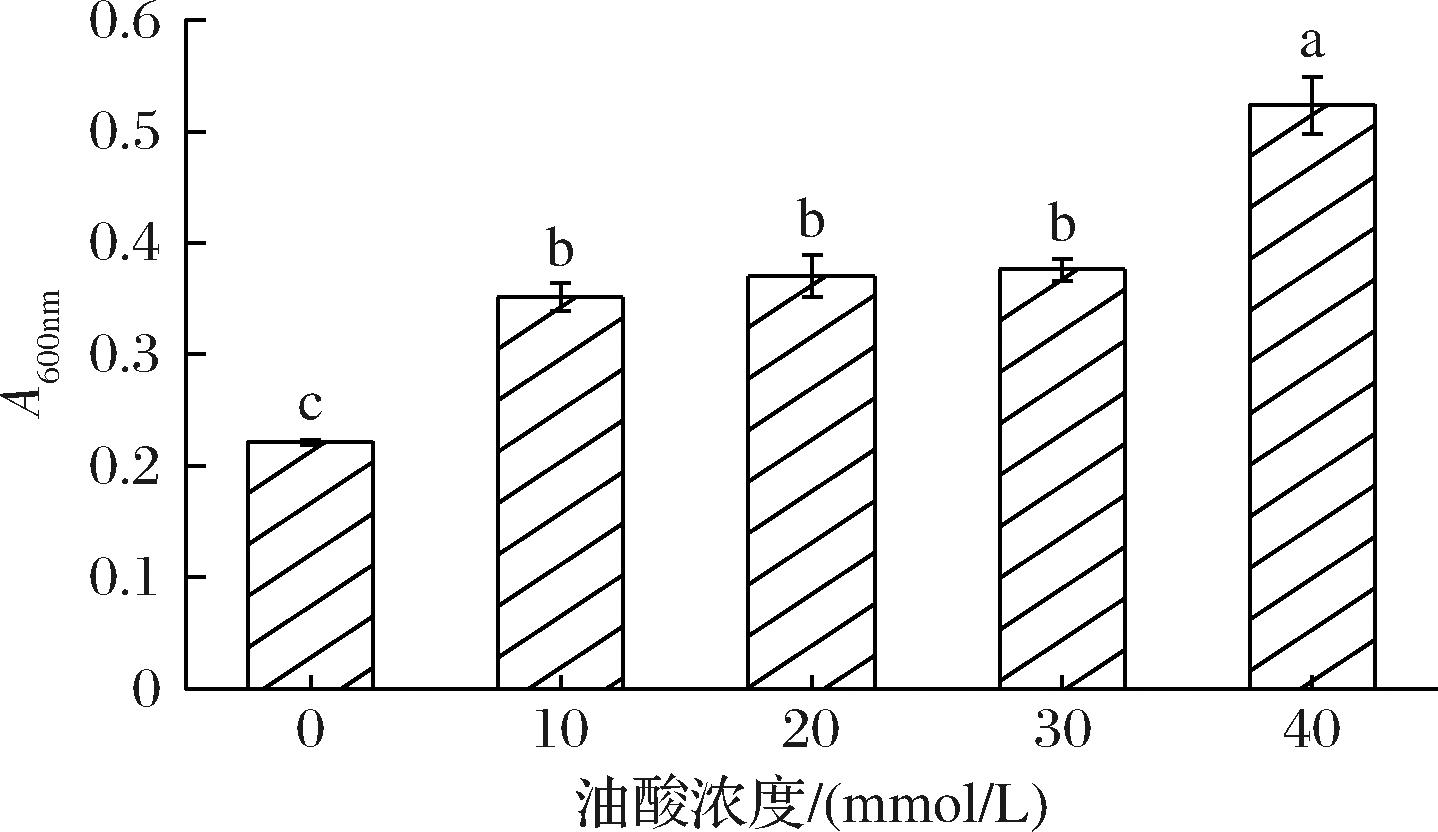
图9 不同浓度OA对鲅鱼肌浆蛋白浊度的影响
Fig.9 Changes in turbidity of sarcoplasmic proteins with different concentrations of OA
3 结论
本文以鲅鱼SP为研究对象,探究不饱和脂肪酸氧化对蛋白质氧化的诱导作用。作为不饱和脂肪酸中的重要组成部分,OA可以触发肌浆蛋白的氧化共价修饰,通过改变SP的结构和形成聚合物导致蛋白质的品质下降。研究发现,OA的添加可以引起SP结构基团的改变,产生羰基的同时发生去折叠和疏水基团的暴露,导致蛋白质二级结构的变化。此外,蛋白质间二硫键的形成,进一步引起蛋白质三级结构的改变,并最终形成SP聚合物,降低蛋白质的溶解度及稳定性。从蛋白质结构和化学变化可以看出,OA对鲅鱼SP具有显著的诱导氧化效果(P<0.05),氧化程度与其浓度具有很好的线性关系。OA主要通过产生活性氧自由基,诱导SP的蛋白质氧化变质,从而在鲅鱼储藏过程中引起肉质劣变。本研究结果致力于探究不饱和脂肪酸对蛋白质氧化的诱导机制,为水产品品质变化研究提供理论和技术支持。
[1] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会.中国渔业统计年鉴-2021[M].北京:中国农业出版社, 2021.Bureau of Fisheries and Fishery Administration, National Fisheries Technology Extension Center, China Society of Fisheries.China Fisheries Statistical Yearbook 2021[M].Beijing:China Agriculture Press, 2021.
[2] SHULGINA L V, DAVLETSHINA T A, PAVLOVSKY A M, et al.Composition of lipids and fatty acids in muscle tissue of chub mackerel Scomber japonicus[J].Izvestiya TINRO, 2019, 196:193-203.
[3] ZHOU C F, ZHANG L J, ZAKY A A, et al.High internal phase Pickering emulsion by Spanish mackerel proteins-procyanidins:Application for stabilizing astaxanthin and surimi[J].Food Hydrocolloids, 2022, 133:107999.
[4] TORNBERG E.Effects of heat on meat proteins-Implications on structure and quality of meat products[J].Meat Science, 2005, 70(3):493-508.
[5] SAYD T, MORZEL M, CHAMBON C, et al.Proteome analysis of the sarcoplasmic fraction of pig semimembranosus muscle:Implications on meat color development[J].Journal of Agricultural and Food Chemistry, 2006, 54(7):2732-2737.
[6] ZHANG W G, XIAO S, AHN D U.Protein oxidation:Basic principles and implications for meat quality[J].Critical Reviews in Food Science and Nutrition, 2013, 53(11):1191-1201.
[7] WANG L, ZHANG M, BHANDARI B, et al.Effects of malondialdehyde-induced protein modification on water functionality and physicochemical state of fish myofibrillar protein gel[J].Food Research International, 2016, 86:131-139.
[8] ZHOU F B, ZHAO M M, SU G W, et al.Gelation of salted myofibrillar protein under malondialdehyde-induced oxidative stress[J].Food Hydrocolloids, 2014, 40:153-162.
[9] LIU G, XIONG Y L.Oxidatively induced chemical changes and interactions of mixed myosin, β-lactoglobulin and soy 7S globulin[J].Journal of the Science of Food and Agriculture, 2000, 80(11):1601-1607.[10] WANG L, ZHANG M, FANG Z X, et al.Influence of linoleic acid-induced oxidative modification on gel properties of myofibrillar protein from silver carp (Hypophthalmichthys molitrix) muscle[J].Food Biophysics, 2016, 11(3):266-274.
[11] DUNFORD N T.Oxidative Stability of Sunflower Seed Oil[C].Sunflower:Chemistry, Production, Processing, and Utilization.Amsterdam:Elsevier 2015.
[12] ALVES J L, FIGUEIRA A S C, SOUTO M, et al.Oleic acid enhances the production of reactive oxygen species in neuronal tissue[J].Energy Reports, 2020, 6:885-890.
[13] BERASATEGI I, NAVARRO-BLASCO I, CALVO M I, et al.Healthy reduced-fat Bologna sausages enriched in ALA and DHA and stabilized with Melissa officinalis extract[J].Meat Science, 2014, 96(3):1185-1190.
[14] BOTSOGLOU E, GOVARIS A, AMBROSIADIS I, et al.Lipid and protein oxidation of α-linolenic acid-enriched pork during refrigerated storage as influenced by diet supplementation with olive leaves (Olea europea L.) or α-tocopheryl acetate[J].Meat Science, 2012, 92(4):525-532.
[15] CHEN Q, KONG B H, HAN Q, et al.The role of bacterial fermentation in the hydrolysis and oxidation of sarcoplasmic and myofibrillar proteins in Harbin dry sausages[J].Meat Science, 2016, 121:196-206.
[16] WANG Z M, HE Z F, EMARA A M, et al.Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J].Food Chemistry, 2019, 288:405-412.
[17] ELLMAN G L.Tissue sulfhydryl groups[J].Archives of Biochemistry and Biophysics, 1959, 82(1):70-77.
[18] MARCOS B, KERRY J P, MULLEN A M.High pressure induced changes on sarcoplasmic protein fraction and quality indicators[J].Meat Science, 2010, 85(1):115-120.
[19] MA Y Y, LI X X, SUN P, et al.Effect of ultrasonic thawing on gel properties of tuna myofibrillar proteins[J].Journal of Food Processing and Preservation, 2022, 46(2):e16268.
[20] JIANG W X, HE Y F, XIONG S B, et al.Effect of mild ozone oxidation on structural changes of silver carp (Hypophthalmichthys molitrix) myosin[J].Food and Bioprocess Technology, 2017, 10(2):370-378.
[21] KOBAYASHI Y, MAYER S G, PARK J W.FT-IR and Raman spectroscopies determine structural changes of tilapia fish protein isolate and surimi under different comminution conditions[J].Food Chemistry, 2017, 226:156-164.
[22] JIANG Y, LI D H, TU J C, et al.Mechanisms of change in gel water-holding capacity of myofibrillar proteins affected by lipid oxidation:The role of protein unfolding and cross-linking[J].Food Chemistry, 2021, 344:128587.
[23] WANG S X, ZHANG Y M, CHEN L, et al.Dose-dependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J].Food Chemistry, 2018, 243:50-57.
[24] ZHANG D, LI H J, WANG Z F, et al.Effects of in vitro oxidation on myofibrillar protein charge, aggregation, and structural characteristics[J].Food Chemistry, 2020, 332:127396.
[25] LI Y Q, KONG B H, XIA X F, et al.Structural changes of the myofibrillar proteins in common carp (Cyprinus carpio) muscle exposed to a hydroxyl radical-generating system[J].Process Biochemistry, 2013, 48(5-6):863-870.
[26] SAUERLAND M, MERTES R, MOROZZI C, et al.Kinetic assessment of Michael addition reactions of alpha, beta-unsaturated carbonyl compounds to amino acid and protein thiols[J].Free Radical Biology and Medicine, 2021, 169:1-11.
[27] DAVIES M J.Protein oxidation and peroxidation[J].The Biochemical Journal, 2016, 473(7):805-825.
[28] ÖZALP B Ö, SOYER A.Effect of plant extracts on lipid and protein oxidation of mackerel (Scomber scombrus) mince during frozen storage[J].Journal of Food Science and Technology, 2018, 55(1):120-127.
[29] NYAISABA B M, HATAB S, LIU X X, et al.Physicochemical changes of myofibrillar proteins of squid (Argentinus ilex) induced by hydroxyl radical generating system[J].Food Chemistry, 2019, 297:124941.
[30] JIA N, WANG L T, SHAO J H, et al.Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science, 2017, 127:45-50.
[31] TADPITCHAYANGKOON P, PARK J W, YONGSAWATDIGUL J.Conformational changes and dynamic rheological properties of fish sarcoplasmic proteins treated at various pHs[J].Food Chemistry, 2010, 121(4):1046-1052.
[32] BORCHERT L L, POWRIE W D, BRISKEY E J.A study of the sarcoplasmic proteins of porcine muscle by starch gel electrophoresis[J].Journal of Food Science, 1969, 34(2):148-152.
[33] SHI G P, ZHOU M Z, WANG L, et al.The effect of gamma and electron beam irradiation on the structural and physicochemical properties of myofibrillar protein and myosin from grass carp[J].Journal of Food Biochemistry, 2021:e13828.
[34] RABBANI G, BAIG M H, JAN A T, et al.Binding of erucic acid with human serum albumin using a spectroscopic and molecular docking study[J].International Journal of Biological Macromolecules, 2017, 105:1572-1580.
[35] ZHENG Y, ZHANG L, QIU Z H, et al.Comparison of oxidation extent, structural characteristics, and oxidation sites of myofibrillar protein affected by hydroxyl radicals and lipid-oxidizing system[J].Food Chemistry, 2022, 396:133710.
[36] LV L T, LIN H, LI Z X, et al.Changes of structure and IgE binding capacity of shrimp (Metapenaeus ensis) tropomyosin followed by acrolein treatment[J].Food &Function, 2017, 8(3):1028-1036.
[37] LEI X Q, QIN Z W, YE B, et al.Interaction between secondary lipid oxidation products and hemoglobin with multi-spectroscopic techniques and docking studies[J].Food Chemistry, 2022, 394:133497.
[38] STAPORNKUL N, PRYTKOVA T, WERE L.Effect of green tea on interaction of lipid oxidation products with sarcoplasmic and myofibrillar protein homogenates extracted from bovine top round muscle[J].Food Research International, 2016, 89:1038-1045.
[39] LI F, WU X J, WU W.Effects of malondialdehyde-induced protein oxidation on the structural characteristics of rice protein[J].International Journal of Food Science &Technology, 2020, 55(2):760-768.
[40] XI C Y, SUN Z W, CHEN X, et al.Characterization of coacervation behavior between whey protein isolate and propylene glycol alginate:A morphology, spectroscopy, and thermodynamics study[J].Food Chemistry:X, 2022, 15:100402.
[41] WANG P, XU L, NIKOO M, et al.Effect of frozen storage on the conformational, thermal and microscopic properties of gluten:Comparative studies on gluten-, glutenin- and gliadin-rich fractions[J].Food Hydrocolloids, 2014, 35:238-246.
[42] SHEN S K, BU Q Y, YU W T, et al.Interaction and binding mechanism of lipid oxidation products to sturgeon myofibrillar protein in low temperature vacuum heating conditions:Multispectroscopic and molecular docking approaches[J].Food Chemistry:X, 2022, 15:100389.
[43] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[44] FU Q Q, LIU R, WANG H O, et al.Effects of oxidation in vitro on structures and functions of myofibrillar protein from beef muscles[J].Journal of Agricultural and Food Chemistry, 2019, 67(20):5866-5873.
[45] GAO W H, HUANG Y P, ZENG X N, et al.Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing[J].International Journal of Biological Macromolecules, 2019, 135:839-844.
[46] MOHAN M, RAMACHANDRAN D, SANKAR T V.Functional properties of Rohu (Labeo rohita) proteins during iced storage[J].Food Research International, 2006, 39(8):847-854.
[47] SABEENA FARVIN K H, GREJSEN H D, JACOBSEN C.Potato peel extract as a natural antioxidant in chilled storage of minced horse mackerel (Trachurus trachurus):Effect on lipid and protein oxidation[J].Food Chemistry, 2012, 131(3):843-851.
[48] CUI X H, XIONG Y L, KONG B H, et al.Hydroxyl radical-stressed whey protein isolate:Chemical and structural properties[J].Food and Bioprocess Technology, 2012, 5(6):2454-2461.
[49] DOM NGUEZ R, PATEIRO M, MUNEKATA P E S, et al.Protein oxidation in muscle foods:A comprehensive review[J].Antioxidants, 2021, 11(1):60.
NGUEZ R, PATEIRO M, MUNEKATA P E S, et al.Protein oxidation in muscle foods:A comprehensive review[J].Antioxidants, 2021, 11(1):60.