胶原蛋白是一种高分子质量的纤维蛋白,在整个人体不同结缔组织的细胞外基质中大量存在。它与弹性蛋白和角蛋白一起形成细胞外骨架,使组织和器官具有抗拉强度和灵活性。同时在生物体内参与多种生命活动,包括组织的形成与成熟、细胞间的信息传递、伤口愈合、组织修复与器官衰老等[1]。
胶原大部分来源于哺乳动物,例如:牛或猪的皮、肌腱、骨骼等。但考虑到疯牛病、口蹄疫和伦理宗教等因素的存在,一些发达国家正禁止从哺乳动物皮中提取胶原蛋白,并积极寻找安全的胶原蛋白来源。鱼类胶原蛋白大多来源于鱼皮、鱼骨和鱼鳞,与牛或猪胶原蛋白相比,生物利用率更高,并且由于其低分子质量和小颗粒尺寸,具有更高的吸收能力,血液循环更迅速。此外,鱼类胶原蛋白在氨基酸组成和生物相容性方面与传统的牛和猪胶原蛋白相似[2]。但目前淡水鱼的加工仅局限于对鱼肉的利用,对鱼鳞等下脚料的利用较少。大部分都被废弃,这不仅严重污染环境,而且造成资源的极大浪费[3]。因此,对鱼鳞胶原蛋白进行提取不仅可以减少环境污染,增加企业经济效益,对提高我国水产加工技术水平,促进渔业经济快速发展具有重要意义[4]。
在内蒙古地区黄河流域有着丰富资源的鱼类种群,黄河鲤鱼具有适应性强、食性广、繁殖率高、抗逆性强、味道鲜美等优点。黄河鲤鱼以金鳞赤尾、体形梭长、肉质鲜嫩、营养丰富而驰名中外,是内蒙古自治区和我国宝贵的鱼类资源[5]。内蒙古黄河河段的水温温差较大、温度较低,有文献研究表明,低温环境下的生物体内有更高的胶原蛋白含量[6],而对内蒙古河段黄河鲤鱼鳞片胶原的研究很少,因此仍有必要对其提取工艺和特性进行研究。
本研究的目的是探索酸联合酶法从鱼鳞中提取胶原工艺,考察了提取参数(如酸浓度、加酶量、提取时间等)对胶原提取率的影响,并对制得的胶原样品结构进行了表征,为其进一步的开发利用奠定基础。
1 材料与方法
1.1 实验材料
原材料:内蒙古黄河河段鲤鱼鱼鳞,由内蒙古包头市小白河附近渔场购买鲜活鱼体获得。
主要试剂:NaCl2、Na2CO3、柠檬酸、冰乙酸,分析纯,天津市鑫铂特化工有限公司;胃蛋白酶(猪源)、牛胶原I,上海阿拉丁生化科技股份有限公司。
主要设备:3-18KS高速冷冻离心机,Sigma-Aldrich公司;J-810型圆二色光谱(circular dichroism,CD)仪,JASCO公司;Nicolet Is5型傅里叶红外光谱(Fourier transform infrared spectrometer,FT-IR)仪,美国Thermo Fisher公司;Apero 2S型扫描电子显微镜(scanning electron microscope,SEM),Thermo Scientific公司;200-F3型差示扫描量热仪(differential scanning calorimeter, DSC),德国耐驰仪器制造有限公司;FD-1A-50+冷冻干燥机,博医康仪器有限公司;KQ-500VDB双频数控超声清洗仪,昆山市超声仪器有限公司;DHG-9240A电热恒温鼓风干燥箱、HWS-28电热恒温水浴锅,上海一恒科学仪器有限公司;HJ-6A数显恒温磁力搅拌器,金坛市医疗仪器厂。
1.2 实验方法
1.2.1 胶原提取步骤
由于新鲜的鱼鳞中有大量的杂质,包括油脂、杂蛋白、血液和黏液等,且鱼鳞中含有大量矿物质,如碳酸盐、羟基磷灰石等,其中羟基磷灰石占比最高,且与胶原黏附紧密,难以分离,这极大的影响了胶原提取率[7],因此,在提取实验前对鱼鳞进行预处理是必要的。参考李泽民等[8]的提取方法,在预实验的基础上,根据实际情况进行提取实验的改进和实施。整个提取过程分为材料预处理、鱼鳞脱钙处理、酶提取处理、胶原分离提纯和胶原保存共5个主要步骤,在温和的提取条件下,得到鱼鳞中的胶原。
1.2.1.1 材料预处理
用大量的自来水反复冲洗收集到的鱼鳞,洗去血液和黏液,直至洗出的水呈清澈状。然后加入NaCl2溶液中清洗两遍,接着加入Na2CO3溶液洗涤,直至洗出液体无明显浑浊,将洗涤过的鱼鳞放入干燥箱中,设置温度30 ℃,干燥48 h,即可得到干鱼鳞。
1.2.1.2 脱钙处理
本实验参考郝星海等[9]的优化鱼鳞脱钙工艺,采用超声辅助柠檬酸法进行鱼鳞的脱钙。
取10 g干鱼鳞置于烧杯中,以料液比1∶25(g∶mL)加入柠檬酸溶液,柠檬酸的质量分数为5%。使用超声辅助脱钙,设置超声功率200 W、超声频率80 kHz、超声时间80 min,以除去鱼鳞中的矿物质,使胶原易于溶出。用蒸馏水冲洗处理过的鱼鳞,直至洗出的液体呈中性。
1.2.1.3 酶提取阶段
取脱钙后的鱼鳞,以料液比1∶25(g∶mL)加入一定浓度的冰乙酸,并加入一定量的胃蛋白酶,使用磁力搅拌,提取一定时间得到酸酶处理液。
1.2.1.4 胶原分离提纯
在胃蛋白酶存在的情况下酸提取一定时间后,离心去除酸酶处理液中不能溶解的杂质,设置转速为3 500 r/min、时间为20 min。取离心后的上清液,加入同体积2 mol/L的NaCl溶液,充分搅拌后,通过离心方法得到盐析物,将盐析物置于500 Da的透析袋中进行除盐,透析3 d,每12 h换1次透析液。
1.2.1.5 胶原的保存
透析后的鱼鳞胶原呈灰白色凝胶状,将透析物置于一次性培养皿中,-18 ℃预冷过夜后,使用真空冷冻干燥机将样品冻干,得到海绵状的冻干样品。将冻干的样品存放于自封袋中,放在干燥器内保存。
1.2.2 提取工艺的优化
1.2.2.1 单因素试验设计
根据上述试验方案,选取提取时间、酶蛋白酶添加量和酸浓度3个因素进行单因素试验,分析各个因素对胶原的提取率的影响。表1为单因素试验的设计表。
表1 单因素试验设计表
Table 1 Single-factor experimental design
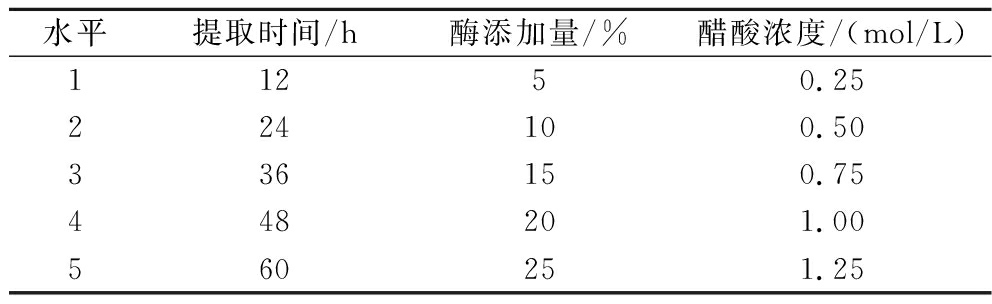
水平提取时间/h酶添加量/%醋酸浓度/(mol/L)11250.25224100.50336150.75448201.00560251.25
提取结束后,得到冻干的胶原样品,以得到的冻干样品的质量计算提取率。
1.2.2.2 考察提取时间对提取率的影响
按照表1的提取时间,醋酸与干鱼鳞15∶100(g∶mL),醋酸浓度选择0.5 mol/L,通过后续盐析、透析、冷冻干燥等操作得到鱼鳞胶原样品。
1.2.2.3 考察酶添加量对提取率的影响
按照表1的酶添加量,醋酸浓度选择0.5 mol/L,提取时间确定为48 h,通过后续盐析、透析、冷冻干燥等操作得到鱼鳞胶原样品。
1.2.2.4 考察醋酸浓度对提取率的影响
按照表1的醋酸浓度,酶添加量选择干鱼鳞质量的15%(质量分数),提取时间确定为48 h,通过后续盐析、透析、冷冻干燥等操作得到鱼鳞胶原样品。
1.2.2.5 正交试验设计
在单因素试验的基础上,以醋酸浓度、酶添加量、提取时间为影响因素,各取3个水平,设计正交试验,以得到样品的质量为指标,确定鱼鳞胶原的最佳提取工艺。试验设计见表2。
表2 工艺优化正交试验设计表
Table 2 Process optimization orthogonal experimental design table
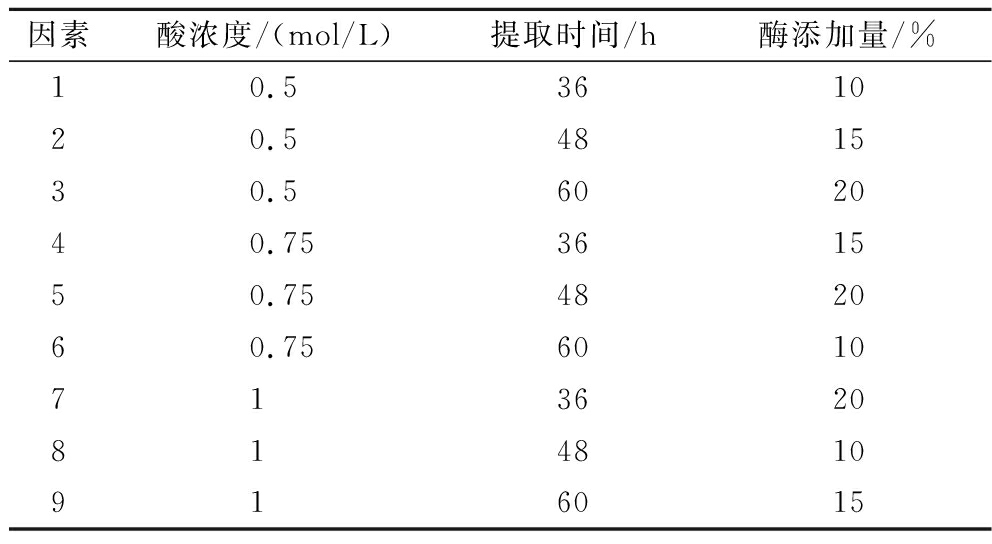
因素酸浓度/(mol/L)提取时间/h酶添加量/%10.5361020.5481530.5602040.75361550.75482060.756010713620814810916015
1.2.3 产品表征
1.2.3.1 羟脯氨酸含量的测定
羟脯氨酸标准曲线的测定:分别取30 mg/mL羟脯氨酸标准液0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1 mL,在CuSO4、NaOH存在的前提下向样品中加入H2O2,使羟脯氨酸经过氧化脱羧反应生成吡咯,再以对二甲基氨基苯甲醛显色,在560 nm处测定其吸光度,并绘制标准曲线。
样品纯度的测定:取提取的样品0.2 g,加入4 mL 6 mol/L的HCl溶液于具塞比色管中,做好密闭措施防止试样蒸发带来影响,于110 ℃下水解24 h,水浴加热除去HCl,定容至5 mL。取1 mL水解样品,加入1 mL 0.01 mol/L的CuSO4溶液和1 mL 2.5 mol/L的NaOH溶液,然后加入体积分数为3.6%的H2O2,振荡5 min后,静置30 min,置于30 ℃水浴加热10 min再激烈振荡5 min,加入4 mL 1.5 mol/L的H2SO4和2 mL质量分数为5%的二甲基氨基苯甲醛,于65 ℃水浴加热20 min,冷水中冷却至室温,用紫外分光光度计在波长560 nm下测定其吸光度。实验重复3次,取平均值,根据标准曲线确定提取的胶原样品中羟脯氨酸含量。
1.2.3.2 FTIR测试
将冷冻干燥后的鱼鳞胶原样品用镊子小心撕碎后,与KBr混合均匀后,进行压片制样,使用FTIR仪在波数400~4 000 cm-1区间扫描,测定投射光谱,分辨率设置4 cm-1。
1.2.3.3 CD测试
将冻干后的鱼鳞胶原样品溶于0.5 mol/L的冰乙酸溶液中,配制成2 mg/mL的胶原溶液。在N2的保护下,采用CD仪在190~240 nm的远紫外区对胶原溶液进行25、40、50 ℃下扫描,并记录摩尔椭圆率。
1.2.3.4 DSC测试
准确称取干燥的冻干后的鱼鳞胶原和牛胶原I样品2~3 mg于坩埚中,加盖密封后,以空坩埚作为参比,从20 ℃加热至210 ℃,升温速率5 ℃/min,采用N2保护,样品室的N2流量为60 mL/min。将转变峰的峰值温度记作胶原的热变性温度,转变峰的起始温度记作胶原开始变性的温度。
1.2.3.5 SDS-PAGE
本实验采用8%的分离胶和5%的浓缩胶进行凝胶电泳实验。首先将制胶所需要的模具(玻璃板、板夹、垫片)洗净并吹干,并安装好。按照8%的分离胶10 mL的配方进行配制,先后加入4.6 mL蒸馏水,2.7 mL、0.3 g/mL的丙烯酰胺,2.5 mL 1.5 mol/mL的Tris-HCl,0.1 mL 0.1 g/mL的SDS,0.1 mL 0.1 g/mL的过硫酸铵,0.006 mL的四甲基乙二胺(tetramethylethylenediamine,TEMED),混匀后加入到制胶板中间,加入约7 mL,并加入1 mL正丁醇,静置10 min左右,出现明显界线时倒掉正丁醇,并取滤纸将残留正丁醇吸干净。按照5%浓缩胶4 mL的配方配制浓缩胶,先后加入2.7 mL蒸馏水,0.67 mL 0.3 g/mL丙烯酰胺,0.5 mL 1.5 mol/mL的Tris-HCl,0.04 mL 0.1 g/mL的SDS,0.04 mL 0.1 g/mL的过硫酸铵,0.004 mL的TEMED,混匀后加入制胶板中,小心插入梳子,等待1 h,待胶凝固后小心取出梳子,并用蒸馏水冲洗干净。将制好的胶片固定在电泳槽内,在电泳槽内层加入电极缓冲液。
将鱼鳞胶原和牛胶原I用水溶解,配制成0.02 g/mL的溶液,加入缓冲溶液后,置于沸水中变性3 min。选择20 μL体系,样品与buffer体积比例为4∶1进行上样。设置电压70 V电泳30 min,待条带经过浓缩胶与分离胶的界线后,调整电压为120 V,待指示条带走到距离底部1.5 cm处,停止电泳。
取出胶片置于染色盒内,加入考马斯亮蓝染液,放在摇床上染色1.5 h,倒掉染色液,加入脱色液,更换数次脱色液,直至背景的颜色不影响观察条带。
1.2.3.6 扫描电镜测试
将冷冻干燥后的鱼鳞胶原样品和牛胶原I样品剪成0.5 cm×0.5 cm×0.2 cm的小块,对其喷金后,使用SEM对胶原表面形貌进行扫描,设置电压为3 kV,分别拍下800×和2 000×的扫描照片。
2 结果和分析
2.1 单因素试验结果
2.1.1 酸浓度单因素试验结果
在酸性环境下,胶原中维持结构的氢键等作用力容易被破坏,这会使胶原更容易从原材料中分离出来、更容易溶解在水环境中,但酸浓度过高又会引起胶原蛋白质结构的稳定性变化,导致胶原变性失活,影响可溶性胶原的提取。
通过不同的醋酸浓度进行鱼鳞胶原提取实验,用制得的冻干胶原样品质量进行提取率计算,探索酸浓度对可溶性鱼鳞胶原的提取效率。
由图1可知,酸浓度的提高可以使鱼鳞中的胶原提取更加充分,使提取率升高。酸浓度在0.25~0.75 mol/L,随着酸浓度的提高,提取率显著升高;酸浓度在0.75~1.25 mol/L,提取率随酸浓度的升高缓慢增加。由此分析可得,提取的最佳酸浓度应该确定在0.75 mol/L,在此酸浓度下,鱼鳞中的胶原既可以使胶原分子更加容易舒展开,胶原分子溶解更加充分,且胶原分子不会因酸浓度过高而被破坏。
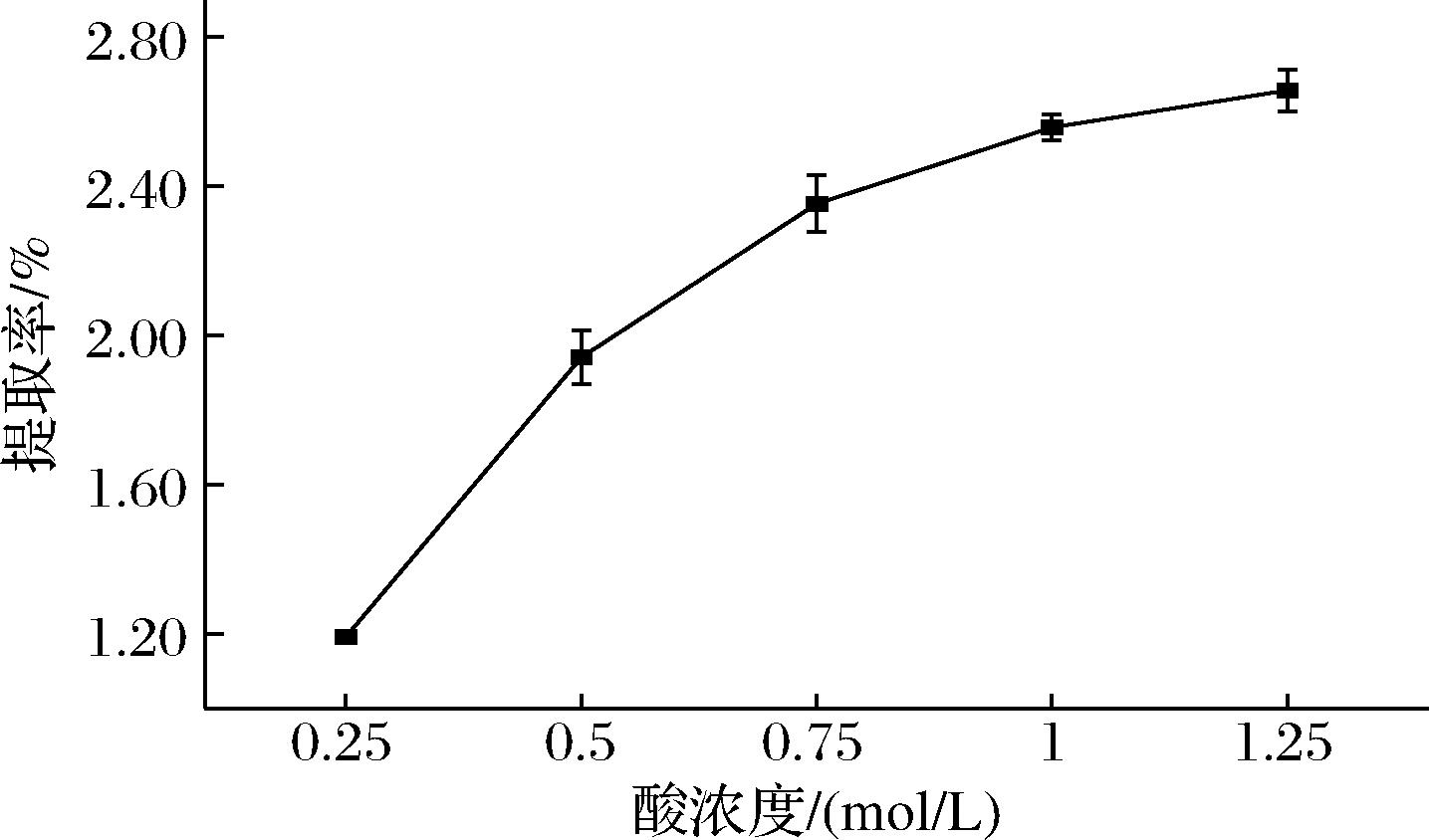
图1 不同醋酸浓度对提取率的影响
Fig.1 Effect of different acetic acid concentrations on the extraction rate
2.1.2 酶加量单因素试验结果
胃蛋白酶是一种被广泛应用的内切蛋白酶,可以将长链的蛋白质水解为多肽。胃蛋白酶在酸性环境下具有较好的催化活性,倾向水解胶原分子疏水残基或芳香族残基间的肽键,适量的胃蛋白酶能够在不破坏胶原纤维三股螺旋结构的前提下打开缠绕的胶原纤维束,促进胶原的溶解。
通过不同的胃蛋白酶添加量进行鱼鳞胶原提取实验,用制得的冻干胶原样品质量进行提取率计算。
由图2可知,酶加量的增加会使提取率显著提高,使胶原在鱼鳞中充分提取出来。酶加量在干鱼鳞质量的5%~15%,酶加量对提取率的影响十分显著,加酶量增加会使胃蛋白酶和鱼鳞的碰撞率提高,酶与底物充分接触,提高反应效率;当酶加量在干鱼鳞质量的15%以上时,酶加量对提取率的提升效果降低,并且当胃蛋白酶添加到一定数值时,反应达到饱和状态,且过多的胃蛋白酶会导致胶原过度水解对产品的纯度和性能产生影响,导致产品品质降低。综上所述,提取的最佳酶加量应为干鱼鳞质量的15%。
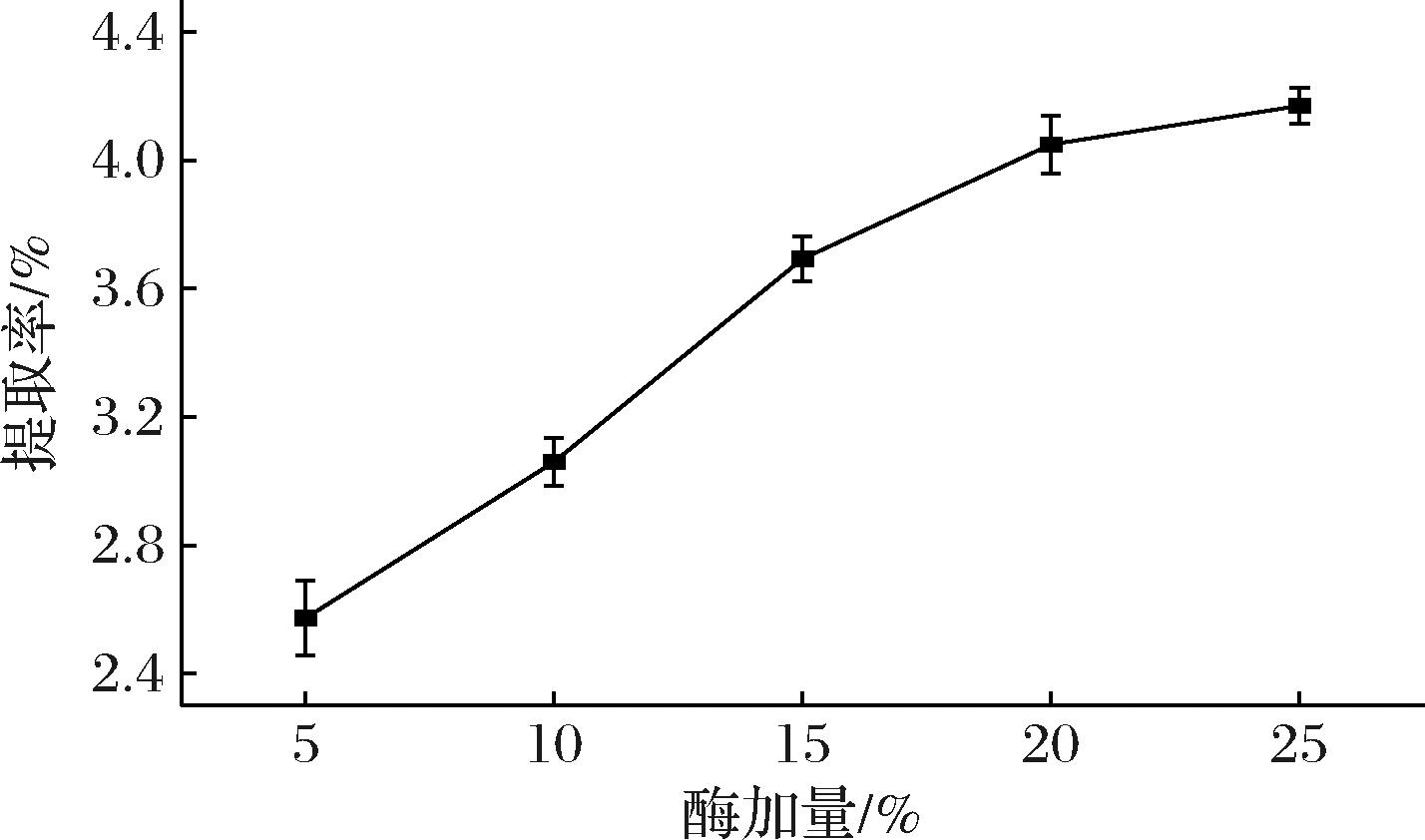
图2 不同酶添加量对提取率的影响
Fig.2 Effect of different enzyme additions on the extraction rate
2.1.3 提取时间单因素试验结果
提取时间是影响鱼鳞提取效率的因素之一,长时间的提取不仅带来提取成本的急剧增加,还可能带来微生物污染的风险,导致胶原的变性失活。
为了进一步优化提取时间,在相同的提取条件下,对鱼鳞处理不同时间,用制得的冻干胶原样品质量进行提取率计算。
由图3可知,随着时间的增加,鱼鳞胶原的提取率有增加的趋势,随着时间达到48 h,提取率增加的趋势放缓,时间对提取率的影响减小。为了提高胶原提取效率,确定提取时间为48 h,此时鱼鳞中的胶原既能够充分被提取,且有效控制了成本,避免了微生物的污染。
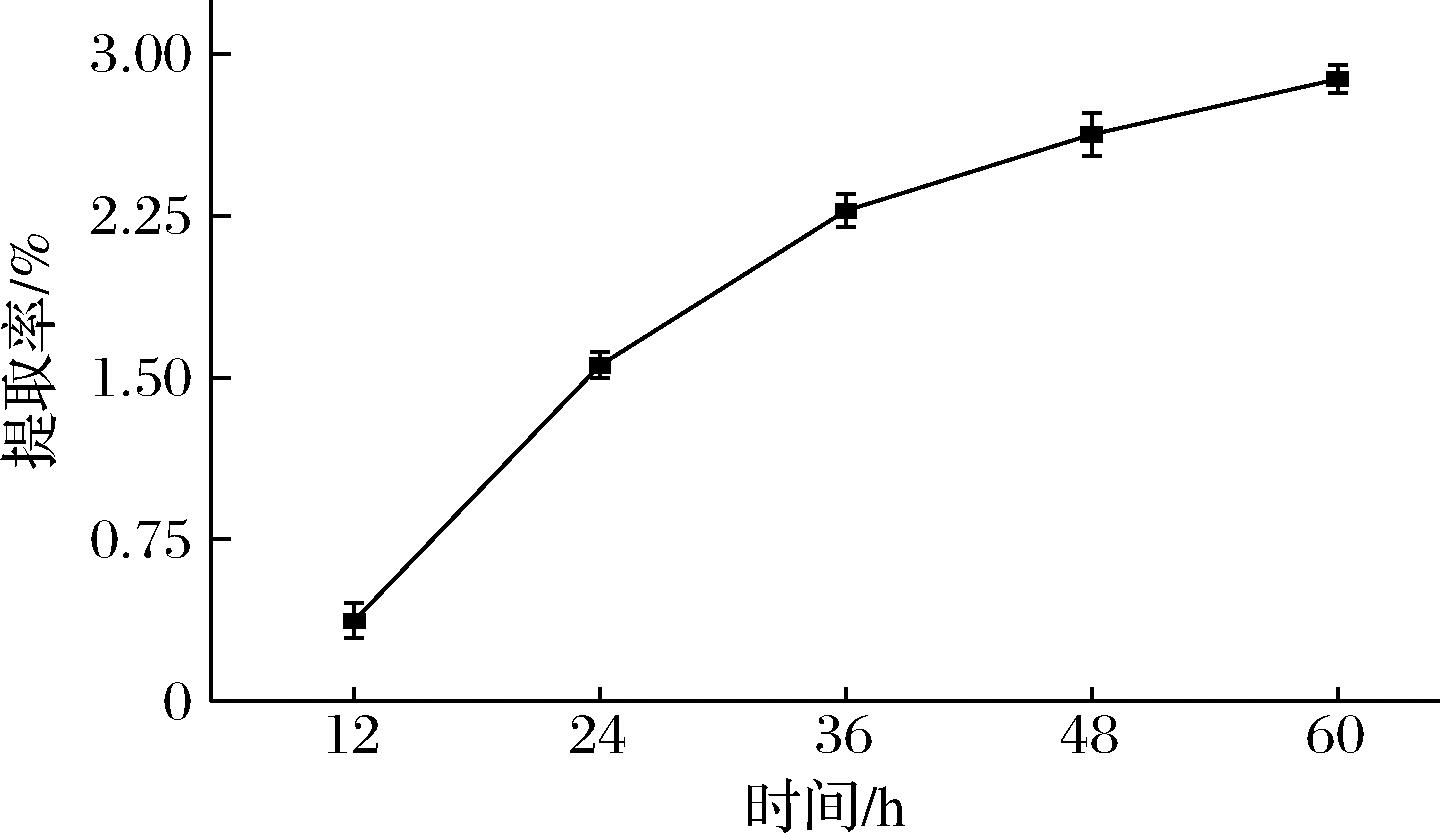
图3 不同提取时间对提取率的影响
Fig.3 Effect of different extraction time on extraction rate
2.1.4 正交试验
根据单因素试验,选取了酸浓度、提取时间、酶添加量这3个因素进行三因素三水平的正交试验,结果如表3所示,3个因素对提取率影响的大小顺序为:提取时间>醋酸浓度>酶添加量,最优的条件组合为:A3B3C3。按照此最优条件进行验证实验,发现提取率为3.84%,高于表3的各个组合的胶原蛋白提取率,说明此方法可靠,可以认为是鱼鳞胶原蛋白提取的最佳工艺条件。
表3 正交试验结果
Table 3 Orthogonal test results

因素提取时间/h酸浓度/(mol/L)酶添加量/%实验结果1120.2551.472120.5101.643120.75152.464360.25102.435360.5152.896360.7553.147480.25153.678480.553.069480.75103.32k12.8573.1903.557k23.8203.5303.463k34.0173.9733.673极差1.1600.7830.210优先水平A3B3C3主次因素A>B>C
2.1.5 提取工艺优化综合分析
通过实验结果进行综合分析,可以得出最佳提取工艺为使用0.75 mol/L的醋酸,酶加量为鱼鳞质量的15%,提取时间为48 h。在此提取工艺下,可以以相对合适的醋酸浓度使胶原溶解,避免胶原的三级结构被破坏;适量的酶在明显提高胶原的提取效率的同时避免了过度水解对产品纯度和性能的影响;相对合适的提取时间不仅提高了提取效率而且降低了提取成本避免了微生物污染。
2.2 羟脯氨酸含量结果
羟脯氨酸(Hyp)作为一种特征性氨基酸,它几乎完全存在于结缔组织的胶原蛋白中,在正常胶原蛋白中含量约为9%[10]。本实验使用酸联合酶水解提取获得的胶原,将胶原进一步酸化水解得到的胶原水解液中包含Hyp,之后通过双氧水氧化Hyp脱羧成吡咯,再用对二甲基氨基苯甲醛与吡咯生成红色复合物,根据复合物在560 nm的吸光度,判断溶液中Hyp的含量。
采用1.2.3.1节描述的羟脯氨酸标准曲线法定方法,测得羟脯氨酸的标准曲线为y=0.092 12x-0.083 53,其线性范围为:2~30 mg/L,R2为0.990 81,如图4所示。标准曲线的线性范围低,说明此方法灵敏度较高;R2接近于1,说明线性相关度较高,采用该标准曲线分析样品中的羟脯氨酸含量较为准确。
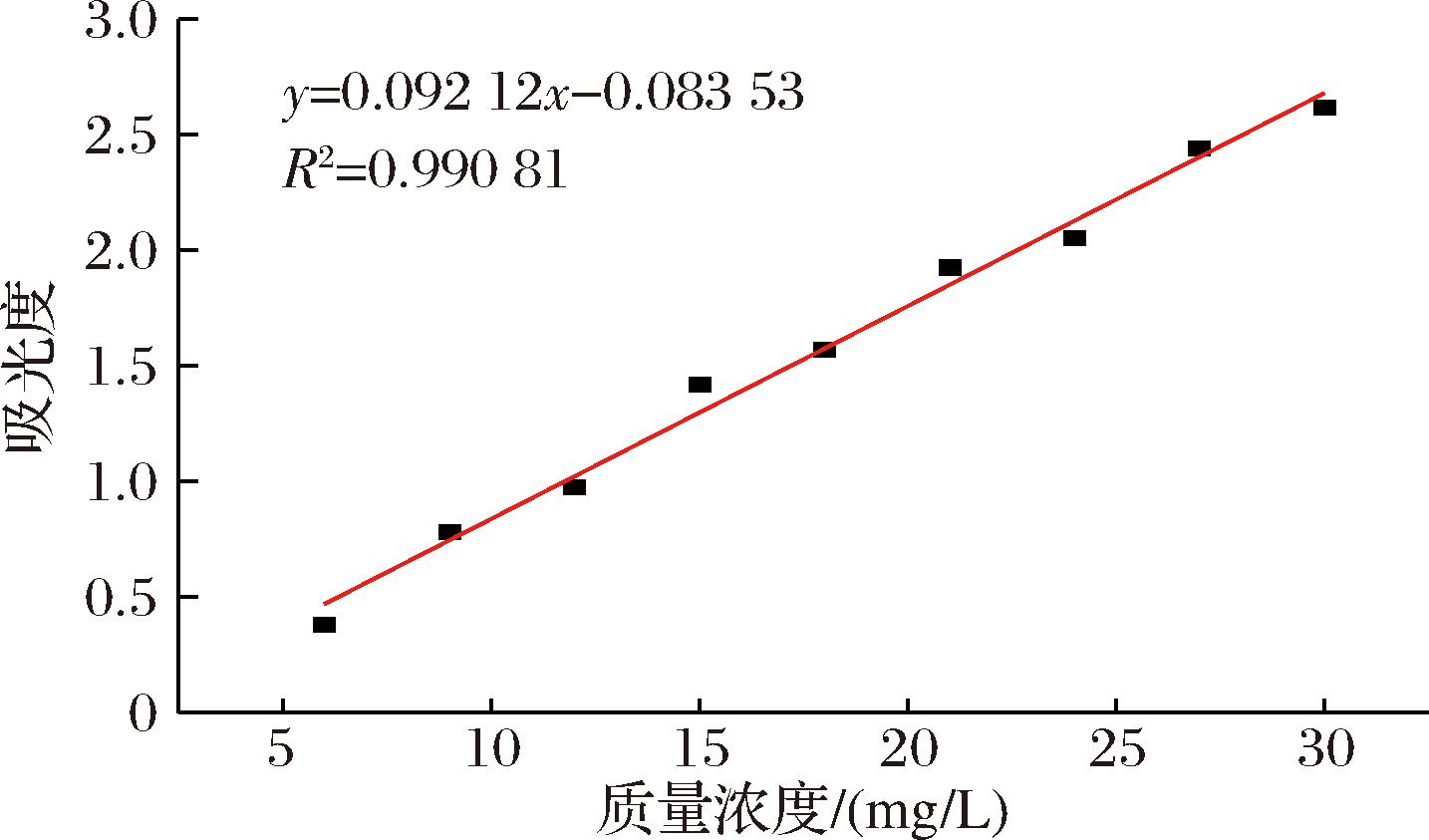
图4 羟脯氨酸浓度标准曲线
Fig.4 Hydroxyproline concentration standard curve
通过1.2.3.1节描述的样品羟脯氨酸含量测试的方法对样品进行羟脯氨酸含量测试。结果表明,未经超声辅助柠檬酸法脱钙的黄河鲤鱼鱼鳞的胶原样品几乎无法提取得胶原样品,经过超声辅助柠檬酸法脱钙后的黄河鲤鱼鱼鳞提取获得的胶原在0.2 g样品中,羟脯氨酸约为14.63 mg,约占制得胶原样品的7.31%,与文献[11]报道的胶原蛋白中羟脯氨酸的含量相接近,说明本实验制得的胶原样品纯度相对较高。此外内蒙古地区鲤鱼鳞片中提取的胶原其羟脯氨酸含量较陆生动物和热带地区鱼类的胶原含量低,在一级结构上对其温度敏感性的提高产生影响[12]。
2.3 FT-IR测试结果
未变性胶原的三级结构是由左手螺旋结构的肽链相互缠绕而形成的螺旋结构,这种结构使其具有锚定和促进细胞生长的生物活性。使用FT-IR分析内蒙古地区鲤鱼鳞片胶原的FT-IR确定部分基团存在状态,分析其高级结构,推测其生物活性的保留程度,如图5所示。
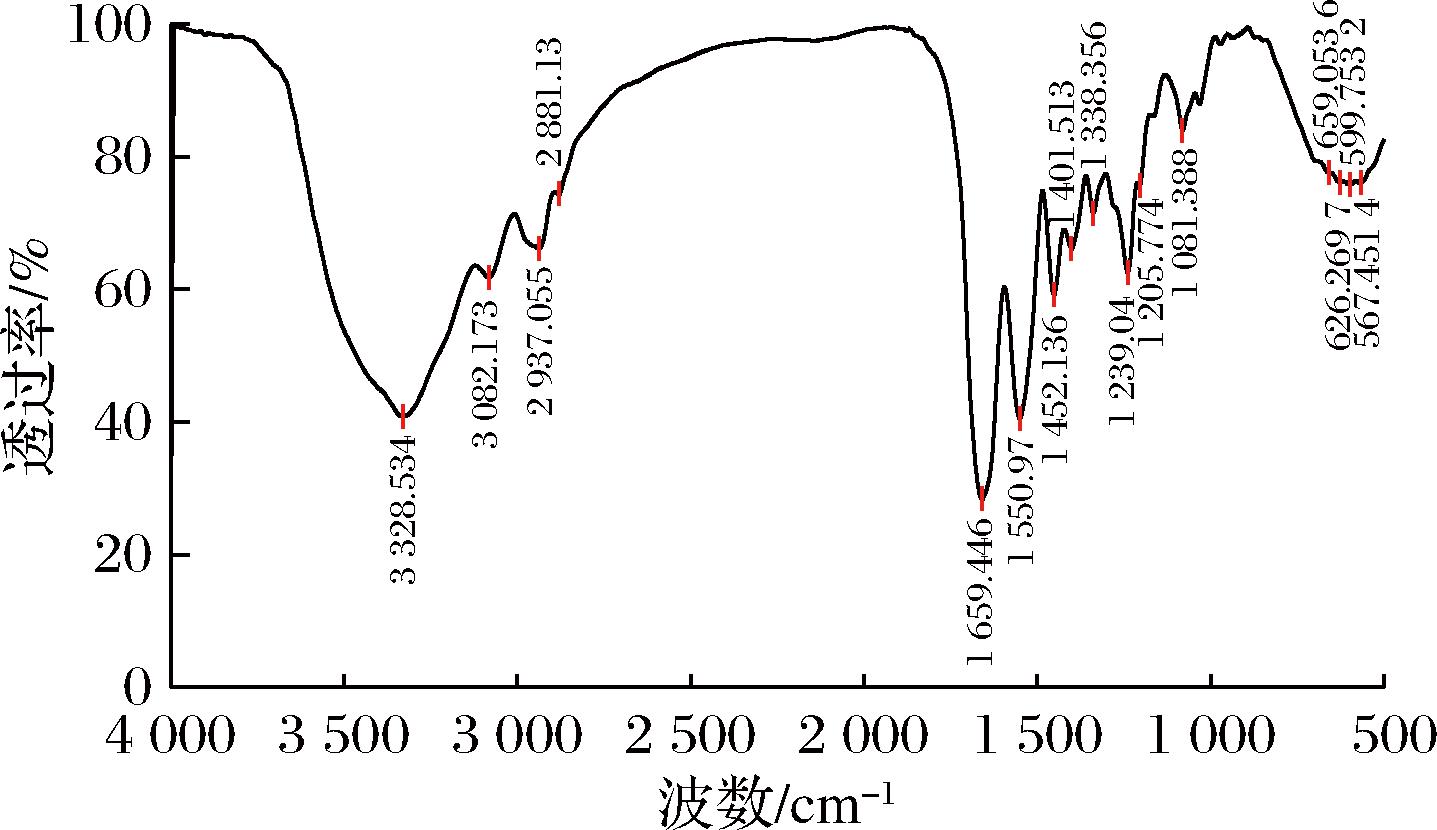
图5 鱼鳞胶原FTIR图谱
Fig.5 FTIR of fish scale collagen
具有完整螺旋结构的胶原红外图谱中存在酰胺A带、酰胺B带、酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带的特征吸收峰[13]。内蒙古地区鲤鱼鳞片胶原的红外谱图中,在2 000~1 500 cm-1有两个很窄但强度很高的吸收峰,其中1 659 cm-1处有酰胺Ⅰ带的吸收峰,在1 550 cm-1处的吸收峰则是酰胺Ⅱ带的吸收峰。酰胺Ⅰ带的吸收峰是由于C![]() O的伸缩振动引起的,酰胺Ⅱ带的吸收峰是由于N—H基团的变型振动和C—N基团的伸缩振动引起的。酰胺Ⅰ带和酰胺Ⅱ带与胶原分子中的二级结构(α螺旋、β折叠和不规则卷曲)等相关,证实了提取获得鲤鱼鳞片胶原二级结构的正确存在。在4 000~2 000 cm-1,产生了多个吸收峰,其中位于3 325.37 cm-1处有一个较宽的吸收峰,该吸收峰代表了酰胺A带;位于2 937.18 cm-1的吸收峰代表了酰胺B带,这两个峰的产生主要是由N—H的伸缩振动引起的。酰胺A带和酰胺B带的存在进一步表明了胶原分子的螺旋的三级结构有效保留[14]。鲤鱼鳞片胶原在1 239.21 cm-1处的吸收峰归属于酰胺Ⅲ带,此吸收峰是由于C—N拉伸和N—H平面弯曲振动,以及主链—CH2基团所产生的[15]。
O的伸缩振动引起的,酰胺Ⅱ带的吸收峰是由于N—H基团的变型振动和C—N基团的伸缩振动引起的。酰胺Ⅰ带和酰胺Ⅱ带与胶原分子中的二级结构(α螺旋、β折叠和不规则卷曲)等相关,证实了提取获得鲤鱼鳞片胶原二级结构的正确存在。在4 000~2 000 cm-1,产生了多个吸收峰,其中位于3 325.37 cm-1处有一个较宽的吸收峰,该吸收峰代表了酰胺A带;位于2 937.18 cm-1的吸收峰代表了酰胺B带,这两个峰的产生主要是由N—H的伸缩振动引起的。酰胺A带和酰胺B带的存在进一步表明了胶原分子的螺旋的三级结构有效保留[14]。鲤鱼鳞片胶原在1 239.21 cm-1处的吸收峰归属于酰胺Ⅲ带,此吸收峰是由于C—N拉伸和N—H平面弯曲振动,以及主链—CH2基团所产生的[15]。
综上所述,红外光谱扫描结果表明,提取的鱼鳞胶原具有酰胺A带、酰胺B带、酰胺Ⅰ带、酰胺Ⅱ带,酰胺Ⅲ带,说明本文中提取内蒙古地区鲤鱼鱼鳞胶原的工艺没有破坏胶原的三级结构,保持了胶原完整的高级螺旋结构。
2.4 CD测定结果
CD测试技术是研究溶液体系中蛋白质构型的一种简便、快捷、精准的方法。胶原是一类光学活性蛋白质,采取类聚脯氨酸-Ⅱ型的螺旋构象,溶液状态下胶原的三股螺旋结构的CD图的特征吸收峰是215~227 nm的正吸收峰和200 nm左右的负吸收峰。胶原部分变性会造成其三股螺旋结构部分解旋,从而引起CD图中吸收峰强度降低,而胶原完全变性会造成其三股螺旋结构完全解旋,最终导致CD图中正吸收峰的消失和负吸收峰的红移[16]。
由图6可知,25 ℃时,鱼鳞胶原在波长为209 nm处有负吸收峰,在波长为225 nm处有正吸收峰,这证明了本实验提取的胶原具有天然胶原的三股螺旋的特征。在25 ℃时有正吸收峰,说明此时鱼鳞胶原有完整的三螺旋结构,随着温度从25 ℃升高到40 ℃,再从40 ℃升高50 ℃,从图6中可以明显看出胶原由于部分变性造成的吸收峰强度变小,且在40 ℃时正吸收峰就消失了,这说明胶原经历了从25 ℃的未变性状态,到完全变性的过程,氢键和疏水性相互作用等维持胶原三级结构的作用力逐渐消失,三股螺旋结构随着温度升高而解开,胶原在40 ℃就失去了三螺旋结构,从而导致了负吸收峰的红移和正吸收峰逐渐消失。说明这些变化映证了相关文献的报道,证实了鱼鳞胶原在溶液中的温度敏感性[17]。
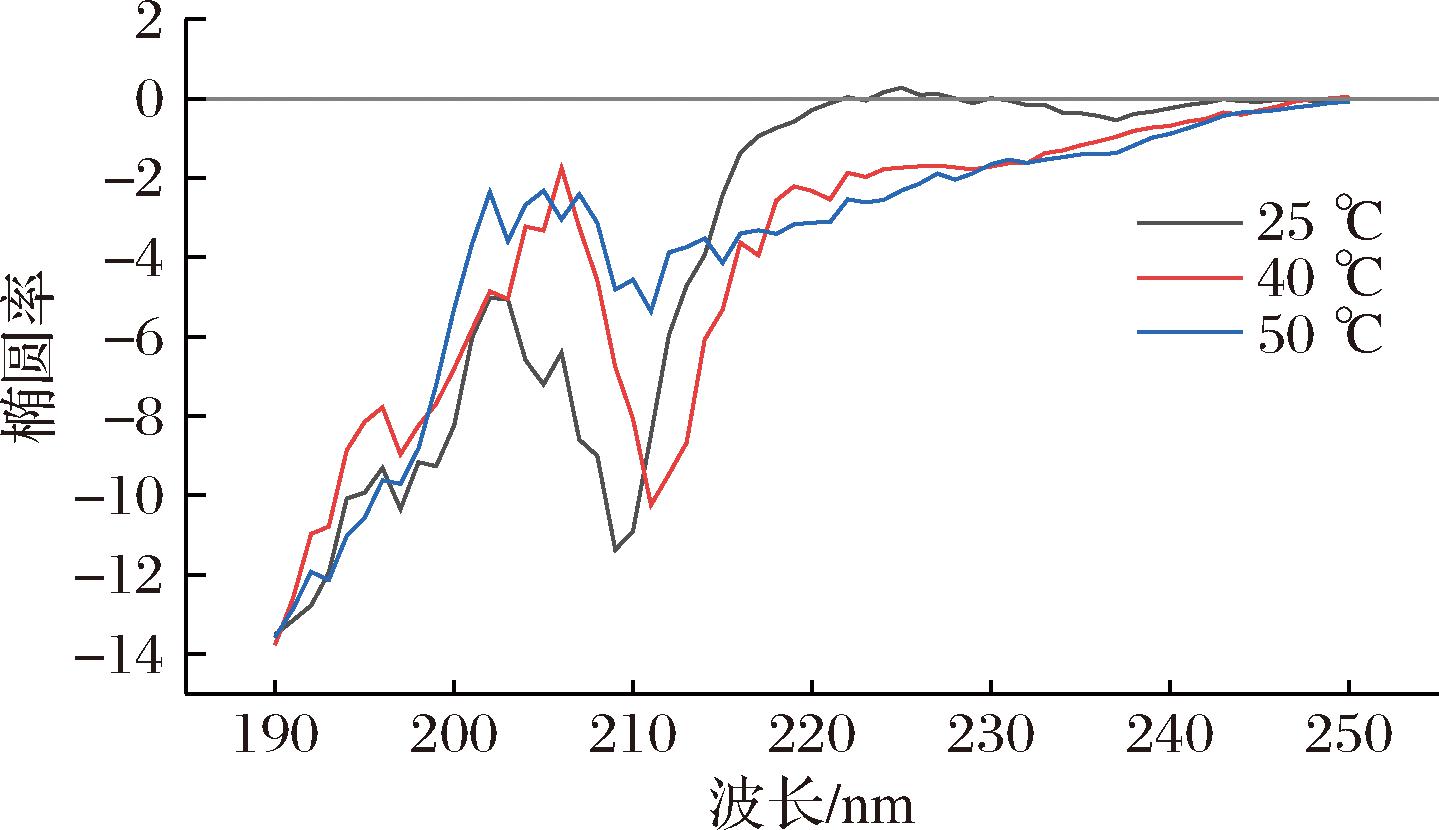
图6 鱼鳞胶原CD图
Fig.6 CD spectra of fish scale collagen
2.5 DSC测试结果
DSC是一种研究物质热力学性质的测试方法。胶原在未变性时是由多肽链缠绕成超螺旋结构,加热会导致胶原分子结构发生变化,而结构的变化往往伴随着热量的变化,DSC测试就是检测这个过程中的热量变化。
由图7、图8可知,鱼鳞胶原在54.19 ℃的温度下开始变性,纤维结构开始发生变化,最大峰值出现在97.11 ℃,此温度是鱼鳞胶原的变性温度。通过对比牛胶原I和鱼鳞胶原的DSC测试图,发现鱼鳞胶原的变形温度低于牛胶原I,并且低于100 ℃;但其峰值的高度高于牛胶原I的峰值高度,说明鱼鳞胶原在变性过程中要吸收更多的热量,这是因为鱼鳞胶原分子的排列方式更加规整,而规整的排列会使胶原的焓值变高。

图7 鱼鳞胶原DSC测试图
Fig.7 Fish scale collagen DSC result
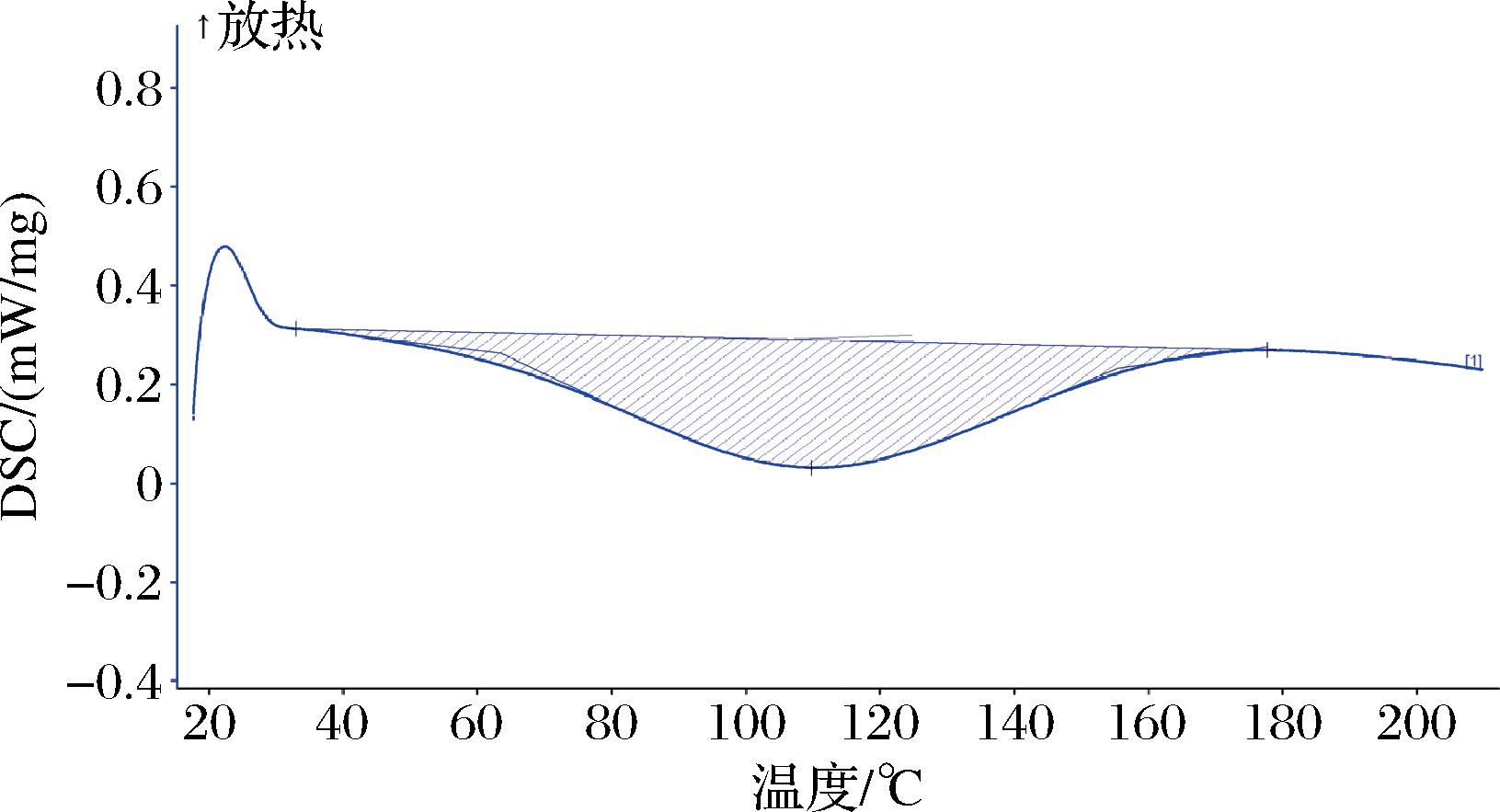
图8 牛胶原DSC测试图
Fig.8 Bovine achilles tendon collagen DSC result
内蒙地区黄河鲤鱼的生存环境温度较低,且温度差较大,为了适应这种环境,黄河鲤鱼的鳞片胶原的变性温度低,且焓值高,以保证在温差较大的生存环境中胶原的稳定性。同时也有文献[18]表明,鱼胶原在氨基酸组成和一级结构上存在区别,羟脯氨酸含量明显低于陆地动物胶原,这也导致了鱼胶原的变性温度低于陆地动物胶原,这使得鱼类胶原在对温度敏感的应用场景有明显的优点。
另一方面,对比鱼鳞胶原CD测试和DSC测试结果,证明了胶原在冷冻干燥后较其在溶液中的热稳定性更高,有利于储存和运输,这为鱼鳞胶原冻干技术和产品的应用提供了理论基础。
2.6 SDS-PAGE结果
如图9所示,经过提取的鱼鳞胶原相较于牛胶原I在分子质量上较为均一,有明显的两种α-肽链(α1和α2)和一条β-肽链,α1-链分子质量约为120 kDa,α2-链分子质量约为100 kDa,β-链的分子质量大小约为200 kDa,总分子质量约为420 kDa,说明提取得到的鱼鳞胶原为Ⅰ型胶原。而观察牛胶原I的电泳图,发现牛胶原I出现了多个条带,说明分子质量分布不均一,并发生了较严重的水解过度的情况。
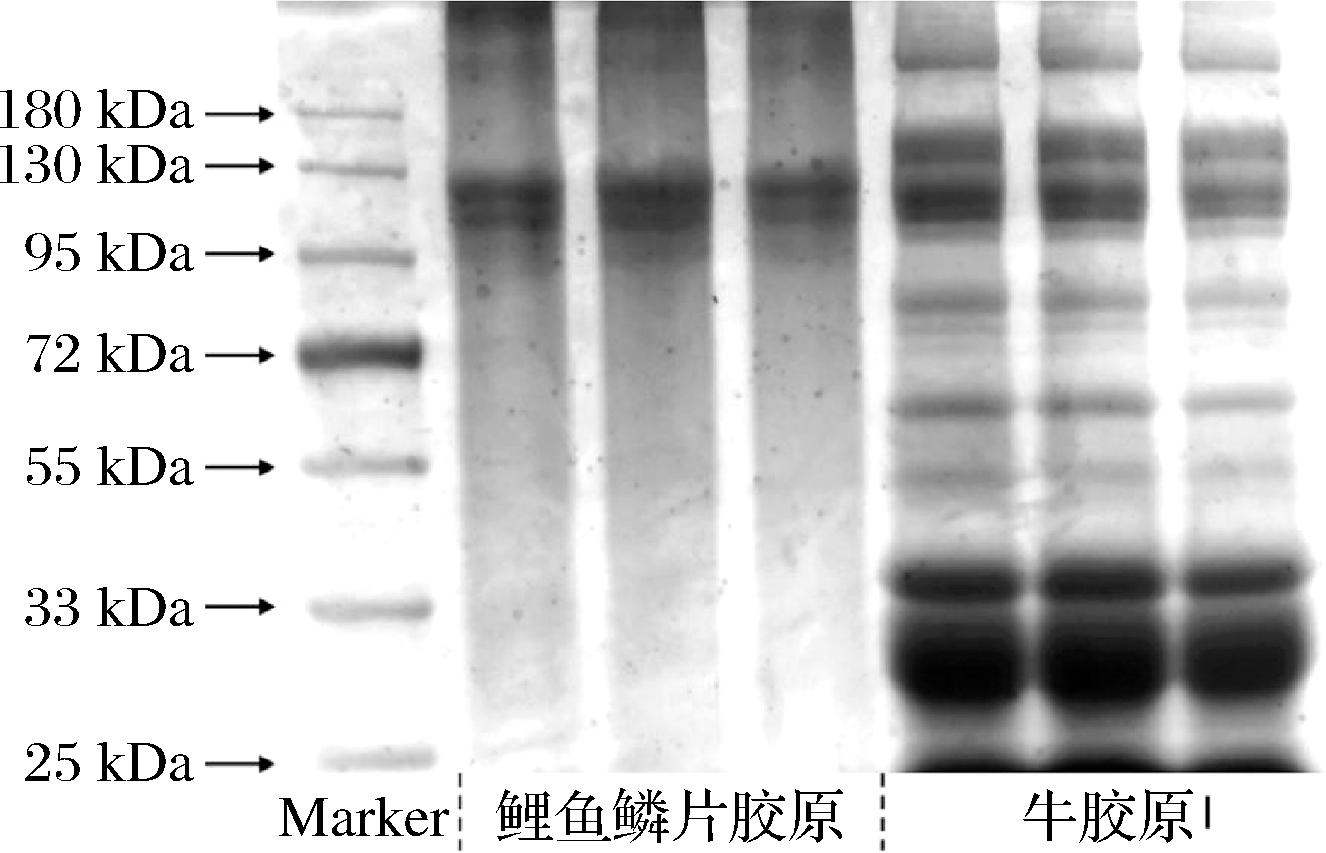
1-Marker,2~4-鱼鳞胶原,5~7-牛胶原I(从左到右)
图9 SDS-PAGE结果
Fig.9 SDS-PAGE results
通过比对凝胶电泳图发现,鱼鳞胶原分子质量分布更加均匀,只出现了3个条带,并且鱼鳞胶原的相对分子质量要低于牛胶原I的相对分子质量,这说明鱼鳞胶原分子会暴露更多的反应基团,更容易对其进行改性,以探索出性质更好的胶原基生物材料。
2.7 SEM测试结果
经冷冻干燥后的鱼鳞胶原和用同种方法提取的牛胶原I的SEM图如图10、图11所示。胶原在冷冻干燥后,胶原分子靠氢键、疏水性相互作用、分子间作用力等缠绕形成大分子纤维。通过对比鱼鳞胶原和牛胶原I的扫描电镜照片,发现牛胶原I表面分布更加杂乱;而鱼鳞胶原表面分布更加均匀,更加平整。这是由于鱼鳞胶原比牛胶原I分子质量更小,冻干后其表面更加质密,网状结构更加平整、均匀,进一步映证了凝胶电泳鱼鳞胶原分子质量为420 kDa且分布较窄,分子质量更加均匀的结论。
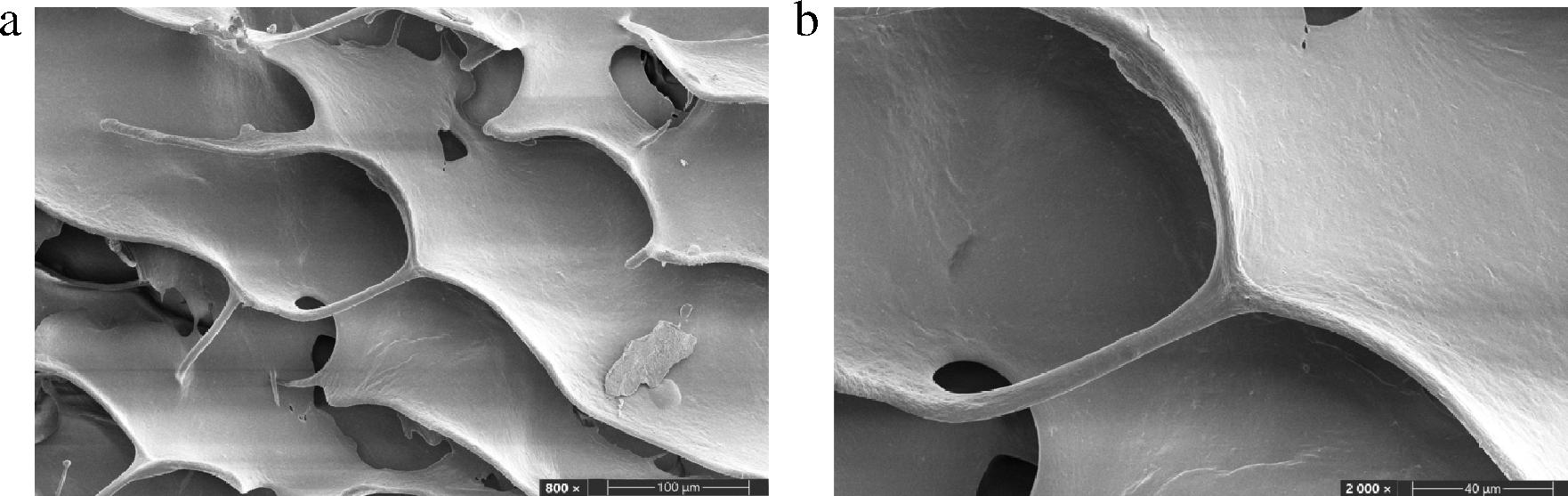
a-放大倍数800×;b-放大倍数2 000×
图10 鱼鳞胶原SEM图片
Fig.10 SEM graph of fish scale collagen
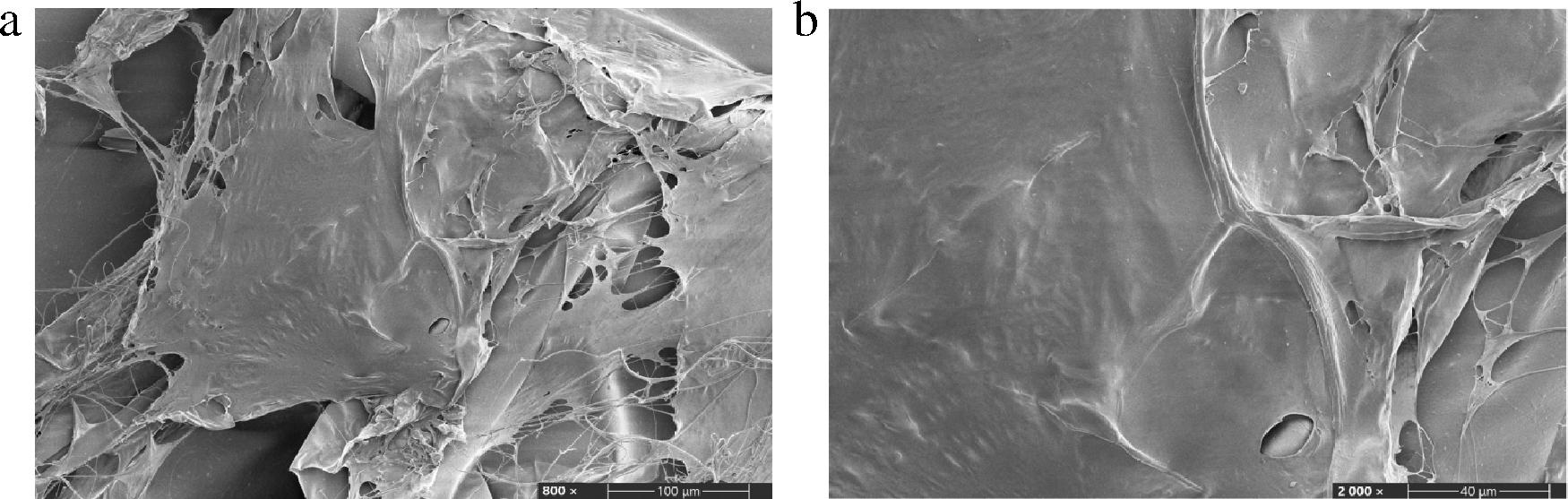
a-放大倍数800×;b-放大倍数2 000×
图11 牛胶原I SEM图片
Fig.11 SEM graph of bovine achilles tendon collagen I
3 结论与讨论
本实验采用酸法和酶法相结合,从黄河鲤鱼鱼鳞中提取胶原,探索出最佳提取条件为:脱钙后的鱼鳞与0.75 mol/L的醋酸混合,以干鱼鳞质量的15%加入胃蛋白酶,提取48 h,透析冻干后得到海绵状胶原样品。通过对样品中羟脯氨酸含量分析,证实了提取的胶原具有较高的纯度和低温水域鱼类胶原的低羟脯氨酸含量特性。通过红外光谱分析,可以推测出提取的鱼鳞鳞片胶原具有完整的高级结构。考察不同温度下胶原的圆二色谱图结合通过示差扫描量热仪测试的结果,证明了内蒙古地区鲤鱼鱼鳞胶原的具有更好的温度敏感性,且在水溶液中的温度敏感性更强。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳和扫描电镜观察胶原的微观形貌,发现鱼鳞胶原分子质量比牛胶原I分子质量小且分布较窄;存在较明显的网状纤维结构,表面较牛胶原I更加平整、均匀。
本文建立了内蒙古地区黄河流域昼夜温差较大环境中生长的鲤鱼鳞片胶原提取工艺,并对其结构性能进行了表征,研究发现内蒙古地区鱼鳞胶原分子质量均匀且温度敏感性较高,在温敏性胶原基材料开发和应用领域具有巨大的潜在价值。对内蒙古地区鲤鱼鱼鳞的研究,将鱼鳞“变废为宝”,能够提高鱼类产品的附加值,对推动内蒙古中西部渔业资源的发展和新型生物材料的开发应用都具有十分重要的意义。
[1] 王沥浩, 王文慧, 郭咏昕, 等.胶原蛋白功能概述[J].黑龙江农业科学, 2014(3):150-156.WANG L H, WANG W H, GUO Y X, et al.Summary on the function of collagen[J].Heilongjiang Agricultural Sciences, 2014(3):150-156.
[2] ALEMAN A, MARTINEZ-ALVAREZ O.Marine collagen as a source of bioactive molecules:A review[J].The Natural Products Journal, 2013, 3(2):105-114.
[3] 胡建平. 鱼鳞胶原蛋白的酸法提取及性质研究[J].食品科技, 2012, 37(11):141-148.HU J P.Extraction and properties on scale collagen[J].Food Science and Technology, 2012, 37(11):141-148.
[4] 王林. 深海红鱼(Sebastes mentella)胶原蛋白的制备及其理化特性研究[D].南京:南京农业大学, 2009.WANG L.Preparation and physicochemical characteristics of collagen from deep-sea redfish (Sebastes mentella)[D].Nanjing:Nanjing Agricultural University, 2009.
[5] 冯伟业, 王哲奇, 李振林, 等.黄河内蒙古段黄河鲤生物学特性的研究[J].现代农业, 2018(10):75-78.FENG W Y, WANG Z Q, LI Z L, et al.Study on biological characteristics of Yellow River carp in Inner Mongolia section of the Yellow River[J].Modern Agriculture, 2018(10):75-78.
[6] 林佳丽. 温度对斑马鱼肌肉营养组成和胶原蛋白含量的影响及初步机制研究[D].汕头:汕头大学, 2021.LIN J L.Preliminary study on the effects of temperature on muscle nutritional composition and collagen content of zebrafish (Danio rerio)[D].Shantou:Shantou University, 2021.
[7] 银旭红, 傅学军.鱼鳞加工利用情况的研究进展[J].江西水产科技, 2016(1):43-45.YIN X H, FU X J.Research progress on processing and utilization of fish scales[J].Jiangxi Fishery Science and Technology, 2016(1):43-45.
[8] 李泽民, 何生林, 丁云桥, 等.五因素混水平正交实验优化鱼鳞胶原提取工艺[J].山东化工, 2019, 48(20):18-22;24.LI Z M, HE S L, DING Y Q, et al.Optimization of collagen extraction from fish scale by five-factor mixed horizontal orthogonal experiments[J].Shandong Chemical Industry, 2019, 48(20):18-22;24.
[9] 郝星海, 张峥, 夏牧秋, 等.超声辅助柠檬酸法优化草鱼鱼鳞脱钙工艺[J].食品工业, 2022, 43(5):107-111.HAO X H, ZHANG Z, XIA M Q, et al.Optimization of decalcification process of grass carp scale by ultrasonic assisted citric acid method[J].The Food Industry, 2022, 43(5):107-111.[10] NISHIMOTO M, SAKAMOTO R, MIZUTA S, et al.Identification and characterization of molecular species of collagen in ordinary muscle and skin of the Japanese flounder Paralichthys olivaceus[J].Food Chemistry, 2005, 90(1-2):151-156.
[11] 肖枫, 朱文学, 康怀彬, 等.正交试验优化黄河鲤鱼鳞酶促溶性胶原蛋白提取工艺[J].食品科学, 2015, 36(12):60-64.XIAO F, ZHU W X, KANG H B, et al.Orthogonal array design for the optimization of pepsin soluble collagen extraction from Cyprinus carpio haematopterus scale[J].Food Science, 2015, 36(12):60-64.
[12] LIN Y K, LIU D C.Comparison of physical-chemical properties of type I collagen from different species[J].Food Chemistry, 2006, 99(2):244-251.
[13] 付芳燕. 通过傅里叶变换红外光谱研究金属离子与蛋白的相互作用[D].北京:北京化工大学, 2011.FU F Y.Study on the interaction of the metal ions and protein via fourier transform infrared spectroscopy[D].Beijing:Beijing University of Chemical Technology, 2011.
[14] 肖枫. 黄河鲤鱼鳞胶原蛋白的性质及胶原肽活性研究[D].镇江:江苏大学, 2014.XIAO F.Study on the characterization of collagen and bioactive peptides from Cyprinus carpio haematopterus scale[D].Zhenjiang:Jiangsu University, 2014.
[15] 闫鸣艳. 狭鳕鱼皮胶原蛋白结构和物理特性的研究[D].青岛:中国海洋大学, 2009.YAN M Y.Study on the structure and physical properties of collagen from walleye pollock (Theragra calcogramma) skin[D].Qingdao:Ocean University of China, 2009.
[16] FENG Y B, MELACINI G, TAULANE J P, et al.Acetyl-terminated and template-assembled collagen-based polypeptides composed of gly-pro-hyp sequences.2.synthesis and conformational analysis by circular dichroism, ultraviolet absorbance, and optical rotation[J].Journal of the American Chemical Society, 1996, 118(43):10351-10358.
[17] 顾其胜, 蒋丽霞.胶原蛋白与临床医学[M].上海:第二军医大学出版社, 2003.GU Q S, JIANG L X.Collagen and Clinical Medicine[M].Shanghai:The Second Military Medical University Press, 2003.
[18] 李杰, 闫鸣艳, 刘均洪, 等.鱼胶原蛋白的研究进展[J].食品安全质量检测学报, 2015, 6(10):3941-3946.LI J, YAN M Y, LIU J H, et al.Research progress of fish collagen[J].Journal of Food Safety &Quality, 2015, 6(10):3941-3946.