近年来,五味子成为一种具有开发潜能的药食兼用的植物而备受瞩目,其在临床应用和养生保健中的功效愈发受到人们的重视[1]。南、北五味子分别来源于木兰科植物华中五味子(Schisandra sphenanthera)和五味子(Schisandra chinensis)的干燥成熟果实[3]。南五味子主产于陕西、湖南、云南、江西、四川等地,北五味子主产于辽宁、吉林、黑龙江等地,二者不是一种药物,其功效、主治等不同[4]。五味子主要有效成分为挥发油、木脂素类和多糖等,具有镇静催眠、保肝护肝、抗氧化、抗衰老及降糖降脂等多种功效[5-13]。五味子中挥发油和木脂素类等成分和含量测定已有诸多报道,不同产地的五味子的化学成分存在差异[14-21]。北五味子油是其果实通过超临界CO2萃取得到的油状物,主要含有五味子醇甲和五味子乙素,具有抗氧化作用和保护胰岛细胞的降糖作用[8,22]。虽然南五味子油的成分分析报道较多,但是关于其降糖及抗氧化活性尚未见报道。因此,为了研究南北五味子油的成分及其生物活性,本研究采用超临界CO2萃取五味子油,运用GC-MS和HPLC法进行成分分析,利用胰岛素抵抗(insulin resistance,IR)模型测定降糖活性,DPPH自由基法测定抗氧化活性,以期为五味子的人工种植及开发应用提供科学依据。
1 材料与方法
1.1 仪器与试剂
LC-10ATVP高效液相色谱仪,日本岛津公司;L5S紫外可见分光光度计,上海仪电分析仪器有限公司;HA220-40-11超临界萃取装置,南通市华安超临界萃取有限公司;7890A-5975C气质联用仪(配NIST11数据库),美国安捷伦科技有限公司;SPARK 10M酶标仪,瑞士TECAN公司;WIGGENSWCI-180 CO2恒温培养箱,北京桑翌实验仪器研究所;SW-CJ-2FD超净工作台;上海笃特科学仪器有限公司;TD5离心机,上海卢湘仪离心机仪器有限公司。
五味子醇甲(21031610)、酯甲(22010413)、甲素(21090915)、乙素(21090103)标准品,北京中科质检生物技术有限公司;五味子果实,陕西久泰农旅文化有限公司五味子种植基地;甲醇、乙腈(阿拉丁)为色谱纯,其余试剂为分析纯。
1.2 超临界CO2萃取
将五味子干燥粉碎后过筛,取800 g装入提取罐中,在30 MPa和50 ℃萃取、5 MPa和40 ℃分离,得到五味子超临界CO2萃取物,计算其提取率。
1.3 GC-MS分析
超临界萃取物与正己烷按1∶10(g∶mL)的比例混合,经0.22 μm微孔滤膜过滤,按照下述条件进行GC-MS分析。(1)GC分析条件:色谱柱起始温度50 ℃恒温保持2 min,以5 ℃/min的速度升高至120 ℃,以10 ℃/min的速度升高至300 ℃恒温保持10 min。气化室的温度260 ℃,传输线温度300 ℃,氦气流速1.0 mL/min,进样量1 μL,分流比50∶1,色谱柱为HP-5MS石英毛细管柱(30.0 m×250 μm,0.25 μm)[19];(2)MS分析条件:电喷离子源、离子源温度230 ℃、扫描模式为Scan、扫描质量范围20~500 u、电子能量70 eV、四极杆温度150 ℃[23]。
1.4 木脂素类成分含量测定
1.4.1 样品液制备
精密称取木脂素单体标准品,配制得到五味子醇甲(0.104 mg/mL)、酯甲(0.104 mg/mL)、甲素(0.106 mg/mL)、乙素(0.106 mg/mL)混合标准品溶液。精密称取超临界CO2萃取物,得到供试品溶液。
1.4.2 HPLC测定条件
Hypersil ODS C18色谱柱,进样量20 uL,柱温25 ℃,检测波长225 nm,流量1 mL/min,流动相A为乙腈、流动相B为水。梯度洗脱程序为0~10 min,A由40%升至55%;10~20 min,A由55%升至68%;20~25 min,A由68%升至74%;25~32 min,A由74%升至75%;32~37 min,A由75%升至100%,保持11 min;48~48.1 min,A由100%跳转至40%,保持7 min[24]。
1.4.3 标准曲线
取混合标准品溶液8 mL,用甲醇定容至10 mL得到混合标准品1。然后取1 mL混合标准品1,用甲醇依次稀释2倍,得到混合标准品2、3、4、5。将混合标准品1、2、3、4、5过滤,按照1.4.2节进行检测。以混合标准品1、2、3、4、5的浓度为横坐标,峰面积为纵坐标绘制出上述4种木脂素的标准曲线,得到回归方程。
1.4.4 供试品含量测定
按照1.4.2节进行检测,利用线性回归方程计算得出其超临界萃取物4种木脂素含量。
1.5 降糖活性
化合物、盐酸二甲双胍分别用二甲基亚砜配成1 g/L的储备液,然后分别用高糖DMEM(Dulbecco’s modified eagle medium,含25 mmol/L葡萄糖)培养基配制成药物质量浓度为1、5、25 mg/L的培养基稀释液。参考费烨等[25]的方法测定药物对IR-HepG2细胞的降糖活性。取对数生长期的HepG2细胞,按照8×103/孔接种到96孔板中,5% CO2, 37 ℃恒温培养箱中培养至细胞贴壁。改为无血清DMEM培养基培养12 h,然后用含1.00 μmol/L胰岛素的高糖DMEM培养基培养36 h,随后加入100 μL/孔分组稀释液培养24 h(CK、IR用正常DMEM培养液处理)。每个处理组3次重复,每孔取上清液在505 nm处检测葡萄糖含量,计算各孔细胞的葡萄糖消耗量。
1.6 抗氧化活性
参考李启思等[26]五味子木脂素清除DPPH自由基的测定方法,拟合计算半抑制浓度(half inhibitory concentration,IC50)值,考察萃取物抗氧化活性。
2 结果与分析
2.1 超临界CO2萃取结果
如表1所示,南五味子经超临界CO2萃取后,得到棕褐色不透明液体萃取物A,萃取率9.0%。北五味子从两个解析釜中到颜色不同的液体,合并,静置分层后分离得到萃取物B(上层)和C(下层),总萃取率为5.2%。
表1 南北五味子超临界CO2萃取率
Table 1 Supercritical CO2 extraction rates of Schisandra chinensis and Schisandra sphenanthera

原料品质萃取率/%南五味子棕褐色不透明液体9.0北五味子淡黄色不透明液体1.5棕褐色不透明液体3.7
2.2 GC-MS分析结果
南五味子萃取物A的GC-MS总离子流图如图1所示。
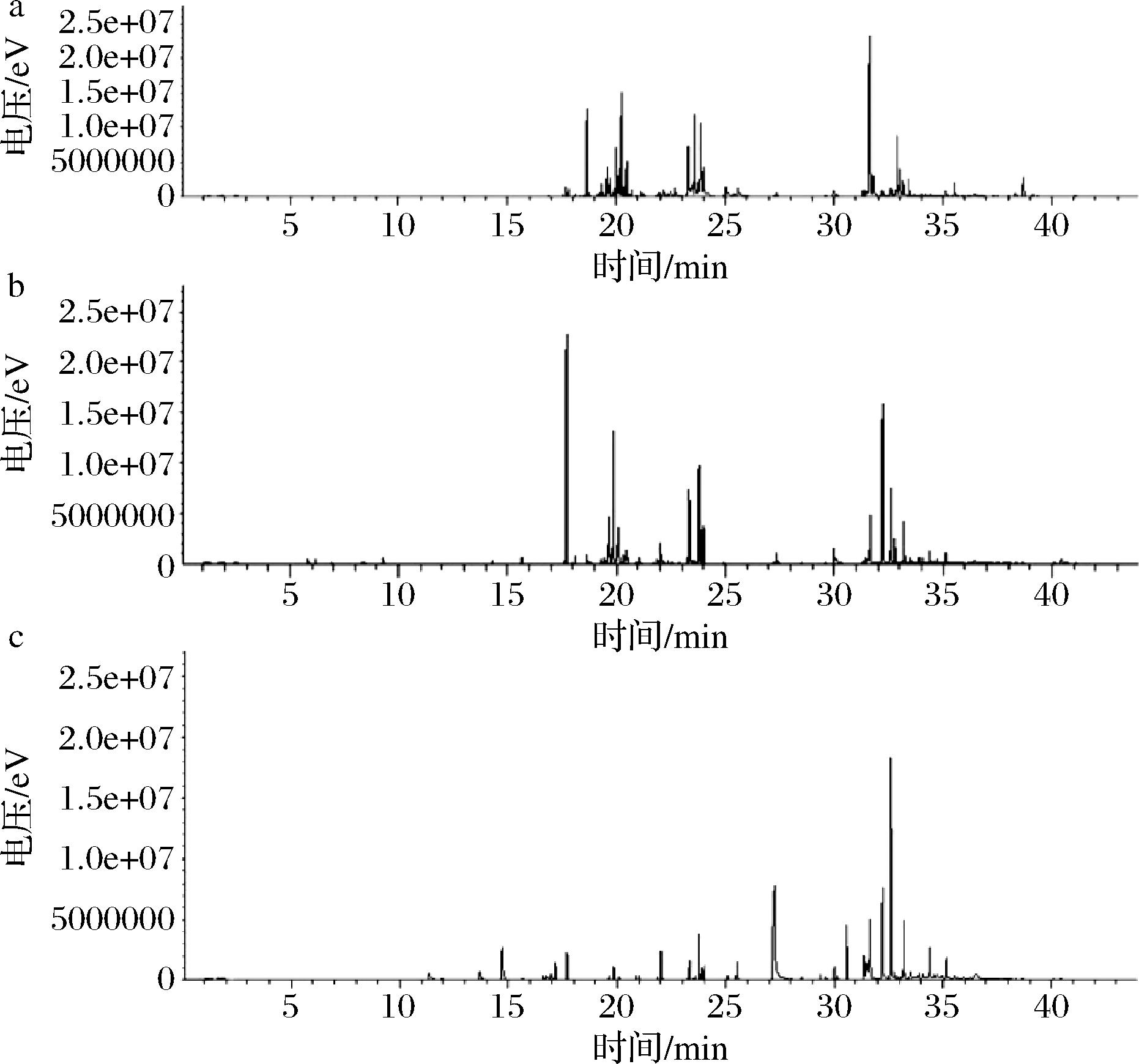
a-萃取物A;b-萃取物B;c-萃取物C
图1 超临界CO2萃取物GC-MS总离子流图
Fig.1 GC-MS total ion flow diagram of supercritical CO2 extraction
扣除聚氧硅烷等杂质峰和溶剂峰,从南五味子萃取物中鉴定出120个成分,其中相对含量大于2.5%的有10个成分(表2)。相对含量大于2.5%的成分占总挥发性成分的54.26%,主要为烃类、醇类、酯类、酮类和酚类等。其中相对含量较高的有N-(1,3-苯并二氧代-5-基)-2-(1H-咪唑并[4,5-b]吡啶-2-基巯基)乙酰(10.75%)、3,3-二甲基-2-(3,3-二甲基-1-丁炔-1-基)环丙烯甲酸(7.85%)、木罗烯(6.34%)、檀香烯(5.64%)、2-甲基-1-苯基-2-丙烯醇(5.32%)、β-生育酚(4.71%)、富马酸环己-3-烯基甲基十二烷基酯(4.67%)、加尔巴辛(3.55%)等。
表2 萃取物A相对含量大于2.5%成分表
Table 2 Components with relative content of extract A greater than 2.5%

峰保留时间/min化合物分子式相对分子质量/(g/mol)相对含量/%118.64檀香烯C15H24204.195.64220.00β-喜马雪松烯C15H24204.192.77320.22木罗烯 C15H24204.196.34423.31富马酸环己-3-烯基甲基十二烷基酯 C23H38O4378.284.67523.592-甲基-1-苯基-2-丙烯醇C10H12O148.095.32623.873,3-二甲基-2-(3,3-二甲基-1-丁炔-1-基)环丙烯甲酸C12H16O2192.127.85731.61N-(1,3-苯并二氧代-5-基)-2-(1H-咪唑并[4,5-b]吡啶-2-基巯基)乙酰胺C15H12N4O3S328.0610.75831.65β-生育酚 C28H48O2416.374.71932.89加尔巴辛C20H20O5340.133.551033.015,6-二甲氧基茚酮C11H12O3192.082.66
北五味子萃取物B经过GC-MS分析结果见图1及表3,共鉴定出96种化合物。其中相对含量超过2.5%的化合物有10种,占总挥发性成分的43.18%,主要为烃类、醇类、酯类、酮类和酚类和木脂素类等。含量较高的有:依兰烯(17.65%),2-[4-(1,3-二乙基-2,6-二氧代-2,3,6,7-四氢-1H-嘌呤-8-基)苯氧基]乙酸异丙酯(12.36%),长香酚酮(5.81%)、2-乙基-1-甲基-3,4-二氢萘-1,2-二醇(4.62%)、五味子醇甲(4.41%)、花柏烯(3.26%)等。
表3 萃取物B相对含量大于2.5%成分表
Table 3 Components with relative content of extract B greater than 2.5%

峰保留时间/min化合物分子式相对分子质量/(g/mol)相对含量/%117.72依兰烯 C15H24204.1917.65219.64花柏烯 C15H24204.193.26319.86α-香柠檬烯 C15H24204.198.43420.09花侧柏烯 C15H22202.172.98523.342-乙基-1-甲基-3,4-二氢萘-1,2-二醇C13H18O2206.134.62623.79长香酚酮 C15H22O218.175.81724.004-(2-methyl-2-propenyl)phenol 2-(2-甲基-2-丙烯基)-苯酚C10H12O148.092.93831.652-[(4-环己基丁基)氨基]-4-[(4-甲氧基苯基)亚氨基]-萘酮C27H32N2O2416.253.67932.212-(4-(1,3-二乙基-2,6-二氧代-2,3,6,7-四氢-1H-嘌呤-8-基)苯氧基)乙酸异丙酯C20H24N4O5400.1812.361032.60五味子醇甲C24H32O7432.214.41
北五味萃取物C经过GC-MS分析结果见图1及表4,共鉴定出164种化合物。其中相对含量超过2.5%的化合物有7种,占总挥发性成分的43.18%,主要为烃类、脂肪酸、酯类、酮类和木脂素类等。含量较高的有:五味子醇甲(11.35%)、油酸(7.79%)、顺式,顺式-亚油酸(7.55%)、山小星蒜碱(5.94%)、反式-2,4-癸二烯醛(4.16%)、2-[(4-环己基丁基)氨基]-4-[(4-甲氧基苯基)亚氨基]-萘酮(3.43%)、戈米辛A(2.96%)等。
表4 萃取物C相对含量大于2.5%成分表
Table 4 Components with relative content of extract C greater than 2.5%

峰保留时间/min化合物分子式相对分子质量/(g/mol)相对含量/%114.72反式-2,4-癸二烯醛C10H16O152.124.16227.21顺式,顺式-亚油酸 C18H32O2280.247.55327.25油酸C18H34O2282.267.79431.662-[(4-环己基丁基)氨基]-4-[(4-甲氧基苯基)亚氨基]-萘酮C27H32N2O2416.253.43532.22山小星蒜碱C22H28N2O5400.205.94632.62五味子醇甲C24H32O7432.2111.35733.20戈米辛A C23H28O7416.182.96
综上所述,南五味子和北五味子萃取物在化学组成上存在较大差异,其中木脂素和脂肪酸相对含量存在明显差异。
2.3 木脂素类成分含量测定结果
以乙腈和水为流动相,对混合标准品和供试品分别进行梯度洗脱,得到混合标准品和供试品溶液的HPLC图(图2),4种木脂素标准品的回归方程见表5。
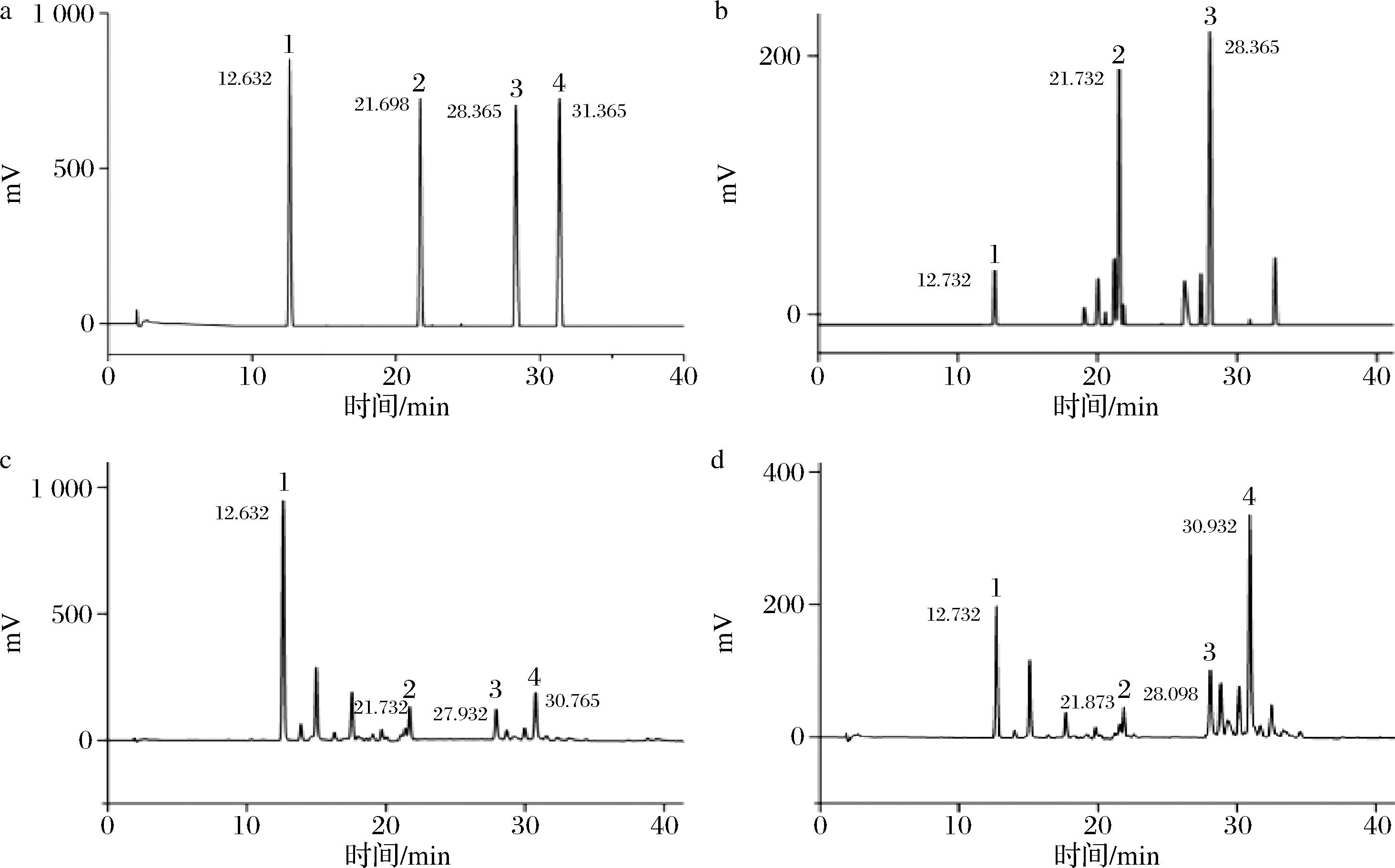
a-混合标准品;b-萃取物A;c-萃取物B;d-萃取物C
图2 混合标准品和供试品溶液HPLC图
Fig.2 HPLC diagram of mixed standard and test solutions
表5 木脂素线性回归方程及相关系数
Table 5 Linear regression equation and correlation coefficient of lignans

峰号化合物线性回归方程相关系数1五味子醇甲y=1E+08x-763 117R2=12五味子酯甲y=1E+08x-339 162R2=0.999 63五味子甲素y=1E+08x-419 048R2=0.999 94五味子乙素y=1E+08x-706 920R2=0.998 7
根据表中方程得出萃取物A中五味子醇甲、酯甲、甲素的含量分别为1.14%、2.30%、2.83%,其中五味子乙素未检出;萃取物B中五味子醇甲、酯甲、甲素分别为9.50%、1.60%、1.65%、2.40%;萃取物C中化合物含量1.30%、0.48%、0.95%、2.45%。萃取物C中木脂素类的含量在GC-MS和HPLC检测结果差距较大,可能是其中存在一些不易挥发的物质。结合GC-MS和HPLC数据,北五味子中五味子醇甲、五味子乙素和脂肪酸含量明显高于南五味子。
2.4 降糖活性结果
如表6所示,1 μmol/L胰岛素和25 mmol/L葡萄糖联合作用36 h,CK与IR组的葡萄糖消耗量差异极显著,表明高糖高胰岛素可诱导HepG2细胞产生IR。与IR组相比,阳性对照盐酸二甲双胍、萃取物A和B能够提高IR-HepG2细胞的葡萄糖消耗量,具有减轻IR的作用。其中5 μg/mL阳性对照组和25 μg/mL萃取物A差异极显著,25 μg/mL阳性对照组、5 μg/mL萃取物A和5 μg/mL萃取物B差异显著,且萃取物A和B的降糖活性呈剂量效应。不同浓度萃取物C组与IR组相比,葡萄糖消耗量差异不明显,没有减轻IR的作用。现有研究表明,五味子降糖的主要活性成分为五味子木脂素类和多糖,具有保护胰岛细胞,发挥抗氧化机制、调节脂质代谢从而降低血糖。南五味子萃取物A和北五味子萃取物中主要成分为木脂素类和挥发性精油,因此具有减轻IR的降糖活性。而北五味子萃取物C除含有木脂素类以外,还含有较多脂肪酸类物质,其能够降低外周组织对胰岛素的敏感性,加重IR。
表6 萃取物对HepG2细胞降糖活性的影响![]()
Table 6 Effect of the extract on the hypoglycemic activity of HepG2 cells ![]()
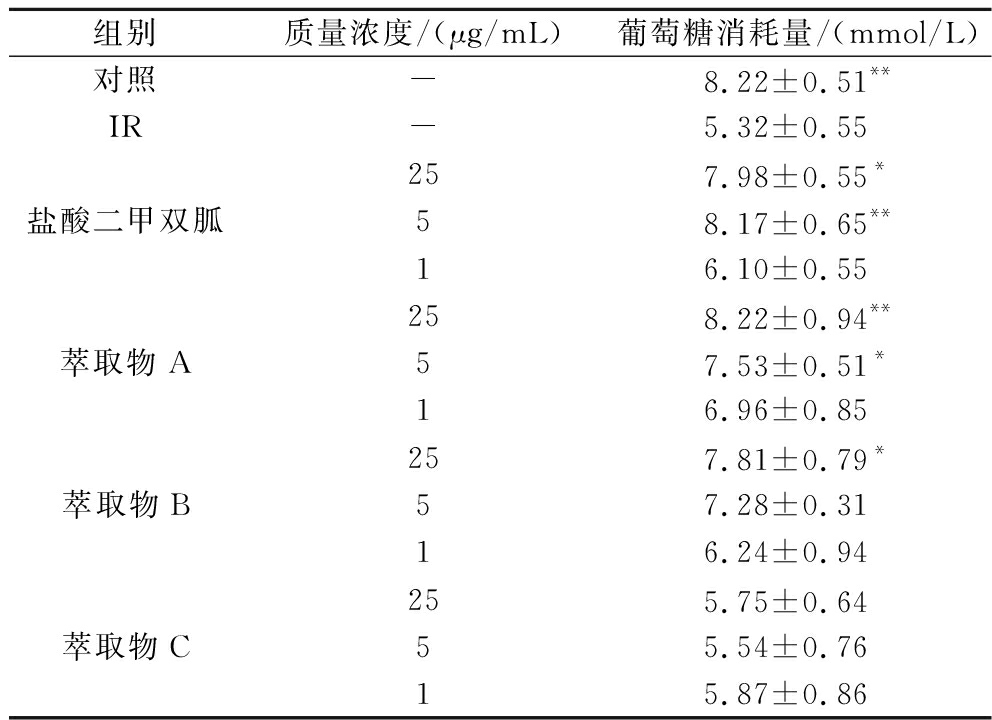
组别质量浓度/(μg/mL)葡萄糖消耗量/(mmol/L)对照-8.22±0.51**IR-5.32±0.55盐酸二甲双胍257.98±0.55*58.17±0.65**16.10±0.55萃取物A258.22±0.94**57.53±0.51*16.96±0.85萃取物B257.81±0.79*57.28±0.3116.24±0.94萃取物C255.75±0.64 55.54±0.7615.87±0.86
注:采用单因素ANOVA检验中LSD方差分析;与IR比较,*表示差异显著P<0.05);**表示差异极显著(P<0.01)。“-”表示未加药物。
2.5 抗氧化活性结果
如图3所示,根据各样品的方程计算得出维生素C、萃取物A、B、C的IC50分别为:4.96、46.77、3.95、7.63 mg/mL。北五味子萃取物B和C的抗氧化活性高于南五味子萃取物A。南北五味子样品均含有大量的木脂素类成分,具有抗氧化活性,但不同五味子木脂素类成分的抗氧化活性不同,北五味子的抗氧化活性高于南五味子。

图3 维生素C和供试品溶液对DPPH自由基的清除作用
Fig.3 Removal of DPPH radical by vitamin C and test solutions
3 结论
本文采用超临界CO2萃取同一产地南北五味子干燥果实,采用GC-MS和HPLC法分析其组成。南五味子萃取物主要含烃类、醇类、酯类、酮类、酚类和木脂素类等。北五味子萃取物分2层,主要含烃类、醇类、脂肪酸、酯类、酮类和酚类和木脂素类等。北五味子中五味子醇甲、五味子乙素及脂肪酸含量明显高于南五味子。南五味子萃取物降糖活性和北五味子上层萃取物能够减轻IR,且呈剂量效应,但含有较多脂肪酸的北五味子下层萃取物没有降糖活性。抗氧化活性实验结果表明北五味子抗氧化活性明显高于南五味子。
[1] 谭晓虹, 田嘉铭, 杨辉, 等.南五味子有效成分及其药理作用的研究进展[J].神经药理学报, 2014, 4(6):28-32.TAN X H, TIAN J M, YANG H, et al.Research progress on chemical constituents in Schisandra sphenanthera Rehd.et Wils.and its pharmacological activities[J].Acta Neuropharmacologica, 2014, 4(6):28-32.
[2] 马嘉慕, 刘晓云, 任雪阳, 等.基于AHP-SOM聚类-TOPSIS的白及保胃护肝保健食品配方设计与评价[J].中草药, 2021, 52(18):5676-5687.MA J M, LIU X Y, REN X Y, et al.Formula design and evaluation of health food with protection of gastric mucosa and liver of Bletillae Rhizoma based on AHP-SOM-TOPSIS algorithm[J].Chinese Traditional and Herbal Drugs, 2021, 52(18):5676-5687.
[3] 国家药典委员会. 中华人民共和国药典(一部)[M].北京:中国医药科技出版社, 2010, 65.Chinese Pharmacopoeia Commission.Pharmacopoeia of People’s Repubic of China (Vol I) [M].Beijing:China Medical Science Press, 2020, 65.
[4] 王卫明, 刘亮, 彭慧, 等.南五味子和五味子的基原考证和现代研究[J].中华中医药杂志, 2019, 34(7):3220-3223.WANG W M, LIU L, PENG H, et al.Textual research and modern research of Schisandrae sphenantherae Fructus and Schisandrae chinensis Fructus[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(7):3220-3223.
[5] 邢楠楠, 屈怀东, 任伟超, 等.五味子主要化学成分及现代药理作用研究进展[J].中国实验方剂学杂志, 2021, 27(15):210-218.XING N N,QU H D,REN W C, et al.Main chemical constituents and modern pharmacological action of Schisandrae chinensis Fructus:A review[J].Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(15):210-218.
[6] 李晓博, 胡文忠, 李婧, 等.五味子果实的功能作用及主要活性成分研究进展[J].食品工业科技, 2016, 37(4):386-390.LI X B,HU W Z,LI J,et al.Review on the extraction of main effective active ingredients and function of Schisandra chinensis(Turcz.)Baill[J].Science and Technology of Food Industry, 2016, 37(4):386-390.
[7] 张明晓, 黄国英, 白羽琦, 等.南、北五味子的化学成分及其保肝作用的研究进展[J].中国中药杂志, 2021, 46(5):1017-1025.ZHANG M X, HUANG G Y, BAI Y Q, et al.Research advances in chemical constituents and hepatoprotective effect of Schisandrae sphenantherae Fructus and Schisandrae chinensis Fructus[J].China Journal of Chinese Materia Medica, 2021, 46(5):1017-1025.
[8] 梁华, 彭博伟, 王燕, 等.五味子有效成分的降糖作用及机制研究探析[J].辽宁中医药大学学报, 2021, 23(8):1-5.LIANG H, PENG B W, WANG Y, et al.Research analysis of hypoglycemic effect and mechanism of Wuweizi (Schisandre chinensis fructus) active components[J].Journal of Liaoning University of Traditional Chinese Medicine, 2021, 23(8):1-5.
[9] JIN D, ZHAO T, FENG W W, et al.Schisandra polysaccharide increased glucose consumption by up-regulating the expression of GLUT-4[J].International Journal of Biological Macromolecules, 2016, 87:555-562.[10] LI X K, LI M Y, DENG S, et al.A network pharmacology-integrated metabolomics strategy for clarifying the action mechanisms of Schisandrae chinensis Fructus for treating drug-induced liver injury by acetaminophen[J].Bioorganic &Medicinal Chemistry, 2021, 31:115992.
[11] CHEN X, CAO J H, SUN Y, et al.Ethanol extract of Schisandrae chinensis Fructus ameliorates the extent of experimentally induced atherosclerosis in rats by increasing antioxidant capacity and improving endothelial dysfunction[J].Pharmaceutical Biology, 2018, 56(1):612-619.
[12] LI N, LIU J L, WANG M Y, et al.Sedative and hypnotic effects of Schisandrin B through increasing GABA/Glu ratio and upregulating the expression of GABA A in mice and rats[J].Biomedicine &Pharmacotherapy, 2018, 103:509-516.
[13] YUAN R S, TAO X, LIANG S, et al.Protective effect of acidic polysaccharide from Schisandra chinensis on acute ethanol-induced liver injury through reducing CYP2E1-dependent oxidative stress[J].Biomedicine &Pharmacotherapy, 2018, 99:537-542.
[14] 张金朋, 郭晓帆, 杨园园, 等.UPLC同时测定五味子木脂素纯化物中15个化学成分的含量[J].药物分析杂志, 2022, 42(10):1697-1707.ZHANG J P,GUO X F,YANG Y Y,et al.Simultaneous determination of fifteen components in purified lignans from Schisandrae chinensis Fructus by UPLC[J].Chinese Journal of Pharmaceutical Analysis, 2022, 42(10):1697-1707.
[15] 刘子祯, 姜蕊, 许冬瑾.醋五味子配方颗粒的特征图谱建立及5种成分的含量测定[J].中国药房, 2021, 32(12):1453-1459.LIU Z Z,JIANG R,XU D J.Establishment of characteristic pattern of vinegar-processed Schisandra chinensis formula granules and content determination of 5 components[J].China Pharmacy, 2021, 32(12):1453-1459.
[16] 郭良君, 郑巍, 王翔, 等.不同产地南五味子和北五味子中2种三萜酸的含量测定[J].第二军医大学学报, 2021, 42(1):107-111.GUO L J, ZHENG W, WANG X, et al.Determination of two triterpenoid acids in Schisandra sphenanthera and Schisandra chinensis from different habitats[J].Academic Journal of Second Military Medical University, 2021, 42(1):107-111.
[17] 陈舒妤, 石婧婧, 邹立思, 等.UFLC-Q-TRAP-MS/MS同时测定五味子中木脂素及有机酸类成分[J].中国中药杂志, 2018, 43(10):2104-2111.CHEN S Y, SHI J J, ZOU L S, et al.Simultaneous determination of lignans and organic acids in Schisandrae chinensis Fructus by UFLC-Q-TRAP-MS/MS[J].China Journal of Chinese Materia Medica, 2018, 43(10):2104-2111.
[18] 董家潇, 郑巍, 孙亮, 等.北五味子果实低极性化学成分的GC-MS分析[J].解放军药学学报, 2017, 33(5):391-395.DONG J X, ZHENG W, SUN L, et al.GC-MS analysis of low-polarity components from fruits of Schisandra chinensis(Turcz.)Baill[J].Pharmaceutical Journal of Chinese PLA, 2017, 33(5):391-395.
[19] 刘亚敏, 刘玉民, 李鹏霞.超临界CO2流体萃取-GC-MS分析南北五味子挥发油成分[J].食品科学, 2011, 32(6):204-208.LIU Y M,LIU Y M,LI P X.Composition analysis of volatile oils from Schisandra spenanthera Rehd.et Wils.and Schisandra chinensis (Turcz) Baill.by supercritical CO2fluid extraction and GC-MS[J].Food Science, 2011, 32(6):204-208.
[20] 谢旭东, 穆淑珍, 沈晓华, 等.北五味子总木脂素的GC-MS分析及其生物活性[J].中国实验方剂学杂志, 2016, 22(2):33-37.XIE X D, MU S Z, SHEN X H, et al.GC-MS analysis and bioactivity of total lignans from Schisandrae chinensis Fructus[J].Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(2):33-37.
[21] 李昕, 聂晶, 高正德, 等.超声微波协同水蒸气蒸馏-GC-MS分析南、北五味子挥发油化学成分[J].食品科学, 2014, 35(8):269-274.LI X, NIE J, GAO Z D, et al.Analysis of volatile oils from fruits of Schisandra chinensis (Turcz.) Baill and Schisandra sphenanthera Rehd.et Wils.by ultrasonic-microwave assisted steam distillation coupled with gas chromatography-mass spectrometry[J].Food Science, 2014, 35(8):269-274.
[22] 魏斌斌, 陈晓辉, 苏丹, 等.北五味子油中五味子甲素与五味子乙素的RP-HPLC测定[J].药物分析杂志, 2009, 29(12):2061-2063.WEI B B, CHEN X H, SU D, et al.RP-HPLC determination of deoxyschizandrin and γ-schizandrin in Schisandra chinensis (Turcz.) Baill.oil[J].Chinese Journal of Pharmaceutical Analysis, 2009, 29(12):2061-2063.
[23] 向智敏, 李会林, 张骊.五味子超临界CO2提取物的气相色谱质谱分析[J].色谱, 2003, 21(6):568-571.XIANG Z M, LI H L, ZHANG L.Study on supercritical carbon dioxide extract from Schisandra chinensis by gas chromatography-mass spectrometry[J].Chinese Journal of Chromatography, 2003, 21(6):568-571.
[24] 程振玉, 杨英杰, 刘治刚, 等.高效液相色谱法测定北五味子中5种木脂素含量[J].理化检验(化学分册), 2014, 50(5):575-578.CHENG Z Y YANG Y J, LIU Z G, et al.HPLC determination of 5 lignans in Schisandra chinensis (Turcz.) Baill[J].Physical Testing and Chemical Analysis(Part B:Chemical Analysis),2014, 50(5):575-578.
[25] 费烨, 王雍, 龚仕英, 等.苦荞清蛋白酶解物对高糖诱导的HepG2细胞胰岛素抵抗的保护作用[J].食品科学, 2021, 42(1):222-227.FEI Y, WANG Y, GONG S Y, et al.Protective effect of Tartary buckwheat albumin hydrolysate on high glucose induced insulin resistance in HepG2 cells[J].Food Science, 2021, 42(1):222-227.
[26] 李启思, 王雅玲, 邓玉华, 等.五味子木脂素超声提取工艺优化及其抗氧化和抗真菌的潜力[J].浙江农业学报, 2021, 33(11):2145-2154.LI Q S, WANG Y L, DENG Y H,et al.Optimization of ultrasonic extraction technology of Shisandra lignans and its anti-oxidant and anti-fungi potentials[J].Acta Agriculturae Zhejiangensis, 2021, 33(11):2145-2154.