阿尔茨海默病(Alzheimer’s disease,AD)是一种多因素引起的进行性发展的神经系统退行性疾病,临床表现从无症状逐渐发展为轻度认知障碍(mild cognitive impairment, MCI),进而继续发展成为AD[1]。AD是全球医学研究和公共卫生系统的主要难题之一,目前该病的流行人数已接近5 000万[2],对公共健康有相当大的影响。
桑葚(Morus),桑科桑葚属(Morus alba L.),是一种药食同源食物,现代研究表明,桑葚中含有丰富的酚类、黄酮类、维生素等活性成分[3],具有抗肿瘤、抗氧化、抑制炎症因子等作用[4-6]。多项研究已经证明桑葚具有改善AD小鼠模型或AD果蝇模型细胞中β-淀粉样蛋白低聚物诱导的细胞毒性或促进β-淀粉样蛋白低聚物清除等有效作用[7-8],由于AD的完整发病机制过于复杂且尚未确定,而且主流药物比如乙酰胆碱酯酶抑制剂等都是以缓解症状为目的,作用靶点单一且长期服用会引起副作用和成瘾性[9-10]。因此进行多活性成分、多靶点、多通路的抗AD研究就成为必要的研究方向及热点。
鉴于此,本文以新疆不同产地的黑桑作为研究对象,采用HPLC建立指纹图谱,对主要化学成分进行指认并通过不同化学模式识别方法对黑桑质量差异进行探讨,结合网络药理学和分子对接技术进行分析,目的是获取黑桑治疗AD的核心作用靶点、核心活性成分、作用信号通路,并通过分子对接技术研究核心靶点与核心活性成分的空间结构相互作用,为黑桑防治AD提供一定的理论基础。
1 材料与方法
1.1 材料的制备
黑桑为自采,经新疆医科大学肖辉教授鉴定均为黑桑。采收的新鲜黑桑以内置冰袋的泡沫保温箱及时运回实验室处理,标本保存于新疆医科大学协同创新实验楼1406室。样品信息见表1。
表1 黑桑样品信息
Table 1 information of black mulberry samples
编号采集时间产地S12022.5托克逊S22022.5吐鲁番S32022.5鄯善S42022.5温宿S52022.5库车S62022.5阿瓦提S72022.5喀什S82022.5莎车S92022.5和田S102022.5于田S112022.6英吉沙S122022.6奇台
1.2 仪器与设备
Waters ACQUITY UPLC H-CLASS高效液相色谱仪,沃特世科技有限公司;Agilent TC-C18色谱柱(250 mm×4.6 mm,5 μm)、MS205DU型电子分析天平,梅特勒托利多集团;KQ-600 KED型数控超声波清洗器,昆山市超声仪器有限公司;3-30K型离心机,德国Sigma公司;U2型超纯水仪,四川优普超纯科技有限公司。
1.3 数据库及软件
中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform, TCMSP)(https://old.tcmsp-e.com/tcmsp.php)、Swiss Target Prediction平台(http://www.swisstargetprediction.ch/)、UniProt数据库(https://www.uniprot.org/)、Gene Cards数据库(https://www.genecards.org/)、AD专属数据库(Chemogenomics Database for Alzheimer’s Disease)(https://www.cbligand.org/AD/target_list.php)、String(Search Tool for the Retrieval of Interacting Genes/Proteins, String)数据库(https://cn.string-db.org/)、Cytoscape3.7.2、R 4.2.2、Auto Dock软件、Pymol软件。
1.4 实验方法
1.4.1 色谱条件
色谱柱:Agilent TC-C18(4.6 mm×250 mm,5 μm);流动相:A相为乙腈,B相为0.1%磷酸水溶液(体积分数);梯度洗脱(0~6 min,10%~12% A;6~25 min,12%~45% A;25~26 min,45%~10% A);检测波长260 nm;流速1.0 mL/min;柱温40 ℃;进样量10 μL。
1.4.2 供试品溶液制备
称取试样5.00 g(精确到0.01 g)于50 mL聚四氟乙烯离心管中,加入25 mL 75%(体积分数)乙醇溶液。用漩涡混合器充分混合,室温下超声提取60 min,以7 000 r/min转速、4 ℃离心10 min,重复提取1次,上清液合并转人50 mL离心管中。约50 mL提取液在旋转蒸发器上减压蒸发至1~2 mL,温度55 ℃。50%(体积分数)甲醇复溶,定容至5 mL。过0.22 μm有机相微孔滤膜,供高效液相色谱测定。
1.4.3 单标对照品制备
分别精密称取绿原酸、芦丁、阿魏酸标准品适量,甲醇溶解并定容,配制质量浓度为1 mg/mL的贮备液,于-20 ℃下保存备用。另分别取各储备液适量,以50%甲醇定容至5 mL作为混合对照品溶液。
2 结果与分析
2.1 方法学考察
2.1.1 精密度考察
取黑桑样品的供试品溶液,按1.4.1节色谱条件连续进样6针,记录色谱图,选择保留时间适中、峰面积大小适宜的芦丁共有峰(6号峰)作为参照峰,测得7个共有峰相对保留时间相对标准偏差(relative standard deviation,RSD)值为0.01%~0.13%,相对峰面积RSD值为0.42%~1.08%,均在2%以下,说明仪器和方法的精密度良好,可以用于黑桑指纹图谱的测定。
2.1.2 重复性考察
取黑桑样品适量,平行制备6份供试品溶液,分别按1.4.1节色谱条件进行测定,以芦丁(6号峰)作为参照峰,测得各共有峰相对保留时间RSD值范围为0.03%~0.33%,相对峰面积RSD值范围为0.9%~2.86%,表明本方法的重复性良好。
2.1.3 稳定性考察
取黑桑样品的供试品溶液,在室温下放置0、2、4、8、12、24 h,分别按1.4.1节色谱条件进行测定,以6号峰作为参照峰,测得各共有峰相对保留时间RSD值为0.03%~0.33%,相对峰面积RSD值为0.99%~2.87%,表明黑桑供试品溶液在室温下放置24 h内稳定性良好。
2.2 黑桑指纹图谱结果与分析
2.2.1 黑桑指纹图谱的建立及共有峰的标定
将指纹图谱数据导入《中药色谱指纹图谱相似度评价系统》(2012A)中进行分析,选取S1为参照图谱,时间窗设置为0.2 min,选择中位数法进行MARK峰匹配,生成对照指纹图谱(R),12批黑桑样品的叠加指纹图谱和对照指纹图谱见图1。指纹图谱共生成7个共有峰,通过与单标对照品溶液色谱图对比,指认了其中3个峰,分别是2号峰绿原酸、6号峰芦丁和7号峰阿魏酸。
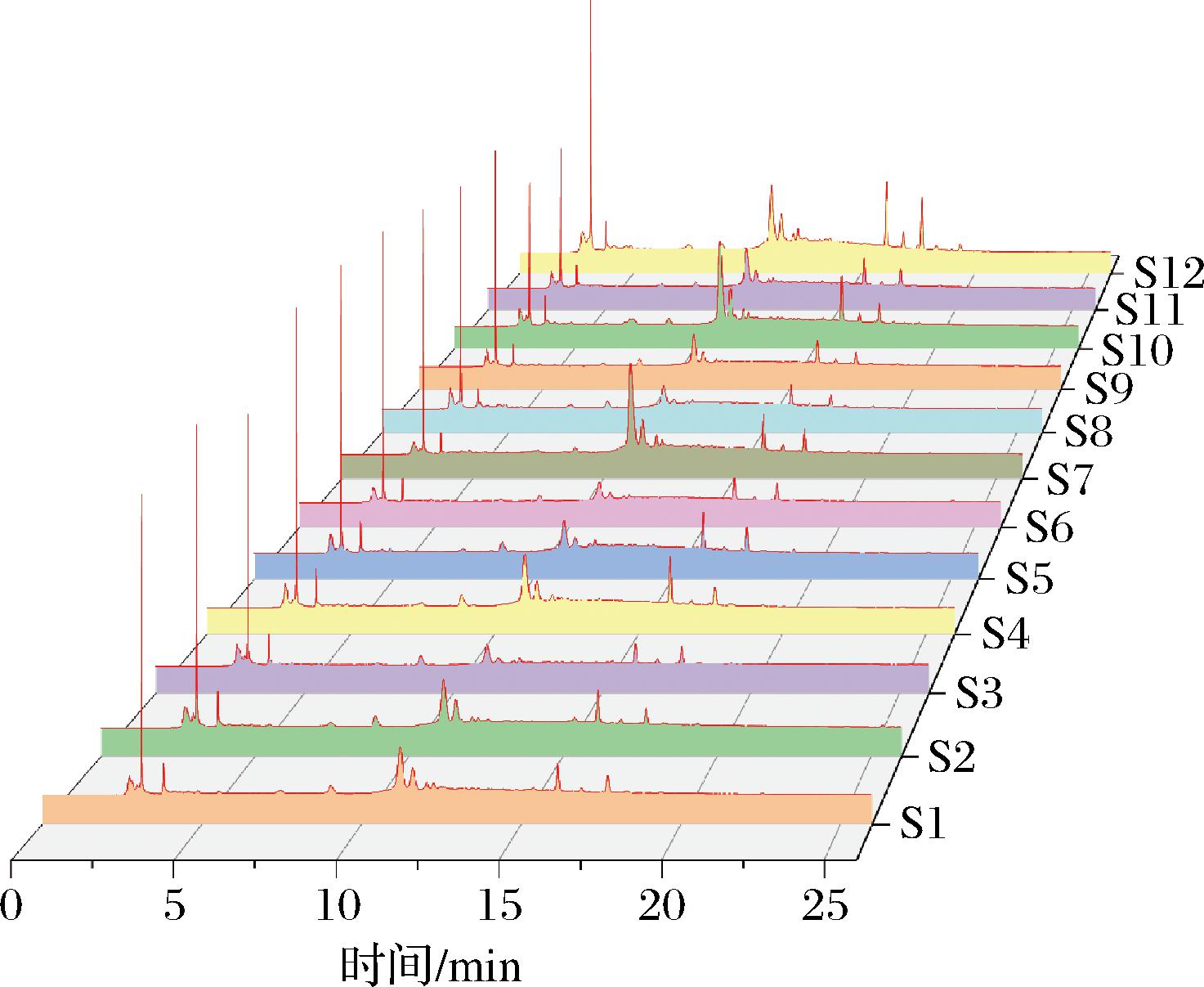
图1 十二批黑桑HPLC叠加图谱
Fig.1 HPLC of 12 batches of black mulberry samples
2.2.2 相似度评价
通过《中药色谱指纹图谱相似度评价系统》(2012A),以生成的对照指纹图谱(R)为标准进行相似度的计算,结果见表2。12批黑桑样品图谱与对照指纹图谱之间的相似度结果在0.965~0.998之间,结果显示不同产地之间黑桑具有很高的一致性,符合指纹图谱分析的结果。
表2 十二批黑桑的HPLC指纹图谱相似度评价
Table 2 HPLC fingerprint similarity evaluation of 12 batches of black mulberry samples
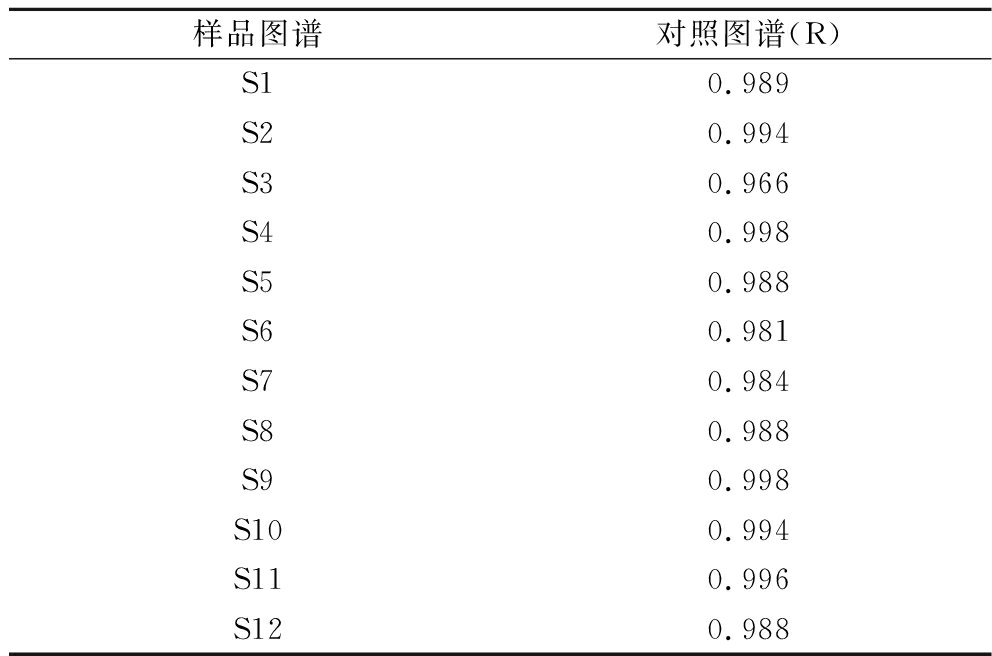
样品图谱对照图谱(R)S10.989S20.994S30.966S40.998S50.988S60.981S70.984S80.988S90.998S100.994S110.996S120.988
2.2.3 聚类分析
将12个不同产地的黑桑的7个共有峰绝对峰面积作为变量,导入SPSS 26.0软件,经过Z值矫正后,采用组间联接和平方欧氏距离法进行聚类分析,当设定判别欧氏距离选择为13时,12个样品中托克逊(S1)、吐鲁番市(S2)、鄯善(S3)、温宿(S4)、库车(S5)、阿瓦提(S6)、莎车(S8)、和田市(S9)聚为一类,喀什(S7)、于田(S10)和英吉沙(S11)聚为一类,奇台(S12)聚为一类,将结果导入Origin 2021软件绘制聚类分析热图结果见图2。

图2 十二批黑桑样品聚类分析热图
Fig.2 Heatmap of cluster analysis of 12 batches of black mulberry samples
2.2.4 主成分分析
为综合评价不同批次黑桑样品的质量,将12个不同产地的黑桑的7个共有峰绝对峰面积作为变量,导入SPSS 26.0软件进行主成分分析,结果显示巴特利特球形度测度KMO值(kaiser-meyer-olkin measure of sampling adequacy, KMO)为0.518,巴特利特球形检验得到统计量为99.395,P值<0.001。以特征值>1作为提取条件,前2个主成分累计贡献率为80.765%,提取作为主成分,见表3。图3是主成分的碎石图,结合特征根曲线的拐点及特征根值,前2个主成分的折线坡度较陡,后面逐渐趋于平缓。
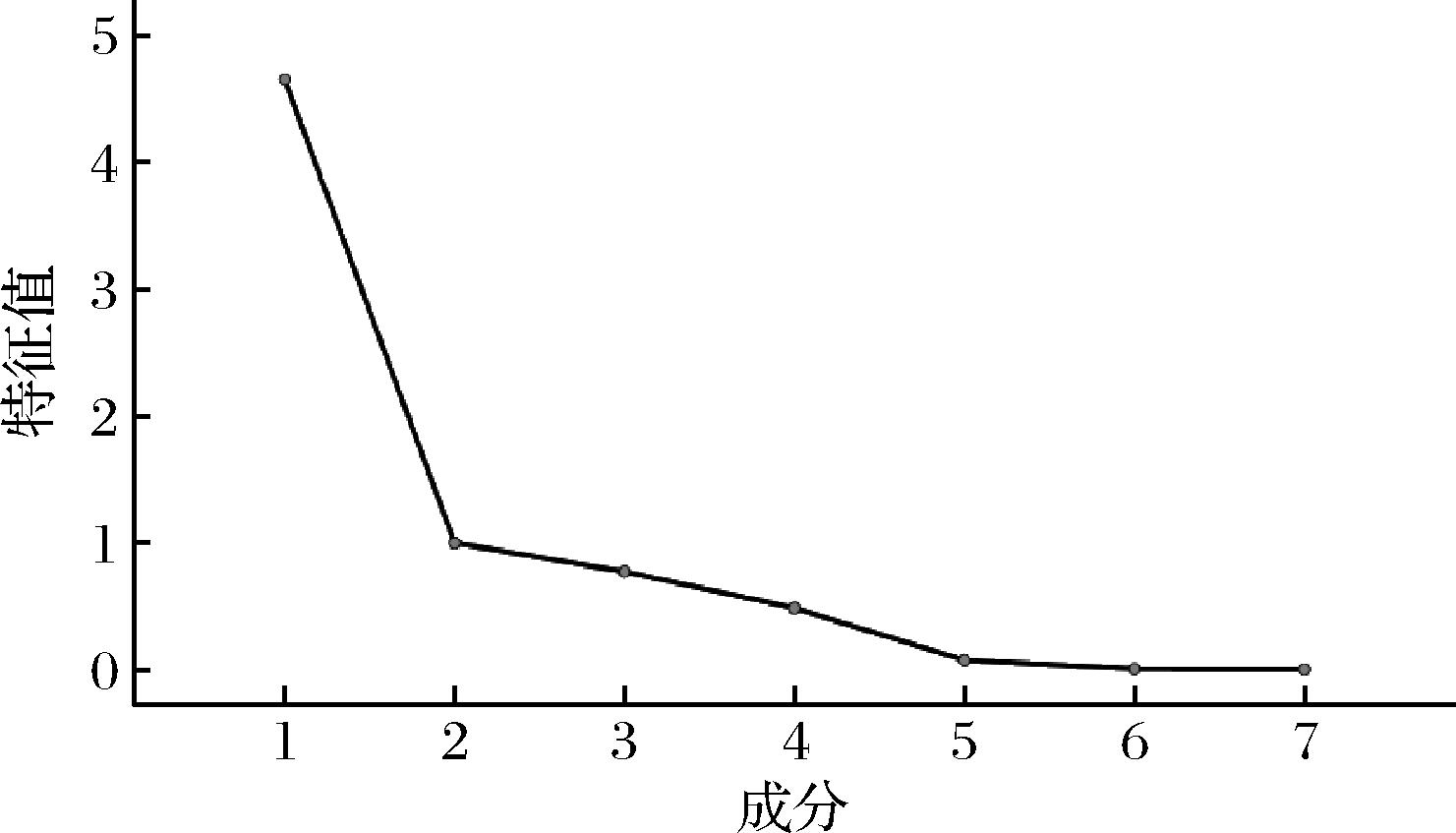
图3 碎石图
Fig.3 Lithotripsy diagram
表3 黑桑样品主成分分析相关系数特征值和累计方差贡献率表
Table 3 Correlation coefficient characteristic value and cumulative variance contribution rate in principal component analysis of black mulberry samples
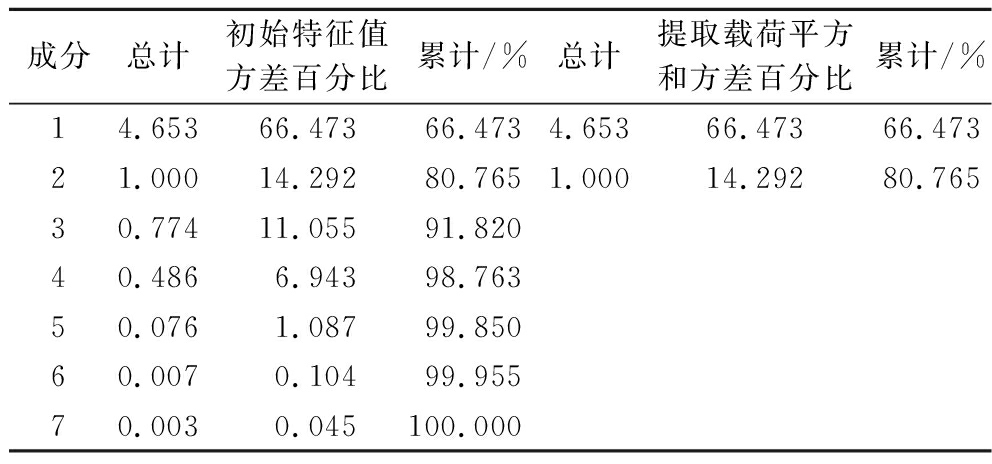
成分总计初始特征值方差百分比累计/%总计提取载荷平方和方差百分比累计/%14.65366.47366.4734.65366.47366.47321.00014.29280.7651.00014.29280.76530.77411.05591.82040.4866.94398.76350.0761.08799.85060.0070.10499.95570.0030.045100.000
各变量对主成分的影响程度和作用方向可由主成分载荷矩阵来表示,根据因子载荷矩阵(表4),第1主成分的信息主要来自F2(绿原酸)、F3、F4、F5、F6(芦丁)和F7(阿魏酸);第2主成分的信息主要来自F1。
表4 黑桑主要成分旋转后因子载荷矩阵
Table 4 Factor load matrix after rotation of the main components of black mulberry
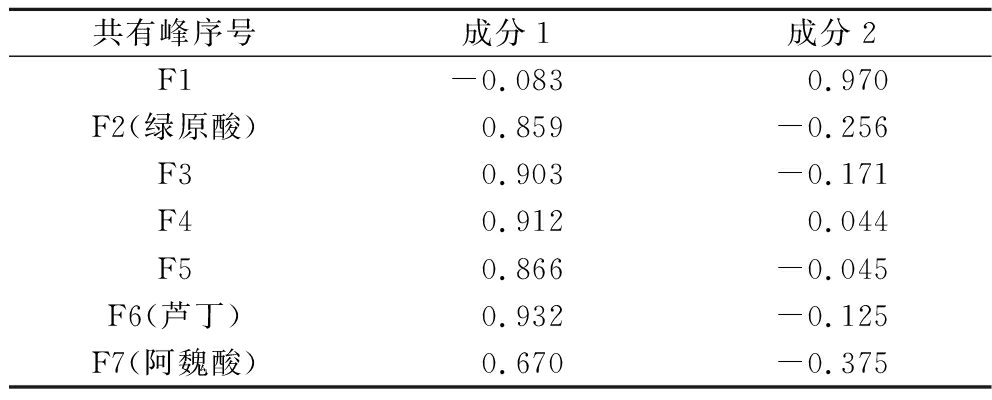
共有峰序号成分1成分2F1-0.083 0.970F2(绿原酸)0.859-0.256F30.903-0.171F40.9120.044F50.866-0.045F6(芦丁)0.932-0.125F7(阿魏酸)0.670-0.375
用提取的2个主成分对不同批的黑桑样品进行因子旋转综合评价,将数据标准化,以得到的特征向量与标准化数据相乘,得到主成分表达式,以主成分分析所得的贡献率为权重得到主成分综合模型,表5是12批黑桑样品的综合得分情况,可以得知不同产地的黑桑的综合水平中于田最高,阿瓦提最低。
表5 十二批黑桑样品综合得分表
Table 5 Comprehensive score table of 12 batches of black mulberry samples
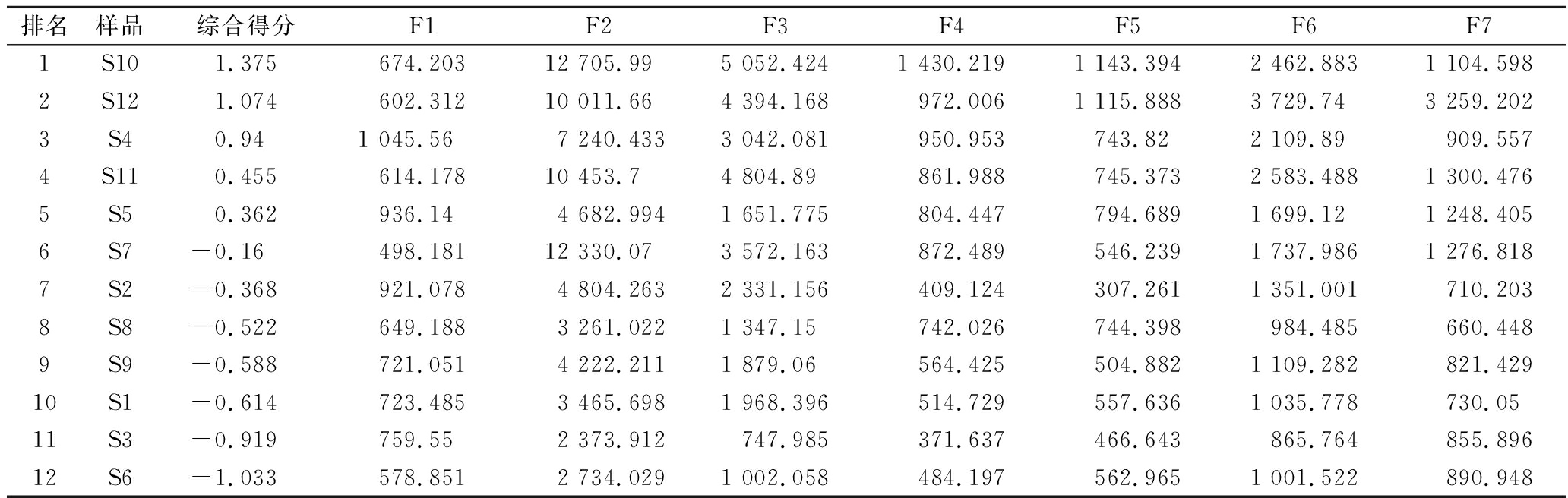
排名样品综合得分F1F2F3F4F5F6F71S101.375674.20312 705.995 052.4241 430.2191 143.3942 462.8831 104.5982S121.074602.31210 011.664 394.168972.0061 115.8883 729.743 259.2023S40.941 045.567 240.4333 042.081950.953743.822 109.89909.5574S110.455614.17810 453.74 804.89861.988745.3732 583.4881 300.4765S50.362936.144 682.9941 651.775804.447794.6891 699.121 248.4056S7-0.16498.18112 330.073 572.163872.489546.2391 737.9861 276.8187S2-0.368921.0784 804.2632 331.156409.124307.2611 351.001710.2038S8-0.522649.1883 261.0221 347.15742.026744.398984.485660.4489S9-0.588721.0514 222.2111 879.06564.425504.8821 109.282821.42910S1-0.614723.4853 465.6981 968.396514.729557.6361 035.778730.0511S3-0.919759.552 373.912747.985371.637466.643865.764855.89612S6-1.033578.8512 734.0291 002.058484.197562.9651 001.522890.948
2.2.5 正交偏最小二乘法判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)
为进一步筛选引起不同批次黑桑特征差异的标志性成分,将共有峰绝对峰面积作为变量导入SIMCA软件中构建正交偏最小二乘法分析模型,构建的模型参数是R2X=0.908,R2Y=0.967,Q2=0.897,结果十分接近1,说明使用此模型进行预测的结果稳定可靠。从OPLS-DA得分图中可以看出12个样品明显聚为3类,见图4。可以与上述聚类分析结果进行相互印证。
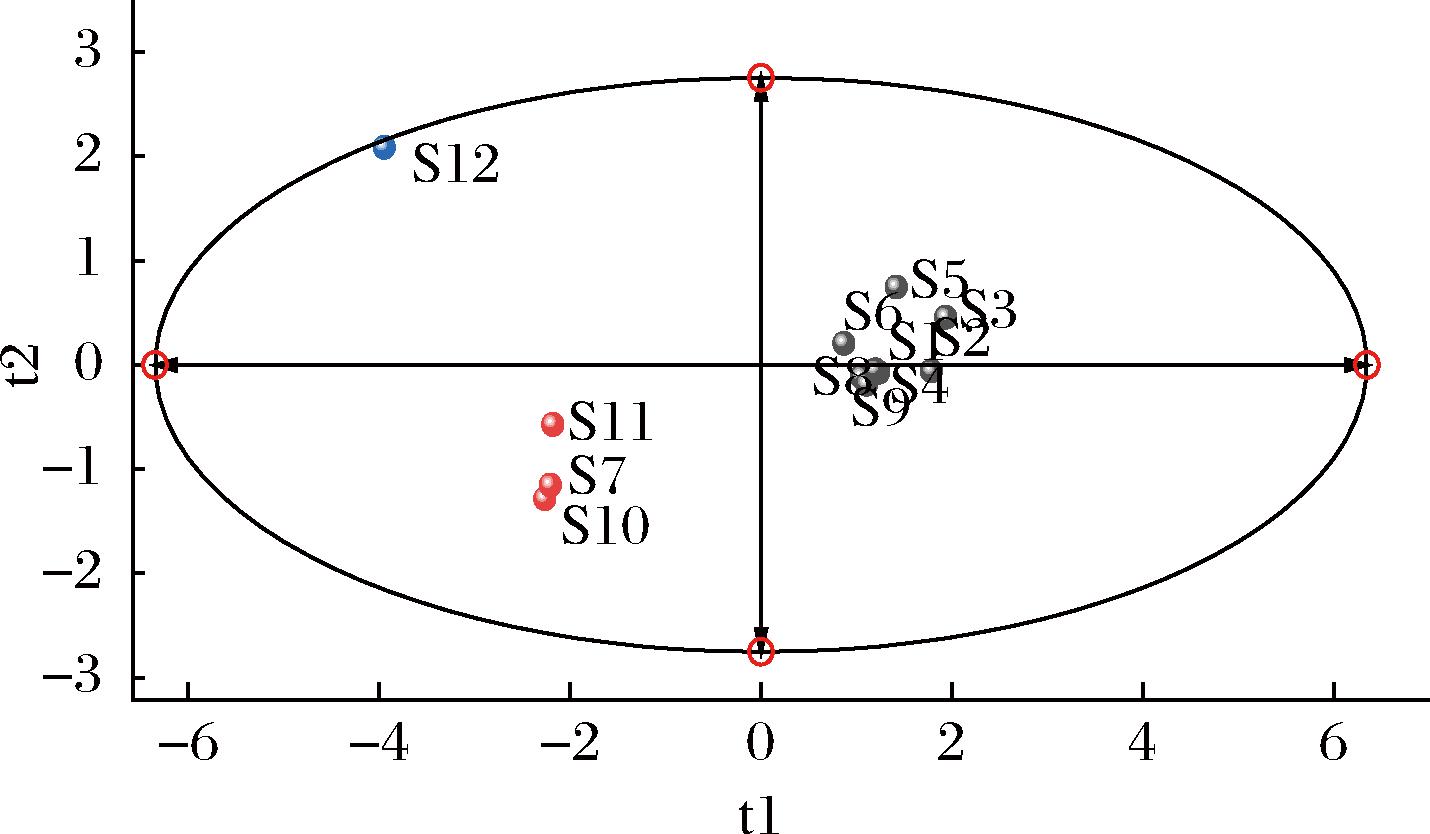
图4 正交偏最小二乘判别分析得分图
Fig.4 Quadrature partial least squares discriminant analysis score chart
将正交偏最小二乘法分析模型随机进行200次置换检验,得到的结果如图5,显示R2和Q2截距值分别为0.202和-0.868,所有位于左边的R2和Q2值均低于其最右边的值,且Q2为负值,说明该模型没有出现过拟合,具有很好的可靠性。对OPLS-DA得到的结果继续分析,可以得到变量重要性投影值(variable importance in projection,VIP)图,见图6,以VIP>1作为标准,可以得到4个差异标志物,影响程度由高到低依次是色谱峰7、色谱峰2、色谱峰6和色谱峰3。
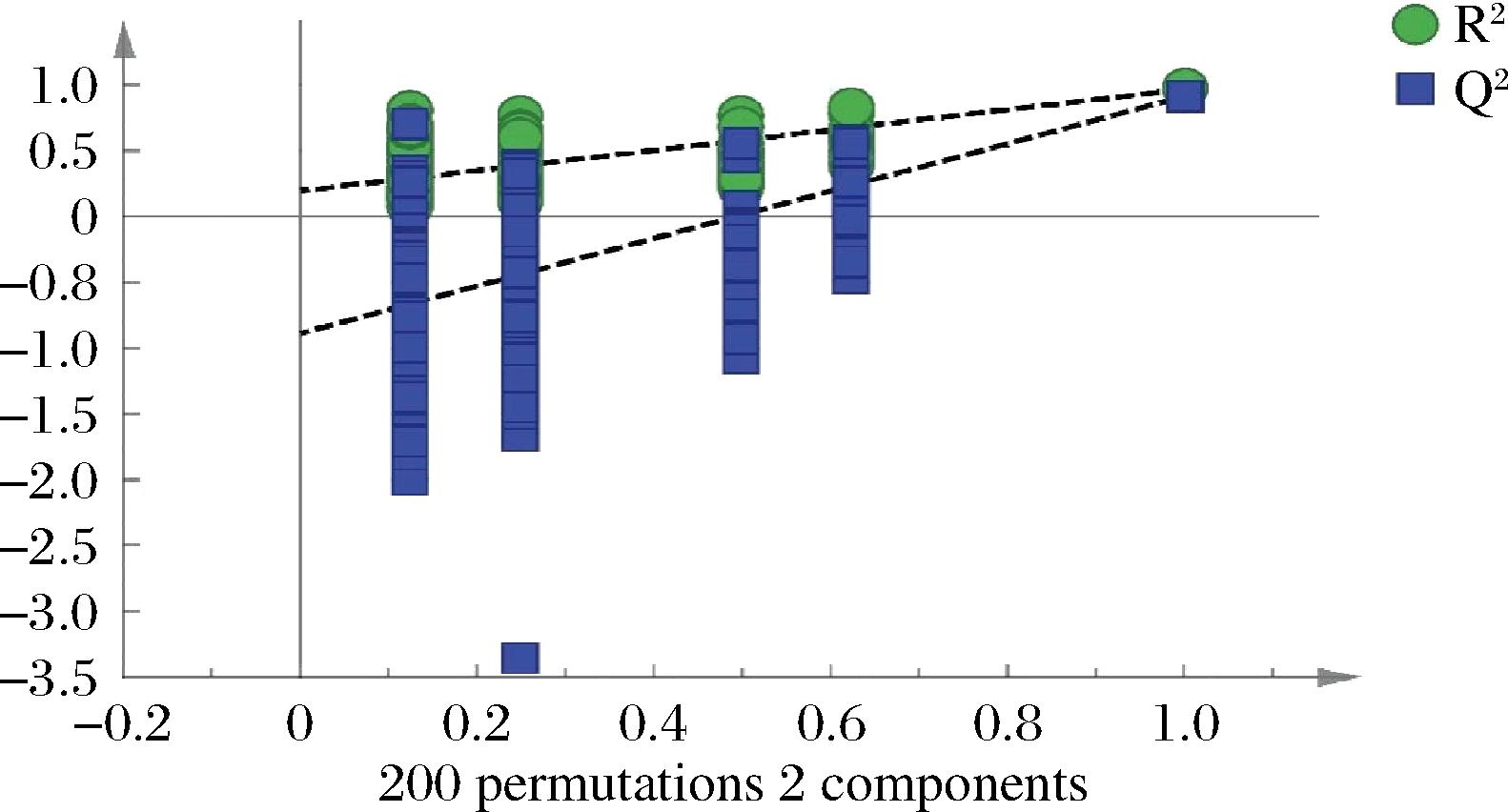
图5 OPLS-DA模型置换验证图
Fig.5 Diagram for verification of OPLS-DA model replacement
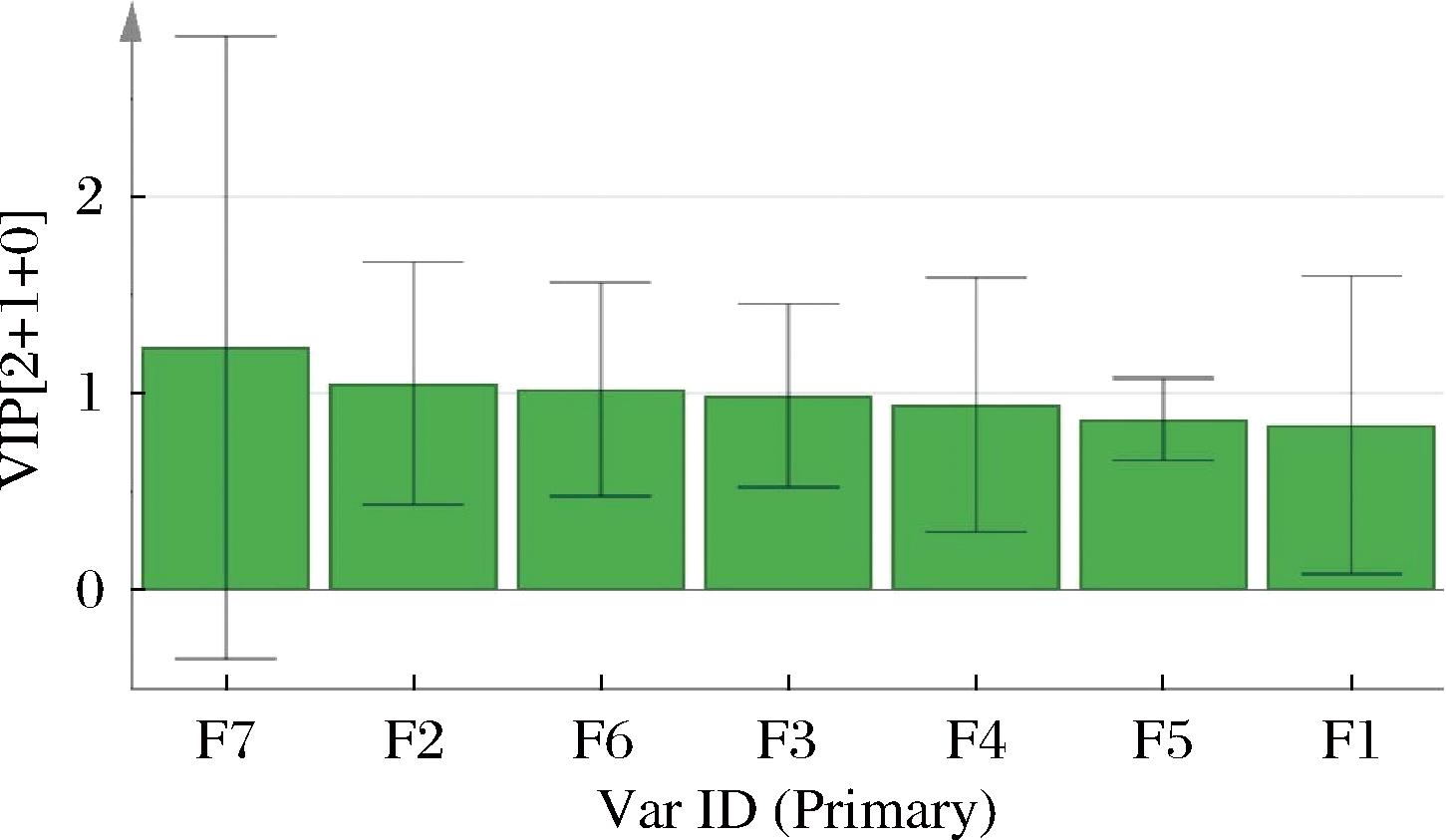
图6 OPLS-DA模型的VIP分析
Fig.6 VIP values of OPLS-DA model
2.2.6 TOPSIS分析
黑桑中7个特征峰面积均是越大越优型数据,进行正向项归一化指标处理,以OPLS-DA中影响黑桑化学成分差异的VIP值作为各指标权重(Wj),将归一化后数据与Wj相乘得加权决策矩阵。根据加权决策矩阵得到最优方案和最劣方案(Z均为0)计算12批黑桑样品的D+(与正理想解距离)、D-(与负理想解的距离)及综合得分指数,得表6。结果显示奇台、于田、英吉沙、温宿、喀什、库车、吐鲁番排名前7,与因子旋转综合评价得到的综合评价得分结果相一致,可以相互印证。
表6 十二批黑桑TOPSIS分析结果
Table 6 TOPSIS analysis results of 12 batches of black mulberry samples
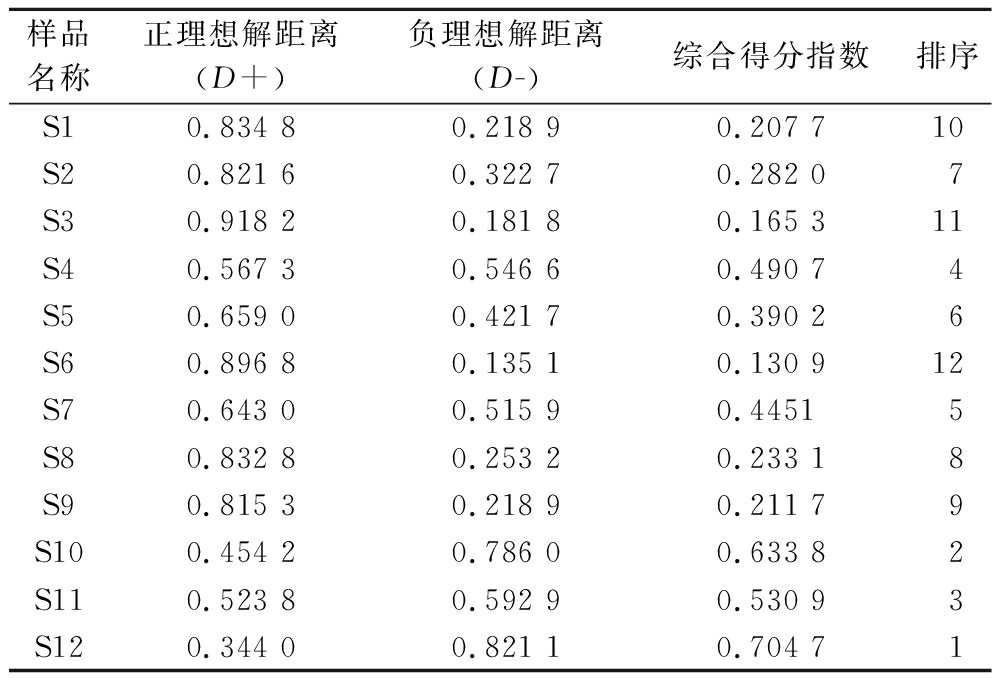
样品名称正理想解距离(D+)负理想解距离(D-)综合得分指数排序S10.834 80.218 90.207 710S20.821 60.322 70.282 07S30.918 20.181 80.165 311S40.567 30.546 60.490 74S50.659 00.421 70.390 26S60.896 80.135 10.130 912S70.643 00.515 90.44515S80.832 80.253 20.233 18S90.815 30.218 90.211 79S100.454 20.786 00.633 82S110.523 80.592 90.530 93S120.344 00.821 10.704 71
2.3 网络药理学及分子对接
2.3.1 黑桑潜在活性成分及黑桑靶点的筛选
将通过指纹图谱实验指认的3个活性成分作为黑桑的潜在活性成分,并结合中药系统药理学数据库与分析平台TCMSP(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform)和Swiss Target Prediction平台进行黑桑活性成分检索。TCMSP中以桑葚为关键词进行检索。筛选满足OB(口服利用度)≥30%和DL(类药性)≥0.18的主要活性成分。在Swiss Target Prediction平台中筛选Probability*>0的靶点信息,最终得到8个活性成分和349个基因靶点信息,通过利用Cytoscape3.7.2软件绘制出黑桑活性化合物-靶点网络图,见图7。
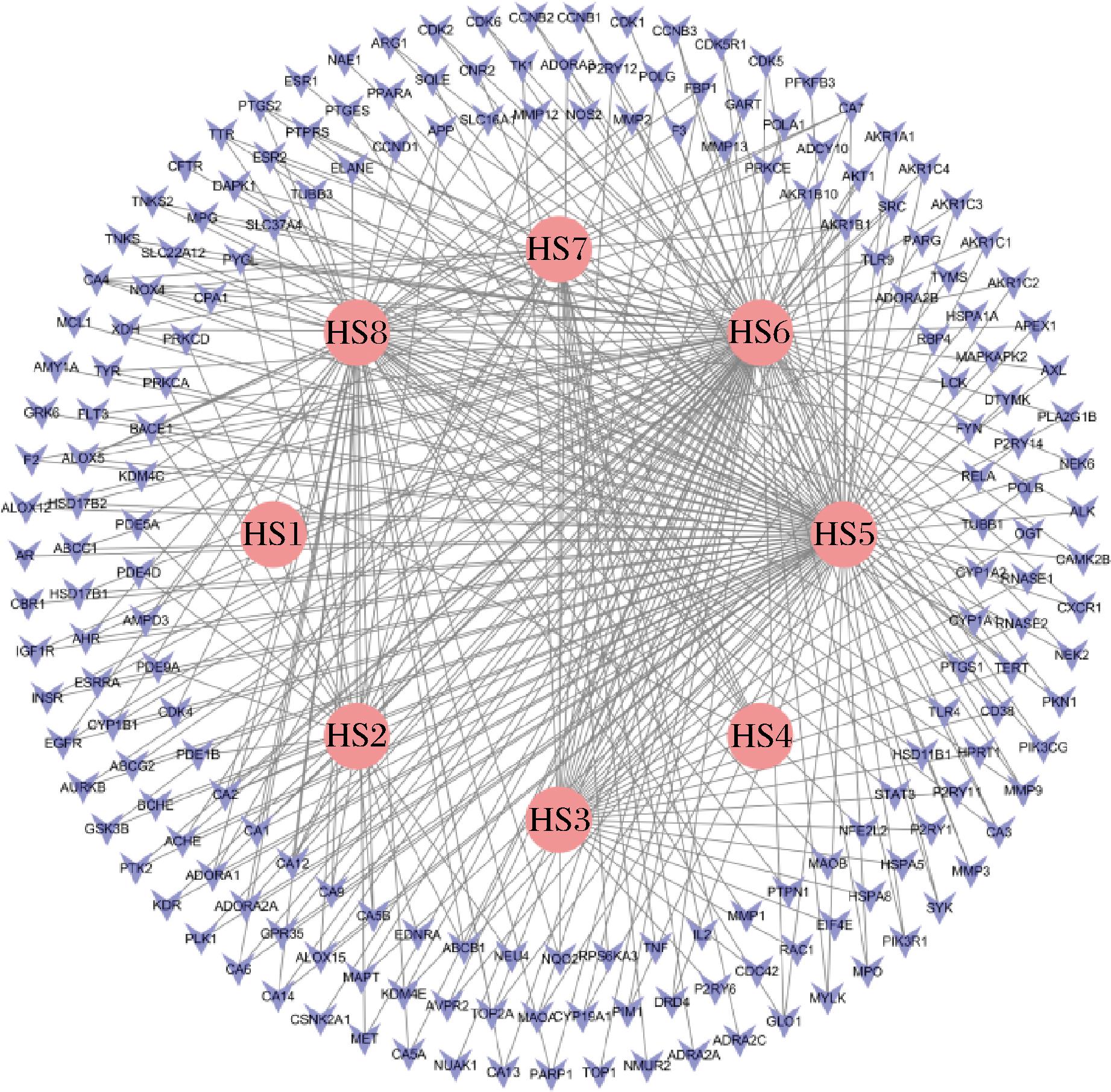
图7 黑桑活性化合物-靶点网络图
Fig.7 Network diagram of active compound-target interactions in black mulberry
2.3.2 疾病靶点筛选以及潜在靶点获取
在Gene Cards数据库中以“Alzheimer Syndrome”、“Alzheimer’s Diseases”、“AD”等作为关键词进行检索,得到Gene Cards数据库中阿尔兹海默病的疾病靶点,并结合AD数据库得到AD的疾病靶点1 511个,利用在线韦恩图绘制工具绘制韦恩图,交集靶点即为黑桑治疗阿尔兹海默病的潜在靶点,最终得到黑桑与AD的交集靶点95个,见图8。

图8 黑桑-AD韦恩图
Fig.8 Venn diagram of black mulberry &AD
2.3.3 构建蛋白相互作用网络并筛选核心靶点
将潜在靶点导入string平台,选择物种为“homo sapiens”,隐藏PPI网络中断开节点,筛选交互得分≥0.9,进行PPI网络分析,并通过“Degree≥二倍中位数,Betweenness Centrality≥中位数,Closeness Centrality≥中位数”的条件筛选,得到核心靶点为SRC、STAT3、PIK3R1、AKT1、RELA、EGFR、RAC1、ESR1、FYN、APP、IL2、SYK,利用Cytoscape3.7.2绘制PPI网络图,见图9。
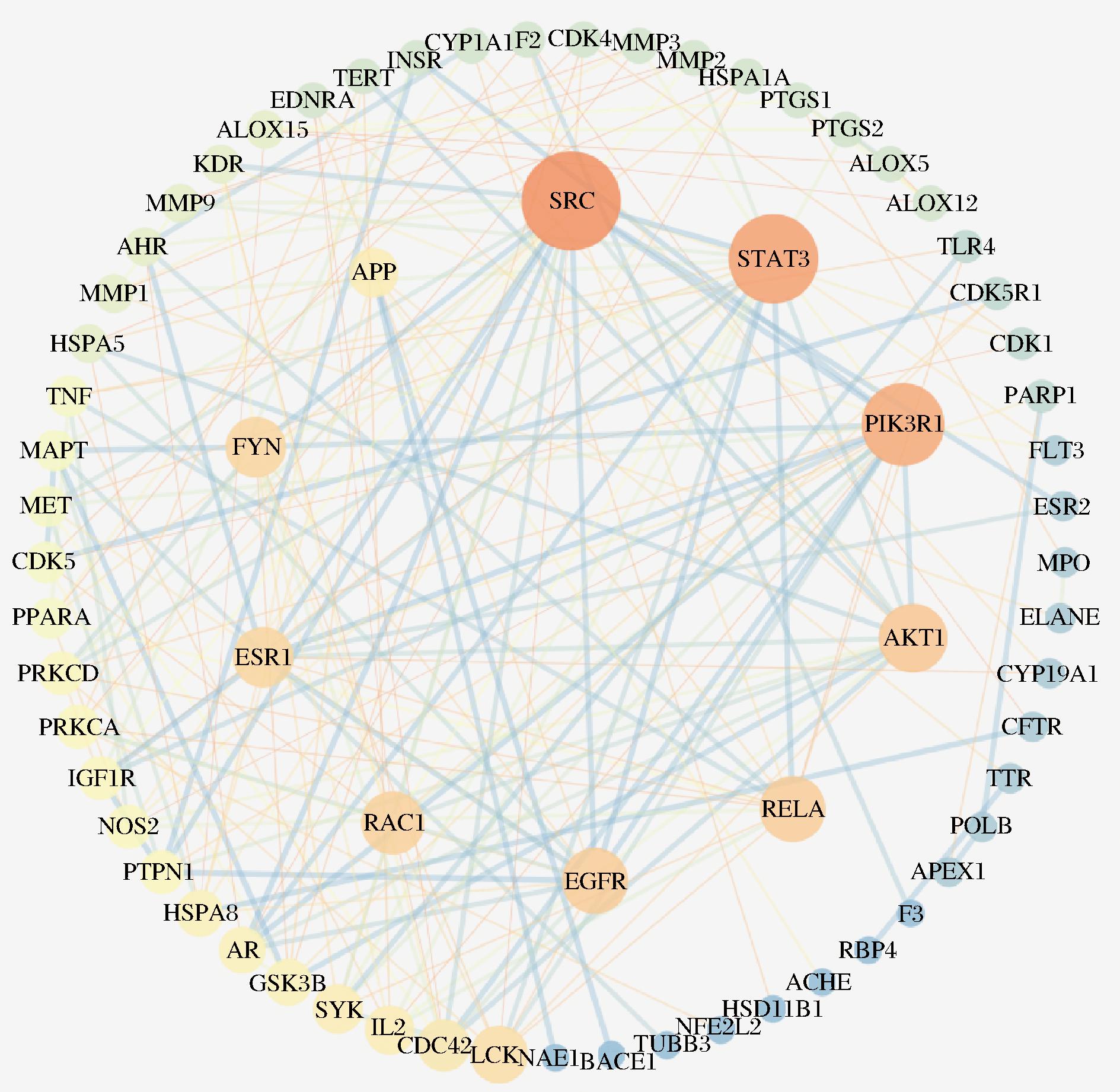
图9 PPI网络图
Fig.9 PPI network diagram
2.3.4 KEGG通路富集分析和GO功能富集分析
通过R studio 4.2.2软件中的“org.Hs.eg.db”、“ggplot2”、“cluster Profiler”、“enrich plot”等R包对核心靶点进行KEGG和GO富集分析,得到可视化结果。将12个核心靶点进行GO功能富集分析之后共得到1 480个条目,其中GO分析具体分为生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)3个部分,以P值、Q值等于0.05为阈值,以count值排序,分别进行排序取前十,最终得到的结果如图10。
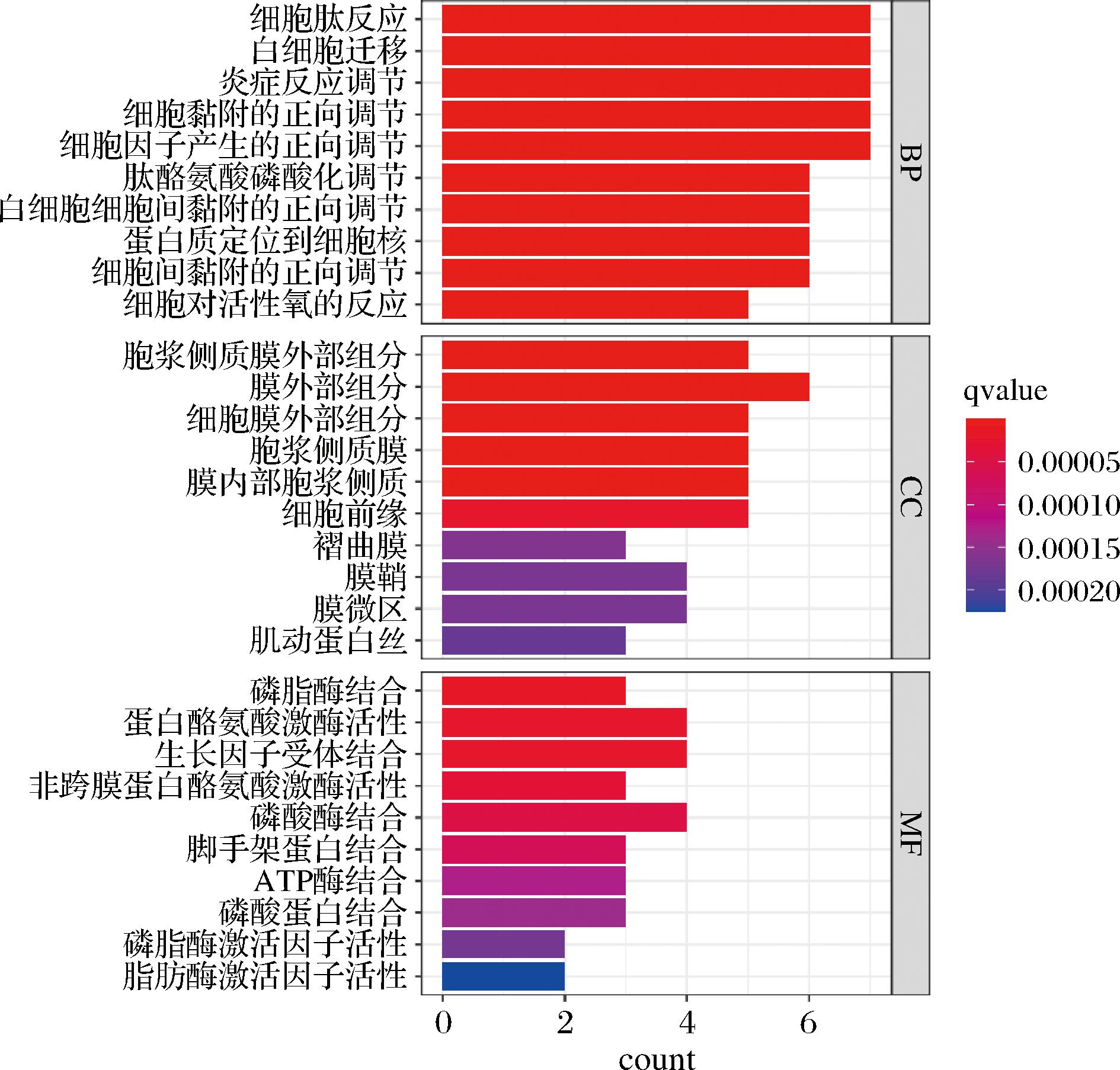
图10 GO富集分析柱状图
Fig.10 Bar diagram of GO enrichment analysis
图中横坐标count代表富集到该条目上的基因数目,颜色代表显著性。BP显著富集在白细胞迁移、对炎症反应的调节作用、细胞黏附的正向调节、正调控细胞因子的产生、肽基酪氨酸磷酸化的调控等,CC词条显著富集在质膜胞质侧的外部成分、膜外成分、质膜的外部成分、质膜的细胞质侧、膜细胞质侧等。MF词条显著富集在磷脂酶结合、蛋白酪氨酸激酶活性、生长因子受体结合、非膜跨蛋白酪氨酸激酶活性、磷酸酶结合等。
将12个核心靶点进行KEGG信号通路富集分析后得到104个信号通路结果,主要富集通路有PI3K-Akt信号通路、中性粒细胞外陷、脂质和动脉粥样硬化、HIF-1信号通路、鞘脂信号通路、血小板活化、JAK-STAT信号通路、Rap1信号通路、Ras信号通路、toll样受体信号通路、胰岛素抵抗、FoxO信号通路、MAPK信号通路、TNF信号通路、阿尔兹海默病,见图11。
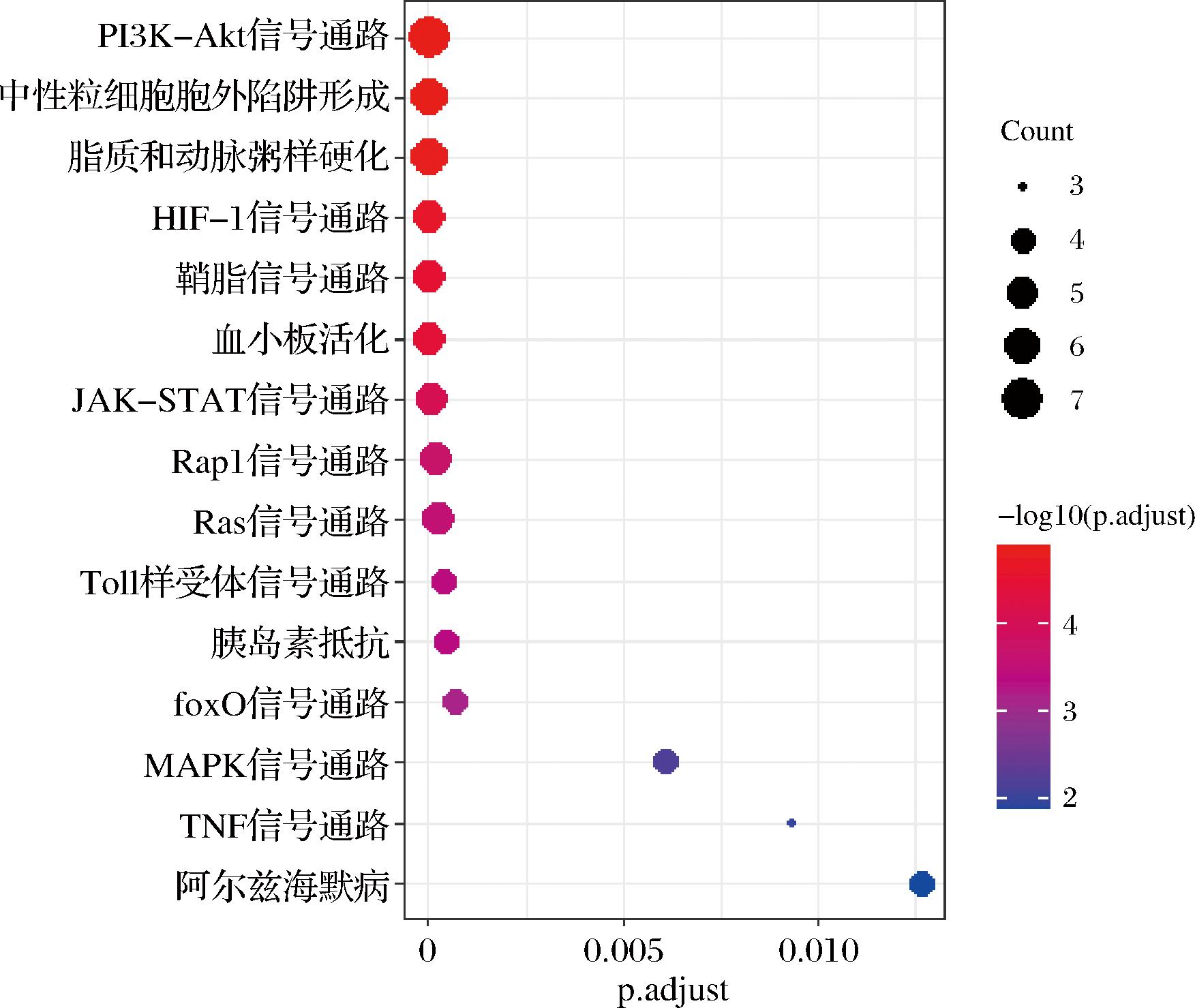
图11 KEGG富集分析气泡图
Fig.11 Bubble map of KEGG enrichment analysis
2.3.5 分子对接
通过TCMSP数据库下载核心活性成分的mol2结构,在PDB数据库中结合uniport数据库下载核心靶点(大分子受体)的pdb格式结构图。Auto Dock软件进行去水、加氢、计算电荷等操作后进行模拟对接,将结合能较低对接构象导入Pymol软件中进行画图展示。
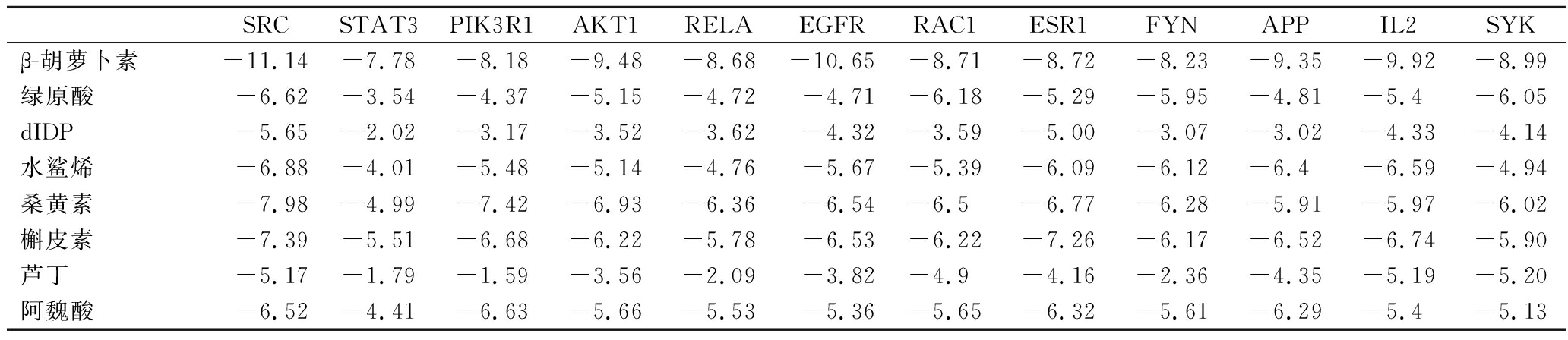
将黑桑HPLC指纹图谱指认出的3个黑桑活性成分与网络药理学筛选后得到的5个黑桑活性成分一起作为核心活性成分,分别与12个核心靶点进行分子对接。结合能结果越小,受体与配体的结合越强,一般认为结合能小于-4.25 kJ/mol 提示配体与受体有一定的结合活性,小于-5.0 kJ/mol 有较好的结合活性,小于-7.0 kJ/mol 有强烈的结合活性,对接结合能见表7,桑黄素与槲皮素与SRC的分子对接结果最稳定,经过可视化处理后如图12。
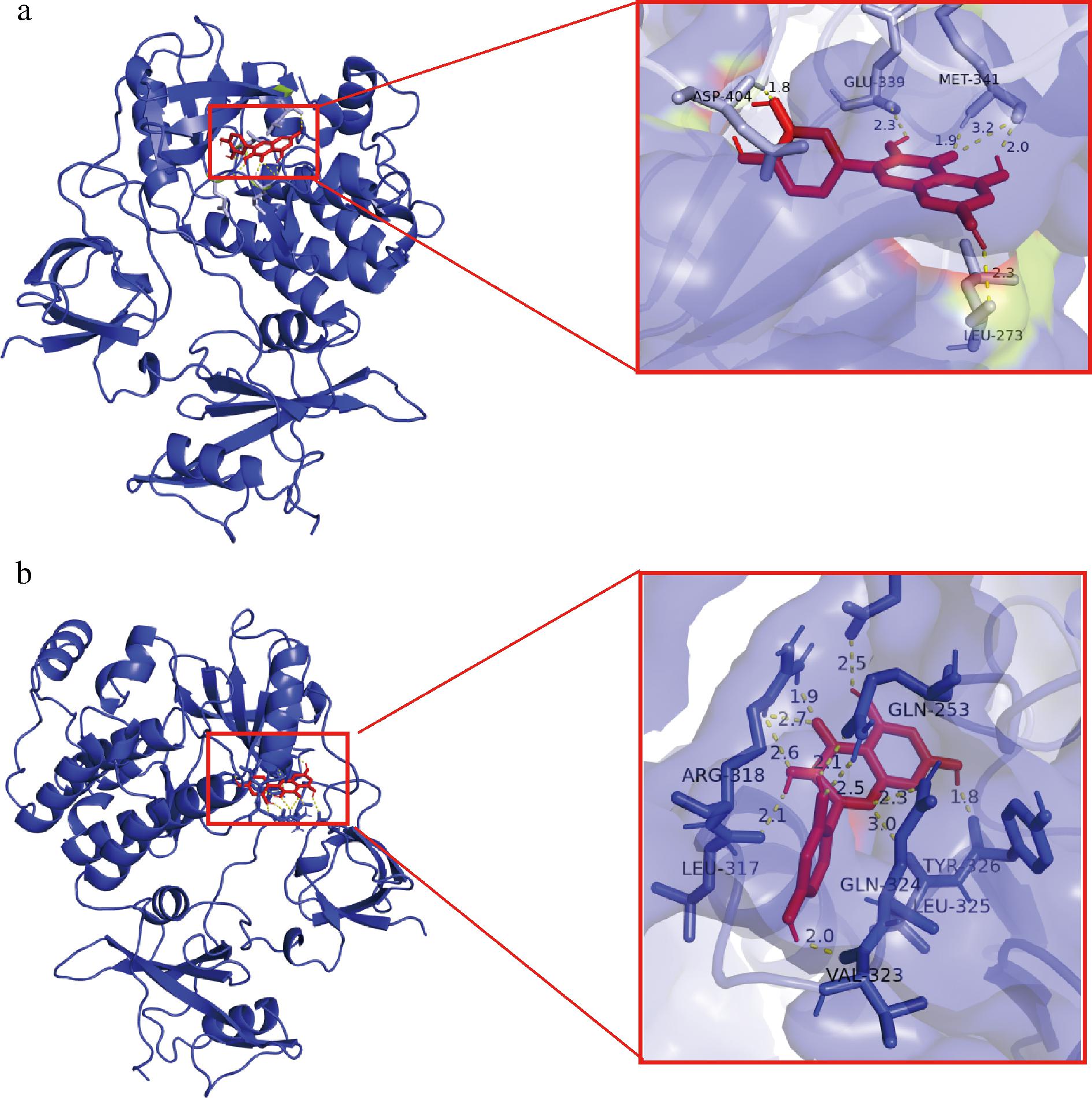
a-桑黄素与SRC分子对接;b-槲皮素与SRC分子对接
图12 桑黄素与槲皮素与SRC分子对接模拟图
Fig.12 Simulation diagram of SRC molecule docking between mulberry pigment and quercetin
表7 分子对接结合能统计表 单位:kJ/mol
Table 7 Molecular docking binding energy statistics table
SRCSTAT3PIK3R1AKT1RELAEGFRRAC1ESR1FYNAPPIL2SYKβ-胡萝卜素-11.14-7.78-8.18-9.48-8.68-10.65-8.71-8.72-8.23-9.35-9.92-8.99绿原酸-6.62-3.54-4.37-5.15-4.72-4.71-6.18-5.29-5.95-4.81-5.4-6.05dIDP-5.65-2.02-3.17-3.52-3.62-4.32-3.59-5.00-3.07-3.02-4.33-4.14水鲨烯-6.88-4.01-5.48-5.14-4.76-5.67-5.39-6.09-6.12-6.4-6.59-4.94桑黄素-7.98-4.99-7.42-6.93-6.36-6.54-6.5-6.77-6.28-5.91-5.97-6.02槲皮素-7.39-5.51-6.68-6.22-5.78-6.53-6.22-7.26-6.17-6.52-6.74-5.90芦丁-5.17-1.79-1.59-3.56-2.09-3.82-4.9-4.16-2.36-4.35-5.19-5.20阿魏酸-6.52-4.41-6.63-5.66-5.53-5.36-5.65-6.32-5.61-6.29-5.4-5.13
3 讨论
建立12个黑桑样本的指纹图谱并进行聚类分析,结合新疆地理位置进行分析,托克逊、吐鲁番市、鄯善、温宿、库车、阿瓦提、莎车、和田市这些地区位于新疆的南部和西部地区,属于塔里木盆地和昆仑山脉周边的区域,地理环境相似,被归为同一类别。喀什、于田和英吉沙位于新疆南部的喀什地区,地理环境相似,被归为同一类别。奇台位于新疆北部的巴音郭楞蒙古自治州,地理环境与上述地区不同,被归为单独的一类。结合PCA、OPLS-DA等多元统计学分析,初步分析判断色谱峰7(阿魏酸)、色谱峰2(绿原酸)和色谱峰6(芦丁)可能作为黑桑潜在活性成分,随后结合网络药理学方法进行靶点预测及相关通路富集分析。
富集分析结果发现主要的作用通路包括PI3K-Akt信号通路、中性粒细胞外陷、Rap1信号通路、Ras信号通路、toll样受体信号通路、FoxO信号通路、MAPK信号通路等,这一结果与许多进行AD网络药理学研究的文章中关于信号通路的结果一致[11-15]。PI3K/Akt信号通路功能在细胞繁殖,分化和凋亡等多个过程中起着至关重要的作用,该通路可以通过β-淀粉样蛋白积聚的减轻来减缓AD发展,还可以通过抑制GSK-3β的活性来减少Tau过度磷酸化,达到治疗AD的目的[10-11,13]。中性粒细胞累积是AD患者的共有特征[16-18],有实验研究利用大型人群队列和动物实验证明AD患者大脑中的髓过氧化物酶(myeloperoxidase,MPO)沉积主要是由于中性粒细胞的累积来驱动的[19]。在AD的发病机制中,MAPK通路通过诱导神经元凋亡、β和γ分泌酶的转录和活化以及淀粉样蛋白-β前体蛋白和Tau的磷酸化来促进AD疾病的进一步发展[14,20]。NF-κB、MAPK等信号通路通过激活小胶质细胞或增强小胶质细胞的M1状态参与小胶质细胞炎症分子的释放[19,21]。TLR4的激活可以诱导下游信号通路并促进促炎细胞因子的产生,因此TLR4可能是通过调节神经炎症、激活小胶质细胞来治疗AD的重要分子靶标[22-24]。Rap1和Ras都属于GTP酶超家族,它们的结构和功能有相似之处[25-26]。Rap1信号通路可能参与了AD神经元突触损伤和神经元死亡的过程,涉及调控细胞的增殖分化与细胞凋亡等过程[21,27-28]。许多研究表明FoxO信号通路在大脑的许多部位都很活跃,包括海马体、杏仁核和伏隔核是治疗AD患者的重要途径[29-30]。细胞凋亡是一种内在的生化细胞过程,可调节细胞死亡,对细胞存活、细胞稳态和维持最佳功能状态至关重要[31]。神经退行性疾病的大多数中心病理特征是受线粒体调节的细胞凋亡[32],通过凋亡、吞噬的过程可以抑制促炎因子和抗原自身免疫成分的释放,增强对神经元存活和轴突再生微环境的形成,从而进行AD的防治[31-33]。
4 结论
目前,AD的发病机制并不明确且主流西方药物只能缓解症状并伴随一定副作用,因此探寻黑桑等药食同源植物与AD之间的相互作用机制尤为重要。本研究采用HPLC法建立了不同产地的黑桑指纹图谱,对其主要化学成分进行指认并通过网络药理学、分子对接技术研究核心靶点与活性成分之间的空间结构相互作用。结果分析发现黑桑可能通过核心靶点调节PI3K-Akt信号通路、中性粒细胞外陷、Rap1信号通路、Ras信号通路、toll样受体信号通路、FoxO信号通路、MAPK信号通路等,进而调控炎症反应、抑制氧化损伤、控制细胞凋亡、减少蛋白沉积和Tau蛋白的过度磷酸化等的多靶点-多通路-多途径,从而达到治疗和预防AD的效果。
本文通过HPLC指纹图谱、网络药理学、文献阅读、公共数据库的挖掘和分子对接等技术,为黑桑防治AD的作用机制提供一定的理论基础和思路,但本研究仍存在一定的局限性,需要进行体内外实验验证和深入研究,以进一步确定黑桑活性成分与靶点的具体作用机制和生物学效应。
[1] BADHWAR A, MCFALL G P, SAPKOTA S, et al.A multiomics approach to heterogeneity in Alzheimer’s disease:Focused review and roadmap[J].Brain:a Journal of Neurology, 2020, 143(5):1315-1331.
[2] GUZMAN-MARTINEZ L, CALF O C, FARIAS G A, et al.New frontiers in the prevention, diagnosis, and treatment of Alzheimer’s disease[J].Journal of Alzheimer’s Disease:JAD, 2021, 82(s1):S51-S63.
O C, FARIAS G A, et al.New frontiers in the prevention, diagnosis, and treatment of Alzheimer’s disease[J].Journal of Alzheimer’s Disease:JAD, 2021, 82(s1):S51-S63.
[3] 钟雪, 李倩, 宋昱, 等.基于网络药理学的桑葚药理功能定位及作用机制分析[J].天津师范大学学报(自然科学版), 2022, 42(4):46-51;63.ZHONG X, LI Q, SONG Y, et al.Analysis of pharmacological function and mechanism of action of mulberry based on network pharmacology[J].Journal of Tianjin Normal University (Natural Science Edition), 2022, 42(4):46-51;63.
[4] LIN Z W, GAN T T, HUANG Y Z, et al.Anti-inflammatory activity of mulberry leaf flavonoids in vitro and in vivo[J].International Journal of Molecular Sciences, 2022, 23(14):7694.
[5] MAQSOOD M, ANAM SAEED R, SAHAR A, et al.Mulberry plant as a source of functional food with therapeutic and nutritional applications:A review[J].Journal of Food Biochemistry, 2022, 46(11):e14263.
[6] PALACHAI N, WATTANATHORN J, MUCHIMAPURA S, et al.Phytosome loading the combined extract of mulberry fruit and ginger protects against cerebral ischemia in metabolic syndrome rats[J].Oxidative Medicine and Cellular Longevity, 2020, 2020:5305437.
[7] LIU D X, DU D Q.Mulberry fruit extract alleviates cognitive impairment by promoting the clearance of amyloid-β and inhibiting neuroinflammation in Alzheimer’s disease mice[J].Neurochemical Research, 2020, 45(9):2009-2019.
[8] OCHIISHI T, KAKU M, KAJSONGKRAM T, et al.Mulberry fruit extract alleviates the intracellular amyloid-β oligomer-induced cognitive disturbance and oxidative stress in Alzheimer’s disease model mice[J].Genes to Cells, 2021, 26(11):861-873.
[9] 王腾华, 罗颖懿, 王驭辰, 等.基于GC-MS与网络药理学的青皮挥发油防治阿尔茨海默症的活性成分及作用机制研究[J].中国药房, 2020, 31(17):2093-2100.WANG T H, LUO Y Y, WANG Y C, et al.Study on active components and mechanism of volatile oil of citri reticulatae preventing and treating Alzheimer’s disease based on GC-MS and network pharmacology[J].China Pharmacy, 2020, 31(17):2093-2100.[10] 罗连响, 黄芳芳, 吴锐剑, 等.花青素对阿尔兹海默病关键药理途径的生物信息学分析及实验验证[J].中国免疫学杂志, 2021, 37(18):2217-2224.LUO L X, HUANG F F, WU R J, et al.Bioinformatics analysis and experimental validation of cyanidin on key pharmacological pathways of Alzheimer’s disease[J].Chinese Journal of Immunology, 2021, 37(18):2217-2224.
[11] ZHANG T T, WEI W, CHANG S R, et al.Integrated network pharmacology and comprehensive bioinformatics identifying the mechanisms and molecular targets of Yizhiqingxin formula for treatment of comorbidity with Alzheimer’s disease and depression[J].Frontiers in Pharmacology, 2022, 13:853375.
[12] HUANG X Y, XUE L L, CHEN T B, et al.Miracle fruit seed as a potential supplement for the treatment of learning and memory disorders in Alzheimer’s disease[J].Frontiers in Pharmacology, 2023, 13:1080753.
[13] MA X Y, ZHAO Y, YANG T, et al.Integration of network pharmacology and molecular docking to explore the molecular mechanism of Cordycepin in the treatment of Alzheimer’s disease[J].Frontiers in Aging Neuroscience, 2022, 14:1058780.
[14] ZHANG J, LI H J, ZHANG Y B, et al.Uncovering the pharmacological mechanism of stemazole in the treatment of neurodegenerative diseases based on a network pharmacology approach[J].International Journal of Molecular Sciences, 2020, 21(2):427.
[15] MARTIZ R M, PATIL S M, ABDULAZIZ M, et al.Defining the role of isoeugenol from Ocimum tenuiflorum against diabetes mellitus-linked Alzheimer’s disease through network pharmacology and computational methods[J].Molecules, 2022, 27(8):2398.
[16] LUO H Y, GUO H J, ZHOU Y, et al.Neutrophil extracellular traps in cerebral ischemia/reperfusion injury:Friend and foe[J].Current Neuropharmacology, 2023, 21(10):2079-2096.
[17] SMYTH L C D, MURRAY H C, HILL M, et al.Neutrophil-vascular interactions drive myeloperoxidase accumulation in the brain in Alzheimer’s disease[J].Acta Neuropathologica Communications, 2022, 10(1):38.
[18] JANSSON D, DIERIKS V B, RUSTENHOVEN J, et al.Cardiac glycosides target barrier inflammation of the vasculature, meninges and choroid plexus[J].Communications Biology, 2021, 4(1):260.
[19] JOHNSON E C B, CARTER E K, DAMMER E B, et al.Large-scale deep multi-layer analysis of Alzheimer’s disease brain reveals strong proteomic disease-related changes not observed at the RNA level[J].Nature Neuroscience, 2022, 25(2):213-225.
[20] CARL E.Proliferation and differentiation deficits are a major convergence point for neurodevelopmental disorders[J].Trends in Neurosciences, 2016, 39(5):290-299.
[21] ZU G X, SUN K Y, LI L, et al.Mechanism of quercetin therapeutic targets for Alzheimer disease and type 2 diabetes mellitus[J].Scientific Reports, 2021, 11(1):22959.
[22] WU L Y, XIAN X H, XU G Y, et al.Toll-like receptor 4:A promising therapeutic target for Alzheimer’s disease[J].Mediators of Inflammation, 2022, 2022:7924199.
[23] YANG J L, WISE L, FUKUCHI K I.TLR4 cross-talk with NLRP3 inflammasome and complement signaling pathways in Alzheimer’s disease[J].Frontiers in Immunology, 2020, 11:724.
[24] QIN Z J, GU M, ZHOU J, et al.Triggering receptor expressed on myeloid cells 2 activation downregulates toll-like receptor 4 expression and ameliorates cognitive impairment in the Aβ1-42-induced Alzheimer’s disease mouse model[J].Synapse, 2020, 74(10):e22161.
[25] SHAH S, BROCK E J, JI K, et al.Ras and Rap1:A tale of two GTPases[J].Seminars in Cancer Biology, 2019, 54:29-39.
[26] KOSURU R, CHRZANOWSKA M.Integration of Rap1 and calcium signaling[J].International Journal of Molecular Sciences, 2020, 21(5):1616.
[27] XIA Y Y, QADOTA H, WANG Z H, et al.Neuronal C/EBPβ/AEP pathway shortens life span via selective GABAnergic neuronal degeneration by FOXO repression[J].Science Advances, 2022, 8(13):eabj8658.
[28] GOSWAMI S, KAREEM O, GOYAL R K, et al.Role of forkhead transcription factors of the O class (FoxO) in development and progression of Alzheimer’s disease[J].CNS &Neurological Disorders Drug Targets, 2020, 19(9):709-721.
[29] SHARMA V K, SINGH T G, SINGH S, et al.Apoptotic pathways and Alzheimer’s disease:Probing therapeutic potential[J].Neurochemical Research, 2021, 46(12):3103-3122.
[30] WU Y B, CHEN M Q, JIANG J L.Mitochondrial dysfunction in neurodegenerative diseases and drug targets via apoptotic signaling[J].Mitochondrion, 2019, 49:35-45.
[31] JAYARAMAN A, REYNOLDS R.Diverse pathways to neuronal necroptosis in Alzheimer’s disease[J].The European Journal of Neuroscience, 2022, 56(9):5428-5441.
[32] LI X Q, CHENG Y X, QIN Y P, et al.Chrysophanol exerts neuroprotective effects via interfering with endoplasmic reticulum stress apoptotic pathways in cell and animal models of Alzheimer’s disease[J].The Journal of Pharmacy and Pharmacology, 2022, 74(1):32-40.
[33] TAJBAKHSH A, READ M, BARRETO G E, et al.Apoptotic neurons and amyloid-beta clearance by phagocytosis in Alzheimer’s disease:Pathological mechanisms and therapeutic outlooks[J].European Journal of Pharmacology, 2021, 895:173873.