食用菌是一种大型真菌,富含多糖、酚类、萜类、甾醇、核苷类、蛋白质、氨基酸等多种营养成分[1],其味道鲜美和风味独特,是公认的健康食品。食用菌已被证实具有抗肿瘤[2]、抗病毒[3]、抗氧化[4]、抗菌[5]、免疫调节[6]、保护胃黏膜[7]等生物功效,目前食用菌及其衍生产品已被广泛应用于药品、食品、保健品、化妆品、调味料等领域[8]。
目前,食用菌的培养方式主要包括固体栽培和液体发酵。固体栽培一般可采收4~5潮菇,前3潮菇产量高,占总产量的85%左右,但固体栽培存在对场地要求高、栽培周期长、品质不稳定等问题。近年来,由于液体发酵工艺简单、生长周期短、培养条件易于控制等优势,逐渐成为食用菌主流的培养方式[9]。有研究表明,蛹虫草菌丝体同样具有子实体的生物活性且液体发酵方式更经济、高效、稳定,故可以使用高效快捷获取的菌丝体代替子实体,用于蛹虫草多糖产品的开发[10]。也有研究表明,相较于菌丝体,子实体营养物质更加丰富,具有更高的实用和经济价值。例如,银丝草菇子实体中各营养成分含量均高于菌丝体[11];桑黄子实体在抗肿瘤活性上优于菌丝体[12]。关于食用菌,仅有对同一品种或者单一指标进行比较分析,缺乏不同培养方式对食用菌营养品质影响的系统性研究与评价。
因此,本论文以猴头菇(Hericium erinaceus)、榆黄菇(Pleurotus citrinopileatus)、茶树菇(Agrocybe aegerita)3种典型食用菌菌株作为研究对象,通过固体栽培和液体发酵分别收获三潮次子实体及菌丝体,系统分析子实体与菌丝体代谢差异性,包括大分子代谢产物多糖、蛋白质,以及小分子代谢产物多酚、氨基酸、核苷等,解析固体栽培子实体和液体发酵菌丝体营养品质差异,以期为食用菌产品的精细化开发与应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株与培养基
猴头菇(Hericium erinaceus)、榆黄菇(Pleurotus citrinopileatus)、茶树菇(Agrocybe aegerita)保藏于江南大学粮食发酵与食品生物制造国家工程研究中心。
玉米麸皮培养基(g/L):玉米粉10、麸皮10、葡萄糖20、KH2PO4 3、MgSO4·7H2O 2。
榆黄菇和猴头菇固体栽培培养基(%):木屑35、棉籽壳40、麸皮13、玉米粉10、蔗糖1、石膏1。
茶树菇固体栽培培养基(%):棉籽壳85、麸皮10、玉米粉3、蔗糖1、石膏1。
1.1.2 主要试剂
KH2PO4、MgSO4·7H2O、体积分数95%乙醇、高氯酸、乙腈(色谱纯)、甲醇(色谱纯),国药集团化学试剂有限公司;没食子酸、碳酸钠、齐墩果酸、香草醛、冰乙酸、麦角硫因、醋酸铵、麦角固醇、CuSO4、K2SO4、胞苷、尿苷、腺苷、鸟苷、肌苷,上海阿拉丁生化科技股份有限公司。
1.1.3 仪器与设备
FD-1A-50真空冷冻干燥机,美国LABCONCO公司;SYG-1210水浴锅,上海跃进医疗器械公司;SW-CJ-1FD5950超净工作台,苏净集团安泰公司;HC-2518高速离心机,安徽中科中佳科学仪器有限公司;EX224ZH/AD电子天平,奥豪斯仪器(常州)有限公司;HN-50BS恒温培养箱,上海森信实验仪器有限公司;1260 Infinity II高效液相色谱仪,美国安捷伦公司;UV-3200紫外分光光度计,上海美普达仪器有限公司;K1160全自动凯氏定氮仪,海能未来技术集团有限公司。
1.2 实验方法
1.2.1 液体发酵
菌种活化:挑取斜面菌种接种于PDA平板,30 ℃培养至菌丝布满整个平板。
一级种子培养:自平板取1 cm×1 cm大小菌块,捣碎接种到装液量为80 mL的玉米麸皮培养基中,猴头菇150 r/min、30 ℃培养12 d;榆黄菇150 r/min、25 ℃培养5 d、茶树菇150 r/min、25 ℃培养13 d。
二级种子培养:将一级种子液中的菌丝体用玻璃珠打散,猴头菇5%的接种量接种到150 mL发酵培养基中,30 ℃、150 r/min培养12 d;榆黄菇3%的接种量接种到150 mL发酵培养基中,25 ℃、150 r/min培养3 d;茶树菇6.5%的接种量接种到150 mL发酵培养基中,25 ℃、150 r/min培养3 d。利用重悬法分离出菌丝体,将收集到的菌丝体冷冻干燥处理后研磨成粉放置在阴凉干燥处保存备用。
1.2.2 固体栽培
菌包制备:使用新鲜的原材料,按照培养料配比称取各种原材料加水搅拌均匀,含水量60%~65%。选取12 cm×24 cm聚丙烯塑料袋,确保装料紧实,松紧度上下均匀一致。灭菌条件:温度121 ℃,时间50 min。
接菌:待料包完全冷却后进行接种操作,全程无菌环境,移液枪吸取15 mL液体菌种至菌包接种口。
菌丝培养:初步吃料阶段温度控制在24~26 ℃,菌丝快速生长建立优势。新陈代谢旺盛阶段袋内温度明显升高,降低环境温度至20~23 ℃,防止烧菌。空气湿度60%~65%,黑暗环境,适当通风。
出菇管理:出菇时间段控制在无锡地区上半年的4~6月份和下半年9~11月份。猴头菇菌丝满袋后即可开袋出菇,而茶树菇、榆黄菇需要等到菌丝成熟期才可开袋出菇。空气湿度90%~95%,昏暗环境,增加通风,子实体成熟后及时采收。榆黄菇和茶树菇菌盖和菌柄分离,将收集到的子实体样品冷冻干燥处理后研磨成粉放置在阴凉干燥处保存备用。
1.3 多糖分析
1.3.1 多糖含量测定
精密称取30 mg菌粉到5 mL离心管中,加入4 mL蒸馏水,涡旋振荡混合均匀,开水浸提3 h。冷却至室温后10 000 r/min离心5 min,取1 mL上清液加入3倍体积的体积分数95%乙醇混匀,4 ℃冰箱过夜沉淀多糖。醇沉结束10 000 r/min离心5 min,去上清液,用体积分数75%的乙醇洗涤沉淀,重复3次。加4 mL蒸馏水复溶沉淀,10 000 r/min离心5 min,取上清液待测。采用苯酚硫酸法[13]测定。
1.3.2 多糖分子质量测定
提取多糖方法同1.3.1节,水浴浸提法提取多糖,上清醇沉,加水复溶沉淀。离心取上清液,过膜待测。色谱条件:UltrahydrogelTMLinear 300 mm×7.8 mmid×2色谱柱,流动相:0.1 mol/L NaNO3溶液,流速0.9 mL/min,进样量30 μL,柱温45 ℃,示差折光检测器(RID)。
1.3.3 单糖组成分析
称取适量样品,加入0.5 mL 12 mol/L硫酸35 ℃水浴1 h。水浴后的样品加入2.5 mL的蒸馏水混匀,98 ℃水浴加热1 h。水解完成的样品冷却至室温后10 000 r/min离心5 min。上清液用1 mol/L NaOH调节至中性,并稀释至200 mg/L,过膜后使用离子色谱法测定。色谱柱:CarboPac PA20(3.0 mm×150 mm),流动相A:200 mmol/L NaOH,流动相B:1 mol/L NaAC,流动相C:ddH2O。梯度洗脱:0~35 min,B∶C=98.8∶1.2;35.1~50 min,A∶B∶C=15∶83.8∶1.2;50.1~60 min,B∶C=98.8∶1.2。进样量10 μL,流速1.0 mL/min。
1.4 多酚含量测定
称取一定量的干菌粉与体积分数70%的乙醇以料液比1∶60(g∶mL)充分混合均匀,70 ℃水浴浸提50 min,冷却至室温后,10 000 r/min离心5 min,取上清液。采用福林酚试剂法[14]测定。
1.5 三萜含量测定
将干菌粉与体积分数95%的乙醇以料液比1∶100(g∶mL)涡旋振荡充分混合均匀,80 ℃水浴浸提2 h,冷却至室温后,用体积分数95%的乙醇补足失重。10 000 r/min离心5 min,上清液即三萜提取液,采用香草醛-高氯酸-冰乙酸显色法[15]测定。
1.6 麦角固醇含量测定
冻干的菌粉与无水甲醇(色谱级)以料液比1∶100(g∶mL)混合均匀,60 ℃超声波处理10 min。取出室温放冷,冷却至常温后10 000 r/min离心5 min,上清液过0.22 μm孔径滤膜待测,色谱条件:Waters Symmetry C18色谱柱(4.6 mm×150 mm),流动相为V(甲醇)∶V(超纯水)=98∶2等度洗脱,进样量20 μL,流速0.5 mL/min,柱温30 ℃,紫外检测器(VWD)检测波长λ=280 nm。
1.7 麦角硫因含量测定
冻干的菌粉与体积分数70%甲醇(色谱级)以料液比1∶100(g∶mL)混合均匀,60 ℃超声波提取30 min,离心取上清液1 mL,氮吹仪吹干后加等体积蒸馏水复溶,过0.22 μm孔径滤膜待测。色谱条件:XBridgeTMAmide色谱柱(5 μm,4.6 mm×250 mm),流动相为V(乙腈)∶V(5 mmol/L)醋酸铵=80∶20等度洗脱,进样量10 μL,流速1 mL/min,柱温25 ℃,紫外检测器(VWD)检测波长λ=280 nm。
1.8 核苷含量测定
将一定量的干菌粉与体积分数70%甲醇以1∶60(g∶mL)的料液比进行混合,混合均匀后在60 ℃水温下超声波提取30 min。冷却室温后10 000 r/min离心5 min,上清液过0.22 μm孔径滤膜待测,色谱条件:Waters XSELECTTMHSS T3色谱柱(3.5 um,4.6 mm×150 mm),流动相为V(甲醇)∶V(超纯水)=90∶10等度洗脱,进样量10 μL,流速0.5 mL/min,柱温37 ℃,紫外检测器(VWD)检测波长λ=260 nm。
1.9 蛋白质含量测定及氨基酸组成分析
1.9.1 蛋白质含量测定
采用凯氏定氮法测定样品中的总氮含量,测定方法参照国标GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》。
1.9.2 氨基酸组成分析
采用OPA柱前衍生反相高效液相色谱-紫外检测法测定氨基酸种类及其含量。称取适量菌粉,加入8 mL 6 mol/L HCl后充N2,溶液呈微沸状态后拧紧水解管。121 ℃烘箱水解24 h。水解结束后加4.8 mL 10 mol/L NaOH中和,蒸馏水定容至25 mL,双层滤纸过滤,过滤后的液体过膜待测。色谱条件:Agilent Hypersil ODS柱(5 μm,4.0 mm×250 mm),流动相A(pH=7.2):27.6 mmo/L醋酸钠∶三乙胺∶四氢呋喃=500∶0.11∶2.5,流动相B(pH=7.2):80.9 mmol/L醋酸钠∶甲醇∶乙腈=1∶2∶2。梯度洗脱:0 min,92% A;17 min,50% A;20.1 min,0% A;24.0 min,100% A。流速1.0 mL/min,柱温40 ℃,紫外检测器(VWD)检测波长λ=338 nm,脯氨酸在λ=262 nm下检测。
1.10 数据分析与处理
使用Microsoft Excel 2010统计数据;采用SPSS 26对数据进行单因素方差分析(one-way ANOVA)。
2 结果与分析
2.1 固体栽培前三潮子实体以及液体发酵菌丝体宏观生长表型
猴头菇一潮子实体呈现乳白色,质地柔软且有弹性(图1-a);二潮猴头菇子实体形态与一潮子实体类似,但直径小于一潮菇(图1-b);三潮猴头菇子实体颜色洁白,质地较紧实,直径小于二潮菇(图1-c)。而猴头菇液体发酵菌丝体是菌丝缠绕聚集形成的小菌球,发酵液呈现黄色(图1-d)。

a-猴头菇一潮子实体;b-猴头菇二潮子实体;c-猴头菇三潮子实体;d-猴头菇菌丝体;e-榆黄菇一潮子实体;f-榆黄菇二潮子实体;g-榆黄菇三潮子实体;h-榆黄菇菌丝体;i-茶树菇一潮子实体;j-茶树菇二潮子实体;k-茶树菇三潮子实体;l-茶树菇菌丝体
图1 固体栽培前三潮子实体及液体发酵菌丝体
Fig.1 Growth phenotype of fruiting bodies from the first three flushes in solid cultivation and mycelia produced through liquid fermentation
榆黄菇一潮子实体朵形完整,菌盖为黄色,菌柄为白色,质地紧实(图1-e);二潮榆黄菇子实体形态与一潮子实体类似,但小菇数量少于一潮菇(图1-f);三潮榆黄菇子实体菌盖为淡黄色,菌柄为白色,质地较紧实,小菇数量少于二潮菇(图1-g)。而榆黄菇液体发酵菌丝体为白色菌丝聚集形成的小菌球,发酵液呈现淡黄色(图1-h)。
茶树菇一潮子实体朵形完整,菌盖为土黄色,菌柄为浅棕色,质地紧实(图1-i);二潮茶树菇子实体菌盖为浅土黄色,菌柄为浅棕色,质地较紧实,小菇数量少于一潮菇(图1-j);三潮茶树菇子实体形态与二潮子实体类似,小菇数量少于二潮菇(图1-k)。而茶树菇液体发酵菌丝体为白色菌丝聚集形成的小菌球,发酵液无色(图1-l)。
2.2 多糖含量、分子质量及其单糖组成
多糖是食用菌最主要的活性成分。不同培养方式下的3种食用菌多糖含量及其分子质量测定结果如表1所示,猴头菇、榆黄菇、茶树菇菌丝体多糖含量较高,分别为(86.97±0.67)、(75.29±5.45)、(73.71±2.87) mg/g。前三潮猴头菇子实体多糖含量最少仅有22.32~25.06 mg/g,不同潮次间多糖含量无差异。榆黄菇一潮、二潮子实体菌柄多糖含量明显高于同潮菌盖,而第三潮子实体菌柄多糖含量少于第三潮菌盖,随着潮次的增加榆黄菇子实体多糖含量曾现递增的趋势。茶树菇同一潮次菌盖多糖含量远高于菌柄,但茶树菇子实体以食用菌柄为主,一、二潮茶树菇子实体多糖含量略高于第三潮子实体。液体发酵培养基中添加的固形物玉米粉、麸皮使得菌丝体以此为基点形成菌球,培养过程中由于剪切力的作用,产生的菌丝断片再次附着在固形物上生长繁殖,同时快速消耗玉米粉、麸皮,在这种培养方式下食用菌菌丝体快速生长并积累多糖。
表1 多糖含量及其分子质量
Table 1 Polysaccharides yield and molecular weight
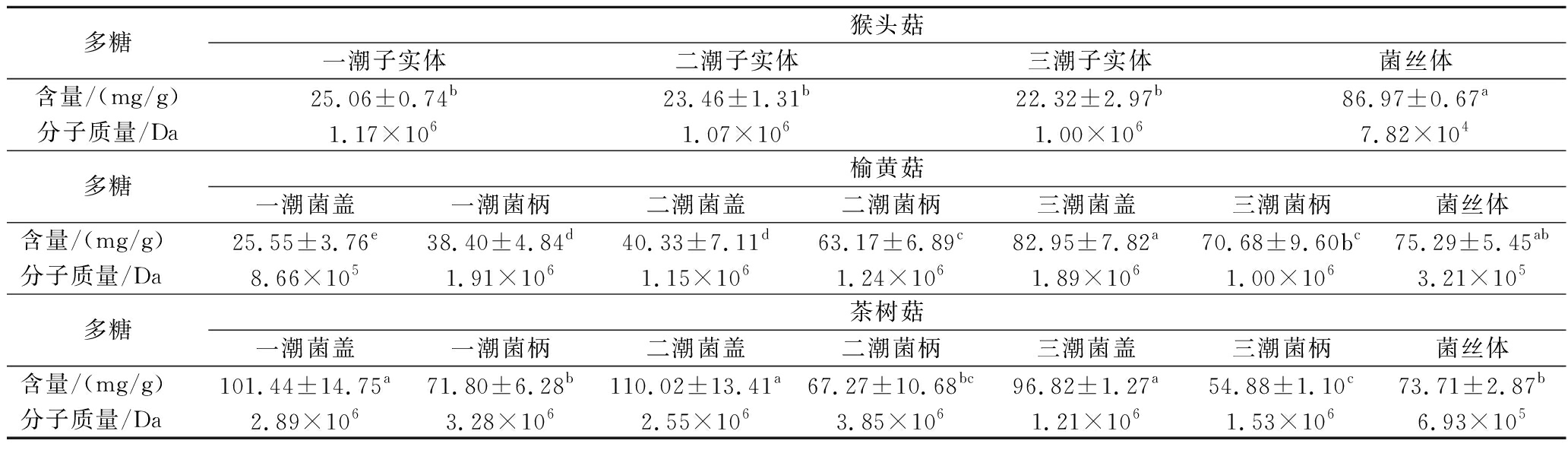
多糖猴头菇一潮子实体二潮子实体三潮子实体菌丝体含量/(mg/g)25.06±0.74b23.46±1.31b22.32±2.97b86.97±0.67a分子质量/Da1.17×1061.07×1061.00×1067.82×104多糖榆黄菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体含量/(mg/g)25.55±3.76e38.40±4.84d40.33±7.11d63.17±6.89c82.95±7.82a70.68±9.60bc75.29±5.45ab分子质量/Da8.66×1051.91×1061.15×1061.24×1061.89×1061.00×1063.21×105多糖茶树菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体含量/(mg/g)101.44±14.75a71.80±6.28b110.02±13.41a67.27±10.68bc96.82±1.27a54.88±1.10c73.71±2.87b分子质量/Da2.89×1063.28×1062.55×1063.85×1061.21×1061.53×1066.93×105
注:同行字母不同表示差异显著(P<0.05)(下同)。
3种食用菌子实体多糖分子质量为8.66×105~3.85×106Da,而3种食用菌菌丝体多糖分子质量为7.82×104~6.93×105Da,菌丝体多糖分子质量均显著低于对应子实体。说明多糖合成与培养方式有关,相对于固体栽培,液体发酵周期较短,合成的多糖的相对分子质量较小。多糖的分子质量及其结构与多糖的生物活性密切相关[16]。有研究表明菌丝体多糖分子质量较小且结构更加稳定,在抗炎活性、修复损伤的胃黏膜细胞等功效上优于子实体[17]。
3种食用菌前三潮子实体和菌丝体多糖的单糖组成,葡萄糖是含量占比最高的单糖,比例为52.65~87.63%(表2)。且所有样品中菌丝体多糖的单糖组成要比对应子实体更丰富,其中,鼠李糖仅存在于3种食用菌菌丝体多糖的单糖组分,茶树菇菌丝体多糖的单糖组成检测中发现存在木糖和甘露糖,而前三潮茶树菇子实体中并未检测到。不同潮次食用菌子实体多糖的单糖组成差异相对较小,但3种食用菌菌丝体和子实体多糖的单糖组成明显不同。鼠李糖的糖供体dTDP-鼠李糖的合成需要dTDP-葡萄糖焦磷酸化酶、dTDP-葡萄糖4,6-水解酶、dTDP-4-脱氢-6-脱氧葡萄糖差向异构酶一系列酶的作用且dTDP-鼠李糖不能在酶的作用下与其他的糖供体互相转化。此外,茶树菇子实体多糖并未合成木糖和甘露糖,说明不同的培养方式会影响菌丝体和子实体多糖的合成路径,导致多糖中单糖组分不同。
表2 单糖组成 单位:%
Table 2 Monosaccharide composition
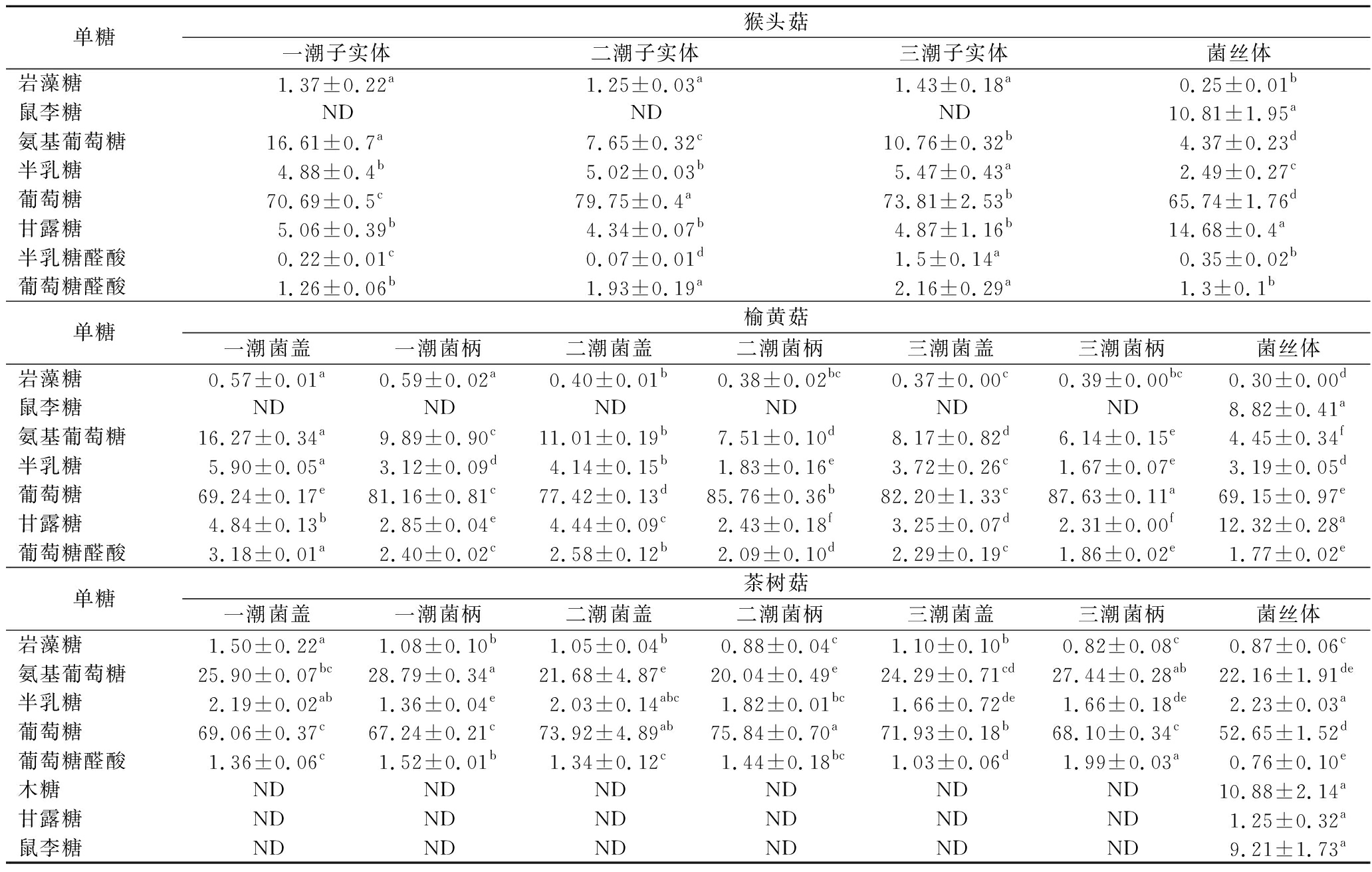
单糖猴头菇一潮子实体二潮子实体三潮子实体菌丝体岩藻糖1.37±0.22a1.25±0.03a1.43±0.18a0.25±0.01b鼠李糖NDNDND10.81±1.95a氨基葡萄糖16.61±0.7a7.65±0.32c10.76±0.32b4.37±0.23d半乳糖4.88±0.4b5.02±0.03b5.47±0.43a2.49±0.27c葡萄糖70.69±0.5c79.75±0.4a73.81±2.53b65.74±1.76d甘露糖5.06±0.39b4.34±0.07b4.87±1.16b14.68±0.4a半乳糖醛酸0.22±0.01c0.07±0.01d1.5±0.14a0.35±0.02b葡萄糖醛酸1.26±0.06b1.93±0.19a2.16±0.29a1.3±0.1b单糖榆黄菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体岩藻糖0.57±0.01a0.59±0.02a0.40±0.01b0.38±0.02bc0.37±0.00c0.39±0.00bc0.30±0.00d鼠李糖NDNDNDNDNDND8.82±0.41a氨基葡萄糖16.27±0.34a9.89±0.90c11.01±0.19b7.51±0.10d8.17±0.82d6.14±0.15e4.45±0.34f半乳糖5.90±0.05a3.12±0.09d4.14±0.15b1.83±0.16e3.72±0.26c1.67±0.07e3.19±0.05d葡萄糖69.24±0.17e81.16±0.81c77.42±0.13d85.76±0.36b82.20±1.33c87.63±0.11a69.15±0.97e甘露糖4.84±0.13b2.85±0.04e4.44±0.09c2.43±0.18f3.25±0.07d2.31±0.00f12.32±0.28a葡萄糖醛酸3.18±0.01a2.40±0.02c2.58±0.12b2.09±0.10d2.29±0.19c1.86±0.02e1.77±0.02e单糖茶树菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体岩藻糖1.50±0.22a1.08±0.10b1.05±0.04b0.88±0.04c1.10±0.10b0.82±0.08c0.87±0.06c氨基葡萄糖25.90±0.07bc28.79±0.34a21.68±4.87e20.04±0.49e24.29±0.71cd27.44±0.28ab22.16±1.91de半乳糖2.19±0.02ab1.36±0.04e2.03±0.14abc1.82±0.01bc1.66±0.72de1.66±0.18de2.23±0.03a葡萄糖69.06±0.37c67.24±0.21c73.92±4.89ab75.84±0.70a71.93±0.18b68.10±0.34c52.65±1.52d葡萄糖醛酸1.36±0.06c1.52±0.01b1.34±0.12c1.44±0.18bc1.03±0.06d1.99±0.03a0.76±0.10e木糖NDNDNDNDNDND10.88±2.14a甘露糖NDNDNDNDNDND1.25±0.32a鼠李糖NDNDNDNDNDND9.21±1.73a
注:ND表示未检测到。
2.3 多酚
酚类物质是天然的抗氧化剂[18],3种食用菌样品均含有多酚(表3),菌丝体多酚含量均显著小于对应子实体,猴头菇菌丝体多酚含量仅约为前三潮猴头菇子实体的60%。榆黄菇同一潮次子实体间菌盖多酚含量均远高于菌柄,而茶树菇正好与之相反,相同潮次菌柄多酚含量高于菌盖。榆黄菇子实体随着潮次的增加多酚含量曾现递减的趋势。第三潮茶树菇多酚含量明显小于前二潮子实体。猴头菇前两潮子实体多酚含量无差异,第三潮子实体多酚含量略少于前两潮子实体。
表3 多酚、三萜、麦角固醇、麦角硫因、蛋白质含量 单位:mg/g
Table 3 Content of Polyphenols, triterpenes, ergosterol, ergothioneine, protein
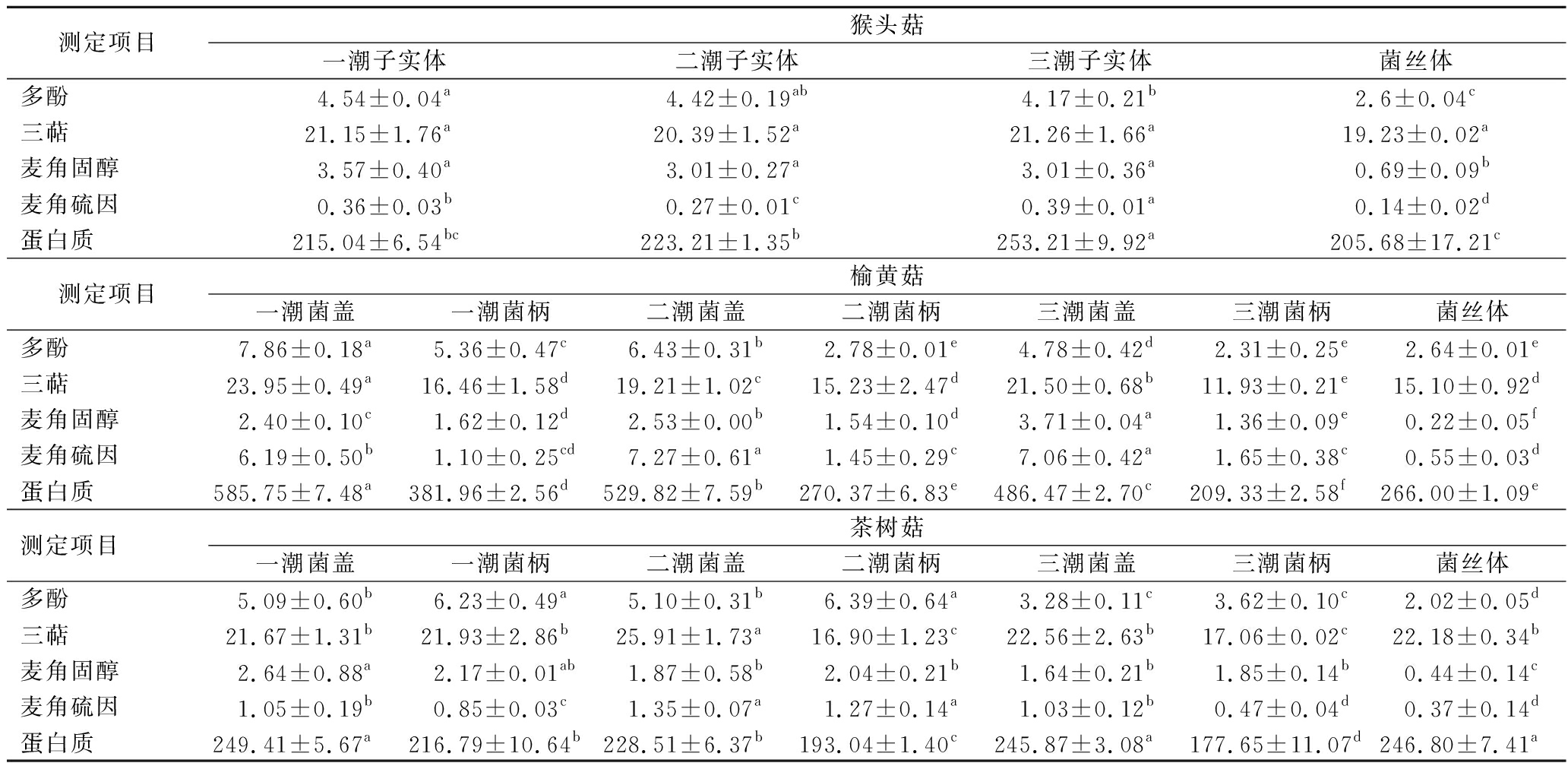
测定项目猴头菇一潮子实体二潮子实体三潮子实体菌丝体多酚4.54±0.04a4.42±0.19ab4.17±0.21b2.6±0.04c三萜21.15±1.76a20.39±1.52a21.26±1.66a19.23±0.02a麦角固醇3.57±0.40a3.01±0.27a3.01±0.36a0.69±0.09b麦角硫因0.36±0.03b0.27±0.01c0.39±0.01a0.14±0.02d蛋白质215.04±6.54bc223.21±1.35b253.21±9.92a205.68±17.21c测定项目榆黄菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体多酚7.86±0.18a5.36±0.47c6.43±0.31b2.78±0.01e4.78±0.42d2.31±0.25e2.64±0.01e三萜23.95±0.49a16.46±1.58d19.21±1.02c15.23±2.47d21.50±0.68b11.93±0.21e15.10±0.92d麦角固醇2.40±0.10c1.62±0.12d2.53±0.00b1.54±0.10d3.71±0.04a1.36±0.09e0.22±0.05f麦角硫因6.19±0.50b1.10±0.25cd7.27±0.61a1.45±0.29c7.06±0.42a1.65±0.38c0.55±0.03d蛋白质585.75±7.48a381.96±2.56d529.82±7.59b270.37±6.83e486.47±2.70c209.33±2.58f266.00±1.09e测定项目茶树菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体多酚5.09±0.60b6.23±0.49a5.10±0.31b6.39±0.64a3.28±0.11c3.62±0.10c2.02±0.05d三萜21.67±1.31b21.93±2.86b25.91±1.73a16.90±1.23c22.56±2.63b17.06±0.02c22.18±0.34b麦角固醇2.64±0.88a2.17±0.01ab1.87±0.58b2.04±0.21b1.64±0.21b1.85±0.14b0.44±0.14c麦角硫因1.05±0.19b0.85±0.03c1.35±0.07a1.27±0.14a1.03±0.12b0.47±0.04d0.37±0.14d蛋白质249.41±5.67a216.79±10.64b228.51±6.37b193.04±1.40c245.87±3.08a177.65±11.07d246.80±7.41a
2.4 三萜
三萜是食用菌中一大类生物活性物质,表现出抗肿瘤、抗氧化、抗菌、抗炎等生物活性[19],目前市场上三萜类产品十分稀少且价格昂贵。三萜同时存在于3种食用菌菌丝体和前三潮子实体中(表3)。前三潮榆黄菇菌盖三萜含量均高于对应菌柄,榆黄菇菌丝体三萜含量低于前两潮子实体。茶树菇菌丝体三萜含量高于茶树菇前三潮子实体菌柄。前三潮猴头菇子实体三萜含量略高于猴头菇菌丝体。
2.5 麦角固醇
麦角固醇又称麦角甾醇是食用菌中重要的次级代谢产物,在保护胃黏膜以及物质运输上发挥重要的作用[20]。麦角固醇标准品质量浓度100 μg/mL,保留时间为13.32 min(图2-a)。3种食用菌菌丝体麦角固醇含量均明显少于相应菌株的前三潮子实体(表3)。前三潮猴头菇、茶树菇子实体麦角固醇含量分别为3.01~3.57、1.64~2.64 mg/g,不同潮次的猴头菇、茶树菇子实体麦角固醇含量差异较小。榆黄菇同一潮次子实体菌盖麦角固醇含量均高于对应菌柄。
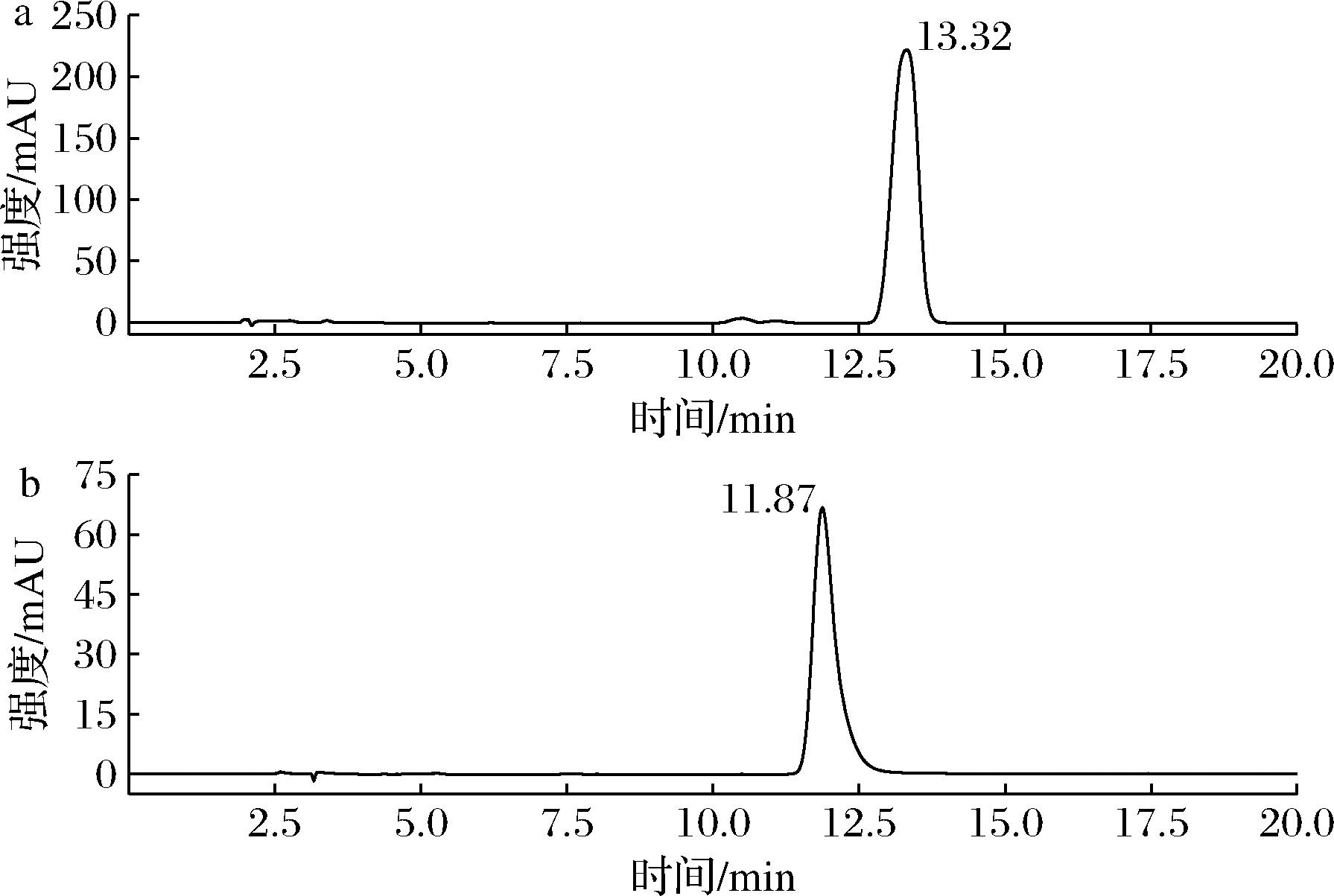
a-100 μg/mL麦角固醇标准品;b-100 μg/mL麦角硫因标准品
图2 麦角固醇、麦角硫因标准品HPLC
Fig.2 HPLC chromatogram of ergosterol and ergothioneine standard
2.6 麦角硫因
麦角硫因是食用菌具代表性的生物活性成分之一,具有清除自由基和抗氧化的功效[21]。麦角硫因标准品质量浓度100 μg/mL,保留时间为11.87 min(图2-b)。3种食用菌菌丝体麦角硫因含量远小于对应子实体(表3)。麦角硫因主要存在于榆黄菇子实体菌盖中,同一潮次榆黄菇子实体菌盖麦角硫因是菌柄的4.28~5.63倍,茶树菇、猴头菇子实体麦角硫因含量明显少于榆黄菇子实体。
2.7 核苷
采用高效液相色谱法测定食用菌样品中核苷含量,100 μg/mL核苷混合标准品按照保留时间先后分别是胞苷7.68 min;尿苷9.18 min;肌苷12.74 min;鸟苷13.87 min;腺苷31.10 min(图3)。
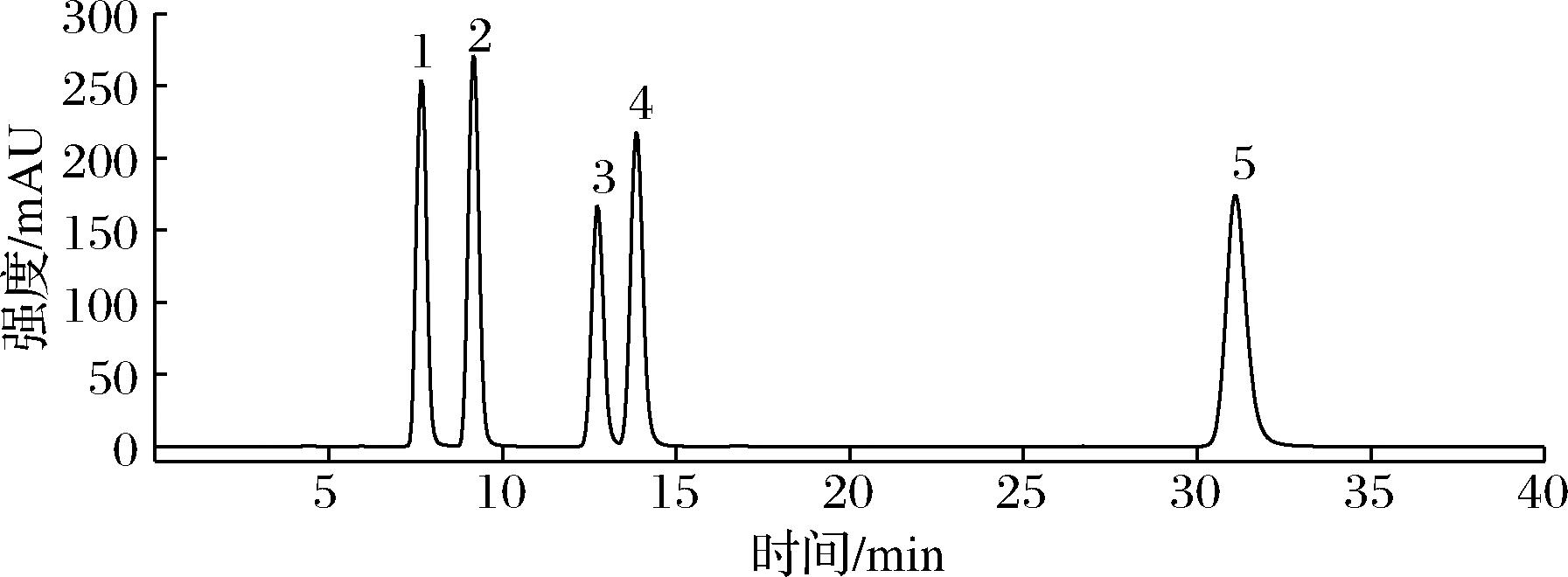
1-胞苷;2-尿苷;3-肌苷;4-鸟苷;5-腺苷
图3 核苷类物质混合标准品HPLC
Fig.3 HPLC chromatogram of mixed standard of nucleoside substances
3种食用菌前三潮子实体、菌丝体均含有胞苷、尿苷、肌苷、鸟苷、腺苷5种核苷(表4)。所有猴头菇、榆黄菇样品胞苷、尿苷、腺苷含量占比较多,肌苷和鸟苷含量较少。茶树菇子实体尿苷、肌苷、腺苷含量占比较多,胞苷和鸟苷含量较少,而茶树菇菌丝体胞苷、尿苷、肌苷含量占比较多,鸟苷和腺苷含量较少。猴头菇、茶树菇菌丝体核苷含量明显少于对应子实体,榆黄菇菌丝体核苷含量少于一、二潮子实体,高于第三潮子实体。
表4 核苷类成分含量 单位:mg/g
Table 4 Content of nucleoside components

核苷猴头菇一潮子实体二潮子实体三潮子实体菌丝体胞苷0.46±0.03a0.37±0.04b0.34±0.01b0.12±0.01c尿苷0.70±0.05ab0.74±0.037a0.68±0.00b0.23±0.02c肌苷0.08±0.00ab0.08±0.01a0.08±0.01ab0.07±0.01b鸟苷0.14±0.00c0.17±0.01a0.15±0.01b0.07±0.01d腺苷0.30±0.06c0.36±0.02b0.43±0.03a0.19±0.00d总量1.67±0.15a1.71±0.14a1.69±0.06a0.67±0.06b核苷榆黄菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体胞苷1.65±0.08a0.65±0.08c1.20±0.13b0.35±0.10d0.36±0.07d0.26±0.04d0.72±0.06c尿苷2.19±0.04a1.00±0.11c1.21±0.11b0.39±0.09d0.39±0.11d0.32±0.07d0.31±0.03d肌苷0.19±0.00a0.12±0.02cd0.14±0.01c0.09±0.02ef0.11±0.02de0.07±0.01f0.17±0.01b鸟苷0.13±0.02a0.11±0.01bc0.12±0.01ab0.09±0.00cd0.10±0.00cd0.09±0.00de0.08±0.01f腺苷0.39±0.04a0.37±0.07a0.31±0.05ab0.18±0.06cd0.16±0.04cd0.13±0.02d0.24±0.04bc总量4.55±0.06a2.26±0.27c2.98±0.03b1.10±0.27e1.11±0.23e0.87±0.13e1.51±0.16d核苷茶树菇一潮菌盖一潮菌柄二潮菌盖二潮菌柄三潮菌盖三潮菌柄菌丝体胞苷0.29±0.02a0.25±0.01ab0.28±0.03ab0.27±0.00ab0.24±0.01ab0.22±0.07b0.14±0.01c尿苷2.05±0.35a0.71±0.04cd0.96±0.08bc0.38±0.01de1.19±0.08b1.07±0.47bc0.19±0.01e肌苷0.41±0.04ab0.45±0.03a0.23±0.01d0.34±0.00bc0.31±0.01c0.43±0.10a0.09±0.00e鸟苷0.12±0.02a0.10±0.00ab0.10±0.01ab0.10±0.00ab0.09±0.01b0.09±0.02ab0.05±0.00c腺苷0.73±0.01b0.44±0.02c0.93±0.10a0.44±0.08c0.71±0.05b0.63±0.20b0.07±0.00d总量3.59±0.45a1.94±0.10bc2.50±0.21b1.54±0.10c2.54±0.14b2.45±0.87b0.53±0.03d
2.8 蛋白质及氨基酸组成
3种食用菌中榆黄菇子实体的蛋白质含量最为丰富(表3),一、二、三潮榆黄菇子实体菌盖和菌柄蛋白质含量分别为486.47~585.75 mg/g、209.33~381.96 mg/g,随着潮次的增加榆黄菇子实体蛋白质含量曾现递减的趋势。通过液体发酵获得的3种食用菌菌丝体蛋白质含量比较接近,其中猴头菇、榆黄菇、茶树菇菌丝体蛋白质含量分别为(205.68±17.21)、(266.00±1.09)、(246.80±7.41) mg/g。
3种食用菌子实体和菌丝体氨基酸种类齐全,含有10种非必须氨基酸和人体自身不能合成的7种必须氨基酸[电子版增强出版附表1所示(https://doi.org/10.13995/j.cnki.11-1802/ts.039001)]。猴头菇子实体氨基酸总量为14.17%~18.22%,其中包含必须氨基酸49.81~63.34 mg/g,非必须氨基酸91.84~118.85 mg/g。前三潮榆黄菇子实体菌盖、菌柄氨基酸总量分别为36.07%~40.04%、14.81%~26.55%,其中包含必须氨基酸134.59~153.80、53.95~99.99 mg/g,非必须氨基酸226.10~246.63、94.16~165.50 mg/g。前三潮茶树菇子实体菌盖、菌柄氨基酸总量分别为18.76%~20.06%、12.71%~16.99%,其中包含必须氨基酸68.14~72.02、42.96~59.14 mg/g,非必须氨基酸119.44~128.58、84.11~110.78 mg/g。榆黄菇、茶树菇前三潮子实体菌盖总氨基酸、必须氨基酸、非必须氨基酸均远高于同一潮次相应子实体菌柄。3种食用菌液体菌丝体氨基酸总含量比较接近菌粉总量15.21%~19.44%,其中包含必须氨基酸54.25~72.05 mg/g,非必须氨基酸97.82~122.33 mg/g。虽然3种食用菌菌丝体氨基酸在含量上与子实体有一定的差异,但氨基酸组成一致,均检测到17种氨基酸,其中含量最多的为谷氨酸和天冬氨酸两种鲜味氨基酸,经过加工后能曾现较好的风味,可用深加工成天然调味品。
3 结论与讨论
通过对不同培养方式收获的猴头菇、榆黄菇、茶树菇3种典型食用菌前三潮子实体和菌丝体中的多糖、多酚、三萜、麦角固醇、核苷、蛋白质、氨基酸系统分析,发现食用菌前三潮子实体中功能性成分同样存在于对应菌丝体,但是不同营养物质在子实体和菌丝体中生成特性不同。
3种食用菌菌丝体多糖含量十分丰富,这可能和液体发酵培养基中添加的葡萄糖有关,菌丝体利用葡萄糖在短期内代谢转化成多糖。但3种食用菌不同潮次子实体多糖分子质量明显高于对应菌丝体。单糖组成分析发现3种食用菌菌丝体多糖的单糖组分比对应子实体更丰富。3种食用菌菌丝体多酚、核苷、麦角固醇以及麦角硫因含量明显少于相应菌株的子实体。核苷是一类糖苷的总称,可被肠道上皮吸收,摄入的核苷含量越高容易导致高尿酸血症[22]。因此相比于子实体,菌丝体制成的系列产品更加适合痛风人群食用。在三萜分析中发现猴头菇、茶树菇菌丝体与子实体含量差异较小,榆黄菇菌丝体三萜含量略低于前两潮子实体,但三萜类化合物种类繁多,有研究发现灵芝菌丝体和子实体中三萜酸的组分存在显著差异,子实体中三萜酸组分相对较多[23]。关于食用菌菌丝体和子实体中三萜、多酚类物质组分还需要深入研究。3种食用菌前三潮子实体和菌丝体氨基酸组成中含量最多的均为谷氨酸,其次为天冬氨酸,谷氨酸及天冬氨酸是食用菌呈现鲜味的主要原因[24]。所有食用菌样品的必需氨基酸与氨基酸总量的比值较为理想,均接近1973年由FAO/WHO提出的理想蛋白质模式:必需氨基酸占氨基酸总量40%左右,必需氨基酸与非必须氨基酸比值达到60%以上。
随着生活水平普遍提高,以及“健康中国2030”战略实施,公众对具有健康功能的膳食产品需求不断提升,对于食用菌这种具有生物活性的健康食品需求量逐年增加。综合3种食用菌菌丝体和子实体系统分析,发现不同菌株、不同潮次、不同培养方式对食用菌营养品质均有不同程度的影响,不同培养方式对食用菌营养品质影响较大。食用菌菌丝体和子实体均具有同样的营养物质组成,都可以被开发为功能性食品;而液体发酵在生产多糖上具有显著优势,菌丝体和子实体都是理想的蛋白来源和补充剂,固体栽培方式在生产多酚、三萜、麦角硫因、麦角固醇、核苷这些小分子代谢产物上优于液体发酵。
[1] YANG F, WANG H L, FENG G Q, et al.Rapid identification of chemical constituents in Hericium erinaceus based on LC-MS/MS metabolomics[J].Journal of Food Quality, 2021, 2021:1-10.
[2] ZHANG S J, LI Y L, LI Z G, et al.Structure, anti-tumor activity, and potential anti-tumor mechanism of a fungus polysaccharide from Fomes officinalis[J].Carbohydrate Polymers, 2022, 295:119794.
[3] ELHUSSEINY S M, EL-MAHDY T S, AWAD M F, et al.Antiviral, cytotoxic, and antioxidant activities of three edible Agaricomycetes mushrooms:Pleurotus columbinus, Pleurotus sajor-caju, and Agaricus bisporus[J].Journal of Fungi, 2021, 7(8):645.
[4] THARU A K, PAUDEL M, JOSHI A P, et al.Screening of secondary metabolites and antioxidant activity of wild edible termite mushroom[J].Pharmacognosy Journal, 2022, 14(2):301-307.
[5] KANDASAMY S, CHINNAPPAN S, THANGASWAMY S, et al.Assessment of antioxidant, antibacterial activities and bioactive compounds of the wild edible mushroom Pleurotus sajor-caju[J].International Journal of Peptide Research and Therapeutics, 2020, 26(3):1575-1581.
[6] QIN X, MA G H, LIU L P, et al.Microwave-assisted degradation of β-D-glucan from Ganoderma lucidum and the structural and immunoregulatory properties of oligosaccharide fractions[J].International Journal of Biological Macromolecules, 2022, 220:1197-1211.
[7] CHEN W C, WU D, JIN Y L, et al.Pre-protective effect of polysaccharides purified from Hericium erinaceus against ethanol-induced gastric mucosal injury in rats[J].International Journal of Biological Macromolecules, 2020, 159:948-956.
[8] 况丹. 食用菌的营养价值及应用进展[J].现代食品, 2020(15):53-55.KUANG D.The nutritional value and application progress of edible fungi[J].Modern Food, 2020(15):53-55.
[9] 杨舒廷. 桦树桑黄菌丝体的液体发酵工艺优化及产品研发[D].长春:吉林大学, 2023.YANG S T.Liquid fermentation process optimization and product development of mycelium of birch Phellinus igniarius[D].Changchun:Jilin University, 2023.[10] 张峥. 大米主料蛹虫草液体发酵及菌丝体多糖的研究[D].天津:天津科技大学, 2021.ZHANG Z.Study on liquid fermentation of cordyceps militaris with rice as main material and polysaccharide of mycelia[D].Tianjin:Tianjin University of Science &Technology, 2021.
[11] 陈艳霞, 秦超, 张姗姗, 等.银丝草菇子实体、菌丝体和发酵液中营养成分比较分析[J].中国食用菌, 2021, 40(3):71-78.CHEN Y X, QIN C, ZHANG S S, et al.Analysis of nutrient content comparasion of fruiting body, mycelium and fermentation broth of Volvariella bombycina[J].Edible Fungi of China, 2021, 40(3):71-78.
[12] 张俊峰, 张忠, 汪雯翰, 等.桑黄菌丝体和子实体中次级代谢产物及其活性的比较[J].菌物学报, 2020, 39(2):398-408.ZHANG J F, ZHANG Z, WANG W H, et al.Comparison of active secondary metabolites between mycelia and fruiting bodies of Sanghuangporous Sanghuang[J].Mycosystema, 2020, 39(2):398-408.
[13] YUE F F, ZHANG J R, XU J X, et al.Effects of monosaccharide composition on quantitative analysis of total sugar content by phenol-sulfuric acid method[J].Frontiers in Nutrition, 2022, 9:963318.
[14] CSICSOR A, TOMB CZ E, KULCS
CZ E, KULCS R P.Antioxidant potential of humic substances measured by Folin-Ciocalteu, CUPRAC, QUENCHER-CUPRAC and ESR methods[J].Journal of Molecular Liquids, 2023, 391:123294.
R P.Antioxidant potential of humic substances measured by Folin-Ciocalteu, CUPRAC, QUENCHER-CUPRAC and ESR methods[J].Journal of Molecular Liquids, 2023, 391:123294.
[15] 赵武, 覃思明, 银慧慧, 等.不同采摘时期桃金娘叶三萜的动态变化研究[J].现代食品, 2023, 29(11):132-135.ZHAO W, QIN S M, YIN H H, et al.Study on the dynamic changes of triterpenes in Rhodomyrtus tomentosa leaves at different picking periods[J].Modern Food, 2023, 29(11):132-135.
[16] 刘袆帆, 郭烁璇, 林映妤, 等.石斛多糖的构效关系研究进展[J].现代食品科技, 2021, 37(1):308-338.LIU H F, GUO S X, LIN Y Y, et al.The relationship between the structure and function of Dendrobium polysaccharides:A review[J].Modern Food Science and Technology, 2021, 37(1):308-338.
[17] 王瑞琦, 王植朔, 那治国, 等.猴头菌子实体与液态发酵菌丝体活性成分差异及其在改善胃部疾病中的应用进展[J].食品安全质量检测学报, 2023, 14(4):239-248.WANG R Q, WANG Z S, NA Z G, et al.Difference of active components between fruiting body and liquid fermentation mycelium of Hericium erinaceus and its application in improving gastric diseases[J].Journal of Food Safety &Quality, 2023, 14(4):239-248.
[18] LANG Y X, GAO N X, ZANG Z H, et al.Classification and antioxidant assays of polyphenols:A review[J].Journal of Future Foods, 2024, 4(3):193-204.
[19] 魏巍, 赵文文, 孔祥辉, 等.食药用菌抗肿瘤及免疫调节作用的研究进展[J].食用菌, 2022, 44(4):1-5.WEI W, ZHAO W W, KONG X H, et al.Research progress on anti-tumor and immune regulation effects of edible and medicinal fungi[J].Edible Fungi, 2022, 44(4):1-5.
[20] 蒋俊, 宋小亚, 刘昆, 等.麦角甾醇在猴头菌种质评价中的应用研究初探[J].食药用菌, 2021, 29(4):323-327.JIANG J, SONG X Y, LIU K, et al.Preliminary application research of ergosterol in germplasm evaluation of Hericium erinaceus[J].Edible and Medicinal Mushrooms, 2021, 29(4):323-327.
[21] 荣爽. 麦角硫因, 食用菌类中的“长寿维生素”[J].中国食品, 2024(1):132-133.RONG S.Ergothionine, a “longevity vitamin” in edible fungi[J].China Food, 2024(1):132-133.
[22] 王家彬, 潘力.降解核苷作用乳酸菌的筛选及其潜在降尿酸功能[J].食品科学, 2022, 43(10):199-206.WANG J B, PAN L.Screening and uric acid-lowering potential of Nucleoside-degrading lactic acid bacteria[J].Food Science, 2022, 43(10):199-206.
[23] 陈慧. 灵芝菌丝体和子实体中三萜酸的高效提取及其组分初步分析[D].长沙:中南林业科技大学, 2015.CHEN H.The efficient extraction and preliminary analysis of constituents of triterpene acids of G.Lingzhi mycelia and fruiting bodies[D].Changsha:Central South University of Forestry &Technology, 2015.
[24] ZHANG Y, ZHANG P C, PENG H C, et al.Effects of cooking processes on protein nutritional values and volatile flavor substances of silver carp (Hypophthalmichthys molitrix)[J].Foods, 2023, 12(17):3169.