果酒是以新鲜水果或果汁为原料,经微生物全部或部分发酵酿制而成。我国果酒种类繁多,包括葡萄酒、苹果酒等。据果酒行业蓝皮书和中国产业信息网统计,2022年我国果酒线上销售额20.3亿元,市场规模已突破千亿元,果酒产业发展前景广阔[1]。然而,除葡萄酒以外,其他果酒发展时间短,尚属于工艺探索期,产品质量和安全存在诸多问题,例如桃子酒难以澄清,猕猴桃酒含有抗氧化多酚,使用SO2会造成果酒风味退化等问题[2]。当前,果酒安全问题主要包括重金属污染、农药残留和微生物污染等,其中微生物污染波及果酒种类多、污染范围广、造成损失最大。
果酒酒精发酵有大量微生物参与其中,包括有益及有害微生物。由于果酒发酵具有高糖、高酸、低pH等条件,极易引起腐败微生物定殖,造成发酵缓慢、停滞、产生不良挥发性风味物质等果酒质量问题。例如,腐败酵母会与商业酵母竞争营养物质影响发酵速率[3],真菌毒素影响商业酵母活性,导致发酵缓慢或停滞[4]。腐败微生物定殖还会造成瓶中二次发酵引起爆瓶风险、产生威胁人体健康的有害代谢物质等果酒安全问题[5]。
果酒产业在帮助解决水果滞销问题的同时也提升了水果产业链附加值,开辟了助农增收、乡村振兴的新路径。保证果酒高质量发展,也就保障了果酒产业引领的乡村振兴战略健康发展。在保障果酒安全发酵中,认识和监测腐败微生物,预防腐败微生物滋生,对保证果酒产品的质量具有重要意义。本文主要概述了果酒腐败微生物种类及其对果酒质量影响机制,重点总结了检测和防治腐败微生物方法在果酒中的应用及其优缺点,以期为果酒产业绿色、健康发展提供参考。
1 果酒中腐败微生物及其对果酒质量的影响
果酒生产中的腐败微生物污染一般是由发酵设备管理不当和野生腐败微生物增殖引起。果酒中常见的腐败微生物主要涉及酵母菌、细菌和丝状真菌。它们会造成发酵缓慢或停滞、产生不良挥发性风味物质、影响果酒理化性质等果酒质量问题和二次发酵、产生威胁人体健康的物质等果酒安全问题(表1)。
表1 果酒中主要腐败微生物、污染源、不良代谢产物及其对果酒的不良影响
Table 1 Main spoilage microorganisms, pollution sources, and undesirable metabolites in fruit wine and their adverse effects on fruit wine
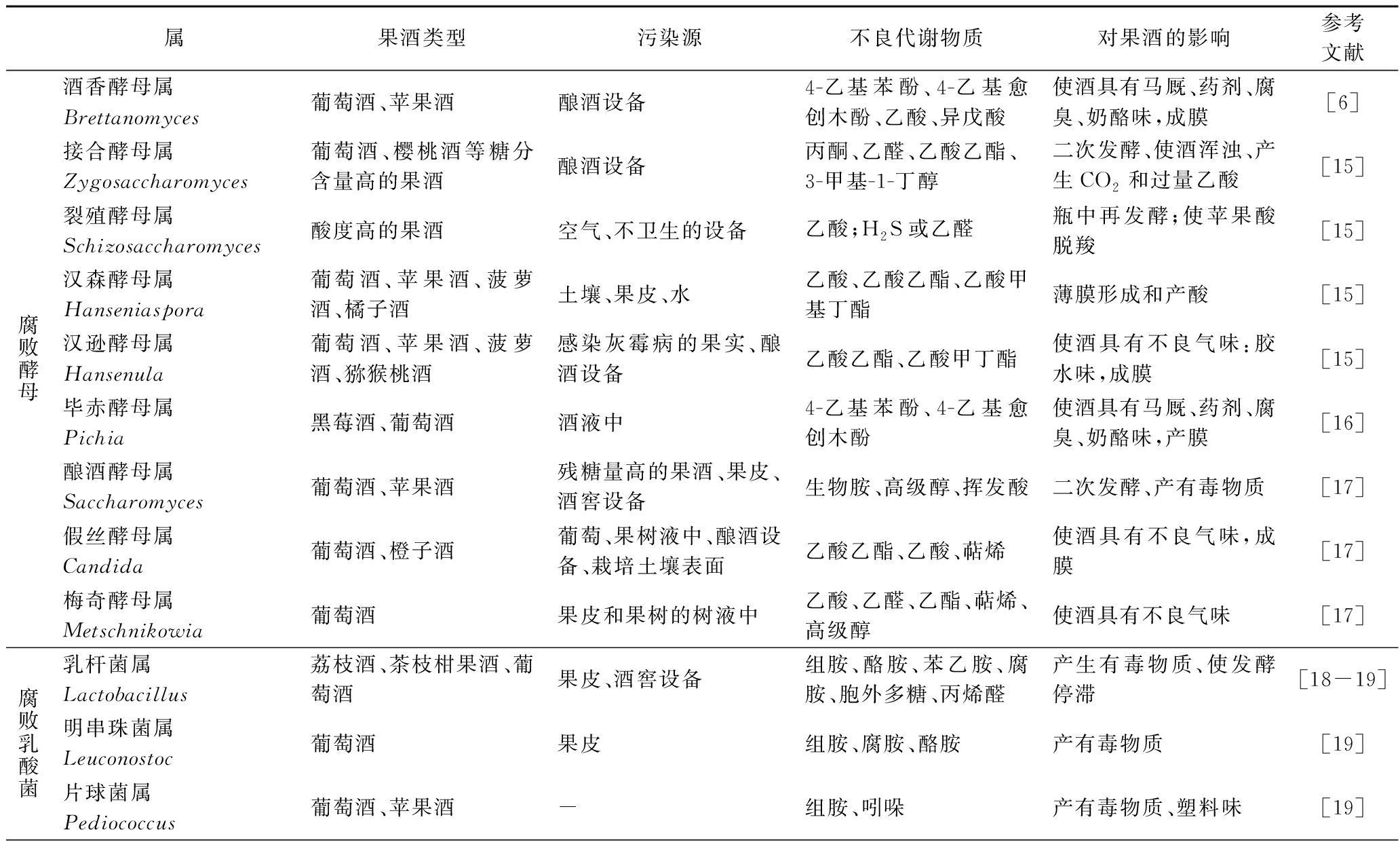
属果酒类型污染源不良代谢物质对果酒的影响参考文献腐败酵母酒香酵母属Brettanomyces葡萄酒、苹果酒酿酒设备4-乙基苯酚、4-乙基愈创木酚、乙酸、异戊酸使酒具有马厩、药剂、腐臭、奶酪味,成膜[6]接合酵母属Zygosaccharomyces 葡萄酒、樱桃酒等糖分含量高的果酒酿酒设备丙酮、乙醛、乙酸乙酯、3-甲基-1-丁醇二次发酵、使酒浑浊、产生CO2和过量乙酸[15]裂殖酵母属Schizosaccharomyces酸度高的果酒空气、不卫生的设备乙酸;H2S或乙醛瓶中再发酵;使苹果酸脱羧[15]汉森酵母属Hanseniaspora葡萄酒、苹果酒、菠萝酒、橘子酒土壤、果皮、水乙酸、乙酸乙酯、乙酸甲基丁酯薄膜形成和产酸[15]汉逊酵母属Hansenula葡萄酒、苹果酒、菠萝酒、猕猴桃酒感染灰霉病的果实、酿酒设备乙酸乙酯、乙酸甲丁酯使酒具有不良气味:胶水味,成膜[15]毕赤酵母属Pichia黑莓酒、葡萄酒酒液中4-乙基苯酚、4-乙基愈创木酚使酒具有马厩、药剂、腐臭、奶酪味,产膜[16]酿酒酵母属Saccharomyces葡萄酒、苹果酒残糖量高的果酒、果皮、酒窖设备生物胺、高级醇、挥发酸二次发酵、产有毒物质[17]假丝酵母属Candida葡萄酒、橙子酒葡萄、果树液中、酿酒设备、栽培土壤表面乙酸乙酯、乙酸、萜烯使酒具有不良气味,成膜[17]梅奇酵母属Metschnikowia葡萄酒果皮和果树的树液中乙酸、乙醛、乙酯、萜烯、高级醇使酒具有不良气味[17]腐败乳酸菌乳杆菌属Lactobacillus荔枝酒、茶枝柑果酒、葡萄酒果皮、酒窖设备组胺、酪胺、苯乙胺、腐胺、胞外多糖、丙烯醛产生有毒物质、使发酵停滞[18-19]明串珠菌属Leuconostoc葡萄酒果皮组胺、腐胺、酪胺产有毒物质[19]片球菌属Pediococcus葡萄酒、苹果酒-组胺、吲哚产有毒物质、塑料味[19]
续表1

属果酒类型污染源不良代谢物质对果酒的影响参考文献腐败醋酸菌醋酸杆菌属Acetobacter葡萄酒、蓝莓酒果皮、空气、酿酒设备乙酸、乙醛、乙酸乙酯果酒腐败、苦醋味[20]葡糖杆菌属Gluconobacter葡萄酒、苹果酒空气、酒液乙酸苦醋味、引起酒变质[20]芽孢杆菌属Bacillus葡萄酒土壤、水源、水果、果汁吲哚、酚类化合物、挥发酸浑浊沉淀,“塑料味”,降低酒石酸[20]腐败丝状真菌葡萄孢属Botrytis葡萄酒、草莓酒、樱桃酒、桃子酒果皮、橡木桶漆酶灰霉病、果实腐烂、酸败[21]衣霉属Byssochlamys葡萄酒果皮、果汁青霉素和丝衣霉酸果实腐烂[14]链格孢属Alternaria葡萄酒、苹果酒、桃子酒、李子酒、樱桃酒,果皮、果汁二苯并吡啶酮衍生物、链格孢霉毒素果实腐烂[21]青霉属Penicillium葡萄酒、桃子酒、苹果酒、樱桃酒果皮棒曲霉素、柑橘素果实腐烂、产蘑菇、泥土味、有毒物质[5]曲霉属Aspergillus葡萄酒灰尘散布、果皮赭曲霉毒素B1、A,扶马毒素B2果实腐烂、产有害化合物[5]毛霉属Mucor葡萄酒、草莓酒果实表面、裂口-多汁软腐病,毛霉腐病[5]
1.1 腐败酵母
降低食品质量、产生有害物质的酵母被认为是腐败酵母。果酒中的腐败酵母一般来源于水果表皮、酿酒设备、发酵环境等,其中水果表皮是其主要来源[6]。研究表明,附着在水果表皮的腐败非酿酒酵母在不恰当的发酵条件中定殖,会与商业酿酒酵母竞争营养物质,造成果酒发酵迟缓或停滞[3]。腐败酵母还会通过其生理代谢产生不良风味物质影响果酒的感官品质。酒香酵母属(Brettanomyces)中的布鲁塞尔酒香酵母(B.bruxellensis)和异常酒香酵母(B.anomalus)是果酒中最常见的腐败酵母。TUBIA等[7]发现B.bruxellensis主要存在于消毒不彻底的酿酒设备中,进入果酒中可以将羟基肉桂酸合成为乙酸和异戊酸等挥发性脂肪酸,带给果酒恶臭腐败的气味。有研究对B.anomalus污染的苹果酒进行感官评估和香气量化,通过GC-MS和HPLC分析发现被污染的酒具有更高的挥发性酚含量(4-乙基苯酚、4-乙基愈创木酚),感官分析发现挥发性酚造成的异味严重影响苹果酒质量[8]。
1.2 腐败细菌
乳酸菌和醋酸菌是在果酒生产常见的腐败细菌。乳酸菌包括乳酸杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)等,主要来源于水果果皮和未清洁干净的酿酒设备[9]。研究发现造成果酒质量问题的大多是异型发酵乳酸杆菌(L.fermentum),它能够同时分解果酒中的糖、酸等物质变成丙烯醛和其他脂肪酸,使酒产生烂水果味[9]。随着对乳酸菌的深入研究,发现乳酸菌产生的生物胺还会造成果酒安全问题。当人体过量摄入生物胺时会出现头痛、呼吸紊乱、心悸,甚至脑出血死亡[10]。醋酸菌能将果酒中的乙醇氧化成乙酸、乙醛,产生乙酸乙酯,使果酒挥发酸含量上升,出现老鼠味、指甲油味等异味,引发果酒质量问题,给企业带来重大经济损失[11]。研究表明,当浆果破损或受到灰霉菌侵染、酒液与空气长期接触、酿酒设备清洁不当时,会引起以醋杆菌属(Acetobacter)和葡糖杆菌属(Gluconobacter)的大量繁殖[11]。酒液与空气长期接触是引起醋酸菌繁殖的主要原因,有研究发现将葡萄酒完全与氧气接触达时,醋酸菌快速增加到108 个/mL;而当氧气含量≤50%时,醋酸菌的浓度大幅度降低[12]。
1.3 腐败丝状真菌
腐败丝状真菌包括曲霉属(Aspergillus)、青霉属(Penicillium)、链格孢属(Alternaria)等,一般存在于果园土壤中。果实成熟腐烂、潮湿环境、过度灌溉、果皮较薄等因素会诱发丝状真菌污染[13]。当腐败丝状真菌进入果酒中会产生有毒的次生代谢产物,这些产物具有致癌性、致畸性和神经毒性,会引起食品安全问题,严重危害人体健康[3]。真菌毒素包括赭曲霉毒素A、黄曲霉毒素B1以及伏马毒素,均在葡萄酒、苹果酒、樱桃酒等果酒中被检出。果酒酿造中的浸渍工艺会加速真菌毒素的释放,如葡萄酒的浸渍工艺会导致酒中赭曲霉毒素A含量较高[14]。酵母外壁的甘露糖蛋白对真菌毒素有吸附作用,酵母细胞壁吸附后毒素后会堵塞其物质交换通路,影响酵母生长代谢,进而导致发酵停滞或缓慢[13]。具体见表1。
2 腐败微生物及其代谢产物检测技术应用现状
2.1 腐败微生物检测
腐败微生物的检测是预防果酒污染的重要措施,针对不同类型微生物的检测方法存在差异(图1),本文对目前所使用的主要控制方法的优劣进行了比较。传统的微生物学技术通常使用平板划线来分离微生物,这种方法培养时间长,无法检测到不可培养的微生物。现代分子学方法可以快速准确的检测和鉴定果酒酿造过程中的腐败微生物,主要包括实时聚合酶链式反应(real-time PCR, RT-PCR/qPCR)、16S rRNA基因序列分析、脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)、线粒体DNA限制性分析(restriction fragment length polymorphism,RFLP)、扩增片段长度多态性(amplified fragment length polymorphism,AFLP)等[22]。有研究使用RFLP鉴定了不同葡萄酒产区的葡萄酒中分离的Brettanomyces菌株[23]。也有研究使用16S rRNA基因序列分析和内部转录间隔区分析技术鉴定了菠萝蜜酒、桑葚酒、草莓酒、橙子酒、葡萄酒等果酒中能够产生组胺的细菌和酵母[24]。虽然现代分子学技术检测的速度快、精度高、范围广,但是对于果酒工业化生产而言,现代分子学技术检测时间仍然较长,因此,现代分子学技术仍需进一步优化研究。表2总结了本文提及的腐败微生物及其不良产物检测方法的优缺点。
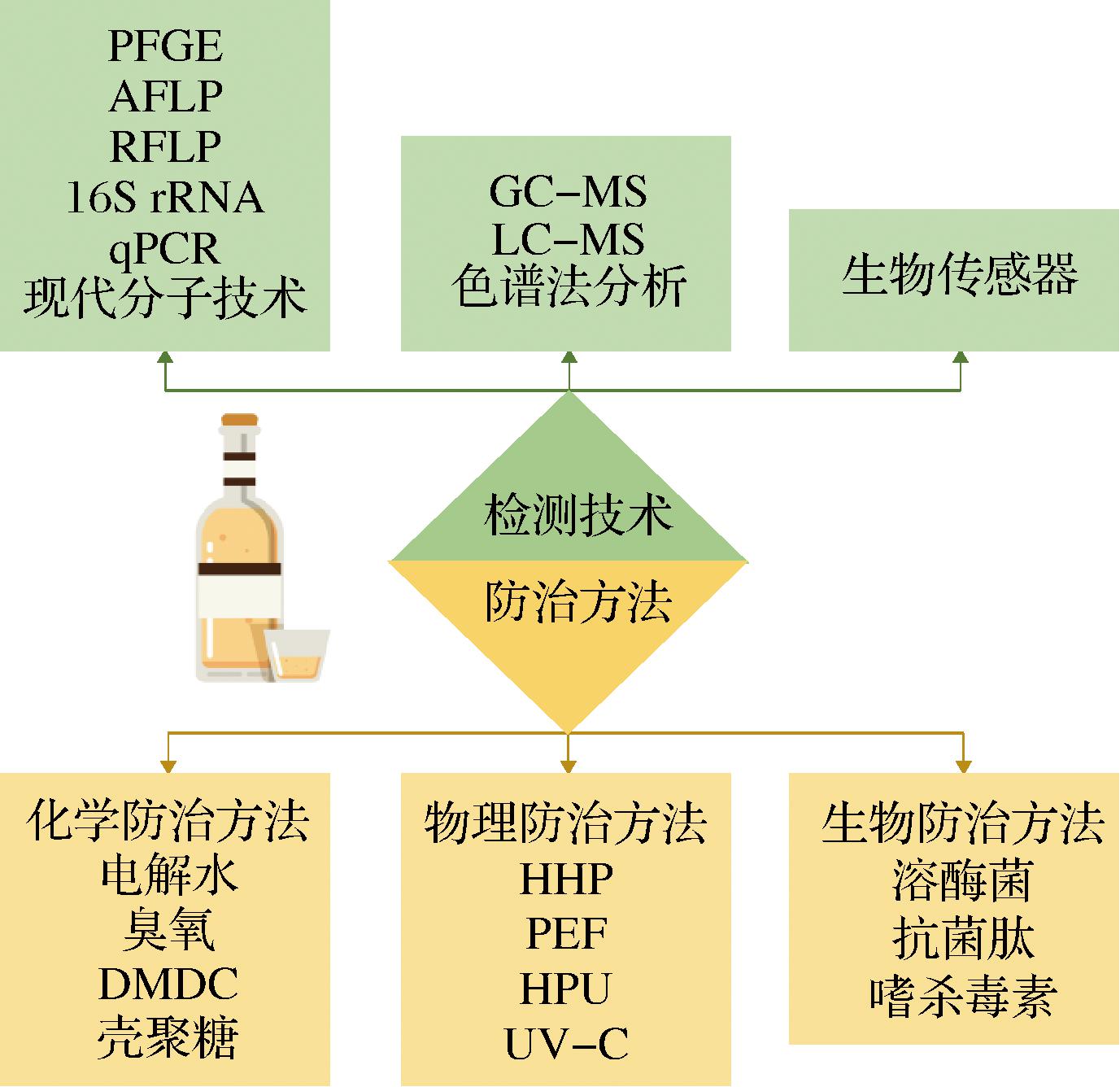
图1 本文中介绍的检测和防治腐败微生物的方法
Fig.1 The methods of detecting and controlling spoilage microorganisms described in this review
表2 果酒中腐败微生物及不良产物检测方法的优缺点
Table 2 The advantages and disadvantages of the detection method of corrupt microorganisms and products in fruit wine

设备方法优点缺点参考文献色谱法高精度、灵敏度、分辨率设备昂贵、检测速度慢、操作复杂[22]生物传感器便携,检测速度快,重复性好,稳定,经济传感元件成本高、寿命短,不同物质需要的特定系统[22]qPCR分析步骤简单低灵敏性[22]16S rRNA基因序列基因分布广泛、丰度较高、成本较低需要纯培养、需大量DNA[22]RFLP检测快速且易于操作,与PCR相比更可靠检测灵敏度有限,耗时,费力,难以自动化[22]AFLP检测高遗传多态性获得适当的引物对以区分不同物种非常耗时[25]PFGE处理快速,能检测到酒香酵母不同大小的DNA片段的分辨率低,不适用于不可培养的微生物[22]
2.2 不良代谢产物检测
监测腐败微生物的不良代谢物的主要方法有色谱法和生物传感器(图1)。液相色谱法能够精准检测果酒中生物胺、乙酸、漆酶等影响果酒质量的物质。FABJANOWICZ等[26]用盐析液-液微萃取和GC-MS结合的方式测得了23种葡萄酒中的11种生物胺。但是色谱法的设备昂贵、检测速度慢和操作复杂[22]。生物传感具有便携、检测速度快等优势更适合应用于工业生产中[27]。在果酒中一般使用电化学生物传感器。GUAN等[28]使用一种基于Co-59MOF金属有机材料为信号探头的电化学生物传感器,可以高效快速检测到葡萄酒中1 fg/mL~50 ng/mL的赭曲霉毒素A。然而,电化学生物传感器对于一些物质需要的特定系统和生物识别元件才能进行检测,并且生物传感元件成本高、寿命短、检测蛋白质等大分子时存在电极结垢和非特异性吸附的问题[27]。果酒中不良产物的检测和去除会增加产品成本,影响果酒产品质量。因此,在果酒工业生产中,预防腐败微生物滋生、避免不良产物产生是关键。
3 腐败微生物的防治研究进展
3.1 化学控制方法
人体摄入SO2会引起人体过敏反应,而电解水、臭氧、二甲基二碳酸盐(dimethyl dicarbonate,DMDC)和壳聚糖可替代SO2,成为果中抑制腐败微生物的新化学方法。
3.1.1 电解水、臭氧
水果原料采收时,采用臭氧和电解水杀菌可以有效减少腐败微生物进入果酒发酵阶段。电解水通过电解盐溶液产生的不同pH值使微生物表面的氧化还原电位失衡,从而起到灭菌作用。臭氧具有强氧化性,具有广谱抑菌和高效的特点。CRAVERO等[29]在酿酒葡萄果实表面培养酒香酵母后,分别使用电解水、水溶液臭氧、气态臭氧对其进行杀菌处理,结果显示所有处理都起到有效的抑制作用,其中气态臭氧处理能明显抑制酒香酵母。此外,臭氧还被应用酿酒设备灭菌中,ENGLEZOS等[30]评价了水溶液臭氧和气态臭氧处理的灭菌有效性,发现3.5 mg/L臭氧水溶液处理30 min可有效灭活污染输送酒的管道和装瓶机的Brettanomyces等腐败酵母。此外,臭氧可以抑制真菌孢子和菌丝生长,其氧化作用还能破坏真菌毒素,降低真菌毒素的危害[31]。
3.1.2 DMDC
DMDC是我国《食品安全国家标准食品添加剂使用标准》中批准使用的一种果蔬饮料防腐剂,其具有作用迅速,广谱灭菌的效果,DMDC的焦碳酸基团和微生物细胞酶蛋白发生甲氧基羧化反应,使酶蛋白的结构发生变化,导致微生物死亡[32]。CHENG等[33]使用两种浓度的DMDC杀灭橙子果汁中的霉菌和酵母,结果显示2种处理均将微生物种群降低至检出限水平。但有研究发现DMDC对细菌的灭活效果较差。邓莎莎[18]在荔枝和茶枝柑果酒中使用亚硫酸盐、DMDC、巴氏杀菌法对比分析DMDC的灭菌效果,结果表明在茶枝柑果汁中,DMDC处理后的发酵液中仍然存在乳酸菌。因此,DMDC应联用其他杀菌技术抑制果酒中的细菌[5]。
3.1.3 壳聚糖
壳聚糖是一种从水产养殖废物甲壳素中获得的抗菌物质,主要依靠氨基与微生物细胞膜相互作用,使微生物不能维持基本代谢,从而抑制其生长。研究发现壳聚糖及衍生物对Lactobacillus hilgardii,Oenococcus oeni和B.bruxellensis等腐败微生物菌均有较好的抑制效果[34]。但是醋酸菌对于壳聚糖具有耐受性,并且壳聚糖不能防止甜葡萄酒再发酵[35]。研究表明,高浓度糖会增强了酵母对壳聚糖的耐受性,从而降低了抑菌效率[35]。SCANSANI等[36]进一步研究发现,添加壳聚糖会影响葡萄酒的化学成分,主要引起α-酮戊二酸、高级醇、乙酯等物质含量变化。也有研究发现由S.cerevisiae接种发酵的蓝莓酒,添加壳聚糖后会引起萜烯类物质含量的减少,减弱蓝莓酒的花果香,与SCANSANI的研究结果相似[37]。
3.2 物理控制方法
近年来,随着消费者对于有机果酒需求的增加,物理方法控制腐败微生物因其高灭菌效率和较少风味损失受到广泛关注。控制腐败微生物的物理方法有高静水压(high hydrostatic pressure,HHP)、脉冲电场(pulsed electric fields,PEF)、超声波、紫外线辐射。
3.2.1 HHP
HHP通常采用水基溶液作为介质,使产品处在非常高的压力环境下(100~800 MPa),使微生物和酶的全部或部分失活。HHP作为非热杀菌技术,不会改变果酒风味和营养价值[38]。研究发现200~500 MPa的压力能够灭活酵母和细菌,而不会显著改变其感官特性[38]。Brettanomyces作为葡萄酒中最常见的腐败微生物,在400 MPa的压力5 s下被有效失活[39]。但是有研究发现更高压力的处理(>650 MPa)会致使酚类化合物的缩合反应增加,改变红葡萄酒的理化特性[40]。此外,果酒中的酵母菌、霉菌、乳酸菌和真菌孢子对加压的敏感性不同,HHP单一的灭菌手段对腐败微生物的杀灭具有局限性,其高昂的设备成本难以大规模应用于果酒工业生产。
3.2.2 PEF
PEF是在处理室内的2个电极之间向样品施加高压的短脉冲,引起微生物细胞的细胞质膜中孔的形成,进而影响微生物稳态,导致微生物死亡。PEF处理不会影响果酒的理化性质,还能快速有效杀灭腐败微生物。研究发现PEF应用于霞多丽葡萄酒中能避免微生物污染,且不影响霞多丽葡萄酒的基本化学指标和香气成分[41]。但使用PEF灭菌也存在一定风险,在灭菌过程中电极和果酒之间需要直接接触,电极材料腐蚀以及离子会从金属电极迁移至果酒中,从而造成污染[42]。有研究使用PEF对2种葡萄酒中的B.bruxellensis进行灭菌处理后,发现Ni+从未经处理的0.510 mg/kg增加到0.820 mg/kg[43]。PEF仍是具有应用前景的物理杀菌技术之一,其具有灭活微生物的能力,在果酒工业生产中可替代SO2控制腐败微生物,并且PEF的处理室能够并入酒庄的酿造流水线,可适配果酒大规模生产灭菌需求。
3.2.3 高功率超声波(high power ultrasound,HPU)
HPU灭菌是通过在液体系统中使气泡破裂产生超声波和自由基,造成高温、高强、氧化作用可致使细胞膜溶解。HPU能够均质杀菌,并且对微生物灭活效率主要与功率大小、作用时间和微生物敏感性有关。研究发现HPU处理敏感性与细胞体积大小一致,细胞体积越小,抗超声波能力越强,体积大的细胞更敏感[44]。此外,革兰氏阳性菌(G+)细胞壁比革兰氏阴性菌(G-)更厚,可免受超声波作用[44]。HPU作为单一灭菌手段时,灭菌不彻底且能耗较高,因此一般会结合其他灭菌手段协同灭菌[45]。LEE等[46]使用超声波结合热和低压处理苹果酒,发现低压-热超声波的灭菌效率远大于热超声波和低压超声波。此外,近年来学者发现超声波处理还可以帮助果酒加速陈化,丰富香气。史彬星[47]使用超声波处理沙棘果酒后,芳香类物质显著提升。
3.2.4 紫外线辐照(ultraviolet radiation-C,UV-C)灭菌
DNA能有效吸收在250~260 nm的波长,使用200~280 nm的紫外线,会使DNA发生光化学反应,使细胞失去复制能力。UV-C能有效地减少葡萄酒中的腐败微生物,但是UV-C的有效性会受到微生物敏感度、光密度和个体遮蔽效应的影响[48]。研究发现,使用UV-C会影响葡萄酒颜色的和香气成分(花色苷含量),这可能会影响果酒的感官质量[49]。葡萄酒中β-大马酮和芳樟醇经UV-C照射后会被分解[50]。有研究发现,经紫外线照射后葡萄酒中会产生挥发性硫化合物和2-氨基苯乙酮,这些物质的产生会致使葡萄酒挥发酸含量上升和“非典型老化”[49]。因此,UV-C照射杀菌是否会造成感官质量下降仍需进一步研究。
3.3 生物防治方法
生物防治是近年来新兴的灭菌方法,主要是利用生物学资源抑制或消除果酒中的有害微生物及其代谢产物。相较于化学、物理防治方法,生物防治方法具有绿色、健康、高效、不影响果酒感官质量等特点。近年来,使用溶菌酶、抗菌肽(antimicrobial peptide,AMP)和嗜杀毒素抑制果酒中的腐败微生物已经成为学术界的研究热点。
3.3.1 溶菌酶
溶菌酶是一种具备广谱抑菌活性、食用安全性的生物防腐剂。溶菌酶通过水解细胞壁造成微生物死亡,主要对G+有抑制作用,而对G-的抑制效率较低。近些年,学者们为了扩展溶菌酶抑菌谱,致力于通过不同改性手段调整其分子结构,使其能够抑制G-。有研究使用Na2SO3修饰溶菌酶的二硫键,增强了溶菌酶对G-的抑菌活性[51]。但是化学修饰方法中试剂的毒性会影响在果酒中的应用。生物改性与化学修饰相比,更具安全性。ZHU等[52]利用可抑制G-菌生长的AMP对溶菌酶的C-末端和N-末端进行融合,发现N-末端融合重组体对G-表现出更强的抗菌性能。随着材料技术发展,材料改性比酶改性更经济简便,有研究发现将溶菌酶共价固定在壳聚糖上,能够高效连续灭杀葡萄酒中的乳酸菌[53]。
3.3.2 AMP
AMP是低分子质量的寡肽,通过与细胞膜相互作用来诱导微生物死亡。AMPs作为一种新兴的天然生物防腐剂,因其高效、环保和低毒的特点在近些年受到广泛关注。研究发现,由枯草芽孢杆菌产生的AMPs能够有效抑制灰霉菌[54]。多种AMPs联用可以扩大AMPs的抑菌范围,联合使用可显著抑制赤霞珠干红葡萄酒中的多种真菌,同时抑制赭曲霉毒素A的生成[55]。使用天然AMPs来抑制腐败微生物非常昂贵,通过基因工程技术使AMPs异源表达,不仅可以增加AMPs的产量,还能增强AMPs的抑菌效率。黄钦耿等[56]将小菜蛾的AMPs基因mor-3整合到毕赤酵母基因组中,发现可增加AMPs产量至248.98 mg/L,且对G-有特异性抑菌活性。
3.3.3 嗜杀毒素
嗜杀毒素是由酵母菌分泌的蛋白质类抗菌化合物。由Saccharomyces eubayanus产生的嗜杀毒素SeKT能有效抑制葡萄酒发酵过程中的敏感腐败酵母[57]。嗜杀毒素作为酵母菌的产物,无毒无害且能抑制杂菌。研究发现,将嗜杀菌株直接接种于果酒酿造过程中可以净化发酵体系[58]。为了获得具有优良酿酒特性的嗜杀菌株,有研究使用原生质体融合技术,对优良酿酒学特性的酵母菌株和广谱抑菌的嗜杀菌株进行融合[59]。此外,研究发现使用耐受性强的嗜杀菌株与发酵菌株混合发酵,发现其嗜杀毒素不仅能抑制发酵中的腐败酵母,还能保证发酵进程顺利进行[60]。果酒中腐败微生物防治方法的优缺点如表3所示。
表3 果酒中腐败微生物防治方法的优缺点
Table 3 The advantages and disadvantages of the treatment of corrupt microorganisms in fruit wine
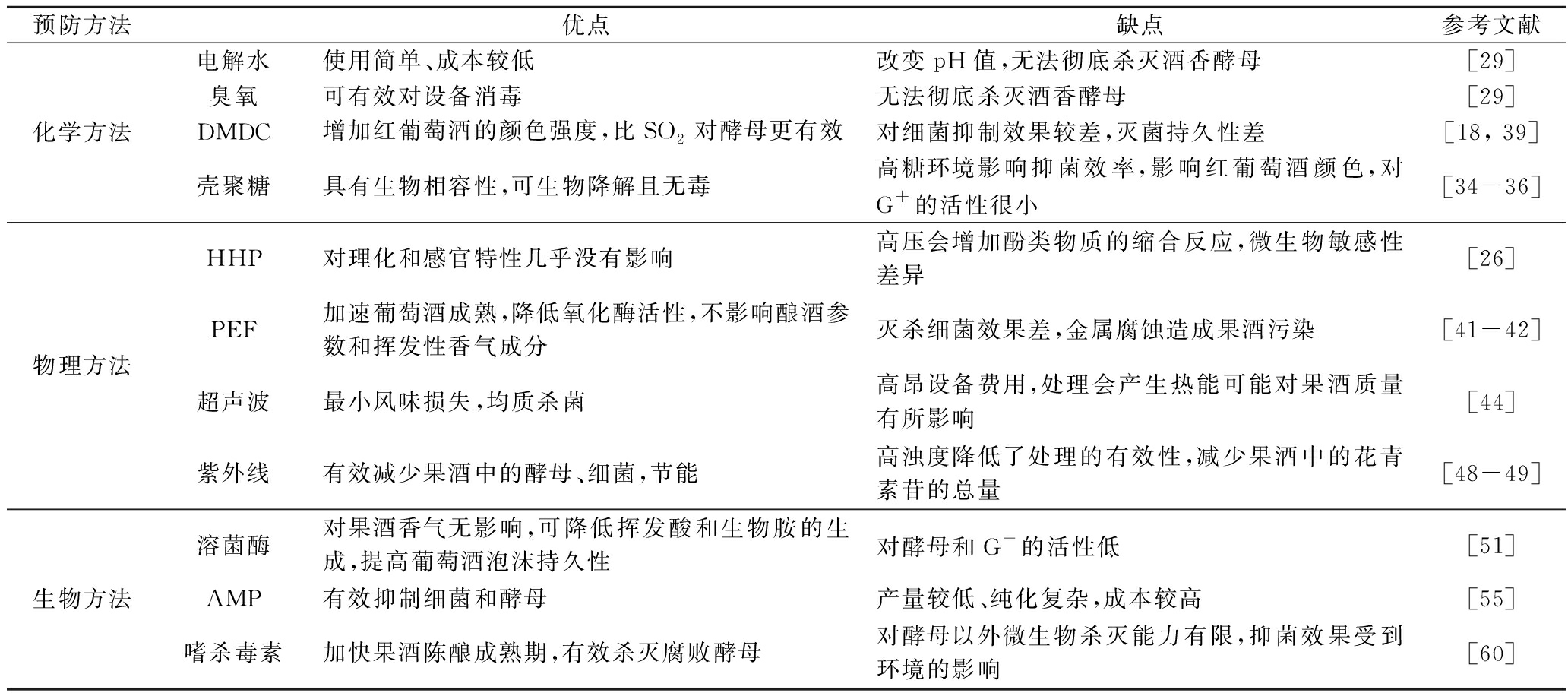
预防方法优点缺点参考文献化学方法电解水使用简单、成本较低改变pH值,无法彻底杀灭酒香酵母[29]臭氧可有效对设备消毒无法彻底杀灭酒香酵母[29]DMDC增加红葡萄酒的颜色强度,比SO2对酵母更有效对细菌抑制效果较差,灭菌持久性差[18, 39]壳聚糖具有生物相容性,可生物降解且无毒高糖环境影响抑菌效率,影响红葡萄酒颜色,对G+的活性很小[34-36]物理方法HHP对理化和感官特性几乎没有影响高压会增加酚类物质的缩合反应,微生物敏感性差异[26]PEF加速葡萄酒成熟,降低氧化酶活性,不影响酿酒参数和挥发性香气成分灭杀细菌效果差,金属腐蚀造成果酒污染[41-42]超声波最小风味损失,均质杀菌高昂设备费用,处理会产生热能可能对果酒质量有所影响[44]紫外线有效减少果酒中的酵母、细菌,节能高浊度降低了处理的有效性,减少果酒中的花青素苷的总量[48-49]生物方法溶菌酶对果酒香气无影响,可降低挥发酸和生物胺的生成,提高葡萄酒泡沫持久性对酵母和G-的活性低[51]AMP有效抑制细菌和酵母产量较低、纯化复杂,成本较高[55]嗜杀毒素加快果酒陈酿成熟期,有效杀灭腐败酵母对酵母以外微生物杀灭能力有限,抑菌效果受到环境的影响[60]
4 总结与展望
本文主要对果酒中常见的腐败微生物的种类、来源及危害进行了阐释和归纳,总结了检测与预防腐败微生物的措施。早期监测和预防腐败微生物污染是防止果酒劣变的关键,色谱法的精度和灵敏度高,生物传感器检测速度快、便捷,化学灭菌方法经济、简便,物理和生物灭菌方法安全、高效。然而这些技术应用依旧存在一些不可忽视的问题:一是果酒中腐败微生物种类繁多、来源复杂、检测阈值低,缺乏价格低廉且高效的检测方法;二是物理、化学灭菌处理会改变果酒中的一些化学指标,给果酒质量带来不良影响;三是生物防治的高成本和灭菌局限性是果酒工业普及的难点所在;四是单一灭菌手段无法全面彻底杀灭腐败微生物。因此,今后的研究需进一步解析不同灭菌技术影响果酒中化学物质的机制,探究联合不同灭菌技术降本增效的方法,并建立联合灭菌技术的统一标准。
[1] 中国产业信息网. 2021年中国饮料酒产业链及产量现状分析:产量同比增长2.73%[EB/OL].(2022-03-24)[2022-04-12].http://chyxx.com/industry/1102599.html.html.
[2] 刘明, 郭意如, 张世杰, 等.黄桃酒澄清工艺研究[J].保鲜与加工, 2020, 20(5):94-99.LIU M, GUO Y R, ZHANG S J, et al.Studies on clarification technology of yellow peach wine[J].Storage and Process, 2020, 20(5):94-99.
[3] DI GIANVITO P, ENGLEZOS V, RANTSIOU K, et al.Bioprotection strategies in winemaking[J].International Journal of Food Microbiology, 2022, 364:109532.
[4] JAKOPOVI Ž,
Ž,  I
I A K H, MRV
A K H, MRV I
I J, et al.Properties and fermentation activity of industrial yeasts Saccharomyces cerevisiae, S.uvarum, Candida utilis and Kluyveromyces marxianus exposed to AFB1, OTA and ZEA[J].Food Technology and Biotechnology, 2018, 56(2):208-217.
J, et al.Properties and fermentation activity of industrial yeasts Saccharomyces cerevisiae, S.uvarum, Candida utilis and Kluyveromyces marxianus exposed to AFB1, OTA and ZEA[J].Food Technology and Biotechnology, 2018, 56(2):208-217.
[5] UBEDA C, HORNEDO-ORTEGA R, CEREZO A B, et al.Chemical hazards in grapes and wine, climate change and challenges to face[J].Food Chemistry, 2020, 314:126222.
[6] OELOFSE A, PRETORIUS I S, DU TOIT M.Significance of Brettanomyces and Dekkera during winemaking:A synoptic review[J].South African Journal of Enology &Viticulture, 2016, 29(2):128-144.
[7] TUBIA I, PRASAD K, PÉREZ-LORENZO E, et al.Beverage spoilage yeast detection methods and control technologies:A review of Brettanomyces[J].International Journal of Food Microbiology, 2018, 283:65-76.
[8] GUICHARD H, POUPARD P, LEGOAHEC L, et al.Brettanomyces anomalus, a double drawback for cider aroma[J].LWT, 2019, 102:214-222.
[9] 张艳芳, 罗耀文.葡萄酒微生物病害的防治[J].食品工业, 2005(4):15-16.ZHANG Y F, LUO Y W.Prevention and cure of microbe diseases in wine[J].The Food Industry, 2005, 26(4):15-16.[10] ST J A, P
J A, P OTKA-WASYLKA J, SIMEONOV V, et al.The content of biogenic amines in Rondo and Zweigelt wines and correlations between selected wine parameters[J].Food Chemistry, 2022, 371:131172.
OTKA-WASYLKA J, SIMEONOV V, et al.The content of biogenic amines in Rondo and Zweigelt wines and correlations between selected wine parameters[J].Food Chemistry, 2022, 371:131172.
[11] BARTOWSKY E J, HENSCHKE P A.Acetic acid bacteria spoilage of bottled red wine:A review[J].International Journal of Food Microbiology, 2008,125(1):60-70.
[12] ISLAM T, DIBA F, MIAH R, et al.Optimization of acetic acid production rate by thermotolerant Acetobacter spp.[J].Advances in Microbiology, 2017, 7(11):749-759.
[13] WELKE J E.Fungal and mycotoxin problems in grape juice and wine industries[J].Current Opinion in Food Science, 2019, 29:7-13.
[14] ZHAO G, YANG X, NISAR T, et al.Patulin biodegradation and quality improvement of apple puree fermented with Byssochlamys nivea FF1-2[J].Food Bioscience, 2018, 21:45-52.
[15] LI M Y, QIN J W, ZHONG B, et al.Improving acidity and flavors of citrus juice as well as its antioxidant activity by cofermentation with deacidification bacteria combination[J].Food Bioscience, 2023, 53:102592.
[16] WANG Y, ZHAO Y C, FAN L L, et al.Identification and characterization of Pichia membranifaciens Hmp-1 isolated from spoilage blackberry wine[J].Journal of Integrative Agriculture, 2018, 17(9):2126-2136.
[17] CAPOZZI V, GAROFALO C, CHIRIATTI M A, et al.Microbial terroir and food innovation:The case of yeast biodiversity in wine[J].Microbiological Research, 2015, 181:75-83.
[18] 邓莎莎. 二甲基二碳酸盐发酵前处理在果酒发酵中的应用[D].湘潭:湘潭大学, 2016.DENG S S.Application of dimethyl dicarbonate fermentation pre-treatment in the fermentation of fruit wine[D].Xiangtan:Xiangtan University, 2016.
[19] LANDETE J M, FERRER S, PARDO I.Which lactic acid bacteria are responsible for histamine production in wine?[J].Journal of Applied Microbiology, 2005, 99(3):580-586.
[20] GOMES R J, BORGES M F, ROSA M F, et al.Acetic acid bacteria in the food industry:Systematics, characteristics and applications[J].Food Technology and Biotechnology, 2018, 56(2):139-151.
[21] FEL ÖCIOV
ÖCIOV S, MA
S, MA KOV
KOV Z, KA
Z, KA
 NIOV
NIOV M.Fungal diversity in the grapes-to-wines chain with emphasis on Penicillium species[J].Potravinarstvo Slovak Journal of Food Sciences, 2018, 12(1):379-386.
M.Fungal diversity in the grapes-to-wines chain with emphasis on Penicillium species[J].Potravinarstvo Slovak Journal of Food Sciences, 2018, 12(1):379-386.
[22] AYHAN K, CO ANSU S, ORHAN-YAN
ANSU S, ORHAN-YAN KAN E, et al.Advance methods for the qualitative and quantitative determination of microorganisms[J].Microchemical Journal, 2021, 166:106188.
KAN E, et al.Advance methods for the qualitative and quantitative determination of microorganisms[J].Microchemical Journal, 2021, 166:106188.
[23] LLEIX J, MART
J, MART NEZ-SAFONT M, MASNEUF-POMAREDE I, et al.Genetic and phenotypic diversity of Brettanomyces bruxellensis isolates from ageing wines[J].Food Bioscience, 2021, 40:100900.
NEZ-SAFONT M, MASNEUF-POMAREDE I, et al.Genetic and phenotypic diversity of Brettanomyces bruxellensis isolates from ageing wines[J].Food Bioscience, 2021, 40:100900.
[24] CHANG S C, LIN C W, JIANG C M, et al.Histamine production by bacilli bacteria, acetic bacteria and yeast isolated from fruit wines[J].LWT- Food Science and Technology, 2009, 42(1):280-285.
[25] JAVIER GALLEGO F, ANGELES PÉREZ M, N
 EZ Y, et al.Comparison of RAPDs, AFLPs and SSR markers for the genetic analysis of yeast strains of Saccharomyces cerevisiae[J].Food Microbiology, 2005, 22(6):561-568.
EZ Y, et al.Comparison of RAPDs, AFLPs and SSR markers for the genetic analysis of yeast strains of Saccharomyces cerevisiae[J].Food Microbiology, 2005, 22(6):561-568.
[26] FABJANOWICZ M, ![]() A, KALINOWSKA K, et al.Miniaturized, green salting-out liquid-liquid microextraction coupled with GC-MS used to evaluate biogenic amines in wine samples[J].Microchemical Journal, 2022, 180:107616.
A, KALINOWSKA K, et al.Miniaturized, green salting-out liquid-liquid microextraction coupled with GC-MS used to evaluate biogenic amines in wine samples[J].Microchemical Journal, 2022, 180:107616.
[27] OTERO F, MAGNER E.Biosensors-recent advances and future challenges in electrode materials[J].Sensors, 2020, 20(12):3561.
[28] GUAN Y, SI P B, YANG T, et al.A novel method for detection of ochratoxin A in foods—Co-MOFs based dual signal ratiometric electrochemical aptamer sensor coupled with DNA walker[J].Food Chemistry, 2023, 403:134316.
[29] CRAVERO F, ENGLEZOS V, RANTSIOU K, et al.Control of Brettanomyces bruxellensis on wine grapes by post-harvest treatments with electrolyzed water, ozonated water and gaseous ozone[J].Innovative Food Science &Emerging Technologies, 2018, 47:309-316.
[30] ENGLEZOS V, RANTSIOU K, CRAVERO F, et al.Minimizing the environmental impact of cleaning in winemaking industry by using ozone for cleaning-in-place (CIP) of wine bottling machine[J].Journal of Cleaner Production, 2019, 233:582-589.
[31] 刘芳, 李萌萌, 卞科.臭氧对食品中真菌毒素的降解效果及影响因素研究进展[J].食品与发酵工业, 2021, 47(18):282-286;293.LIU F, LI M M, BIAN K.Recent progress in the degradation effects of mycotoxins in food with ozone and the related influencing factors[J].Food and Fermentation Industries, 2021, 47(18):282-286;293.
[32] 刘红艳. DMDC前处理在巨峰冰葡萄酒酿造中的应用研究[D].湘潭:湘潭大学, 2019.LIU H Y.Application research of DMDC pretreatment in Khoyo ice wine brewing[D].Xiangtan:Xiangtan University, 2019.
[33] CHENG R M, CHUREY J J, WOROBO R W.Inactivation of Salmonella enterica and spoilage microorganisms in orange juice treated with dimethyl dicarbonate (DMDC)[J].International Journal of Food Microbiology, 2018, 285:152-157.
[34] CASTRO MAR N A, COLANGELO D, LAMBRI M, et al.Relevance and perspectives of the use of chitosan in winemaking:A review[J].Critical Reviews in Food Science and Nutrition, 2021, 61(20):3450-3464.
N A, COLANGELO D, LAMBRI M, et al.Relevance and perspectives of the use of chitosan in winemaking:A review[J].Critical Reviews in Food Science and Nutrition, 2021, 61(20):3450-3464.
[35] MIOT-SERTIER C, PAULIN M, DUTILH L, et al.Assessment of chitosan antimicrobial effect on wine microbes[J].International Journal of Food Microbiology, 2022, 381:109907.
[36] SCANSANI S, RAUHUT D, BREZINA S, et al.The impact of chitosan on the chemical composition of wines fermented with Schizosaccharomyces pombe and Saccharomyces cerevisiae[J].Foods, 2020, 9(10):1423.
[37] 刘乾坤, 徐晓云, 李二虎.壳聚糖和酵母甘露聚糖对蓝莓酒单宁特性及品质的影响[J].中国酿造, 2022, 41(6):44-50.LIU Q K, XU X Y, LI E H.Effects of chitosan and yeast mannan on tannin property and quality of blueberry wine[J].China Brewing, 2022, 41(6):44-50.
[38] BUZRUL S.High hydrostatic pressure treatment of beer and wine:A review[J].Innovative Food Science &Emerging Technologies, 2012, 13:1-12.
[39] VAN WYK S, FARID M M, SILVA F V M.SO2, high pressure processing and pulsed electric field treatments of red wine:Effect on sensory, Brettanomyces inactivation and other quality parameters during one year storage[J].Innovative Food Science &Emerging Technologies, 2018, 48:204-211.
[40] TAO Y, SUN D W, G RECKI A, et al.Effects of high hydrostatic pressure processing on the physicochemical and sensorial properties of a red wine[J].Innovative Food Science &Emerging Technologies, 2012, 16:409-416.
RECKI A, et al.Effects of high hydrostatic pressure processing on the physicochemical and sensorial properties of a red wine[J].Innovative Food Science &Emerging Technologies, 2012, 16:409-416.
[41] DELSO C, BERZOSA A, SANZ J, et al.Pulsed electric field processing as an alternative to sulfites (SO2) for controlling Saccharomyces cerevisiae involved in the fermentation of Chardonnay white wine[J].Food Research International, 2023, 165:112525.
[42] YANG N N, HUANG K, LYU C N, et al.Pulsed electric field technology in the manufacturing processes of wine, beer, and rice wine:A review[J].Food Control, 2016, 61:28-38.
[43] VAN WYK S, SILVA F V M, FARID M M.Pulsed electric field treatment of red wine:Inactivation of Brettanomyces and potential hazard caused by metal ion dissolution[J].Innovative Food Science &Emerging Technologies, 2019, 52:57-65.
[44] MU OZ R, VIVEROS N, BEVILACQUA A, et al.Effects of ultrasound treatments on wine microorganisms[J].Ultrasonics Sonochemistry, 2021, 79:105775.
OZ R, VIVEROS N, BEVILACQUA A, et al.Effects of ultrasound treatments on wine microorganisms[J].Ultrasonics Sonochemistry, 2021, 79:105775.
[45] 樊丽华, 侯福荣, 马晓彬, 等.超声波及其辅助灭菌技术在食品微生物安全控制中的应用[J].中国食品学报, 2020, 20(7):326-336.FAN L H, HOU F R, MA X B, et al.The application of ultrasound and assistant sterilization technologies in food microbiological control:A review[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(7):326-336.
[46] LEE H, KIM H, CADWALLADER K R, et al.Sonication in combination with heat and low pressure as an alternative pasteurization treatment-Effect on Escherichia coli K12 inactivation and quality of apple cider[J].Ultrasonics Sonochemistry, 2013, 20(4):1131-1138.
[47] 史彬星. 超声波及超高压处理对沙棘果酒品质影响研究[D].太原:中北大学, 2021.SHI B X.The effect of ultrasonic and ultra-high pressure treatment on the sea buckthorn wine quality[D].Taiyuan:North University of China, 2021.
[48] DEL-CASTILLO-ALONSO M  , MONFORTE L, TOM
, MONFORTE L, TOM S-LAS-HERAS R, et al.To what extent are the effects of UV radiation on grapes conserved in the resulting wines?[J].Plants, 2021, 10(8):1678.
S-LAS-HERAS R, et al.To what extent are the effects of UV radiation on grapes conserved in the resulting wines?[J].Plants, 2021, 10(8):1678.
[49] GRANT-PREECE P, BARRIL C, SCHMIDTKE L M, et al.Light-induced changes in bottled white wine and underlying photochemical mechanisms[J].Critical Reviews in Food Science and Nutrition, 2017, 57(4):743-754.
[50] DIESLER K, GOLOMBEK P, KROMM L, et al.UV-C treatment of grape must:Microbial inactivation, toxicological considerations and influence on chemical and sensory properties of white wine[J].Innovative Food Science &Emerging Technologies, 2019, 52:291-304.
[51] LIU J H, WANG N, LIU Y P, et al.The antimicrobial spectrum of lysozyme broadened by reductive modification[J].Poultry Science, 2018, 97(11):3992-3999.
[52] ZHU D W, CAI G L, LI X M, et al.Enhancing the antimicrobial activity of Sus scrofa lysozyme by N-terminal fusion of a sextuple unique homologous peptide[J].Journal of Biotechnology, 2017, 243:61-68.
[53] CAPPANNELLA E, BENUCCI I, LOMBARDELLI C, et al.Immobilized lysozyme for the continuous lysis of lactic bacteria in wine:Bench-scale fluidized-bed reactor study[J].Food Chemistry, 2016, 210:49-55.
[54] 刘奎, 赵焕兰, 宗宁, 等.枯草芽孢杆菌BS-1菌株对猕猴桃采后软腐病的抑制和保鲜效果评价[J].保鲜与加工, 2021, 21(10):40-49.LIU K, ZHAO H L, ZONG N, et al.Inhibition and fresh-keeping effects evaluation of Bacillus subtilis BS-1 strain on soft rot of postharvest kiwifruit[J].Storage and Process, 2021, 21(10):40-49.
[55] JIANG C, CHEN X, LEI S, et al.Lipopeptides from Bacillus subtilis have potential application in the winemaking process:Inhibiting fungal and ochratoxin A contamination and enhancing esters and acids biosynthesis[J].Australian Journal of Grape and Wine Research, 2017, 23(3):350-358.
[56] 黄钦耿, 梁玲, 陈巧红, 等.小菜蛾moricin在毕赤酵母中的表达及抑菌活性分析[J].食品科学, 2017, 38(16):36-42.HUANG Q G, LIANG L, CHEN Q H, et al.High-level expression and antibacterial properties of antimicrobial peptide moricin in Pichia pastoris[J].Food Science, 2017, 38(16):36-42.
[57] VILLALBA M L, MAZZUCCO M B, LOPES C A, et al.Purification and characterization of Saccharomyces eubayanus killer toxin:Biocontrol effectiveness against wine spoilage yeasts[J].International Journal of Food Microbiology, 2020, 331:108714.
[58] SANTOS A, NAVASCUÉS E, BRAVO E, et al.Ustilago maydis killer toxin as a new tool for the biocontrol of the wine spoilage yeast Brettanomyces bruxellensis[J].International Journal of Food Microbiology, 2011, 145(1):147-154.
[59] 陈玉茜. 具有广谱嗜杀能力酿酒酵母菌株的选育[D].杨凌:西北农林科技大学, 2017.CHEN Y X.Breeding of Saccharomyces cerevisiae strains with broad-spectrum killer capabilities[D].Yangling:Northwest A &F University, 2017.
[60] FERN NDEZ DE ULLIVARRI M, MENDOZA L M, RAYA R R.Characterization of the killer toxin KTCf20 from Wickerhamomyces anomalus, a potential biocontrol agent against wine spoilage yeasts[J].Biological Control, 2018, 121:223-228.
NDEZ DE ULLIVARRI M, MENDOZA L M, RAYA R R.Characterization of the killer toxin KTCf20 from Wickerhamomyces anomalus, a potential biocontrol agent against wine spoilage yeasts[J].Biological Control, 2018, 121:223-228.