生物活性肽来源广泛、种类繁多,在过去几年中出现的越来越多的研究结果表明,人们对乳制品中的生物活性肽越来越感兴趣。乳制品不仅是蛋白质的良好来源,而且也是酸奶或奶酪发酵过程[1]或食用后胃肠道消化[2-3]产生的多种生物活性肽的良好来源。发酵乳制品生物活性肽的各种功能一直备受关注,2017年已知的所有哺乳动物物种中至少有1 061种潜在的功能性乳肽[4]。随着对乳及发酵乳制品中生物活性肽研究的深入,人们发现了越来越多的乳源生物活性肽,这些肽对心血管系统、免疫系统、消化系统和神经系统有许多作用[5],不但可以提供人类需要的氨基酸,还具有抗氧化生物活性。研究证明用于生产发酵酸奶或干酪的乳酸菌具有抗氧化能力[6],可以消除自由基,螯合金属离子,从而防止油脂氧化、参与体内氧化应激反应,达到改善人体健康的效果。BELLINAZO等[7]在发酵黄油中添加干酪乳杆菌发现可以抑制黄油氧化,延长货架期改善发酵黄油的品质。KIM等[8]用一株Lactococcus lactis SL6发酵脱脂牛乳并用反相高效液相色谱和质谱技术分离并鉴定出了抗氧化肽,其氨基酸序列为:Phe-Ser-Asp-Ile-Pro-Asn-Pro-Ile-Gly-Ser-Glu-Asn-Ser-Glu-Lys-Thr-Thr-Met-Pro-Leu-Trp,分析其对应于牛乳αS1-酪蛋白的C端179-199片段。乳是生物活性肽的重要来源之一,当前关于发酵乳的抗氧化研究主要集中于体外抗氧化指标的测定,而对于消化后的发酵乳活性肽抗氧化活性相关研究资料较少。本研究中采用的菌株副干酪乳杆菌(Lactobacillus paracasei) LX5和屎肠球菌(Enterococcus faecium) AS8前期分离自内蒙古自治区锡林郭勒盟地区的传统发酵奶油制品中,研究对AS8和LX5所产胞外多糖的活性进行初步研究[9-10],尚未对其产出多肽、蛋白等活性物质进行研究。鉴于此,本研究中采用菌株LX5和AS8制备发酵乳,进行超滤后采用胃蛋白酶和胰蛋白酶对2株乳酸菌的发酵液多肽进行体外模拟消化处理,傅里叶变换红外光谱仪进行结构分析,通过氨基酸分析测定氨基酸组成,探讨乳酸菌发酵液中肽在消化前后抗氧化能力的变化为相关功能食品的开发提供了参考。
1 材料与方法
1.1 材料与试剂
脱脂乳粉,丹麦 Arla Foods公司;乳粉,恒天然合作社集团有限公司;屎肠球菌Enterococcus faecium AS8、副干酪乳杆菌Lactobacillus paracasei LX5,来源于内蒙古锡林郭勒盟的发酵乳制品;超滤管(10 000 Da)、胃蛋白酶、胰蛋白酶,美国Sigma公司;DPPH、ABTS(生化试剂)、抗坏血酸(维生素C)、无水乙醇、水杨酸等(分析纯),兰州新区鑫鑫尚信试剂经销部。
1.2 仪器与设备
HC-2T18R型冷冻高速离心机,日本 Hitachi 公司;DW-86L338A型冻干机(-80 ℃),青岛海尔特种电器有限公司;S433D型全自动氨基酸分析仪,德国赛卡姆公司;IRAffinity-1型傅里叶变换红外光谱仪,日本岛津公司;BG-verMIDI型电泳仪,北京百晶生物技术有限公司。
1.3 实验方法
1.3.1 多肽的提取
将发酵产物经5 000 r/min离心30 min去除不溶性物质后,在1.0 MPa、4 ℃条件下,选用截留相对分子质量1~10 kDa的聚砜类中空纤维膜对发酵上清液进行超滤,分别收集不同分子质量肽段的分级样品,分别为LX5≤10 kDa、LX5 >10 kDa、AS8≤10 kDa、AS8>10 kDa,下文将4个样品称为LX5-Ⅰ、LX5-Ⅱ、AS8-Ⅰ和AS8-Ⅱ。经旋转蒸发、冷冻干燥得到多肽粉末进行后续试验。
1.3.2 发酵液各组分模拟胃肠消化
参考MINEKUS等[11]的方法,稍作修改。用HCl(1 mol/L)将模拟胃液的pH值调节至3.0,加入20 g/L胃蛋白酶(3 000 U/mg)、0.3 mol/L CaCl2和水,加入等体积的液体样品维持37 ℃,继续消化2 h,调pH值至7.0终止反应后离心(4 ℃、6 000 r/min,10 min),20 ℃储存待测。取胃消化后的消化液加入pH 7.0的模拟肠液,添加40 g/L胰蛋白酶(250 U/mg),10 g/L 胆汁、0.3 mol/L CaCl2和水,保持温度37 ℃,持续消化2 h,加入胰蛋白酶抑制剂终止反应后离心(4 ℃、6 000 r/min,10 min),进行后续试验。
1.3.3 SDS-PAGE
参照TIAN等[12]的方法,配制浓缩胶浓度为5%,分离胶浓度为12%的SDS-PAGE、使用考马斯亮蓝染色法,用标准蛋白Marker (6.5~200 kDa) 作对照分析不同样品蛋白分子质量。取一定量样品冻干粉,使用上样缓冲液处理后上样。于常温下90 V恒压电泳30 min左右,将电压调制130 V电泳60 min,当条带距离胶底1 cm时关闭电源。取出琼脂凝胶,用考马斯亮蓝染料染色,并在脱色液中脱色后拍照分析。
1.3.4 傅里叶红外光谱
称取样品和KBr(比例1∶100),在研钵中均匀混合,压成薄片,放入样品槽中。
1.3.5 氨基酸组成的测定
氨基酸自动分析仪采用LCAK06/Na(4.6 mm×150 mm)水解氨基酸分析柱;进样量50 μL;反应器温度130 ℃;柱温58~74 ℃梯度温控;茚三酮流速0.25 mL/min;流动相流速0.45 mL/min;检测器为440 nm/570 nm双波长检测器。
1.3.6 抗氧化活性测定
DPPH自由基清除能力参照文献[13]的方法;清除羟自由基能力的测定参照文献[14]的方法;ABTS阳离子自由基清除能力的测定参照文献[15]的方法。
2 结果与分析
2.1 发酵液多肽消化前后的SDS-PAGE
由图1体外模拟消化前后LX5、AS8发酵乳上清液的电泳图可以看出,所有电泳条带颜色较为清晰,分子质量均分布在116 kDa 以下,消化后蛋白分子质量的分布与体外模拟消化前的蛋白分布有差异。经过体外模拟消化后,分子质量均分布在97.2 kDa以下。蛋白经过胃肠消化后,条带明显减小,是由于酶解的作用,经过蛋白水解不完全仍有条带残留,但使分子质量<14.3 kDa的条带颜色明显。由此可知,消化产物的平均分子质量比原来明显降低。上述结果佐证多肽产率结果的同时,也表明发酵乳蛋白易于被人体消化。

M-标准蛋白;1-LX5发酵上清液;2-AS8发酵上清液;3-LX5发酵乳上清液消化产物;4-AS8发酵乳上清液消化产物
图1 体外模拟消化前后LX5、AS8发酵乳蛋白的SDS-PAGE图
Fig.1 SDS-PAGE results of LX5 and AS8 fermented milk proteins before and after in vitro simulated digestion
2.2 模拟消化前后的傅里叶红外光谱分析
LX5-Ⅰ、LX5-Ⅱ模拟消化前后的红外光谱如图2-a、图2-b所示,AS8-Ⅰ、AS8-Ⅱ模拟消化前后的红外光谱如图2-c、图2-d所示。LX5所有组分样品经过模拟消化后在3 650~3 100 cm-1表现出的与消化前样品一致,由—OH、N—H伸缩振动引起[16];在 3 000~2 850 cm-1表现出与消化前一致的由蛋白中甲基和亚甲基C—H 伸缩振动引起的拉伸峰[17];经消化后未显示出1 652 cm-1处属于蛋白质酰胺Ⅰ带的C![]() O不饱和键吸收峰[18],可能是被消化酶水解后形成C—O键和更多的氢键;在1 410 cm-1处是—CH的弯曲振动引起的吸收峰[19],和消化前一致。AS8所有组分样品经过模拟消化后在3 848、3 483 cm-1处与消化前样品一致,是—OH、N—H伸缩振动引起的吸收峰,引起的2个吸收峰可能是因为消化过程中加入了胃、肠消化缓冲液形成了消化体系,里面添加Cl-,使吸收峰位置向高波数方向发生偏移[20];在 3 000~2 850 cm-1是与消化前一致的,由蛋白中甲基和亚甲基的C—H伸缩振动引起的拉伸峰;2 141、1 965 cm-1处于双键区,可能是C
O不饱和键吸收峰[18],可能是被消化酶水解后形成C—O键和更多的氢键;在1 410 cm-1处是—CH的弯曲振动引起的吸收峰[19],和消化前一致。AS8所有组分样品经过模拟消化后在3 848、3 483 cm-1处与消化前样品一致,是—OH、N—H伸缩振动引起的吸收峰,引起的2个吸收峰可能是因为消化过程中加入了胃、肠消化缓冲液形成了消化体系,里面添加Cl-,使吸收峰位置向高波数方向发生偏移[20];在 3 000~2 850 cm-1是与消化前一致的,由蛋白中甲基和亚甲基的C—H伸缩振动引起的拉伸峰;2 141、1 965 cm-1处于双键区,可能是C![]() C或炔烃,此处可能是经过消化后新出现的吸收峰,可能是受到消化体系中物质的影响;经消化后未显示出1 652 cm-1处属于蛋白质酰胺Ⅰ带的C
C或炔烃,此处可能是经过消化后新出现的吸收峰,可能是受到消化体系中物质的影响;经消化后未显示出1 652 cm-1处属于蛋白质酰胺Ⅰ带的C![]() O不饱和键吸收峰,可能是消化酶水解后产生游离氨基酸,在碱性环境中形成羧酸盐。1 580和1 420 cm-1处的吸收峰也表明羧酸盐的存在[21];1 335 cm-1处是由甲基上的—CH键的弯曲振动引起的吸收峰,与消化前相同。总之,体外模拟消化对样品的骨架有一定的影响,可能是经过水解后产生大量氨基酸与消化体系中的物质会发生很多结合作用,也有可能是消化体系中的离子对吸收峰产生了影响,需要进一步研究。
O不饱和键吸收峰,可能是消化酶水解后产生游离氨基酸,在碱性环境中形成羧酸盐。1 580和1 420 cm-1处的吸收峰也表明羧酸盐的存在[21];1 335 cm-1处是由甲基上的—CH键的弯曲振动引起的吸收峰,与消化前相同。总之,体外模拟消化对样品的骨架有一定的影响,可能是经过水解后产生大量氨基酸与消化体系中的物质会发生很多结合作用,也有可能是消化体系中的离子对吸收峰产生了影响,需要进一步研究。

a-LX5-Ⅰ、LX5-Ⅱ模拟消化前红外光谱图;b-LX5-Ⅰ、LX5-Ⅱ模拟消化后红外光谱图;c-AS8-Ⅰ、AS8-Ⅱ模拟消化前红外光谱;d-AS8-Ⅰ、AS8-Ⅱ模拟消化后红外光谱
图2 LX5-Ⅰ、LX5-Ⅱ、AS8-Ⅰ、AS8-Ⅱ模拟消化前后的红外光谱
Fig.2 Infrared spectra of LX5-Ⅰ,LX5-Ⅱ,AS8-Ⅰ,AS8-Ⅱ before and after simulated digestion
2.3 发酵液多肽消化前后的氨基酸分析
决定抗氧化特性的因素有下几个:①氨基酸序列,组氨酸(His)是抗氧化肽中的主要氨基酸之一,其存在了提高了抗氧化活性,可能是由于侧链咪唑基的存在。先前报道了酪氨酸(Tyr)的酚羟基和色氨酸(Trp)的吲哚基可以供氢,从而增加了含有这些氨基酸的肽的抗氧化活性。研究报告表明Trp、Tyr和Phe可以构成具有高抗氧化能力的肽[22]。②氨基酸疏水性,疏水性氨基酸增加了肽在脂质食物中的溶解度,从而提高抗氧化活性[23]。③分子质量,与大分子质量的肽相比,分子质量较小的抗氧化肽抗氧化活性更强,同时在体内可以更好的被吸收[24]。④构效关系,定量的结构-活性关系和分子对接是该领域常用的工具, 分子对接根据锁键原理描述了配体-受体的关系,使得抗氧化肽的潜在作用机制可以通过现有数据来确定,并通过最佳结构配置来解释[25]。由表1发酵乳多肽模拟体外消化前后的氨基酸种类及含量可知,乳酸菌发酵乳具有丰富的氨基酸组成, 含有16种氨基酸,消化后更有17种氨基酸。据报道,肽段中含有的疏水性氨基酸、酸性氨基酸(天冬氨酸和谷氨酸)和碱性氨基酸(组氨酸、精氨酸、赖氨酸)使抗氧化肽具有较强的金属离子螯合能力和自由基清除活性[20]。模拟消化前LX5-Ⅰ、LX5-Ⅱ、AS8-Ⅰ、AS8-Ⅱ的氨基酸总含量分别为1.25%、2.35%、1.31%、2.07%。其疏水性氨基酸含量分别为0.57%、0.75%、0.62%、0.46%,分别占总氨基酸的45.6%、31.91%、47.33%、22.22%;酸性氨基酸占比分别为5.6%、27.66%、12.21%、19.81%;碱性氨基酸占比分别为8.8%、16.60%、8.40%、39.61%;芳香族氨基酸占比38.4%、13.62%、25.95%、10.14%。经过模拟体外消化后LX5-Ⅰ、LX5-Ⅱ、AS8-Ⅰ、AS8-Ⅱ,总氨基酸含量增加,分别达到2.49%、4.14%、1.78%、3.90%。与消化前相比其中疏水性氨基酸占氨基酸总量比例大幅度下降,分别为28.92%、27.54%、33.15%、25.38%;酸性氨基酸占总比分别为38.15%、29.71%、27.53%、30%,与消化前相比占氨基酸总量比例明显上升;碱性氨基酸占总氨基酸比例分别为13.65%、21.50%、13.48%、22.56%,与消化前相比占比有所增大;芳香族氨基酸占比3.21%、7.25%、7.30%、8.72%,各组分样品与消化前相比占氨基酸总量比下降。与抗氧化活性有密切关系的以上4类氨基酸含量分别占总氨基酸含量的83.94%、86%、81.46%、86.67%,相比消化前各组分的占比92.80%、81.68%、62.13%、71.98%,除LX5-Ⅰ占总氨基酸含量比例有所增加,其他样品占比都显示出降低现象。这与消化后各样品抗氧化活性变化趋势相同,由抗氧化活性部分结果可知,经消化后的样品的ABTS阳离子自由基、DPPH自由基、羟自由基清除率有所增减。
表1 LX5和AS-8发酵乳多肽模拟体外消化前后的氨基酸种类及含量 单位:%
Table 1 Amino acid species and contents of LX5 and AS-8 fermented milk peptides before and after simulated in vitro digestion
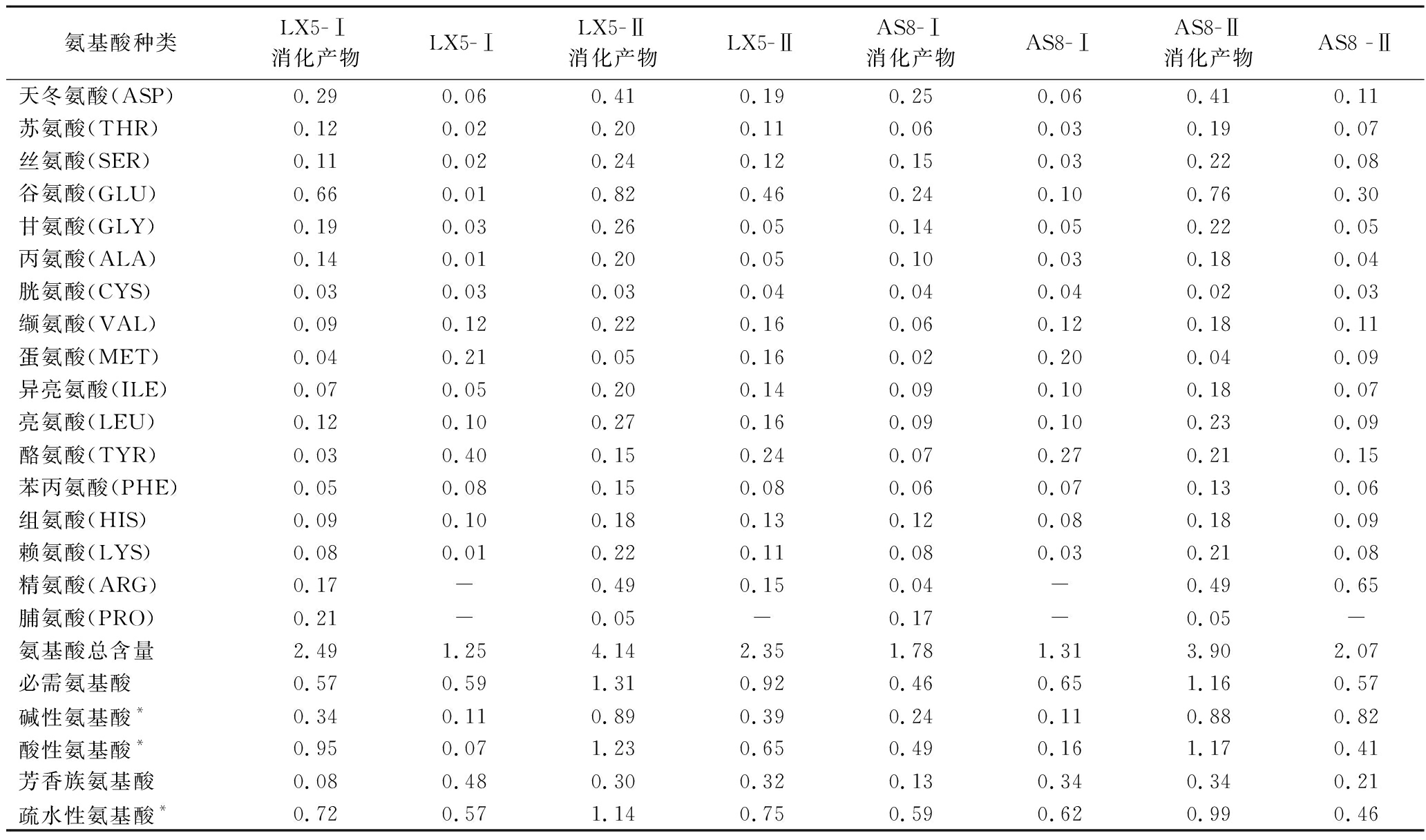
氨基酸种类LX5-Ⅰ消化产物LX5-ⅠLX5-Ⅱ消化产物LX5-ⅡAS8-Ⅰ消化产物AS8-ⅠAS8-Ⅱ消化产物AS8 -Ⅱ天冬氨酸(ASP)0.290.060.410.190.250.060.410.11苏氨酸(THR)0.120.020.200.110.060.030.190.07丝氨酸(SER)0.110.020.240.120.150.030.220.08谷氨酸(GLU)0.660.010.820.460.240.100.760.30甘氨酸(GLY)0.190.030.260.050.140.050.220.05丙氨酸(ALA)0.140.010.200.050.100.030.180.04胱氨酸(CYS)0.030.030.030.040.040.040.020.03缬氨酸(VAL)0.090.120.220.160.060.120.180.11蛋氨酸(MET)0.040.210.050.160.020.200.040.09异亮氨酸(ILE)0.070.050.200.140.090.100.180.07亮氨酸(LEU)0.120.100.270.160.090.100.230.09酪氨酸(TYR)0.030.400.150.240.070.270.210.15苯丙氨酸(PHE)0.050.080.150.080.060.070.130.06组氨酸(HIS)0.090.100.180.130.120.080.180.09赖氨酸(LYS)0.080.010.220.110.080.030.210.08精氨酸(ARG)0.17-0.490.150.04-0.490.65脯氨酸(PRO)0.21-0.05-0.17-0.05-氨基酸总含量2.491.254.142.351.781.313.902.07必需氨基酸0.570.591.310.920.460.651.160.57碱性氨基酸*0.340.110.890.390.240.110.880.82酸性氨基酸*0.950.071.230.650.490.161.170.41芳香族氨基酸0.080.480.300.320.130.340.340.21疏水性氨基酸*0.720.571.140.750.590.620.990.46
肽链中含疏水性氨基酸通常具有高抗氧化活性,如Tyr、Ala、Ile、Met、Val、Phe、Leu和Pro[26]。这可能是因为疏水性氨基酸充当氢供体,可以与自由基反应,增强粗肽的抗氧化能力。酸性氨基酸(Glu和Asp)和碱性氨基酸(His、Lys和Arg),其电荷与带相反电荷的金属离子结合,阻碍氧化自由基的链式反应[27]。芳香族氨基酸中的Phe含有芳香环和酚羟基,它们通过电子共振或离域效应稳定各种形式的活性氧,将它们转化为更稳定的苯氧基,从而抑制自由基诱导的过氧化链式反应的转移[28]。
2.4 模拟消化前后抗氧化活性比较分析
由图3、图4可知,经模拟胃肠消化后,随样品浓度的增加ABTS阳离子自由基清除活性有增强(P<0.05)。当样品的质量浓度达到10 mg/mL时AS8-Ⅰ和抗坏血酸之间的清除率没有显著差异,几乎和维生素C持平,其次是AS8-Ⅱ消化产物,均高于维生素C。LX5组份在样品质量浓度为2 ~10 mg/mL的范围内,LX5-Ⅰ消化产物、LX5-Ⅱ消化产物的ABTS阳离子自由基清除率较高,显著高于未进行消化样品和抗坏血酸(P<0.05)。这可能是由于在模拟消化过程中暴露出更多疏水的氨基酸侧链,大分子蛋白质中含有的具有抗氧化性的多肽片段会从蛋白质中释放出来,从而增大了产物的抗氧化性[29]。杨玉亮等[30]研究发现,消化后牦牛骨胶原蛋白肽的ABTS阳离子自由基的清除率增加速度更快,且消化后牦牛骨胶原蛋白肽的ABTS阳离子自由基的清除率更强,与本试验研究结果基本一致。ABTS阳离子自由基的清除能力与多肽的结构、氨基酸的组成、水解的方式和程度等因素有关[31]。LX5组份、AS8组份消化前后的DPPH自由基清除活性与AS8组份ABTS阳离子自由基清除活性变化相似,经模拟消化后,随样品浓度增加,样品间的清除率变化有显著不同(P<0.05)。在10 mg/mL时,LX5、AS8组份消化后的DPPH自由基清除活性明显不如未消化样品(P<0.05)。这可能是由于部分活性肽被胃蛋白酶和胰蛋白酶水解,过度暴露疏水基团,导致降低了抗氧化活性。消化后清除羟自由基的活性降低(P<0.05),这与玉米蛋白水解物在体外消化后清除羟自由基的能力显著提高的结果不同[23]。原因可能是抗氧化肽与抗氧化有关的关键氨基酸序列或结构被蛋白酶破坏导致其失去抗氧化性;也可能是由于水解度增大,产生了游离氨基酸和小分子肽,使抗氧化肽的含量降低。综上,发酵乳中多肽含有抗氧化活性片段,经模拟体外消化后仍表现出良好的抗氧化活性,说明可以被人体吸收后仍能发挥较大作用。
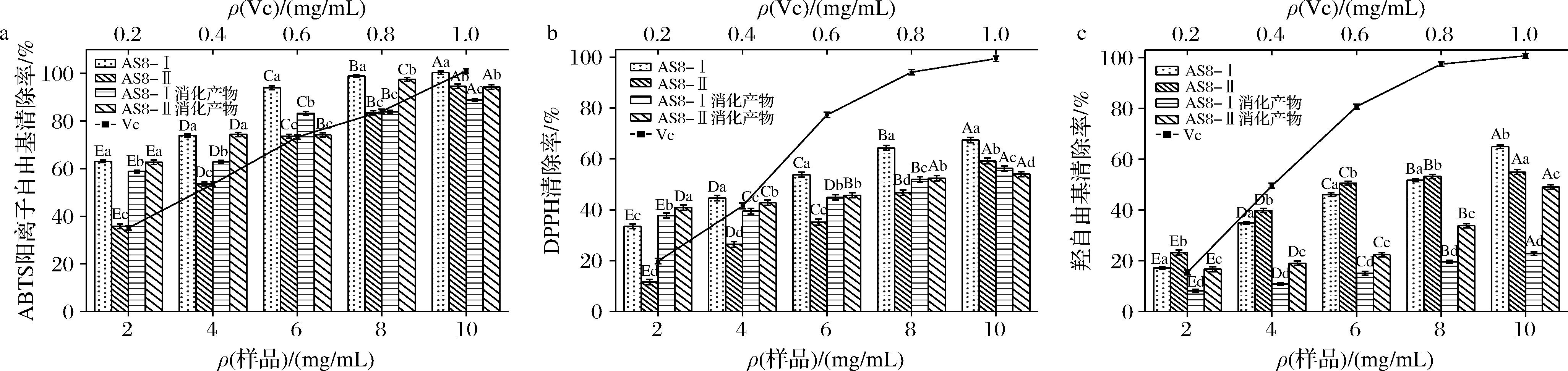
a-ABTS阳离子自由基清除率;b-DPPH自由基清除率;c-羟自由基清除率
图3 维生素C、AS8-Ⅰ和AS8-Ⅱ消化前后的ABTS阳离子自由基、DPPH自由基、羟自由基清除率
Fig.3 ABTS cation, DPPH, and hydroxyl radical scavenging before and after digestion of vitamin C, AS8-Ⅰ, and AS8-Ⅱ

a-ABTS阳离子自由基清除率;b-DPPH自由基清除率;c-羟自由基清除率
图4 维生素C、LX5-Ⅰ和LX5-Ⅱ消化前后的ABTS阳离子自由基、DPPH自由基、羟自由基清除率
Fig.4 ABTS cation, DPPH, and hydroxyl radical scavenging before and after digestion of vitamin C, LX5-Ⅰ, and LX5-Ⅱ
3 结论与讨论
超滤制得的乳酸菌发酵液多肽混合物,经过体外模拟消化后,分子质量均分布在97.2 kDa以下。蛋白经过胃肠模拟消化后,因酶解作用条带明显减小,经过蛋白水解不完全仍有条带残留,但是使分子质量<14.3 kDa的条带颜色明显。因此可知,消化产物平均分子质量相比原来明显降低,表明发酵乳蛋白易于被人体消化。通过傅里叶红外光谱测定,说明经过消化后乳酸菌发酵液多肽的官能团构成有所变化。通过ABTS阳离子自由基清除能力、DPPH自由基清除能力和羟自由基清除能力测定试验,证明了超滤制备的发酵液多肽经模拟胃肠道消化后与未消化处理的抗氧化活性相比变化不大。综上所述,模拟体外消化影响了乳酸菌发酵液多肽混合物的官能团组成,但其抗氧化活性依旧随浓度增加并且保持较强活性,说明消化过程并没有破坏样品中具有抗氧化活性的基团。同时,与抗氧化活性有密切关系的以上4类氨基酸含量除LX5-Ⅰ占总氨基酸含量比例有所增加,其他样品占比都显示出降低现象,这与消化后各样品抗氧化活性变化趋势相同,这说明氨基酸的种类及组成对抗氧化活性的影响贡献更大。实验证实,乳酸菌发酵液肽具有较强的消化稳定性和抗氧化性,为其在天然功能保健食品中的应用提供了理论与依据。
[1] PESSIONE E, CIRRINCIONE S.Bioactive molecules released in food by lactic acid bacteria:Encrypted peptides and biogenic amines[J].Frontiers in Microbiology, 2016, 7:876.
[2] BOUTROU R, GAUDICHON C, DUPONT D, et al.Sequential release of milk protein-derived bioactive peptides in the jejunum in healthy humans[J].The American Journal of Clinical Nutrition, 2013, 97(6):1314-1323.
[3] BOUTROU R, HENRY G, SANCHEZ-RIVERA L.On the trail of milk bioactive peptides in human and animal intestinal tracts during digestion:A review[J].Dairy Science &Technology, 2015, 95(6):815-829.
[4] NIELSEN S D, BEVERLY R L, QU Y Y, et al.Milk bioactive peptide database:A comprehensive database of milk protein-derived bioactive peptides and novel visualization[J].Food Chemistry, 2017, 232:673-682.
[5] YANG F J, CHEN X, HUANG M C, et al.Molecular characteristics and structure-activity relationships of food-derived bioactive peptides[J].Journal of Integrative Agriculture, 2021, 20(9):2313-2332.
[6] SHARMA S, KANDASAMY S, KAVITAKE D, et al.Probiotic characterization and antioxidant properties of Weissella confusa, KR780676, isolated from an Indian fermented food[J].LWT, 2018, 97:53-60.
[7] BELLINAZO P L, VITOLA H R S, DOS SANTOS CRUXEN C E, et al.Probiotic butter:Viability of Lactobacillus casei strains and bixin antioxidant effect ( Bixa orellana L.)[J].Journal of Food Processing and Preservation, 2019:e14088.
[8] KIM S H, LEE J Y, BALOLONG M P, et al.Identification and characterization of a novel antioxidant peptide from bovine skim milk fermented by Lactococcus lactis SL6[J].Korean Journal for Food Science of Animal Resources, 2017, 37(3):402-409.
[9] 刘春晓, 李佳宇, 刘乃齐, 等.内蒙古锡林郭勒盟地区传统奶油制品中产共轭亚油酸乳酸菌的分离筛选与鉴定[J].食品科学, 2016, 37(9):186-191.LIU C X, LI J Y, LIU N Q, et al.Isolation, screening and identification of lactic acid bacteria with conjugated linoleic acid-producing from traditional cream products in Xilingol league of Inner Mongolia[J].Food Science, 2016, 37(9):186-191.
[10] 刘乃齐.乳酸菌胞外多糖对发酵乳流变学特性的影响[D].呼和浩特:内蒙古农业大学, 2018.LIU N Q.Effect of exopolysaccharides produced by Lactobacillus on rheological properties of fermented milk[D].Hohhot:Inner Mongolia Agricultural University, 2018.
[11] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food:An international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[12] TIAN M M, HAN J Z, YE A Q, et al.Structural characterization and biological fate of lactoferrin-loaded liposomes during simulated infant digestion[J].Journal of the Science of Food and Agriculture, 2019, 99(6):2677-2684.
[13] PENG X Y, XIONG Y L, KONG B H.Antioxidant activity of peptide fractions from whey protein hydrolysates as measured by electron spin resonance[J].Food Chemistry, 2009, 113(1):196-201.
[14] VON STASZEWSKI M, PILOSOF A M R, JAGUS R J.Antioxidant and antimicrobial performance of different Argentinean green tea varieties as affected by whey proteins[J].Food Chemistry, 2011, 125(1):186-192.
[15] LI G F, YAN N, LI G Q.The effect of in vitro gastrointestinal digestion on the antioxidants, antioxidant activity, and hypolipidemic activity of green jujube vinegar[J].Foods, 2022, 11(11):1647.
[16] SATHIYANARAYANAN G, SEGHAL KIRAN G, SELVIN J.Synthesis of silver nanoparticles by polysaccharide bioflocculant produced from marine Bacillus subtilis MSBN17[J].Colloids and Surfaces B:Biointerfaces, 2013, 102:13-20.
[17] BLAND N L M, ISLAN G A, CASTRO G R, et al.Kefiran-alginate gel microspheres for oral delivery of ciprofloxacin[J].Colloids and Surfaces.B, Biointerfaces, 2016, 145:706-715.
N L M, ISLAN G A, CASTRO G R, et al.Kefiran-alginate gel microspheres for oral delivery of ciprofloxacin[J].Colloids and Surfaces.B, Biointerfaces, 2016, 145:706-715.
[18] WU Y, CUI S W, TANG J, et al.Preparation, partial characterization and bioactivity of water-soluble polysaccharides from boat-fruited sterculia seeds[J].Carbohydrate Polymers, 2007, 70(4):437-443.
[19] SANTOS E E, AMARO R C, BUSTAMANTE C C C, et al.Extraction of pectin from agroindustrial residue with an ecofriendly solvent:Use of FTIR and chemometrics to differentiate pectins according to degree of methyl esterification[J].Food Hydrocolloids, 2020, 107:105921.
[20] 胡坪, 王氢.仪器分析(第五版)[M].高等教育出版社, 2019.HU P, WANG Q.Instrumental Analysis (Fifth Edition) [M].Higher Education Press, 2019.
[21] KYOMUGASHO C, CHRISTIAENS S, SHPIGELMAN A, et al.FT-IR spectroscopy,a reliable method for routine analysis of the degree of methylesterification of pectin in different fruit-and vegetable-based matrices[J].Food Chemistry, 2015, 176:82-90.
[22] JIANG Y, ZHANG M D, LIN S Y, et al.Contribution of specific amino acid and secondary structure to the antioxidant property of corn gluten proteins[J].Food Research International, 2018, 105:836-844.
[23] LAGUERRE M, SØRENSEN A D M, BAYRASY C, et al.Role of hydrophobicity on antioxidant activity in lipid dispersions[M]//Lipid Oxidation.Amsterdam:Elsevier, 2013:261-296.
[24] CHAI T T, ZHI-YIN S, HSU K C, et al.Antioxidant activity of semen cassiae protein hydrolysate:Thermal and gastrointestinal stability, peptide identification, and in silico analysis[J].Modern Food Science and Technology, 2019, 35(9):38-48.
[25] SHAHLAEI M.Descriptor selection methods in quantitative structure-activity relationship studies:A review study[J].Chemical Reviews, 2013, 113(10):8093-8103.
[26] ZHAI Y X, CHEN Y, TENG Z X, et al.Identifying antioxidant proteins by using amino acid composition and protein-protein interactions[J].Frontiers in Cell and Developmental Biology, 2020, 8:591487.
[27] SAMARANAYAKA A G P, LI-CHAN E C Y.Food-derived peptidic antioxidants:A review of their production, assessment, and potential applications[J].Journal of Functional Foods, 2011, 3(4):229-254.
[28] CHEN H M, MURAMOTO K, YAMAUCHI F.Structural analysis of antioxidative peptides from soybean β-conglycinin[J].Journal of Agricultural and Food Chemistry, 1995, 43(3):574-578.
[29] O’KEEFFE M B, CONESA C, FITZGERALD R J.Identification of angiotensin converting enzyme inhibitory and antioxidant peptides in a whey protein concentrate hydrolysate produced at semi-pilot scale[J].International Journal of Food Science &Technology, 2017, 52(8):1751-1759.
[30] 杨玉亮, 衣大龙, 刘春雨, 等.体外模拟消化对牦牛骨胶原蛋白肽抗氧化活性的影响[J].食品与发酵工业, 2021, 47(13):79-84.YANG Y L, YI D L, LIU C Y, et al.Effects of in vitro simulated digestion on the antioxidant activity of yak bone collagen peptides[J].Food and Fermentation Industries, 2021, 47(13):79-84.
[31] SAN MARTIN D, IBARRURI J, I ARRA B, et al.Valorisation of brewer’s spent yeasts’ hydrolysates as high-value bioactive molecules[J].Sustainability, 2021, 13(12):6520.
ARRA B, et al.Valorisation of brewer’s spent yeasts’ hydrolysates as high-value bioactive molecules[J].Sustainability, 2021, 13(12):6520.
[32] 张淼. 玉米蛋白及其水解物模拟体外消化产物抗氧化活性研究[D].呼和浩特:内蒙古农业大学, 2016.ZHANG M.Antioxidative activities of corn protein and corn protein hydrolysate in vitro digests[D].Hohhot:Inner Mongolia Agricultural University, 2016.